Из всех классов животных класс насекомых – самый многочисленный: число описанных видов приближается к 1 млн. Насекомые могут наносить огромный ущерб урожаю сельскохозяйственных культур, а некоторые из них являются переносчиками болезней человека и животных. В 1940-х гг. было синтезировано множество химических инсектицидов, позволяющих контролировать численность популяций насекомых-вредителей. Самым известным из них был дихлордифенилтрихлорэтан (ДЦТ). Это хлорорганическое соединение синтезировали в 1870-х гг., но в качестве инсектицида стали применять лишь в конце 1930-х гг. ДДТ оказался высокоэффективным средством борьбы со многими насекомыми-вредителями. Как и другие хлорорганические соединения, он оказывает парализующее действие на нервную систему и мышечные ткани насекомых. К настоящему времени синтезированы и широко применяются другие хлорорганические соединения, такие как дильдрин, альдрин, хлордан, линдан, токсофен.
Еще один класс химических инсектицидов – фосфорорганические соединения, включающие малатион, паратион и диазинон. Фосфорорганические инсектициды первого поколения были разработаны как боевые отравляющие вещества. Теперь их используют для контроля численности насекомых. Их действие основано на ингибировании ацетилхолинэстеразы, которая гидролизует нейромедиатор ацетилхолин Инсектициды этого класса нарушают функционирование мотонейронов и нейронов мозга насекомого.
В США к началу 1960-х гг. химическими инсектицидами обрабатывалось около 50 млн. га сельскохозяйственных угодий. Примерно в это время было показано, что хлорорганические (в большей степени) и фосфорорганические (в меньшей степени) инсектициды оказывают вредное воздействие на человека, животных и экосистемы. Это воздействие может проявляться немедленно или спустя длительное время. Хлорорганические соединения (в частности, ДДТ) сохраняются в окружающей среде от 15 до 20 лет и накапливаются во все возрастающих концентрациях. Биоаккумуляция химических инсектицидов в жировых тканях многих организмов уже привела к пагубным последствиям. Так, в Северной Америке были практически истреблены многие виды птиц: сапсаны, ястребы-перепелятники, белоголовые орланы, бурые пеликаны, ушастые бакланы.
Со временем основные насекомые-вредители становились все более устойчивыми ко многим химическим инсектицидам, и это привело к тому, что к 1950-м гг. для контроля их численности пришлось использовать более высокие концентрации инсектицидов. Кроме того, было показано, что химические инсектициды действуют не избирательно, т. е. наряду с насекомыми-вредителями они уничтожают и полезных насекомых, а в некоторых случаях гораздо эффективнее уничтожают естественных врагов насекомых-вредителей, чем самих вредителей. Зачастую это приводило к весьма неожиданным результатам: обработка вызывала увеличение численности насекомых-вредителей.
С учетом этого все последние 20 лет проводились интенсивные поиски альтернативных способов контроля численности насекомых-вредителей. Прежде всего исследователи обратились к природным инсектицидам, синтезируемым различными микроорганизмами и растениями. Дело в том, что эти соединения, как правило, высокоспецифичны и подвергаются быстрой биодеградации, поэтому устойчивость к ним вырабатывается медленно. К сожалению, они не очень эффективны, а их получение обходится дорого, что ограничивает возможность их широкого применения. Есть надежда, что все эти проблемы удастся решить с помощью технологий рекомбинантных ДНК. Теперь для увеличения эффективности микробиологических инсектицидов исследователи могут проводить манипуляции с генами, которые кодируют их биосинтез. В частности, речь может идти о генах инсектицидов, вырабатываемых бактерией Bacillus thuringiensis или бакуловирусами насекомых; эти инсектициды безопасны, специфичны и весьма эффективны.
Рынок пестицидов огромен: в настоящее время на их производство во всем мире ежегодно расходуется более 20 млрд. долларов, и эта цифра быстро растет. При этом на долю биопестицидов, главным образом инсектицидов В. thuringiensis, приходится всего 1% этой суммы, но по прогнозам дальнейший прогресс в этой области будет связан именно с биопестицидами.
ТОКСИН, СИНТЕЗИРУЕМЫЙ BACILLUS THURINGIENSIS
Механизм действия и использование
Под «микробным инсектицидом» иногда понимается микроорганизм, либо синтезирующий какое-либо токсичное вещество, избирательно действующее на определенных насекомых, либо инфицирующий насекомое-мишень и приводящий к его гибели. Наиболее изученные, наиболее эффективные и наиболее часто используемые микробные инсектициды – бактерии В. thuringiensis. Они представлены множеством штаммов и подвидов (subsp.), и каждый из них синтезирует токсин, специфичный в отношении определенных насекомых (табл. 15.1). Например, В. thuringiensis subsp. kurstaki токсичен для личинок чешуекрылых (в том числе моли и бабочек), для личинок толстоголовки, мермитид и гусениц листовертки-почкоеда елового. В. thuringiensis subsp. israelensis уничтожает двукрылых: комаров и мошек. В. thuringiensis subsp. tenebrionis (также известный как san diego) эффективен в отношении жесткокрылых, в том числе колорадского жука и хлопкового долгоносика. Описаны и другие штаммы В. thuringiensis, каждый из которых токсичен для определенных насекомых.
Таблица 15.1. Некоторые свойства инсектицидных токсинов, синтезируемых разными штаммами В.Thuringiensis1)

Инсектицид (белковый токсин) В. thuringiensis subsp. kurstaki и других штаммов находится в клетке в виде так называемого параспорального кристалла – структуры, которая образуется во время споруляции бактерий. Никакой особенной биологической функции эта структура не несет. На ее долю приходится от 20 до 30% сухой массы спорулирующей культуры и состоит она главным образом из белка (~95%) и некоторого количества углеводородов (~5%). Кристалл – это на самом деле некий белковый агрегат, диссоциирующий на субъединицы в слабой щелочи. Субъединицы можно далее диссоциировать in vitro обработкой β-меркаптоэтанолом, который восстанавливает дисульфидные связи (рис. 15.1).
Все инсектицидные токсины, выделенные из множества штаммов В. thuringiensis, в соответствии с их токсичностью можно сгруппировать в четыре основных класса: Cryl, Cryll, Crylll и CrylV. Белки Cryl токсичны для чешуекрылых, Cryll – для чешуекрылых и двукрылых, Crylll – для жесткокрылых, CrylV – для двукрылых. Классы можно разделить далее на подклассы (А, В, С, ...) и подгруппы (а, Ь, с, ...) согласно нуклеотидным последовательностям генов соответствующих токсинов. Например, класс генов cryl включает шесть подклассов (от crylA до F), а подкласс crylА – три подгруппы [от crylA(a) до (с)]. Кроме того, в соответствии с иммунологическими особенностями выделяют примерно 30 разных серотипов В. thuringiensis (табл. 15.1). Каждый серотип отличается от другого специфическим набором антигенных детерминант на поверхности клеток определенного штамма В. thuringiensis.
В параспоральном кристалле инсектицид обычно находится в неактивной форме; при солюбилизации кристалла белок высвобождается в форме протоксина, предшественника активного токсина. Протоксин класса токсинов Cryl имеет мол. массу примерно 130 кДа (рис. 15.1). После заглатывания насекомым параспорального кристалла протоксин активируется в кишечнике в условиях щелочного рН (7,5–8,0) и под действием специфических пищеварительных протеиназ превращается в активный токсин с мол. массой примерно 68 кДа (рис. 15.1). В таком виде он встраивается в мембрану эпителиальных клеток кишечника насекомого и образует ионный канал, через который, как полагают, происходит утечка значительной части клеточного АТР (рис. 15.2). Примерно через 15 мин после формирования такого ионного канала клеточный метаболизм блокируется, насекомое перестает питаться, происходит обезвоживание организма и в конечном счете наступает смерть. Поскольку превращение протоксина в активный токсин происходит только в условиях щелочного рН и в присутствии определенных протеиназ, вероятность вредного воздействия токсинов на человека и сельскохозяйственных животных мала.
Рис. 15.1. Схематическое изображение параспорального кристалла В. thuringiensis, состоящего из белкового протоксина Cryl. Каждая белковая субъединица имеет мол. массу 250 кДа и содержит два полипептида мол. массой 130 кДа каждый. Молекулярные массы определяли с помощью электрофореза в полиакриламидном геле; приведены округленные значения. Превращение протоксина (130 кДа) в активный токсин (68 кДа) происходит только в слабощелочных условиях (рН 7,5–8) в присутствии специфической протеиназы (протеиназ). Именно эти условия реализуются в кишечнике насекомого.
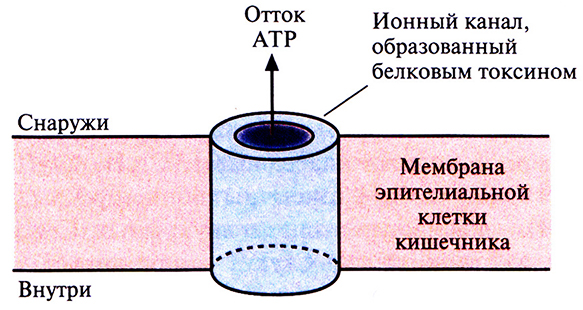
Рис. 15.2. Встраивание токсина В. thuringiensis в мембрану эпителиальной клетки кишечника насекомого и образование ионного канала.
Способ действия токсинов В. thuringiensis налагает некоторые ограничения на область их применения. Чтобы убить насекомое, В. thuringiensis обязательно должен попасть в его кишечник, в противном случае никакого эффекта не будет. В. thuringiensis чаще всего распыляют, причем бактерии обычно смешивают с атрактантами насекомых, чтобы повысить вероятность того, что насекомое-вредитель проглотит токсин. Однако для насекомых, обитающих в тканях растений или на корнях, токсин В. thuringiensis при такой обработке вряд ли будет представлять какую-либо опасность. С учетом всего этого были предприняты попытки разработать другие стратегии защиты растений от таких вредителей. Один из подходов состоит в создании трансгенных растений, несущих и экспрессирующих ген токсина В. thuringiensis и, следовательно, защищенных от насекомых-вредителей в течение всего периода вегетации.
Второе ограничение, налагаемое на применение токсина В. thuringiensis, связано с тем, что этот токсин действует на насекомое, находящееся только на определенной стадии развития. Именно в этот момент и должна проводиться обработка.
Штамм В. thuringiensis subsp. kurstaki был выделен в 1901 г., но интерес к нему как к ценному коммерческому продукту возник лишь в 1951 г., а за последние десять лет эта бактерия стала основным инструментом контроля численности гусениц листовертки-почкоеда елового в Канаде. В 1979 г. лишь над 1% лесов Канады, обрабатываемых инсектицидами с целью уничтожения этого насекомого (что соответствует примерно 2 млн. га), распыляли В. thuringiensis subsp. Kurstaki, остальные площади обрабатывали химическими инсектицидами. К 1986 г. масштабы использования В. thuringiensis subsp. kurstaki возросли до 74%. В других странах В. thuringiensis subsp. kurstaki используют для борьбы с коконопрядом, непарным шелкопрядом, мертимидами, совкой капустной и бражником. Основное препятствие на пути еще более широкого применения В. thuringiensis subsp. kurstaki состоит в его дороговизне: стоимость такого препарата в 1,5–3 раза выше, чем химических инсектицидов.
Для биоконтроля численности насекомых-вредителей распыляют 1,5 • 109–2,5 • 109 спор В. thuringiensis subsp. kurstaki на каждый квадратный метр обрабатываемого участка. Обработку проводят в тот период, когда число личинок в популяции насекомого-мишени максимально, поскольку параспоральные кристаллы чувствительны к солнечному свету и быстро разрушаются. В лабораторных условиях на свету за 24 ч разлагается более 60% остатков триптофана в белках параспорального кристалла, а в окружающей среде в зависимости от освещенности кристаллы могут сохраняться от одних суток до одного месяца. Такая нестабильность инсектицидного протоксина подразумевает, что появление устойчивых к нему насекомых маловероятно.
Однако в том случае, когда В. thuringiensis subsp. kurstaki использовали в качестве инсектицида в условиях малой освешенности (например, в зернохранилищах), через несколько генераций появлялись устойчивые к токсину насекомые. Одна из причин такой передаваемой по наследству устойчивости заключается в изменении мембранного белка клеток кишечника, в норме выполняющего функцию рецептора токсина В. thuringiensis subsp. kurstaki. Возможно, она возникает вследствие того, что в этих условиях протоксин не разрушается и служит фактором отбора. Из всего этого следует, что появления насекомых, устойчивых к В. Thuringiensis subsp. kurstaki, проще всего избежать, если ограничить применение данного микроорганизма полевыми условиями. Впрочем, имея в виду масштабы использования В. thuringiensis, нельзя исключить, что может произойти его накопление в среде в количестве, достаточном для того, чтобы вступил в действие механизм отбора. А поскольку В. thuringiensis используется все более широко в разных регионах, вероятность появления популяций устойчивых насекомых будет увеличиваться.
Идентификация генов токсинов
Для создания штаммов В. thuringiensis, более эффективно синтезирующих инсектициды и имеющих широкий круг хозяев, нужно было идентифицировать и охарактеризовать ген(ы) протоксина, и в первую очередь выяснить, где они локализованы: в плазмиде или в хромосомной ДНК. Чтобы проверить гипотезу плазмидной локализации, штамм В. thuringiensis, продуцирующий токсин, можно конъюгировать со штаммом, не обладающим инсектицидной активностью. Передача хромосомной ДНК во время конъюгации происходит крайне редко, и если «дефектный» штамм приобретает способность синтезировать инсектицид, значит, токсиновые гены локализованы в плазмиде.
Для идентификации гена, кодирующего протоксин, используют обычную методику. В. thuringiensis выращивают в культуре и лизируют клетки. Выделяют суммарную клеточную ДНК и центрифугируют ее в градиенте плотности CsCl, чтобы разделить плазмидную и хромосомную ДНК. Если гены протоксинов входят в состав генома, создают банк клонов хромосомной ДНК. Если же они содержатся в плазмиде, то плазмидную ДНК фракционируют по размерам центрифугированием в градиенте плотности сахарозы. Это обогащает ту плазмидную фракцию, которая послужит в дальнейшем исходным материалом для идентификации генов протоксинов (рис. 15.3).
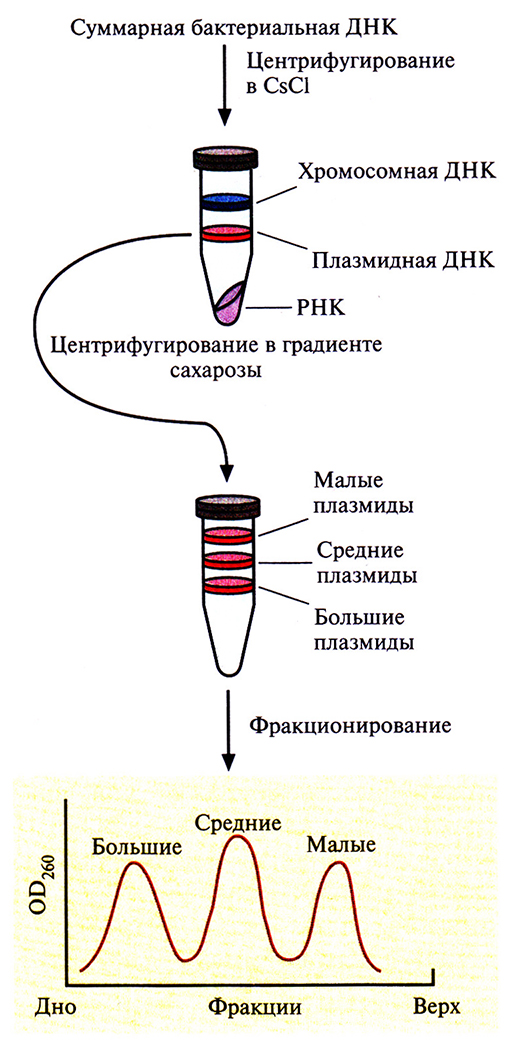
Рис. 15.3. Выделение и фракционирование плазмид, одна из которых несет ген протоксина.
Ген протоксина В. thuringiensis subsp. kurstaki находится на одной из семи плазмид длиной 2,0; 7,4; 7,8; 8,2; 14,4; 45 и 71 т. п. н. Чтобы определить, в какой именно, проводили центрифугирование плазмидной ДНК в градиенте плотности сахарозы. Были выделены три фракции, в которых концентрировались малые (2,0 т. п. н.), средние (7,4; 7,8; 8,2 и 14,4 т. п. н.) и большие (45 и 71 т. п. н.) плазмиды. Малые плазмиды из рассмотрения были исключены, поскольку они не могли кодировать белок мол. массой 130 кДа. Длина нуклеотидной последовательности, кодирующей белок такого размера, должна превышать 4,0 т. п. н. Средние и большие плазмиды подвергли частичному гидролизу рестрицирующей эндонуклеазой Sau3Al и фрагменты встроили в BamHI-сайт плазмиды pBR322. Полученными рекомбинантными плазмидами трансформировали клетки Е. coli, а затем провели иммунологический скрининг по следующей схеме:
1. Колонии клеток перенесли с агара на нитроцеллюлозный фильтр.
2. Перенесенные клетки частично лизировали органическими растворителями.
3. Все сайты неспецифического связывания первых и вторых антител на фильтре блокировали с помощью бычьего сывороточного альбумина (БСА).
4. Обработанные БСА фильтры инкубировали с кроличьими антителами к искомому инсектициду.
5. Отмывали фильтры от несвязавшихся антител и обрабатывали 125I-меченным А-белком Staphylococcus aureus, который взаимодействует с Fc-фрагментом связанных антител.
6. Области на фильтре, которые соответствуют колониям, активно синтезирующим инсектицид, выявляли с помощью радиоавтографии.
Используя идентифицированный ген протоксина в качестве гибридизационного зонда, установили, что соответствующая нуклеотидная последовательность содержится в плазмиде В. thuringiensis subsp. kurstakiдлиной 71 т. п. н. Аналогичная схема клонирования и скрининга использовалась для идентификации генов токсинов, локализованных в плазмидах или (реже) в хромосомной ДНК других штаммов В. thuringiensis.
Генная инженерия генов токсинов В. thuringiensis
После идентификации токсинового гена В. thuringiensis была определена первичная структура кодируемого им белка. Сравнение аминокислотных последовательностей разных белковых токсинов показало, что белки некоторых штаммов имеют одинаковый домен, ответственный за токсичность. Кроме того, был субклонирован сегмент полной кодирующей последовательности, с которого синтезировался укороченный белок, в полной мере сохранивший свою токсичность. Таким образом, при последующих генной нженерных манипуляциях могут использоваться интактный ген токсина, его фрагмент или химически синтезированный олигонуклеотид.
В естественных условиях большинство протоксинов В. thuringiensis синтезируются только во время споруляции, т. е. параспоральный кристалл образуется только на определенной стадии развития микроорганизма. Если бы экспрессия гена токсина происходила во время всего жизненного цикла, можно было бы существенно увеличить количество получаемого токсина и уменьшить время его синтеза. Кроме того, это позволило бы сделать синтез токсина непрерывным процессом и тем самым значительно удешевить продукт, поскольку для непрерывной ферментации используют небольшие, а потому менее дорогие биореакторы и оборудование, чем для периодической (более подробно см. об этом в гл. 16).
Во время споруляции В. thuringiensis специфический фактор инициации транскрипции (сигма-фактор) связывается с промоторами генов, функционирующих только на этой стадии жизненного цикла бактерии так что синтезируются матричные РНК (мРНК), специфичные для споруляции. Следовательно, чтобы добиться непрерывной экспрессии инсектицидного гена (генов) В. thuringiensis, необходимо поместить его (их) под контроль промотора, функционирующего в течение всего жизненного цикла.
Для этого фрагмент ДНК, содержащий ген токсина без его собственного промотора, встроили в плазмиду так, чтобы он находился под контролем активного конститутивного промотора гена устойчивости к тетрациклину, который ранее был вырезан из плазмиды Bacillus cereus и введен в В. thuringiensis. На всех этапах развития микроорганизма непрерывно синтезировался полноценный токсичный белок (рис. 15.4). Кроме того, когда этой конструкцией трансформировали мутантный штамм В. thuringiensis, не способный к споруляции, токсин все равно синтезировался. При этом процесс был гораздо более эффективным, чем в случае В. thuringiensis дикого типа: количество получаемого продукта было больше, а израсходованное количество субстрата и время синтеза – значительно меньше.
Рис. 15.4. Клонирование фрагмента гена токсина В. Thuringien sis subsp. kurstaki под контролем промотора гена устойчивости к тетрациклину (pTet). Из выделенного гена В. thuringiensis удаляют его собственный промотор с помощью рестриктаз RE1 и RE2. Полученный фрагмент встраивают в плазмидный вектор рядом с промотором pTet вместо гена устойчивости к тетрациклину, удаленного с помощью рестриктаз RE1 и RE2, и лигируют при участии ДНК-лигазы фага Т4.
Дальнейшее усовершенствование этой системы могло бы состоять во введении токсинового гена, экспрессирующегося в течение всего жизненного цикла, в хромосомную ДНК штамма В. thuringiensis, не способного к споруляции. Это гарантировало бы сохранность гена при непрерывной ферментации, что не всегда достигается при его плазмиднои локализации вследствие нестабильности плазмиды.
В отличие от большинства других токсиновых генов (cry) В. thuringiensis, экспрессия гена crylllA в норме контролируется «негативным» промотором, а не промотором, специфичным для споруляции. Ген cryllLA кодирует токсин, эффективный в отношении личинок жесткокрылых. В результате трансформации мутантного штамма В. thuringiensis, не способного образовывать споры, плазмидой, несущей клонированный ген сгуША, токсин синтезировался более эффективно и был более стабильным, чем при его синтезе в штамме дикого типа. Получив этот результат, ученые предположили, что суперэкспрессии других сrу-генов, обычно экспрессирующихся только во время споруляции, можно достичь, если поместить их под контроль промотора сгуIIIА и трансформировать получившейся конструкцией мутантный штамм В. thuringiensis, не способный к споруляции.
Урожаю многих сельскохозяйственных культур наносят ущерб сразу несколько видов насекомых, поэтому чрезвычайно полезным было бы создание микробиологических инсектицидов, направленных против широкого спектра насекомых-вредителей. Токсин широкого спектра действия можно получить двумя путями: 1) переносом гена данного токсина (например, токсина, эффективного в отношении двукрылых) в штамм В. thuringiensis, синтезирующий другой видоспецифичный токсин (например, эффективный в отношении жесткокрылых); 2) соединением частей двух генов разных видоспецифичных токсинов с образованием последовательности, кодирующей уникальный токсин двойного действия (гибридный токсин).
Чтобы проверить возможность получения токсина с широким спектром действия, встроили гены токсинов В. thuringiensis subsp. aizawai и tenebrionis в челночные векторы, способные реплицироваться и в В. thuringiensis, и в Escherichia coli. Затем такие генетические конструкции ввели с помощью электропорации в В. thuringiensis subsp. aizawai, kurstaki, israelensis и tenebrionis. Токсичность полученных трансформированных штаммов проверяли на личинках трех отрядов насекомых.
Во всех случаях токсичность, обусловливаемая собственным хозяйским токсиновым геном (генами), сохранялась, а в большинстве случаев введенный ген обусловливал специфичность токсического действия, характерную для штамма, откуда он был выделен (табл. 15.2). Кроме того, один из экспериментов дал совсем уж удивительный результат: при введении гена токсина В. thuringiensis subsp. tenebrionis в В. thuringiensis subsp. israelensis получились трансформанты, в какой-то степени токсичные для Pieris brassicae (капустницы белой), на которую не действовал ни один из продуктов исходных генов.
Таблица 15.2. Токсичность природных и рекомбинантных подвидов В. thuringiensis
для насекомых Pieris brassicae (капустница), Aedes aegypti (комар)
и Phaedon cochleariae (жук)1)

Плазмидные векторы, несущие клонированные с cry-гены, часто оказываются нестабильными в В. thuringiensis: даже в отсутствие селективного давления все они или их часть утрачиваются. Интересно, что при этом в природе большинство cry-генов локализуются именно в плазмидах. Нестабильность плазмид еще раз убеждает в целесообразности интеграции клонированного cry-гена (генов) с хромосомной ДНК. Рассмотрим один успешный пример такой интеграции.
Штамм В. thuringiensis subsp. kurstaki обычно содержит пять разных генов токсинов: cryl (а), crylA (b), cryLA (с), cryllA и cryIIB. Их продукты токсичны для различных чешуекрылых, но не эффективны против Spodoptera spp. В хромосомную ДНК штамма В. thuringiensis subsp. kurstaki встроили ген crylC, обычно присутствующий только у В. thuringiensis subsp. aizawai и subsp. entomocidus. Трансформированный штамм В. thuringiensis subsp. kurstaki был в шесть раз более эффективен в отношении личинок Spodoptera exigua, чем штамм дикого типа.
Как мы уже говорили, другой способ получения токсина широкого спектра действия состоит в слиянии кодирующих участков генов двух разных токсинов. Эта возможность была проверена в лаборатории. Было создано несколько гибридных токсинов, действующих только на чешуекрылых; некоторые из этих токсинов были более эффективны, чем продукты каждого из исходных генов, а в одном случае гибридный белок обладал абсолютно новой биологической активностью.
За токсическое действие белка Cry ответственны три домена. Домен I, локализованный в N-концевой области белковой молекулы, обеспечивает специфическое связывание токсина с рецептором на поверхности эпителиальных клеток кишечника насекомого. Домен III, расположенный в С-концевой области молекулы, предположительно и отвечает за токсичность. Устойчивость к токсинам В. thuringiensis обычно обусловливается мутационным изменением (изменениями) рецепторного белка (белков) на поверхности клеток кишечника насекомого, приводящим к тому, что рецептор перестает узнавать Cry-белок. Однако, если модифицировать ген токсина так, чтобы токсин мог связываться с другими поверхностными белками, то вероятность возникновения устойчивости уменьшится.
Белки CrylC и CrylE токсичны для чешуекрылых, но обладают разной видоспецифичностью: CrylC действует на S. exigua, Mamestra brassicae и Manduca sexta, в то время как CrylE – только на М. sexta. В одной из лабораторий был создан гибридный белок CrylC-CrylE, токсичность которого проверялась на разных насекомых. Была исследована также его способность связываться с различными рецепторами (рис. 15.5). Гибридный токсин G27, содержащий домен III белка CrylC, был токсичен для личинок S. exigua, хотя связывался только с Сгу1Е-рецептором, но не с рецептором CrylC. И наоборот, гибридный токсин F26 не оказывал действия на личинок S. exigua, хотя и связывался с CryIC-рецептором. Поскольку токсичные для S. exigua белки CrylC и G27 связываются с разными рецепторами на поверхности клеток кишечника насекомого, одновременная или поочередная обработка S. exigua двумя этими токсинами может уменьшить вероятность появления устойчивого к ним штамма, поскольку для этого необходимо, чтобы мутационные изменения произошли одновременно в двух разных белках.
Рис. 15.5. Токсичность белков CrylC, CrylE и гибридных токсинов G27 и F26 и специфичность их связывания с рецепторами. Специфичность связывания определяли в экспериментах по взаимодействию токсина с рецептором. К комплексу белкового рецептора на поверхности клеток кишечника S. exigua и изотопно меченного токсина добавляли немеченые CrylC или CrylE и определяли связывание меченого токсина. (Из работы Bosch et al., Bio/Technology 12:915-918, 1994.)
Инсектицид, продуцируемый В. thuringiensis subsp. israelensis, проявляет свои токсические свойства, когда он попадает в кишечник личинок комара. Если же этот токсин, находящийся в виде параспоральных кристаллов, распылить над водой, то кристаллы быстро утонут, и токсин будет исключен из пищевой цепи личинок комара. Чтобы решить эту проблему, можно ввести ген токсина в организм, который служит пищей для личинок комаров. Это могут быть, например, фотосинтезирующие цианобактерии Synechocystis и Synechococcus spp., которые размножаются в поверхностном слое воды, где достаточно солнечного света и где обычно обитают личинки.
Еще один организм, который можно использовать для экспрессии генов токсинов В. thuringiensis, – бактерия Caulobacter crescentus, широко распространенная в водной среде, где живут личинки комаров. Инсектицид, синтезированный трансформированными цианобактериями или С. crescentus, в лабораторных условиях был токсичен для личинок комара. Однако в полевых условиях трансформированные цианобактерии и С. crescentus быстро погибали, а уровень экспрессии клонированных генов был очень низок.
В качестве организма-хозяина для чужеродных сrу-генов, кодирующих токсичные для комаров белки, можно использовать также грамотрицательную аэробную бактерию Asticcacciulis excentricus, обитающую у поверхности водоемов. Были проведены эксперименты, в которых A. excentricus трансформировали плазмидным вектором с широким кругом хозяев, который нес гены белковых токсинов Bacillus sphaericus (бактерии, аналогичной В. thuringiensis). Гены находились под контролем промотора tacl, одного из вариантов ta-промотора. Полученньш трансформант синтезировал белковые токсины мол. массой 51 и 42 кДа и был практически столь же токсичен для личинок комаров Anopheles и Culex, как природные высокотоксичные штаммы В. sphaericus. Однако в отличие от В. sphaericus в случае с A. excentricus не возникало проблем, связанных с распылением над водоемами. Кроме того, культивирование A. excentricus обходится гораздо дешевле, поскольку этот микроорганизм растет на более простой среде, чем В. sphaericus и В. thuringiensis. Для него характерна низкая протеиназная активность, так что токсин не подвергается немедленной деградации. A. excentricus хорошо адаптирована к таким условиям, как относительно высокая интенсивность УФ-света. Однако, прежде чем применять рекомбинантные бактерии A. excentricus для контроля популяций комаров в природных условиях, необходимо убедиться, что встроенные гены токсинов не содержат последовательностей, детерминирующих устойчивость к антибиотикам.
Инсектициды, продуцируемые В. thuringiensis, при их нанесении на листья и стебли не действуют на насекомых, повреждающих корни растений. Чтобы обойти эту трудность, можно ввести ген токсина В. thuringiensis в штамм одного из видов бактерий, которые обитают в слое почвы, непосредственно прилегающем к корням (в ризосфере). Такие рекомбинантные бактерии, внесенные в почву, будут секретировать инсектицидный токсин прямо в ризосферу и защищать корни от насекомых все то время, в течение которого они остаются в почве. Это устраняет необходимость многократной обработки растений биологическими или химическими инсектицидами.
Ген токсина В. thuringiensis subsp. kurstaki был встроен в хромосомную ДНК штамма Pseudomonasfluoresceins, который образует колонии на корнях кукурузы, следующим образом (рис. 15.6).
1. Транспозон Тn5 встроили в плазмиду и генетически модифицировали его левую и правую фланкирующие последовательности и удалили ген транспозазы. Такой модифицированный транспозон не может вырезаться из плазмиды даже с помощью экзогенной транспозазы.
2. Ген токсина В. thuringiensis subsp. kurstaki встроили в середину модифицированного транспозона Тn5 так, чтобы он находился под контролем конститутивного промотора.
3. Транспозон Тn5 дикого типа встроили в хромосомную ДНК штамма P. fluoresceins, обитающего на корнях.
4. Плазмиду, несущую модифицированный транспозон Тn5 со встроенным геном токсина, ввели в бактерию, в хромосомную ДНК которой был встроен транспозон Тn5 дикого типа.
5. Осуществили гомологичную рекомбинацию с помощью двойного кроссинговера между не способным к транспозиции Тn5-элементом, несущим ген токсина, и «плазмидным» транспозоном Тn5 дикого типа, интегрированным в хромосому. В результате интеграции измененный транспозон Тn5 с геном токсина оказался встроенным в хромосомную ДНК, а транспозон Тn5 дикого типа был элиминирован.
Рис. 15.6. Получение рекомбинантного штамма Р. fluorescens, в хромосомную ДНК которого встроен ген токсина В. thuringiensis. Ген встраивают в не способный к вырезанию транспозон Тn5, локализованный в плазмиде. Такую конструкцию вводят в штамм Р. fluorescens, содержащий в своей хромосомной ДНК транспозон Тn5 дикого типа. В результате гомологичной рекомбинации не способный к вырезанию транспозон Тn5, несущий ген токсина В. thuringiensis, оказывается встроенным в хромосому P. fluorescens.
В таком виде ген токсина вряд ли утратится при крупномасштабном выращивании рекомбинантных микроорганизмов в лабораторных условиях или после их переноса в окружающую среду. Кроме того, вероятность передачи такого гена другим микроорганизмам в окружающей среде очень мала. Как показали предварительные исследования, рекомбинантный штамм P. fluorescens токсичен для личинок бражника. Теперь планируется проверить способность этого рекомбинантного микроорганизма минимизировать повреждения корней насекомыми-вредителями в оранжереях и в полевых условиях.
Гены токсинов В. thuringiensis вводили в хромосомную ДНК самых разных микроорганизмов. Так, гены crylA (с) были введены в ДНК P. fluorescens, которые защищают растения сахарного тростника от Eldana saccharina. Трансформация этим геном бактерии Clcivibcicter xyli subsp. cynodontis, обычно обитающей в ксилеме бермудской травы, приводит к тому, что рекомбинантные бактерии приобретают способность защищать растения кукурузы от мотылька кукурузного (Ostrinia nubilalis).
БАКУЛОВИРУСЫ КАК ИНСТРУМЕНТ БИОКОНТРОЛЯ
Механизм действия
Бакуловирусы – палочкообразные вирусы с двухцепочечным ДНК-геномом, инфицирующие разнообразных беспозвоночных. Различные подгруппы этого семейства патогенны для таких отрядов насекомых, как чешуекрылые, перепончатокрылые, двукрылые, сетчатокрылые, ручейники, жесткокрылые и равнокрылые. Некоторые из них играют важную роль в контроле численности определенных насекомых-вредителей в природных условиях. Бакуловирусы использовали в Северной Америке, начиная с 1930-х гг., до появления химических пестицидов в 1960-х гг., для борьбы с вредителями лесов, в том числе с пилильщиком еловым (Neodiprion sertifer), и продолжают применять, хотя и в меньшем масштабе, для контроля популяций непарного шелкопряда (Lymantria dispar) (табл. 15.3).
Таблица 15.3. Некоторые насекомые-вредители,
для контроля численности которых применяют бакуловирусы

Вирион бакуловируса имеет цилиндрический нуклеокапсид, в котором заключена его ДНК. Попав в ядро инфицированной клетки, бакуловирусные частицы объединяются, образуя компактную структуру, заключенную в кристаллический белковый матрикс. Он состоит в основном из белка полиэдрина. После гибели инфицированных насекомых в среду выходят миллионы полиэдриновых частиц. Попадая в кишечник других насекомых, они подвергаются действию щелочной среды, матрикс растворяется и высвобождаются инфекционные вирусные частицы. Они проникают в клетки кишечника насекомых, через цитоплазму попадают в ядро, где после удаления нуклеокапсида происходит репликация вируса и образование новых вирусных частиц. Некоторые из них попадают в кровоток насекомого, отшнуровываясь от плазматической мембраны инфицированных клеток, а затем и в другие органы. Обычно насекомое погибает по прошествии 10 раундов репликации вируса, т.е. примерно через 5–6 сут после инфекции, при этом до 25% сухой массы насекомого приходится на долю полиэдрина.
Одно из преимуществ бакуловирусов как инструмента биоконтроля численности насекомых состоит в избирательности их действия. С одной стороны, это означает, что данный бакуловирус может использоваться для контроля численности только определенных насекомых-вредителей. Но с другой, благодаря тому что бакуловирусы эволюционировали в течение многих тысяч лег совместно со своими насекомыми-хозяевами, они научились преодолевать их защитные механизмы, а потому устойчивость к этим вирусам развивается крайне редко – гораздо реже, чем к В. thuringiensis. Более того, устойчивые к бакуловирусам насекомые быстро утрачивают эту способность после того, как прекрашают взаимодействовать с вирусами.
Фермеры и садоводы предпочитают использовать один инсектицидный агент, действующий на различных насекомых-вредителей, а не множество инсектицидов. Это означает, что для более широкого применения бакулирусов необходимо расширить круг их хозяев.
Было показано, что при одновременном инфицировании клетки насекомого двумя штаммами бакуловирусов после их репликации иногда появляются новые штаммы, немного отличающиеся по своим действиям от исходных вирусов. Причиной этому является гомологичная рекомбинация между ДНК разных вирусов. Детальное изучение этого явления показало, что рекомбинация осуществляется в пределах участка ДНК длиной всего 79 нуклеотидов, расположенного в гене геликазы р143. Возможно, этот участок и определяет круг хозяев различных бакуловирусов. Учитывая все это, можно предположить, что замена в нем некоторых нуклеотидов позволит создавать бакуловирусы с более широкой специфичностью.
Усиление биоконтроля с помощью генной инженерии
Бакуловирусы не оказывают свое действие мгновенно. В зависимости от условий инфицированное насекомое может погибнуть за период от нескольких дней до нескольких недель. Чтобы ускорить этот процесс, попытались увеличить вирулентность бакуловирусов введением в них чужеродных генов, в результате экспрессии которых произойдет ослабление инфицированного насекомого или его гибель (табл. 15.4). В одном из экспериментов предполагалось использовать ген, экспрессия которого в клетках насекомого-хозяина нарушает его нормальный жизненный цикл.
Таблица 15.4. Эффект некоторых генов, введенных в бакуловирусы
для повышения их инсектицидного действия1)

Известно, что понижение уровня ювенильного гормона у личинок инициирует окукливание и приводит к прекращению их активного питания. Это снижение происходит в результате повышения содержания специфической эстеразы, катализирующей превращение биологически активной формы сложного метилового эфира ювенильного гормона в неактивную кислую форму. Ингибирование активности эстеразы приводит к накоплению in vivo активного ювенильного гормона, личинки дольше остаются на стадии активного питания и в результате достигают гигантских размеров. Разумно было предположить, что при искусственном повышении уровня экстеразы ювенильного гормона произойдет понижение уровня эндогенного активного ювенильного гормона и преждевременное прекращение питания. К тому же было известно, что при уменьшении времени активного питания личинок урожаю наносится меньший ущерб.
Чтобы проверить это предположение, пришлось сначала провести эксперименты по клонированию и экспрессии гена эстеразы ювенильного гормона. Фермент выделили из насекомого Heliothis virescens (совки) и очистили. Определили его аминокислотную последовательность, синтезировали олигонуклеотид, соответствующий одному из сегментов белковой молекулы, и использовали его в качестве зонда для гибридизации. Из библиотеки кДНК Н. virescens выделили кодирующую последовательность для эстеразы ювенильного гормона и встроили ее в геном бакуловируса так, чтобы она находилась под транскрипционным контролем вируса. После обработки таким рекомбинантным бакуловирусом Trichoplusia ni (совки ни), находящейся на первой личиночной стадии развития, содержание ювенильного гормона у насекомого снизилось, а рост личинок резко замедлился по сравнению с таковыми контрольных личинок, обработанных бакуловирусом дикого типа.
К сожалению, применимость этого подхода для повышения эффективности инсектицидного действия бакуловирусов ограничивается тем, что ухудшение питания личинок при повышении уровня эстеразы ювенильного гормона происходит только на первой стадии развития личинок. Личинки, находящиеся на других стадиях развития, гораздо менее чувствительны к обработке бакуловирусами. Таким образом, бакуловирусы, специально сконструированные для экспрессии гена эстеразы ювенильного гормона, эффективны лишь тогда, когда личинки большей части популяции насекомого-вредителя находятся на первой стадии развития, что в естественных условиях почти недостижимо.
Другой подход к повышению эффективности инсектицидного действия бакуловирусов основан на включении в вирусный геном гена мощного насекомоспецифичного токсина, который экспрессировался бы во время цикла вирусной инфекции. В один из штаммов бакуловируса был введен ген насекомоспецифичного нейротоксина, синтезируемого североафриканским скорпионом, Androctonus ciustrcilis Hector. Этот нейротоксин, не оказывающий никакого действия на мышей, блокирует транспорт ионов натрия в нейронах насекомых-мишеней, что приводит к параличу и смерти. Насекомые, которые были инфицированы бакуловирусом, несушим ген нейротоксина скорпиона, повреждали листья контрольных растений на 50% меньше, чем насекомые, инфицированные бакуловирусом дикого типа.
Клонирование и экспрессия кДНК токсина израильского желтого скорпиона, Leiurus quinquestriatus hebraeus, в бакуловирусе Autogrciphci ccilifornicci привело к уменьшению времени, которое необходимо для уничтожения 50% личинок контрольного насекомого, со 120 до 78 ч. Кроме того, через 120 ч после инфекции личинки насекомого, обработанные рекомбинантным вирусом, набрали втрое меньший вес по сравнению с личинками, обработанными вирусом дикого типа. Таким образом, рекомбинантный бакуловирус не только ускорял гибель инфицированных личинок, но и существенно уменьшал способность насекомых повреждать растения.
Не так давно рекомбинантный бакуловирус A. californica, продуцирующий насекомоспецифичный нейротоксин Androctonus australis, был протестирован в полевых условиях. В проведенных ранее лабораторных экспериментах наблюдалось уменьшение времени, необходимого для уничтожения насекомого Т. ni, на 25–50%, но еще больший эффект оказывал рекомбинантный бакуловирус в контрольных полевых испытаниях (рис. 15.7): он быстрее приводил к гибели насекомых, снижал ущерб, причиняемый растениям капусты, сокращал число вредителей в следующем цикле репродукции.
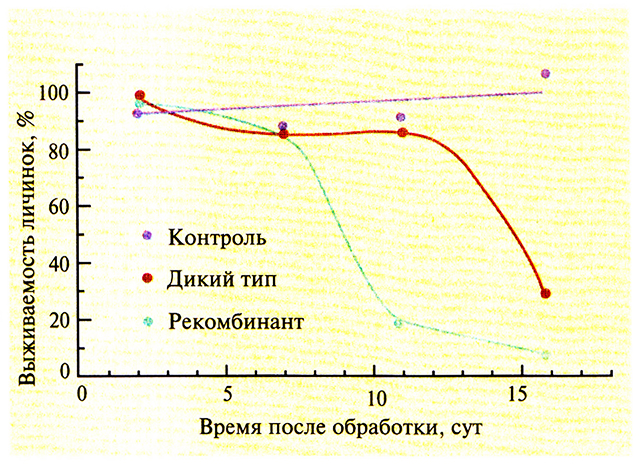
Рис. 15.7. Выживаемость личинок Т. ni после обработки листьев капусты бакуловирусом дикого типа или рекомбинантным бакуловирусом, экспрессирующим ген нейротоксина скорпиона. На контрольные растения наносили только личинок насекомых. Чем ниже выживаемость, тем больше личинок погибло и тем больше эффективность обработки. Растения обрабатывали бакуловирусами только один раз в начале эксперимента.
Какую бы эффективность ни обнаруживал конкретный рекомбинантный бакуловирус в лабораторных экспериментах, основным препятствием на пути его широкомасштабного применения является высокая стоимость его препаратов и трудность распространения. Бакуловирусы – это облигатные паразиты, они могут размножаться только в живом организме или в культуре клеток насекомого. Стоимость препаратов бакуловирусов, независимо от того, является вирус рекомбинантным или нет, гораздо выше, чем химических инсектицидов. И тем не менее не исключено, что биологические инсектициды найдут более широкое применение, если учесть, какое неблагоприятное воздействие на окружающую среду оказывают химические инсектициды, т. е. если сопоставить их стоимость и выгоду, которую они дают.
ЗАКЛЮЧЕНИЕ
В настоящее время микробиологические инсектициды получают все более широкое распространение благодаря тому, что они не оказывают вредного воздействия на окружающую среду. Некоторые подвиды бактерии Bcicillis thuringiensis образуют протоксин, который, попадая в кишечник насекомого, в условиях щелочной среды и под действием пищеварительных протеаз превращается в активный токсин и вызывает гибель насекомого. Летальное действие токсина обусловливается образованием в мембранах клеток кишечника ионных каналов, через которые АТР выходит из клеток. Это приводит к нарушению метаболизма, прекращению питания, дегидратации и т. д. Токсины В. thuringiensis высокоспецифичны в отношении ограниченного числа видов насекомых и нетоксичны для всех остальных; они разрушаются в окружающей среде и поэтому редко оказывают ощутимое влияние на нее, что не способствует отбору устойчивых к ним насекомых. Благодаря всем этим свойствам биологические инсектициды являются перспективными кандидатами на роль агентов, с помощью которых можно контролировать численность насекомых, причиняющих ущерб сельскохозяйственным культурам, и насекомых – переносчиков болезней человека.
Клонированы и охарактеризованы гены различных токсинов В. thuringiensis. Один из таких генов был введен в неспорулирующий штамм Bacillus. При этом ген экспрессировался на всех стадиях развития микроорганизма, а не только на стадии образования спор, когда формируется параспоральный кристалл.
Чтобы расширить специфичность токсина В. thuringiensis, гены различных токсинов встраивали в плазмиды и вводили в хозяйский штамм – либо в составе плазмид с широким кругом хозяев, либо путем интеграции в хромосомную ДНК клетки-хозяина. Бактерии, несущие два разных токсиновых гена, иногда оказывались токсичными для какого-то третьего вида насекомого-вредителя, а не только для тех двух видов насекомых, на которых действовали продукты исходных генов. С помощью генетических манипуляций был создан рекомбинантный белок, состоящий из двух доменов, кодируемых разными генами В. thuringiensis. Он оказывал двоякое токсическое действие. В ходе другого эксперимента рецепторсвязывающий домен одного токсина был объединен с обладающим токсичностью доменом другого. Есть надежда, что применение таких гибридов уменьшит вероятность появления устойчивых насекомых.
Гены токсинов В. thuringiensis вводили также в различные обитающие в поверхностном слое воды микроорганизмы, которые служат пищей для личинок комаров. Этот подход оказался весьма эффективным для прямой доставки токсинов В. thuringiensis в организм насекомого-мишени. Генноинженерными методами были созданы также бактерии, обитающие в ризосфере и экспрессирующие гены токсинов В. thuringiensis. Это позволяет бороться с насекомыми, повреждающими корни растений.
Бакуловирусы патогенны для многих видов насекомых, но каждый их штамм специфичен в отношении небольшого числа видов. Обычно гибель инфицированного насекомого происходит лишь спустя довольно длительное время, поэтому бакуловирусы пе очень эффективны как средство контроля численности насекомых. Однако в различные штаммы бакуловирусов можно ввести специфические гены, и тогда вирус может действовать как система доставки гена, обеспечивающего синтез инсектицида в течение всего жизненного цикла вируса. Проведены предварительные испытания в лабораторных условиях, которые дали положительные результаты. Кроме того, в бакуловирус был введен ген нейротоксина, смертельного для насекомых, и были проведены полевые испытания.

