Более 95% казеина в молоке находится в мицеллярной форме. Мицеллы казеина - близкие к сферической форме частицы размером от 30 до 300 нм и молекулярной массой от 2,6-107 до 5109 (чаще от 6108 до 6-109) . Каждая мицелла содержит от нескольких тысяч до сотен тысяч молекул всех четырех типов казеинов. Шарообразная форма мицелл играет важную роль в обеспечении их высокой устойчивости, так как при одинаковой массе удельная поверхность минимальна у частиц шарообразной формы. В то же время, чем ниже удельная поверхность коллоидных частиц, тем ниже у них запас свободной энергии, тем выше стабильность при прочих равных условиях. Диаметр мицелл уменьшается при снижении в среде содержания неорганических компонентов, особенно кальция и фосфора. Средний состав мицеллы показан в табл. 2.2.
Структура мицеллы казеина окончательно не установлена, несмотря на интенсивное ее изучение. Предложены два принципиальных типа модели мицеллы казеина: каркасная (скелетная) и субмицеллярная. Согласно каркасной модели мицелла казеина представляет непрерывную трехмерную сетку свернутых полипептидных цепей as,-казеина, с которыми посредством мицеллярного фосфата кальция связывается æ-казеин; β-казеин удерживается на каркасе слабыми гидрофобными связями и может легко покидать мицеллу и снова в нее входить.

Субмицеллярная модель (рис. 2.1) полагает, что мицеллы составлены из сотен дискретных частиц - субмицелл диаметром 10-20 нм, в которых молекулы казеинов гидрофобно связаны друг с другом. Существуют два типа субмицелл: F2 и F3 (Опо & Tagaki, 1986; Опо & Obata, 1989; Aori, 1989). Субмицеллы F2 состоят из asl- и æ-казеина, их диаметр равен 20 нм; субмицеллы F3 диаметром 10 нм состоят из α- и β-казенное. Субмицеллы удерживаются в составе мицелл, главным образом, коллоидным фосфатом кальция (ККФ).
Формы Са и фосфатов в мицелле говяжьего казеина приведены в табл. 2.3. В молоке в среднем содержится 30 мМ Са (120 г/100 кг) и 22 мМ Рн (неорганического фосфора) (68 г/100 кг). В мицеллах содержится ~ 2/3 Са и 1/2 Рн 20-38% (в среднем 30%) растворенного в молоке Са, или около 10% от общего содержания, находится в ионизированном виде.
Са в мицелле представлен двумя формами: коллоидным (нерастворимым) фосфатом кальция (ККФ) и казеинатом кальция (органический Са) в примерном соотношении 3:1. Р0 (органический фосфор) входит в состав казеина: остатки фосфорной кислоты ковалентно соединены с радикалами оксиаминокислот - серина и треонина.
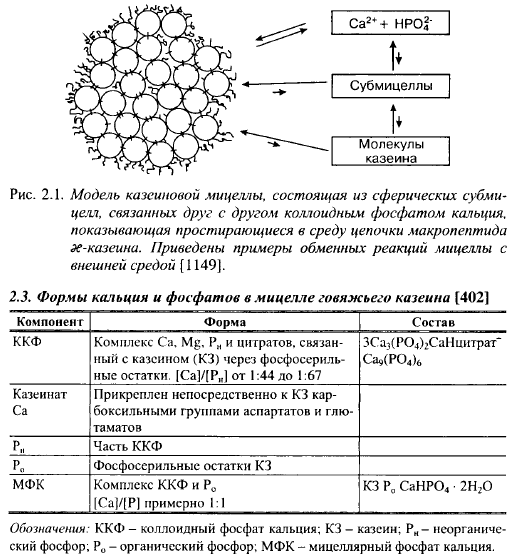
ККФ - аморфный комплекс неорганического Са и Р с отношением Са к Р, равным примерно 3:2; в состав комплекса также входят Mg и цитраты. Весь Рн мицеллы входит в ККФ. ККФ прикреплен к фосфосерильным остаткам казеинов через кальциевые мостики. Holt et al. (1989 г.) предложили ККФ, связанный с фосфосерильными группами казеинов (Р0), считать единым комплексом, назвав его мицеллярным фосфатом кальция (МФК). МФК находится в коллоидной форме и выделяется вместе с казеином при осаждении и ультрацентрифугировании [402]. В этом случае Са и Р в мицелле будет находиться в двух формах: мицеллярного фосфата кальция (неорганический Са + неорганический и органический Р) и казеината Са.
Концентрация кальция в МФК не зависит от активности ионов Са в молоке, а в составе казеинатов Са (органический Са) зависит. Органический Са, наряду с растворенным в сыворотке Са, является источником ионов Са. Мицеллы начинают распадаться при удалении из них более 20% ККФ хелатными соединениями или повышением кислотности, а также повышением pH выше 9 мочевиной, солянокислым гуанидином или подобными агентами. Органический Са играет роль в стабилизации мицелл.
Гидрофобные участки α-, β- и æ-казеинов погружены внутрь субмицелл и образуют неполярное ядро субмицеллы. Полярные фосфосерильные группы α- и β казеинов и почти не содержащий фосфатов гидрофильный гликомакропепгид (МП) æ-казеина, несущие отрицательные заряды, окружают ядро. Более гидрофобные Р3-субмицеллы расположены в ядре мицеллы, более гидрофильные Р2-субмицеллы - на поверхности. Цепочки МП æ-казеина, соединенные с основной гидрофобной его частью связью между фенилаланином в положении 105 и метионином в положении 106 (Фен105 - Мет106), в виде ворсинок (волосков) выступают над поверхностью мицеллы. Удельный внутренний объем мицелл приблизительно равен 2,2 мл на г сухого веса, внешний (гидродинамический), включающий наружный ворсистый (волосообразный) слой, - около 3,9 мл/г. По другим данным, внешний удельный объем варьирует в интервале от 1,5 до 7,1 мл/г протеина, достигая максимума при pH 5,4. Таким образом, МП занимает довольно большое пространство. Изменение доли æ-казеина на 1 % изменяет диаметр мицеллы на 20%, поскольку при снижении дозы æ-казеина на поверхности мицеллы образуются незащищенные от агрегации с другими мицеллами участки и мицелла начинает расти до тех пор, пока вся поверхность не будет защищенной (за счет снижения удельной поверхности).
Полярные участки полипептидных цепей субмицелл типа F3 тоже выступают над поверхностью мицеллы и активно взаимодействуют с водной фазой молока.
Мицеллы казеина отличаются высокой устойчивостью к нагреванию. Свежее молоко с pH 6,6-6,7 свертывается при 100° С за несколько часов, при 130° С - более чем за 20 мин, при 140° С - за 20 мин и 150° С - за несколько секунд. Часть пептидных и фосфатных связей казеина разрушается даже во время нагревания молока до 95° С, что доказывается появлением в молоке свободного неорганического фосфата и увеличением содержания небелкового азота, но эта степень денатурации казеина недостаточна для агрегации мицелл и свертывания молока. Исследования японских ученых показали, что выдержка концентрированного (1:2,5) молока в течение 15, 75 и 135 с при 135-140° С вызывает дезинтеграцию мицелл казеина без свертывания молока.
Мицеллы могут быть получены в виде гранул ультрафильтрацией молока с последующим восстановлением без каких-либо повреждений.
Они не разрушаются при механической обработке молока, например, при гомогенизации.
Стабильность мицелл казеина обеспечивается гидратацией (сольватацией), поверхностным зарядом, стерической устойчивостью. Полярные группы as- и β- казенное, МП æ-казеина в мицелле взаимодействуют с растворителем, в результате вокруг мицеллы образуется гидратный слой, изменение величины которого в зависимости от pH показано на рис. 2.2. По Fox, в зависимости от температуры степень гидратации мицелл составляет от 0,5 до 4,0 г/г казеина, в среднем - 2 г/г.
Степень гидратации белков молока зависит от его тепловой обработки: для сырого молока она составила 2,29 г Н20 /г сухих веществ, после нагревания при 85° С в течение 10 мин - 3,44 г/г. Обработка молока, подвергшегося и не подвергшегося нагреву, реннетом изменила степень сольватации соответственно до 2,64 и 2,78 г Н20/г сухих веществ. Степень сольватации уменьшалась при снижении pH и зависела от вида кислоты, используемой для подкисления. По величине сольватации белков кислоты располагались в следующем порядке: уксусная > соляная > фосфорная > молочная. Подкисление молока, подвергнутого тепловой обработке, до pH 5,8-6,0 предотвращало его сычужную свертываемость.
Нет единой точки зрения на то, насколько прочно связана вода в мицелле казеина, хотя широкие колебания массовой доли влаги в мицелле свидетельствуют о том, что большая часть ее связана мицеллой непрочно. Тем не менее наличие вокруг нативной мицеллы гидратной оболочки из молекул воды, достаточно прочно удерживаемой полярными группами и в определенной степени придающей стабильность мицелле, не вызывает сомнений. Отщепление от æ-казеина МП уменьшает величину гидратного слоя приблизительно в 1,5 раза (рис. 2.2).
В результате адсорбции ионов и ионизации остатков аминокислот на поверхности мицеллы казеина образуется отрицательный заряд. Он невелик (от минус 8 до минус 20 мВ при pH 6,7 и 20° С), но достаточен для того, чтобы противостоять силе молекулярного притяжения между мицеллами казеина при их сближении. Больше половины поверхностного заряда (примерно минус 12 мВ) обусловлено МП, выступающим над поверхностью мицеллы. Поверхностный заряд постепенно снижается при падении pH с 6,7 до 6,0, затем скорость его снижения резко возрастает при понижении pH до 5,4, после чего величина заряда начинает увеличиваться, пока pH не снизится примерно до 5,1. После этого заряд снова уменьшается при снижении pH и становится равным нулю при pH 4,6 (изоэлектрическая точка). Минимальное значение ξ-потенциала при pH 5,3-5,4 обусловлено адсорбцией ионов Са мицеллами. Поверхностный заряд обеспечивает электростатическую стабильность мицеллы.
Стабильность мицеллы в молоке в основном обусловлена æ-казеином, в частности его гидрофильной частью - МП. При низком содержании æ-казеина на поверхности мицеллы остаются незащищенные участки и мицелла продолжает расти, при этом доля субмицелл, содержащих æ-казеин, в ядре мицеллы снижается, а размеры мицелл увеличиваются. Чем выше содержание æ-казеина, тем меньше размер мицелл при прочих равных условиях.
Часть казенное не входит в состав мицеллы. Этот казеин называется «растворимым»; он в основном представлен β-казеином и, вероятно, находится в молоке в виде мономеров. Массовая доля растворенного казеина в свежем молоке составляет 5-10% от общего содержания. Она увеличивается при снижении температуры молока и уменьшается при повышении концентрации ионов кальция и массовой доли æ-казеина. Часть казеина молока переходит в растворимую форму в результате высокотемпературной обработки молока.
Мицеллы казеина нестатичны. В молоке нормального состава они находятся в состоянии динамического равновесия со средой. Мицеллы подвержены многочисленным изменениям: от броуновского движения ворсистого внешнего слоя до диффузии ионов, молекул или их частей, как в мицеллу, так и из нее. Приблизительно 45% Са мицеллы может принимать участие в обменных процессах за 1 час и 63% - за двое суток (Yamauchi & Yoneda, 1977).
Если мицеллу раздробить, то ее фрагменты снова соединяются друг с другом с образованием частиц, подобных исходной мицелле. После разрушения мицеллы восстанавливаются за несколько минут, преимущественно за счет гидрофобных взаимодействий белков.
Выдержка молока в течение нескольких часов при низких температурах сопровождается потерей мицеллой части ККФ, значительного количества β-казеина, в меньшей степени æ-казеина, но, как это ни парадоксально, повышает стабильность мицеллы по отношению ко всем видам свертывания. Выход части β-казеина из мицеллы при низких температурах может быть связан с ослаблением гидрофобных связей или диссоциацией части ККФ, или с обоими этими факторами. Между выходом из мицеллы β-казеина и коллоидного Са имеется связь (рис 2.3)

Выход из мицелл казеина белков во время хранения при низких температурах носит обратимый характер, хотя обратный процесс требует длительного времени и идет не до конца. Для восстановления минерального состава мицелл молока, выдержанного 48 ч при 2-4° С, требуется 18-24 ч при 20° С. Снижение pH также сопровождается солюбилизацией ККФ (рис. 2.4).
Разноречивы данные о значении pH, при котором ККФ полностью растворяется: это или pH 5,2-5,3 при 20-30° С, или pH 4,9-5,0 при 0-20° С (Davies & White, 1986; Pyne & McGang, 1986). Из исследований Dalgleish & Law (1989) вытекает, что ККФ при 20° С полностью растворяется при pH 5,8. Различия в этих данных, очевидно, обусловлены различиями в методике исследований.
После полного удаления ККФ в мицеллах остается 14-16% от общего содержания Са, который находится в форме казеината кальция. Этот Са можно удалить из мицеллы только после полного растворения ККФ. Весь Са, но не весь Р0 удаляется из мицеллы в изоэлектрической точке.
Параллельно с солюбилизацией ККФ при снижении pH из мицеллы в сыворотку выходят казенны в порядке: β > æ>α. Степень диссоциации казеинов зависит от pH и температуры (рис. 2.5).
После достижения максимума степень диссоциации казеинов начинает снижаться и становится равной нулю в изоэлектрической точке. В интервале pH от 6,8 до 4,8 степень диссоциации казеинов увеличивается с понижением температуры от 35 до 4° С. Максимальное количество растворенного казеина при 4, 20 и 30° С равняется соответственно около 60, 30 и меньше 10% от его общего содержания в молоке.
Степень диссоциации различных типов казеинов в зависимости от температуры меняется неодинаково. Доля растворенного æ-казеина в интервале pH от 6,8 до 5,4 не зависит от pH, но в большой степени зависит от температуры: при 4, 20 и 30° С она равняется 8, 15 и 20% от общего содержания растворенного казеина. При дальнейшем снижении pH по направлению к изоэлектрической точке доля лæ-казеина в содержании растворенного казеина при температурах больше 20° С снижается. Доли немицеллярных as!- и β-казеинов также не зависят от pH в интервале 6,8-5,4, но сильно зависят от температуры и составляют при 4, 20 и 30° С соответственно 8 и 75, 15 и 55, 55 и 25%. Сильная зависимость степени диссоциации индивидуальных казеинов от температуры свидетельствует о различии их связей в мицеллах.
Диссоциация ККФ, очевидно, главная причина выхода казеинов из мицелл при снижении pH при температурах больше 20° С. Повышение температуры и pH увеличивает содержание в молоке ионизированного Са, а добавление воды, хлористого натрия, цитрата или других веществ, способных образовывать хелатные высокомолекулярные соединения, снижает содержание Са и Р в мицелле.
Выход ККФ и казеинов из мицеллы сопровождается изменением ее параметров. Степень гидратации мицеллы немного снижается при понижении pH от 6,6 до 6,0, затем увеличивается, с достижением максимума при pH 5,3-5,4, когда весь ККФ выходит из мицеллы и диссоциация казеинов достигает максимума. Объяснить это можно тем, что выход казеинов из мицеллы увеличивает ее пористость, что способствует проникновению сыворотки в мицеллу. При дальнейшем снижении pH уменьшаются степень диссоциации казеинов, поверхностный заряд и степень гидратации мицеллы; последняя достигает минимума в изоэлектрической точке казеина. Частичная замена кальция натрием при pH 6,6-6,5 увеличивает гидратацию.
При 30° С и pH 5,3 появляются мелкие мицеллы: субмицеллы, вышедшие из мицелл, или новые мицеллы, образовавшиеся из покинувших мицеллу казеинов. Пастеризация сырого молока (74° С, 30 с) не предотвращает миграцию β-казеина из мицеллы при 4° С.
Описанные изменения в составе мицелл казеина характерны только для нативных мицелл; мицеллы после воздействия на них молокосвертывающих энзимов ведут себя по-иному (разд. 2.5).

