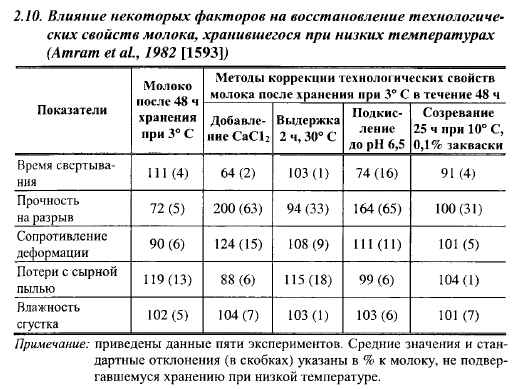
Все молокосвертывающие энзимы, достаточно широко используемые в сыроделии, принадлежат к кислым протеазам, проявляющим максимальную активность в кислой среде. Они характеризуются высоким содержанием дикарбоновых аминокислот, низким содержанием основных аминокислот. Их еще называют аспарагиновыми протеазами, потому что в их активном центре имеются два остатка аспартата. Кислые протеазы содержат 325-360 аминокислотных остатков; молекулярная масса их находится в пределах 33000-38000. Молекулярные массы говяжьего химозина и свиного пепсина равны 35600 и 34600 соответственно.
Молокосвертывающие энзимы животного происхождения выделяются в виде проферментов, которые превращаются в активные энзимы путем отщепления от N-терминального конца ингибитора, содержащего около 45 аминокислотных остатков. Плесневые кислые протеазы образуются в активной форме. Активизацию проферментов инициируют водородные ионы. Активизация - процесс автокаталити- ческий, протекает при pH 2,0—4,6. На молочные заводы препараты молокосвертывающих энзимов поступают в активной форме и концентрированном виде.
В природе нет энзимов, катализирующих разрыв только связи Фен105-Мет106 в æ-казеине, но молокосвертывающие энзимы должны расщеплять эту связь во много раз быстрее, чем другие связи в протеинах молока, так как весь æ-казеин должен быть гидролизован молокосвертывающими энзимами во время выработки сыра, иначе не произойдет коагуляция казеина или значительная часть казеина останется в сыворотке. Любая другая протеолитическая активность молокосвертывающих энзимов во время выработки сыра нежелательна, так как растворимые продукты протеолиза остаются в сыворотке, что снижает выход сыра. По-видимому, теряется для сыра и макропептид, отделяемый от æ-казеина в результате гидролиза молокосвертывающими энзимами, но с этим нужно мириться, так как без гидролиза æ-казеина сычужный сыр выработать нельзя.
Способность быстро гидролизовать æ-казеин - общее свойство молокосвертывающих энзимов, применяемых в сыроделии, - называют молокосвертывающей активностью, в отличие от способности расщеплять другие связи в белках, получившей название общей протеолитической активности. Общая протеолитическая активность молокосвертывающих энзимов по отношению к молокосвертывающей должна быть как можно более низкой.
Одна часть кристаллического химозина может свернуть 72 млн. частей молока при 35° С. Химозин гидролизует в æ-казеине связь Фен105-МеТ106 в 200 раз быстрее, чем другие связи. Это обусловлено составом и последовательностью расположенных рядом с ней аминокислот. æ-Казеины женского и свиного молока вообще не содержат этой связи, но оба гидролизуются говяжьим химозином, хотя и медленнее, чем æ-казеин коровьего молока. По данным Foltman с соавт., говяжий химозин свертывает коровье молоко в два раза быстрее, чем свиное, а свиной химозин свертывает свиное молоко в шесть раз быстрее, чем коровье.
Молокосвертывающие энзимы существенно различаются по отношению общей протеолитической активности к молокосвертывающей. При оптимальном для каждого фермента pH и равной молокосвертывающей активности соотношение общей протеолитической активности (по гемоглобину) говяжьего химозина, говяжьего и свиного пепсина составило 1:3:6. На рис. 2.6 показан гидролиз казеина некоторыми молокосвертывающими препаратами при pH 5,5, близком к pH созревающих сыров и содержимому желудка телят в молочный период. Неспецифический протеолиз (избыточный по отношению к химозину) после 3-часовой инкубации составил для свиного пепсина 0,275 мг, для говяжьего - 0,10 мг, для смеси химозин + говяжий пепсин - 0,05 мг, что соответствовало 87,9; 30 и 12% к протеолизу под действием химозина. Химозин обладает самой низкой общей протеолитической активностью по отношению к молокосвертывающей активности.
Характер протеолиза в результате совместного действия молокосвертывающих энзимов и Lc. lactis subsp. lactis зависит от вида энзима: если содержание растворимого белка, пептидов и свободных аминокислот в обезжиренном молоке с сычужным порошком после роста молочного лактококка принять за 100%, то оно будет равно соответственно: в молоке со свиным пепсином 41,1; 105,5; 22,8%; с куриным пепсином 45,2; 125 и 17,7%. При замене сычужного порошка пепсинами содержание растворимых белков и свободных аминокислот в результате кооперативного протеолиза уменьшилось, а содержание пептидов увеличилось. Появление горечи в сырах связано с накоплением в них специфических пептидов.
Следует отметить более высокую общую протеолитическую активность промышленных препаратов сычужного порошка по сравнению с кристаллическим химозином (рис. 2.7), что обусловлено наличием в первых не только химозина, но и пепсинов. После расщепления æ-казеина и свертывания молока кристаллическим химозином содержание продуктов протеолиза практически не увеличивается, тогда как при использовании сычужного порошка их накопление идет интенсивнее до свертывания и продолжается после свертывания.
Более низкая общая протеолитическая активность химозина по сравнению с пепсинами имеет важное физиологическое значение, поскольку новорожденные в первый период жизни не имеют собственных защитных систем и нуждаются в нативных иммуноглобулинах молозива для защиты от инфекций.
Гидролиз других, чем Лæ-казеин, казеинов молокосвертывающими энзимами протекает во время созревания сыров. Исключением являются твердые сыры с высокими температурами II нагревания и с плавлением сырной массы, во время выработки которых молокосвертывающие энзимы полностью или частично разрушаются. Участие молокосвертывающих энзимов в протеолизе во время созревания сыра необходимо для формирования органолептических показателей созревающих сыров, но количественные и/или качественные отклонения от нормального хода протеолиза вызывают пороки вкуса и консистенции. Под нормальным протеолизом в сыроделии понимают протеолиз под действием химозина при характерных для сыра условиях.
Более высокая общая протеолитическая активность молокосвертывающих энзимов по сравнению с химозином, как правило, оказывает отрицательное влияние на качество сыров, особенно с длительными сроками созревания. Например, потери молочного жира с сывороткой были выше, а плотность сгустка и качество сыра Чеддер ниже при использовании для свертывания молока пепсина вместо химозина. Однако сыры, вырабатываемые с кристаллическим химозином, имеют менее выраженный вкус и медленнее созревают, по сравнению с сырами, вырабатываемыми из этого же молока и по этой же технологии, но с сычужным порошком. Следовательно, общая протеолитическая активность молокосвертывающих энзимов в определенной степени необходима для получения сыров высокого качества.
Химозин в растворе атакует α- и β- казенны, хотя они не имеют связи Фен-Мет. Первичный участок расщепления β-казеина лежит на участке связей 189-193. Образующийся в результате разрыва связи фрагмент 1-189 называют β-1 казеином. Далее в результате разрыва связи 166-167 или 164—165 образуется β-II казеин, разрыв связи 139-140 дает β-III казеин. Пептиды образуются именно в этой последовательности, что может быть обусловлено различной скоростью атаки указанных связей или изменениями конформации β-казеина в процессе гидролиза. В сырах химозин и пепсин не атакуют β-казеин, что может быть связано с низкой активностью воды или иммобилизованным состоянием β-казеина.
Атака химозином α-казеинов направлена на связи, включающие фенилаланин или лейцин. Первичная атака на а-казеин направлена на связи Фен24-Фен25 или Фен24-Вал25 с образованием пептида asrI- казеина. Дальнейший протеолиз может идти в растворе и сыре с последовательным образованием пептидов II, III, IV и так до XX. Под действием химозина и свиного пепсина из α-казеина образуется asl-I пептид, но этот пептид далее расщепляется только химозином.
Гидролиз а- и β-казеинов идет с гораздо более низкой скоростью, чем æ-казеина, но благодаря длительности созревания и участия протеолитических энзимов микрофлоры закваски к концу созревания αs1-казеин и часть β-казеина бывают расщеплены. Пептиды, получающиеся в результате гидролиза казеинов молокосвертывающими энзимами, более доступны, чем исходный казеин, для протеолитических энзимов молочнокислой микрофлоры, которые играют главную роль в созревании твердых сыров. Участие в созревании, т. е. в формировании характерных для сыров органолептических показателей, — вторая функция молокосвертывающих энзимов в сыроделии.
Из молокосвертывающих энзимов по общей протеолитической активности ближе всего к химозину стоит говяжий пепсин, свиной пепсин обладает более высокой общей протеолитической активностью; наименее пригоден для сыроделия куриный пепсин. Однако по другим данным, белый рассольный сыр, выработанный с цыплячьим пепсином или его смесью с реннетом, ничем не отличались от контрольных, выработанных только с реннетом, кроме более высокого содержания сухих веществ и общего азота.
Плесневые протеазы по общей протеолитической активности отличаются от химозина и говяжьего пепсина, что отрицательно влияет на консистенцию сыров, вырабатываемых с их участием, оставляя ее приемлемой для потребителя. Сравнение протеолитической активности фромазы и сычужного порошка показано на рис. 2.8 (по материалам фирмы «Гист-Брокадес»), Количественные различия в протеолитической активности, оцениваемой по отношению небелкового азота к общему содержанию азота казеина, между реннетом и фромазой незначительны. Однако даже такие различия могут сказаться на выходе сыра и экономичности применения фромазы; кроме того, они могут отличаться по спектру образуемых продуктов гидролиза.
Большинство авторов оценивают молокосвертывающие энзимы по продолжительности свертывания молока и технологическим свойствам сгустка, т. е. по наиболее важным для сыроделия показателям. Однако сычужное свертывание молока состоит из двух фаз, а молокосвертывающие энзимы принимают участие только в первой фазе. Зависимости между процессами в этих фазах и условиями среды далеко неодинаковы. Поэтому результаты опытов на молоке зависят от свойств не только молокосвертывающих энзимов, но и молока, и характеризуют систему молоко-энзим.
Многие авторы при изучении сычужной свертываемости молока используют промышленные препараты молокосвертывающих энзимов, являющихся смесью энзимов, количественный и качественный состав которых может отличаться от партии к партии. В этом случае результаты опытов характеризуют не энзим, а конкретную партию его препарата.
И, наконец, физико-химические факторы влияют как на скорость катализируемой реакции, так и на стабильность самого энзима, причем характер этого влияния на каждый процесс различается для разных энзимов. Протеолитическая активность энзимов в сырах может существенно отличаться от их активности в жидких средах. Так, сыры из молока, свернутого свиным пепсином, имеют удовлетворительные характеристики, потому что свиной энзим почти полностью инактивируется во время выработки сыров, и его высокая общая протеолитическая активность в сырах не реализуется.
Степень участия молокосвертывающих энзимов в созревании зависит от того, сколько их остается в сыре. Количество химозина, остающегося в сыре, увеличивается при снижении pH сыворотки и сырной массы.
Оптимальный pH для общей протеолитической активности при прочих одинаковых условиях равняется для пепсинов 2, для гастриксина - примерно 3, химозина - 3-4, плесневых протеиназ - 3—4. Эти значения существенно отличаются от интервалов pH, характерных для производства сыров, что в определенной степени снижает отрицательное влияние на качество сыров повышенной, по сравнению с химозином, общей протеолитической активности кислых протеиназ, применяемых в сыроделии.
Стабильность молокосвертывающих энзимов зависит от ионной силы среды, температуры, продолжительности выдержки и концентрации энзимов. Пепсин и химозин автолизируются при величине pH, оптимальной для их общей протеолитической активности. Плесневые протеиназы стабильны при pH до 2,5.
Общим свойством молокосвертывающих энзимов является снижение общей протеолитической активности при pH среды выше оптимального уровня. Одной из причин этого является инактивация энзимов при высоком pH. Скорость инактивации зависит от вида энзима (рис. 2.9). Так, говяжий пепсин начинает инактивироваться после 20-минутной выдержки только при pH выше 6,4, а при pH 7,0 сохраняет более трети исходной активности. В то же время свиной пепсин после 20-минутной выдержки при pH 6,4 теряет свыше 50% исходной активности, а при pH 7,0 почти моментально полностью инактивируется. Для свертывания молока с pH 6,6 за 5 мин, требуется одинаковая масса говяжьего и свиного пепсина, а при свертывании за 20 мин, свиного пепсина требуется в 2,5 раза больше, чем говяжьего. Быстрая инактивация свиного пепсина в слабокислой среде, какой является молоко, является главным недостатком его как молокосвертывающего энзима.
Оптимальный pH для гидролиза лæ-казеина химозином равен примерно 6,0, однако в интервале pH от 5,6 до 6,4 разница в скорости реакции невелика; активность снижается при pH выше 6,5 с несколько меньшей скоростью, чем для говяжьего пепсина (рис. 2.10). В интервале pH 6,6-6,7, характерном для молока в начале выработки сыра, скорость гидролиза æ-казеина химозином остается достаточно высокой. Куриный пепсин, гастриксин, фромаза стабильны в диапазоне pH, характерном для выработки и созревания сыра.
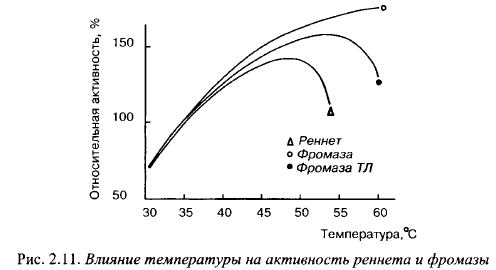
Молокосвертывающие энзимы различаются по отношению к температуре. Изменение молокосвертывающей активности фромазы и сычужного порошка в зависимости от температуры показано на рис. 2.11 (по материалам фирмы «Гист-Брокадес»), Отношение к температуре говяжьего пепсина почти такое же, как у сычужного порошка. В порядке возрастания устойчивости к нагреванию молокосвертывающие энзимы располагаются следующим образом: свиной пепсин, говяжий пепсин, химозин, фромаза и М. pusillus протеазы.
Устойчивость к нагреванию понижается при повышении pH. Молокосвертывающая активность сычужного порошка максимальна при 45° С, чистого пепсина - при 35° С.
Желудочные протеазы млекопитающих показывают различную чувствительность к мочевине: пепсин к ней устойчив, химозин нет. Эти различия используют для их идентификации.
Обработка молока для выработки сыра 0,01-0,15% перекиси водорода повышает активность молокосвертывающих энзимов и микрофлоры закваски, увеличение дозы перекиси до 0,03-0,15% оказывает ингибирующее действие.
Исследования молокосвертывающей и общей протеолитической активности показывают явное преимущество химозина перед другими молокосвертывающими энзимами. Отношение молокосвертывающей активности к общей протеолитической у химозина равно 40:9, а у говяжьего пепсина 4:3, что свидетельствует о высокой общей протеолитической активности пепсина, а следовательно, о большей опасности появления пороков в сырах, выработанных с пепсином.
Продукты протеолиза β-казеина химозином и плесневыми протеи- назами неодинаковы, за исключением одного пептида, однако они подобны, чего нельзя сказать о продуктах его расщепления протеиназой Е. parasitica. Эти различия вызывают пороки органолептических показателей сыра и снижают его выход на 1-2%. Чем продолжительнее созревание сыра, тем больше вероятность появления посторонних привкусов и пороков в сырах, вырабатываемых с заменителями сычужного порошка. Способом предотвращения этого является использование смесей молокосвертывающих энзимов с более высокой и более низкой протеолитической активностью по сравнению с химозином. Низкую протеолитическую активность при производстве сыра проявляет свиной пепсин, так как значительная часть его после свертывания молока инактивируется.
Несмотря на одинаковый основной механизм коагуляции молока различными молокосвертывающими энзимами, структуры образуемых ими сгустков существенно различаются, и эти различия не исчезают во время созревания сыра и обусловливают специфичность консистенции сыров.
Исследование возможности использования в сыроделии вместо сычужного порошка экстракта цветов артишока Cynara carbunculus показало, что опытные сыры содержали меньше микроорганизмов родов Enterobacterium, Lactococcus и Lactobacillus, отличались менее активным протеолизом α- и βказеинов, но в них было выше отношение водорастворимого азота к общему. Однако главным недостатком этого энзима был горький вкус сыра.

