Молочнокислые бактерии являются основной частью необходимой микрофлоры любого вида сыра, кроме сыров, вырабатываемых термокислотным способом. В сыроделии они выполняют следующие функции:
- совместно с молокосвертывающими энзимами и другими группами необходимой микрофлоры осуществляют биотрансформацию компонентов молока в соединения, формирующие органолептические показатели сыра;
- создают условия, подавляющие или ингибирующие рост технически вредной и патогенной микрофлоры;
- ускоряют синерезис молочных сгустков во время выработки сыров, повышая активную кислотность сырной массы и сыворотки.
Метаболизм лактозы
В сычужных сырах вся лактоза должна быть сброжена с образованием преимущественно молочной кислоты, которая создает основной вкусовой фон продукта; в свежих кисломолочных сырах сбраживается большая часть лактозы. В результате сбраживания лактозы в сырах образуется молочная и немного других органических кислот, которые придают им характерный кисловатый вкус, накапливаются внеклеточные экзоэнзимы и биомасса молочнокислых бактерий - источник внутриклеточных эндоэнзимов, катализирующих реакции образования вкусовых и ароматических веществ, создаются неблагоприятные условия для размножения посторонней микрофлоры. Побочные продукты ферментации лактозы служат предшественниками образования вкусовых и ароматических веществ сыра, участвуют в образовании рисунка и сами, например, диацетил, входят во вкусовой букет сыра. Сбраживание лактозы молочнокислыми бактериями - основополагающий процесс в производстве сыров.


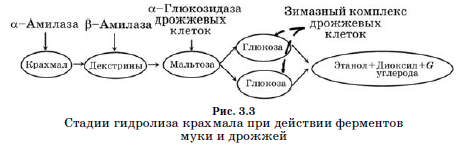
Лактоза - дисахарид, состоящий из глюкозы и галактозы. Пути ферментации лактозы молочнокислыми бактериями, по Cogan & Daly, показаны на рис. 3.3.
У лактококков лактоза транспортируется через клеточную мембрану с помощью фосфоенолпируват (РЕР)-зависимой фосфотрансферазной системы (PEP/PTS-система), в которой РЕР является поставщиком фосфатов и обеспечивает энергией процесс переноса. Лактоза в процессе переноса в клетку фосфорилируется. В клетках фосфорилиро- ванная лактоза сразу же гидролизуется до глюкозо-6-Р и галактозо-6-Р при участии внутриклеточного энзима Р-β-галактозидазы (Р-β-гал). Далее глюкозо-6-Р сбраживается до лактатов гликолитическим путем. Галактозо-6-Р, образующийся в результате гидролиза лактозы, сбраживается в клетках лактококков D-тагатозо-б-Р путем, который соединяется с гликолитическим путем на уровне триозо-фосфатов, так что конечным продуктом ферментации галактозы, как и глюкозы, является молочная кислота. Таким образом, ни глюкоза, ни галактоза в средах (молоке, сыре) не появляются: в среду клеткой выделяется только молочная кислота и минорные продукты ферментации лактозы. Сбраживание глюкозы и лактозы с образованием в качестве конечных продуктов почти исключительно молочной кислоты называется гликолизом или гомоферментативным молочнокислым брожением. Ключевыми энзимами гликолиза являются пируваткиназа (ПК) и лактатдегидрогеназа (ЛДГ). ПК и ЛДГ активируются фруктозо-1,6-диР (ФДР) и ингибируются неорганическим Р (Pi).
В процессе брожения пируваты могут трансформироваться в другие, чем молочная кислота, продукты брожения: формиаты, ацетаты, эта нол, ацетоин. Энзимы, катализирующие реакции образования этих соединений, активируются триозо-фосфатами - промежуточными продуктами гликолиза. Активно размножающиеся клетки лактококков содержат много ЛДГ и ее активатора ФДР, но мало Pi и триозо-фосфатов, что обеспечивает трансформацию основного количества пируватов в лактаты. В голодающих клетках лактококков, что бывает при низком содержании в среде доступных источников энергии, неблагоприятных условиях для роста, резко снижается содержание ФДР, ЛДГ и увеличивается содержание триозо-фосфатов и Pi, и пируваты начинают трансформироваться не только в лактаты, но и в формиат, ацетат и этанол, доля которых в конечных продуктах брожения резко возрастает.
У термофильных молочнокислых бактерий и лейконостоков имеется пермеазная система для транспортировки лактозы внутрь клетки, требующая эндогенного источника энергии. Перенесенная этой системой внутрь клетки лактоза гидролизируется β-галактозидазой (β-гал) до глюкозы и галактозы.
Термофильный стрептококк, по данным Hemme et al. (1980), образует одинаковые количества Р-β-гал и β-гал, а следовательно, может транспортировать лактозу PEP/PTS и пермеазной системами. По Tinson et al., активность β-гал в клетках термофильного стрептококка в 3000 раз выше, чем активность Р-β-гал, а значит, лактоза транспортируется в клетки термофильного стрептококка преимущественно пермеазной системой. По другим данным, термофильный стрептококк вообще не образует Р-β-гал и энзимов D-тагатозо-б-Р пути, но образует большие количества β-гал. Разноречивость этих данных, по-видимому, обусловлена индивидуальными свойствами изученных различными авторами штаммов. Скорее всего, большинство штаммов термофильного стрептококка переносят лактозу в клетки с помощью пермеазной системы и гидролизуют лактозу в клетках β-гапактозидазой.
У термофильных лактобацилл (болгарской и молочной палочек и Lbc. helveticus) обнаружена β-гал и не обнаружена Р-β-гал. Все они переносят лактозу в клетки пермеазной системой. Лейконосгоки также, по-видимому, транспортируют лактозу при помощи пермеазной системы, поскольку они не обладают гликолитической системой, сопряженной с PEP/PTS системой. У болгарской палочки и Lbc. helveticus есть PEP/PTS система только для переноса глюкозы.
Lawrence & Thomas (1979) предполагают, что PEP/PTS система обеспечивает быстрое, пермеазная - медленное сбраживание лактозы. Это подтверждается гем, что штаммы лактококков, выделенные из заквасок и обладающие высокой скоростью сбраживания лактозы, образуют большое количество Р-β-гап, но мало β-гал, а «дикие» штаммы с низкой активностью по отношению к лактозе образуют много β-гал и мало Р-β-гал.
У термофильного стрептококка и термофильных гомоферментатив- ных лактобацилл, лактоза, перенесенная в клетку пермеазной системой, гидролизуется β-галактозидазой (β-гал) на глюкозу и галактозу, глюкоза сбраживается до молочной кислоты гликолитическим путем, галактоза может трансформироваться в глюкозо-1-Р путем Лелиора, глюкозо-1-Р гликолитическим путем сбраживается до молочной кислоты. У термофильного стрептококка есть ЛДГ, которая активируется ФДР, но есть штаммы, в которых ФДР не стимулирует активность, a Pi не ингибирует ЛДГ. Первые могут сбраживать глюкозу по гомоферментатив- ному пути, вторые, очевидно, только гетероферментативным путем.
Ключевым энзимом пути Лелиора является галактокиназа. Большинство штаммов термофильного стрептококка образует очень мало этого энзима, что ведет к неспособности их сбраживать галактозу. Несброженная галактоза выходит из клетки и накапливается в среде (в сыроделии - в молоке и сыре). Это же происходит в культурах молочной и болгарской палочек, которые не могут сбраживать галактозу; Lbc. helveticus галактозу сбраживает.
У лейконостоков лактоза переносится в клетки пермеазной системой, гидролизуется Д-гал до глюкозы и галактозы, глюкоза далее сбраживается фосфокетолазным путем до молочной кислоты, С02 и этанола. Пока нет экспериментальных данных, каким путем лейконостоки сбраживают галактозу, но, скорее всего, она трансформируется путем Лелиора в глюкозо-1-Р, который сбраживается фосфокетолазным путем.
Суммарные уравнения сбраживания лактозы гликолитическим (гомоферментативным) путем (3.1) и фосфокетолазным (гетероферментативным) путем (3.2) имеют следующий вид:
![]()
Из этих уравнений следует, что гликолитический путь ферментации лактозы энергетически в два раза более выгоден, чем гетерофер- ментативный.
Следует еще раз отметить, что гомо- и гетероферментативные пути характерны для сбраживания глюкозы и лактозы соответствующими микроорганизмами при оптимальных для их жизнедеятельности условиях. Отклонение от этих условий может изменить характер брожения. Так, например, лактококки в средах с галактозой или низким содержанием глюкозы сбраживают сахара с образованием лактатов, формиатов, ацетатов, этанола и ацетоина из пируватов.
Таким образом, при размножении термофильных стрептококка и лактобацилл, неспособных сбраживать галактозу, в сыре накапливается свободная галактоза. Лактококки сбраживают свободную, не входящую в состав лактозы или других углеводов галактозу, но только при отсутствии лактозы и глюкозы в среде. Следовательно, в сырах лактококки будут сбраживать галактозу только после того, как сброжена вся лактоза.
Thomas et al. показали, что 10 исследованных ими штаммов сливочного лактококка транспортировали галактозу внутрь клетки с помощью PEP/PTS системы, а далее метаболизировали ее по тагатозному пути. Поскольку PEP/PTS система имеет низкое сродство к галактозе, рост их на среде с содержанием галактозы меньше 30 мМ (0,54%) был очень медленным. Четыре из пяти штаммов молочного лактококка транспортировали галактозу пермеазной системой. Все изученные штаммы лактококков, за исключением одного, сбраживали галактозу с образованием лактатов, формиатов, ацетатов и этилового спирта, т. е. гетероферментативным путем.
Таким образом, галактоза, образуемая в сыре термофильным стрептококком, молочной и болгарской палочками, при сбраживании лактозы может быть медленно сброжена лактококками после окончания ферментации лактозы по гетероферментативному пути. Альтернативой этому является сбраживание галактозы незаквасочной микрофлорой.
Метаболизм цитратов
В молоке в среднем содержится 0,16% лимонной кислоты, что примерно в 30 раз ниже содержания лактозы. В свежем сыре обнаруживается около 1,5 г/кг цитратов. Продукты метаболизма цитратов молочнокислыми бактериями - диацетил и С02 - играют важную роль в сыроделии. Аромат кисломолочных сыров обусловлен, главным образом, диацетилом; диацетил также входит в число ароматообразующих соединений твердых сыров, хотя роль его в твердых сырах ниже, чем в кисломолочных. Углекислый газ, образуемый молочнокислыми бактериями из цитратов и лактозы, формирует рисунок в сырах голландской группы. Образование С02 из цитратов может принести и вред сыроделию: вызвать всплывание сгустка при производстве сыра Коттедж и самокол в твердых сырах. В последнем случае ферментация цитратов происходит в конце первой и во второй половине созревания в результате развития бактерий незаквасочного происхождения при условии, если цитраты не были сброжены микрофлорой закваски во время выработки и на первых этапах созревания. Цитраты не являются источниками энергии для молочнокислых бактерий, за исключением энтерококков, поэтому они ферментируются только в присутствии сбраживаемых лактобактериями углеводов.
В мезофильных заквасках для производства твердых и кисломолочных сыров цитраты сбраживают диацетильный лактококк и лейконостоки. Из бактерий, редко включаемых в закваски, цитраты сбраживают Lbc. plantarum, Lbc. casei, Lbc. fermentum. В производстве сыров важен не только сам факт сбраживания цитратов, но и этап, во время которого это происходит: при слишком быстром сбраживании цитратов рисунок в мелких сырах типа Костромского будет мелким, неправильным и даже щелевидным; сбраживание цитратов до формования сыра или слишком поздно может привести к отсутствию рисунка или самоколу.
Протеолиз
Молочнокислые бактерии не могут синтезировать целый ряд аминокислот и должны получать их из среды обитания в готовом виде. Лактококки имеют абсолютную потребность не менее чем в шести аминокислотах (глутаминовой, валине, метионине, лейцине, изолейцине и гистидине), а некоторые штаммы также нуждаются в фенилаланине, тирозине, лизине и аланине. Лейконостоки имеют абсолютные потребности в валине и глутамине, другие аминокислоты стимулируют рост лейконостоков или необходимы для развития отдельных штаммов. Потребности термофильного стрептококка в аминокислотах схожи с потребностями лактококков; потребности лактобацилл более сложные, и они недостаточно изучены.
Органический азот молочнокислые бактерии могут усваивать в виде свободных аминокислот и низкомолекулярных пептидов, содержащих не более семи аминокислотных остатков с молекулярной массой менее 1500, для переноса которых через мембраны имеются системы, зависимые от pH и нуждающиеся в эндогенных источниках энергии.
В свежем молоке содержится такое количество свободных аминокислот и низкомолекулярных пептидов, которое достаточно для синтеза не более 5-20% биомассы лактококков от уровня, которого она достигает в свернутом ими молоке (0,5 мг/мл сухого веса, или 1,0-1,5 млрд. КОЕ/мл). Для того чтобы при росте в молоке получить недостающее количество доступного для них органического азота, лактококки должны иметь протеолитические системы, которые также используются ими для биосинтеза собственных белков в клетках.
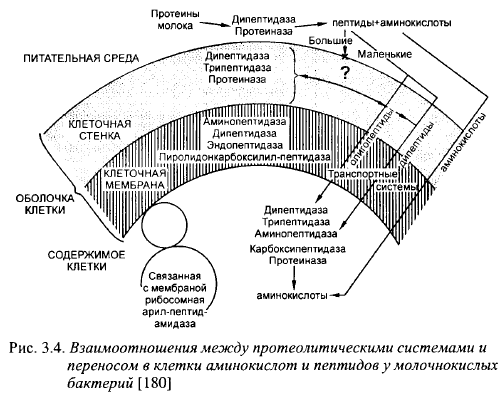
Для получения источников азота в доступной для них форме лактококки имеют полный набор протеолитических энзимов: от протеиназ до амино-, карбокси- и дипептидаз. На рис. 3.4 приведены взаимоотношения между протеолитическими энзимами молочнокислых бактерий и транспортом аминокислот и пептидов в их клетки.
Начальный этап расщепления казеинов происходит при участии протеиназ. Для расщепления белков и крупных пептидов лактококки имеют 4 протеиназы и две пептидазы с узким и широким спектрами действия, локализованные на клеточной стенке или мембране. Протеиназы лактококков - металлоэнзимы, активные в присутствии Са. Только одна из 4-х протеиназ присутствует у всех штаммов лактококков. Неодинаковый набор протеиназ определяет неодинаковые протеолитические свойства штаммов лактобактерий. Протеиназы непрочно связаны с клеточной стенкой и могут выделяться в среду, вследствие чего лактобактерии могут расщеплять белки вне клетки. Расщепленные ассоциированными с клеточными стенками протеиназами белки в виде свободных аминокислот, ди- и трипептидов, поступают внутрь клетки. Внутри клетки имеется набор энзимов для расщепления пептидов до аминокислот и синтеза собственных белков (дипептидазы, трипептидазы, аминопептидазы, карбоксипептидазы, протеиназы). На пептидазный транспорт оказывает влияние pH среды: чем выше pH, тем ниже эффективность транспорта, например, дипептида лейцин-лейцин.
У лактобацилл в расщеплении белков основную роль играют также протеиназы, связанные с клеточными стенками, но их количество меньше, а диапазон действия, возможно, уже, чем у лактококков. Так, у болгарской палочки только одна протеиназа, которая связана с клеточной стенкой и проявляет высокую активность при 45-50° С и pH 5,2-5,8. Этот диапазон не совпадает с условиями выработки сыров в сырной ванне. Активность протеиназ, связанных с клеточными стенками мезофильных лактобацилл, в большой степени зависит от штамма.
У лейконостоков протеиназная активность клеточных стенок очень низкая, возможно, у них вообще отсутствуют протеиназы, ассоциированные с клеточной стенкой.
Для синтеза собственных протеолитических энзимов лактококкам нужны экзогенные аминокислоты, поэтому они начинают синтез спустя 2-3 генерации после внесения в молоко, когда численность популяции достигнет 8-16% от максимально возможного уровня в молоке при неконтролируемом pH. Таким образом, для нормального развития лактококков в молоке должен быть стартовый запас низкомолекулярных аминокислот и низкомолекулярных пептидов.
Гены, управляющие синтезом протеиназ и пептидаз, локализованных в клеточных стенках, расположены на плазмидах, в то время как синтез внутриклеточных протеолитических энзимов кодируется хромосомной ДНК. В популяции лактококков всегда имеются спонтанные мутанты, которые потеряли плазмиды, кодирующие синтез протеиназ, и поэтому неспособные к расщеплению протеинов (Prt варианты). Обработка акрифлавином, выдержка при 39-40° С, голодание клеток приводят к потере клетками плазмид, кодирущих синтез протеиназ, ассоциированных с клеточной стенкой или мембраной, и превращению Prt+ штаммов в Prt варианты, не затрагивающему активность внутриклеточных протеолитических энзимов.
Существуют стабильные в молоке Prt штаммы лактококков, что может быть обусловлено наличием в их клетках плазмид, имеющих гомологичные участки и сходный механизм репликации с плазмидами, кодирующими синтез протеиназ, ассоциированных с клеточными стенками и мембранами, что делает невозможным одновременное присутствие этих плазмид в клетках (Воробьева, Лапина, 1988).
Prt варианты молочнокислых бактерий плохо растут в молоке, если его не обогатить доступными для лактококков источниками азота. После выращивания в обезжиренном молоке при 22° С в течение 16 ч биомасса Prt варианта сливочного лактококка составила 17-21% от биомассы родительского Prt+ штамма, а время его генерации возросло в 3,5 раза. Обычно, чем выше протеиназная активность лактококков, тем быстрее они растут в молоке, но имеются Prt варианты с достаточно высокой скоростью роста в молоке, что можно объяснить быстрым автолизом их клеток с высвобождением внутриклеточных энзимов, среди которых есть протеиназы.
Медленно растущие в молоке штаммы и виды молочнокислых бактерий активизируются в присутствии молокосвертывающих энзимов, которые не влияют на скорость развития быстро растущих культур. Некоторые штаммы термофильного стрептококка расщепляют казеин только в присутствии молокосвертывающих энзимов или природных протеиназ молока. Это свидетельствует о том, что низкая протеиназная активность является одной из причин плохого роста в молоке так называемых «медленных» штаммов.
Протеиназная активность лактококков и лактобацилл в значительной степени зависят от штамма и вида, пептидазная и аминопептидазная - выше у лактобацилл, у которых более активны внутриклеточные пептидазы и аминопептидазы. 80-90% штаммов термофильных лактобацилл, в основном Lbc. helveticus, а также болгарской и молочных палочек, Lbc. fermentum, выделенные из сывороточных заквасок для производства итальянских крупных сыров, были вообще неактивны по отношению к казеину, при сохранении активности внутриклеточных энзимов. По-видимому, это связано с их адаптацией к подсырной сыворотке, в которой всегда есть продукты расщепления казеина, или с потерей кодирующих синтез протеиназ плазмид во время выдержки сыворотки при достаточно высоких температурах (для предупреждения роста мезофилов), которую проводят перед использованием в качестве закваски. О широкой распространенности в молоке штаммов Lbc. helveticus с низкой скоростью кислотообразования и казеолитической активностью свидетельствуют опыты Тер-Казарьяна.
Из 59 штаммов мезофильных лактобацилл (в основном Lbc. casei и Lbc. plantarum), выделенных из твердых сыров, только один штамм Lbc. casei обладал достаточно высокой протеолитической активностью. Польские ученые также установили более высокую активность ассоциированных с клеточными стенками протеиназ лактококков по сравнению с соответствующими протеиназами Lbc. casei. В совместных культурах протеолитические системы лактококков и лактобацилл дополняют друг друга, что ведет к взаимному стимулированию роста лактококков и лактобацилл. Так, скорость образования свободных аминокислот в совместных культурах Lbc. casei и молочного лактококка по сравнению с чистыми культурами возросла почти в два раза, а количество жизнеспособных клеток в период максимума увеличилось примерно в три раза.
Проверка 100 штаммов сливочного лактококка с различными плазмидными профилями, выделенных из двух заквасок, показала, что 20 и 28% из них расщепляли /i-казеин, ни один не расщеплял а-казеин; в опытах Exerkate только один штамм сливочного лактококка атаковал а-казеин. Ассоциированные с клеточной стенкой протеиназы лактококков действуют, по данным Geis et al. (1985), только на β-казеин [180]; по другим данным, они могут атаковать и а-казеин, но с меньшей скоростью. В сырах они атакуют первичные продукты расщепления а-казеина молокосвертывающими энзимами. Эндо пептидаза диацетильного лактококка действует на а s1-казеин, но не на сывороточные белки.
Протеиназы лактобацилл действуют на α-, β-, æ-казеины, а также на сывороточные белки. Специфичность лактобацилл по отношению к типу казеина зависит от штамма. В опытах El-Soda & Desmazeaud Lbc. helveticus не гидролизовал β-казеин и только частично гидролизовал аs-казеин, молочная и болгарская палочка гидролизовали оба типа казеина. Выделенные другими авторами из сывороточных заквасок для производства сыра Грана протеолитически активные штаммы Lbc. helveticus быстро гидролизовали весь α- и большую часть β-каеинов, а молочная палочка расщепляла толькоβ-казеин; Lbc. casei, болгарская палочка и часть штаммов Lbc. helveticus, которые утратили плазмиду 3,5 М Да, обладали только слабым действием на казеин. Термофильный стрептококк атакует β- и æ-казеины.
Протеолиз под действием молочнокислых бактерий играет громадную роль в формировании органолептических показателей твердых сыров. Так, сыр Чеддер, выработанный с Prt мутантом сливочного лактококка, имел значительно менее выраженный сырный вкус по сравнению с контрольным сыром, выработанным на обычной промышленной закваске.
Липолиз
Липолитическая активность молочнокислых бактерий настолько низкая, что на нее не стоило бы обращать внимание, если бы не важность липолиза в формировании органолептических показателей сыров. В большинстве сыров расщепляется только очень небольшая доля молочного жира, но продукты липолиза играют ведущую роль в формировании вкуса и аромата сыров, потому что они обладают низким вкусовым порогом. Сыры из обезжиренного молока не приобретают сырного вкуса и аромата, а у низкожирных сыров вкус всегда менее выражен, чем у полножирных. В свете этого важно выяснить участие молочнокислых бактерий в трансформации липидов во вкусовые и ароматические соединения твердых сыров (в производстве мягких сыров принимает участие микрофлора с гораздо более высокой липолитической активностью, чем липолитическая активность лактобактерий, а в кисломолочных сырах липолиз не играет роли).
Липолитическая активность молочнокислых и пропионовокислых бактерий показана в табл. 3.1. Липолитическую активность молочнокислых бактерий в этом опыте оценивали по приросту содержания свободных жирных кислот (СЖК) в цельном стерильном молоке после семидневного культивирования при оптимальной температуре для роста изучаемого штамма: увеличение содержания СЖК на 4% и выше свидетельствовало о высокой, на 2,0-2,5% - о средней и на 1,5% - о низкой липолитической активности штамма. Липолитическую активность пропионовокислых бактерий определяли диффузионным методом, выращивая испытуемую культуру в индикаторной среде следующего состава: 30 г пептона, 20 мл 40 %-ной молочной среды, 10 мл дрожжевого автолизата на 1 л водопроводной воды, 1,2% агара и 1% твина 40 как субстрата, pH среды 7,0. Первоначально изучаемый штамм выращивали анаэробно в течение 3 сут в жидкой среде указанного состава, но без агара и твина, и вносили в лунки на индикаторную среду, посевы выращивали в анаэростате в течение 10 сут, затем выдерживали 3-4 сут при комнатной температуре. О липолитической активности судили по ширине зоны помутнения вокруг лунок, образуемой кристаллами жирных кислот, высвобождаемых при гидролизе твина: 1-3 мм - низкая; 4—7 мм - средняя и более 7 мм - высокая.
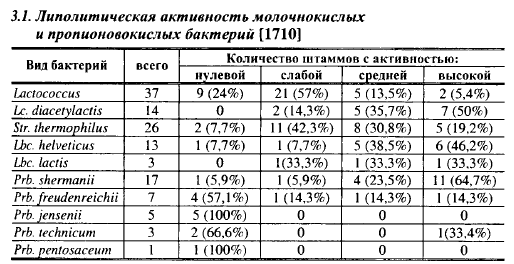
Из молочнокислых бактерий наиболее часто штаммы с высокой липолитической активностью встречались у диацетильного лактококка и швейцарской палочки (Lbc. helveticus), из пропионовокислых бактерий максимальной липолитической активностью обладали штаммы Prb. sher- manii. Высокой липолитической активностью обладают также лейконо- стоки [947]. Таким образом, молочнокислые и пропионовокислые бактерии обладают определенной липолитической активностью в молоке и питательных средах, которая зависит от их вида и штамма.
Липолитическая активность микрофлоры заквасок проявилась и в сырах. В сырах, выработанных в асептической ванне с применением закваски, содержание СЖК в три раза превышало их содержание в сырах, вырабатываемых без закваски. Низкая удельная липолитическая активность молочнокислых бактерий в определенной степени компенсируется большим их количеством в сырах и длительным контактом с субстратом во время созревания.
Видовые и штаммовые различия молочнокислых и пропионовокислых бактерий позволили создать закваски для производства Советского сыра с высокой и низкой липолитической активностью. В зрелом сыре, выработанном на заквасках с высокой липолитической активностью, количество свободных жирных кислот (12,22% от общего количества жирных кислот) было в 1,5 раза выше, чем в сырах с заквасками из штаммов с низкой липолитической активностью; сыры первого варианта имели более выраженный сырный вкус и лучшую консистенцию. Штаммы молочнокислых бактерий с высокой липолитической активностью обладают более высокой кислотообразующей и протеолитической активностью.
Штаммы молочнокислых и пропионовокислых бактерий отличаются не только по скорости гидролиза липидов, но и по спектру высвобождаемых жирных кислот. Более высокое качество имел Советский сыр, выработанный на заквасках с наиболее высоким отношением ненасыщенных к насыщенным свободным жирным кислотам, высвобождаемым при липолизе.
Бактериальные закваски для сыроделия обладают фосфолипазной активностью, особенно по отношению к фосфатидилэтаноламину и фосфатидилхолину. Закваски с высокой фосфолипазной активностью, в отличие от заквасок с высокой липолитической активностью, ухудшают качество сыра.
Крайне желательно, чтобы липолиз в сырах, кроме специфических видов, например, вырабатываемых с участием плесневых грибов или экзогенных липаз, проходил под воздействием только молочнокислых бактерий, обладающих низкой липолитической активностью по сравнению с представителями других родов, потому что слишком активный липолиз приводит к появлению разнообразных пороков сыра, и прежде всего прогорклого вкуса. Низкое содержание свободных жирных кислот обусловливает невыраженный сырный вкус.
Более подробно биотрансформация компонентов молока в сыре изложена в гл. 11.
Ингибирование и подавление роста посторонней микрофлоры
Молочнокислые бактерии играют ведущую роль в подавлении или ингибировании роста технически вредной и патогенной микрофлоры. Антибактериальные факторы молочнокислых бактерий можно разделить на две группы: неспецифические и специфические, перечень их приведен в табл. 3.2.
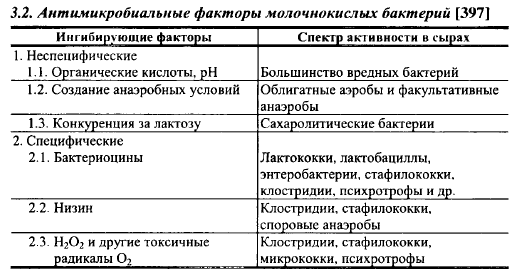
Из неспецифических факторов образование органических кислот, снижение pH и быстрое использование источников энергии, наиболее доступных для большинства вредных для сыроделия микроорганизмов, непосредственно связано со сбраживанием молочнокислыми бактериями лактозы. Большинство вредных для сыроделия бактерий не растет при pH кисломолочных сыров, но растет в питательных средах при значениях pH, характерных для твердых сычужных сыров (5,0-5,5). Однако в сырах pH снижается в результате образования молочнокислыми бактериями молочной и уксусной кислот, а ингибирующее действие органических кислот намного выше, чем неорганических. Молочная кислота, например, ингибирует развитие кишечной палочки при pH 5,1 в такой же степени, как соляная кислота при pH 4,5. По мнению некоторых авторов, происходит это потому, что органические кислоты, в отличие от неорганических, проникают внутрь бактериальной клетки, вызывая необратимые изменения цитоплазмы [912]. Кроме того, минимальные значения pH для роста микроорганизмов определяют при прочих оптимальных условиях, а в сырах и другие факторы, особенно содержание Ог и температура, далеки от оптимальных значений для роста большинства представителей патогенных и технически вредных микроорганизмов.
Лактококки и лактобациллы быстро связывают большую часть растворенного в молоке и водной фазе сыра кислорода, снижая редокс- потенциал в сыре до - (140-150) мВ, тем самым делают невозможным рост в сырной массе облигатных аэробов и сильно ограничивают рост факультативных анаэробов. Сочетание анаэробных условий и отсутствия углеводов подавляет рост многих факультативных анаэробов, которые в отсутствие кислорода обладают абсолютной потребностью в углеводах.
Специфический антагонизм молочнокислых бактерий по отношению к технически вредной микрофлоре сыра очень важен в тех случаях, когда совокупность неспецифических антагонистических факторов недостаточна для подавления ее развития в сырах. Конкретным примером являются маслянокислые бактерии, которые не нуждаются для роста в сыре ни в лактозе (они получают энергию в сырах за счет сбраживания лактатов), ни в кислороде и сравнительно устойчивы к pH. Широкое промышленное применение в сыроделии нашли молочнокислые палочки, образующие достаточное количество перекиси водорода для ингибирования роста в сырах маслянокислых бактерий без угнетения роста лактококков. Если степень неспецифического антагонизма определяется в основном видовой принадлежностью молочнокислых бактерий, то специфический антагонизм зависит главным образом от индивидуальных особенностей штаммов. Как правило, штаммы с низкой скоростью кислотообразования обладают более выраженным специфическим антагонизмом.

