Для сыроделия наиболее важны бактериофаги лактококков - лак- тококкофаги (ЛФ). Всего идентифицировано 11 морфологически различных типов ЛФ. По Teuber, наиболее часто встречаются четыре типа ЛФ:
- фаги с пролатной (вытянутой) головкой (тип Р001);
- с маленькой изометрической головкой с размером ДНК от 18 до 20 МДа (тип Р008);
- с маленькой изометрической головкой, размером ДНК 22-25 МДа (тип Р335);
- с большой изометрической головкой (тип Р026).
Менее часто встречающиеся фаги характеризуются морфологическим разнообразием, касающимся воротничка, базальной пластинки, отростка.
Во ВНИИМС создана коллекция ЛФ. Изучение морфологии 165 ЛФ показало, что все фаги имеют длинные несократимые хвостовые отростки, т. е. относятся к группе В по Бредли. 30 фагов имеют изометрическую головку, характерную для вида 936 подгруппы В1 по Аккерману; остальные имеют головки меньшего размера и удлиненной формы, что соответствует виду С2 подгруппы В2. Эти бактериофаги, типовыми для которых являются фаги Р008 и Р001 по Тойберу, доминируют среди фагов, циркулирующих в других странах. Два фага по морфологии близки к фагу Р087 и 5 - к виду К1. Фаги типа Р335, широко распространенные за рубежом, среди коллекционных фагов ВНИИМС не обнаружены.
По морфологическим характеристикам группу ЛФ В1 можно разделить на 4 подгруппы, имеющие следующие размеры диаметра капсида и длины хвостового отростка (нм): В1-1 - 56±5 и 136±12; В1-2 - 58+4 и 150±13; В1-3 - 65±2 и 200±15; В1-3 - 70±2 и 255±15 (Перфильев, 1998). 62,2% изученных фагов принадлежали к подгруппе В1-1; 21,6% - к В 1-2; 5,7% - к В1-3 и 10,5% - к В1-4. В России более распространены фаги В2, за рубежом - В1. Специфичность генома фагов В1-3 и В1-4 подтверждена методом прямой гибридизации ДНК/ДНК.
Изученные ЛФ имели различные спектры хозяев, что, наряду с результатами рестрикционного анализа, свидетельствует об отсутствии среди них повторных изолятов. Результаты изучения спектра действия с использованием в качестве тест-культур производственных штаммов НПО «Углич» показаны в табл. 4.1. Только несколько проверенных фагов лизировали по одному штамму лактококков, остальные фаги оказались поливалентными.
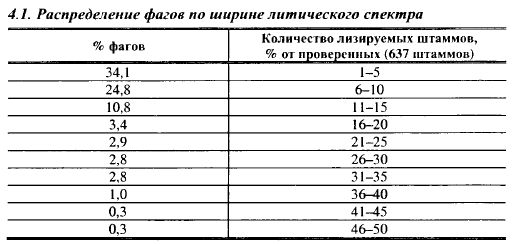
Исследования 1979 г. показали, что 30,8% фагов из коллекции ВНИИМС лизировали все 3 подвида лактококков. Проверка литического спектра коллекционных фагов в 1997 г. выявила 67,2% таких фагов; 29% фагов лизировали по два подвида и только 3,8% лизировали по одному подвиду. Это свидетельствует, с одной стороны, о правильности объединения лактококков в один вид, с другой стороны, о повышении чувствительности к фагу производственных штаммов лактококков, использованных в качестве тест-культур для определения литического спектра бактериофагов. Подвиды лактококков в составе заквасок длительное время культивируются совместно, что не исключает возможности обмена между ними и их фагами генетическим материалом с возникновением фагов с новыми более широкими спектрами литической активности.
Особую опасность представляют фаги, способные лизировать до 50% испытанных штаммов лактококков, несмотря на их небольшое количество. Выделены они на заводах, на которых была неблагополучная фаговая ситуация и, как следствие, вырабатывались сыры низкого качества. Ранее украинские ученые отмечали, что фаги, обнаруживаемые на таких заводах, обладают более широким литическим спектром и повышенной вирулентностью, фиксируемой по скорости лизиса клеток хозяина, по сравнению с фагами, обнаруживаемыми на молочных фермах и молокоприемных пунктах. Отсутствие узкой специфичности у многих фагов, разнообразие и высокая изменчивость спектров их литической активности представляют громадную угрозу сыроделию. Считается, что частота мутаций фагов, вызывающих изменение спектра литического действия, равняется 10-8— 10-9, изменение скорости лизиса бактериальных хозяев - 103. Обнаружен фаг лактококков, образующий мутант с расширенным спектром действия с частотой 5-10-6.
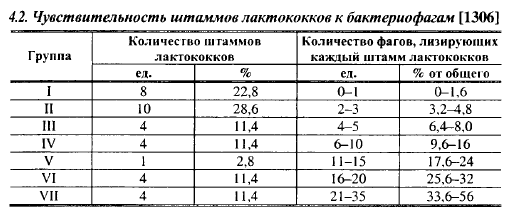
Неодинакова чувствительность к бактериофагам и у производственных штаммов лактококков, о чем говорят результаты исследований, представленные в табл. 4.2. Более половины проверенных штаммов (62,8%) лизировались 0-5% испытанных фагов, 8 штаммов лизировались 16-35 фагами из 65 проверенных. Протасова спустя 19 лет проверила чувствительность к бактериофагам 586 производственных штаммов лактококков. В ее опытах не обладали чувствительностью ни к одному коллекционному фагу 50,6% проверенных штаммов молочного, 53,8% диацетильного и 60,7% сливочного лактококков. Это значительно больше, чем в опытах Докукина с соавт., что, по-видимому, обусловлено включением в состав производственных штаммов фагоустойчивых мутантов, полученных в отделе микробиологии ВНИИМС. Второй особенностью ее результатов является наличие среди исследованных культур штаммов, лизируемых 50 - более 70% коллекционных фагов, которые не были обнаружены в опытах Докукина с соавт. Высокочувствительные к бактериофагам штаммы, по результатам опытов Протасовой, составили 4,1% среди штаммов молочного, 4,7% диацетильного и 2,8% сливочного лактококков.
У лактококков системы устойчивости к бактериофагам кодируются плазмидной и частично хромосомной ДНК. Полученные данные свидетельствуют о чрезвычайно высокой генетической изменчивости как хромосомных, так и плазмидных компонентов геномов лактококков.
Ясно, что включение в закваски штаммов, чувствительных к большому числу фагов, приведет к быстрому их лизису на производстве, что, учитывая способность фага к спонтанным мутациям с изменением спектра литического действия, может привести к лизису и других штаммов, входящих в закваску.
В то же время, для определения чувствительности штаммов лактококков к бактериофагам при их селекции в состав заквасок необходимо использовать фаги с максимально широкими спектрами литического действия. Из этих штаммов лактококков следует также формировать набор для мониторинга фагов на сырзаводах.
Литический тип взаимодействия фагов с бактериальными клетками характеризуется скоростью адсорбции фага, продолжительностью латентного периода, т. е. промежутком времени между адсорбцией и лизисом бактериальной клетки, и урожаем (выходом) фага.
Адсорбцию фага можно определить количественно по разности между количеством вирионов, внесенных в бактериальную культуру, и количеством в ней вирионов до момента окончания литического цикла, при этом продолжительность литического цикла можно увеличить, понизив температуру культивирования. Количество вирионов определяют по числу негативных колоний на газоне штамма-хозяина (фаги, адсорбированные исследуемой культурой, негативные колонии перестают образовывать). Процесс адсорбции бактериофага подчиняется уравнению:
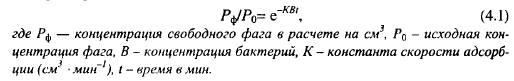
Константа скорости адсорбции ЛФ варьирует в интервале от 0,51 до 32,5 -1010, продолжительность латентного периода при 30° С - от 22 до 60 мин, выход частиц фага - от 34 до 328. Скорость адсорбции снижается при внесении в молоко сычужного порошка, но не чистого химозина.
Продолжительность латентного периода увеличивается при снижении температуры культивирования с 37 до 22° С, что коррелирует со снижением скорости размножения лактококков. Следовательно, скорость лизиса бактериальных клеток в системах фаг-хозяин будет далеко не одинаковой. Некоторые штаммы лизируются фагом с такой силой, что в месте его действия на газоне остается совершенно прозрачная зона. Возможно, отдельные клетки в популяции таких штаммов оказались резистентными к этому фагу, но они не успевают образовывать видимые колонии за время выдержки. У других штаммов при действии этого же фага в пределах прозрачной зоны вырастают точечные колонии фагорезистентных мутантов. У некоторых штаммов в зоне лизиса сохраняются участки сплошного роста. Скорости лизиса фагом разных штаммов могут различаться в тысячи и десятки тысяч раз.
В состав бактериальных заквасок необходимо включать штаммы лактококков не только чувствительные к минимальному количеству фагов, но имеющие наименьшие скорости лизиса фагами-гомологами. Однако даже при небольших скоростях лизиса скорость репродукции бактериофагов выше, чем размножения его бактериального хозяина. Пусть в системе фаг-хозяин продолжительность латентного периода равняется 30 мин, выход фага - 40 вирионам, время генерации лактококка - 30 мин. В этом случае через 1,5 ч количество клеток хозяина из одной бактериальной клетки может увеличиться в 8 раз, количество вирионов из одного вириона - в 64000 раз. Если фаг, способный лизировать клетки микрофлоры одноштаммовой закваски, попадет в молоко в начале приготовления производственной закваски даже в таком небольшом количестве, как один вирион/мл, то этого будет достаточно для того, чтобы закваска полностью потеряла активность к концу культивирования.
Обычно минимальные, максимальные и оптимальные температуры для репликации фагов совпадают с этими температурами для хозяев, но не всегда: некоторые фаги имеют более низкую максимальную температуру, чем хозяин. Выделяют три группы ЛФ, максимальные температуры для репликации которых равны (°С): 34—36; 36-38; 38-40.
Есть фаги, не размножающиеся при 21° С. У систем хозяин- фаг, оптимальная температура репликации фага в которых равна 38° С, снижение температуры культивирования с 38 до 31 ° С не изменило выход фага, но увеличило продолжительность латентного периода с 30 до 70 мин.
Инактивация фагов при нагревании идет согласно уравнению:

К70°С •103 для 10 из наиболее терморезистентных фагов находится в интервале 558-665, для 7 - 176-229 мин-1. При 70° С для снижения титра наиболее терморезистентных ЛФ в гидролизованном молоке на 5 порядков нужна выдержка в течение 50-63 мин, в то же время 17 наиболее термолабильных фагов при этой температуре погибали практически мгновенно. По Цаневой, наиболее термостойкие ЛФ выдерживают нагревание до 74° С в течение 10 мин, наименее стойкие погибают при 62-66° С в течение этого же времени. В молоке устойчивость к тепловой обработке ЛФ несколько повышается. Следовательно, при обычной пастеризации молока в сыроделии (72° С, 15-25 с) будет уничтожена только часть бактериофагов лактококков (при такой обработке титр терморезистентных бактериофагов в молоке снижается на 1-2 порядка). Молоко для приготовления производственных заквасок на сыродельных заводах пастеризуют при 95° С в течение 10-30 мин или стерилизуют. При 95° С за 10 мин инактивировались все имеющиеся в коллекции ВНИИМС бактериофаги лактококков при исходном содержании 106 мл-1. В подсырных сливках полная инактивация ЛФ наступала при 95° С за 5 мин. Повышение концентрации ионов Са и Mg увеличивает, a Na и К - снижает термоустойчивость фагов. У фагов могут появиться мутанты, отличающиеся от родительского фага по термоустойчивости в 1000 раз.
При изучении чувствительности ЛФ к УФ их суспензию в фосфатном буфере с начальным содержанием (1-4) -106 частиц/мл облучали БУФ 30 (длина волны 2357 А), расположенной на расстоянии 40 см. Инактивация фагов в этом опыте шла по уравнению 4.2, где: Р и Р0- титры фага после и до облучения в течение t,c,K- константа скорости инактивации.
К·103 для изученных фагов в этом опыте изменялась от 10,8 до 55,52 с-1, т. е. в несколько более узких пределах, чем константа термоактивации.
Фаги обладают достаточно высокой чувствительностью к УФ облучению: содержание даже наиболее устойчивого к УФ фага за 60 с снижалось более чем на два порядка. В промышленных условиях невозможно расположить источники УФ на расстоянии не более 40 см от обрабатываемых объектов, однако увеличение расстояния может компенсироваться увеличением продолжительности облучения. Для проверки этого был поставлен второй опыт, в качестве источника УФ в котором была взята БУФ 60, расстояние до облучаемого объекта увеличено до 2 м, продолжительность облучения - до 60 мин. Результаты этого опыта представлены на рис 4.4. В воздушной среде инактивация фагов шла намного быстрее: они погибают в результате 25-минутного облучения при длине волны 2357 А. Однако, в опытах Протасовой бактериофаги не были полностью уничтожены даже после 48 ч УФ облучения.
Santer считает, что источник УФ лучей можно помещать не в заквасочной, а в камере, через которую циркулирует воздух из заквасочной, или вмонтировать в вентиляционную систему.
Перекисно-каталазная обработка оказала незначительное действие на бактериофаги: за 4 ч в бульоне с 0,3% перекиси водорода содержание бактериофагов снизилось только в 1,5-2,0 раза.
Мощным инактивирующим действием на бактериофаги обладает хлорная известь (рис. 4.5). В 1 %-ном растворе хлорной извести титр бактериофага через час уменьшается в десятки тысяч раз, через сутки - в сотни тысяч раз; в 10 %-ном ее растворе уже через 5 мин фаги нельзя обнаружить даже качественно.

Этиловый спирт начинает действовать на бактериофаги при концентрациях выше 50%.
Для дезактивации ЛФ рекомендуются синтетические моющие средства Вимол и Триас в концентрации 0,5-1,0% с двухминутной продолжительностью контакта их растворов с обрабатываемыми поверхностями при 60-70° С и десятиминутной при 40-50° С.
Шесть фагов лактококков были инактивированы за 10 мин при 20° С в водных растворах 0,6% формальдегида, 0,5% гипохлорита натрия, 0,2% хлорамина, 3% фенола, 1% дихлорфенола и 0,5% средства на основе перуксусной кислоты. Хлорамин и гипохлорит натрия в этих концентрациях через 10 мин снижал содержание фагов на 7-8 порядков. 6% Н202, щелочная среда (pH 11,0), кислая среда (pH 2,0) за 1-2 ч экспозиции снижали содержание фагов только на 1-2 порядка. В присутствии молока или сыворотки скорость инактивации снижалась. 45-4500 мг/кг активного хлора не могли дезактивировать фаг в молочном сгустке при 20° С за 30 мин. Эти фаги были защищены коагулированным казеином. В хлорсодержащих растворах без органических веществ 300-500 мг/л активного хлора полностью уничтожали бактериофаги лактококков за 1-5 мин.

Противоречивы данные о влиянии цитратов на бактериофаги лактококков. В опытах Докукина цитраты в концентрации до 3% снизили титр фагов примерно на порядок, причем увеличение продолжительности экспозиции с 5 мин до суток почти не повлияло на степень инактивации фагов. По данным Мытник, 0,5 и 1,0% цитратов снизили титр фагов соответственно на 1 и 3 порядка.

