Можно выделить два направления в профилактике лизиса микрофлоры заквасок бактериофагом:
- максимально возможное снижение вероятности контакта микрофлоры с фагами;
- повышение устойчивости микрофлоры заквасок к действию бактериофагов во время контактов с ними.
Полностью исключить контакты микрофлоры закваски с фагами на производстве невозможно, так как сыры вырабатывают из нестерильного сырья в контакте с нестерильной внешней средой. Однако эти контакты можно исключить вплоть до начала выработки сыра в сырной ванне, а потерю активности качественной до внесения в смесь закваски во время выработки сыра из-за бактериофага можно рассматривать как чрезвычайное событие, небольшие же масштабы лизиса микрофлоры закваски во время выработки сыра большого вреда не приносят. Комплекс мер по предотвращению контактов микрофлоры заквасок с бактериофагами включает следующее.
Закваски не должны содержать лизогенных культур, которые сами несут в себе фаги. Имеются методы освобождения («излечивания») лизогенной культуры от содержащихся в ней профагов, при этом часть «вылеченных» культур остается нечувствительной к бывшему в ней фагу. Вероятно, эти методы могут быть использованы для получения пригодных для сыроделия штаммов.
С точки зрения загрязнения производства фагами со стороны закваски предпочтительнее использовать моновидовые одноштаммовые закваски, нечувствительные к собственным профагам. Однако при их применении нужны специальные меры защиты от загрязнения фагами из внешней среды, так как попадание в одноштаммовую закваску даже одного фага может вывести ее из строя. В течение многих лет безукоризненно действует система защиты закваски от заражения фагами и посторонней микрофлорой, разработанная Льюисом. В соответствии с этой системой закваски готовят в герметичных сосудах, погруженных в воду, введение посевного материала проводят через специальные клапаны с дезинфицирующим раствором стерильными шприцами, что предотвращает загрязнение закваски фагами во время ее внесения в заквасочник. С помощью этой системы один и тот же штамм лактококков можно использовать в качестве закваски годами. Применение герметичных заквасочников и асептическое внесение инокулята предлагается и другими учеными в качестве главного условия защиты заквасок от бактериофага.
В многоштаммовых заквасках особенно опасны мультилизогенные штаммы, выделяющие во внешнюю среду несколько типов фагов. Фаги, высвобождаемые лизогенными культурами, это внутренние враги микрофлоры заквасок. Их нелегко выявить, поэтому при подборе микрофлоры закваски, нужно проверять штаммы на лизогенность, используя в качестве индикаторных другие штаммы, которые используют в закваске вместе с исследуемым штаммом. При выявлении лизогенной культуры ее исключают из состава закваски. Если же лизогенность культуры не будет выявлена, то выделяемые ею профаги не будут лизировать другие штаммы, включаемые в закваску. Limsowtin et al. сообщают о непрерывном использовании в течение 2-8 месяцев (в зависимости от завода) многоштаммовой закваски лактококков в производстве сыра Чеддер [648]. Скорее всего, она была составлена из лизогенных штаммов, нечувствительных к умеренным фагам, выделяемым друг другом. В другой работе сообщается, что одну многоштаммовую закваску использовали в промышленности в течение 10 лет без каких-либо помех по отношению к скорости кислотообразования, составлена она была из лизогенных штаммов. Teuber & Lembke считают, что возможно, лизогения и система рестрикции-модификации - это два фактора, которые обусловливают способность лактококков выполнять свои функции в условиях сыроделия. Наиболее вирулентные фаги никогда не выступают в роли профага, что вызывает сомнения в важности лизогенных культур как источников обсеменения фагами сыродельных предприятий. Таким образом, мнения о возможности использования лизогенных культур в сыроделии противоречивы.
Для предупреждения загрязнения закваски фагами из внешней среды особое внимание должно быть обращено на помещения для приготовления заквасок. Инфекция закваски фагами наиболее опасна именно на этом этапе, поскольку приготовление закваски в зависимости от способа и исходного инокулята может продолжаться от 5 до 18 ч. Все возможные пути проникновения бактериофагов в заквасочную должны быть перекрыты: окна, двери в заквасочную должны плотно закрываться, при открытии дверей в помещение заквасочной воздух должен не входить, а выходить из него, что обеспечивается подачей в заквасочную по автономной системе вентиляции стерильного воздуха.
Доступ в заквасочную должен разрешаться только оператору и через тамбур, в котором хранится спецодежда, включая обувь, предназначенные для работы только в заквасочной. Оператору заквасочной нельзя посещать помещения, в которых вырабатывается сыр и перерабатывается сыворотка. Необходимо дистанционное управление подачей закваски в сыродельный цех и заполнения заквасочников молоком.
Направления воздушных потоков на предприятиях должны предупредить заражение бактериофагами заквасок и молока после пастеризации. Через заквасочную не должны проходить сквозные молоко- проводы, воздухопроводы, канализация, особенно из помещений, в которых вырабатывают сыр, перерабатывают сыворотку или обрабатывают сырое молоко.
Заквасочная, включая тамбур, должна быть оснащена бактерицидными лампами, расположенными так, чтобы оставалось минимальное количество затененных мест. Облучение УФ заквасочных обязательно перед пастеризацией и охлаждением молока для приготовления производственной закваски. Затененные места после УФ облучения должны хлорироваться. Целесообразно применять для приготовления производственных заквасок герметичные заквасочники с поддержанием небольшого избыточного давления внутри него путем непрерывной подачи стерильного воздуха или азота и устройствами для асептического внесения посевного материала. Существуют специальные фильтры типа «Ultrapolymembrane РР-РР 30/3» для воздуха, подаваемого в заквасоч- ник, которые пропускают не более одного вириона из 108, и другие фильтры. Немецкая фирма Wolbern разработала оборудование для приготовления и распределения производственных заквасок в асептических условиях.
Необходимо использовать автономные системы для мойки и дезинфекции оборудования заквасочных помещений; пол заквасочных должен быть сухим, без трещин и выбоин.
Активизацию бактериальных концентратов, приготовление пересадочных заквасок следует проводить в специальном боксе, лучше в стерильном молоке и герметичных емкостях. Свести возможные контакты микрофлоры закваски с фагами можно до минимума при внесении бактериальных концентратов в смесь для выработки сыра непосредственно или после кратковременной активизации в небольших объемах стерильного молока или специальных сред, т. е. без размножения микрофлоры сухих заквасок на заводе до внесения их в сыродельную ванну (гл. 5). Бактериальные концентраты, вырабатываемые Угличской биофабрикой, пригодны для непосредственного внесения в сырную ванну, но, к сожалению, они пока стоят слишком дорого, а дозы их внесения непосредственно в смесь для выработки сыра резко возрастают по сравнению с дозами, необходимыми для приготовления производственной закваски. Метод непосредственного внесения в смесь можно использовать в экстренных случаях при потере активности основной закваски, в нормальных условиях следует готовить производственные закваски беспересадочным способом с предварительной активизацией бакконцентратов.
Для снижения загрязнения завода бактериофагами помещения, в которых хранится и обрабатывается сырое молоко, перерабатывается сыворотка, должны быть изолированы от помещений, в которых вырабатывают сыр. Желательно, чтобы цвет спецодежды у работников сырьевой и сыродельных зон был различен, перемещение работников из зоны в зону должно быть запрещено или максимально ограничено. Сепарирование сыворотки следует проводить в герметичных сепараторах. Все сливы должны поступать в канализацию по закрытым системам.
Размножающиеся во время выработки сыров бактериофаги не должны заражать последующие выработки, поэтому оборудование и инвентарь после каждой выработки должны быть продезинфицированы, в частности, сыродельные ванны пропарены в течение 5 мин. В противном случае бактериофаги от предыдущей выработки, оставшиеся на поверхности оборудования и инвентаря, попадут в смесь для следующей выработки, и опасность снижения активности микрофлоры закваски в последующих выработках резко возрастает. Так, в сырах второй выработки, выработанных без санитарной обработки ванны после первой, количество бактериофагов возросло в 371 раз, а стафилококков - на порядок по сравнению с их содержанием в сырах первой выработки. На поверхности сырных ванн, не продезинфицированных сразу после выработки, ЛФ обнаруживали в 100% случаев, на поверхностях, пропаренных сразу после выработки ванн - в 20% случаев. Загрязнение дезинфицирующих средств белками резко снижает эффективность их действия на бактериофаги.
Периодически следует дезинфицировать воздух, так как фаг с капельками сыворотки распространяется по воздуху [1269]. В воздухе в зоне приготовления закваски обнаружено 102 м~3, рядом с сепаратором для обработки сыворотки - 108 м~3 фагов. Для уничтожения фагов в воздухе используют 1% раствор хлорной извести (17 мг активного хлора на м3) или 0,05% раствор хлорамина (7,5 мг/м3 активного хлора).
Для уничтожения фагов при обработке оборудования и молокопроводов содержание активного хлора в дезинфицирующем растворе должно быть не ниже 100 мг/кг, для обработки деревянных поверхностей - не менее 450 мг/кг; температура растворов - не ниже 60° С.
Наиболее часто снижение активности заквасок наблюдается в конце смены во время последних выработок сыра. Правда, повышенное содержание фагов нередко наблюдается в сырах первой выработки, что обусловлено репликацией фагов ночью на поверхностях молокопроводов и оборудования и смыванием их первыми порциями молока. Дезинфекцию следует проводить не только после, но и до работы. Важно держать в исправном и сухом состоянии полы, стены, памятуя о том, что репродукция бактериофагов происходит в размножающихся бактериальных клетках, а размножение лактобактерий происходит только во влажных условиях, в местах, где скапливаются остатки молока и других молочных продуктов.
Высокий уровень гигиены - необходимое, но недостаточное условие в профилактике снижения активности заквасок из-за действия фага, что обусловлено возможностью попадания на завод терморезистентных фагов с сырым молоком и лизогенными культурами. Поэтому парад- дельно с мероприятиями по повышению гигиены должны осуществляться и мероприятия по второму направлению - обеспечению нормальной работы закваски в присутствии бактериофагов.
Определенный эффект дает использование в составе заквасок нескольких видов бактерий, в частности, в качестве газообразующей микрофлоры - диацетильного стрептококка и лейконостоков, или в качестве кислотообразователей - лактококков и термофильного стрептококка.
Вероятно, нечувствительных к бактериофагам штаммов лактококков в природе нет. Однако при проверке чувствительности к фагам штаммов лактококков значительное количество их не лизировалось ни одним коллекционным фагом. У Henning et al. 31 из 100 штаммов были нечувствительны ни к одному из 60 фагов, у Chopin et al. 83 из 291 штамма - к 132 фагам, у Erickson 32 из 74 - к 25 фагам, у Докукина около 77% штаммов - к 88 фагам. Скорее всего, это следствие неполноты использованных коллекций бактериофагов, но в любом случае можно утверждать, что фаги, способные лизировать эти штаммы, встречаются редко.
Штаммы, для которых в коллекциях есть фаги, способные их лизировать, различались по фаготипу (типу и количеству способных их лизировать фагов) (табл. 4.2). Для проверки влияния фаготипа на качество сыра Докукиным были составлены три закваски, в каждую из них включили 3-4 штамма молочного, 2-3 штамма диацетильного и 1-2 штамма сливочного лактококков. В закваску А включили только штаммы, для которых в коллекции не было вирулентных фагов, в закваску Б включены штаммы, лизируемые не более чем 5% коллекционных фагов (все штаммы имели разные фаготипы), и в закваску В - штаммы, которые лизировались более чем 25% фагов. С опытными заквасками вырабатывали Костромской сыр в экспериментальных и заводских условиях. В экспериментальных условиях с благополучной фаговой ситуацией различий в микробиологических и технологических процессах, качестве сыров, выработанных с заквасками А, Б и В, не было, что свидетельствует о правильности подбора микрофлоры опытных заквасок по другим, чем отношение к фагу, критериям. Испытание же заквасок в заводских условиях с неблагополучной фаговой ситуацией выявило явные преимущества заквасок А и Б: качество сыров вариантов А и Б было выше, чем качество сыров варианта В, на 7,3 и 9,8 балла.
Обычно штаммы лактококков с высокой скоростью кислотообразования более чувствительны к бактериофагам, чем штаммы с низкой кислотообразующей активностью. Сочетание в закваске обоих типов штаммов, с одной стороны, понижает ее чувствительность к бактериофагам, с другой, обеспечивает общую нормальную активность, так как энергичные кислотообразователи стимулируют рост «слабых» штаммов.
Установлено, что штаммы лакто кокков, имеющие клетки с более толстыми клеточными стенками (40-65 нм), менее чувствительны к действию бактериофагов. В клеточной стенке фагоустойчивых штаммов лактококков выше содержание соединений, в состав которых входят белок и гексозы.
В лизатах чувствительных к фагу штаммов лактококков могут быть специфические лизины (энзимы типа лизоцима), которые растворяют другие, нечувствительные к данному фагу штаммы лактококков. Лизины, как и вирулентные фаги, лизируют бактериальные клетки, но, в отличие от фагов, их репликации в клетках не происходит. Фаговые лизины не обладают специфичностью, какая присуща фагам, под действием которых они образованы. Так, лизины, образуемые в клетках лактококков, могут атаковать не только лактококки, но и стрептококки группы D. Оптимальная температура для действия лизинов 37° С, оптимальный pH 6,5-6,9. Все фаги, образующие лизины, имеют ожерелье вокруг негативных колоний и пролатные (вытянутые) головки. Образующие лизины фаги особенно опасны для производства, поэтому поставщики сухих заквасок и концентратов должны не включать в их состав штаммы-хозяева таких фагов. Кроме этого, даже небольшое количество пенициллина в молоке повышает чувствительность лактобактерий к фаговым лизинам, поэтому такое молоко нельзя использовать в производстве ферментированных молочных продуктов.
Все, что сказано выше, указывает на необходимость учета природной резистентности штаммов лактококков к бактериофагу при подборе их штаммового состава в состав заквасок.
На заводе, вырабатывающем 10 т сыра в сутки, ежедневно «работает» огромное количество клеток лактококков (не менее 1016), каждый день на нем может появиться - 5-107 спонтанных мутантов с измененной чувствительностью к фагу. На заводах с большим количеством дефектных сыров циркулируют фаги с широким спектром литического действия и высокой вирулентностью. Ясно, что при высокой степени инфицирования производства фагами всегда могут появиться мутанты, способные быстро лизировать штаммы закваски, и закваска рано или поздно потеряет активность. Чтобы этого не произошло, проводят ротацию штаммов, заключающуюся в их смене каждые 4-7 дней. Каждая закваска, приходящая на смену, должна включать штаммы с другими фаготипами, чем предшествующая. Важно, чтобы скорости размножения во время выработки сыра штаммов, включенных в состав многоштаммовой закваски, были близкими, иначе более активные (доминантные) штаммы вытеснят при пересадках менее активные и фагорезистентность закваски понизится. Многоштаммовость и ротация заквасок - основные принципы действующей в России системы защиты заквасок от бактериофага. Правда, нет полной ясности о количестве штаммов каждого вида, которое нужно вносить в закваску. Гибшман и Белоусова считают, что нужно вносить до 10 штаммов в состав закваски. По-видимому, это число для каждого подвида лактококков нужно сократить, так как количество штаммов с достаточно высокой природной устойчивостью к фагу невелико, и чем чаще их используют, тем больше вероятность появления на заводах фагов, способных быстро их лизировать. Лизис фагами хотя бы одного из штаммов, входящих в закваску, увеличивает опасность появления мутантов фага, способных лизировать другие штаммы. Для производства Чеддера в закваски, составленные из известных штаммов, обычно включают два штамма с ротацией через 4-5 суток, в закваски из неизученных штаммов раньше включали до 6 штаммов, теперь - также два штамма. Чем реже проводится ротация штаммов при условии сохранения ими активности, тем стабильнее качество сыра.
При недостаточно высоком уровне гигиены производства многолетнее использование одного и того же набора производственных штаммов приводит к появлению на заводах фагов, способных лизировать все эти штаммы. Численность каждого фага будет колебаться в зависимости от того, входит ли его хозяин (хозяева) в состав закваски, используемой в данный момент, но в небольших количествах они могут постоянно присутствовать на предприятии. В этом случае продолжительность использования закваски на заводе будет определяться временем, необходимым для размножения до опасных количеств фагов, способных лизировать входящие в ее состав штаммы. Зачастую закваски начинают терять свою активность после 1-2 дней использования.
На предприятиях с высоким уровнем гигиены производства закваска может работать без потери активности длительное время, если она составлена из фагоустойчивых мутантов, в результате чего можно исключить ротацию штаммов или заквасок или снизить ее частоту. Фагоустойчивые мутанты бывают спонтанные и индуцированные. Спонтанное появление фагорезистентных мутантов - очень важное свойство культур, обеспечивающее возможность их существования в природе при постоянном контакте с фагами. Они появляются в культуре с частотой от 10~7 до 10-10 . То же можно сказать и о мутациях фагов, изменяющих спектр их литического действия, что помогает фагу выжить при изменении бактериального окружения. Это свойство бактерий и фагов обеспечивает динамическое равновесие бактерий и их фагов в природе, поэтому проблемы бактериофагии при выработке сыров из сырого молока не было. Отсюда следует, что к спонтанным фагоустойчивым мутантам лактококков рано или поздно появятся способные их лизировать бактериофаги. Время, необходимое для их появления, зависит от количества бактериофагов, циркулирующих на заводе: чем их больше, тем быстрее появятся мутанты фагов, способные лизировать фагоустойчивые культуры. Эффективность и возможная продолжительность применения фагоустойчивых мутантов, таким образом, в огромной степени зависит от уровня гигиены производства сыра.
Спонтанные мутанты отбирают двумя способами. Первый способ заключается в выращивании «родительского» штамма в среде со смесью коллекционных фагов, выделении из культур «вторичного» роста мутантов, размножение которых свидетельствует об их резистентности к находящимся в среде фагам, очистке их серией перевивок в жидкой среде с посевами на твердые среды и выделении изолированных колоний, проверке по технологическим критериям, прежде всего по скорости кислото- образования. Пригодные по технологическим показателям фагоустойчивые мутанты родительского штамма лактококка используют в составе заквасок. Их можно поддерживать на заводе в чистой культуре или в виде смеси штаммов, добавляя при пересевах в молоко каждый раз фильтраты сыворотки, получаемой на заводах, где они применяются, осуществляя таким образом непрерывный отбор фагоустойчивых мутантов. Пересевы фагоустойчивых мутантов или заквасок проводят в молоке с фильтратом сыворотки и в качестве контроля - в молоке. Если кислотность в опыте при пересеве стала несколько ниже, чем в контроле, но при последующем пересеве различия в нарастании кислотности в опыте и контроле исчезли, то такой штамм (или закваска) может использоваться в производстве; если различия велики и не исчезают при новых пересевах, то штамм или закваску выбраковывают.
При подборе многоштаммовых заквасок нужно проверять взаимоотношения между штаммами, так как если устойчивость к фагам у мутантов появилась в результате их перехода в лизогенное состояние, то умеренные фаги, которые всегда есть в лизогенных культурах, могут лизировать другие штаммы, включаемые в закваски.
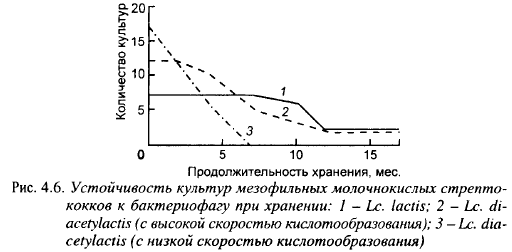
Из 21 родительского штамма лакто кокков этим методом было отобрано 211 фагоустойчивых вариантов, из которых 28 были забракованы за низкую кислотообразующую активность, 53 - за нетипичную морфологию, 99 - за органолептические показатели свернутого ими молока (чаще всего из-за горького или нечистого вкуса). Отобранные мутанты с целью проверки стабильности приобретенной устойчивости к фагу хранили в обезжиренном молоке с перевивками через каждые 15 дней. Изменение устойчивости фагорезистентных вариантов, полученных из штаммов молочного и диацетильного (с высокой энергией кисло- тообразования) лакто кокков, показано на рис. 4.6. Все варианты диацетильного лактококка с низкой скоростью кислотообразования потеряли устойчивость к фагам через 7 месяцев хранения. Скорее всего, они были недостаточно хорошо очищены от клеток родительских штаммов, обладающих высокой скоростью кислотообразования в молоке, которые и вытеснили фагоустойчивые дочерние клетки с низкой скоростью кислотообразования. Для предотвращения этого следует провести культивирование родительских штаммов в присутствии смеси фагов не один раз, как было сделано в работе, а повторить его несколько раз (ирландские ученые применили 7-кратное культивирование штаммов в присутствии фагов при получении фагоустойчивых мутантов).
Все культуры молочного и половина культур диацетильного лактококка с высокими скоростями кислотообразования сохранили приобретенную устойчивость к бактериофагу в течение 7 месяцев хранения, а по две культуры этих подвидов сохранили ее в течение 17 месяцев хранения.
В зарубежных работах при отборе фагорезистентных мутантов проверяют их протеолитическую активность, поскольку потеря способности адсорбировать фаг часто сопровождается потерей казеинолитической активности. Однако протеиназонегативные мутанты обладают и низкой кислотообразующей активностью, поэтому достаточно провести пробу только на кислотообразующую активность.
Вторым методом отбора спонтанных фагорезистентых мутантов является их выделение из подсырной сыворотки после инкубации ее в течение определенного времени при оптимальной для размножения лактококков температуре или воздействие на родительские штаммы смесью коллекционных фагов и сыворотки, освобожденной от микробных клеток с помощью мембранных фильтров. В этом методе в качестве селекционного фактора используются коллекционные фаги и фаги, циркулирующие на сыродельных заводах, на которых отбирается сыворотка. Именно эту идею используют, применяя сыворотку из предыдущих выработок как закваску для последующих выработок. Из 24 образцов подсырной сыворотки, отобранной на шести сыродельных заводах России, было получено 206 фагоустойчивых культур лактококков, 22% которых сохранили устойчивость к фагу в течение 9-10 месяцев хранения. Полученные фагоустойчивые мутанты используются в производстве угличских заквасок.
Оба метода можно объединить, выращивая в фильтратах сыворотки с добавлением коллекционных бактериофагов хорошо изученные, ценные для производства штаммы лактококков.
Ирландские ученые 7-кратной обработкой родительских штаммов коллекционными фагами и сывороткой получили 35 фагорезистентных мутантов; по-видимому, все они были лизогенными, но ни один из них не был индикаторным штаммом для других. Полученные фагоустойчивые культуры использовали без ротации в производстве Чеддера (по 2-4 культуры) до тех пор, пока на заводе в сыворотке не появлялись фаги, способные их лизировать с достаточно высокой скоростью. «Провинившуюся» фагоустойчивую культуру заменяли другой, предварительно проверенной в пилотной установке, или из нее снова получали фагоустойчивые мутанты. Набор фагоустойчивых культур сохранял активность в течение сезона.
Есть рекомендации по приготовлению закваски, резистентной к циркулирующим на заводе фагам, путем ежедневного культивирования в течение 15-18 ч при 30° С нескольких штаммов лактококков в пермеа- те сыворотки, отобранной на этом же заводе, с последующей пересадкой в обезжиренное молоко для проверки кислотообразующей активности. Схема получения и использования спонтанных сывороточных фагорезистентных мутантов, разработанная американскими учеными, показана в табл. 4.4.

Согласно их схеме отбираются штаммы лактококков с высокой скоростью кислотообразования, к которым не обнаружено гомологичных фагов в сыворотке на том предприятии, на котором эти штаммы намечено использовать. Образцы этих штаммов хранят в лаборатории в замороженном виде, перед приготовлением производственной закваски намеченные штаммы размножаются до нужных количеств и направляются в производство. Каждый штамм ежедневно проверяют на отсутствие в сыворотке фагов, способных его лизировать. Процедура проверки состоит в следующем. Отбираются образцы сыворотки из различных ванн, смешиваются, и с помощью мембранных фильтров готовится фильтрат сборной пробы сыворотки, свободный от бактерий. Из полученного фильтрата в асептических условиях готовят 0, 1 и 2 разведения в стерильном обезжиренном молоке с индикатором бромкрезолпурпур (БКП), разлитым в пробирки по 10 мл.
После этого подготовленное молоко и молоко без добавления сывороточного фильтрата (контроль) инокулируют 1% проверяемого штамма и посевы выдерживают 1 ч при 37° С и 5 ч при 30° С, затем сравнивают окраску индикатора в пробирках с фильтратом сыворотки и контролем. Необходимы две температуры инкубации, так как есть фаги, репликация которых не происходит при температуре ниже 37° С, у других она происходит при 25-30° С. После инкубации в контроле цвет индикатора становится желтым. Если в опытных пробирках цвет будет таким, как в контроле, то фагов к проверяемому штамму на заводе нет; если цвет индикатора в опытных пробирках более темный, то это означает наличие фагов к проверяемому штамму в фильтрате сыворотки. Скорость свертывания молока в расчет не принимается, так как в сыворотке остается достаточно высокое количество молокосвертывающих энзимов.
По наблюдениям Sandine, нет необходимости выбраковывать штамм, если отличия в окраске отмечаются только в пробирках, в которые внесен неразбавленный фильтрат или его первое разведение. Если окраска индикатора в пробирке с добавлением меньших количеств фильтрата отличается от контроля, то штамм изымают из закваски. В лаборатории повторяют процедуру получения из него мутанта, устойчивого к циркулирующим на производстве фагам.
Для получения фагоустойчивого мутанта используют 1-2 л культуры родительского штамма и добавляют к ней 5-10 мл фагового лизата, после этого культуру выдерживают до свертывания молока, на что иногда требуется несколько суток. Для отбора мутантов, обладающих достаточно высокой скоростью кислотообразования, американские ученые используют специальную среду - агар для дифференциации штаммов с высокой и низкой кислотообразующей способностью (FSDA), состав которой приведен в табл. 4.5. На этой среде активные ки- слотообразователи образуют колонии 2-3 мм в диаметре, слабые кисло- тообразователи - 0,5-1,0 мм в диаметре.

Для использования в закваске пригодны штаммы, которые приобрели устойчивость к фагам в результате потери способности их адсорбировать, поэтому необходимо поставить пробу на адсорбцию, а также на отсутствие посторонних привкусов в свернутом ими молоке. Лизогенные культуры отбраковываются.
В США считают, что для включения в закваски для сыра Чеддер пригодны штаммы, способные свернуть обезжиренное молоко при 22° С и 1% инокулята не позднее чем за 16 ч [928]. Для приготовления производственной закваски они рекомендуют антифаговые среды с внутренним контролем pH.
Индуцированные фагоустойчивые мутанты получают путем обработки фагочувствительной культуры мутагенными факторами (УФ, гамма- и рентгеновские лучи, нитрозометилмочевина, формальдегид и др.). Так, например, у-излучение (поглощенные дозы 350-800 Гр) индуцировало появление фагоустойчивых мутантов, выход которых в 10—105 раз превышал уровень фона спонтанных мутаций. Часть мутантов, полученных в результате воздействия на родительскую культуру у-лучей, была резистентна ко всем 52 фагам, использованным для отбора фагоустойчивых мутантов. Большинство мутантов сохранило устойчивость к фагам при ежемесячных пассажах в стерильное обезжиренное молоко и при хранении в лиофилизированном состоянии. Более 60% мутантов сохранили на уровне родительских штаммов основные технологические свойства: кислото-, газо- и ароматообразование, термо-, соле-, щелочеустойчивость, спектр ферментируемых углеводов и др. Разработаны методики получения фагоустойчивых мутантов с помощью УФ-облучения, нитрозометилмочевины.
Существует корреляция между плазмидными профилями и устойчивостью к бактериофагам. Одна из многоштаммовых заквасок, в составе которой были штаммы с определенными плазмидными профилями, использовалась для производства Чеддера в течение пяти лет без ротации. Разработана методика получения фагоустойчивых мутантов лактококков путем конъюгативного переноса ДНК; этим методом получены и широко используются в промышленности фагоустойчивые варианты лактококков.
Из хромосомы Lc. lactis выделен и идентифицирован элемент, стабилизирующий плазмидные гены, в том числе ответственные за фаго- устойчивость.
Для проникновения генома фага в клетки хозяина нужны ионы Са2+, однако это справедливо не для всех штаммов. Потребность ЛФ в Са2+ использована при разработке антифаговых сред для приготовления производственных заквасок, из которых ионы Са2+ удалены оксалатом аммония, 2% смеси NaH2P04H20 : Na2HP04 в отношении 3 : 2 (pH 6,5) или цитратом натрия. Основой этих сред является обезжиренное молоко или сыворотка. Антифаговые среды или антифаговые добавки в молоко для приготовления заквасок вырабатывают несколько фирм, в т. ч. Miles, Dairyland Lab. и Galloway-West Со. (США), Wiesby (Германия). Несмотря на то что в этих средах ингибируется репродукция не всех ЛФ и не все лактококки хорошо растут, опасность потери активности закваски при приготовлении на антифаговых средах резко сокращается. Так, в среде, содержащей 10% сухого обезжиренного молока, 2% фосфатного буфера, 1% дрожжевого экстракта активность лактококков закваски была значительно выше, чем в обезжиренном молоке, титр инокулированных фа- гов-гомологов микрофлоры закваски снижался с 107 мл”1 до 1 мл”1 после трех пересадок, в то время как в обезжиренном молоке он повысился до 108 мл, расход закваски снизился на 30-40%. Кроме этого, применение сухих антифаговых сред, вырабатываемых централизованно при строгом микробиологическом контроле, исключает такой фактор, влияющий на закваску, как низкое качество молока.
В Польше получали антифаговую сыворотку путем внутримышечной инъекции суспензии фагов коровам за несколько дней до и после отела. Полученную сыворотку вносили в молоко для выработки сыра, что обеспечивало нормальную скорость кислотообразования в присутствии соответствующих фагов гомологичными штаммами лактококков [1047].
Некоторые технологические факторы могут влиять на размножение ЛФ на сыродельных заводах. При недостаточно высокой кислотообразующей активности заквасок иногда применяют их активизацию, заключающуюся во внесении закваски в молоко, приготовленное для выработки сыра, за 1-2 ч до внесения молокосвертывающих энзимов. Увеличение пребывания закваски в молоке до свертывания повышает ее активность во время выработки, но также резко повышает опасность бактериофага. При низкой активности закваски в качестве оперативной меры можно увеличить ее дозу, а далее нужно выявить и устранить причины ее низкой активности.
Во время приготовления производственных заквасок и выработки мелких сычужных сыров лактококки подвергаются действию различных температур. Установлено, что повышение температуры с 31 до 38° С почти вдвое снижает продолжительность латентного периода при малом изменении выхода фага. В России температуру II нагревания в производстве сыров этого класса часто повышают до 41^42° С, но, к сожалению, неизвестно, как эта температура влияет на репликацию фагов. Однако есть исследования, показывающие, что выдержка штаммов лактококков, обладающих системой рестрикции и модификации, при температурах 40-50° С снижает рестрикцию фагов и приводит к появлению модифицированных фагов с высокой эффективностью репликации на новых хозяевах. Это может значительно снизить эффективность ротации штаммов и многоштаммовости заквасок.
Для приготовления производственной закваски молоко пастеризуют при 90-95° С с выдержкой 10-20 мин. Жесткая тепловая обработка снижает содержание в молоке ионов Mg2+, которые необходимы, как и ионы Са2+, для адсорбции фага. Производственную закваску на заводах готовят при температурах от 23 до 31° С. Чем выше температура приготовления закваски, тем быстрее адсорбируется фаг на клетки лакгококков.
Постоянное наблюдение за фаговой ситуацией (фаговый мониторинг) на каждом предприятии и в целом в промышленности - необходимый элемент управления качеством ферментированных молочных продуктов, в т. ч. сыров. Он осуществляется на нескольких уровнях:
- ежедневный контроль активности производственной закваски (кислотность закваски после ее культивирования в течение определенного времени и при определенной температуре, установленных на заводе; проба на активность по приросту кислотности молока с молокосвертывающим энзимом при оптимальной для закваски температуре, однопроцентной посевной дозе за 3 ч; нарастание кислотности сыворотки во время выработки сыра и pH сыров после прессования);
- периодическое определение титра и спектра литической активности бактериофагов в различных объектах, и прежде всего в производственных заквасках и сыворотке, а также в воздухе помещений, в которых вырабатывают сыр и готовят закваску, по количеству негативных колоний на газонах индикаторных штаммов или штаммов, входящих в ее состав закваски;
- выявление причин, вызывающих отклонения фаговой ситуации от нормы, разработка мер по их устранению с особым вниманием к мойке и дезинфекции оборудования, молокопроводов, инвентаря, соблюдению правил приготовления закваски;
- проведение мероприятий по нормализации фаговой ситуации.
При определении количества фагов в различных объектах на заводе нужно использовать в качестве тест-культур набор индикаторных штаммов, который вырабатывается на Угличской биофабрике, и можно использовать саму закваску, принимая во внимание, что негативные колонии на газоне, образуемом микрофлорой закваски, появляются только при наличии в составе этой микрофлоры не менее 20-40% чувствительных к данному фагу клеток, когда закваску уже нужно изымать из обращения. При определении наличия на заводе фагов к конкретным штаммам для решения вопроса о возможности использования того или иного штамма этот штамм и должен служить индикаторным.
Среды для выявления фагов должны быть хорошо забуферены, чтобы получить высокую плотность клеток индикаторных штаммов, необходимую для получения газона. При высокой плотности популяции титр фага может достигать 1010. Нужно следить, чтобы буферные соли не связывали ионы Са2+, необходимые для осуществления литического цикла фага. Идеальным средством для этой цели является //-глицерофосфат.
Образцы сыворотки нужно отбирать в конце обработки зерна в последних выработках, когда обсемененность сыворотки фагами максимальна, или, что еще лучше, из балансового танка перед сепарированием сыворотки или из танка для хранения сыворотки после сепарирования. Следует избегать хранения сыворотки или хранить фильтраты сыворотки, свободные от бактерий, при температуре до 5° С, в противном случае фаги или часть из них могут дезактивироваться.
Во ВНИИМС разработана процедура проведения фагового мониторинга на сыродельных предприятиях. Основу метода выявления фага составляет набор высокочувствительных к ЛФ штаммов лактококков (каждый чувствителен к более чем 50% коллекционных фагов); в совокупности штаммы, входящие в набор, чувствительны к 100% фагов, которые хранятся в коллекции ВНИИМС. Высокочувствительные штаммы высевают классическим методом на двухслойный агар для получения сплошного газона, в качестве среды используют среду для учета мезофильных аэробных и факультативно-анаэробных бактерий, вырабатываемую в коммерческих масштабах. При выявлении бактериофагов посевы необходимо выдерживать при 30 и 37° С, так как не все фаги образуют негативные колонии при каждой из этих температур. Мытник с соавт. считают, что для выявления бактериофагов нужно одновременно засевать исследуемый субстрат в плотную и жидкую среды. В качестве плотной среды они рекомендуют агар с гидролизованным молоком, жидкой - гидролизованное молоко с индикаторами бромкрезолиурпуром или метиленовым голубым. Можно использовать СДА агар и бульон. Инокулят индикаторных штаммов следует выращивать при той температуре, при которой готовят производственную закваску.
В процессе разработки схемы фагового мониторинга проведено обследование ряда сыродельных заводов, на которых наблюдались случаи потери активности производственных заквасок. Фаги, способные лизировать тест-культуры, обнаружены в 61,9% исследованных образцов молока в количестве до 109 мл-1. Такая высокая обсемененность части молока бактериофагами свидетельствует о его низком бактериальном качестве. Фаги лактококков обнаружили в 25% пастеризованного молока и 33,3% пастеризованного молока при поступлении в сырную ванну, в 16,7% пастеризованного молока, подготовленного для приготовления производственной закваски. Пастеризация молока для приготовления закваски достаточна для полного уничтожения ЛФ, и их появление в нем свидетельствует или о нарушении режима пастеризации, или о загрязнении молока после пастеризации во время охлаждения, когда в заквасочнике создается разрежение и воздух из заквасочной втягивается в заквасочник.
Результаты тестов сухих бактериальных концентратов и производственных заквасок на присутствие ЛФ показаны в табл. 4.6. Только в одном образце сухих бакконцентратов были обнаружены бактериофаги лактококков, и только в двух производственных заквасках из 18 проверенных они не были найдены. Следовательно, закваски были загрязнены фагами во время их приготовления на заводе. В 5,5% исследованных заквасок содержание фагов превышало 109 мл"1, в 38,9% оно было ниже 109, но выше 107 мл"1, еще у 38,9% оно было ниже 107 мл"1, но выше 105 мл"1. В заквасках, содержащих такое количество фага, обнаруживались гомологичные фаги не только к индикаторным штаммам лактококков, но и к штаммам, входящим в состав закваски, применяемой во время обследования заводов для выработки сыра. Это неудивительно, так как при наличии в закваске 107 мл"1 фага в 1 мл закваски может содержаться один мутант фагов с измененным спектром литического действия. Кислотность таких заквасок к окончанию установленного периода культивирования была ниже нормы. 25% выделенных на этих заводах фагов лизировали от 50 до 60% тесткультур, т. е. они обладали широчайшим спектром литической активности.

Эти исследования показали крайне неблагополучную фаговую ситуацию на обследованных предприятиях, обусловленную отсутствием должной защиты заквасок от бактериофага во время их приготовления.
Еще хуже положение на обследованных заводах Республики Беларусь, где фаги найдены во всех образцах проверенных заквасок в количестве 104-1010 мл"1, в сыворотке в конце обработки зерна в первой выработке в количестве 10б—108, в последних выработках - от 104 до 1010 мл'1. Это означает, что в сырной ванне с 10 т смеси может содержаться до 1017 вирионов и не менее 108 мутантов с измененным спектром литического действия. Ясно, что в такой обстановке ни ротация штаммов, ни использование фагоустойчивых культур не предотвратят быструю потерю активности производственных заквасок. Причины неблагополучной фаговой ситуации на ряде заводов состоят в нарушениях правил приготовления заквасок, низком уровне гигиены производства. Меры исправления такой ситуации изложены в разд. 4.5. При этом чрезвычайно много в складывающейся на заводах фаговой ситуации зависит именно от коллектива завода. Так, фаговый мониторинг на заводах в Венгрии показал, что в подсырной сыворотке содержание фага на различных от заводах варьирует от 10 до 1010 мл"1 . В другой работе контрольные сыры вырабатывали на оборудовании, для мойки и дезинфекции которого использовали кальцинированную соду и хлорную известь, в опытных выработках использовали более прогрессивные моюще-дезинфицирующие средства и режимы санитарной обработки оборудования. Контрольные сыры были оценены первым, опытные - высшим сортом.
На крупных сыродельных заводах, где опасность фаголизиса микрофлоры и убытки от этого особенно велики, может быть другая система использования заквасок и фагового мониторинга. Первое условие - высокий гигиенический уровень приготовления заквасок и производства сыра - обязательное для предприятий любой мощности. На крупных предприятиях с хорошо поставленной микробиологической службой можно использовать для выработки сыра только мутанты лактококков, нечувствительные ко всем фагам, циркулирующим на предприятии, и не выделяющие в среду умеренных фагов, к которым чувствительны другие штаммы, применяемые на данном предприятии. Фаговый мониторинг на предприятии заключается в ежедневном исследовании сыворотки и закваски на наличие бактериофагов, гомологичных к применяемым на предприятии мутантам.
С фагоустойчивыми мутантами лактококков, получаемыми путем культивирования родительских штаммов в стерилизованном молоке с сывороткой, вырабатывают больше 60% сыра Чеддер в Австралии.

