2.1. ОБЪЕКТЫ БИОТЕХНОЛОГИИ
Активным началом в биотехнологических процессах является биологический агент. Номенклатура биологических агентов, используемых в биотехнологии, включает клетки микроорганизмов, животных, растений; вирусы (в пищевой промышленности не используются); компоненты клеток, внеклеточные продукты (ферменты, коферменты); иммобилизованные клетки микроорганизмов, животных, растений, их компоненты и внеклеточные продукты.
Первое место среди важнейших биологических агентов занимает самый традиционный из них – микробная клетка.
Точное знание основ жизнедеятельности микроорганизмов является важнейшим условием рациональной постановки технологических процессов, лежащих в основе биотехнологических производств.
2.1.1. МИКРООРГАНИЗМЫ
К микроорганизмам, широко используемым в биотехнологии для получения микробной массы и продуктов метаболизма, относятся бактерии (роды Micrococcus, Bacillus, Nocardia, Brevibacterium, Pseudomonas, Mycobacterium, Corynebacterium, Acetobacter, Aerobacter, Achromobacter и др.), микроскопические грибы (роды Aspergillus, Rhizopus, Trichoderma, Cladosporium, Penicillium и др.), актиномице- ты (роды Streptomyces, Actinomyces) и дрожжи (роды Saccharomyces, Candida, Torulopsis, Rhodotorula, Hansenula, Pichia).
Эубактерии
Это одноклеточные микроорганизмы. За немногими исключениями они имеют шарообразную (кокки) или цилиндрическую (палочки, прямые или изогнутые) форму. Диаметр кокков 0,5–2мкм, размер палочек 0,5–4мкм в длину и 0,5–4 мкм в поперечнике. Размножаются бактерии, как правило, путем бинарного деления клетки. В природе при наличии воды бактерии могут существовать в аэробных и анаэробных условиях.
По типу питания бактерии делят на автотрофов и гетеротрофов. Автотрофы способны синтезировать все компоненты клетки из СО2, используя энергию, полученную при окислении неорганических веществ (NH3, NO–2, Fe2+, Н2, H2S) или энергию света. Гетеротрофы для построения веществ своего тела получают энергию в процессе окисления или сбраживания органических веществ (сахара, спирты, органические кислоты, углеводороды и т. д.).
Микроскопические грибы
Представители родов Penicillium и Aspergillus, а также Trichoderma и дрожжеподобных грибов родов Endomycopsis и Endomyces являются продуцентами многих биологически активных веществ: ферментов, аминокислот, витаминов, органических кислот, антибиотиков, средств защиты растений, бактериальных удобрений и др.
Вегетативное тело микроскопических грибов состоит из сильно разветвленных, длинных, диаметром 1–5 мкм грибных нитей (гиф), образующих грибницу, или мицелий. У микроскопических грибов различают три типа размножения: половое, бесполое и вегетативное. Половое размножение встречается редко и протекает в неблагоприятных условиях, например при недостаточном доступе кислорода. Наиболее развиты бесполое и вегетативное размножение. В основном грибы – это свободно живущие сапрофита, но некоторые из них паразитируют на животных, а многие являются опасными вредителями растений. Для роста, развития и синтеза метаболитов микроскопические грибы требуют наличия в среде кислорода.
Макромицеты в отличие от микромицетов формируют плодовые тела, дифференцированные в шляпку и ножку; размножаются вегетативно (грибницей) или половым путем.
Актиномицеты
Как и бактерии, это прокариотные организмы, не имеющие дифференцированного ядра. Подобно грибам они образуют слаборазвитый или длинный (свыше 600 мкм), ветвистый и очень тонкий мицелий, толщина (диаметр) гиф которого 0,8–1,4 мкм. На питательных средах актиномицеты образуют субстратный, а также воздушный мицелий, в отдельных его гифах – спороносцах – образуются споры, предназначенные для размножения.
Актиномицеты могут также размножаться вегетативным путем. Подобно многим бактериям актиномицеты не переносят кислых условий среды. В отличие от истинных грибов некоторые представители актиномицетов являются анаэробами.
Дрожжи
Представляют собой одноклеточные грибы. Форма дрожжевых клеток чаще всего округлая или эллипсоидальная, но она может меняться в зависимости от условий культивирования. Средние размеры дрожжевой клетки составляют от 3–5 до 8–15мкм. Большинство дрожжей размножаются почкованием. На материнской клетке образуется почка, которая вырастает в дочернюю клетку; достигнув объема материнской, она отделяется от нее (род Saccharomyces). Есть дрожжи, размножающиеся делением, подобно бактериям (род Schizosaccharomyces), и дрожжи, сочетающие процессы почкования и деления, так называемое почкующееся деление (роды Nadsonia, Saccharomycodes и др.).
В отличие от истинных грибов дрожжи проявляют свою жизнедеятельность как в анаэробных, так и в аэробных условиях. В анаэробных условиях дрожжи, сбраживая сахара, получают необходимую им энергию и промежуточные продукты обмена, используемые клеткой для всех жизненных процессов. Основными продуктами брожения являются этанол и диоксид углерода. В аэробных условиях дрожжи не сбраживают, а окисляют углеводы до диоксида углерода (углекислого газа) и воды. Спирт при этом почти не образуется, но резко ускоряется процесс размножения дрожжей.
Микроскопические водоросли
Они достаточно полноценны по белку. Синезеленые водоросли, или цианобактерии, называются делящимися водорослями, и с бактериями их объединяют признаки, типичные для протокариот. Все водоросли дефицитны по серосодержащим аминокислотам и триптофану.
По такому показателю, как отношение суммы незаменимых аминокислот к общему азоту в продукте, водоросли и цианобактерии близки по значению, но уступают по нему стандартным продуктам (коровье молоко, гусиные яйца). Представляет также интерес возможность получения из водорослей одновременно с белком кислых полисахаридов – важного компонента искусственных продуктов питания.
В мировой практике микроводоросли используют как добавку в шоколад и бисквиты (до 10 %), джемы (до 30 %). В пищу употребляют также водоросли, выращенные на отходах переработки картофеля и томатов, виноделия, сахарного и спиртового производств.
2.1.2. КЛЕТКИ РАСТЕНИЙ
Культивирование клеток растений – относительно молодая отрасль биотехнологии. С помощью этого метода возможно проведение исследовательских и прикладных работ, которые затруднены или невозможны при использовании интактных растений.
Метод клеточных культур дает возможность получить неограниченное количество идентичных клеток, которые могут служить модельными системами для изучения метаболизма растений, при этом продолжительность эксперимента сокращается с нескольких лет до 10–15 дней. Культуры растительных клеток являются удобной моделью для изучения системы хозяин–паразит (вирусы, бактерии, грибы, нематоды, насекомые) и для поиска важных для промышленности и сельского хозяйства метаболитов (токсинов, гербицидов, регуляторов роста и др.). Чистые культуры растительных клеток также могут быть использованы в биосинтетических и биотрансформирующих реакциях.
В настоящее время насчитывается более 50 групп вторичных метаболитов, которые продуцируют культуры клеток растений, основные из них: углеводы, аминокислоты, пептиды, белки, ферменты, нуклеиновые кислоты и их производные, витамины, липиды, гормоны, ароматические вещества, красители, органические кислоты, пигменты, пищевые добавки, специи, алкалоиды и др.
В ряде случаев целевой продукт накапливается в клеточных культурах в значительно больших количествах, чем в соответствующих интактных растениях.
Культуры клеток растений могут быть использованы не только в биосинтезе вторичных метаболитов, но и для биотрансформации химических соединений.
В культурах клеток растений найдены ценные биологически активные соединения, не обнаруженные в соответствующих интактных растениях, например перицин, перикалин, хинокиол, ферригинол и др.
Культуры тканей животных и человека используют только в клинической медицине.
2.2. ПИТАТЕЛЬНЫЕ СРЕДЫ ДЛЯ МИКРООРГАНИЗМОВ
Потребность в тех или иных веществах определяется физиологическими особенностями данного вида микроорганизмов, но во всех случаях питательная среда должна представлять собой сбалансированный водный раствор этих веществ и обеспечивать их приток в клетку в определенном количестве.
2.2.1. ПРИНЦИПЫ СОСТАВЛЕНИЯ ПИТАТЕЛЬНЫХ СРЕД
В самом приближенном виде физиологические потребности микроорганизма в питательных веществах можно выявить, определив химический состав микробной клетки, однако в этом случае не учитываются количество и состав метаболитов, выделенных клеткой во внешнюю среду, и то обстоятельство, что состав клеточного вещества микроорганизма зависит от состава среды обитания и варьирует в достаточно широких пределах. Но все же первоначальную ориентировку в выборе оптимального состава питательной среды можно сделать на основе анализа состава клеточного вещества микроорганизма (табл. 2.1).
Таблица 2.1. Усредненный элементарный состав биомассы некоторых групп микроорганизмов
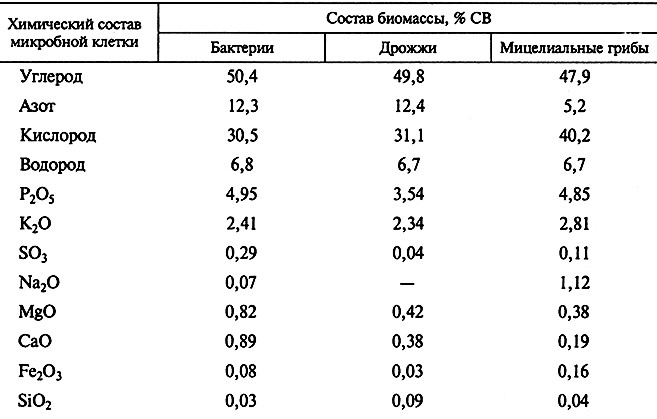
Кроме важнейших элементов в состав клеток всегда входят микроэлементы: бор, молибден, марганец, цинк, медь, бром, йод, кобальт и др., необходимые клетке для образования ферментов и витаминов. Обычно микроэлементы вносят в среду вместе с водопроводной водой. Соотношение отдельных химических элементов в среде может заметно колебаться в зависимости от вида микроорганизмов и условий их роста.
Среди элементов наибольшее биогенное (жизненно важное) значение имеет углерод. Он входит в состав почти всех органических соединений, образующихся в микробной клетке. Углерод прежде всего вступает во взаимодействие с кислородом, водородом, азотом, образуя в сочетании с другими элементами основу жизненно важных соединений клетки: аминокислот, белков, углеводов, нуклеиновых кислот, жиров и др.
Важны для питания микроорганизма и остальные элементы: фосфор, сера, кислород, железо, калий и др.
Микроорганизмы чувствительны к составу питательных сред. Одни соединения они интенсивно потребляют, другие оставляют нетронутыми или используют во вторую очередь. Состав среды в процессе роста культуры меняется, что оказывает влияние на ее развитие и биосинтетическую способность.
В то же время микроорганизмы весьма неприхотливы и легко адаптируются к условиям обитания. Например, дрожжи прекрасно растут на глюкозе, сахарозе, мальтозе, но могут быть адаптированы к выращиванию на пентозах, парафинах нефти, этаноле, метаноле и т.д.
Часто сырьем для выращивания микроорганизмов служит материал, который они не в состоянии использовать без предварительной подготовки (например, целлюлоза, гемицеллюлоза, крахмал, пектин, пентозаны и т.д.). В подобных случаях при приготовлении питательной среды биополимеры предварительно гидролизуют ферментативным или химическим способом до получения усваиваемой формы.
Таким образом, питательная среда должна иметь определенное значение рН, содержать водный раствор или суспензию усваиваемых форм углерода, азота, необходимый набор макро- и микроэлементов.
Для нормальной жизнедеятельности микроорганизмов часто оказывается необходимым присутствие в питательной среде факторов роста, главным образом витаминов, источником которых могут быть автолизаты и гидролизаты клеток дрожжей и других микроорганизмов, кукурузный экстракт, отвары растительных отходов и т.д. Далее рассматриваются источники отдельных компонентов питательных сред.
Источники углерода
Большинство микроорганизмов в качестве источника углерода ассимилируют органические вещества. Исключение составляют цианобактерии, которые используют диоксид углерода.
Непосредственным источником углерода могут быть различные углеводы несложного строения: гексозы, пентозы, низкомолекулярные олигосахариды. Полисахариды, такие, как целлюлоза, гемицеллюлозы, пектиновые вещества, крахмал, маннаны, пентозаны и т.д., могут быть источником углерода лишь после их гидролиза и при условии, что микроорганизм обладает способностью синтезировать ферменты, гидролизующие эти вещества. Микроорганизмы могут использовать органические кислоты, спирты, жирные кислоты, легкие и тяжелые углеводороды и другие углеводородсодержащие соединения.
Выбор источника углерода в биотехнологии имеет большое значение. Он часто предопределяет состав остальных компонентов среды и даже технологию и аппаратурное оформление производства, особенно если сырье нуждается в предварительной подработке.
Источники азота
Азот должен находиться в среде в химически связанном состоянии: в виде неорганических солей, кислот и органических соединений. Потребность в тех или иных азотсодержащих соединениях определяется физиологическими возможностями микроорганизмов. На основе экспериментального изучения потребности микроорганизма в той или иной форме азота определяют необходимое содержание этих веществ в питательной среде.
Как правило, продуценты биологически активных веществ нуждаются в отдельных аминокислотах, реже – во всех 20 протеиногенных.
Органические азотсодержащие соединения и аммонийный азот обычно легко усваиваются микроорганизмами, нитраты – медленнее, так как азот нитратов должен быть сначала восстановлен, лишь после этого он может быть реализован клеткой в процессе обмена веществ. Нитриты практически не используются как источник азота в среде.
Источники фосфора
Фосфор вносят в среду в виде солей фосфорной кислоты, как правило, с различными естественными субстратами (отварами растительных тканей, мукой, кукурузным экстрактом и т.д.) или реже с синтезированными соединениями (например, фитином).
Фосфор – важный элемент питательной среды. В клетке он входит в состав ATP, ADP, AMP, обеспечивая энергетический и конструктивный обмены, участвуя в синтезе белков, нуклеиновых кислот, гликолизе и других процессах. Скорость роста культуры зависит от содержания фосфора. При недостатке его в среде, особенно в начале роста микроорганизмов, наблюдаются пониженный уровень накопления биомассы, незначительный прирост липидов, обеднение клеток белками и витамином В2, резкое снижение интенсивности дыхания и повышение бродильной способности дрожжей. При этом в несколько раз уменьшается содержание фосфора во всех клеточных фракциях микроорганизма.
Источники витаминов, макро- и микроэлементов
Без витаминов и ионов металлов невозможно представить обмен веществ микробной клетки. Но потребность микроорганизмов в этих соединениях различна. По этому признаку все микроорганизмы делятся на два типа: ауксоавтотрофы, не требующие введения в питательную среду витаминов и синтезирующие их из строительных блоков самостоятельно, и ауксогетеротрофы, не способные синтезировать ряд витаминов. Если продуцент – ауксогетеротроф, то введение хотя бы небольших количеств витаминов необходимо: оно ускоряет его рост и развитие. Многие микроорганизмы относятся к ауксогетеротрофам, например, для дрожжей необходим водорастворимый комплекс витаминов группы В.
Обычно потребность микроорганизмов в витаминах устанавливают экспериментально, конкретно для каждого штамма. Как правило, недостатка в витаминах в средах нет, так как они вводятся вместе с растительными субстратами, которые являются одновременно основным источником углерода в среде, и лишь в редких случаях прибегают к введению в среды автолизатов микробных масс, кукурузного экстракта и т.п.
Многие ионы металлов, являясь составной частью активного центра ферментов или участвуя в поддержании их пространственной структуры, обеспечивают обмен веществ микроорганизмов. Ферменты, содержащие металлы, активируют процессы дыхания, окислительно-восстановительные реакции, синтез аминокислот, жирных кислот, Сахаров, нуклеотидов, пиримидиновых оснований; регулируют образование сложнейших молекул белков, гликогена, нуклеиновых кислот, их трансформацию и распад.
Наибольшее влияние на рост и развитие микроорганизмов оказывают ионы железа, меди, марганца, цинка, бора, молибдена, кобальта и ряда других металлов. Микроорганизмы нуждаются в микродозах этих элементов, о чем свидетельствует количественный состав золы продуцента. Если же эти вещества присутствуют в средах в больших количествах, чем это необходимо для развития микроорганизма, то они оказывают ингибирующее действие, что объясняется законами конкурентного и неконкурентного торможения.
Токсическое действие на многие микроорганизмы, в том числе и на дрожжи, оказывают галогены, формальдегиды, фенол, толуол, бензол и ряд других веществ. Таким образом, питательная среда должна содержать определенное количество углерода, азота, фосфора, витаминов, макро- и микроэлементов.
В биологических исследованиях перспективно использование математических методов планирования эксперимента, которые позволяют быстрее установить и научно обосновать оптимальный режим культивирования и состав среды.

