Биодеградация органических соединений, загрязняющих окружающую среду, оправдана только в том случае, если в результате происходит их полная минерализация, разрушение и детоксикация; если же биохимическая модификация этих соединений приводит к повышению их токсичности или увеличивает время нахождения в среде, она становится не только нецелесообразной, но даже вредной. Детоксикация загрязняющих среду веществ может быть достигнута путем всего одной модификации структуры. Судьба ксенобиотика зависит от ряда сложным образом взаимосвязанных факторов как внутреннего характера (устойчивость ксенобиотика к различным воздействиям, растворимость его в воде, размер и заряд молекулы, летучесть), так и внешнего (pH, фотоокисление, выветривание). Все эти факторы будут определять скорость и глубину его превращения. Скорость биодеградации ксенобиотика данным сообществом микроорганизмов зависит от его способности проникать в клетки, а также от структурного сходства этого синтетического продукта и природного соединения, который подвергается естественной биодеградации. В удалении ксенобиотиков из окружающей среды важную роль играют различные механизмы метаболизма.
В большинстве случаев при исследовании биодеградации использовался традиционный подход, основанный на выделении и анализе свойств чистых изолятов из окружающей среды. C другой стороны, из-за гетерогенности среды в ней формируются местообитания для множества разных микроорганизмов с самыми разнообразными метаболическими свойствами. Эти местообитания не могут не быть взаимосвязанными друг с другом. Ксенобиотики подвергаются действию смешанных популяций микроорганизмов, т. е. сообществ, для которых характерны отношения кооперации, комменсализма и взаимопомощи.
- 6.7.2. Участие микробных сообществ в биодеградации ксенобиотиков
Можно выделить стабильные сообщества, в которых взаимодействия между отдельными его членами дает им ряд преимуществ, в результате чего такая ассоциация становится более эффективной, чем отдельно взятые виды. Классификация микробных сообществ основана на характере взаимосвязей между отдельными видами.
1. Сообщества, в которых один или несколько членов не способны к синтезу тех или иных компонентов, необходимых для роста; этот дефицит покрывается за счет метаболической активности других членов сообщества. Сложность различных взаимоотношений в подобных сообществах может варьировать, но в любом случае взаимосвязи такого типа, по всей видимости, играют роль в деградации многих соединений. Например, сообщество из двух микроорганизмов, растущее на циклогексане, включает один из видов Nocardia, способный окислять циклогексан, но не способный к росту на нем одном, а также один из видов Pseudomonas, который поставляет другим видам необходимые для роста соединения, возможно биотин. Такие- взаимосвязи могут быть облигатными для роста определенных видов или поставлять дополнительные питательные вещества, способствующие росту первично окисляющего организма и увеличению скорости деградации. Это со всей очевидностью» показывает, что истинную скорость деградации ксенобиотикон- в окружающей среде можно оценить, только учитывая возможности микробных сообществ, а не отдельных видов микроорганизмов.
2. Сообщества, в которых метаболиты, в какой-то мере подавляющие рост организма-продуцента или других организмов- в том же местообитании, удаляются остальными членами сообщества.3. Сообщества, в которых параметры роста одного или нескольких его членов изменяются так, что получается более конкурентоспособное сообщество, устойчивое к изменениям4 среды. Такое сообщество может стать менее чувствительным к ингибированию субстратом и приобрести способность справляться с перегрузками, возникающими в очистных системах.
4. Крайне важная роль микробных сообществ в деградации ксенобиотиков состоит в том, что они способны осуществлять- совместную «метаболическую атаку» на субстрат. Отдельные члены такого сообщества в отличие от сообщества в целом не обладают метаболической активностью, необходимой для полной деградации данного соединения. Так, в лаборатории иногда не удается добиться минерализации какого-либо вещества, но происходит это потому, что деградацию тщетно пытаются7 осуществить с помощью одного вида микроорганизмов. Отмечалось также, что такого рода комбинированная метаболическая система может возникать в результате синтеза отдельными видами разных компонентов ферментного комплекса, с проявлением ферментативной активности только у целого сообщества (например, синтез активной лецитиназы двумя видами Pseudomonas).
5. Ранее подчеркивалась важность сопряженного метаболизма для расщепления ксенобиотиков. Микроорганизмы, растущие на одном субстрате, превращают другой в ходе одной или нескольких ферментативных реакций. Эти реакции не связаны с ростом микроорганизма в том смысле, что в них не образуются промежуточные продукты, которые данный организм использовал бы для роста. Однако эти промежуточные продукты могут служить источником углерода для других членов сообщества. Выделение или создание подобных сообществ для решения проблем загрязнений среды ксенобиотиками вполне реально, хотя о стабильности таких ассоциатов в условиях переработки отходов известно немного.
6. Были выявлены сообщества, в которых осуществляется передача восстановительных эквивалентов от одной популяции другой. В анаэробных условиях классическим ферментативным ^способом получения избытка восстановительных эквивалентов было восстановление конечных продуктов обмена. Однако в упомянутых сообществах используется второй, акцепторный организм. На сегодняшний день уже выделено немало таких сообществ. Анаэробное разрушение подобными сообществами ароматических соединений может иметь экономическое значение.
7. При изучении непрерывных культур были обнаружены сообщества, в которых к полному использованию лимитирующего рост субстрата способна не одна, а несколько первичных популяций, хотя можно было бы ожидать, что наиболее конкурентоспособный организм окажется доминирующим. Следовательно, -существующие в сообществе взаимодействия должны стабилизировать свободную конкуренцию между его членами.
В стабильных сообществах микроорганизмов создаются условия для свободного обмена генетической информацией меж- .ду популяциями. Важным эволюционным механизмом появления новых штаммов in vivo, способных взаимодействовать с новыми компонентами окружающей среды, может служить перенос плазмид между сообществами микроорганизмов (гл. 7). 'Частота таких событий для природных сообществ неизвестна, однако в условиях лаборатории они действительно происходят. Так, в одном из опытов в течение многих поколений выращивали смешанные непрерывные культуры разных видов Pseudomonas. Один из видов мог расти на хлоркатехолах, а другой обладал плазмидой TOL, несущей ген фермента бензолдиоксигеназы. На 4-хлорбензоате не мог расти ни один из штаммов, однако, использовав принцип обогащения, удалось выделить мутант, способный к росту на этой хлорсодержащей ароматической кислоте. По всей видимости, здесь произошел перенос плазмиды, в результате которого мутантный штамм приобрел •способность к окислительному декарбоксилированию 4-хлор- бензойной кислоты с помощью приобретенной диоксигеназы с широкой специфичностью, а следовательно, и способность к росту на образующемся хлоркатехоле.
В свете взаимодействий подобного рода, существенных для окружающей среды, мы рассмотрим еще несколько специфических примеров деградации ксенобиотиков. Потенциальная возможность использования микроорганизмов при биотехнологической переработке промышленных отходов обсуждается в разд. 6.6. Мы знаем, что в промышленных сточных водах содержатся стабильные побочные продукты реакций, часто известного состава. Вполне понятно, что технология контроля за ними хорошо разработана. Однако в окружающую среду могут- попадать и сложные смеси промышленных продуктов, например при разнообразных неспецифических выбросах на любом из этапов технологического процесса (утечки и т. п.). Деградация ксенобиотиков будет рассмотрена именно в этом контексте.
- 6.7.2. Хлорпроизводные углеводородов
C-I- и С-2-хлорпроизводные углеводородов широко используются в качестве растворителей и представляют собой важный фактор загрязнения окружающей среды. Тем не менее о микробной деградации этих соединений известно немного. Были выделены организмы, способные к использованию дихлорме- тана, однако механизм его деградации до конца не выяснен.. По-видимому, в результате первичного дегалогенирования, катализируемого какой-то галоидгидролазой, образуется хлорметанол, спонтанно разлагающийся до формальдегида.
Дегалогенирование галогензамещенных ароматических соединений происходит в основном после расщепления ароматических групп системы под действием диоксигеназ. Связь углерод—галоген становится лабильной после присоединения атома кислорода к углероду, связанному с галогеном, с образованием галогензамещенных катехолов. Относительно широкая специфичность ферментов начальных этапов катаболизма может обусловливать довольно быстрое превращение разных галогензамещенных ароматических соединений, хотя работа ферментов и осложняется стерическими и негативными индуктивными эффектами боковых групп-заместителей. Это пример участия обычных катаболических ферментов в первичной атаке на ксенобиотики. Галогензамещенные катехолы представляют собой ключевые метаболиты в деградации арилгалогенов. Они разрушаются путем орто-расщепления, поскольку ферменты мета- расщепления необратимо инактивируются веществами, образующимися в ходе реакции. Обычные пирокатехазы расщепляют- галоген-замещенные катехолы с относительно низкой эффективностью, поэтому основное значение в деградации этих соединений приобретает раскрытие кольца. На последующих этапах: метаболизма, включая циклоизомеризацию, происходит отщепление оставшихся замещающих групп кольца. На работе обычно применяемых очистных сооружений плохо сказываются перегрузки их отходами, содержащими хлорзамещенные ароматические соединения: путь лета-расщепления нарушается, а неэффективность орто-пути приводит к накоплению токсичных фенолов и темноокрашенных продуктов их самоокисления.
- 6.7.3. Другие замещенные простые ароматические соединения
При деградации арилгалогенов замещающие группы часто отщепляются на последних этапах катаболизма после разрушения ароматических колец системы. В случае сульфонированных ароматических соединений связь углерод — заместитель высо- кополярна и должна стать лабильной на первых же этапах, в противном случае всем последовательно работающим ферментам придется «иметь дело» с этой замещающей группой. Сульфонированные нафталины широко используются в качестве эмульгаторов и смачивающих агентов, а также при производстве азокрасителей; в обычных очистных сооружениях эти соединения не разлагаются микроорганизмами. Однако в непрерывной культуре одно из использующих нафталин микробных сообществ, выделенное из сточных вод, приобрело способность к расщеплению нафталинсульфоновых кислот. Первые этапы катаболизма включают диоксигенацию, удаление замещающей группировки и реароматизацию — ключевой этап, для которого необходима диоксигеназа с широкой специфичностью, способная к специфическому гидроксилированию по положению 1,2 кольца (рис. 6.19).
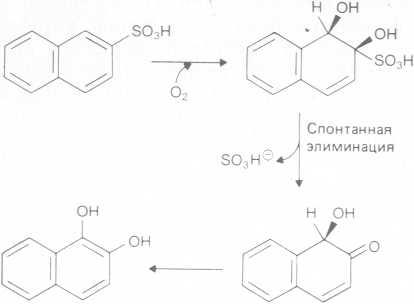
Рис. 6.19. Элиминация остатка сульфоновой кислоты из молекулы нафталинсульфоновой кислоты.
Нитротолуолы представляют собой токсичные компоненты сточных вод военных заводов, которые в природе быстро разрушаются. Однако они минерализуются не полностью, поскольку продукты их деградации (ароматические амины) конденсируются с карбоксильными группами биологических макромолекул, образуя полиамиды, которые, по-видимому, устойчивы к последующему действию микробов.
- 6.7.4. Полиароматические углеводороды
Полихлорбифенилы (ПХБ) — это очень устойчивые соединения, которые долго остаются в окружающей среде и прочно адсорбируются биологическими и осадочными материалами. В почвах они практически не мигрируют, а микроорганизмы не могут их глубоко деградировать. ПХБ в пробах из окружающей среды отличаются по составу от ПХБ, получаемых в промышленности, поскольку они модифицируются природными системами. Микробная деградация бифенила осуществляется при участии систем катаболизма, сходных с известными для других ароматических углеводородов. C увеличением степени хлорирования скорость метаболизма падает. Сообщалось, что смешанные культуры микроорганизмов осуществляют деградацию промышленных ПХБ до неохарактеризованных углеводородов, при этом расщепляются преимущественно молекулы с более низкой степенью хлорирования. Если замещающих группировок больше, чем в тетрахлор-ПХБ, то молекула становится полностью резистентной. В большинстве работ исследовали превращения чистых изомеров ПХБ.
Бензпирен представляет собой устойчивое полиароматиче- ское соединение, при деградации которого образуются канцерогенные гидрокси- и эпоксипроизводные. Он не минерализуется в системах активного ила, хотя было описано несколько культур микроорганизмов, способных частично метаболизировать этот продукт с помощью индуцибельных и неиндуцибель- ных гидроксилазных систем. При этом образуется сложная смесь конъюгированных производных.
Полистирол очень устойчив к биодеградации. Был описан процесс, в котором тонко измельченные автомобильные шины, изготовленные из стирол-бутадиеновой резины, частично разлагались микроорганизмами после добавления какого-либо поверхностно-активного вещества. Содержащиеся в шинах анти- озонаты, антиоксиданты и ускорители вулканизации замедляют этот процесс; конечный продукт можно использовать для улучшения почвы. Имеются сообщения о росте сообщества микроорганизмов на стироле, в результате чего удаляется ингибитор полимеризации 4-трег-бутилкатехол. В результате свободнорадикальной полимеризации стирола происходит осаждение полистирола. Впоследствии этот полимер исчезает, что свидетельствует о способности данного микробного сообщества к разрушению полистирола.
- 6.7.5. Биодеградация нефтяных загрязнений
Рассмотрим теперь процессы биодеградации сложных смесей углеводородов и их производных в средах, загрязненных нефтью. Речь пойдет как о сточных водах нефтяной промышленности, так и о загрязнении нефтью окружающей среды. Источники таких загрязнений могут быть самые разнообразные: промывка корабельных бункеров для горючего, аварии на танкерах в открытом море (основная причина нефтяных загрязнений окружающей среды), утечки в. нефтехранилищах и сброс отработанных нефтепродуктов.
Сточные воды нефтяной промышленности обычно очищают биологическим способом после удаления большей части нефти физическими способами или с помощью коагулянтов. Токсическое воздействие компонентов таких сточных вод на системы активного ила можно свести к минимуму путем постепенной «акклиматизации» очистной системы к повышенной скорости поступления стоков и последующего поддержания скорости потока и его состава на одном уровне. Однако загрузка этих систем может значительно варьировать и, видимо, лучше использовать более совершенные технологии, например системы с илом, аэрированным чистым кислородом, или же колонные биореакторы.
Самые большие утечки нефти в окружающую среду происходят в море, где она затем подвергается различным физическим превращениям, известным как выветривание. В ходе этих абиотических процессов, включающих растворение, испарение и фотоокисление, разлагается — в зависимости от качества нефти и от метеорологических условий — 25—40% нефти. На этой стадии разрушаются многие низкомолекулярные алканы.. Степень микробиологической деградации выветрившихся нефтяных разливов определяется рядом факторов. Весьма важен состав нефти: относительное содержание насыщенных, ароматических, содержащих азот, серу и кислород соединений, а также асфальтенов в различных типах нефти различно. Определенную устойчивость нефти придают разветвленные алканы, серусодержащие ароматические соединения и асфальтены. Кроме того, скорость роста бактерий, а следовательно, и скорость биодеградации определяются доступностью питательных веществ, в частности азота и фосфора. Оказалось, что добавление таких веществ увеличивает скорость биодеградации.
Количество разных организмов, способных расти на компонентах нефти, зависит от степени загрязненности углеводородами. Например, больше всего их находят поблизости от крупных портов или нефтяных платформ, где среда постоянно загрязнена нефтью. Полная деградация нефти зачастую не происходит даже при участии богатых по видовому составу микробных сообществ. Наиболее биологически инертные компоненты, например асфальтены, содержатся в осадочных породах и нефтяных залежах. Основные физические факторы, влияющие на •скорость разложения нефти, — это температура, концентрация кислорода, гидростатическое давление и степень дисперсности нефти. Наиболее эффективная биодеградация осуществляется тогда, когда нефть эмульгирована в воде.
Особую проблему представляют выбросы или случайные фазливы нефти на поверхности почвы, поскольку они могут привести к загрязнению почвенных вод и источников питьевой воды. В почве содержится очень много микроорганизмов, способных разрушать углеводороды. Однако даже их активность не всегда достаточна, если образуются растворимые производные или поверхностно-активные соединения, увеличивающие распространение остаточной нефти.
- '6.7.6. Пестициды
Слив отходов производства пестицидов сегодня строго контролируется; технология очистки сточных вод или их детоксикации хорошо разработана, хотя остается сложной и многообразной. Она включает сначала экстракцию пестицидов растворителями, а затем обычную биологическую обработку. Для ликвидации непредусмотренных выбросов, происходящих при утечках или при промывке и замене контейнеров с пестицидами, подходящая технология пока отсутствует. Пестициды попадают в окружающую среду и в результате использования их для обработки сельскохозяйственных культур. Большинство пестицидов расщепляются бактериями и грибами. Превращение исходного пестицида в менее сложные соединения нередко осуществляется при участии сообществ микроорганизмов. Были описаны различные стадии и промежуточные продукты процессов деградации ДДТ, идущей, например, в ходе сопряженного метаболизма и приводящей к полной минерализации этого стойкого пестицида. Часто из среды, содержащей ксенобиотик, Можно выделить сообщества такого рода, в которых он служит не основным источником углерода, а источником фосфора, серы или азота. Чрезвычайно высокая токсичность пестицидов зачастую утрачивается на первой же стадии их модификации. Это позволяет разработать относительно несложные микробиологические способы их детоксикации. Например, в результате гидролиза может значительно уменьшиться токсичность пестицида или увеличиться вероятность биодеградации. Для этого хорошо было бы использовать внеклеточные ферменты, способные функционировать в отсутствие коферментов или специфических факторов и осуществлять детоксикацию разнообразных пестицидов. Это могут быть такие гидролазы, как эстеразы, ациламидазы и фосфоэстеразы. Чтобы выбранный фермент можно было применять in situ, он должен обладать подходящей кинетикой в широком диапазоне температур и pH, быть нечувствительным к небольшим количествам растворителей или тяжелых металлов, не ингибироваться субстратом при концентрациях, характерных для содержимого очистных систем, а также хорошо храниться. В ряде случаев в качестве биологического агента детоксикации была испробована паратионгид- ролаза, выделенная из Pseudomonas sp. C ее помощью удалось удалить 94—98% остаточного паратиона (около 75 г) из контейнера с пестицидом за 16 ч при концентрации субстрата 1% (по весу). Забуференные растворы паратионгидролазы использовали также для детоксикации паратиона в разливах на почве, где его концентрация, по-видимому, была весьма высока. Скорость разложения паратиона в этом случае зависела от типа почвы, влажности, буферной емкости раствора и концентрации фермента. При этом значительные количества пестицида были обезврежены всего за 8 ч. Как показали лабораторные эксперименты, еще одна возможная сфера применения иммобилизованных ферментов — это очистка сточных вод. Были описаны гидролазы для детоксикации других пестицидов. Многие из них обладают широкой субстратной специфичностью, что открывает большие возможности для создания других простых систем детоксикации пестицидов. В будущем подобные системы смогут применяться при промывке промышленных химических установок и реакторов, ферменты в виде аэрозолей — для удаления пестицидов с поверхностей, а ферменты в сочетании с пестицидами — для быстрого разрушения пестицидов после их использования.
- 6.7.7. Биодеградация поверхностно-активных веществ
По чувствительности к биодеградации синтетические поверхностно-активные соединения, применяемые в быту и в промышленности как моющие средства, можно разделить на «жесткие» и «мягкие». Анионные соединения этой группы, такие как алкилбензолсульфонаты, в конце 50-х гг. привлекли к себе внимание тем, что они загрязняют окружающую среду: это проявлялось в образовании пены в водоемах. Сначала в продажу поступали «жесткие» детергенты, устойчивость которым придавали их разветвленные алкильные боковые цепи. Чтобы предотвратить их накопление в природе, промышленность добровольно перешла к производству подверженных биодеградации, линейных неразветвленных алкилбензолсульфонатов. Разрушение этих поверхностно-активных соединений начинается с окисления концевых метильных групп, после чего за счет р-окисления идет расщепление линейных боковых цепей. Кольцевые структуры молекул обычно разрушаются только после полной деградации боковой цепи. Данный процесс осуществляется только в аэробных условиях, поскольку для начального окислительного этапа требуется кислород. Разветвленные молекулы не всегда оказываются устойчивыми, хотя процесс их Р-окисления и затруднен. Механизм разрушения разветвленной цепи до конца не установлен. Связь углерод — сера является очень прочной, и это увеличивает биологическую инертность молекулы детергента. Реакции десульфирования детально не изучены, но скорее всего в них участвуют гидроксилазы или монооксигеназы. По-видимому, далее сульфонатный остаток превращается в сульфат, возможно, с образованием сульфита в качестве промежуточного продукта. Метаболизм арил- сульфонатов уже был рассмотрен нами в разд. 6.7.3. Есть основания считать, что десульфирование и лета-расщепление ароматического кольца детерминируются плазмидами.
Алкилсульфаты все еще используются как моющие средства на фабриках-прачечных и в косметической промышленности; основную их массу составляют первичные алкилсульфаты. Линейные сульфаты легко разрушаются, но этот процесс замедляется из-за наличия разветвленных участков. В первичной атаке этих молекул участвуют сульфатазы, образующие соответствующие спирты, которые подвергаются затем дальнейшему метаболизму. Для этого процесса кислород не нужен, и он может идти в анаэробных условиях. Необычность алкилсульфатаз по сравнению с сульфатазами вообще состоит в том, что они атакуют связь C-O в группах C—О—S. Первичные и вторичные алкилсульфаты индуцируют образование сложного комплекса сульфатаз.
Неионные детергенты применяются в быту; поскольку они облегчают смачивание и способствуют образованию эмульсий, их с успехом используют при производстве аэрозолей для сельского хозяйства и в косметической промышленности. Линейные первичные алкогольэтоксилаты минерализуются быстро и до конца, но более высокомолекулярные гомологи более устойчивы. Деградация осуществляется путем окисления концевых метильных групп и последующего окисления с образованием низкомолекулярных алканоатэтоксилатов, лишенных поверхностно-активных свойств. У вторичных алкогольэтоксилатов гидрофобная алкильная цепь разрушается с обоих концов за счет ω- и р-окисления. Имеющиеся в этих соединениях эфирные связи увеличивают их устойчивость к биодеградации. Были предложены возможные способы расщепления этих связей, в частности монооксигеназное расщепление, гидролиз, участие углерод: кислород—лиазы и окисление а-атома углерода эфирной связи с последующим гидролизом сложного эфира.
Имеющиеся в продаже детергенты редко содержат по весу более 30% поверхностно-активного соединения. К числу остальных компонентов относятся оптические отбеливатели, отбеливатели-окислители, вспомогательные пенообразователи, антикоррозийные добавки и (в ряде случаев) ферменты. Основную массу составляет носитель (наполнитель). Наполнители нужны для: 1) уменьшения концентрации свободного кальция и магния с целью предотвращения образования неорганических осадков; в противном случае выпадут в осадок соли щелочноземельных металлов и аниона детергента; 2) диспергирования агрегатов почвенных частиц и стабилизации почвенных суспензий.
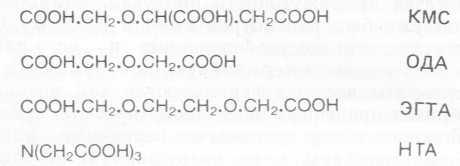
Рис. 6.20. Структура некоторых органических соединений, пригодных для повышения эффективности детергентов.
Наполнители должны иметь хорошую буферную емкость и не вступать в нежелательные реакции с другими компонентами смеси. В течение многих лет для этих целей использовали тринатрийфосфат, но он ускоряет зарастание внутренних водоемов. Процесс эвтрофикации водоемов может ускоряться в результате биодеградации и минерализации любого азотистого или фосфорного соединения. В поисках кандидатов на роль свободных от азота и фосфора наполнителей были выбраны синтетические карбоксиэфиры (КМС, карбоксиметилсукци- нат; ОДА, окисидиацетат; ЭГДА, этиленгликольдиацетат; рис. 6.20). Изучение метаболизма KMC и его аналогов позволило понять, каким путем микроорганизмы приобретают способность к деградации новых ксенобиотиков. Сам KMC быстро разрушается в природе; в начальной реакции участвует индуцибельная лиаза, расщепляющая молекулу KMC с образованием гликола- та и фумарата. Аналоги KMC оказались более стойкими, видимо, вследствие субстратной специфичности индуцируемых лиаз. Устойчивость этих аналогов не связана с процессом их поглощения клетками, поскольку было показано, что они поступают в них при участии конститутивной системы транспорта цитрата. КМС-лиаза оказалась удивительно сходной с по- лигалактуронатлиазой; организмы, развивающиеся на KMC1 так же хорошо растут на полигалактуронате. Это весьма показательный пример появления способности к деградации путем приобретения новой функции уже существующими ферментами. Возможно, что эта лиаза кодируется плазмидой. В качестве наполнителя широко использовался нитрилтриацетат (HTA), поскольку он подвержен быстрой биодеградации в системах активного ила и в речной воде.
ЛИТЕРАТУРА
Callely A. G., Forster С. F., Stafford D. A. (eds.), 1977. Treatment of Industrial Surfactants, pp. 283—327, Hodder aπs Stoughton, London.
Chater K. W. A., Somerwille M. J. (eds.), 1978. The Oil Industry and Microbial Ecosystems, Heyden and Son Ltd. (on behalf of the Institute of Petroleum), London.
Gibson D. T. (ed.), 1984. MicrobiaI Degradation of Organic Compounds, Microbiology Series, Vol. 13, Marcel Dekker, New York.
Higgins J. J., Burns R. G., 1975. The Chemistry and Microbiology of Pollution, Academic Press, London.
Leisinger T., Cook A. M., Hutter R., Nuesch J., 1981. MicrobiaI Degradation of Xenobiotics and Recalcitrant Compounds, FEMS Symp., 12, Academic Press (on behalf of the Federation of European Microbiological Societies), London.
Monlin G., Galzy P., 1984. Whey, a Potential Substrate for Biotechnology. In: Biotechnology and Engineering Reviews, Vol. I, (ed. Russel G. E.), pp. 347— 374, Intercept Ltd., Newcastle-upon-Tyne.
Stafford D. A., 1982. Biological Treatment of Organic Compounds and Solvents. In: Safe Use of Solvents (eds. Collings A. J., Luxton S. G.), pp. 293—304, Academic Press, London.
Stafford D. A., Etheridge S. P., 1982. Farm Wastes, Energy Production and the Economics of Farm Anaerobic Digesters. In: Anaerobic Digestion, pp. 255— 268, Elsevier Biomedical Press, Amsterdam.
Stafford D. A., Hawkes D. L., Horton R., 1980. Methane Production from Waste Organic Matter, CRC Press, Boca Raton, Florida.
Turner J., Stafford D. A., Hughes D. E., Clarkson J. (1983). The Reduction of Three Plant Pathogens (Fusarium, Corynebacterium and Globodera) in Anaerobic Digestion, Agric. Wastes, 6, 1—11.
Wheatley A. D., 1984. Biotechnology and Effluent Treatment. In: Biotechnology and Genetic Engineering Reviews, Vol. I (ed. Russel G. E.), pp. 261—310, Intercept Ltd., Newcastle-upon-Tyne.

