- 7.4.1. Технология
Для получения разнообразных белков эукариот и вирусов животных широко применяются бактерии и дрожжи Saccharo- myces Cerevisiae. При этом используются самые разные методы, но наиболее широко те из них, которые описаны ниже.
Прежде всего необходимо изолировать нужный ген. Если ген животного должен экспрессироваться в клетках бактерий или дрожжей, то обычно вначале выделяют соответствующую мРНК. Как правило, осуществить прямую экспрессию генов животных в бактериальных клетках не удается, поскольку эти гены содержат интроны. Интроны — это некодирующие участки гена; вся информация об аминокислотной последовательности белка содержится в других участках — экзонах. Зрелые молекулы мРНК клеток млекопитающих не содержат последовательностей, комплементарных интронам: они удаляются ферментами в процессе, называемом сплайсингом. Следовательно, такие молекулы можно транскрибировать с помощью ферментов ревертазы (обратной транскриптазы) и ДНК-полимеразы с образованием ДНК. Некоторые гены животных, например кодирующие а-лейкоцитарные интерфероны, не содержат интронов и могут прямо экспрессироваться в бактериальных или дрожжевых клетках. Если в качестве исходного объекта приходится использовать мРНК, то прежде всего следует найти ее источник — ткань, в которой этот продукт образуется в наибольшем количестве. Иногда таким источником служат опухолевые ткани или же клетки в культуре, образующие необходимую мРНК.
После транскрипции данной мРНК и получения комплементарной ДНК (кДНК) необходимо определить, какие из множества молекул этой кДНК содержат ген, подлежащий выделению и экспрессии. На этом этапе работы молекулы кДНК обычно вводят в состав плазмид или генома бактериофагов, которые служат векторами. Затем рекомбинантные плазмиды со встроенными молекулами кДНК переносят в клетки подходящих бактерий-хозяев.
Идентификация искомых клонов занимает иногда много- времени. Если же клонирование гена проведено, выявить сходные гены в банках кДНК относительно несложно, если применить метод Грюнштейна и Хогнесса. В этом случае колонии бактерий, содержащих рекомбинантные плазмиды, выращивают на нитроцеллюлозных фильтрах, помещенных на поверхность питательной среды. Затем бактериальные клетки разру шают, а высвободившуюся ДНК денатурируют. При этом она остается связанной с фильтром. Далее на фильтр наносят радиоактивный зонд — денатурированную ДНК или РНК, которая связывается с гомологичной или частично гомологичной бактериальной ДНК- Избыток радиоактивных молекул зонда, которые не связались специфически с гомологичной ДНК, удаляют промыванием и выявляют лизированные колонии, связавшие зонд, методом радиоавтографии. Бактерии, для которых наблюдалась положительная реакция в этом тесте, можно выделить из дубликата — реплики набора колоний.
Если специфический зонд отсутствует, то его можно синтезировать химическими методами, если известна полностью или частично аминокислотная последовательность белка — продукта интересующего нас гена. Конечно, определить точную нуклеотидную последовательность, исходя из аминокислотной последовательности, нельзя, поскольку каждая аминокислота может кодироваться разными триплетами (от 1 до 4). Однако, зная аминокислотную последовательность, можно синтезировать набор зондов и идентифицировать с их помощью плазмиды с частично гомологичными последовательностями.
Другие методы идентификации рекомбинантных плазмид основаны на экспрессии включенного в них гена. При этом идентифицируется белковый продукт, для чего используются иммунологические методы или методы определения его специфической активности. Для обнаружения антигенов в бактериях путем скрининга, на основе специфического их взаимодействия с антителами, часто используется метод, разработанный Брумом и Джилбертом. Для этого пластиковый диск покрывают слоем специфических радиоактивных антител и помещают его на предварительно лизированные колонии. Антигены из лизированных бактерий связываются с антителами на диске. Положение антигенов, адсорбированных на диске, определяют с помощью радиоавтографии.
Включение ДНК в плазмидные и фаговые векторы
Обычно выбор вектора определяется штаммом хозяина, который используется для экспрессии клонированной ДНК. Если в роли хозяина выступает E. coli, плазмидный вектор скорее всего представляет собой производное pBR322, а если хозяином является Bacillus spp., то векторные плазмиды получают из различных видов Bacillus или Staphylococcus. Вектор для Saccharomyces Cerevisiae конструируют либо на основе плазмиды длиной 2 мкм, либо из фрагментов хромосомы дрожжей, способных реплицироваться подобно плазмидам. Нередко используются челночные векторы, которые могут реплицироваться в одном или нескольких организмах- хозяевах. Применение таких векторов оказывается весьма перспективным в связи с тем, что нередко для наработки большого количества плазмид и для трансформации ДНК удобнее в роли хозяина использовать- E. coli. Строение плазмиды pBR322 показано на рис. 7.3.
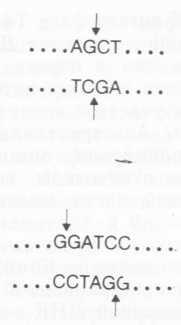
Рис. 7.6. Нуклеотидные последовательности, узнаваемые и расщепляемые эн донуклеазами рестрикции AluI (вверху) и BamIII (внизу).
Она несет гены устойчивости к тетрациклину и ампициллину. На карте указаны места расщепления этой молекулы эндонуклеазами рестрикции (рестриктазами).Испо льзуемые при клонировании рестриктазы выделяют из различных прокариот. Всего было получено более ста пятидесяти их разновидностей. Они отличаются друг от друга тем, что узнают и расщепляют разные нуклеотидные последовательности. Сайты узнавания для большинства ферментов, используемых в генетической инженерии, представляют собой палиндромы из 4, 5 или 6 нуклеотидов. Расщепление происходит с образованием либо «тупых» (как в случае AluI), либо липких (способных к комплементарному связыванию) концов (как в случае BamHI; см. рис. 7.6). Неспаренные нуклеотиды липкого конца оканчиваются З'-гидроксильной или 5'-монофосфатной группировкой в зависимости от фермента.
Обычный метод клонирования ДНК основан на расщеплении плазмидной и встраиваемой ДНК одной и той же рестриктазой. При этом получаются молекулы с липкими концами, которые затем отжигают, получают кольцевую рекомбинантную молекулу и сшивают ДНК-лигазой фага Т4. В случае плазмиды pBR322 встраивание обычно осуществляют по генам устойчивости к антибиотикам, поскольку такие рекомбинантные молекулы легко распознать по их неспособности обеспечить устойчивость.
ДНК-лигазу фага Т4 можно применять и для сшивания «тупых» концов молекул ДНК, хотя этот процесс осуществляется труднее, чем в случае липких концов. Липкие концы можно превратить в тупые путем отщепления одноцепочечных выступающих участков специфичными только к таким участкам нуклеазами. Альтернативный способ основан на использовании ДНК-полимеразы: она присоединяет к короткой цепи недостающие нуклеотиды, комплементарные 5'-одноцепочечной выступающей части молекулы. Лигаза применяется также для встраивания в плазмиды синтезированных фрагментов ДНК с целью получения на стыке ДНК-вставки и вектора нужной последовательности. Комплементарные одноцепочечные концы у вектора и встраиваемой ДНК могут быть образованы при помощи концевой ДНК—нуклеотидилтрансферазы: она присоединяет нуклеотиды к З'-концам молекул ДНК- C ее помощью к З'-концам вектора могут быть добавлены «хвосты» из нескольких остатков дезоксигуаниловой кислоты [oligo(dG)]1 а к концам встраиваемой молекулы — комплементарная последовательность oligo (dC). Смысл этой процедуры состоит в том, что .повторное лигирование вектора становится невозможным.
Трансформация
Полученные in vitro рекомбинантные плазмиды необходимо перенести в подходящую клетку-хозяина, природа которой и определяет особенности способа трансформации. Так, клетки Е. coli становятся компетентными (т. е. способными захватывать очищенную ДНК) после обработки их на холоду CaCR, а клетки Bacillus subtilis приобретают компетентность на определенной фазе клеточного цикла при их разовом культивировании в условиях дефицита питательных веществ. Многие другие бактерии, включая виды Streptomyces, можно трансформировать только в форме протопластов, когда удалены клеточные стенки. Для облегчения проникновения ДНК в дрожжевые клетки после обработки их CaCK или ПЭГ из этих клеток также часто получают протопласты. Интактные дрожжевые клетки становятся компетентными после обработки ионами щелочных металлов, например Li+.
- 7.4.2. Экспрессия клонированных генов
Цель многих опытов по клонированию состоит в наработке в большом количестве какого-либо белка эукариот. Именно для этого и встраивают гены эукариот в плазмиды бактерий. Чтобы достичь высокого уровня экспрессии гена, эукариотическую ДНК нужно встроить вблизи от активного промотора транскрипции; образующаяся мРНК при этом должна эффективно транслироваться. Промоторы, использующиеся для обеспечения активной экспрессии, обычно не принадлежат к числу изначально присутствующих в плазмидах. Как правило, это бывают промоторы фаговых или хромосомных генов, включаемые в плазмидные векторы. Типичным примером такого рода служит промотор Pl бактериофага λ. ДНК с таким промотором эффективно транскрибируется, и образуется большое количество мРНК- Контроль за работой Pl осуществляется белком-репрессором, продуктом гена Ci этого бактериофага. Ген Cι857 кодирует температурочувствительный белок-репрессор, который активен при 30 0C, но не работает при 420C. Если внести этот ген в составе плазмиды или фага в ту же клетку, что и промотор Pl, то экспрессию клонированных генов, контролируемую Pl, можно регулировать, изменяя температуру.
У дрожжей Saccharomyces cereυisiae векторы с высоким уровнем экспрессии конструируют на основе промоторов генов, которые кодируют важнейшие клеточные белки (например, алкогольдегидрогеназу и фосфоглицераткиназу). Так, с помощью промотора алкогольдегидрогеназы Cl удалось добиться прямой транскрипции в дрожжах гена инсулина человека, а в опытах с использованием промотора фосфоглицераткиназы получен высокий уровень экспрессии генов интерферонов.
C помощью бактерий были получены с высоким выходом некоторые белки — продукты генов животных и их вирусов. Так, были созданы штаммы E. coll, у которых 20% всего клеточного белка составляли коровый антиген вируса гепатита В, гормон роста человека или главный капсидный антиген вируса ящура. У одного из сконструированных штаммов В. SUbtilis последний составлял около 1 % синтезируемого этой бактерией белка. Однако добиться экспрессии в бактериальных клетках генов некоторых белков животных или их вирусов совсем непросто, даже если эти гены сопряжены с сигналами инициации транскрипции и трансляции, которые обеспечивают в норме высокий уровень экспрессии генов прокариот. Причины такой неэффективной экспрессии не всегда ясны, но в некоторых случаях удалось установить, что протеазы бактерий быстро разрушают белки животных и вирусов. В подобных ситуациях можно повысить выход, применяя несодержащие протеаз мутанты. При выработке проинсулина, предшественника инсулина, некоторая защита от протеаз обеспечивается тем, что полипептид секретируется в периплазматическое пространство у клеточной стенки E. coll. На N-конце молекулы препроинсулина находится последовательность гидрофобных аминокислот, с помощью которой (с одновременным ее отщеплением) осуществ ляется транспорт этой молекулы через мембрану в периплаз- матическое пространство. Время полужизни проинсулина в жлетке 2 мин, а в периплазматическом пространстве 20 мин.
Другой способ получения чувствительных к протеазам белков основан на выделении их бактериями Bacillus в окружающую среду. Эти бациллы в отличие от E. coll способны экскретировать некоторые белки. Так, получены штаммы Bacillus, осуществляющие экскрецию проинсулина. Выделенный в среду •белок обычно проще очищать, чем внутриклеточный. Помимо этого, использование штаммов Bacillus имеет то преимущество, что они не образуют эндотоксинов. Выяснилось, однако, что -клетки Bacillus эффективно экскретируют, видимо, лишь некоторые типы полипептидов. В опытах с дрожжами проблема секреции была решена путем создания векторов, содержащих сигнальные последовательности генов a-фактора гормона спаривания или токсина-«убийцы».
- 7.4.3. Прикладные аспекты генетической инженерии
Не вызывает сомнения, что методы генетической инженерии будут играть ведущую роль в развитии биотехнологии и найдут в ней самое широкое применение. Уже сегодня с помощью бактерий и дрожжей мы получаем в больших количествах белки эукариот и вирусов, которые применяются в медицине и ветеринарии. В табл. 7.1 перечислены некоторые белки, для синтеза которых используется этот подход.
Таблица 7.1. Белки эукариот и вирусов, получаемые методом клонирования генов в микроорганизмах
Инсулин человека a-, β- и γ-инτepфepoны
Коровый антиген вируса гепатита В
Поверхностный антиген вируса гепатита В
Гормон роста человека
Капсидный белок вируса ящура
Реннин теленка
Образование больших количеств ненужного бактериальной клетке белка ставит ее в неблагоприятное положение при отборе, так что приходится решать сложные проблемы стабилизации таких штаммов. Их удается решить — по крайней мере в случае выработки очень ценных продуктов — путем создания жестких условий отбора, направленных на сохранение плазмидного вектора, а иногда и клонируемого в нем гена. Использование индуцибельных промоторов типа ZPl препятствует постоянному синтезу продукта, и он образуется лишь в результате индукции в определенное время клеточного цикла.
Проблема стабилизации не возникает, если вместе с клонируемым геном клетка-хозяин получает определенные преимущества при отборе. Так, методы генетической инженерии позволяют расширить спектр используемых микроорганизмом субстратов. Пивоварение, например, заинтересовано в создании штаммов дрожжей, способных к секреции ферментов, разрушающих крахмал и белки. Появление у организма ряда новых ферментативных активностей может увеличить эффективность его обмена веществ. Так, фирме ICI удалось повысить эффективность усвоения азота клетками Methylophilus methylotrop- hus, продуцента БОО, введя в них ген фермента глутаматдегидрогеназы E. coll (рис. 7.7). Это позволило увеличить выход БОО примерно на 7% при росте бактерий на метаноле и аммиаке. Сегодня мы можем уже конструировать искусственные линейные хромосомы дрожжей Saccharomyces Cerevisiae, что в принципе позволяет осуществлять стабильную модификацию клеток путем формирования в них новых путей метаболизма.
Введение чужеродного гена в клетки организма-продуцента — это отнюдь не единственный генно-инженерный способ конструирования новых штаммов. Иногда оказывается полезным клонирование собственных генов организма. Так, если известно, что определенная ферментативная реакция лимитирует скорость какого-то метаболитического процесса, то введение многих копий соответствующего гена в рекомбинантные плазмиды может ликвидировать это «узкое место» благодаря образованию большего числа молекул фермента. Главной областью применения «самоклонирования», видимо, может стать направленный мутагенез. При обычном методе получения новых штаммов с помощью мутагенеза и отбора действию мутагена подвергается весь геном организма-продуцента. При этом, естественно, не гарантируется, что полезные мутации произойдут именно в интересующих нас генах. Мутируют также и другие гены, и некоторые из таких мутаций неблагоприятно повлияют на жизнеспособность организма-продуцента. Если же провести клонирование нужных генов, то их обработку мутагеном можно провести in vitro, а затем вернуть эти гены в организм. Это гарантирует получение только желаемых мутаций.
Основой развития фармацевтической промышленности до недавнего времени был скрининг микроорганизмов и синтетических химических веществ. Появление новейших методов химического синтеза генов, возможно, позволит пойти другим путем: конструирования случайных нуклеотидных последовательностей, их клонирования и оценки биологической активности соответствующих белков и пептидов. Хотя занятие это можно уподобить написанию сонета Шекспира группой печатающихна машинке обезьян, случайная крупная находка поможет убедиться, что и такой стратегией поиска не следует пренебрегать.
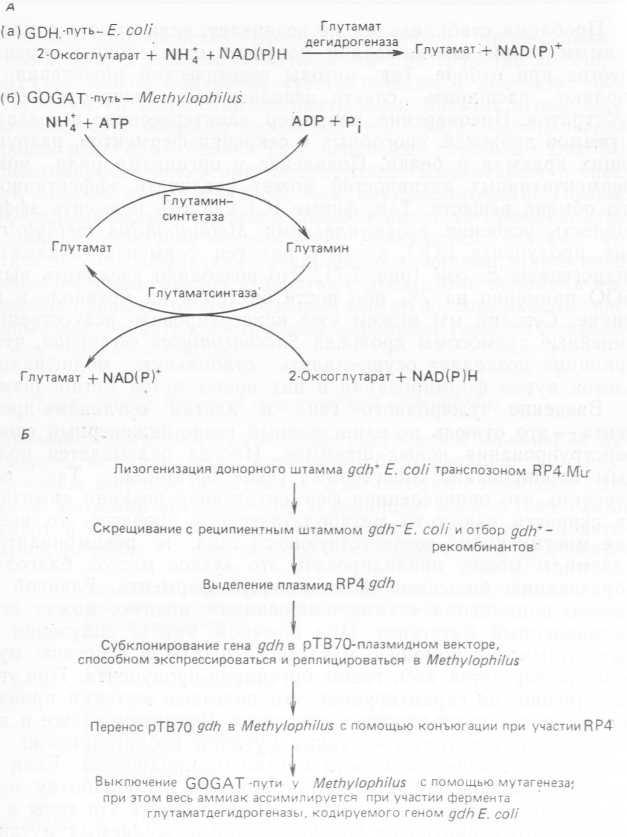
Рис. 7.7. Увеличение эффективности ассимиляции азота бактериями Methylophilus methyIotrophus, используемыми для получения БОО. А. Пути ассимиляции аммиака у бактерий. Путь (а) эффективнее, чем (б), так как в нем не потребляется ATP. Б. Клонирование гена gdh Е. coll (гена глутаматдегидрогеназы) и его введение в Methylophilus.

