- 9.8.1. Вегетативное размножение
Изменчивость высших растений определяется в основном перераспределением генов при половом размножении. Хотя такая изменчивость и важна с эволюционной точки зрения, она служит помехой при разведении сортов растений с желаемым набором признаков. К счастью, не все цветковые растения размножаются только половым путем. У многих из них образуются особые органы вегетативного размножения, например видоизмененные стебли— известные всем усы земляники и клубни картофеля. Многие растения обладают ценной особенностью: они способны к полной регенерации из небольшого отрезка стебля, черенка. Эта особенность широко используется для разведения растений с ценными сортовыми признаками. Только таким способом можно разводить растения, неспособные давать потомство половым путем. Некоторые растения полностью регенерируют из целых листьев (многие суккуленты) или их частей (например, бегонии).
Полноценное растение может развиться и из каллусной ткани, выращенной из меристемы in vitro. Этот метод позволил получить безвирусные сорта картофеля. Вот уже несколько лет метод культуры тканей используется для выведения оздоровленных и устойчивых к болезням растений, для создания сортов с определенным генотипом, а также для сохранения и разведения сортов ценных растений.
Сегодня мы знаем, что многие изолированные клетки, если их культивировать в соответствующих условиях, могут регенерировать в целое растение. Клетка, обладающая такой способностью к росту и формированию ткани, из которой затем развивается полноценное растение, называется тотипотентной. В середине 60-х гг. тотипотентность клеток была обнаружена у многих видов растений.
Из тотипотентных клеток легко получить лишенные клеточной стенки протопласты. Разработаны методы их культивирования для получения каллусной ткани и затем — небольших растеньиц, которых можно размножать обычными способами.
Протопласты получены из тканей большинства органов растений, в том числе из корней, листьев, лепестков, плодов, коле- оптил, запасающих органов, тетрад микроспор (из пыльников), корневых клубеньков бобовых и каллусных тканей. Чаще всего для этого берут мезофильную ткань листа: из нее образуется много единообразных протопластов. Нередко из протопластов получают каллусные культуры, из которых можно регенерировать целое растение. К сожалению, до последнего времени не удавалось вырастить целые растения из изолированных протопластов бобовых и злаков — двух важнейших групп культивируемых растений. Нередко в относительно простых условиях выращивания и с высоким выходом была осуществлена регенерация в целое растение протопластов Medicago satiυa (люцерна, альфальфа). Это позволяет надеяться, что подобрав соответствующие условия, удастся регенерировать из протопластов и бобовые. Сегодня мы еще не умеем регенерировать растения из протопластов хлебных злаков и пищевых бобовых, но в 1980 г. Вернике и Бреттел (Werniche, Brettell, 1980) добились образования каллуса и регенерации растений из листьев злаков, так что можно ожидать, что и в случае протопластов злаков будет достигнут прогресс.
Особая ценность протопластов для селекции растений определяется целым рядом их свойств. Во-первых, протопласты можно получать в большом количестве и отбирать из них разновидности с полезными свойствами. Хотя сами протопласты генетически единообразны, формирующиеся из них каллусы дают растения, существенно различающиеся по внешним признакам. Во-вторых, отсутствие клеточной стенки облегчает слияние- протопластов и образование гибридов. Поскольку при этом сливаются соматические, как минимум диплоидные, клетки, селекционер растений получает в свои руки мощный инструмент для отбора. В-третьих, в отсутствие клеточной стенки облегчается захват чужеродной ДНК—фрагментов молекул или же бактериальных плазмид, в результате чего формируются растения с совершенно новым набором признаков.
Изменчивость
Хотя растения, полученные в результате размножения вегетативным путем (клоны), обычно похожи на родительское растение, из этого вовсе не следует, что все эти клоны генетически одинаковы. Иногда возникают клоны, которые существенно отличаются от исходной формы. Их называют соматическими вариантами или «спортами», и появляются они в результате генетических изменений в клетках меристемы, которые дают начало всему новому растению или его части. В ряде случаев такие спорты были размножены и привели к созданию новых сортов. Примером могут быть апельсины «Навель» и персики-нектарины. В основе соматической изменчивости лежит ряд генетических механизмов: изменение числа хромосом в ядре, мутация отдельных генов, модификация внеядерных генов клеточных органелл (хлоропластов и митохондрий). Хотя изменчивость растений картофеля, полученных из протопластов, обычно невелика, для протоклонов тетраплоидного сорта Russet Burbank она оказалась существенной. Изучение изменчивости у регенерированных растений картофеля сорта Maris Bard показало, что она возникает при росте каллусов из генетически единообразных протопластов и не является следствием экспериментов с самими протопластами.
Изменчивость протоклонов, наблюдающаяся в отсутствие мутагенов, весьма важна для растениеводства: благодаря ей селекционер растений получает богатый исходный материал. Так, среди регенерантов картофеля были выявлены растения с потенциально полезными признаками: низкорослые, с измененными клубнями и с разными сроками созревания.
- 9.8.2. Регенерация растений из протопластов
Шеферд и Тоттен (Shephard, Totten, 1977 г.) в опытах с картофелем, у которого регенерация растений из культуры тканей затруднена, разработали метод, позволяющий достаточно успешно регенерировать растения из протопластов. Их способ был несколько необычным, поскольку предусматривал особые условия выращивания растений, из которых потом получали протопласты. Кроме того, на каждой стадии развития растений-регенерантов они применяли особую среду.
Выращивание растений для опытов
Растения картофеля (американский сорт Russet Burbank) выращивали из клубней, свободных от Х-вируса, при высокой освещенности (продолжительность светового дня 12 ч), при 24 0C и относительной влажности 70—75%. Перед началом опыта растения выдерживали 4—10 сут при той же температуре и влажности, но более слабом (7000 люкс) и менее продолжительном освещении (6 ч в сутки). Содержание растений в условиях слабого и непродолжительного освещения приводило к существенному увеличению выхода жизнеспособных протопластов из тканей листьев (до 2—3∙ IO6 на 1 г ткани).
Среды для выделения и размножения
При выделении и размножении протопластов применяли среды пяти типов (А —Е), которые представляли собой варианты среды, предложенной Лэмом (Lam, 1975). В их состав входили основные питательные вещества растений, микроэлементы, аминокислоты, факторы роста, фитогормоны и регуляторы осмотического давления. Содержание веществ подбиралось так, чтобы обеспечить оптимальный рост на каждом этапе регенерации. Все среды содержали 1,5—2,0% агара, кроме полужидкой среды А, где его концентрация составляла только 0,5%. Среды DhE, использованные на заключительном этапе, содержали 1650 мг/л NH4NO3.
Выделение протопластов
4 г ткани, вырезанной из стерилизованных с поверхности молодых листьев, инкубировали в 200 мл среды А (без сахарозы и агара) в темноте при 4 °C в течение 16—24 ч. Затем среду заменяли на 100 мл забуференного (pH 5,6) раствора с ферментами, чтобы отделить мезофильные клетки и удалить их клеточные оболочки. При встряхивании смеси процесс заканчивался за 4 ч при 28 0C. Жизнеспособные протопласты после процеживания смеси собирали центрифугированием, промывали средой А, снова осаждали и хранили в жидкой среде А при концентрации 6∙ IO5 клетка/мл.
Рост каллуса
При инкубации протопластов на твердой среде В или на модифицированной твердой среде происходит регенерация клеточных стенок и ограниченное деление клеток, в результате чего образуются микрокаллусы. После переноса в среду C они растут далее до стадии, когда становится возможным перенос в среду D, где индуцируется образование (морфогенез) побегов. На заключительной стадии каллусы с побегами длиной около 1 мм переносят на среду E для завершения образования побегов и формирования корней. Укорененные растения пересаживают в небольшие горшочки с вермикулитом, где они и растут далее.
Здесь изложена суть метода, который следует использовать для регенерации целых растений из одиночных протопластов, и проиллюстрировано, как экспериментатору приходится варьировать условия на разных стадиях развития, чтобы добиться успеха. На рис. 9.7—9.10 показано, как выглядят свежевыделенные протопласты, молодые каллусы и крошечные растения, регенерированные из ткани каллуса. Особенно важно в этой работе строго выдерживать надлежащие условия, однако почти наверняка их придется специально подбирать для каждого изучаемого вида растений.
Томасу (Thomas, 1981) удалось получить культуры побегов тетраплоидного картофеля сорта Maris Bard1 которые использовались как исходный материал для выделения протопластов.
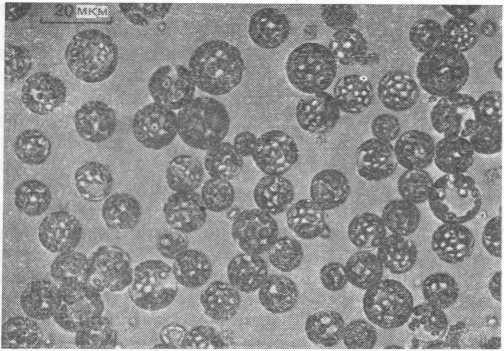
Рис. 9.7. Свежевыделенные протопласты Solanum breυidens.
Пазушные почки стерилизовали с поверхности раствором гипохлорида натрия и культивировали затем на среде Мурасиге и Скуга (Murashige, Skoog, 1962), содержащей, кроме того, сахарозу (30 г/л), агар (6 г/л) и 6-бензиламинопурин (6-БАП, 0,5 мг/л), pH 5,8. В ходе инкубации при 26 oC при освещенности ~400 люкс (16 ч днем, 8 ч ночью) за 3—5 нед образовывались ростки длиной около 3 см. Их можно было использовать для дальнейшего размножения на той же среде, но без 6-БАП, для чего брали короткие (3—8 мм) отрезки стебля с листом и пазушной почкой. Рост продолжался три недели, после чего побеги можно было опять использовать для размножения или же выделения протопластов. Цельные проростки (но не взятые отдельно листья) давали жизнеспособные протопласты, которые могли длительное время делиться в культуре.
- 9.8.3. Методы слияния протопластов
Хотя о возможности слияния протопластов растений было известно уже давно, метод контролируемого слияния с воспроизводимыми результатами был разработан лишь в 1970 г. (Power et al., 1970). Тем самым был сделан первый шаг к соматической гибридизации растений. При суспендировании протопластов в 0,25 M растворе азотнокислого натрия слияние происходило очень быстро. Впоследствии для индукции слияния протопластов Parthenocissus tricuspidata и Petunia hybrida использовали 10,2%-ный раствор сахарозы, содержащий 5,5% азотнокислого натрия. Для той же цели применяли хлористый кальций.
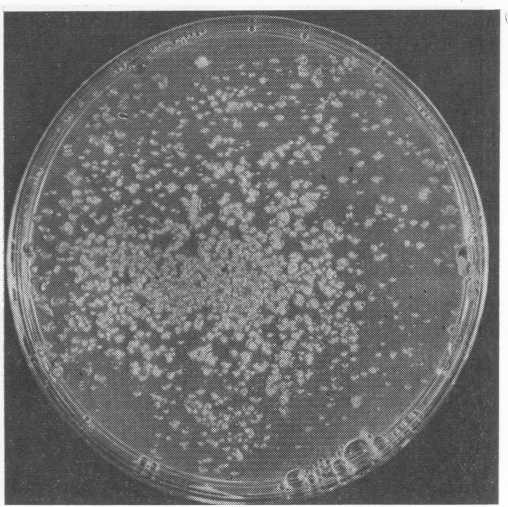
Рис. 9.8. Каллусы, образовавшиеся из протопластов Solanum brevidens на агаре. Снимок сделан примерно через месяц после получения протопластов. Для выращивания использована чашка Петри диаметром 9 см.
Было показано (Као, Michayluk, 1974), что полиэтиленгликоль с большой молекулярной массой также вызывает неспецифическое слипание, а затем и слияние протопластов растений. При инкубации в самом полиэтиленгликоле слияний почти не происходило, но при его разведении гибриды образовывали до 10% протопластов. ПЭГ способствовал также захвату хлоропластов водоросли Vaucheria dichotoma протопластами моркови. Методы слияния протопластов подробно описаны в руководстве Пауэра и Дэйви (Power, Davey, 1979).
Получение соматических гибридов
Для осуществления гибридизации соматических клеток методом слияния протопластов необходимо выполнить следующие операции: 1) выделить протопласты; 2) осуществить слияние; 3) регенерировать клеточные стенки; 4) осуществить слияние ядер так, чтобы получить полноценное гибридное ядро; 5) размножить гибридные клетки; 6) регенерировать целое растение.
Осуществить слияние протопластов растений, вообще говоря, несложно, но из этого не следует, что столь же просто размножить гибридные клетки или же регенерировать гибридное растение. Прежде всего нужно отобрать гибридные протопласты, которые составляют лишь малую часть всех клеток, а затем создать им условия для развития. Примером работы такого рода может быть эксперимент по соматической гибридизации Petunia hybrida и Petunia parodii. Здесь отбор был основан на различиях в способности к росту протопластов из листьев этих двух видов растений. Дело в том, что протопласты Petunia parodii в использованной в этом опыте среде могли формировать лишь микрокаллусы, состоящие не более чем из пятидесяти клеток, в то время как из протопластов Petunia hybrida можно получать растущие каллусы. Было использовано также и то обстоятельство, что протопласты Petunia hybrida более чувствительны к актиномицину D, чем протопласты Petunia parodii.
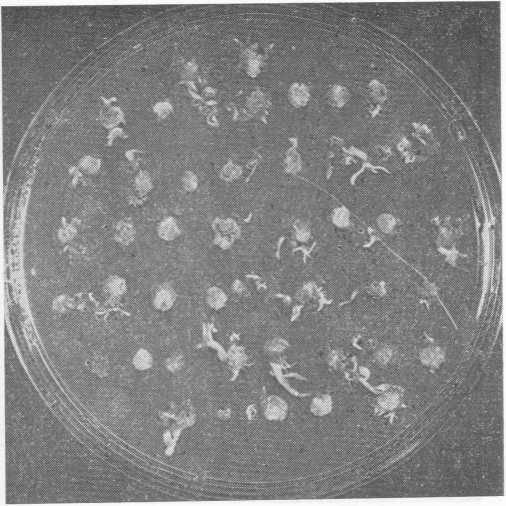
Рис. 9.9. Регенерация мини-растений Solanutn tuberosum из каллусной ткани, полученной из протопластов (снимок сделан примерно через 100 сут после перенесения на агаровую среду, способствующую регенерации).
Гетерокарион, образующийся в результате слияния двух разных протопластов, может после слияния ядер превратиться в гибридную клетку. Имеется в виду, что происходит объединение всех несущих гены, самореплицирующихся органелл обоих протопластов, в то время как при обычном половом скрещивании от каждой родительской клетки поступает по ядру, несущему хромосомные гены (кариомы), но гены, передаваемые с пластидами (пластидомы) и митохондриями (хондриомы), передаются обычно лишь от женской клетки. Таким образом, методы на основе слияния протопластов позволяют получать комбинации двух полных родительских геномов. Слияние протопластов двух скрещивающихся половым путем видов нередко приводит к образованию стабильных амфиплоидных гибридных клеток, из которых могут быть регенерированы растения — соматические гибриды. Надо сказать, что метод слияния протопластов пригоден для работы не только со столь близкими видами или гибридными клетками.
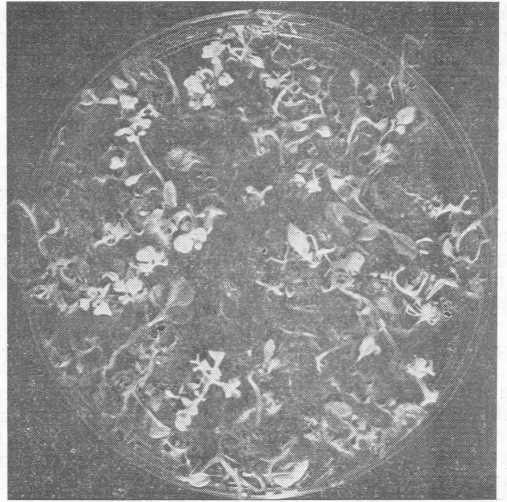
Рис. 9.10. Регенерация мини-растений Solanum brevidens из каллусной ткани, полученной из протопластов (снимок сделан приблизительно через 100 сут после перенесения на агаровую среду, способствующую регенерации).
Томас и др. (Thomas et al., 1979) перечисляет ряд работ, в которых была осуществлена регенерация в экспериментах по слиянию протопластов растений, принадлежащих к одному и тому же (7 случаев) и разным (14 случаев) видам. В четырех экспериментах по межвидовому слиянию были получены линии клеток, а в четырех других — осуществлен захват клеточных органелл протопластами. В двух опытах в протопласты растений была введена чужеродная ДНК, которая экспрессировалась, а в трех из протоклонов были получены мутантные растения. Способы применения метода слияния протопластов весьма многообразны.
Возможность образования соматических гибридов создает предпосылки для изменений внеядерного генного компонента гибридных клеток. Для этого, например, можно использовать протопласты-альбиносы, в которых нет хлоропластных генов, или же протопласты, у которых во время слияния проводится инактивация ядерного генома одного из родителей. Донорами цитоплазматических генов, вводимых путем слияния в полноценные протопласты, могут быть безъядерные субпротопласты или микропласты.
Захват протопластами микроорганизмов и ДНК
Дэйви и Пауэр (Davey, Power, 1975) обнаружили, что ПЭГ способствует захвату клеток и протопластов дрожжей и клеток сине-зеленых водорослей протопластами Parthenocissus tricusρi- data. При этом микроорганизмы локализуются в ограниченных мембранами пузырьках (везикулах) цитоплазмы протопластов. Значительный интерес представляет возможность введения в протопласты интактных микроорганизмов с полезными свойствами, например таких, которые способны фиксировать азот. Другой вариант —это введение в высшие растения генетического материала микробов с последующей его экспрессией. В принципе методы слияния протопластов вполне могут использоваться для этой цели, но пока успехи и в этой области весьма скромны (Thomas et al., 1979).
При введении в протопласты нового генетического материала в виде чистой ДНК последняя не всегда сохраняется и экспрессируется в хозяйских клетках. Весьма перспективным представляется использование в качестве векторов Ti-плазмид Agrobacterium tumefaciens (раздел 9.5.3), так как они непосредственно включаются в ДНК хозяина и легко экспрессируются при образовании опухолей. Ti-плазмиды, содержащие или не содержащие чужеродной ДНК, могут вызвать трансформацию протопластов растений. По-видимому, такие исследования будут проводиться все более интенсивно.
ЛИТЕРАТУРА
Alien М. F., Moore Т. S. jun., Christensen М. (1980). Phytohormone changes in Bouteloua gracilis infected by vesicular-arbuscular mycorrizae. I. Cytokinin increases in the host plant, Canad. J. Bot., 58, 371—374.
Aviv D, Fluhr R., Edelman M., Galun Е. (1980). Progeny analysis of the interspecific hybrids: Nicotiana tabacum (CMS) + Nicotiana sylυestris with respect to nuclear and chloroplast markers, Theor. appl. Genet., 56, 145—150.
Backman P. A., Rodriguez-Kabana R. (1975). A system for the growth and delivery of biological control agents to the soil, Phytopathology, 65, 819—821.
Beringer J. E, 1982. Microbial genetics and biological nitrogen fixation. In: Advances in Agricultural Microbiology (ed. Subba Rao N. S.), pp. 2—23, Oxford and IBM Publishing Co., New Delhi.
Bilkey P. C, Cocking E. C. (1980). Isolation and properties of plant microplasts: newly identified Subcellular units capable of wall synthesis and division into separate microcells, Eur. J. Cell Biol., 22, 502.
Bonnett H. T, Eriksson T. (1974). Transfer of algal chloroplasts of higher plants, Planta, 120, 71—79.
Brown M. E, 1982. Nitrogen fixation by free-living bacteria associated with, plants —fact or fiction? In: Bacteria and Plants (eds. Rhodes-Roberts M. E. and Skinner F. A.), pp. 25—41, Academic Press, London.
Burton I. C. (1980). New developments in inoculating Iegumens. In: Recent Advances in Biological Nitrogen Fixation (ed. Subba Rao N. S.), pp. 380— 405, Edward Arnold, London.
Burton J. C, Curley R. L. (1965). Comparative efficiency of liquid and peatbase inoculants of field-grown soybeans (Glycine max'), Agron. J., 57, 379— 381.
Carr J. G. (1982). The production of foods and beverages from plant materials by micro-organisms. In: Bacteria and Plants (ed. Rhodes-Roberts M. E. and Skinner F. A.), pp. 155—-167, Academic Press, London.
Cocking E. C. (1981). Opportunities from the use of protoplasts, Phil. Trans. Roy. Soc. Lond., B292, 557—568.
Coombs J. (1981). Biogas and power alcohol, Chemy Ind. 4 April, 223—229.
Cooper A, 1979. The ABC of NET, Grower Books, London.
Corby H. D. L, 1975. A method of making a ρure-culture, peat-type, legume inoculant, using a substitute for peat. In: Symbiotic Nitrogen Fixation in Plants (ed. Nutman P. S.), pp. 169—173, Cambridge University Press, Cambridge.
Corby H. D. L, 1980. The systematic value of leguminous root nodules. In: Advances in Legume Systematics, Part 2 (eds. Polhill R. M. and Raven P. H.), pp. 657—669, Royal Botanic Gardens, Kew.
Davey R. AL, Power J. B. (1975). Polyethylene glycol-induced uptake of microorganisms into higher plant protoplasts. An ultrastructural study, Plant Sci. Lett., 5, 269—274.
Deacon J. W, 1983. Microbial Control of Plant Pests and Diseases, Aspects of Microbiology 7, Van Nostrand Reinhold (UK) Co., Ltd., Nottingham, England.
Dunican L. K., O’Gara F., Tierney A. B, 1976. Plasmid control of effectiveness in Rhizobium. Transfer of nitrogen fixing genes on a plasmid from Rhizobium trifolii to Klebsiella aerogenes. In: Symbiotic Nitrogen Fixation in Plants (ed. Nutman P. S.), pp. 77—90, Cambridge University Press, Cambridge.
Dye M, 1979. The Rothamsted Rhizobium culture collection and inoculant use in the UK, Rothamsted Report for 1978, Part 2, 119—130.
Elmes R. P., Mosse B, 1980. Nutrient film technique, Rothamsted Report for 1979, Part I, 188.
Elmes R. P, Mosse B. (1984). Vesicular-arbuscular endomycorrhizal inoculum production. II. Experiments with maize (Zea mays) and other hosts in nutrient flow culture, Canad. J. Bot., 62, 1531—1536.
Fraser M. E. (1966). Pre-inoculation of lucerne seed, J. appl. Bacteriol., 29, 587—595.
Fraser M. E. (1975). A method of culturing Rhizobium meliloti on porous granules to form a pre-inoculant for lucerne seed, J. appl. Bacteriol., 39, 345—351.
Fred E. B., Baldwin I. L., McCoy E., 1932. Root Nodule Bacteria and Leguminous Plants, University of Wisconsin Press, Madison, Wisconsin.
Hadar Y., Chet I., Henis У. (1979). Biological control of Rhizoctonia solani damping-off with wheat bran culture of Trichoderma harzianum, Phytopathology, 69, 64—68.
Hayman D. S. (1977). Mycorrhizal effects on white clover in relation to hill land improvement, ARC Res. Rev., 3, 82—85.
Hayman D. S. (1980). Mycorrhiza and crop production, Nature, 287, 487—488.
Hayman D. S., Mosse B. (1979). Improved growth of white clover in hill grasslands by mycorrhizal inoculation, Ann. appl. Biol., 93, 141—148.
Hayman D. S., Morris E. J., Page R. J. (1981). Methods for inoculating field crops with mycorrhizal fungi, Ann. appl. Biol., 99, 241—253.
Hepburn A. G., 1982. The biology of the crown gall—a plant tumour induced by Agrobacterium tumefaciens. In: Bacteria and Plants (eds. Rhodes-Roberts M. E. and Skinner F. A.), pp. IOl—113, Academic Press, London.
Hobson P. N., Feilden N. E. H. (1982). Production and use of biogas in agriculture, Prog. Energy Combust. Sci., 8, 135—158.
Kao K. N., Michayluk M. R. (1974). A method for high-frequency intergeneric fusion of plant protoplasts, Planta, 115, 355—367.
Kerr A. (1972). Biological control of crown gall: seed inoculation, J. appl. Bac- teriol., 35, 493—497.
Kerr A. (1980). Biological control of crown gall through production of agro- cin 84, Pl. Disease, 64, 25—30.
Khin Htay., Kerr A. (1974). Biological control of crown gall: seed and root inoculation, J. appl. Bacteriol., 37, 525—530.
Kumar A., Wilson D., Cocking E. S. (1981). Polypeptide composition of Fraction 1 protein of the somatic hybrid between Petunia parodii and Petunia ρar- viflora, Biochem. Genet., 19, 255—261.
Lam S. (1975). Shoot formation in potato tuber discs in tissue culture, Am. Potato J., 52, 103—106.
Lawrie J. (1961). Natural Gas and Methane Sources, pp. 82—88, Chapman and Hall, London.
Liu S., Baker R. (1980). Mechanism of biological control in soil suppressive to Rhizoctonia solani, Phytopathology, 70, 404—412.
Menge J. A. (1983). Utilization of vesicular-arbuscular mycorrhizal fungi in agriculture, Canad. J. Bot., 61, 1015—1024.
Menge J. A., Lembright H., Johnson E. L. V. (1977). Utilization of mycorrhizal fungi in citrus nurseries, Proc. Int. Soc. Citriculture, 1, 129—132.
Mosey F. E. (1982). New developments in the anaerobic treatment of industrial wastes, Wat. Pollut. Contr., 81, 540—552.
Munns D. N., Mosse B., 1980. Mineral nutrition of legume crops. In: Advances in Legume Science (eds. Summerfield R. J. and Bunting A. H.), pp. 115—125, Royal Botanic Gardens, Kew.
Murashige T., Skoog F. (1962). A revised medium for rapid growth and bioassay with tobacco tissue cultures, Physiologia Pl., 15, 473—497.
Nemec S. (1980). Effects of 11 fungicides on endomycorrhizal development in sour orange, Canad. J. Bot., 58, 522—526.
New P. B., Kerr A. (1972). Biological control of crown gall: field measurements and glasshouse experiments, J. appl. Bacteriol., 35, 279—287.
Noack W., 1955. Biogas in der Landwirtschaft, Otto Elsner Verlagsgesellschaft, Darmstadt.
Pasveer A. (1959). A contribution to the development of the activated sludge process, J. Proc. Inst. Sewage Purif., 4, 436.
Phillips J. M., Hayman D. S. (1970). Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection, Trans. Br. mycol. Soc., 55, 158—161.
Polhill R. M., Raven P. H. (eds.), 1980. Advances in Legume Systematics, Royal Botanic Gardens, Kew.
Power J. B., Cummins S. E., Cocking E. C. (1970). Fusion of isolated plant protoplasts, Nature, 225, 1016—1018.
Power J. B., Davey M. R., 1979. Laboratory manual: Plant Protoplasts (isolation, fusion, culture, genetic transformation), Department of Botany, University of Nottingham, Nottingham.
Power J. B., Frearson E. M., Hayward C., Cocking E. C. (1975). Some consequences of the fusion and selective culture of Petunia and Parthenocissus protoplasts, Plant Sci. Lett., 5, 197—207.
Power J. B., Frearson E. M., Hayward C., George D., Evans P. K-, Berry S. F., Cocking E. C. (1976). Somatic hybridisation of Petunia hybrida and P. ρarodii, Nature, 263, 500—502.
Rishbeth J. (1963). Stump protection against Fomes annosus. III. Inoculation with Peniophora gigantea, Ann. appl. Biol., 52, 63—77.
Roberts W. P., Tate M. E., Kerr A. (1977). Agrocin 84 is a 6-N-phosphoramidate of an adenine nucleotide analogue, Nature, 265, 379—381.
Robinson K, 1971. Aerobic treatment of agricultural wastes. In: Microbial Aspects of Pollution (eds. Sykes G. and Skinner F. A.), pp. 91—102, Academic Press, London.
Robinson K- (1974). The use of aerobic processes for the stabilization of animal wastes, CRC Crit. Rev. Environ. Contr., 4, 193—220.
Robinson K- (1979). Developments in aerobic stabilization of animal wastes in Northeast Scotland: a review, Environ. Protec. Eng., 5, 127—143.
Roughley R. J. (1968). Some factors influencing the growth and survival of root nodule bacteria in peat culture, J. appl. Bacteriol., 31, 259—265.
Roughley R. J. (1970). The preparation and use of legume seed inoculants, Pl. Soil., 32, 675—701.
Roughley R. J., Date R. A., Walker M. H. (1966). Inoculating and lime pelleting legume seed, Agric. Gaz. N. S. W., March, 142—146.
Roughley R. J., Vincent J. M. (1967). Growth and survival of Rhizobium spp. in peat culture, J. appl. Bacteriol., 30, 362—376.
Santos A. V. P. Dos, Outka D. E., Cocking E. C., Davey M. R. (1980). Organogenesis and somatic ebbryogenesis in tissues derived from leaf protoplasts and leaf explants of Medicago sativa, Z. Pfl Physiol., 99, 261—270.
Schroth M. N., Hancock J. G. (1981). Selected topics in biological control, Ann. Rev. Microbiol., 33, 453—476.
Shanmugam K. T., Hennecke H., 1980. Microbial genetics and nitrogen fixation. In: Recent Advances in Biological Nitrogen Fixation (ed. Subba Rao N. S.), pp. 227—256, Edward Arnold, London.
Shephard J. F., Bidney D., Shahin E. (1980). Potato protoplasts in crop improvement, Science, 208, 17—24.
Shephard J. F., Totten R. E. (1977). Mesophyll cell protoplasts of potato. Isolation, proliferation and plant regeneration, Pl. Physiol., 60, 313—316.
Steinborn J., Roughley R. J. (1974). Sodium chloride as a cause of low numbers of Rhizobium in legume inoculants, J. Appl. Bacteriol., 37, 93—99.
Stewart W. D. P. (ed.), 1975. Nitrogen Fixation by Free-living Microorganisms, IBP 6, Cambridge University Press, Cambridge.
Streicher S, Gurney E, Valentine R. C. (1971). Transduction of the nitrogenfixation genes in Klebsiella pneumoniae, Proc, natn. Acad. Sci USA, 68, 1174—1177.
Strijdom B. W., Deschodt C. C., 1975. Carriers of rhizobia and the effects on the survival of rhizobia. In: Symbiotic Nitrogen Fixation in Plants (ed. Nutman P. S.), pp. 151—168, IBP 7, Cambridge University Press, Cambridge.
Thomas E. (1981). Plant regeneration from shoot culture-derived protoplasts of tetrapioid potato (Solanum tuberosum cv. Maris Bard), Plant Sci. Lett., 23, 81—88.
Thomas E., Bright S. W. J., Franklin J., Lancaster V. A., Miflin B. J., Gibson R. (1982). Variation amongst protoplast-derived potato plants (Solanum tuberosum cv. «Maris Bard»). Theor. appl. Genet., 62, 65—68.
Thomas E., King P. J., Potrykus I. (1979). Improvement of crop plants via single cells in vitro — an assessment, Z. Pfl Ziicht, 82, 1—30.
Weindling R. (1946). Microbial antagonism and disease control, Soil. Sci., 61, 23 3θ.
Wells H. D., Bell D. K., Jaworksi C. A. (1972). Efficacy of Trichoderma har- zianum as a biocontrol for Sclerotium rolfsii, Phytopathology, 62, 442—447.
Wenzel G., Schieder O., Przewozny T., Sopory S. K., Melchers G. (1979). Comparison of single cell culture-derived Solanum tuberosum L. plants and a model for their application in breeding programs, Theor. appl. Genet., 55, 49—55.
Wernicke W., Brettell R. (1980). Somatic embryogenesis from Sorghum bicolor leaves, Nature, 287, 138—139.
Vincent J. M. (1970). A Manual for the Practical Study of the Rootnodule Bacteria, IBP Handbook, No. 15, Blackwell Scientific Publications, Oxford.
Zaenen 7., van Larebeke N., Teuchy H., van Montagu M., Schell J. (1974). Supercoiled circular DNA in crown gall inducing Agrobacterium strains, J. Mol. Biol., 86, 109—127.

