4.1. ВВЕДЕНИЕ
Оценка численности жизнеспособных микроорганизмов в пробе пищевого продукта как индикатор его безопасности или качества не может быть точной. Причиной ошибок, связанных с используемыми методами анализа и исследуемыми материалами, могут служить такие факторы, как образование скоплений микроорганизмов, неспособность некоторых клеток размножаться в типичных условиях и неравномерное распределение микроорганизмов по пищевому продукту. Все это наводит на мысль, что, возможно, получаемым численным значениям придается большее значение, чем это оправдано с технической или статистической точки зрения. Тем не менее различные микробиологические показатели продолжают использоваться на пищевых производствах и их клиентами, регламентирующими органами, органами ветеринарного, санитарного и таможенного контроля, лабораториями органов здравоохранения, учеными и т.п. В последние годы значение микробиологических анализов еще более возросло в связи с повсеместным внедрением системы НАССР, в которой он играет важную роль в процедурах валидизации и верификации управления технологическим процессом. Определение критических контрольных точек (ККТ) может подразумевать предварительное определение численности контролируемых микроорганизмов и заданных параметров ее снижения в целях удовлетворения требований пищевой безопасности.
Традиционные методы количественного подсчета, естественно, не являются единственными средствами оценки численности микроорганизмов в пищевых продуктах. Продолжаются разработки в области автоматизированных и экспресс-методов, обеспечивающих повышение надежности результатов и сокращающих время на их получение. Эти разработки касаются целого ряда систем, в том числе систем на основе АТФ-биолюминисценции, на основе измерения изменений импеданса или проводимости культуральных сред, а также микрокалориметрии, проточной цитометрии и кондуктометрии. Приемлемость любого нового метода обычно определяется по степени статистической корреляции его результатов с результатами, полученными одним или несколькими традиционными методами подсчета (несмотря на известную вариабельность этих методов и непостоянство численности микроорганизмов в исследуемом материале). Считается, что это тормозит развитие методов микробиологических исследований, этим можно также объяснить, почему потенциально эффективные альтернативные методы определения численности микроорганизмов внедряются очень медленно.
Несмотря на то, что сырье животного происхождения иногда бывает контаминировано патогенными для человека микроорганизмами, распределение последних очень неравномерно, а их численность зачастую невелика. Из-за этого эти микроорганизмы с трудом поддаются обнаружению и количественному подсчету, требуя применения методов на основе определения наиболее вероятного числа (НВЧ), которые очень трудоемки и даже менее точны, чем подсчет колоний. В качестве альтернативы для обнаружения конкретного патогенного микроорганизма правильнее оценивать содержание определенных микроорганизмов-индикаторов. В идеальном случае такой микроорганизм или группа микроорганизмов по своему происхождению и свойствам должны быть подобны искомому патогену, будучи при этом настолько обычными, широко распространенными, легко выделяемыми и подсчитываемыми, что их можно было бы легко выявлять в большинстве исследуемых образцов. Теоретически в этих целях мог бы использоваться почти любой соответствующий этим требованиям микроорганизм. В качестве возможного кандидата на эту роль могли бы рассматриваться Bacteroides spp., обычно присутствующие в экскрементах животных в большом количестве, то есть они характеризуются той же кишечной средой обитания, что и такие патогенные микроорганизмы, как Campylobacter, Salmonella, Clostridium perfringens и патогенные Е. coli. С другой стороны, Bacteroides spp. в качестве микроорганизмов-индикаторов использовать не удобно, так как они представляют собой облигатные анаэробы, плохо выживающие вне кишечника; кроме того, они требуют использования методов выделения в анаэробных условиях, которые гораздо труднее применять в повседневной работе и можно использовать лишь относительно редко. Именно поэтому с практической точки зрения Bacteroides spp. не подходят на роль индикаторов фекального загрязнения. Аналогичные соображения можно было бы применить и к предполагаемому использованию в качестве индикаторов фекального загрязнения мяса и мясопродуктов бифидобактерий.
Более подходят на эту роль представители группы Е. coli, колиформные бактерии и члены семейства Enterobacteriaceae в целом, и именно их мы будем рассматривать далее. Многие из этих микроорганизмов имеют фекальное происхождение и по своим свойствам сходны с представителями патогенных родов семейства Enterobacteriaceae. Кроме того, сложились четкие методы их количественного определения, пригодные для использования в повседневной работе. Относительные достоинства каждой группы микроорганизмов-индикаторов фекального загрязнения пищевых продуктов уже давно широко обсуждаются учеными и практическими работниками, и здесь мы будем рассматривать их в связи с задачами минимизации контаминации мясного сырья патогенными энтеробактериями пищевого происхождения.
4.2. О ПРОИСХОЖДЕНИИ ПОНЯТИЯ И ТЕРМИНА
«МИКРООРГАНИЗМ-ИНДИКАТОР»
В течение более чем ста лет Е. coli и колиформные бактерии использовались в качестве бактериальных индикаторов фекального загрязнения воды. Их использование в этой роли связано с присутствием этих микроорганизмов в экскрементах человека и многочисленных теплокровных животных, а также с тем фактом, что присутствующие в воде патогенные бактерии, в частности 5. typhi, имеют кишечное происхождение. В начальной стадии загрязнения воды содержание любых патогенных микроорганизмов относительно невелико по сравнению с содержанием фекальных колиформ, Е. coli и других микроорганизмов (примерно 1 на несколько миллионов). Тем не менее вода зачастую предъявляет более жесткие требования к выживаемости микроорганизмов (особенно тех, первичной средой обитания которых является кишечник), чем пищевые продукты, так что сальмонеллы, присутствующие в небольших количествах, через несколько дней в воде могут уже не обнаруживаться. Таким образом, более высокое содержание микроорганизмов-индикаторов фекального загрязнения служит сигналом о принципиальной возможности фекального загрязнения (например, из сточных вод) и обеспечивает некоторый запас надежности, так как для полной гибели этих микроорганизмов-индикаторов требуется больше времени, чем для гибели патогенных микроорганизмов. Ни Salmonella, ни Е. coli обычно не способны к размножению в воде в отличие от сред, свойственных различным пищевым продуктам.
Как мы уже отмечали ранее, использование одного типа микроорганизмов как индикатора возможного присутствия других, потенциально более опасных микроорганизмов, способных контаминировать пищевые продукты или воду, имеет длительную историю, в ходе которой была выработана специальная терминология. В сфере микробиологического контроля пищевых продуктов микроорганизмы, о которых идет речь, зачастую называют «маркерами» микробиологического качества данного продукта и рассматривают как важнейший аналитический инструмент для подтверждения соответствия продукта требования нормативных актов. Там, где присутствие микроорганизмов-индикаторов в пищевых продуктах ассоциируется с возможным присутствием патогенных микроорганизмов, ассоциируемых с ними таксономически, физиологически и по среде обитания, их называют микроорганизмами-«показателями». Там же, где их присутствие используется для оценки результатов технологического процесса (например, при определении эффективности пастеризации), предпочитают применять термин «микроорганизмы-индикаторы». В настоящей главе эти микроорганизмы мы будем рассматривать главным образом как «индикаторы» фекального загрязнения в ходе операций убоя и разделки туш, а термин «маркер» будем использовать в другом значении. Здесь «маркером» мы будем называть любой микроорганизм, который сознательно и в заданном количестве вносится в тушу или на оборудование технологической линии для определения возможных путей перекрестной контаминации или для подтверждения действенности особых мер контроля их распространения. В этом случае микроорганизм-«маркер» легко отличить от всех других присутствующих микроорганизмов, его легко выделить и подсчитать на селективной культуральной среде (см. об этом также раздел 4.6).
4.3. ENTEROBACTERIACEAE, КОЛИФОРМЫ И Е. COLI
Семейство Enterobacteriaceae включает примерно 29 родов, некоторые из которых приведены в табл. 4.1. Все его представители являются факультативными оксидазо-отрицательными анаэробами, ферментирующими глюкозу (последние изменения в таксономии микроорганизмов описаны в работе). Некоторые виды являются по происхождению кишечными, основная же среда обитания других – это почва и воздух. Некоторые штаммы видов, принадлежащих к разным родам (табл. 4.1), могут размножаться при температурах ниже 5 °С и были обнаружены на мясе и мясопродуктах, порчу которых они могут вызывать даже при холодильном хранении.
Таблица 4.1.
Некоторые роды микроорганизмов семейства Enterobacteriaceae – возможность фекального происхождения и наличие психротрофных штаммов, способных размножаться на мясопродуктах

В это семейство входят некоторые важные патогенные микроорганизмы, в частности, некоторые представители Е. coli, Salmonella и Shigella spp., а также Yersinia епterocolitica. В качестве микроорганизмов-индикаторов представители семейства Епterobacteriaceae использовались с 1950-х гг. на том основании, что они представляют собой более изолированную таксономическую группу, чем колиформы (см. ниже), и включают больше микроорганизмов, важных с точки зрения здравоохранения.
Те штаммы представителей семейства Enterobacteriaceae, которые ферментируют лактозу (обычно с образованием кислоты и газа), называют «колиформами» – к ним относят представителей родов Citrobacter, Enterobacter, Escherichia и Klebsiella. Некоторые микробиологи, работающие в медицине, расширяют это определение, включая в него виды родов Edwardsiella, Hafnia и Serratia, несмотря на то что в обычных условиях ферментировать лактозу эти микроорганизмы не способны. Все они являются оксидазо-негативными, демонстрируют бродильный тип диссимиляции углеводов и могут расти на относительно простой культуральной среде в присутствии желчи. Некоторые их штаммы являются психротрофными, хорошо растущими при низкой температуре, но при 37 °С их размножение может слегка ингибироваться. Некоторые штаммы Enterobacter, например, могут вызывать порчу мяса и мяса птицы, особенно в условиях длительного хранения. Еще одной подгруппой колиформ являются так называемые «фекальные колиформы», ферментирующие лактозу при 44,5 + 0,2 °С за 48 ч (иногда их называют «термотолерантными»). К таким колиформам относят Escherichia и Klebsiella spp., но не все выделяемые штаммы являются кишечными по происхождению, что снижает их ценность как индикаторов фекального загрязнения.
Из колиформ, присутствующих в экскрементах теплокровных животных, более 90% обычно составляют Е. coli. Другие штаммы этой группы микроорганизмов могут происходить из окружающей среды – из почвы, воды, воздуха, с растений – и обычно выживают в грязной воде дольше, чем Е. coli. Они могут даже размножаться в ней. Понятно, что для практических целей колиформы представлят собой:
- довольно плохо определяемую группу микроорганизмов;
- в качестве индикатора фекального загрязнения воды и пищевых продуктах они менее специфичны, чем собственно Е. coli.
В пищевой промышленности, следовательно, колиформы используют в качестве более широкого санитарно-гигиенического показателя и для описания эффективности отдельных технологических процессов. Кроме того, их можно использовать для демонстрации последующей контаминации пищевых продуктов и роста микроорганизмов в ходе хранения.
Несмотря на то, что Е. coli является преимущественно симбионтом в кишечнике человека и других теплокровных «хозяев», к этому виду относятся также некоторые менее распространенные патогенные штаммы и штаммы, стойкие к действию широко применяемых антибактериальных препаратов, причем это свойство может передаваться и другим микроорганизмам, включая патогенные. Наиболее типичные штаммы подвижны, образуют при ферментировании лактозы при температуре 44 °С и ниже кислоту и газ, продуцируют индола при температурах 37 и 44 °С и не способны утилизировать цитрат. Они дают положительную реакцию при использовании метилового красного и отрицательную – при реакции Фогеса-Проскауэра (несмотря на то что H2S не образуется). Лизин, как правило, декарбоксилируется, но указанные микроорганизмы не способны гидролизовать мочевину, расти в KCN-бульоне или разжижать желатин. Типичные штаммы, продуцирующие индол, зачастую относят к биотипу 1 или называют «фекальными колиформами» (они более специфичны как прямые или косвенные индикаторы фекального загрязнения воды или пищевых продуктов, в частности мясного сырья, чем колиформные бактерии вообще или все представители семейства Enterobacteriaceae).
4.3.1. Выделение и количественный подсчет
Для обнаружения и подсчета Е. coli и других представителей семейства Enterobacteriaceae в пищевых продуктах разработано много различных культуральных сред и методов, но ни один из них не может считаться лучшим, чем другие, во всех отношениях. По существу, культуральные методы состоят в использовании элективных или селективных сред для выделения микроорганизмов и учитывают один или несколько дифференцирующих критериев – например, ферментацию лактозы или продуцирование индола. Культуральные методы грубо подразделяют на методы с использованием посева разведения пробы на или в агаровую среду и на методы со внесением посевного материала во множество пробирок с жидкой средой для определения НВЧ. Методы посева на чашки позволяют сосчитать колонии и являются относительно быстрыми и недорогими. Метод определения НВЧ более чувствителен, позволяя регенерировать более низкие количества контролируемых микроорганизмов, так что их можно использовать для обнаружения образования газа и кислот в результате сбраживания углеводов. Эти методы более дорогие, трудоемкие и менее точные, чем подсчет колоний.
У жидких сред, обычно используемых для определения НВЧ, селективность зачастую обеспечивается поверхностно активными веществами – солями желчных кислот или лаурилсульфатом (по отдельности или в сочетании с другими селективными ингредиентами, например, бриллиантовым зеленым). Тем не менее в лактозном бульоне селективных ингредиентов нет, но он считается единственной средой для исследования материала, в норме являющегося стерильным. Глютаматный бульон, модифицированный минеральными веществами (MMG), – довольно необычная среда, так как она является элективной с заданным химическим составом; в ней, как и в некоторых других жидких средах, в качестве дифференцирующего критерия используется продуцирование кислоты и газа при сбраживании лактозы. В твердых средах для ингибирования роста нежелательных микроорганизмов также используются соли желчных кислот, а селективность достигается применением определенных красителей, иногда в сочетании с солями желчных кислот или сульфитом натрия. Большинство агаровых сред содержат сбраживаемые углеводы и индикаторы значения рН, способствующие различению контролируемых и неконтролируемых микроорганизмов, но при использовании данных средств отсутствуют возможности индикации газообразования. Используются и другие дифференцирующие тесты, в частности, почернение колоний вследствие образования сульфида железа в среде, содержащей железо и сульфит.
Обычной плотной средой для выделения и количественного подсчета бактерий семейства Enterobacteriaceae является глюкозо-желчный агар с кристаллическим фиолетовым и феноловым красным (VRBG, Violet-Red-Bile-Glucose)*. На этой среде микроорганизмы образуют красноватые колонии, окруженные такого же цвета зонами. Использование верхнего слоя агара для поверхностно посеянной или залитой чашки подавляет рост других грамотрицательных бактерий. В зависимости от температуры инкубации на этой среде можно выделять психротрофные (4 °С), мезофильные (35-37 °С) или термофильные (42-44 °С) микроорганизмы, хотя некоторые психротрофные штаммы могут расти и при 42 °С. Типичные колонии подтверждают с помощью оксидазного теста (результат должен быть отрицательным) и с помощью теста по сбраживанию глюкозы.
________________________________________________
* По каталогу HiMedia Laboratories Pvt. Ltd эта среда под номером М581 называется «глюкозо-желчный агар с кристаллвиолетом и нейтральным красным» и является рекомендованной по стандарту ISO 7402 : 1993; далее в разделе 5.9 утверждается, что она содержит «феноловый красный». В Интернете приводится ее пропись как с нейтральным красным, так и с феноловым красным (количество ссылок на них примерно одинаковое. Вместе с тем, нейтральный красный (толуиленовый красный) и феноловый красный — это химически два совершенно различных вещества. Здесь и далее мы будем считать, что используется «феноловый красный» — Примеч. перев.)
Аналогичным образом колиформные бактерии выделяют на агаре с кристаллическим фиолетовым, феноловым красным и солями желчи, содержащем в качестве ферментируемого субстрата не глюкозу, а лактозу. Выделяемые штаммы также подразделяются по температурам инкубации. Иногда используют температуру 35-37 °С, но если обнаруживается полный набор колиформ, то чашки следует инкубировать при 30 °С в течение 24 ч и подсчитывать все колонии независимо от их окрашивания. Психротрофные штаммы могут учитываться особо после инкубации при 4 °С в течение 10 сут. На этой среде лактозо-положительные бактерии образуют красноватые колонии, каждая из которых может быть окружена зоной того же цвета. Лактозо-отрицательные штаммы образуют бледные колонии, зачастую окруженные зеленоватыми зонами.
Эффективный метод счета колоний Е. coli предложен в работе, а в работе он усовершенствован путем введением стадии восстановления клеток с сублетальными повреждениями. В нем применены целлюлозные мембраны, каждая из которых помещается на поверхность чашки с MMG-агаром, засеянной анализируемой пробой в соответствующем разведении. Эту чашку затем инкубируют при 37 °С в течение 4 ч, после чего мембрану переносят на чашку с триптон-желчным агаром (ТЖА, ТВА) и инкубируют ее при температуре 44,5 °С не менее 18 ч. Мембраны, на которых после этого заметен явный рост, обрабатывают реактивом на индол и дают развиться реакции под УФ-лампой или в ярком солнечном свете. Индолположительные колонии окрашены в розоватый цвет и подсчитываются как колонии Е. coli.
Еще одним мембранным методом является метод фильтрации через мембранный фильтр с гидрофобной сеткой (HGMF). В этом случае на мембране имеются гидрофобные линии, расположенные в виде решетки, играющие роль препятствия и недопускающие распространения колоний. Соответствующее разведение пробы пищевого продукта фильтруют через мембрану, которую затем помещают на поверхность агаровой среды. Для определения численности микроорганизмов число квадратов, которые оказались заняты колониями, подсчитывают по формуле пересчета результатов в НВЧ. В случае мясных туш этот метод дает возможность определить 1 клетку Е. coli на 100 см2 (при отфильтровывании всех гомогенатов из мазка пробы).
При использовании для выделения твердых и жидких сред все более популярным становят ферментные тесты по обнаружению и количественному определению численности целевых бактерий. Большинство штаммов Е. coli продуцируют фермент β-D-глюкуронидазу, обнаруживаемый введением различных хромогенных и флуорогенных субстратов, в том числе 5-бром-4-хлор-3-индолил-β-D-глкжуронид (XG-LUC). В присутствии последнего положительные колонии демонстрируют явноотличимую голубоватую окраску. XGLUC содержится в триптон-желчно-глюкуроновом агаре (ТВХ), который в настоящее время используется (с мембранными фильтрами или без них) в стандартных методах количественного определения Е. coli в пищевых продуктах и кормах для животных. Применение ГБХ-агара дает возможность выявлять и определять численность β-глюкуронидаза-положительных Е. coli в течение 24 ч без потребности в подтверждающих тестах. Данное обнаружение ограничено штаммами, растущими при 44 °С, а β-глюкуронидаза-отрицательные штаммы типа Е. coli О157 на этой среде не обнаруживаются.
Не следует забывать и об использовании альтернативных экспресс-методов для обнаружения и количественного определения индикаторных (и показательных) групп микроорганизмов в пределах семейства Enterobacteriaceae, прежде всего методов Petrifilm™ Coliform Count Plate и E. coli Count Plate (корпорации ЗМ, г. Сент Пол, штат Миннесота, США), подробнее рассматриваемые в главе 11. Кроме того, существуют методы, основанные на измерении импеданса и проводимости, которые широко применяются для анализа пищевого сырья и обработанных пищевых продуктов и могут избавить микробиолога от необходимости вычислять НВЧ. Для каждого нового вида исследуемых пищевых продуктов прибор необходимо заново калибровать.
Учитывая наличие большого числа культуральных сред и методов для выделения Е. coli, Служба по контролю безопасности пищевых продуктов США (FSIS) не дает точных указаний на конкретный метод анализа, который должен использоваться в системе НАССР на мясоперерабатывающих предприятиях. По требованиям FSIS следует применять только методы, одобренные Ассоциацией официальных химиков-аналитиков (АОАС) или методы, прошедшие научную валидизацию в ходе сравнительных исследований с трехпробирочным методом определения НВЧ. Применение разных методов микробиологического анализа допускается и другими авторитетными организации, в частности Международной комиссией по микробиологическим показателям пищевых продуктов и Международной организацией по стандартизации.
4.3.2. Необходимость восстановления поврежденных клеток
В любой популяции микроорганизмов, подвергающейся стрессу под воздействием условий окружающей среды, с большой вероятностью будут присутствовать клетки с сублетальными повреждениями, но жизнеспособные. Такие повреждения могутвозникать в результате технологической обработки, в частности, тепловой, воздействия антимикробных препаратов, охлаждения и замораживания – все эти операции применяются на бойнях. Структурные и физиологические результаты воздействия стресса на микробные клетки рассмотрены в работе, где на первый план выдвинуты три важнейших проявления повреждений клеток:
- ингибирование селективными веществами данной культуральной среды;
- чувствительность к низким концентрациям активного кислорода;
- более длительная лаг-фаза, в ходе которой клетка восстанавливается от последствий стресса.
Наличие поврежденных клеток не следует игнорировать, поскольку они после восстановления (или в пищевом продукте, или в кишечно-желудочном тракте) сохраняют возможность порчи пищевых продуктов или могут вызывать у человека пищевые отравления. Чтобы гарантировать, что такие поврежденные клетки учтены при определении численности микроорганизмов, то еще до его проведения с использованием селективных сред необходимо использовать специальные техники восстановления микроорганизмов.
Под воздействием стресса доля поврежденных клеток может быть относительно высокой – в работе показано, что при замораживании 90% клеток повреждаются и неспособны образовывать колонии на VRB- или деоксихолатлактозном агаре. Более того, горячий агар при заливке чашки снижает численность поврежденных замораживанием Е. coli на селективной среде на 80%, тогда как на неселективной среде эффект воздействия горячего агара меньше. Время, необходимое для полного восстановления клеток, широко варьирует и может превышать 20 ч. Такой длительный период обусловлен методом обнаружения, обычно используемым для выявления сальмонелл – в нем для предварительного обогащения применяется неселективная жидкая среда (забуференная пептонная вода), после чего следует селективное обогащение и посев на чашки. В целях количественного определения с использованием метода НВЧ применяют аналогичный подход, причем разведения пробы перед пересевом на селективную среду для финальной инкубации добавляют в многочисленные пробирки с неселективной средой. Следует отметить, что точность метода НВЧ тем ниже, чем меньше используется параллельных пробирок на одно разведение, так что более предпочтителен чашечный анализ с восстановлением на плотной среде (как при использовании мембранных фильтров).
Применение доступных методов восстановления клеток всех микроорганизмов-индикаторов фекального загрязнения может существенно увеличить их определяемую численность в пробах с бойни. На практике, однако, стадию восстановления никогда не используют (если только она не является обязательной частью используемого метода определения численности микроорганизмов). Восстановление поврежденных клеток особенно важно при анализе переработанных пищевых продуктов, поскольку присутствие в них жизнеспособных клеток представителей семейства Enterobacteriaceae вообще не предполагается. В этом случае стадия восстановления крайне важна для гарантии полного их отсутствия.
4.3.3. Общее микробное число
Показатель ОМЧ (общее количество жизнеспособных микроорганизмов) используется для оценки общего микробиологического состояния данного продукта и технологического оборудования для его производства. Этот показатель зачастую называют «результатом чашечного подсчета аэробных микроорганизмов» или «чашечным подсчетом колоний аэробных микроорганизмов», так как в данном случае инкубирование проводится в присутствии воздуха. Одна и та же культуральная среда (например, агар для подсчета микроорганизмов чашечным методом) используется и для поверхностного посева распределением посевного материала по поверхности вручную или спиральным посевом, и для глубинного засева чашек, после чего ее инкубируют при 30 °С в течение 3 сут или при 35-37 °С в течение 2 сут (для целевых микроорганизмов не требуется особых условий для роста, так что добавлять к среде кровь, например, не обязательно). Инкубирование при 30 °С позволяет размножаться и аэробным бактериям порчи, рост которых ингибируется при температуре выше 34 °С, и факультативно анаэробным микроорганизмам из пищеварительного тракта, в частности, Е. coli. Любые высокие значения ОМЧ, полученные этим методом, необходимо интерпретировать с учетом знаний о применяемом технологическом процессе и выпускаемом продукте. Например, они могут свидетельствовать о наличии фекального загрязнения или о неправильном обращении с продуктом, которые впоследствии привели к размножению микроорганизмов порчи. С другой стороны, значения ОМЧ до 106 клеток/г не обязательно свидетельствуют о неприемлемости продукта, особенно если мясо для увеличения срока годности упаковано в вакуумную упаковку и хранилось в условиях охлаждения. Поскольку методы определения ОМЧ при 30 °С позволяют определить больше микроорганизмов, чем обычно с использованием селективных сред, то этот анализ считается приемлемым для верификации системы НАССР мясных производств. У мяса, производимого в условиях строгого контроля, можно легко добиться значений ОМЧ в 104 клеток/см2 и мене, однако этот анализ никак не выявляет возможную контаминацию мяса патогенными микроорганизмами.
Так как любое микробиологическое исследование с использованием культуральных методов занимает довольно много времени, разрабатываются разнообразные ускоренные (экспресс-)методы определения ОМЧ. Одним из таких методов, который освобождает от необходимости культивировать микроорганизмы, является метод прямого эпифлуоресцентного фильтра (DEFT). Пробу обрабатывают ферментом, улавливают микроорганизмы на мембранном фильтре и окрашивают акридиновым оранжевым. Клетки с оранжево-красноватой флуорсценцией являются жизнеспособными и подсчитываются с помощью эпифлуоресцентного микроскопа. Несмотря на то, что этот метод можно использовать и для анализа мяса, и мяса птицы, было обнаружено, что его пригодность для анализа мяса птицы зависит от способа пробоотбора. Метод DEFT неприменим при отборе проб с шейной кожи способом взбалтывания, так как мельчайшие частички кожи затрудняют подсчет.
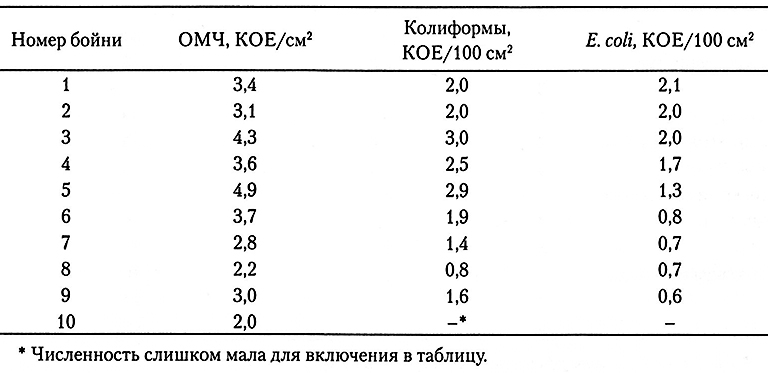
Было показано, что средние логарифмические значения численности Е. coli, выделенных из фекального материала различных сельскохозяйственных животных, варьируют от 4,3 до 6,8 КОЕ/г, причем у свиней и птицы они выше, чем у овец и крупного рогатого скота. Тем не менее сам факт присутствия Е. coli у животных – это лишь один из факторов, влияющих на степень контаминации туш и тушек (к другим, даже более важным, факторам относятся процедура убоя и степень ее контроля). Для мяса, в частности, важнейшим фактором, по-видимому, является квалификация персонала и применяемые меры санитарно-гигиенического контроля. Результаты подсчета микроорганизмов в пробах, взятых с говяжьих туш на выходе с технологической линии, приведены в табл. 4.2 (по 10 бойням). Разница между предприятиями достигает 2,9 лог. ед., что свидетельствует о разных стандартах санитарно-гигиенического контроля. Иногда обнаруживались лишь относительно небольшие количества Е. coli, но применительно к безопасности продукта этот микроорганизм считается лучшим критерием соблюдения санитарно-гигиенических требований, чем показатель ОМЧ.
Таблица 4.2.
Средние арифметические значения (log10) количеств микроорганизмов в пробах, отобранных с боковтуш, перед их замораживанием на десяти различных бойнях.
4.4. МОНИТОРИНГ ФЕКАЛЬНОГО ЗАГРЯЗНЕНИЯ МЯСА
Несмотря на то что представители семейства Enterobacteriaceae менее специфичны как индикаторы фекального загрязнения мяса, чем Е. coli и образуют более широкую группу, чем колиформы, присутствие Enterobacteriaceae на мясном сырье и мясе птицы является, как правило, свидетельством наличия фекального загрязнения, а их высокая численность в пробах с боен обычно свидетельствует о плохих санитарно-гигиенических условиях на производстве. В этой ситуации присутствие таких патогенов, как Salmonella и Shigella, мало сказывается на общей численности, так как Е. coli обычно значительно количественно превосходят патогенные микроорганизмы, а присутствие других бактерий, не утилизирующих лактозу,может являться следствием загрязнения окружающей среды. Тем не менее высокая численность психротрофных микроорганизмов семейства Enterobacteriaceae обычно свидетельствует о плохих условиях хранения. К психротрофным штаммам, выделяемым из мяса, относятся представители родов Citrobacter, Enterobacter, Erwinia, Klebsiella, Kluyvera и Serratia. Встречаемость представителей семейства Enterobacteriaceae на образцах мяса птицы, отобранных на различных стадиях технологического процесса, после инкубирования VRBG-агара при 30 °С приведена в табл. 4.3.
Таблица 4.3.
Встречаемость психротрофных колиформ на предприятии по пеработке мяса птицы
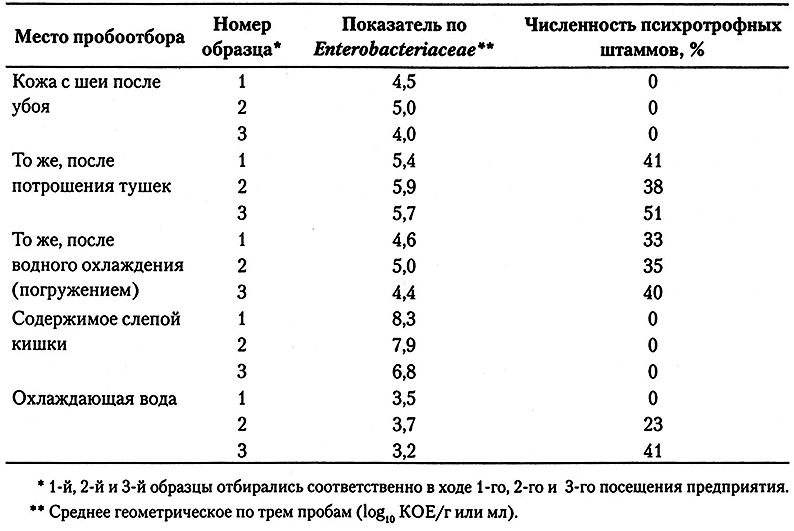
При отборе проб из слепой кишки было получено среднее логарифмическое значение 8,2, тогда как численность бактерий с кожи шеи тушек варьировала между log 5,2 и 6,4. После идентификации микроорганизмов оказалось, что 99% изолятов из проб слепой кишки были Е. coli (в пробах с тушек их оказалось 72-98%). На пробах из слепой кишки и тушках сразу после убоя психротрофные штаммы обнаружены не были, но впоследствии они составляли 15-18% всех штаммов Enterobacteriaceae, выделенных с тушек; по-видимому, они были занесены на них в ходе переработки. Эти штаммы были отнесены к родам Citrobacter, Enterobacter, Hafnia и Serratia, тогда как в работе из проб мяса птицы были выделены психротрофные штаммы, принадлежащие родам Klebsiella и Providencia.
понятно, что на мясных тушах и тушках птицы могут быть обнаружены любые рассматриваемые в настоящем разделе микроорганизмы-индикаторы фекального загрязнения, причем совершенно не обязательно, что на них присутствует какой- либо из ассоциированных с ними патогенных микроорганизмов. Таким образом, независимо от метода анализа численность таких микроорганизмов-индикаторов представляет собой просто показатель возможного присутствия соответствующих патогенов. В случае мяса птицы имеется дополнительная проблема – ошпаривание тушек при температуре ниже 60 °С делает возможным выживание многих первичных фекальных контаминантов, что не позволит выявить дополнительную контаминацию в ходе технологического процесса. Это является серьезным препятствием для использования обычных фекальных микроорганизмов для эффективного мониторинга санитарно-гигиенических условий производства мяса птицы. После водного охлаждения методом погружения половинок тушек, контаминированных фекальными микроорганизмами, в работе не было обнаружено существенных различий между численностью Е. coli, колиформ и представителей семейства Enterobacteriaceae и было показано, что численность микроорганизмов после охлаждения никак не коррелирует с численностью фекальных микроорганизмов до охлаждения водой.
На бойне на любой технологической стадии сопоставимость численности Е. coli, колиформ и представителей семейства Enterobacteriaceae будет зависеть от происхождения соответствующих микроорганизмов. Если на мясе преобладают Е. coli, то численность микроорганизмов всех трех групп, скорее всего, будет сходной, однако при преобладании колиформ или Enterobacteriaceae ситуация изменится. В ходе обследования европейских предприятий по переработке мяса птицы была выявлена очень высокая корреляция между численностью колиформ и представителями семейства Enterobacteriaceae на различных стадиях обработки, хотя численность Enterobacteriaceae в целом была выше. В этом исследовании в обоих случаях использовалась температура инкубирования 37 °С. Знание температуры инкубирования очень важно для интерпретации результатов анализов на наличие представителей семейства Enterobacteriaceae. Количественный подсчет при температурах инкубирования 30-37 °С не пригоден для оценки бактериологической безопасности мясного сырья в тушах (из-за возможности присутствия психротрофных штаммов, размножающихся при других температурах). Следовательно, целесообразно ограничить анализ температурой, свойственной термофильным штаммам, то есть растущим при 42,5 °С. Многие психротрофные представители семейства Enterobacteriaceae неплохо растут при 37 °С, причем попадают они на мясо из внешней среды, а не являются микроорганизмами фекального происхождения. Соотношение мезофильных штаммов Enterobacteriaceae к термофильным штаммам возрастает (на говядине) от log 0,1 ± 0,0 сразу же после обвалки до 1,8 ± 0,2 после охлаждения и последующего измельчения в холодильных условиях.
Несмотря на все сложности, описываемые здесь микроорганизмы продолжают использоваться в регламентирующих документах. В США, где применение системы НАССР на бойнях обязательно, показатели на основе Е. coli применяются для оценки микробиологического качества охлажденных туш, а также тушек птицы. Этот микроорганизм был выбран отчасти из-за своей специфичности в качестве индикатора фекального загрязнения, а отчасти – из-за его сходства с некоторыми патогенными микроорганизмами кишечного происхождения, в частности, с Е. coli О157: Н7 и сальмонеллами. Кроме того, разработаны надежные, устоявшиеся методы обнаружения и количественного определения этого микроорганизма. Эти показатели не являются обязательными регламентирующими нормами, а предназначены в помощь специалистам боен и контролирующих органов. Соответствие предписанным показателям гарантирует, что данное предприятие в соответствии со своими обязательствами предотвращает и снижает степень фекальной контаминации туш. Изначально эти показатели основывались на результатах национального обследования санитарно-гигиенического состояния боен и не являлись показателями, которые необходимо достичь путем обязательного внедрения системы НАС CP. Тем не менее по мере поступления новых данных планируется ставить и целевые количественные показатели.
С другой стороны, в странах ЕС мониторинг санитарно-гигиенических условий убоя и обвалки осуществляется путем анализа проб с туш на численность аэробных микроорганизмов и представителей семейства Enterobacteriaceae. Таким образом, туши исследуются после обвалки, но перед охлаждением (предельно допустимые значения см. в главах 2 и 6). Методы выделения бактерий семейства Enterobacteriaceae основаны на стандарте ISO 7402 :1985, включая метод определения численных колониеобразующих единиц. В случае рубленого мяса, мяса механической обвалки и мясных полуфабрикатов обязательным микроорганизмом-индикатором фекального загрязнения является Е. coli, причем отбор проб проводят в конце производственного процесса. Используемый для этой цели метод основан на стандарте BS EN ISO 16649-2 : 2001 и включает заливку чашек ТВХ-агаром и фильтрование разведенной пробы через целлюлозные мембраны, помещенные на поверхность агара. После инкубирования чашек подсчитывают колонии Е. coli, давшие положительную реакцию на β-глюкуронидазу.
По новым нормативным актам ЕС в ходе технологического процесса не требуется проводить анализ тушек птицы на микроорганизмы-индикаторы фекального загрязнения. Объясняется это тем, что исследования по оценке необходимости анализа на бактерии-индикаторы свидетельствуют о слабой корреляции их численности с санитарно-гигиеническим состоянием производства. Тем самым применение микробиологического анализа для верификации технологических процессов окажется неэффективным. В ходе обследования трех птицеперерабатывающих предприятий в Великобритании были определены коэффициенты вариации по разным микроорганизмам-индикаторам. Коэффициенты вариации для ОМЧ и представителей семейства Enterobacteriaceae оказались одними из самых низких, а погрешность измерений по большинству микроорганизмов была довольно высокой, особенно при небольшой их численности (менее 1,7 лог. ед.). Очевидно, что ошибки измерений легко могут выйти за пределы собственно измеряемых данных. Коме того, была выявлена довольно слабая корреляция между численностью бактерий-индикаторов на тушах и продолжительностью технологического процесса, хотя чистота технологического оборудования с течением времени явно лучше не становилась, а наоборот, ухудшалась.
4.5. ПРОЧИЕ МИКРООРГАНИЗМЫ-ИНДИКАТОРЫ
Использование в качестве индикаторов присутствия потенциально патогенных штаммов на бойнях Aeromonas и Listeria spp. рассмотрено главе 6. Для замороженного мяса важно выяснить, достаточно ли хорошо выживают обычные микроорганизмы-индикаторы фекального загрязнения при замораживании и хранении в замороженном состоянии. При импорте замороженного мяса желательно иметь такой микроорганизм-индикатор, который характеризовался бы такой же или еще большей выживаемостью, как и соответствующие патогенные микроорганизмы. Возможным кандидатом на эту роль являются энтерококки, иногда неточно называемые «фекальными стрептококками». Хотя не все эти грамположительные микроорганизмы ассоциированы с экскрементами теплокровных животных, некоторые их виды, включая Enterococcus faecalis и Enterococcus faecium, обычно присутствуют в кишечнике и, следовательно, могут обнаруживаться на готовых тушах. К сожалению, известно мало данных по степени контаминации туш, но с помощью применения соответствующих культуральных сред их не слишком сложно получить. Примером такой среды для определения численности энтерококков может служить M-Enterococcus-агар. Эта среда, которая в качестве селективного вещества содержит азид натрия, изначально использовалась вместе с мембранными фильтрами, но она подходит и для прямого посева на чашки. Селективность можно повысить путем инкубирования чашек при температуре 37 °С в течение 4 ч с последующим инкубированием при 44 ± 1 °С в течение 44 ч.
4.6. ИСПОЛЬЗОВАНИЕ Е. COLI
ДЛЯ ВЫЯВЛЕНИЯ ПУТЕЙ ПЕРЕКРЕСТНОЙ КОНТАМИНАЦИИ
Полезным способом оценки действенности санитарно-гигиенического контроля и обучения персонала является инокуляция туш или отдельных единиц оборудования легко идентифицируемыми микроорганизмами-маркерами с последующим их определением в других местах и помещениях бойни. В этих целях чаще всего используют непатогенный штамм Е. coli К12, стойкий относительно налидиксовой кислоты. Эта стойкость имеет хромосомную, а не плазмидную природу и, следовательно, она не может передаваться другим микроорганизмам, присутствующим на бойне. Количество микроорганизмов этого штамма может быть специфически определено на агаре МакКонки № 3, содержащем налидиксовую кислоту в количестве 200 мкг/мл. Туши инокулируют из культуры, выращенной в течение 24 ч при 37 °С и соответствующим образом разведенной. Микроорганизмы просто наносятся на поверхность туши широкой кистью (37 мм), покрывая площадь 250 см2 (для бараньих туш) или 500 см2 (для туш крупного рогатого скота). Тушки птицы обрабатывать удобнее, так как для инокуляции их можно снять с производственной линии. В этом случае используют метод инокуляции распылением, но проводят это подальше от производственной зоны во избежание ее случайной контаминации. Для выделения маркерного микроорганизма в конце испытаний с туш обычным способом отбирают пробы, а их разведение высевают на поверхность чашек с соответствующей селективной средой. Все операции должны проводиться в стерильных условиях с использованием для пробоотбора стерильных инструментов и одноразовых перчаток.
Применение микроорганизмов-маркеров на бойне для крупного рогатого скота показало, что упаковка в пакет иссеченного ануса уменьшает, но не предотвращает распространение микроорганизмов из инокулята, наносившегося в анальной зоне до съема шкуры. На другой бойне для мелкого рогатого скота инокуляция бараньих туш в одном-единственном месте привела к выделению этого маркерного микроорганизма в других местах. Тем не менее, когда оператор, отвечающий за съем шкуры, перед обработкой каждой туши мыл руки от кисти до плеча и фартук, а также использовал чистый нож, степень обсеменения значительно уменьшилась (Р< 0,001). На птицефабрике использование маркерных микроорганизмов показало, что при ручной зачистке кожи с шеек, если после обработки каждой тушки кисти рук ополаскивать в хлорированной воде, распространение этих микроорганизмов снижается.
Все вышесказанное – это просто примеры использования маркерных микроорганизмов, способные показать направления технологических инноваций. Так как эти методы относительно просты и не требуют сложного лабораторного оборудования, то их вполне целесообразно использовать для обучения и профессиональной подготовки производственного персонала основам пищевой микробиологии и контроля микробиологических рисков на бойне.

