6.1. ВВЕДЕНИЕ
Мясное сырье от здоровых животных неизбежно бывает контаминировано бактериями – как микроорганизмами, которые, если мясо не заморожено, могут размножаться на продукте, вызывая его порчу, так и патогенными микроорганизмами, вызывающими у людей пищевые отравления. Тем не менее вплоть до последнего десятилетия XX в. рутинный микробиологический контроль мяса можно было встретить очень редко. Заключение о микробиологической безопасности и стабильности свойств мяса при хранении делали по видимым признакам контаминации продукта, по общему внешнему виду мяса и, иногда, по его запаху. Стало очевидным, что такое традиционное обследование мяса явно не могло обеспечить контроль контаминации мяса патогенными микроорганизмами и стабильность свойств мяса при хранении в упаковке, способной существенно увеличить сроки годности при хранении мяса при температурах охлаждения, поскольку их невозможно было определить на основании обследования только внешнего вида и по запаху. Именно поэтому стало широко применяться проведение регулярных микробиологических исследований мяса на различных стадиях его переработки и сбыта. В настоящей главе мы рассмотрим цели и задачи отбора проб мясного сырья и соответствующие процедуры пробоотбора в зависимости от этих целей.
6.2. ЦЕЛИ И ЗАДАЧИ ТЕКУЩЕГО ОТБОРА ПРОБ
Регулярные микробиологические исследования мяса проводятся для принятия решения о приемке или отказе от тех или иных партий продукта (независимо от того, произведен ли он на месте или получен от поставщика), в целях разработки, валидизации и верификации системы НАССР или систем менеджмента качества (QM), а также в регламентирующих целях.
Цель микробиологического контроля при приемке заключается в получении данных, на основании которых можно было с достаточной уверенностью принять решение, является ли данная партия безопасной в микробиологическом отношении и достаточно ли продолжителен срок годности до появления признаков микробиологической порчи (с учетом предполагаемого использования и кулинарной обработки). Каждую партию можно, конечно, подвергнуть микробиологическому анализу как на безопасность, так и стабильность качества при хранении – это подразумевает отбор разных проб для этих двух целей (например, если для тестирования на патогены требуется вся проба целиком).
Кажется разумным, чтобы решение о приемке/неприемке зависело бы не только от теоретически желаемой степени уверенности, но и от ограничений, накладываемых на пробоотбор практическими условиями производства. Количество и объем отбираемых проб и тип возможных анализов должны определяться возможностью обработки проб, затратами на пробоотбор и его удобством, а не теоретическими соображениями. Выбор процедуры пробоотбора во многом зависит от времени, необходимом для проведения анализов – многие виды мясного сырья не могут долго храниться без риска того, что их качество и/или срок годности станут неприемлемыми для потребителя, то есть необходимо учитывать и экономические моменты.
Микробиологическое исследование в целях принятия решения о приемке/неприемке отдельных партий продукта само по себе не предотвращает возможность производства или поставки неприемлемых партий. Несмотря на то, что после выявления неприемлемых партий продукта можно предпринять определенные действия по предотвращению появления подобного брака, на современных высокоскоростных технологических линиях и в огромных дистрибьюторских сетях до появления результатов анализа довольно большая доля продукта может быть выпущена с неприемлемым микробиологическим качеством. Следовательно, процедурам последовательного выявления и отклонения продукта следует предпочесть такие системы контроля и управления производством, хранением и сбытом, которые не допускают выпуска некачественного продукта.
Системы менеджмента качества и НАССР внедряют для гарантии того, чтобы производились только качественные продукты. Системы QM предназначены для контроля коммерчески важные показателей качества продуктов, тогда как системы НАССР – для гарантии их безопасности. Что касается микробиологического качества мясного сырья, то системы QM и НАССР используются, соответственно, для контроля присутствия в продукте микроорганизмов порчи и патогенных микроорганизмов, но все равно в определенных обстоятельствах одни и те же микробиологические данные могут использоваться и для того, и для другого. Тем не менее следует четко придерживаться указанного формального разделения этих систем, так как показатели качества могут меняться с изменением коммерческой ситуации и потребительских ожиданий, но безопасность продукта при этом страдать не должна. Как бы то ни было, но на практике системы QM и НАССР часто путают.
В целях управления технологическим процессом отбор проб для микробиологического анализа продукта может предприниматься еще в ходе разработки систем контроля – это помогает определить, где именно численность контролируемых бактерий существенно возрастает или снижается. Технологические участки, где происходит такое существенное повышение или снижение численности микроорганизмов, выделяются как критические контрольные точки (ККТ). Желательно определять ККТ именно объективно, поскольку субъективная оценка технологического процесса, рекомендованная нормативными документами по разработке системы НАССР, может не позволить правильно определить влияние отдельных технологических операций на микробиологическое состояние перерабатываемого сырья. Если оно точно не известно, то ККТ могут быть определены ошибочно, то есть вся система, разработанная для контроля степени микробиологической контаминации, окажется неэффективной.
Отбор проб для микробиологического исследования может предприниматься также для валидизации ККТ и объективной проверки действенности системы контроля. Валидизация ККТ отдельного технологического процесса необходима, поскольку невозможно надежно гарантировать, что конкретные операции или виды обработки, эффективные в лабораторных условиях, окажутся такими же эффективными в производственных условиях. Кроме того, желательно провести верификацию средств контроля путем определения микробиологического состояния продукта, полученного по конкретной технологии, поскольку сбои в контроле бывает невозможно выявить ни проверкой соответствующей документации, ни инспекцией собственно технологического процесса, ни тем и другим одновременно. Кроме того, верификация с помощью микробиологического исследования может объективно подтвердить микробиологическое качество продукта независимым органом.
Несоответствие критериям верификации при четком выполнении соответствующих технологические операций должно инициировать взятие проб продукта с различных технологических участков в целях выявления той(тех) операции(ий), где произошел сбой в контроле, и валидизации соответствующих корректирующих воздействий. Практикуют также отбор проб продукта до и после какой-либо технологической модификации для определения ее воздействия на микробиологическое качество продукта. В общем, по мере внедрения технологических стандартов и эффективного их контроля относительно контаминации микроорганизмами объем микробиологических исследований в целях управления технологическим процессом должен сокращаться.
Начиная с середины 1990-х гг., регламентирующие органы большинства развитых стран выпустили нормативные акты, требующие внедрения систем НАССР на мясоперерабатывающих предприятиях. После этого можно было бы ожидать, что микробиологические анализы, связанные с инспекцией мясного сырья, будут пересмотрены так, чтобы они способствовали внедрению и эффективной работе систем НАССР. Казалось бы, именно это и было целью требований к отбору проб с мясных туш, говядины, предназначенной для измельчения, и говяжьего фарша, так как если микробиологические показатели будут не удовлетворительными, то необходимо будет пересмотреть всю систему НАССР. Увы, разработанные ранее микробиологические показатели представлены как результат анализов на преемлемость, так что при несоответствии данному показателю вся партия может быть отбракована. Тем самым, некоторая путаница между микробиологическими показателями для работы системы НАССР и микробиологическими анализами при приемке партий мясного сырья и продуктов заложена уже в действующих нормативных документах.
6.3. КОНТРОЛИРУЕМЫЕ МИКРООРГАНИЗМЫ
К микроорганизмам, которые являются «целевыми» при микробиологическом исследовании мяса, то есть подлежащими контролю, относятся их группы, обычно присутствующие в аэробной или анаэробной микробиоте порчи, специфические микроорганизмы, вызывающие ускоренную порчу продукта или необычные ее формы, специфические патогенные микроорганизмы, а также группы микроорганизмов-индикаторов возможного присутствия патогенных микроорганизмов или микроорганизмов порчи.
Микробиологическое исследование мяса на присутствие микроорганизмов порчи обычно выполняют только в тех случаях, когда требуется установить причины неожиданной порчи продукта или найти способы увеличения срока годности. Испорченный продукт можно анализировать на присутствие таких групп микроорганизмов, как псевдомонады или энтеробактерии, а также на такие специфические микроорганизмы, как Shewanella putrefaciens, Brochothrix thermosphacta или Clostridium estertheticum. Из продуктов, подлежащих переработке, впоследствии можно взять пробы для определения численности микроорганизмов, вовлеченных в неожиданные или слишком рано проявившие себя процессы порчи, – это поможет выяснить, стала ли эта порча следствием необычной или слишком сильной контаминации продукта этими микроорганизмами.
Стандартное микробиологическое исследование мясного сырья на специфические бактериальные патогенны проводится главным образом в целях выявления Salmonella или Escherichia coli О157 : HI – энтерогеморрагического штамма Е. coli, носителем которого является крупный рогатый скот. Этот штамм не вызывает заболеваний крупного рогатого скота, однако он стал причиной пищевых отравлений из-за употребления говяжьего фарша в Северной Америке и Европе. Исследование на присутствие других патогенных бактерий, нативных для мяса, в частности, Yersinia enterocolitica и Listeria monocytogenes, обычно проводят только в тех случаях, когда исследуют причины вспышек пищевых отравлений, вызванных этими микроорганизмами, или по запросам торговли относительно рисков использования возможно контаминированного мясного сырья в приготовлении блюд, готовых к употреблению.
Помимо микробиологических исследований на присутствие патогенных бактерий, проводят анализы некоторых виды мяса на наличие паразитов, вызывающих трихинеллез. Мышечные ткани могут быть заражены личинками Trichinella spp., которые при употреблении зараженного мяса в пищу могут передаваться новым «хозяевам». Классический цикл развития трихинеллеза подразумевает заражение людей и свиней Т. spiralis в результате употребления в пищу инфицированной свинины. В тех регионах, где у домашних свиней продолжает встречаться инфицирование Т. spiralis, подозрительные свиные туши должны исследоваться на наличие этого паразита. Кроме того, мышечная ткань каждой конской туши, предназначенной для потребления человеком, в странах ЕС должна быть исследована под микроскопом на присутствие личинок Trichinella (известно, что вспышки заболеваемости трихинеллезом могут вызываться потреблением зараженной конины).
В основном отбор проб мяса проводят в целях определения численности микроорганизмов-индикаторов, то есть таких групп микроорганизмов, которые свидетельствуют о присутствии видов, ставящих под угрозу безопасность пищевых продуктов или стабильность их свойств при хранении, родственных им, или которые ведут себя сходным образом или происходят из одного и того же источника. Большинство или даже все микроорганизмы-индикаторы могут быть непатогенными, играть относительно слабую роль в процессе порчи или вообще не иметь к ней никакого отношения.
Чаще всего мясо исследуют на присутствие микроорганизмов-индикаторов, выделяемых на неселективных агаровых средах, которые инкубируют аэробно при заданной температуре в течение заданного времени, после чего подсчитывают общую численность видимых колоний микроорганизмов (ОМЧ). Количество жизнеспособных аэробных микроорганизмов обычно выражают как численность аэробных микроорганизмов, полученную методом чашечного подсчета (ЧАМ), причем могут использоваться разные температуры и продолжительность инкубирования (обычно применяют температуру 35 °С и инкубирование в течение 48 ч, хотя зачастую для микробиоты порчи предпочтительны более низкие температуры и большая продолжительность инкубирования, так как некоторые микроорганизмы порчи плохо или вообще не размножаются при температурах выше 30 °С ).
Показатель ЧАМ может применяться для определения численности не только аэробной микробиоты порчи, но и тех микроорганизмов порчи, которые развиваются в анаэробных условиях (типичных, в частности, для вакуумной упаковки), так как большинство микроорганизмов, размножающихся в этих условиях, являются аэротолерантными или факультативно анаэробными*. Условия инкубирования подбирают так, чтобы ограничить диапазон выделяемых видов и получить тем самым численность микроорганизмов, отличную от полученной подсчете ОМЧ. Например, для определения численности психротрофных микроорганизмов температуру инкубирования можно уменьшить до 7 °С и вести его в течение 10 сут, а для исключения роста строго аэробных микроорганизмов инкубирование можно проводить в анаэробных условиях.
Показатели ЧАМ широко используют для оценки качества микробиологического контроля в ходе разделки туш и последующей переработки мяса, а также для оценки стадии развития микробиоты порчи в пищевом продукте. Тем не менее, на любой стадии переработки или хранения мяса никакой очевидной связи между ЧАМ и численностью патогенных бактерий не существует, как не существует очевидной связи и между ЧАМ и численностью микроорганизмов порчи (до тех пор, пока микроорганизмы порчи в результате их размножения не стали численно преобладать) (рис. 6.1). Таким образом, значимость показателя ЧАМ применительно к безопасности мяса и стабильности его свойств при хранении довольно сомнительна.
________________________________________
* В санитарно-эпидемиологических нормативах РФ и ГОСТах используется аббревиатура КМАФАМ, соответствующая количеству мезофильных аэробных и факультативно анаэробных микроорганизмов, определяемому подсчетом колоний, выросших в агаризованной среде в чашках Петри при температуре 30 °Св течение 3 сут. — Примеч. перев.
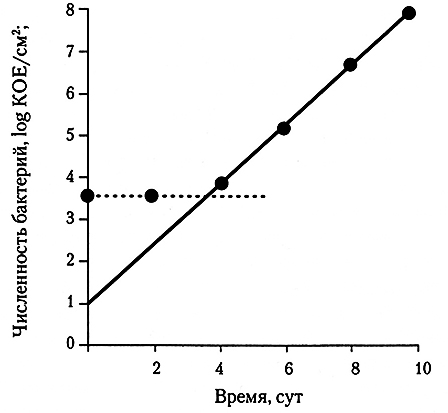
Рис. 6.1. «Отложенный» рост ЧАМ: (•) при развитии микробиоты порчи мяса при температурах охлаждения;
(–) – психротрофные микроорганизмы; (–) – мезофильные микроорганизмы
Обычно считают, что наиболее опасными микроорганизмами, выявляемыми в мясе, являются те, что ассоциируются с фекальным загрязнением продукта, в связи с чем рекомендуется оценивать микробиологическую безопасность мяса по численности бактерий, служащих показателями фекального загрязнения.
К группам микроорганизмов, подсчитываемым в этих целях, относятся бактерии семейства Entervbacteriaceae, колиформы, фекальные колиформы и Е. coli. Взаимосвязь между численностью бактерий первых двух групп и фекальными микроорганизмами может быть неопределенной, так как в обе эти группы входят микроорганизмы из окружающей среды и микроорганизмы порчи, так что по численности они могут превышать численность фекальных микроорганизмов, присутствующих в мясе. К фекальным колиформам, то есть колиформам, которые в ходе своего роста и размножения продуцируют при 44,5 °С кислоту из лактозы, относятся некоторые виды, отличные от Е. coli. Так как уже разработаны методы прямого подсчета Е. coli, то обычно в пробах мяса определяют именно этот микроорганизм, а не менее специфичные фекальные колиформы (подробнее об этом см главу 4).
К другими микроорганизмам-индикаторам, потенциально полезным для оценки микробиологического качества мяса, относятся бактерии родов Aeromonas и Listeria spp. Аэромонады могут в большом количестве размножаться в воде, остающейся на поверхности или внутри элементов оборудования мясокомбинатов, тогда как листерии, очевидно, типичны для микробиоты, ассоциированной с различным мусором и грязью в оборудовании, канализации и арматуре мясокомбинатов. Таким образом, контаминация мяса этими микроорганизмами может указывать на источники потенциального заражения патогенными Aeromonas hydrophila или L. monocytogenes.Несмотря на то что микробиологический эффект условий охлаждения, хранения, транспортировки и выкладки мяса в месте его реализации на состав микробиоты можно оценить путем выделения бактерий из готовых мясопродуктов, зачастую удобнее оценивать его путем расчета потенциального роста патогенных микроорганизмов и/или микроорганизмов порчи по так называемой «температурной истории» продукта. Увеличения численности бактерий в мясе в ходе этих четырех технологических циклов можно почти полностью избежать или предотвратить с помощью упаковки продукта. Тем не менее будет наблюдаться рост психротрофных микроорганизмов порчи, вполне вероятен рост психротолерантных и возможен рост мезофильных патогенов (особенно в ходе охлаждения продукта). Увеличение численности этих трех групп микроорганизмов зависит от температурных условий и может быть рассчитано по «температурной истории» продукта с помощью уравнения, описывающего зависимость скорости роста каждого микроорганизма-индикатора от температуры. Поскольку «температурные истории» обычно можно получить без особого труда, а обработать их можно быстрее, чем провести микробиологическое исследование, то такие методы интегрирования функций температур дают относительно быстрый способ оценки микробиологического эффекта от регулирования и контроля температуры мяса. Если оказывается, что расчетный рост бактерий слишком велик, то проводится проверка температурной истории, в ходе которой, как правило, выясняется, что на той или иной стадии произошел сбой в управлении температурным режимом. После этого ясно, чему именно следует уделить больше внимания.
6.4. ПЛАНЫ ОТБОРА ПРОБ
План отбора проб может быть простым и представлять собой план отбора проб со всех продуктов, производимых в ходе некоторого технологического процесса или получаемых от некоторого поставщика. В тех случаях, когда для валидизации контроля обсеменения говяжьих туш требуется исследование на наличие Е. coli О157: Н7, такой отбор проб некоторыми регламентирующими органами требуется производить на небольших фасовочно-упаковочных агрегатах. Кроме того, некоторые производители котлет для гамбургеров осуществляют микробиологический анализ всех поставляемых им говяжьих мясных блоков на Е. coli О157 : H7. Тем не менее обычно микробиологическое исследование подразумевает отбор небольшого количества случайных проб из данной партии.
При микробиологическом исследовании «на приемлемость» планы отбора проб могут строиться по качественным или количественным признакам. Когда бактерии обнаружены, но их численность не известна, пробы могут различаться лишь по наличию или отсутствию целевого микроорганизма. Следовательно, такие данные должны собираться и интерпретироваться соответственно плану отбора проб по качественным признакам. Если же численность микроорганизмов в пробах определена (посевом на чашки или методом наиболее вероятного числа, НВЧ), то такие данные можно собирать и интерпретировать согласно планам отбора проб и по качественным, и по количественным признакам.
Чтобы численность бактерий можно было рассматривать в качестве качественного признака, необходимо определить критерии «приемлемости» и «неприемлемости». По планам, основанным на двухпараметрической оценке качественных признаков, численность микроорганизмов ниже некоторой заранее определенной величины (m) считается приемлемой, а равная или превышающая m –неприемлемой. В таком плане для принятия решения относительно приемлемости или неприемлемости данной партии должно быть точно определено число проб (n), подлежащих анализу, а также число проб (с) с неприемлемой численностью микроорганизмов для каждой в целом приемлемой партии. Планы отбора проб для последующего анализа в целях лишь выявления микроорганизмов по качественным признакам обязательно являются двухпараметрическими.
В трехпараметрических планах отбора проб по качественным признакам эти три параметра определяются двумя заранее заданными значениями численности микроорганизмов. Их численность, равная или меньше значения (т), считается полностью приемлемой, численность, равная или превышающая значение (М), считается полностью неприемлемой, а значения в диапазоне между m и М считаются условно приемлемыми (партия будет считаться приемлемой, если ни в одной пробе численность бактерий не будет превышать значения М ив некотором количестве проб n, необходимом для принятия решения, количество проб с численностью микроорганизмов в диапазоне между m и М не превышает заранее определенного числа с).
Для планов отбора проб в целях последующего анализа по количественным признакам данные относительно численности микроорганизмов анализируются исходя из допущения, что их распределение в том или ином продукте соответствует некоторой известной модели. Для мяса подобное распределение считается нормальным логарифмическим, то есть для некоторого множества случайных данных о численности микроорганизмов в продукте их логарифм будет характеризоваться нормальным распределением. Следовательно, на этом нормальном распределении может быть основан статистический анализ данных, в результате которого делается заключение о степени приемлемости продукта.
Для планов отбора проб по качественным признакам (оценки «приемлемости») устанавливают количество проб n, требуемое для принятия решения, допустимую долю «не совсем приемлемых» проб р, численность микроорганизмов в которых «не совсем приемлема», и самую низкую возможную вероятность Р отказа от приемки неприемлемого продукта. По этим заданным значениям рассчитывают коэффициент k1, а для каждого множества логарифмических значений – среднее х и стандартное отклонение s. В этом случае, когда логарифмы численности микроорганизмов, превышающие некоторое значение V, «не совсем приемлемы», то продукт считается неприемлемым, если + k1s больше V.
При отборе проб в целях управления технологическим процессом необходимо допустить, что в перерабатываемом продукте формируется отдельная популяция микроорганизмов и что их распределение в продукте или на его поверхности соответствует некоторой известной модели (для мяса, как мы уже отмечали, предполагается нормальное логарифмическое распределение). В этом случае популяция любой группы микроорганизмов на продукте на любой технологической стадии полностью описывается параметрами этой популяции относительно среднего логарифмического и стандартного отклонения. Их значения можно рассчитать с приемлемой достоверностью по численностям микроорганизмов, выделенных из относительно небольшой группы случайных образцов. Затем рассчитанные параметры популяции можно использовать для сравнения численности микроорганизмов в продукте на любой технологической стадии –например, до и после каждой ККТ. Тем не менее по рассчитанным средним логарифмическим х нельзя сравнивать численность микроорганизмов в продукте, так как при прохождении продуктом разных технологических стадий микроорганизмы характеризуются разным распределением, причем с уменьшением дисперсии между отдельными пробами. Таким образом, значения, рассчитанные по стандартному отклонению логарифмических значений s, на последующих стадиях технологического процесса, используемого для приготовления мясопродуктов, по всей вероятности будут снижаться. Это уменьшение дисперсии приведет к увеличению значений х, даже если микроорганизмы в продукт не вносились дополнительно (рис. 6.2). Следовательно, сравнение значений х может привести к ошибочному заключению, что численность микроорганизмов в продукте в процессе переработки возросла, тогда как в действительности она не изменилась.
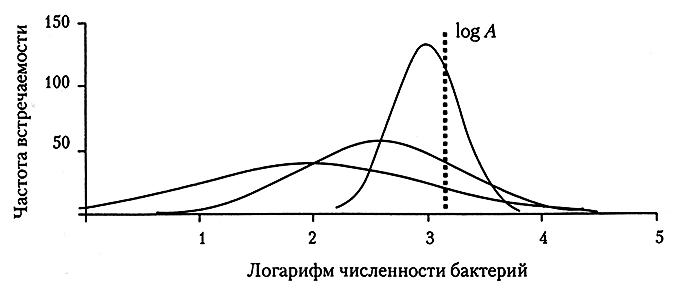
Рис. 6.2. Различные распределения бактерий на мясе
при одном и том же логарифме средних значений (log А)
Если численность микроорганизмов не изменилась, то средние значения их численности в продукте в ходе переработки не меняются. Логарифм средних значений (log А) можно рассчитать по формуле log A = x + logn10 (s2/2), после чего относительно значений log А можно будет сравнивать численность микроорганизмов в продукте на различных технологических стадиях его производства.
6.5. МЕСТА ОТБОРА ПРОБ
Несмотря на то, что иногда в качестве пробы можно взять продукт целиком, например, цельную котлету для гамбургера, зачастую метод отбора проб и/или размер
исследуемого объекта не позволяют использовать в виде пробы продукт целиком. В таком случае необходимо определить места для взятия проб. Пробы можно отбирать с одного или нескольких мест, наиболее репрезентативных относительно всего продукта, – как потенциально наиболее контаминированных, так и методом случайной выборки. Что касается относительно небольших изделий типа отрубов или кусковых полуфабрикатов для реализации в системе розничной торговли, пробу берут с одного места, считающегося наиболее репрезентативным, но если продукт характеризуется сильным жировым покровом, то пробы такого продукта берут как с жировой, так и с постной поверхности.
Что касается крупных мясных изделий, где невозможно выделить места с потенциально сильной контаминацией, отбор проб можно проводить с разных репрезентативных участков или методом случайной выборки. Например, пробы с говяжьего мясного блока можно отбирать путем вырезания отверстий и взятия пробы из центральной части блока, а также путем отрезания нескольких кусков с краев блока; кроме того, пробы можно брать путем отрезания частей мясного блока, выбранных случайным образом. И наоборот, обычной практикой стал отбор проб с туш в местах с известной, зачастую самой сильной контаминацией – с голяшки, заднетазовой части говяжьей туши, грудины и шеи, а пробы из коробок с блоками мяса горячей обвалки часто берут из их геометрического центра, поскольку наиболее интенсивный бактериальный рост и, соответственно, самая высокая численность микроорганизмов наблюдаются в зоне, хуже всего доступной для действия низких температур.
Обоснованием для выбора этих мест отбора проб, которые, как предполагается, являются наиболее контаминированными микроорганизмами, является то, что «раз даже они являются микробиологически приемлемыми, то и микробиологическое состояние других частей будет также удовлетворительным». Вместе с тем у такого мясного сырья, как говяжьи туши, их часть, подвергаемая микробиологическому исследованию, составляет лишь очень небольшую долю общей площади поверхности. Микробиологическое состояние остальной части туши, следовательно, может быть как намного, так и чуть лучше, чем на выбранных участках. Тем самым оценки микробиологического состояния продукта, основанные на одних и тех же данных, могут существенно различаться и определяться зависимостью, существующей между степенью микробиологической обсемененности выбранных участков и остальной части туши.
Для расчета средней численности бактерий в продукте необходимо использовать выборку мест отбора проб и товарных единиц, применяя, например, координатную сетку для последующего выбора мест методом случайных чисел (рис. 6.3). В противном случае перенос микроорганизмов с сильно контаминированных участков на менее контаминированные может создать ложное впечатление о снижении их общей численности (если первоначально пробы брались только с сильно обсемененных участков туш). Тем не менее место или места пробоотбора можно намечать при разработке технологических операций, затрагивающих данную часть туши. В таком случае предполагается, что выбранное место отбора пробы является репрезентативным для всех мест в зоне воздействия данной технологической операции. Разница в средних значениях логарифма численности бактерий на этом участке до и после технологического воздействия демонстрирует его «микробиологическое действие» на избранный участок, но без учета площади общей поверхности или массы изделия не дает представления о последствиях для изделия в целом.
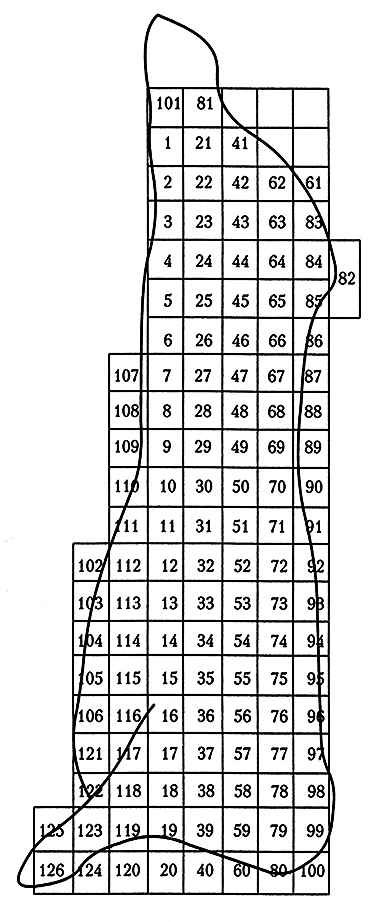
Рис. 6.3. Координатная сетка для выбора мест отбора проб
с боковой поверхности говяжьей туши методом случайных чисел
6.6. МЕТОДЫ ОТБОРА ПРОБ
Поскольку мышечные и жировые ткани здоровых животных обычно стерильны, то мясные изделия из неповрежденных тканей могут быть контаминированы микроорганизмами только поверхностно. Следовательно, отбор проб для микробиологического анализа таких тканей должен производиться с учетом выделения бактерий с поверхности мясопродукта. С другой стороны, бактериями могут оказаться контаминированы ткани и поверхности некоторых внутренних органов животных – в частности, печень, и бактерии переносятся в мышечную ткань при механической обработке (отбивании) или при шприцевании рассолом. Численность бактерий во внутренних тканях таких продуктов всегда будет меньше, чем на поверхности, причем состав микробиоты на поверхности и в глубинных тканях обычно одинаков (по крайней мере, изначально). С учетом вышесказанного, если не требуется специально определять численность микроорганизмов в глубоких тканях, то микробиологическое исследование мясопродуктов подразумевает только выделение бактерий с их поверхности.
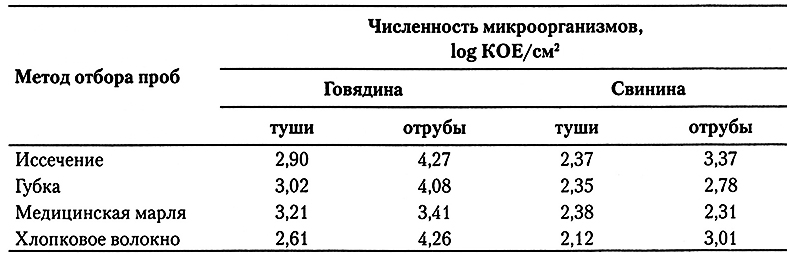
Пробы с поверхности обычно берут методом иссечения части поверхностной ткани или с помощью смыва с части или всей поверхности мяса. Обычно считается, что методом иссечения выделяется больше бактерий на единицу поверхности, чем с помощью смыва, однако если использовать тампон из соответствующего материала, то количество микроорганизмов, выделенных обоими методами, будут сходными (табл. 6.1). Для выделения бактерий со всех типов мясной поверхности можно применять умеренно абразивные и впитывающие материалы типа синтетических губок. Умеренно абразивные, но не впитывающие материалы типа медицинской марли или сырных салфеток (для прессования сыров) рекомендуется применять для выделения микроорганизмов с поверхности туш, но не с отрубов. Впитывающие, но не абразивные материалы типа растительного волокна (хлопкового или из водорослей), могут оказаться достаточно эффективными для выделения бактерий с поверхностей отрубов, но не с поверхности туш. Различие между материалами для выделения бактерий с поверхности туш и отрубов, возможно, является следствием того, что на поверхности туши мало участков надрезанных мышц и она зачастую сухая (именно поэтому требуются абразивные свойства, позволяющие удалить некоторое количество поверхностного материала вместе с присутствующими на нем бактериями). Мясные же отрубы, наоборот, характеризуются обычно большей площадью надрезанной мышечной ткани с разрушенными мышечными волокнами, и бактерии могут проникать между ними на глубину 1-2 мм. Более того, поверхность мышечной и жировой ткани обычно бывает влажной, так что выделение бактерий с таких поверхностей лучше производить с помощью впитывающих материалов.
Таблица 6.1.
Общая численность аэробных микроорганизмов, выделенных из говяжьих и свиных туш
или отрубов методами иссечения и смыва (с помощью губок из ацетата целлюлозы,
медицинской марли или ватных палочек)
Обычно площадь для взятия проб смывом ограничивают с помощью стерильного трафарета или используют специальные приспособления для выемки цилиндра фиксированного размера (для взятия проб иссечением). Поскольку численность бактерий оценивают по логарифмической шкале, то количество жизнеспособных микроорганизмов в ходе их роста или подавления активности меняется экспоненциально, так что некоторый разброс значений в зоне отбора проб несильно влияет на численность выделяемых бактерий в лог. ед. Кроме того, точное определение границ зоны отбора проб трафаретом мало что дает и в определенных обстоятельствах (в частности, при отборе проб с туш на высокоскоростных линиях) может быть практически невыполнимо. В этой связи точное определение зоны отбора проб является излишним и зачастую нецелесообразным.
При использовании метода иссечения площадь для отбора пробы обычно ограничивают участком поверхности не более 100 см2, а при взятии проб смывом площадь участка отбора пробы может быть любого удобного и целесообразного размера. Хотя для относительно многочисленных бактерий, например, аэробных, объем выборки может не иметь особого значения, при выявлении относительно редких микроорганизмов-индикаторов и их количественном определении желательно использовать большие выборки. Кроме того, взятие пробы смывом проводится быстрее, чем методом иссечения, с использованием более простых приспособлений и без повреждения изделия, с которого берутся пробы. Тем самым можно считать, что в большинстве случаев отбор проб с поверхности мяса методом смыва предпочтительнее, чем метод иссечения.
Если микробиологическому исследованию подвергается микробиота глубинных тканей неизмельченного мяса, то перед взятием пробы необходимо простерилизовать его поверхность, предотвращая тем самым возможность занесения в глубинные ткани микроорганизмов с поверхности. Для этого может оказаться достаточным прижигания поверхности до глубины 3 мм с использованием горячего шаблона, однако при влажной поверхности мяса, когда следует полностью исключить возможность внешней контаминации пробы, может потребоваться вырезание части мяса, помещение его в кипящую воду, последующее осушение перед прижиганием поверхности и затем – иссечение глубинной ткани. Адекватность того или иного способа асептического отбора проб оценивают путем взятия пробы с неповрежденной стерильной мышечной ткани с последующим сравнением результатов анализа.
Что касается измельченного мяса и мясного фарша, то поскольку бактерии распределены по всему их объему, пробы такого продукта обязательно представляют собой порции мяса. В случае анализа мясного сырья для последующего измельчения из предназначенных для переработки и отобранных методом случайной выборки кусков изымают середину, измельчают, а затем требуемые порции мясного фарша направляют на микробиологическое исследование.
6.7. МЕТОДЫ ОБНАРУЖЕНИЯ
И КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ БАКТЕРИЙ
Пробы, полученные смывом, иссечением ткани или отбором порции измельченного продукта, вымачивают в соответствующем объеме растворителя. Требуемая степень однородности пробы обеспечивается лопаточным гомогенизатором, в который помещают пробу и растворитель в прочном пакете из полимерной пленки, так что под воздействием лопастей проба и растворитель активно перемешиваются, оставаясь в пакете. В качестве растворителя обычно используют буферный или питательный раствор (фосфатный разбавитель Баттерфилда или пептонную воду). Вместе с тем если целью анализа является обнаружение патогенного микроорганизма, а не определение численности микроорганизмов-индикаторов, то пробу можно вымочить в обогатительном бульоне или бульоне для предварительного обогащения.
При работе с пробами мышечной ткани количество добавляемого растворителя в миллилитрах обычно равно девятикратной массе пробы в граммах. Таким образом, исходный препарат представляет собой десятикратное разведение пробы. При работе с пробами, взятыми смывом, такой же объем растворителя может использоваться с тампоном определенного типа безотносительно к площади поверхности тампонирования. Соответственно, численность бактерий, присутствующих в 1 мл жидкости, должна соответствовать количеству, выделяемому с площади 100 см2 и более. Тампон из впитывающего материала типа губки удерживает существенную часть общего количества жидкости. При использовании тампона из невпитывающего материала типа медицинской марли количество удерживаемой им жидкости (если его выжать при выемке из контейнера после вымачивания) будет незначительным.
Количественное определение бактерий проводится:
- поверхностным, глубинным или спиральным посевом на чашки Петри с соответствующей агаровой средой при использовании неразведенной или надлежащим образом разведенной суспензии пробы;
- посевом жидких проб на коммерчески поставляемые готовые пластинки с сухими питательными и желирующими компонентами, а также (в некоторых случаях) селективными веществами;
- применением метода НВЧ при использовании пробирок с неселективным или селективным бульонами;
- методом фильтрования через мембранный фильтр с нанесенной гидрофобной сеткой (HGMF), подразумевающим фильтрацию жидкости через мембранные фильтры, верхняя поверхность которых поделена на квадраты линиями из гидрофобного материала, с последующей инкубацией фильтров на соответствующих агаровых средах.
Все эти методы посева на чашки подходят для количественного подсчета бактерий в тех случаях, когда их численность в суспензиях, приготовленных из проб, относительно высока. Однако на агаровую пластину можно обычно нанести не более 1 мл жидкости, и поэтому в случае немногочисленности целевых бактерий следует отдавать предпочтение методу НВЧ – в этом случае при необходимости весь объем жидкой пробы может быть распределен по пробиркам. Процедура фильтрования HGMF также сводится к методу НВЧ, поскольку подсчитывают количество квадратов с колониями микроорганизмов после инкубации фильтров, причем в любом квадрате может присутствовать более одной колонии. Что касается жидкостей из вымоченных мышечных тканей, то чувствительность метода HGMF не обязательно будет выше, чем при посеве на чашки, так как забивка фильтра взвешенным в жидкости материалом ограничивает объем фильтруемой неразведенной жидкости до 1 мл и (в большинстве случаев) менее. Тем не менее в случае проб, взятых смывом, зачастую оказывается возможным отфильтровать всю неразведенную полученную смывом жидкость. В этом случае чувствительность определяется только площадью поверхности продукта, доступной для тампонирования и взятия пробы на практике.
В целях обнаружения патогенного микроорганизма пробу сначала инкубируют в неселективном бульоне, который может содержать вещества, восстанавливающие поврежденные клетки с последующим обеспечением их жизнеспособности. Затем одна или больше порций этой среды для предварительного обогащения переносится не менее чем в один обогатительный бульон, в котором рост и размножение целевого микроорганизма поддерживается сильнее, чем рост других присутствующих в пробе бактерий. В качестве альтернативы пробу можно инкубировать непосредственно в обогатительном бульоне (в том случае, если можно пренебречь возможностью существования поврежденных клеток, способных ингибироваться селективными веществами бульона). После инкубации селективного бульона его части распределяют по одному и более селективным агарам, позволяющим получить колонии с типичными для данного патогенного микроорганизма признаками. Предположительно патогенные бактерии, выделенные из таких колоний, должны быть подтверждены с помощью дополнительных исследований.
Патогенные микроорганизмы могут быть обнаружены также в обогатительной среде методами иммуноферментного анализа, латекс-агглютинации, анализа с использованием иммуномагнитных частиц, выявлением специфической ДНК методом полимеразной цепной реакции (ПЦР) или с помощью иных иммунологических или генетических методов, для которых разработаны доступные на рынке тест-наборы и праймеры. Продолжительность анализа такими методами на наличие в пробе того или иного патогена обычно существенно меньше, чем в случае использования типовых методов выделения и подтверждения их результатов биохимическими анализами.
6.8. ИНТЕРПРЕТАЦИЯ ДАННЫХ
Отбор проб в целях определения «приемлемости» и оценки возможного присутствия в мясном сырье кишечных патогенов, в частности, Е. coli О157 : Н7, зачастую состоит в исследовании на данный патоген единичной или смешанной пробы из партии.Понятие партии может варьировать от одной туши или мясного блока до суточной продукции крупного мясоперерабатывающего предприятия. Так как встречаемость кишечных патогенов на мясном сырье обычно невелика, существует очень малая вероятность выделения патогенных организмов из единичной пробы контаминированной партии в отличие от тех случаев, когда этот патоген однородно распределен по всему продукту и в любой пробе он наверняка будет обнаружен. Распределение бактерий в мясном сырье никогда не бывает однородным, и обнаружение целевого организма при его присутствии в пробе всегда довольно проблематично. Таким образом, несмотря на то что обнаружение патогенного микроорганизма в пробе свидетельствует о контаминации данной партии продукта и может служить основанием для отказа от ее приемки, сам факт не выявления патогена еще не может служить надежным доказательством микробиологической чистоты партии (табл. 6.2).
Таблица 6.2.
Количество проб, требуемых для выявления микроорганизма с вероятностью 0,90 и выше,
в случаях, когда данный микроорганизм присутствует в менее чем 10% проб

К сожалению, и в коммерческой, и в регламентирующей деятельности не обнаружение патогенного микроорганизма зачастую считается доказательством его отсутствия в данной партии на момент отбора пробы. Если этот патоген обнаруживают впоследствии или он приводит к пищевому отравлению, то часто предполагают, что контаминация произошла после отбора проб, что может быть ошибочным. Следовательно, микробиологический контроль отдельных партий продукта на патогенные микроорганизмы, редко выделяемые из мясного сырья, для выявления контаминированных и микробиологически чистых партий практически непригоден. Такой анализ, тем не менее, позволяет необоснованно предполагать, что в данной партии целевой микроорганизм отсутствует, из-за чего поиск источников или причин контаминации, выявленной при последующей технологической переработке или при употреблении продукта в пищу, может быть направлен по ложному пути.
Хотя увеличение числа проб в каждой партии продукта должно повысить вероятность обнаружения редко встречающихся патогенных микроорганизмов, любое практическое увеличение числа проб дает возможность выявления лишь очень небольшого количества контаминированных партий, допуская приемку их большинства. Даже при достаточно часто встречающемся в некоторых видах мясного сырья микроорганизме (например, Salmonella) и при взятии нескольких проб из партии в соответствии с планом их отбора по качественным признакам, вероятность приемки партии с недопустимым уровнем контаминации является довольно высокой.
Микробиологический анализ партий некоторых видов мясного сырья (охлажденного, в вакуумной упаковке), транспортируемого морем на отдаленные рынки сбыта, может выполняться заказчиками по прибытии товара; как правило, его целью является принятие решения об остаточном сроке годности. Такой анализ обычно распространяется только на определение численности аэробных микроорганизмов в пробах, взятых смывом, в пробах иссеченной ткани или в мясном соке. Критерием для приемки зачастую является факт не превышения численностью микроорганизмов, присутствующих на 1 см2, в 1 г или 1 мл одной или нескольких проб, известного предельно допустимого значения. Результаты любого такого исследования можно правильно соотнести с микробиологическим состоянием партии в целом только в тех случаях, когда точно известна взаимосвязь между численностью выявленных бактерий и остаточным сроком годности. Кроме того, к моменту получения партии должно быть известно распределение бактерий в данном продукте или о нем можно сделать корректное предположение (это позволяет оценить долю товарных единиц в возможно неприемлемым сроком годности). Специальная информация по этим вопросам очень часто отсутствует или ее бывает недостаточно, так что на практике партию зачастую бракуют, если численность микроорганизмов в любой пробе превышает предельно допустимое значение. На основе такого подхода риск ошибочного решения относительно срока годности продукта в данной партии может быть очень высоким.
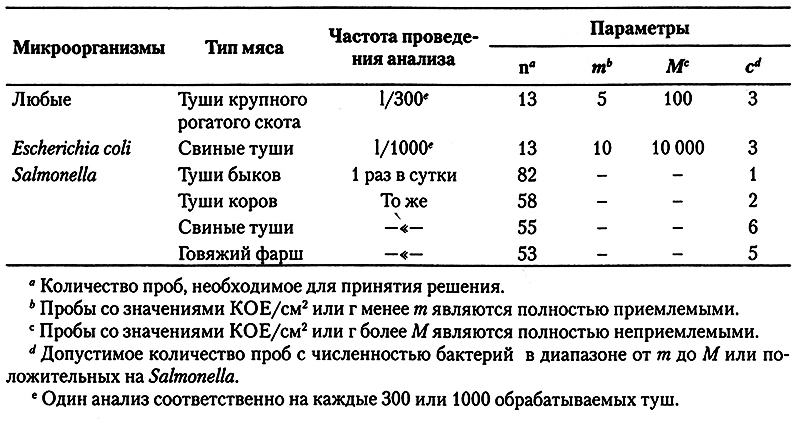
Критерии приемлемости применительно к Е. coli и Salmonella в виде плана отбора проб по качественным признакам сформулированы Министерством сельского хозяйства США в виде стандартов оценки эффективности системы НАССР относительно выявления контаминации туш микроорганизмами (табл. 6.3). Критерии по Е. coli применяются в любое время относительно уже ранее полученных значений n, тогда как данные по Salmonella собирают путем отбора 1 пробы в сутки до тех пор, пока не будет получен требуемый объем данных. Довольно сомнительно, имеют ли эти критерии отношение к безопасности мяса, так как основаны они на данных исследований охлажденных туш на мясоперерабатывающих предприятий США, а не на Требованиях к безопасности пищевых продуктов, что было бы более уместно в данном случае. Более того, эти критерии отражают общее состояние реализуемых туш до проведения обеззараживания, общепринятого в настоящее время на мясокомбинатах Северной Америки. Они основываются на том допущении, что энтеробактерии попадают на мясо только в ходе съема шкуры, тогда как на некоторых предприятиях большая часть этих микроорганизмов попадает на мясо при разделке туш. Следовательно, при несоответствии указанным критериям требуется повторная проверка эффективности работы системы НАССР, так как полученные данные не указывают, где именно произошел сбой контрольных механизмов. И наконец, соответствие этим критериям не может служить доказательством микробиологической безопасности мяса.
Таблица 6.3. Планы отбора проб в целях микробиологического исследования мясных туш
и говяжьего фарша согласно требованиям Министерства сельского хозяйства США
Принимая во внимание неопределенность большинства выводов, которые могут быть сделаны на основе применения планов отбора проб по качественным признакам к мясному сырью, более предпочтительным представляется использование планов отбора проб по количественным признакам. Пробоотбор по количественным признакам может использоваться для объективного определения ККТ в процессе мясопереработки (см. раздел 6.4). Несмотря на то, что пробоотбор по количественным признакам обычно применяется при определении численности микроорганизмов-индикаторов, а не собственно патогенных микроорганизмов, благодаря довольному редкому выявлению энтеропатогенов на мясе зачастую оказывается возможным определить численность отдельных микроорганизмов-индикаторов, присутствующих в очень небольших количествах, которые ниже предела обнаружения по методу анализа проб.
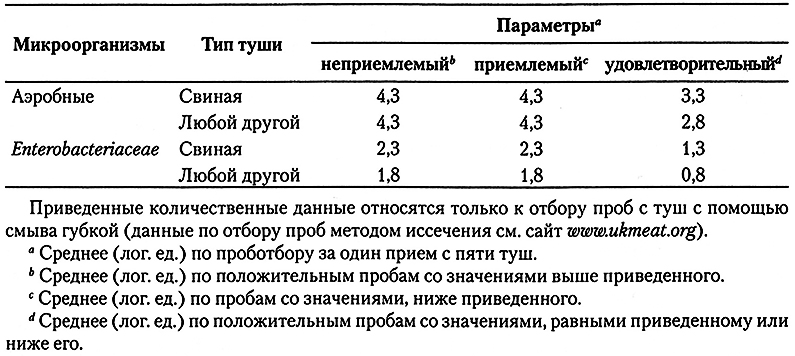
По численности микроорганизмов-индикаторов, выделенных из продукта тем или иным образом, иногда можно определить пропорциональное наличие соответствующих патогенных микрооранизмов или микроорганизмов порчи. Вместе с тем единственной общей зависимостью между важнейшими в санитарно-гигиеническом отношении микроорганизмами и их микроорганизмами-индикаторами является то, что численность патогенных микроорганизмов и микроорганизмов порчи не превышает численности микроорганизмов-индикаторов. Даже в этом случае применение количественных показателей контаминации продукта микроорганизмами-индикаторами позволяет ранжировать технологические параметры и требования к безопасности пищевых продуктов, а также другие показатели микробиологического качества. Очевидно, что степень уверенности в безопасности или стабильности свойств продукта при хранении можно повысить путем правильного выбора микроорганизмов-индикаторов для последующего количественного их определения. Таким образом, показатели на основе численности микроорганизмов, относящихся к Е. coli, дают больше достоверной информации о возможной контаминации энтеропатогенами, чем показатели, основанные на численности представителей семейства Enterobacteriaceae, как это требуется согласно нормативным документам ЕС (табл. 6.4), поскольку последние включают большое число сапрофитных видов, не связанных с фекальным загрязнением. Аналогичным образом, определение численности псевдомонад или молочнокислых бактерий позволяет лучше понять степень обсемененности продукта микроорганизмами, способными вызывать аэробную или анаэробную порчу, чем определение численности аэробных микроорганизмов.
Таблица 6.4.
Планы выборочного контроля для микробиологического тестирования туш красного мяса,
как требуется Европейским Союзом (ЕС) и введено в Великобритании
На практике для более детального понимания степени контаминации продукта различными бактериями и различных источников контаминации желательно определять численность нескольких микроорганизмов-индикаторов. Несмотря на то, что это может потребовать более широкого микробиологического анализа продукта, его можно растянуть на более продолжительный период, а после установления контроля над микробиологической контаминацией можно будет существенно сократить количество отбираемых проб.
6.9. НЕКОТОРЫЕ ТЕНДЕНЦИИ
В последние годы стало общепризнанным фактом, что микробиологическая безопасность мясного сырья и пищевых продуктов вообще только улучшится, если на всех стадиях производства и переработки пищевых продуктов контролировать содержание опасных микроорганизмов. Общепризнанно также, что такой надежный контроль может быть обеспечен благодаря внедрению систем НАССР на всем протяжении пищевой цепи.
Несмотря на то? что применение систем НАССР на всех стадиях пищевой цепи «от фермы до вилки», в принципе, желательно, очевидно, что подобные системы невозможно практически использовать во всех процессах. Например, системы НАССР невозможно применить там, где используются постоянно изменяющиеся технологии (в частности, в животноводстве), так как такого рода деятельность невозможно контролировать по раз и навсегда определенным параметрам, удерживая все микробиологические риски в заданных пределах. С другой стороны, на малых предприятиях по переработке пищевых продуктов типа различного рода кухонь и предприятий системы «фаст фуд» эксплуатация формальных систем НАССР может оказаться экономически нецелесообразной. Вполне возможно, что постепенно получит признание и необходимость ограничения использования систем НАССР, причем снижения микробиологических рисков там, где невозможно внедрить системы НАССР, будут добиваться путем определения и внедрения «правильных производственных практик».
Что касается тех технологических процессов, где микробиологические риски могут контролироваться системами НАССР, следует надеяться, что подобные системы будут внедряться все шире. В ближайшем будущем, однако, в решениях относительно систем НАССР будут по-прежнему доминировать субъективные оценки, а микробиологические данные собираться и использоваться главным образом в целях получения микробиологического заключения о степени «приемлемости» того или иного продукта. Несмотря на то, что исследования в целях оценки «приемлемости» полностью противоречат подходам НАССР относительно гарантии безопасности мяса и мясопродуктов и зачастую оказываются бесполезными относительно выявления контаминированной продукции, применение этого подхода, по всей вероятности, будет расширяться, так как он дает иллюзию внимания к проблемам безопасности; с практической точки зрения он оказывается, как правило, бесполезен.
Ситуация с гарантией срока годности мясного сырья может оказаться аналогичной. Многие предприятия, занимающиеся упаковкой мясного сырья, уже понимают, каким образом можно увеличить срок годности мясопродуктов, направляемых на удаленные рынки сбыта. Тем не менее на срок годности всех видов мяса существенно влияет температура окружающей среды, а температурный контроль на некоторых стадиях дистрибьюции, сбыта и реализации бывает очень ненадежным. Таким образом, предприятия, принимающие партии мясного сырья, продолжают практиковать входной микробиологический контроль, не позволяющий в полной мере определить микробиологическое состояние продукта, – он лишь несколько снижает риск приемки испорченного мясного сырья или продукта с истекающим сроком годности, не считаясь с возможностью отбраковки в целом приемлемого продукта.

