7.1. ВВЕДЕНИЕ
Контаминация переработанного мяса птицы микроорганизмами непосредственно влияет на безопасность пищевого продукта и его срок годности. Определение степени контаминации (как по качественным, так и по количественным признакам) требует применения чувствительных, простых в использовании и не приводящих к повреждению продукта методов отбора проб. Кроме того, эти методы должны давать результаты, которые могут легко интерпретировать специалисты, отвечающие за технологический контроль и качество продукта. Мясо птицы здесь занимает особое место, так как в ходе всей первичной переработки ее тушка остается цельной, а брюшная полость относительно недоступна. Хотя контаминирующие микроорганизмы обычно присутствуют на всей внешней поверхности поверхности тушки, их распределение обычно неравномерно, и многие микроорганизмы настолько прочно закрепляются на коже и в мышечной ткани, что не поддаются удалению физическими способами, в частности, ополаскиванием или протиркой. Для отбора проб с тушек птицы разработано много специальных методов, но при выборе конкретного метода для заданной цели всегда следует учитывать вероятную численность и распределение подлежащих выявлению микроорганизмов.
В последнее время микробиологические исследования мяса птицы получили новый импульс благодаря развитию международной торговли и широкому распространению системы НАССР на птицеперерабатывающих предприятиях. В системе НАССР результаты микробиологических анализов могут учитываться разными способами – в частности, на различных технологических стадиях для обоснования выбора ККТ или в целях верификации надлежащего функционирования системы. Микробиологическое исследование может понадобиться и для демонстрации соответствия определенным микробиологическим критериям, например, показателям по Escherichia coli и Salmonella. Любое использование таких микробиологических критериев предполагает, что согласован и явным образом представлен метод пробоотбора, так как обычно он существенно влияет на получаемые результаты.
Кроме того, необходимо использовать такой план отбора проб, в котором указано число подлежащих отбору проб и предельно допустимые значения по содержанию целевого(ых) микроорганизма(ов).
В настоящей главе мы сначала рассмотрим природу микробиологического обсеменения (контаминации) необработанного мяса птицы и его связь с поверхностью тушки. Затем опишем проблемы пробоотбора для микробиологического исследования охлажденных и замороженных изделий и методы, наиболее пригодные для рутинного использования. Кроме того, мы уделим внимание отбору проб с продуктов, подвергавшихся технологической обработке, поскольку природа и распределение основных микроорганизмов-контаминантов на них отличаются от ситуации с сырым мясом.
7.2. ПРОИСХОЖДЕНИЕ
И РАСПРЕДЕЛЕНИЕ КОНТАМИНАНТОВ НА ТУШКАХ
На птице, поступающей на птицеперерабатывающие предприятия, присутствуют многие миллионы различных микроорганизмов, включая потенциально патогенные и микроорганизмы, способные привести к порче переработанного мяса в условиях холодильного хранения. Эти микроорганизмы присутствуют на коже, перьях, в зобу и пищеварительном тракте птицы. Основные патогены, ассоциируемые с мясом птицы, – это Campylobacter jejuni, неспецифичные относительно организма-хозяина Salmonella и Clostridium perfringens. Все они могут бессимптомно существовать в пищеварительном тракте и переноситься на поверхность тушки с фекальными загрязнениями. Еще одним микроорганизмом, способным вызывать пищевое отравление, является Staphylococcus aureus, который встречается в носоглотке и на коже птицы, но эти штаммы редко продуцируют энтеротоксин, вызывающий у человека пищевое отравление. Холодостойкие бактерии порчи и дрожжи также присутствуют на мясе птицы, особенно на участках между перьями. В значительной степени их источником является окружающая среда, в которой птица выращивается. Основными бактериями порчи окрашиваемые и не окрашиваемые штаммы Pseudomonas spp.; большая часть этих бактерий уничтожается при ошпаривании тушек в целях ослабления перьев, однако в ходе последующих стадий переработки происходит повторная контаминация (особенно через руки и перчатки операторов). Listeria monocytogenes, наоборот, является холодостойким патогеном, редко выделяемым с живой птицы, но эти микроорганизмы могут размножаться на технологическом оборудовании, с которого они переносятся на обрабатываемые тушки.
Как правило, контаминация микроорганизмами происходит на всей внешней поверхности обрабатываемой тушки и в брюшной полости, однако их численность широко варьирует, как и распределение на различных участках. При изучении изменчивости микробной нагрузки на тушки птицы на трех различных птицеперерабатывающих предприятиях, было обнаружено, что важны все факторы, действующие на отдельную особь птицы, на партию птиц и на перерабатывающее предприятие, обусловливая соответственно 56,26 и 18% изменчивости численности микробиоты. При изучении степени контаминации тушек на одном перерабатывающем предприятии в течение 5 мес., отмечается, что изменчивость степени контаминации между отдельными тушками, партиями от одного поставщика и партиями от различных поставщиков составляет соответственно 73,14 и 13% от общей изменчивости. Микробная нагрузка возрастает под действием таких факторов, как более длительные периоды сбора птицы и выдерживания ее в клетях, а также убой в зимний период. Поскольку различия между птицеперерабатывающими предприятиями в технологических процессах и санитарно-гигиеническом состоянии являются ожидаемыми, опыт свидетельствует о том, что на каждом отдельном предприятии численность микроорганизмов меньше зависит от мест отбора проб на одной тушке, чем от отдельных тушек. В работе показано, что при сравнительном определении численности микроорганизмов на крыльях, грудках и ножках ни одно место отбора проб не характеризуется постоянно более высокой степень контаминации, чем другие. Вместе с тем общепризнано, что численность микроорганизмов в области грудки в большинстве случаев относительно невелика, а наиболее сильно контаминированной частью тушки является кожа шеи. Частично это может быть связано с положением тушки во время переработки – при подвешивании тушки за ножки жидкость с нее стекает в лоскут кожи, остающийся после удаления шеи.
Что касается отбора проб с тушек, то между Salmonella и Campylobacter spp. имеется существенное различие. Хотя доля обработанных тушек, контаминированных Salmonella, иногда бывает свыше 50%, количество бактериальных клеток на 1 тушку обычно довольно невелико (табл. 7.1) – лишь изредка выявляются тушки, на которых больше 1000 сальмонелл. Финские исследования в рамках государственной программы контроля тушки бройлеров на наличие Salmonella подтвердили, что постоянно отмечается низкая численность этих бактерий. Регулярные проверки замороженных куриных тушек в течение 3 лет показывают, что Salmonellaположительными оказываются до 11% тушек, но у 70% из них присутствуют менее пяти жизнеспособных клеток. Такая низкая степень контаминации вполне ожидаема благодаря низкой степени контаминации финских бройлеров в период убоя.
Таблица 7.1.
Встречаемость и численность Salmonella на необработанных тушках птицы

Что касается Campylobacter, то здесь ситуация иная, и ко времени убоя присутствие Campylobacter в кишечном тракте птицы зачастую превышает 106 КОЕ/г содержимого слепой кишки. В работе при анализе свежего мяса птицы, реализуемого в розницу, было обнаружено содержание до 1,5 х 106 КОЕ/1 тушку, а пробы смывом с различных мест, включая брюшную полость, дали относительно однородное распределение этих микроорганизмов. В другой работе было подтверждено присутствие Campylobacter на коже и в брюшной полости обработанных бройлеров и показано, что этот микроорганизм может проникать внутрь через кожу (преимущественно через фолликулы пера). Сообщается, что Campylobacter содержатся примерно в 3% проб мышечной ткани, но это может происходить из-за перекрестного обсеменения в ходе пробоотбора. О контаминации глубже расположенной мышечной ткани сообщается и в работе. Campylobacter и Salmonella могут иногда проникать в такие внутренние органы птицы, как печень, но их способность к выживанию в мышечной ткани ограничена действием антимикробных веществ, ассоциируемых с жизнедеятельностью нормальных мышечных тканей и жидкостей.
Традиционно считается, что в глубоких мышечных тканях переработанного мяса птицы нет жизнеспособных микроорганизмов – их размножение не наблюдается даже в непотрошеных тушках, хранившихся при 10 или 15 °С в течение нескольких суток. Здесь следует отметить, что анализов на Campylobacter не проводилось (для прояснения ситуации необходимы дополнительные исследования).
7.3. ПРИКРЕПЛЕНИЕ МИКРООРГАНИЗМОВ
К КОЖЕ И ДРУГИМ УЧАСТКАМ ТУШЕК
Способность микроорганизмов прикрепляться к самым разнообразным поверхностям хорошо известна. Это явление имеет важные последствия для выживания микроорганизмов, для мойки тушек в ходе перебработки и для пробоотбора. Участвующие в этом процессе биологические поверхности имеют сложное строение, и механизмы, с помощью которых микроорганизмам удается прикрепиться к ним или задерживаться на них, все еще не вполне понятны. Первые исследования по прикреплению специфических штаммов бактерий к коже бройлеров показали, что значительное прикрепление характерно только для жгутиковых бактерий, причем на скорость и степень прикрепления влияют такие факторы, как штамм бактерии, продолжительность контакта, температура, значение рН и численность микроорганизмов в пленке воды, покрывающей поверхность кожи. Микроорганизмы в этой водной пленке можно без особого труда удалить в ходе мойки тушек, но микроорганизмы, уже прикрепившиеся к коже, где они защищены от действия шпарки и мойки, удалить значительно труднее.
Некоторые новые обстоятельства удерживания бактерий на коже цыплят описаны в работе, где показано, что подвижность бактерий играет небольшую роль – многие неподвижные бактерии удерживаются так же хорошо, как и подвижные.
Электронная микроскопия естественно контаминированной кожи показывает, что преобладающими микроорганизмами изначально являются разновидности, напоминающие Micrococcus spp. Эти бактерии локализуются на поверхности рогового слоя кожи в скоплениях вещества, подобного кожному салу. Удаление наружного эпидермального слоя в ходе «жесткой» шпарки и удаления пера обнажает новую поверхность для микробиологического обсеменения – в ней много капиллярных каналов и микротрещин. При последующем иммерсионном охлаждении происходит разбухание кожи, что, как предполагается, происходит из-за поглощения влаги, и в результате эти микроканалы и микротрещины становятся доступными для контаминантов, присутствующих в воде (на этот процесс влияют продолжительность и температура иммерсионной воды). Считается, что при набухании кожи бактерии, уже присутствующие в микроканалах и трещинах, могут задерживаться в них, с трудом поддаваясь физическому удалению. Кроме того, набухание кожи может привести к образованию новых убежищ для микроорганизмов-контаминантов.
Естественно, кожа – это не единственный вариант поверхности тушки, подвергающейся воздействию микроорганизмов. В работе показано, что погружение в воду мышечной фасции или соединительно-тканной оболочки мышц цыпленка приводит к тому, что коллаген соединительной ткани набухает и образовывает на поверхности плотную сеть волокон. К волокнам коллагена сумели прикрепиться два штамма Salmonella (оба небахромчатые, один из них – неподвижный), но только после длительного погружения в воду. Эти факты относятся к внутренней стороне шейного кожного лоскута, главного участка отбора проб (об этом см. ниже), где могут удерживаться микроорганизмы-контаминанты.
Удерживание бактерий в трещинах кожи после иммерсионного охлаждения подтверждено в работах. На прикрепление микроорганизмов наличие жгутика или фимбрий (бахромки) существенно не влияет; более того, оказалось, что электростатическое взаимодействие между микроорганизмами и поверхностью не играет никакой роли. Заслуживает внимания тот факт, что бактерии обнаруживаются прочно прикрепленными к коже еще до начала переработки мяса птицы. В экспериментальных исследованиях участков кожи прикрепление бактерий наблюдалось уже в течение первых 15 с, линейно возрастая со временем. Никаких существенных различий в скорости прикрепления бактерий к коже с тушек после «мягкой» и «жесткой» шпарки не наблюдалось.
7.4. ОТБОР ПРОБ С ТУШЕК
НА ПТИЦЕПЕРЕРАБАТЫВАЮЩИХ ПРЕДПРИЯТИЯХ
Разработка планов отбора проб выходят за рамки этой главы, но с практической точки зрения количество тушек, необходимое для отбора проб на любой конкретной стадии технологического процесса, все более диктуется коммерческими соображениями. При крупномасштабном производстве любое количество тушек для пробоотбора представляет собой лишь очень небольшую часть партии. Тем не менее регулярно формируемые на этой основе данные очень полезны для выявления тенденций в контаминации продукта. И наоборот, в большинстве исследований на Salmonella работали не менее чем с пятью парами тушек, хотя если уровень распространения этих микроорганизмов оказывается довольно низким, для выявления всех тушек с наличием сальмонелл может потребоваться большее число тушек. Какой бы ни была выборка, тушки всегда следует отбирать на анализ случайным образом, и браковать или отвергать их только в том случае, если они неполные или имеют иные явные видимые невооруженным глазом повреждения.
Определение времени отбора проб, как представляется, не столь важно, чем считалось ранее. В исследовании Европейской комиссии отбор проб был отложен на 2 ч после начала переработки, что дало сбалансировать микробиологическое обсеменение технологического оборудования. Такое решение, по-видимому, основывалось на чьем-то предположении, поскольку последующие исследования не смогли выявить какой-либо связи между микробиологическими обсеменением партии и временем от начала технологического процесса до момента взятия пробы. Естественно, что большое влияние на микробиологическую нагрузку отдельной партии могут иметь другие факторы. Так, включение в выборку для отбора проб первых поступающих на переработку тушек, когда оборудование еще чистое, может дать результаты анализа, вводящие в заблуждение.
7.5. МЕТОДЫ ОТБОРА ПРОБ С ТУШЕК
Для отбора проб с тушек в ходе и/или после их технологической переработки разработано множество различных методов определения их микробиологического состояния. К таким методам можно отнести:
- смыв;
- ополаскивание целой тушки;
- иссечение ткани и ее вымачивание;
- многократное погружение целой тушки в растворитель;
- сбор мясного сока;
- обработка заданной площади кожи струей воды под высоким давлением или соскоб;
- обработка струей воды брюшной полости с последующим обнаружением микроорганизмов-контаминантов посевом на агаровую пластинку или нитроцеллюлозную мембрану.
В рамках указанных методов существует ряд разных методик, расширяющих применимость того или иного метода. Различия между ними относительно выделения микроорганизмов объясняются или разным уровнем встречаемости и распределения целевых микроорганизмов на тушке, или их степенью прикрепления или удерживания, а следовательно, и возможностям удаления данного микроорганизма. К числу наиболее широко используемых и экономически оправданных способов отбора проб на предприятии относятся взятие смыва, ополаскивание целой тушки и иссечение ткани. Их относительные преимущества и недостатки мы рассмотрим ниже.
7.5.1. Взятие смыва
Взятие смыва – это один из первых методов экспериментального микробиологического исследованиях тушек птицы. Он имеет то преимущество, что является неразрушающим методом и может быть использован для тушек любого размера, однако он удаляет микроорганизмы с поверхности отбора пробы относительно неэффективно (табл. 7.2). В качестве объяснения этого недостатка в работе высказано предположение, что на возможность высвобождения микроорганизмов с поверхности влияет уже имеющаяся их концентрация в суспензии. При взятии проб смывом, следовательно, высокая концентрация микроорганизмов в области контакта «тампон-тушка» может препятствовать дальнейшему удалению микроорганизмов.
Таблица 7.2.
Удаление микроорганизмов с кожи птицы многократным взятием смыва

Традиционно тампоны делают с головкой из ваты, но для анализов мяса птицы можно также использовать хлопковую марлю и другие материалы, в частности губку из ацетата целлюлозы. Так как микроорганизмы с исследуемой поверхности для анализа должны быть перенесены в растворитель, требуется механическое перемешивание взвеси с тампона. Удобнее использовать тампоны из альгината кальция, описанные в работах, поскольку после взятия смыва такой тампон растворяется в растворе гексаметафосфата натрия, высвобождая тем самым микроорганизмы в суспензию.
Для отбора проб в целях количественного определения микроорганизмов для ограничения требуемой площади поверхности используют стерильный трафарет. Эта поверхность может достигать 50 см2, причем в работе рекомендуется брать пробы с пяти таких поверхностей на 1 тушке. Если анализ проводится на выявление относительно немногочисленных микроорганизмов, например Salmonella, то полезно взять пробы с максимально возможного числа тушек. С другой стороны, для количественного определения можно использовать площади меньшего размера, например, 10 см2, причем пробы можно брать с нескольких участков каждой тушки. Численность микроорганизмов приводится на единицу площади поверхности.
7.5.2. Ополаскивание целой тушки
Метод ополаскивания целой тушки получил широкое признание, и у него много разновидностей (табл. 7.3). Это единственный метод, где взятие пробы производится с целой тушки, включая брюшную полость. Несмотря на то, что данный метод является неразрушающим, тушки, изъятые с технологической линии для отбора проб, могут быть возвращены обратно только в том случае, если:
- используемая ополаскивающая жидкость является чистой водопроводной или дистиллированной водой;
- взятие пробы выполняется в производственной зоне;
- до подвешивания вновь на технологической линии не было нарушений температурного режима.
Таблица 7.3.
Некоторые разновидности метода ополаскивания целой тушки
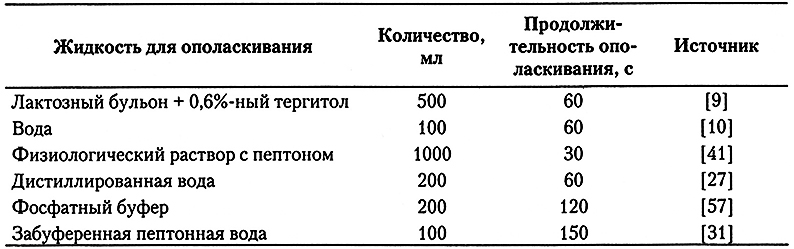
К микроорганизмам, выделяемым при взятии проб ополаскиванием, относятся те, которые легко удаляются с тушки, а не прочно прикрепленные к ней. В работе показано, что даже через 40 последовательных ополаскиваний продолжает вымываться относительно много микроорганизмов. Тем не менее, поскольку ополаскиванию подвергается вся поверхность тушки снаружи и внутри, этот способ хорошо подходит для выявления минорных микроорганизмов и является обязательным в США для выявления Salmonella и определения численности Escherichia coli (согласно Программе по снижению численности патогенных микроорганизмов). В прошлом этот метод был распространен и в Европе.
Основная процедура заключается в следующей:
1. Поместите каждую тушку в стерильный водонепроницаемый полиэтиленовый пакет и при необходимости взвесьте (об этом см. ниже). Для этой цели хорошо подходит пакет для обработки в стомакере вместимостью 3500 мл.
2. Добавьте требуемое количество растворителя (в зависимости от размера тушки).
3. Плотно закройте мешок, завязав, к примеру, шнуром.
4. Держа мешок с тушкой и растворителем обеими руками, энергично потрясите его (сначала вертикально, а затем горизонтально) в течение 1 мин. При этом одной рукой поддерживайте тушку через дно пакета, а другой – ноги сверху закрытого пакета.
5. После встряхивания растворитель должен стечь с тушки в пакет, после чего удалите тушку.
6. Перелейте всю жидкость для ополаскивания или ее часть в соответствующий контейнер с завинчивающейся пробкой для проведения последующих анализов.
Обратите внимание, что любая манипуляция с тушками должна выполняться в стерильных одноразовых перчатках.
Если ополаскивание целой тушки выполняется, как полагается, вручную, то оно представляет собой довольно утомительную операцию, особенно если требуется отобрать пробы с большого числа тушек. Вследствие усталости оператора тушки могут оказаться недостаточно обработанными, а результаты – нестабильными. По этой причине процесс встряхивания был автоматизирован и разработан пробоотборник для работы с несколькими тушками одновременно («мультисэмплер»), способный обрабатывать до шести тушек сразу. Благодаря автоматизации этот процесс стал более стандартизованным, источник ошибок исключается и экономится время, причем данный метод может применяться и для более крупных тушек птицы, в частности, для индейки, которые очень тяжело встряхивать вручную. Что касается определения численности микроорганизмов на чашках Петри и выделения Salmonella, то существенных различий между ручным и автоматизированным ополаскиванием не наблюдалось.
Численность микроорганизмов, полученная в результате отбора проб ополаскиванием, может выражаться на единицу объема (мл) ополаскивающей жидкости или относиться к площади общей поверхности тушки (КОЕ/единицу площади) с использованием соответствующего коэффициента пересчета. Для бройлеров обычного размера (потрошеная тушка массой около 1 кг) площадь поверхности в см2 приблизительно равна массе тушки в граммах плюс 500 г. Разновидности методов на основе ополаскивания, количество используемой жидкости и требуемая продолжительность встряхивания приведены выше в табл. 7.3. Для анализа тушек бройлеров по одному из методов обнаружения сальмонелл использовалось даже такое небольшое количество жидкости, как 100 мл. Это очень важно с практической точки зрения, так как большое количество ополаскивающей жидкости тяжело подготавливать, работать с ним и транспортировать на предприятие по переработке мяса птицы. Кроме того, если объем ополаскивающей жидкости составляет всего 100 мл, всю ее можно использовать для обогащения пробы. Некоторые исследования свидетельствуют, что степень обнаружения сальмонелл при инкубации ополаскиваемой тушки в пакете (в качестве предварительной обогащающей стадии или, по крайней мере, при использовании кожи) возрастает. Вместе с тем цельные тушки неизбежно требуют больше места для инкубирования, которого, как правило, всегда не хватает.
7.5.3. Иссечение кожи и вымачивание
В определенном смысле вымачивание образцов кожи представляет собой своего рода «золотой стандарт» взятия проб, так как оно гарантирует, что высвобождаются фактически все присутствующие микроорганизмы, несмотря на то что отбору проб подверглись не все части тушки. В принципе вымачивание кожи является разрушающим методом, и если пробы отбираются более чем с одного участка, то это может привести к неприемлемому повреждению тушки. Таких проблем можно избежать, ограничиваясь шейным лоскутом кожи, а для определения общей численности микроорганизмов необходимо удалить только маленький кусочек кожи (массой около 5 г, однако выявление сальмонелл требует обычно более крупного образца, массой 10-25 г). Огромное преимущество этого метода состоит в том, что пробы можно отбирать с использованием стерильных ножниц и пинцета, не изымая тушки с технологической линии даже при скорости переработки 6000 тушек/ч. Это означает, что данный метод является самым быстрым из описываемых. Каждый образец кожи может быть помещен в чистый пластиковый пакетик, который выворачивают наизнанку поверх руки с последующим охватом им отрезанного образца. Взятые таким образом пробы обычно вымачивают в стомакере. Можно использовать также механический блендер; кроме того, пробы можно энергично встряхивать в бутылке с завинчивающейся пробкой, куда заранее помещены стеклянные бусины или крупносеянный песок.
Результаты анализов мяса и кожи цыплят после вымачивания в течение 2 мин свидетельствуют, что ОМЧ, полученные с помощью стомакера, не отличаются от данных, полученных с использованием механического блендера. Не удивительно, что вымачивание кожи обычно дает более высокое ОМЧ, чем взятие проб смывом или ополаскиванием, однако степень обнаружения сальмонелл может быть значительно ниже (см., например, работу) из-за небольшой площади для отбора пробы. Метод отбора кожи шеи особенно подходит для выявления влияния технологической обработки на степень обсеменения тушки в целом, причем при этом типе выборки коэффициенты вариации численности микроорганизмов-индикаторов оказываются значительно ниже, чем коэффициенты, полученные при отборе проб методом ополаскивания целых тушек. Какой-то устойчивой связи между ОМЧ, полученными иссечением кожи шеи и ополаскиванием целой тушки, не существует, однако доля микроорганизмов, выделяемых последним способом, по мере прохождения тушки по технологической линии имеет тенденцию к снижению. Это может свидетельствовать о том, что к концу технологического процесса возрастает численность микроорганизмов, крепко удерживающихся на поверхности тушки, – многие из них можно выделить лишь методом вымачиванием кожи.
Хотя в пищевой микробиологии широко распространены стомакеры, Шарпом был разработан аппарат Pulsifier® (фирма FiltaflexLtdy провинция Онтарио, Канада). Это устройство, в котором для высвобождения микроорганизмов-контаминантов из проб пищевых продуктов используется сочетанный эффект воздействия ударной волны и интенсивного перемешивания. Указывается, что численность выделенных таким образом микроорганизмов такая же или превышает численность микроорганизмов, определенную по пробам, вымоченным в стомакере. Кроме того, в получающейся в результате суспензии меньше остатков продукта, мешают отбору проб пипеткой.
7.6. ОТБОР ПРОБ ЗАМОРОЖЕННОГО МЯСА
Замороженные тушки или отдельные их части обычно перед отбором проб размораживают, выдерживая при температуре 1-5 °С в течение ночи. Как вариант, в работе предложено выдерживать тушки при комнатной температуре в течение 2-4 ч, что может оказаться достаточным только для размягчения тканей. Дефростацию следует тщательно контролировать, не допуская значительного увеличения ОМЧ.
Замороженные блоки бескостного мяса представляют собой особую микробиологическую проблему, и перед их размораживанием и использованием в приготовлении какого-либо изделия обычно требуется проведение микробиологического анализа. В этом случае микроорганизмы-контаминанты распределены по всему блоку мяса. Отбор проб с плоских блоков можно осуществить путем отрубания небольших кусочков мяса с края с помощью ножа мясника или стамески. Для более крупных блоков мяса можно приспособить своего рода штопор на электрической дрели с регулированием числа оборотов. Пробы следует брать с нескольких различных участков блока с последующим вымачиванием.
7.7. ЧАСТИ ТУШКИ И ДРУГОЕ СЫРЬЕ ИЗ МЯСА ПТИЦЫ
Части тушки могут быть с кожей или без нее, причем продукты без кожи совсем не обязательно меньше обсеменены микроорганизмами. Как и в случае цельных тушек, более высокую степень обнаружения микроорганизмов из частей тушки дает иссечение ткани с последующим вымачиванием.
Для этой цели для анализов необходимо около 5 г вырезанной мышечной ткани, включая кожу (при наличии). Размер и/или форма конкретной части тушки могут затруднить отбор проб путем смыва, но возможны и другие методы, в том числе ополаскивание или сбор мясного сока. Для микробиологического анализа потрохов (желудка, сердце, печени и шеи) лучше подходит вырезание порции ткани с последующим ее вымачиванием. Для отбора проб мяса механической обвалки (MRM) можно использовать способ, описанный ранее для кожи шеи, – с использованием пластикового пакета, вывернутого наизнанку поверх руки.
7.8. ГОТОВЫЕ К УПОТРЕБЛЕНИЮ
ПРОДУКТЫ ИЗ МЯСА ПТИЦЫ ПОСЛЕ ТЕПЛОВОЙ ОБРАБОТКИ
В настоящее время существует огромное число готовых изделий из мяса птицы, и отбор проб с них должен учитывать вероятность встречаемости и распределение возможных микроорганизмов-контаминантов. Можно ожидать, что в ходе промышленной тепловой обработки будут уничтожены большинство вегетативных форм бактерий, включая и некоторые патогены, но совсем не обязательно погибнут термостойкие микроорганизмы типа энтерококков или бактериальных спор. На практике, продукты после тепловой обработки могут быть подвержены повторной контаминации в ходе последующих технологических операций, в том числе и патогенными микроорганизмами. Тем не менее степень микробиологической контаминации изделий, прошедших тепловую обработку, по всей вероятности, окажется низким, и обнаружение таких патогенов, как Listeria monocytogenes, потребует отбора относительно крупных партий проб. Что касается цельных тушек, то в работе авторы предпочли извлекать мясо из половинки тушки и вымачивать его в двойном по массе количестве растворителя. Можно также использовать отбор проб смывом, охватывая соответственно большую площадь, включая часть брюшной полости.
Кроме того, в работе описана процедура отбора проб из прошедших тепловую обработку рулетов из мяса птицы, нарезаемых ломтиками. Такой рулет состоит из спрессованных кусочков мяса и покрыт оболочкой. Каждый рулет проходит тепловую обработку, охлаждается и либо замораживается, либо хранится в охлажденном состоянии. Изначально микроорганизмы-контаминанты распределены по всему рулету, и для выявления выживших после тепловой обработки микроорганизмов в центре продукта необходимо взять соответствующие пробы. Обычно рулет исследуют в незамороженном состоянии с помощью стерильного устройство типа штопора, вырезающего цилиндр диаметром около 2 см. Такие пробы из центра и других частей изделия анализируют после вымачивания.
7.9. ОБЪЕДИНЕНИЕ ПРОБ
Когда пробы сырья берут в целях выявления факта присутствия сальмонелл, обычной производственной практикой является объединение некоторого количества проб в одну смешанную пробу. Тем самым экономятся трудозатраты и материалы без снижения численности восстанавливаемых на стадии обогащения микроорганизмов. Кроме того, объединение проб может применяться при количественном определении микроорганизмов, так как при этом происходит усреднение численности по всем пробам. Единственным недостатком в этом случае является то, что не ясен разброс между пробами, и одна сильно обсемененная «подпроба» может дать очень высокую общую численность микроорганизмов.
7.10. ОБРАЩЕНИЕ С ПРОБАМИ И ИХ ТРАНСПОРТИРОВКА
Все пробы должны отбираться правильно обученным персоналом в стерильных условиях с использованием предварительно стерилизованных инструментов и материалов. При отборе проб в производственной зоне исключается использование стеклянных бутылок, пипеток и т. п. из-за риска боя стекла. Маркировка проб должна быть понятной и недвусмысленной; необходимо также вести соответствующую документацию с подробной регистрацией времени отбора проб и происхождения каждой пробы.
Как правило, пробы должны поступать на микробиологическое исследование как можно быстрее и защищенными от возможности последующей контаминации или физического повреждения. Условия транспортировки и хранения проб должны подразумевать минимизацию всех рисков размножения микроорганизмов, а это означает, что незамороженные пробы следует транспортировать в термоизолированных емкостях на льду или в присутствии специальных морозильных контейнеров, а если анализ планируется провести на следующий день, то пробы рекомендуется хранить при температуре О °С. По нашему личному опыту при такой температуре численность микроорганизмов за ночь изменяется мало. При температуре 2-5 °С можно ожидать увеличения ОМЧ примерно на 1 лог. ед./ночь. Замороженные пробы лучше транспортировать с сухим льдом, предотвращая их размораживание в пути.
Обычным контаминантом сырого мяса птицы являются бактерии рода Campylobacter, так что при целевом выявлении именно этого микроорганизма следует учитывать его относительно «нежную» природу. Пробы, взятые смывом, не должны высыхать, и при возможности откладывания проведения анализов лучше использовать культуральную среду типа Fastidious Anaerobe Broth («бульон для требовательных анаэробных микроорганизмов»).
7.11. НЕКОТОРЫЕ ТЕНДЕНЦИИ
Требования к микробиологическим анализам пищевых продуктов продолжают ужесточаться и, по всей вероятности, будут иметь значительное воздействие на европейскую птицеперерабатывающую промышленность. В последние годы и в старых, и в новых странах-членах Европейского союза все шире применяется система НАССР. В частности, микробиологическое исследование понадобится для подтверждения того факта, что первичная переработка и производство изделий осуществлялись на базе системы управления рисками и соответствуют действующим предельно допустимым микробиологическим показателям. Несмотря на то что методы обнаружения специфических патогенных микроорганизмов становятся все более быстрыми и эффективными, вряд ли нас ожидает ближайшая перспектива их применения ко всем тушкам на действующей производственной линии в процессе высокоскоростной переработки мяса птицы. Это означает, что в обозримом будущем перед проведением микробиологического анализа будет по-прежнему необходим отбор проб. Как мы старалась показать в настоящей главе, пробоотбор сам по себе всегда является своего рода компромиссом относительно числа проб, отбираемых из одной партии, и относительно способа обработки отдельных изделий в целях выделение? целевого микроорганизма. В последние 30 лет для тушек птицы было разработано лишь несколько новых методов пробоотбора, так что любые методы, которые будут разработаны в будущем, должны быть относительно простыми, удобными и экономически эффективными. В ближайшее время нам кажется более важным стандартизация наиболее подходящих существующих методов для их международного применения. Только тогда можно будет провести методологически правильные сравнительные исследования микробиологического состояния продуктов из мяса птицы в разных странах, что необходимо для успешной международной торговли.

