10.1. ВВЕДЕНИЕ
Микробиологическое исследование мяса, мяса птицы и яйцепродуктов на присутствие патогенных микроорганизмов имеет особое значение для обеспечения безопасности этих пищевых продуктов и может включать в себя:
- анализ фирмами-производителями сырья, ингредиентов и готовых пищевых продуктов в процессе внутренней и внешней торговли в целях приемки или отклонения тех или иных их партий;
- мониторинг эффективности технологических процессов и критических контрольных точек в ходе производства и качества готовой продукции; анализ в целях определения степени приемлемости данного пищевого продукта для употребления в конце предполагаемого срока годности; микробиологическое исследование в целях анализа рисков в системе НАССР должно включать определение численности микроорганизмов-индикаторов, а не выявление патогенных микроорагнизмов, но, тем не менее, анализ на патогены зачастую включают в системы верификации НАССР;
- анализ производителем пищевых продуктов или контрольно-регламентирующими органами в целях проверки соответствия партий пищевых продуктов или ингредиентов установленным требованиям; относительно недавно Постановлением ЕС были введены в действие новые микробиологические показатели пищевых продуктов, выключая критерии пищевой безопасности и санитарно-гигиенических условий производства, применимые к основной группе пищевых продуктов;
- текущий мониторинг или контрольные исследования особых продуктов, могущих представлять потенциальный риск для здоровья, или продуктов, о микробиологическом качестве которых недостаточно информации. Информация, полученная в результате таких исследований, имеет огромное значение для производителей пищевых продуктов и сотрудников контрольно-регламентирующих органов;
- анализ продуктов, в отношении которых имеются основания предполагать их причастность к пищевым отравлениям, а также пищевых продуктов, относительно которых поступили жалобы потребителей.
Традиционные микробиологические методы анализа пищевых патогенных микроорганизмов предназначены для обнаружения и определения численности конкретных целевых микроорганизмов. Природа и численность целевых и прочих микроорганизмов в пробах с различным пищевым матриксом могут существенно различаться. Ложноположительные результаты получаются, если некоторый нецелевой микроорганизм ошибочно идентифицируется как целевой, а ложноотрицательные – если целевой микроорганизм при исследовании не дает характерной или «типичной» реакции. Выбору метода анализа следует уделять серьезное внимание. Метод, аттестованный для конкретного типа пищевого продукта, совсем не обязательно применим для других пищевых матриксов. Результат микробиологического анализа всегда зависит от использованного метода исследования, то есть при исследовании одной и той же пробы разными методами могут быть получены различные результаты. На возможность обнаружения микроорганизма может влиять его физиологическое состояние, а повреждения микроорганизма могут быть разными по своему типу и степени выраженности. Различные методы позволяют улавливать разные доли популяции микроорганизмов. Несмотря на то что многие методы уже закреплены в (меж)национальных стандартах или нормативных актах, ответственность за оценку результативности того или иного метода относительно исследуемого образца и за поиск (при необходимости и возможности) альтернативных вариантов все равно несет конкретная лаборатория. Если в той или иной лаборатории стандартный метод был несколько изменен, то достоверность полученных результатов должна быть валидизирована путем их сравнения с оригинальным сертифицированным методом.
Все микробиологические исследования так или иначе имеют свои ограничения, которые необходимо учитывать перед принятием каких-либо корректирующих воздействий по результатам лабораторного анализа. Полученые результаты зависят и от избранного метода анализа, и от способа пробоотбора. Если предельно допустимые микробиологические показатели утверждены в действующих нормативных актах или в спецификации продукта, то должны быть явным образом описаны как аналитические методы, так и способы пробоотбора.
В настоящей главе мы рассмотрим традиционные культуральные и современные ускоренные (экспресс-)методы обнаружения патогенных микроорганизмов в пищевых продуктах с изложением основных принципов, положенных в основу того или иного метода, стандартизованные и альтернативные методы, а также приведем примеры серийно выпускаемых тест-наборов. Подробнее мы остановимся на методах обнаружения Salmonella, Campylobacter, Escherichia coli О157 : H7 и Listeria monocytogenes, так как эти патогенные микроорганизмы относятся к основным контаминантам мяса, яйцепродуктов и мяса птицы. В заключение мы приведем основные факторы, которые следует учитывать при выборе конкретного метода микробиологического исследования.
10.2. КУЛЬТУРАЛЬНЫЕ МЕТОДЫ
10.2.1. Общие соображения
Несмотря на значительный прогресс в разработке ускоренных методов обнаружения микрооорганизмов, в большинстве микробиологических лабораторий традиционное исследование с использованием специфических культуральных сред по-прежнему остается основой выявления пищевых патогенов. Предпринимаются многочисленные попытки усовершенствовать методы на основе агаровых сред так, чтобы они стали более удобными и «дружественными к пользователю». Примерами могут служить система Petrifilm (фирма 3М), применение погружных слайдов и техника фильтрования через мембранный фильтр с нанесенной гидрофобной сеткой. Параллельно были разработаны и внедрены тест-наборы для идентификации микроорганизмов, упрощающие и автоматизирующие процесс их идентификации – в частности, системы АРР (фирма bioMerieux) и BBL-Crystal (фирма Becton-Dickinson).
Распознавание колоний целевых микроорганизмов в присутствии колоний других представителей сопутствующей микробиоты очень важно, но не всегда легко выполнимо. По сравнению с традиционными культуральными средами в новейших системах используются иные селективные и диагностические свойства. Создание хромогенных и флуорогенных культуральных сред облегчило ускоренное обнаружение и идентификацию многих патогенных микроорагнизмов, а использование разнообразных обогатительных бульонов и сред для посева на чашки повысило вероятность их обнаружения. Тем не менее лаборатории должны научиться соизмерять «цену вопроса», то есть сопоставлять цены на новые аппараты, тест-наборы и приспособления с ожидаемым повышением эффективности обнаружения микроорганизмов, причем применительно к целям проводимых анализов.
При выборе соотвествующего метода исследования важно использовать опубликованные стандартизованные методы (при наличии последних). Для стандартизированных методов даются подробные инструкции по выполнению всего анализа, вплоть до состава культуральных сред и их значения рН. Описание стандартизованных методов можно получить, в частности, в Международной организации по стандартизации (ISO), в Европейской комиссии по стандартизации (CEN), в Международной молочной федерации (IDF), в американской государственной Ассоциации химиков-аналитиков (АОАС), в Комиссии северных стран по анализу пищевых продуктов (NMKL) и национальных органах по стандартизации в каждой стране. Стандарты ISO разрабатываются техническими комитетами, в состав которых входят специалисты, представляющие промышленность, технический сектор и торговлю. Существуют стандартизированные методы обнаружения основных патогенных бактерий, встречающихся в пищевых продуктах, включая Salmonella, Campylobacter, Е. coli О157 и L. monocytogenes – главных контаминантов мяса, яйцепродуктов и мяса птицы. Стандартизованные методы ISO для других патогенных микроорганизмов, которые могут встречаться в этих пищевых продуктах, приведены в табл. 10.1.
Таблица 10.1.
Методы ISO для некоторых патогенных микроорганизмов мяса, мяса птицы и яйцепродуктов
10.2.2. Salmonella
В пищевых продуктах, контаминированных сальмонеллами, последние могут присутствовать в относительно низких количествах, обычно распределяясь неравномерно; они могут быть сублетально повреждены в ходе переработки пищевых продуктов или под действием внутренних для данного продукта факторов, и, кроме того, сальмонеллам обычно сопутствует большое число близкородственных бактерий, конкурирующих с ними за питательные вещества. Все это затрудняет выделение Salmonella из проб пищевых продуктов с помощью культуральных методов. Процедура выделения обычно состоит из четырех основных этапов. Во-первых, для облегчения восстановления и роста Salmonella до уровня не менее 105 КОЕ/мл необходимо предварительное обогащение в неселективной питательной среде. Селективное обогащение небольших порций предварительно обогащенной культуры делает возможным дальнейший рост Salmonella и в то же время ингибирует ростконкурирующих микроорганизмов. При последующем выделении на селективной агаровой среде рост конкурирующих нецелевых микроорганизмов будет ограничиваться, и в результате мы увидим колонии Salmonella (предположительно). В заключение необходимо выполнить процедуру подтверждения присутствия Salmonella с использованием биохимических и серологических тестов.
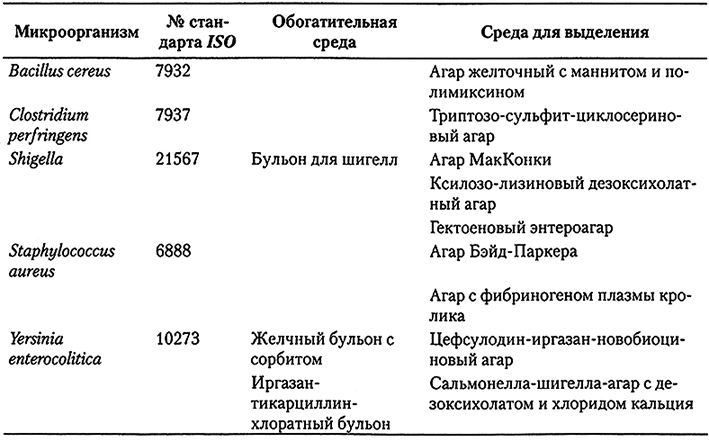
Протокол международного стандарта ISO 6579 по обнаружению Salmonella spp. в пищевых продуктах и кормах для животных приведен на рис. 10.1.
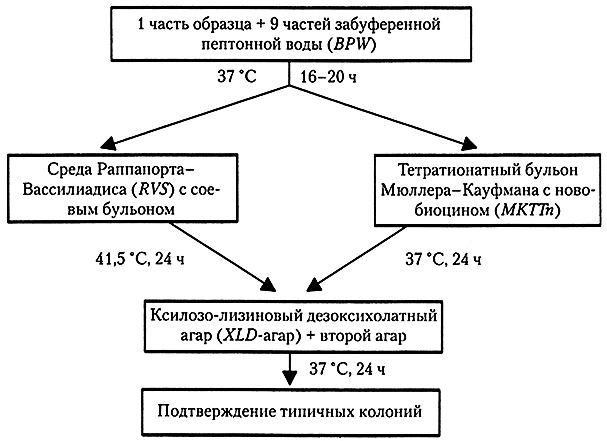
Рис. 10.1. Обнаружение Salmonella в пищевых продуктах согласно стандарту ISO 6579
На первом этапе забуференная пептонная вода (BPW), неселективная среда для предварительного обогащения, смешивается с пробой в разведении 1 в 10 (1:9). Так как во многих микробиологических показателях для пищевых продуктов предписано отсутствие сальмонелл в пробе продукта объемом 25 г, то обычно именно это количество смешивают с 225 мл BPW. Для некоторых пищевых продуктов, в частности кислых и на основе какао, используют модифицированную BPW с добавлением сухого обезжиренного молока, казеина или бриллиантового зеленого, а также двойную концентрацию буфера. Как правило, для анализов мясных и продуктов из мяса птицы такая модификация не требуются. Время и температура инкубации, по-видимому, даже более важны, чем выбор среды для предварительного обогащения. Инкубация суспензии пробы в BPWобычно проводят при температуре 37 °С в течение 16-20 ч. Более длительный период инкубации может привести к покрытию колоний сальмонелл конкурирующей микробиотой и/или подкислению среды до значения рН ниже 4,5, что существенно снижает вероятность выделения Salmonella. Более короткий период инкубации обычно не позволяет адекватно восстановитьповрежденные бактерии и обеспечить достаточную степень размножения клеток Salmonella. После предварительного обогащения культуру переносят в соевый бульон Раппапорта-Вассилиадиса (ЛКУ-бульон) в пропорции 0,1 мл на 10 мл бульона, а также в тетратионатный бульон Мюллера-Кауфмана с новобиоцином (МКТТn) в соотношении 0,1 мл на 10 мл бульона. В стандарте ISO 6579 последнего пересмотра (2002 г.) селективный бульон Раппапорта-Вассилиадиса (RV) был заменен RVS-бульоном, в котором вместо триптона используют соевый пептон, что позволило улучшить степень выделения Salmonella.
Вторая селективная обогатительная среда, МКТТn-булъон, пришла на смену селенит-цистеиновому бульону (SC), так как селенит токсичен. Использование двух селективных обогатительных бульонов считается необходимым для выделения всех серотипов Salmonella, включая S. typhi и S. paratyphi. RVS- и МКТТn-бупьоны инкубируют в течение 24 ч при температурах соответственно 41,5 и 37 °С. После обогащения культуры используют для посева на две селективные среды: ксилозо-лизиновый дезоксихолатный агар (XLD-arap) и другую плотную селективную среду (по выбору лаборатории). Желательно, чтобы эта вторая агаровая среда была бы дополняющей к XLD-arapy и подходила для выделения лактозопозитивных Salmonella, S. typhi и 5. paratyphi. XLD-arap инкубируют при температуре 37 °С и исследуют через 24 ч. Колонии Salmonella (предположительно) пересевают, после чего подтверждают наличие именно сальмонелл с помощью соответствующих биохимических тестов. Культуры, идентифицированные как Salmonella, затем серотипируют с помощью реакции агглютинации на предметном стекле, после чего способные к аутоагглютинации штаммы исключают. Референтная лаборатория по Salmonella должна выполнять любое типирование, необходимое для их обнаружения.
Процедура выделения сальмонелл, описанная в руководстве Bacteriological Analytical Manual FDA, несколько отличается от метода согласно стандарту ISO 6579 – так, в нем более подробно описаны способы обнаружения Salmonella в конкретных пищевых продуктах, особенно в продуктах с низким содержанием влаги. Кроме того, в качестве среды для предварительного обогащения обычно используется лактозный бульон, а RV-агар и тетратионатный бульон применяются как селективные обогатительные среды. Гектоен-энтероагар, XLD-агар и висмутсульфит-агар рассматриваются как среды для селективного выделения.
Метод выделения Salmonella из мяса, мяса птицы и яйцепродуктов, описанный Инспекционной службой безопасности сельхозсырья и пищевых продуктов Министерства сельского хозяйства США ( US Department of Agriculture-Food Safety Inspection Service), подразумевает применение для предварительного обогащения BPW, для селективного обогащения – модифицированной среды RV, а для селективного посева на чашки – ксилозолизинового агара с тергитолом 4 или дважды модифицированного лизинового железосодержащего агара. Помимо стандартных методов описаны также и другие культуральные методы обнаружения Salmonella с использованием модифицированных общепринятых сред для предварительного обогащения и посева на чашки.
Несмотря на многочисленные попытки сократить продолжительность периода предварительного обогащения, обычно для удовлетворительного восстановления и размножения целевого микроорганизма требуется 16-20 ч. Единый протокол для предварительного обогащения Salmonella применительно ко всем пищевым продуктам разработать невозможно, в связи с чем зачастую используют различные модификации стандартной среды для предварительного обогащения (BPW). Для облегчения выделения S. enteritidis из яиц и яйцепродуктов предложено несколько добавок к BPW, в том числе аммоний-железо (III)-цитрат, ферриоксамины Е и G, а также новобиоцин в сочетании с цефсулодином. Известны также модификации среды на основе тетратионата, включая бульон Мюллера-Кауфмана. Селективность этих сред зависит от наличия у сальмонелл фермента тетратионатредуктазы. В качестве селективных агентов R V-бульона служат малахитовый зеленый и хлорид магния (известно несколько модификаций этой среды).
Эффективным для ускоренного обнаружения и выделения Salmonella и некоторых других патогенных бактерий оказалось применение обогащения «по признаку подвижности». При использовании этого метода, основанного на подвижности большинства видов сальмонелл, на присутствие этого микроорганизма указывает образование (после посева предварительно обогащенной культуры в селективную полутвердую среду с последующей инкубацией в течение ночи) зоны роения. В нескольких сравнительных исследованиях такого обогащения «по признаку подвижности» в модифицированной полутвердой среде Раппапорта-Вассилиадиса (MSRV) методика выделения Salmonella из пищевых продуктов была подтверждена как очень эффективная. Результаты, получаемые при использовании среды MSRV, как правило, лучше или, по крайней мере, не хуже результатов, получаемые с применением RV-бульона. О меньшей степени выделения сальмонелл сообщается очень редко (возможно из-за присутствия неподвижных сальмонелл). При использовании среды MSRV обнаружение сальмонелл является простым и дешевым, причем и отрицательные, и положительные результаты доступны на сутки раньше, чем при использовании стандартного метода по ISO. В 2007 г. должна была быть принята поправка к стандарту ISO 6579 относительно возможности применения среды MSRV для обнаружения Salmonella spp. в фекалиях животных и в образцах, взятых на первых стадиях переработки мяса на бойнях. В диагностической среде для выделения Salmonella (DIASALM) используется сахароза-бромкрезолпурпурный индикатор, показывающий миграцию сальмонелл в виде розовых зон внутри зеленой среды. В качестве комбинированных сред для обогащения и выделения Salmonella среды DIASALM vi MSRV являются равноценными.
Оптимальная среда для выделения всех серотипов Salmonella еще не разработана, и поиск новой среды для выделения продолжается. Это означает, что необходимо использовать параллельно не менее двух сред для посева на чашки. Неспособность сбраживать лактозу, продуцированиие H2S и подвижность являются характерными особенностями сальмонелл, используюемыми во многих существующих средах для их выделения. Тем не менее примерно 1% сальмонелл все-таки способны сбраживать лактозу, причем описаны пищевые отравления человека, вызванные этими штаммами. Чтобы не пропустить лактозо-положительные штаммы, для посева на чашки рекомендуется использовать соответствующую лактозо-независимую среду типа висмут-сульфит-агара. Существование Неотрицательных и неподвижныхштаммов сальмонелл также делает необходимым использование второй среды для чашечного посева. Характеристики некоторых агаровых сред, обычно применяемых для выделения Salmonella, приведены в табл. 10.2.
Таблица 10.2.
Характеристики культуральных сред для выделения сальмонелл

В некоторых случаях может понадобиться количественное определение Salmonella, в частности, для оценки эффективности программ контроля численности сальмонелл в птицеводстве. Непосредственное количественное определение посевом на чашках обычно невозможно из-за низкой численности этих бактерий по сравнению с содержанием конкурирующей микробиоты и поврежденных клеток сальмонелл. В качестве метода примерной количественной оценки сальмонелл рекомендуется метод наиболее вероятного числа (НВЧ), который состоит из последовательных разведений пробы, каждое из которых используется для посева в несколько параллельных пробирок с BPW. После обычной инкубации следуют этапы, описанные в стандартных методах выделения Salmonella. Метод НВЧ довольно непрактичен и трудоемок, однако более удобных альтернативных культуральных методов до сих пор не разработано.
10.2.3. Campylobacter
Патогенные Campylobacter spp., присутствующие в пищевых продуктах, относятся к «термотолерантной» или «термофильной» группам бактерий. Наиболее часто встречаемыми видами являются С. jejuni и С. coli. Кроме того, описаны и новые виды, в том числе С. lari, С. upsaliensis и другие. Основополагающее значение при выборе методов обнаружения и выделения этих довольно «привередливых» микроорганизмов имеют следующие факторы.
- Рассматриваемые виды Campylobacter способны расти при температруе 42 °С и не способны – при температуре 25 °С. Так как многие Campylobacter spp. при 37 °С характеризуются лучшим ростом, чем при 42 °С, то в этом случае правильнее использовать термин «термотолерантные», а не «термофильные». Кроме того, на выделяемые генотипы С. jejuni может влиять температура инкубации.
- Для оптимального роста Campylobacter требуется газовая среда с пониженным содержанием кислорода, состоящая из 5% O2,10% СО2 и 85% N2. Ее создают обычно в укупоренной емкости с помощью газогенераторного пакетика или вакуумирования с последующим замещением воздуха газовой смесью. В качестве альтернативы вместо указанной газовой среды можно инкубировать обогатительный бульон в бутылях или флаконах с завинчивающейся крышкой, наполненных почти доверху (свободное пространство под крышкой – менее 2 см).
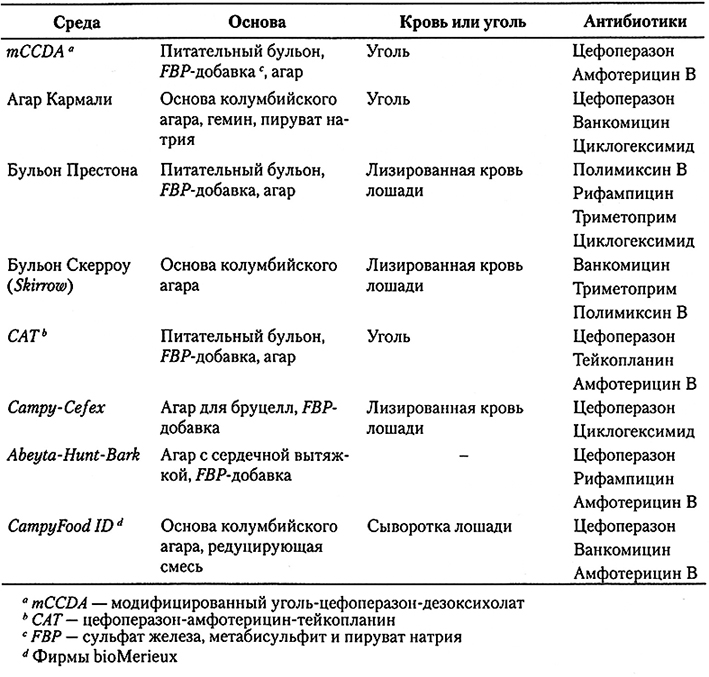
- Среды для выделения Campylobacter spp. должна иметь особый состав, так как эти бактерии размножаются относительно медленно и легко зарастают конкурирующими микроорганизмами (именно поэтому для подавления роста нецелевых микроорганизмов в культуральных средах по-прежнему широко применяют антибиотики – цефоперазон, триметоприм, рифампицин, ванкомицин, полимиксин В и амфотерицин В в различных сочетаниях). В отличие от многих других бактерий, Campylobacter spp. не сбраживают обычные сахара, так что для демонстрации их роста не могут использоваться индикаторы рН или реакций брожения. Для нейтрализации токсичного действия кислорода в среду для выделения зачастую добавляют сульфат железа, метабисульфит и пируват натрия (FBP-добавку) в дозировке каждого компонента 0,25 или 0,5 г/л. Нейтрализовать токсические производные кислорода помогаетдобавление лизированной лошадиной или овечьей крови. На существующей в настоящее время культуральиой среде колонии Campylobacter зачастую выглядят маленькими и бесцветными; обычно они зарастают более крупными и заметными колониями других микроорганизмов, которые обнаружить гораздо легче.
Протокол выявления термотолерантных Campylobacterspp. в пищевых продуктах и кормах для животных согласно стандарту ISO 10272 приведен на рис. 10.2. На первом этапе исследуемая часть пробы добавляется к жидкой обогатительной среде, бульону Болтона в разведении 1 : 9 (1 в 10). В последней версии этого стандарта от 2006 г. бульон Болтона используется вместо и бульона Престона, и бульона Парка-Сандерса, служившими средами для обогащения в первой версии стандарта 1995 г. В чашках, засеянных из обогатительных культур на основе бульона Болтона, наблюдался больший рост Campylobacter, чем в чашках, засеянных бульоном Престона. В других исследованиях для выделения Campylobacter spp. из продуктов из мяса птицы бульон Парка-Сандерса был признан лучше бульона Престона.
Рис. 10.2. Обнаружение Campylobacter в пищевых продуктах согласно стандарту ISO 10272-1.
По. mCCD-arap – модифицированный угольный агар с цефоперазоном и дезоксихолатом
Инкубация в бульоне Болтона и газовой среде с пониженным содержанием кислорода вначале производится при температуре 37 °С в течение 4-6 ч, позволяя восстановиться поврежденным клеткам, после чего инкубацию продолжают уже при температуре 41,5 °С, соответствующей рекомендуемой для обогащения Salmonella и обнаружения Е. coli О157 стандартами ISO.Из полученных после обогащения культур производят посев на две твердые селективные среды. В последней версии стандарта ISO 10272 (2006 г.) в качестве среды первого выбора для посева на чашки вместо агара Кармали используется модифицированный угольный агар с цефоперазоном и дезоксихолатом (mCCD-arap). Агар Кармали – это разновидность mCCD-arapa, причем эти среды не слишком различаются по своей способности выделять Campylobacter spp. из продуктов на основе куриного мяса. Вторая среда выбирается произвольно, но желательно, чтобы в ее основе лежал принцип, отличный от mCCD-агара. Состав сред, наиболее часто используемых для выделения Campylobacter spp., приведен в табл. 10, однако многие из этих сред почти не отличаются по составу и способности к выделению этих бактерий. До сих пор ощущается потребность в более селективных и более дифференцирующих средах, позволивших бы облегчить обнаружение и количественное определение Campylobacter spp.
Таблица 10.3.
Состав сред для выделения Campylobacter
Чашки с агаром инкубируют в газовой среде с пониженным содержанием кислорода в течение 40-48 ч при температуре 41,5 °С. Типичные или предполагаемые колонии пересевают на неселективный колумбийский кровяной агар. Некоторым лаборантам бывает трудно отобрать колонии с mCCD-агара, так как они могут прилипать к этой среде. Кроме того, чтобы отличить Campylobacter spp. от других бактерий, растущих на большинстве существующих сред, необходим определенный опыт, так как колонии Campylobacter spp. могут иметь разные размеры и строение в зависимости от условий роста и размножения – так, подсохший слой питательной среды в чашке иногда способствует росту только точечных колоний, а избыточная влажность в ходе инкубации позволяет образовываться крупным размытым колониям.
Характерные свойства термотолерантных Campylobacter spp., позволяющие подтвердить их присутствие и идентифицировать, сведены в табл. 10.4. Особенно важно, чтобы подозрительные колонии исследовались на типичную клеточную морфологию (мелкие, тонкие, искривленные палочки) и подвижность (по типу «буравчика»). Оксидазный тест (у Campylobacter spp. – положительный) отличает эти микроорганизмы от других оксидазоотрицательных энетробактерий. Способность к росту в газовой среде с пониженным содержанием кислорода при 25 °С, отсутствующая у термотолерантных Campylobacter spp., характерна для других представителей этого рода и Arcobacter spp. Аэробный рост при температуре 41,5 °С должен отсутствовать, благодаря чему можно дифференцировать термотолерантные Campylobacter spp. от оксидазоположительных аэробных грамотрицательных бактерий, например, от Pseudomonas spp. Этих тестов обычно бывает достаточно для подтверждения принадлежности изолята к группе термотолерантных Campylobacter spp. Окончательное подтверждение можно получить при использовании тест-наборов на основе латекс-агглютинации. Для дальнейшей идентификации на уровне видов рекомендуется провести анализ на чувствительность к налидиксовой кислоте и стойкость к цефалотину, а также на гидролиз гиппурата и индоксилацетата. Из-за повышения резистентности многих штаммов Campylobacter к антибиотикам тесты на чувствительность к ним постепенно становятся все менее надежными.
Таблица 10.4.
Характерные особенности некоторых видов термотолерантных Campylobacter spp.

В работе описан американский метод выделения Campylobacter spp. из пищевых продуктов и воды, который существенно не отличается от метода согласно стандарту ISO 10272. Для обогащения и посева на чашки либо с mCCD-агаром, либо с агаром Abeyta-Hunt-Bark используется бульон Болтона. Кроме стандартных методов, разработано множество иных способов выделения Campylobacter spp. культуральными методами с другими протоколами обогащения, условиями инкубации и средами для посева на чашки.
Количественное определение Campylobacter может быть полезно при проверке эффективности конкретных мер и при оценке рисков для здоровья человека. Количественная оценка зачастую бывает основана на методе НВЧ, хотя непосредственный посев на чашки очевидно проще. При последнем подходе суспензии проб или их разведения высевают прямо на чашки с селективным агаром (см., например, ). Чашки затем инкубируют в условиях пониженного содержания кислорода, после чего подсчитывают число типичных колоний Campylobacter. В стандарте ISO 10272, часть 2 описывается метод подсчета колоний, применяемый для Campylobacter spp. из пищевых продуктов и кормов для животных. Чашки с mCCD-агаром засевают указанным количеством исходной суспензии исследуемой пробы или соответствующими ее разведениями. После инкубации при температуре 41,5 °С в течение 40-48 ч проводят подтверждающее исследование подозрительных колоний и подсчитывают количество КОЕ Campylobacter spp в 1 мл или 1 г исследуемой пробы (исходя из количества подтвержденных колоний на чашку).
Для оценки уровня контаминации пробы видами Campylobacter может оказаться полезным полуколичественное определение этого микроорганизма. В работе описыван метод, при котором десятикратные разведения готовят переносом 1 мл первичной суспензии образца в BPW в 9 мл обогатительного бульона. После инкубации и последующего посева на чашки учитывают все чашки с типичными колониями. Численность определяют по порядку возрастания из модифицированной таблицы НВЧ. Данный метод входит в стандарт NMKL по обнаружению и определению численности Campylobacter в пищевых продуктах.
10.2.4. Escherichia coliО157
Чтобы обнаружить наличие в пищевых продуктах или пробах из окружающей среды продуцирующий шигатоксин штамм Е. coli О157 (STEC), необходимы особо чувствительные методы, так как этот патогенный микроорганизм может присутствовать только в небольшом количестве наряду с высокой концентрацией конкурирующих микроорганизмов. Способность выявлять маленькие количества STEC в пищевых продуктах особенно важна для гарантии их безопасности, так как считается, что его инфицирующая доза составляет менее 10 бактерий.Селективное обогащение перед посевом на чашки с селективной средой для выделения является общепринятой частью большинства методов обнаружения Е. coli О157. К селективным агентам обычно относят новобиоцин или акрифлавин (для ингибирования роста грамотрицательных микроорганизмов) и сочетание ванкомицина, цефсулодина и цефиксима (для торможения роста Aeromonas и Proteus spp.). Вместе с тем некоторые селективные агенты могут ингибировать рост поврежденных клеток. Так, пробы пищевых продуктов с Е. coli О157, поврежденных при замораживании, перед селективным обогащением рекомендуется выдерживать при комнатной температуре в течение 3 ч. Кроме того, для выявления клеток, испытавших тепловой, холодовый, кислотный или солевой стресс, может понадобиться предварительное обогащение в неселективном бульоне типа BPW или универсального бульона для предварительного обогащения. Для селективного обогащения температура инкубации обычно составляет 41-42 °С – более низкие температуры дают снижение селективности. В отличие от других штаммов Е. coli, рост штамма О157 при 44-45 °С зачастую намного меньше.
Наиболее чувствительным и экономически эффективным методом выделения Е. coli О157 из пищевого сырья является, по всей видимости, иммуномагнитная сепарация (ИМС) после селективного обогащения с последующим поверхностным посевом концентрированных клеток-мишеней на чашки с селективной средой. Метод разделения на основе иммунозахвата и концентрации включает иммунологическое связывание (захват) с последующим физическим отделением микроорганизмов-мишеней от смешанной обогатительной культуры, после чего происходит повышение концентрации клеток. Чувствительность ИМС можно повысить путем увеличения концентрации Е. coli О157 относительно фоновых микроорганизмов, которые могут маскировать или покрывать целевые клетки на твердой селективной среде. Отличительными признаками этого штамма Е. coli по сравнению с другими являются отсутствие сбраживания сорбитола в течение 24 ч и отсутствие β-глюкуронидазной (GUD-) активности. Обнаружение этого микроорганизма значительно упростилось с использованием агара МакКонки с сорбитолом (SMAC-агара), причем селективность SMAC-агара была повышена путем добавления цефиксима и теллурита (СТ-SMAC-агар). Сорбитол-отрицательные колонии, свидетельствующие о наличии типичных штаммов Е. coli О157, на этой среде бесцветны. Так как некоторые штаммы чувствительны к теллуриту и/или сбраживают сорбитол, рекомендуется использовать вторую среду для выделения – например, одну из современных хромогенных сред. Такие среды основаны на характерном отсутствии Gt/D-активности почти у всех штаммов серогруппы О157. В составе этих сред обычно присутствует хромогенное соединение 5-бром-4-хлор-3-индолил- β-D-глюкуронид.
Стандарт ISO 16654 предписывает использовать горизонтальный метод обнаружения Е. coli О157 (рис. 10.3). Селективное обогащение включает инкубацию в модифицированном триптон-соевом бульоне с новобиоцином (mTSB + N) в течение не менее 6 ч при 37 °С и затем еще 12-18 ч при той же температуре. Для повышения концентрации целевых клеток используют иммуномагнитную сепарацию. Для селективного выделения требуется посев на чашки с CT-SMAC-агаром и любой другой селективной средой (по выбору лаборатории). Для подтверждения присутствия E. coli сорбитолотрицательные колонии на СТ-SMAC-агаре и колонии, типичные для штаммов О157 на второй среде, подвергают исследованию на продуцирование индола, после чего тестируют на агглютинацию с антисывороткой для Е. coli О157. В специализированных лабораториях можно проводить дополнительные анализы на факторы вирулентности.
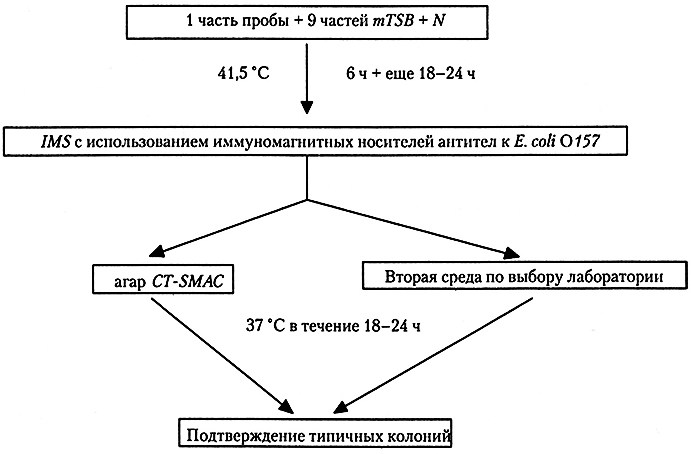
Рис. 10.3. Протокол обнаружения Е. coli О157 в пищевых продуктах согласно стандарту ISO 16654.
Обозначения: mTSB + N – модифицированный триптон-соевый бульон с новобиоцином; IMS – иммуномагнитная сепарация;
CT-SMAC-агар МакКонки с сорбитом и добавлением цефиксима и теллурита
В культуральных методах обнаружения Е. coli О157 помимо бульона mTSB + N, применяемого в стандартном методе, используют также другие обогатительные бульоны – триптон-соевый бульон, бульон для Е. coli (ЕС-бульон) и BPW с селективными агентами (новобиоцином, акрифлавином, солями желчных кислот, ванкомицином, цефиксимом и цефсулодином). Эффективность этих сред проверялась в нескольких исследованиях и было показано, что она зависит от типа исследуемых проб и условий обогащения. С модифицированным.ЕС-бульон с новобиоцином успешно работают во многих лабораториях. Недавно появилось описание нового «метода кислотного обогащения», причем в ходе сравнительных исследований было показано, что она эффективна для обнаружения штаммов О157. Данный метод включает в себя обогащение в сильнокислых условиях, позволяющее снизить численность конкурирующих микроорганизмов, с последующим повышением значения рН выше 7,0 для обеспечения оптимального роста целевых микроорганизмов в среде без ингибиторов. Кроме того, известны несколько хромогенных сред для выделения штаммов О157, причем некоторые из них, в частности CHROMagar О157 (CHROMagar™, фирма Dr A. Rambach) и Rainbow™ Agar О157 (фирма Biolog Inc.) производятся в промышленных масштабах. Для достижения удовлетворительной селективности эти хромогенные среды требуют добавления соединений-ингибиторов (например, цефиксима, новобиоцина и теллурита). Колебания температуры инкубации и использование чашек с агаровыми средами, хранившихся нескольких недель, могут привести к изменениям характерной окраски на хромогенной среде.
Сравнительные исследования селективных агаровых сред для штаммов О157 проводились неоднократно. В большинстве случаев оказалось, что наиболее эффективным для выделения типичных сорбитол-отрицательных штаммов является CT-SMAC- агар. Тем не менее на нем могут давать подозрительные колонии и другие представители семейства Enterobacteriaceae, например, некоторые штаммы Hafnia, Klebsiella и Enterobacter. Таким образом, методика культурального обнаружения Е. coli О157 должна включать использование CT-SMAC-агара и, желательно, второй среды для выделения на основе несбраживания сорбитола, а, например, определения p-глюкуронидазной (01/0)-активности.
10.2.5. Listeria monocytogenes
Для обнаружения L. monocytogenes предложены самые разные методики. Так как для выделения этого микроорганизма из пищевых продуктов прямой посев на чашки зачастую оказывается безуспешным, типовой метод складывается из селективного обогащения и последующего выделения на селективном агаре. В настоящее время нет обогатительных сред, которые могли бы дифференцировать L. monocytogenes от популяций других видов листерий. В разных обогатительных бульонах L. monocytogenes не дает хорошего роста в присутствии других зачастую быстрее растущих Listeria spp. Процедура обогащения для L. monocytogenes обычно включает первую и вторую стадии. Первичные бульоны или бульоны для предварительного обогащения содержат сниженные количества селективных агентов, что позволяет поврежденным клеткам восстановить их жизнеспособность. В широко применяемых обогатительных средах в качестве селективных агентов содержатся акрифлавин, налидиксовая кислота и циклогексимид наряду с фосфатной буферной системой. В состав некоторых сред в качестве дополнительного селективного агента включают хлорид лития, а для восстановления поврежденных клеток – пируват натрия.
На многих селективных средах, применяемых для посева на чашки, колонии L. monocytogenes неотличимы от колоний других Listeria spp. Это относится, в частности, к таким широко распространенным средам, как модифицированная оксфордская среда для листерий (МОХ) и PALCAM (ПАЛКАМ, агар для идентификации листерий). Эти среды содержат эскулин и цитрат железа, и Listeria spp. характеризутся черными зонами вокруг колоний, цвет которым придает гидролизованный эскулин. Когда L. monocytogenes присутствуют в числе других разнообразных Listeria spp., то для идентификации целевого микроорганизма требуется протестировать много колоний. Были предприняты многочисленные попытки создания твердой селективной среды для специфического выделения L. monocytogenes, однако это оказалось трудной задачей. Относительно недавно появились описания некоторых хромогенных сред, селективных для листерий и позволяющих дифференцировать L. monocytogenes от других присутствующих микроорганизмов этого рода, – это агар для листерий Оттавиани (Ottaviani) и Агости (Agosti) (ALOA) и среда Rapid'LMono® (фирма Biorad Laboratories Inc.) для идентификации листерий. В среде ALOA хромогенное соединение Х-глюкозид добавлено в качестве субстрата для выявления β-глюкозидазной активности, что является общим признаком представителей рода Listeria. Дифференциация L. monocytogenes от других видов листерий основана на продуцировании первыми фосфатидилинозитол-специфичной фосфолипазы С (PIPLC), которая может гидролизовать добавленный субстрат, что приводит к появлению вокруг колоний непрозрачного ясно очерченного гало (зоны помутнения среды). Все непатогенные листерии образуют колонии характерного зеленовато-голубого вида. При исследовании проб, содержавших и L. monocytogenes, и L. innocиа, среда ALOA оказалась лучше, чем среды Oxford и PALCAM [135]. Среда Rapid'L. Mono™ также основана на хромогенном обнаружении PIPLC, проявляющемся в гидролизе д:-инозитолфосфата, содержащегося в агаре, и голубом окрашивании ксилозо-отрицательных колоний L. monocytogenes безжелтого гало. При оценке хромогенных сред для обнаружения Listeria spp. в пищевых продуктах среды ALOA, Rapid'L. Mono™ и Oxford-агар оказались одинаково эффективными относительно выделения L. monocytogenes, однако выделение других видов листерий на среде Rapid'L. Mono™ происходило хуже, чем на средах Oxford и ALOA.
Протокол обнаружения L. monocytogenes в пищевых продуктах и кормах для животных согласно стандарту ISO 11290 приведен на рис. 10.4. Он включает двухэтапную процедуру обогащения, причем посев культур производится штрихом на среду ALOA и вторую агаровую среду из первичного обогащения (бульон Фрейзера половинной концентрации) через 1 сут. инкубации, а вторичное обогащение (бульон Фрейзера) проводят через 2 сут инкубации. Относительно недавно в этом стандарте среда ALOA вытеснила среды Oxford и PALCAM, одна из которых может использоваться в качестве второй среды для посева на чашки (по выбору лаборатории). Данный стандартный метод показал удовлетворительные результаты при обнаружении L. monocytogenes, но, возможно, не будет оптимальным для проб пищевых продуктов разных типов. В некоторых случаях штриховой посев вторичного обогатительного бульона через 48 ч инкубации, по-видимому, не нужен. Метод согласно стандарту ISO 11290-1 прошел валидизацию, показав суммарную чувствительность 85,6%, причем специфичность составила 97,4%.
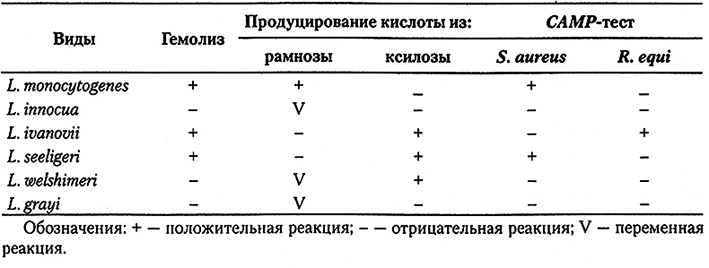
Для подтверждения присутствия Listeria spp. типичные колонии тестируют на каталазу (положительная реакция), окрашивание по Граму (грамположительные тонкие короткие палочки) и подвижность (положительная реакция). Если морфологические и физиологические характеристики, а также каталазная реакция оказываются показательными для Listeria spp., то штамм тестируют на гемолиз, гидролиз рамнозы и ксилозы и подвергают САМР-тесту с использованием в качестве тестовых штаммов Staphylococcus aureus и Rhodococcus equi. Типичные реакции для различных видов листерий указаны в табл. 10.5. Существуют несколько коммерческих тест-наборов для идентификации Listeria spp, однако зачастую для подтверждения присутствия именно L. monocytogenes требуется проведение дополнительного теста на гемолиз или CAMP-теста.
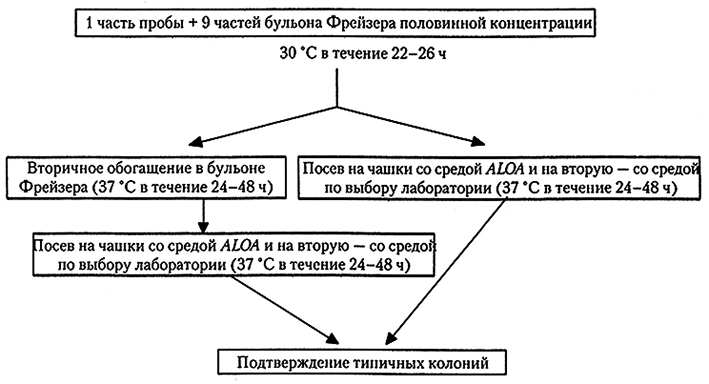
Рис. 10.4. Протокол обнаружения Listeria monocytogenes в пищевых продуктах согласно стандарту ISO 11290-1.
Обозначения: ALOA – агар для листерий Оттавиани и Агости
Таблица 10.5.
Дифференциация видов Listeria spp.
Количественное определение L. monocytogenes по стандарту ISO 11290-2 включает следующие стадии:
- приготовление исходной суспензии пробы в BPW;
- восстановление жизнеспособности клеток при 20 °Св течение 1 ч;
- поверхностный посев на чашки суспензии образца и последующих десятикратных разведений в двух повторностях на среду ALOA;
- инкубация чашек при 37 °С и проведение анализа через 24 и 48 ч инкубирования;
- подтверждение предполагаемого присуствия L. monocytogenes;
- подсчет численности L. monocytogenes.
В США Министерством сельского хозяйства для выделения L. monocytogenes из мяса, мяса птицы, яйцепродуктов и проб окружающей среды рекомендован метод, который включает первичное обогащение в модифицированном бульоне Вермонтского Университета (University of Vermont broth), вторичное обогащение в бульоне Фрейзера и выделение на МОХ-агаре.
Управление по контролю за пищевыми продуктами и лекарственными препаратами США (FDA) рекомендует метод обнаружения L. monocytogenes, включающий неселективное обогащение в забуференном бульоне в течение 4 ч при температуре 30 °С (для увеличения концентрации листерий), последующие внесение селективных агентов (акрифлавина, налидиксовой кислоты, циклогексимида) и продолжение инкубации при температуре 30 °Сеще 26 ч так, чтобы общая длительность инкубирвания составила 48 ч. Обогащенную культуру через 24 и 48 ч сеют штрихом на среды, содержащие эскулин (например, на МОХ-агар, PALCAM или агар с литий хлоридом-фенилэтанол-монолактамом, причем к ним добавляются эскулин и железо), а также на одну из современных хромогенных сред (последнее рекомендуется).
Сравнению сред, содержащих эскулин, посвящено несколько работ. Результаты этих исследований показывают, что иследуемые среды существенно не различаются по продуктивности, однако показатели каждой среды существенно зависят от количества и состояния как целевых, так и нецелевых организмов в пробе. Для оптимального обнаружения L. monocytogenes рекомендуется использовать сочетание эскулин-содержащей и хромогенной среды.
10.3. ЭКСПРЕСС-МЕТОДЫ
10.3.1. Введение
Основным недостатком традиционных культуральных методов является то, что они занимают много времени – для получения результатов требуется несколько суток, так что в ускоренных методах обнаружения патогенных микроорганизмов в пищевых продуктах существует огромная потребность. Применение таких методов позволило бы производителям пищевых продуктов предотвращать выпуск контаминированных пищевых продуктов и реализовывать свою продукцию с особой надписью на этикетке типа «не содержит специфических патогенных микроорганизмов».
Ряд экспресс-методов обнаружения пищевых патогенов уже разработан, причем тест-наборы для некоторых из них уже поступили в продажу. Данные методы делятся на две основные категории: иммунологические методы (или исследования с помощью антител) и молекулярные (или генетические) методы – например, с использованием цепной реакции полимеразы (полимеразной цепной реакции, ПЦР). Эти группы методов мы рассмотрим в разделах 10.3.2 и 10.3.3.
К другим видам ускоренных методов, используемых в пищевой микробиологии, но на которых мы подробнее останавливаться не будем, относятся методы импеданса, биолюминесценция, проточная цитометрия и прямая эпифлюоресцентная микроскопия. Из них для обнаружения в пищевых продуктах патогенных микроорганизмов, в частности, Salmonella и Campylobacter, применяются только методы импеданса, но использование импедансометрии ограничено необходимостью калибровать прибор отдельно для каждой категории пищевых продуктов и недостаточной чувствительностью обнаружения при низкой концентрации микроорганизмов или в случае их сублетальных повреждений.
Рекомендуется провести валидизацию новых экспресс-методов в соответствии со стандартом ISO 16140, в котором описаны основные принципы и протокол валидизации альтернативных методов микробиологического анализа пищевых продуктов, кормов для животных, ветеринарных образцов и проб окружающей среды. В работах по валидизации методов анализа на пищевые патогены зачастую проблемой является доступность естественно зараженных образцов. Сертификация имеющихся в продаже тест-наборов осуществляется одним из международных органов сертификации, в частности MicroVal, АОАС, AFNOR или NORDVAL.
10.3.2. Иммунологические методы
Иммунологические методы основаны на специфическом взаимодействии между антителом и антигеном, ассоциированным с целевым микроорганизмом. Решающее значение имеют выбор и типы антигена и антитела, так как это заметно влияет на специфичность конкретного метода. Антигеном может быть специфический липополисахарид на наружной поверхности клеточной стенки, белок жгутиков некоторых подвижных бактерий или продукт или токсин, вырабатываемый данным микроорганизмом в процессе роста. Создание моноклональных антител значительно повысило специфичность иммуноанализов, которые относительно просты в выполнении и дают возможность проанализировать много образцов. Для большинства иммунологических тестов при обнаружении специфического микроорганизма требуется посевной материал в количестве 104 КОЕ/мл, что делает необходимым проведение стадии предварительного обогащения. Примеры доступных на рынке иммуноанализов для обнаружения пищевых патогенов представлены в табл. 10.6, причем выбор того или иного тест-набора определяется потребностями лаборатории.
Таблица 10.6.
Серийно выпускаемые иммуноанализы для обнаружения патогенов в пищевых продуктах


Агглютинационные тесты
В агглютинационных тестах антиген реагирует с соответствующим ему антителом, приводя к видимой аггрегации бактериальных клеток. В тестах на латексагглютинацию частицы латекса покрывают антителами, которые склеивают (агглютинируют) специфические антигены и образуют лучше видимый преципитат. Агглютинационные тесты зачастую применяют для начального подтверждения наличия специфических патогенов. Так как антитела к целевому микроорганизму могут перекрестно реагировать с другими микроорганизмами и может наблюдаться аутоагглютинация, то эти тесты могут рассматриваться в качестве скрининг-тестов (то есть предварительных, отсеивающих испытаний), для которых обычно требуется дополнительное подтверждение. На рынке предлагаются агглютинационые тесты для большинства патогенных микроорганизмов (фирм Microgen Bioproducts Ltd, Oxoid, Remel Inc. и др.).
Метод ELISA
Метод ELISA (метод обнаружения специфических антител или антигенов с помощью иммобилизованного на антигене или антителе фермента) является широко распространенным иммунологическим методом обнаружения пищевых патогенов. Он заключается в использовании антител, специфических для молекул-мишеней. Чтобы захватывать антигены-мишени, эти антитела иммобилизуют на твердом носителе. Комплекс «антиген-антитело» затем выявляют по его реакции с конъюгатом «фермент-антитело» и хромогенным субстратом. В качестве твердого носителя часто используют планшет для микротитрования, но можно применять и бумажные мембраны, и погружные пластины из полистирола. Наиболее распространенной разновидностью имеющихся в продаже тест-наборов является так называемый «сэндвич-метод ELISA», где антитела-мишени прикрепляются к поверхности твердого носителя (например, лунок планшета). В лунку добавляется обогащенная проба и при наличии целевого антигена он связывается с антителом. После промывки для удаления несвязавшегося материала в лунку добавляется второе антитело с ферментной меткой, которое связывается с целевым антигеном, образуя «сэндвичантитело». После промывки добавляется бесцветный субстрат, который окрашивается ферментом. В заключение для прекращения дальнейшей ферментной активности добавляется так называемый «стоп»-раствор и определяется изменение цвета. В норме работа с ELISA-тест-наборами требует 1-2 ч, но, как правило, для увеличения численности целевых микроорганизмов требуется предварительная стадия обогащения, что приводит к увеличению общего времени анализа до 20-24 ч (предварительное обогащение для восстановления жизнеспособности поврежденных клеток требует 16-20 ч). Разработаны тест-наборы ELISA для Salmonella, Campylobacter, Е. coli О157, Listeria и L. monocytogenes (см. табл. 10.6).
Иммуномагнитная сепарация (ИМС)
В ИМС-методах образцы смешивают с иммуномагнитными частицами (или бусинками), покрытыми антителами к микроорганизму-мишени. Целевые клетки образца связываются с бусинками, и после их захвата и концентрации их присутствие может быть установлено с помощью различных методов обнаружения, в том числе прямым посевом на чашки с агаровой средой, ПЦР, ELISA и ДНК-зондов. Важнейшая особенность иммуномагнитной сепарации состоит в том, чтобы необходимо захватить и сконцентрировать целевые бактерии, одновременно устраняя противодействие со стороны пищевого матрикса. Применение ИМС-методов оказалось особенно полезным для обнаружения в пищевых продуктах Е. coli О157, и они включены в соответствующий стандарт ISO 16654. Существуют несколько коммерческих ИМС-систем, в том числе DynabeadsP (фирмы Dynal Invitrogen) для обнаружения Salmonella, Е. coli О157 и Listeria, Captivate™ (фирмы IDG) для Е. coli О157 и A-Beads™ (фирмы Aureon Biosystems) для обнаружения Salmonella и Е. coli О157.
Системы фирмы Dynal Invitrogen – Dynabeads® для обнаружения сальмонелл и автоматизированная ИМС-система, использованная в тест-наборе BeadRetriever™ – применялись для обнаружения Salmonella у крупного рогатого скота и на тушах. Хотя технология ИМС позволяет разработать простые, быстрые, чувствительные и недорогие методы выявления целевых микроорганизмов в смеси бактерий, пищевой матрикс зачастую мешает захвату бактерий иммуномагнитными частицами, что может проявиться в слабом связывании или низкой эффективности захвата.
Новейшей запатентованной технологией является система Pathatrix (см. табл. 10.6), которая также основана на использовании покрытых антителами парамагнитных частиц, селективно связывающих и очищающих микроорганизмы-мишени от сложных пищевых матриксов. Анализу при этом подвергается вся проба путем ее рециркуляции в течение «фазы захвата», в ходе которой магнитные бусины, покрытые антителами, находятся в иммобилизованном состоянии. Подогрев системы позволяет микроорганизмам расти и одновременно захватываться, благодаря чему повышается чувствительность метода. Показано, что система Pathatrix в сочетании с ПЦР позволяет быстро и с высокой чувствительностью выявлять Е. coli О157 в говяжьем фарше.
В последние годы благодаря использованию наночастиц вместо бусин перед ИМС-методами открылись новые перспективы. Магнитные наночастицы размерами 50-150 нм позволяют ускорить кинетику реакций в 5-20 раз по сравнению с микробусинами размером 1-100 мкм. Магнитные наночастицы не мешают хемилюминесценции, флюоресценции и ПЦР, и их потенциально можно использовать при разработке новых методов обнаружения бактерий с помощью иммунологических тест-систем.
Прочие иммунологические тест-наборы
В некоторых коммерческих системах на основе иммунного анализа использованы принцип иммунохроматографии и приспособления для латеральной диффузии или тестовые полоски («дипстики») (из приведенных в табл. 10.6 систем – это Reveal VIP9, RapidChek®, Singlepath®, ImmunoCard STAT® и Rapid Test (на Listeria и Salmonella). Приспособление для латеральной диффузии представляет собой нитроцеллюлозную мембрану, на которой иммобилизовано антитело, специфичное к целевому антигену. Небольшое количество обогащенной культуры вносится в зону нанесения пробы на этом приспособлении, и жидкость перемещается по мембране благодаря капиллярной диффузии. В ходе тока жидкости любой целевой микроорганизм, экспрессирующий специфический антиген, связывается с соответствующим антителом, образуя комплекс, который мигрирует далее в направлении захватывающего и связывающего белку, где он иммобилизуется; при этом в смотровом окне образуется видимая линия, свидетельствующая о присутствии целевого антигена. Во втором смотровом окне должна быть видна контрольная линия, свидетельствующая о правильной работе тест-набора.
Относительно недавно был разработан иммунохроматографический стрип для экспресс-обнаружения Е. coli О157 в обогащенных пробах. Применение такого стрипа в присутствии штаммов серогруппы О157 приводит в течение 10 мин к появлению видимого сигнала; после обогащения эти патогенные микроорганизмы могут обнаруживаться при концентрации не менее 1,8 КОЕ/мл.
В качестве системы для иммуноанализа на твердом носителе применяются также капиллярные колонки. Капиллярный иммуноанализ был разработан для экспресс-обнаружения Salmonella в пищевых продуктах. Эта аналитическая система состоит из модифицированной антителом капиллярной колонки для улавливания целевых бактерий и выполнения ферментной реакции, и оптического или электрохимического детектора для измерения сигнала. Капиллярные колонки могут автоматизироваться, для них требуется минимальное количество иммунореагентов (благодаря маленьким размерам капилляров). Системы VIDAS® и EiaFoss™ (табл. 10.6) – это автоматизированные системы иммуноанализа, эффективные при обнаружении основных патогенов.
В настоящее время нет традиционных культуральных методов для обнаружения STEC, отличных от представителей серогруппы О157, но разработаны некоторые иммунологические тесты для определения шигатоксинов. К ним относятся тест-наборы Premier® ЕНЕС-тест (фирмы Meridian Bioscience Inc.), Duopath® Verotoxins (фирмы Merck KGaA) [(107], Ridascreen® Verotoxin (фирмы R-Biopharm Rhone Ltd.), VTEC-RPLA Screen (фирмы Denka Seiken Co. Ltd.) и VTEC-RPLA (фирмы Oxoid).
10.3.3. Молекулярные методы
В последние 15-20 лет значительно возросло количество биомолекулярных методов, разработанных для обнаружения в пищевых продуктах патогенных микроорганизмов и их характеристики. В основе этих методов лежит обнаружение целевой последовательности нуклеиновой кислоты (ДНК или РНК), являющейся специфической для искомого микроорганизма. Для определения присутствия бактерий в пробе могут использоваться уникальные для того или иного вида бактерий последовательности нуклеиновых кислот. В зависимости от желаемого уровня обнаружения (род, вид, штамм) в качестве мишени можно использовать различные участки генома. Для идентификации патогенов часто используют гены, ассоциированные с вирулентностью, например, у Е. coli – это гены, кодирующие шигатоксин.
Гибридизация нуклеиновых кислот
Метод гибридизации состоит в специфическом связывании молекулы ДНК или РНК, присутствующей в целевом микроорганизме, с ДНК-зондом, в котором имеется последовательность нуклеотидов, комплементарная последовательность целевого микроорганизма. В ДНК-зондах обычно содержатся 15-30 нуклеотидов. Специфичность гибридизационного анализа определяется нуклеотидной последовательностью пробы. Первой стадией этого метода обычно является лизис бактериальной клетки до свободных нуклеиновых кислот таким образом, чтобы они могли гибридизироваться с ДНК-зондом. После образования гибрида могут применяться различные методы его обнаружения. Радиоактивные и флуоресцентные зонды позволяют использовать непосредственное обнаружение гибридизации и применяются в отношении многих патогенных микроорганизмов (как правило в целях подтверждения идентичности культивируемых микроорганизмов). Непрямое обнаружение ДНК-зондов осуществляется с участием фермента-«репортера». Удаление несвязавшихся репортерных зондов осуществляется перед гибридизацией путем иммобилизации либо целевой ДНК, либо зондов. Твердыми носителями для иммобилизации могут быть мембраны или полимерные частицы. Обнаружение фермента-«репортера» осуществляется после этапа промывки в целях удаления несвязавшегося зонда. Ряд гибридизационных тест-систем для обнаружения пищевых патогенов описаны в работе, причем некоторые из них выпускаются серийно. В системах GENE-TRAK® и GeneQuence™ (фирмы Neogen Corporation) использованы патоген-специфичные зонды для целевых ДНК или РНК бактерий и колориметрическая система обнаружения специфических гибридов «зонд-мишень»; аналитические системы разработаны для выявления Salmonella, Campylobacter, Е. coli О157, L. monocytogenes и S. aureus. Система AccuProbeP Campylobacter (фирмы Gen-Probe) представляет собой тест-набор для экспресс-анализа с ДНК-зондом для идентификации термотолерантных Campylobacter spp. Использование систем гибридизации с ДНК-зондами в целях идентификации ограничено их пределом обнаружения (104-105 бактериальных клеток), что свидетельствует о необходимости стадии обогащения . Для чувствительного и специфического обнаружения патогенов метод гибридизации ДНК-зонда можно сочетать с ПЦР-методами.
Цепная реакция полимеразы
Благодаря их повышенной чувствительности зачастую применяют ДНК-методы со стадией амплификации (образования множественных копий определенной нуклеотидной последовательности). Наиболее известным методом амплификации является полимеразная цепная реакция. С помощью ПЦР-методов можно быстро и с высокой степенью чувствительности обнаруживать пищевые патогены. В этих методах двухспиральная ДНК сначала подвергается денатурации до одиночных спиралей, к которым отжигаются (гибридизируются) специфические короткие фрагменты ДНК (праймеры), что сопровождается удлинением праймеров комплементарно к односпиральной ДНК с помощью термостабильной ДНК-полимеразы. (рис. 10.5). Конечный продукт или ампликон традиционно визуализируется в виде полосы на окрашенном этидиумбромидом геле для электрофореза.
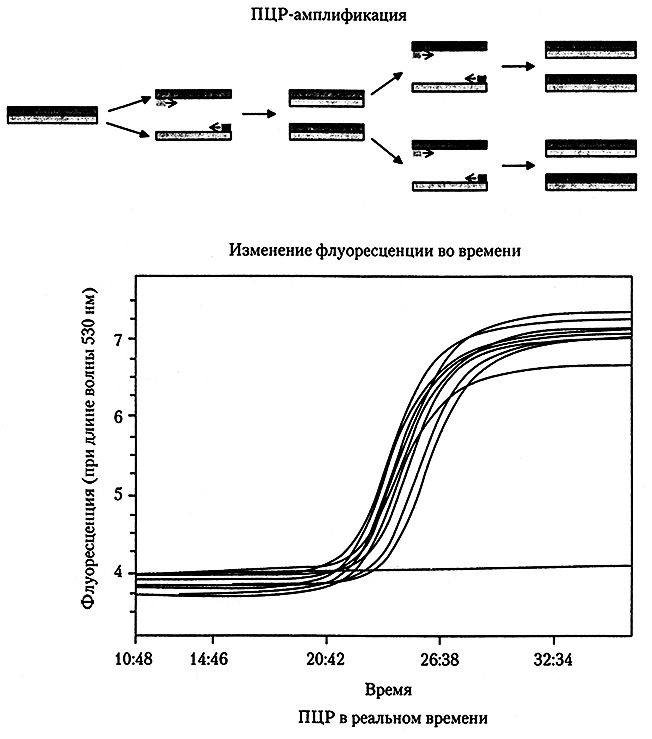
Рис. 10.5. Упрощенная схема полимеразной цепной реакции и график ПЦР в реальном времени
Потенциальной проблемой этого метода является присутствие в некоторых пробах пищевых продуктов ингибиторов ПЦР, что может дать ложноотрицательные результаты. Степень ингибирования существенно зависит от типа пищевого продукта. Описано несколько методов приготовления образцов, включая фильтрацию, центрифугирование, ферментную обработку, разведение, иммуномагнитное разделение и флотацию. Так как различных пищевых матриксов очень много, довольно трудно предложить универсальный метод экстракции ДНК, который подходил бы для всех типов пищевых продуктов. У любого пищевого матрикса свои особенности, зависящие от состава продукта, так что возникающие проблемы можно решать лишь в каждом конкретном случае.
Еще одним потенциальным ограничением применимости ПЦР-методов является возможность обнаружения ДНК, принадлежащей нежизнеспособным организмам. Обогащение пищевых образцов перед ПЦР-амплификацией значительно снижает вероятность обнаружения нежизнеспособных микроорганизмов и, кроме того, увеличивает число живых клеток-мишеней, одновременно уменьшая ингибирующее воздействие пищевого матрикса. Тем не менее включение стадии обогащения в течение ночи существенно увеличивает время обнаружения. В недавно опубликованных протоколах ПЦР предлагается использовать более короткий период обогащения. Для надежности ПЦР-праймеры и условия реакции следует тщательно предварительно оценить и оптимизировать, должны быть разработаны соответствующие методики приготовления образцов с обязательным использованием нескольких контролей, позволяющих отслеживать возможные загрязнения или ингибирование реакции. Из-за возможного неоднородного распределения температур в термоциклере рекомендуется использовать в каждом тесте два положительных контроля: один – в центре блока, а другой – ближе к краю. При этом необходимо дополнительное подтверждение идентичности ампликона, которое может быть получено использованием гнездовой реакции ПЦР*, анализом с помощью гидролизующего фермента рестрикции, гибридизационного тест-набора или путем секвенирования (табл. 10.7).
_____________________
* Проведение двух последовательных ПЦР-реакций, когда исходным материалом для второй реакции является продукт (ампликон) первой реакции. — Примеч. перев.
Таблица 10.7.
Наиболее важные контроли при ПЦР-анализе на патогенные микроорганизмы.

В качестве мишени для ПЦР можно выбрать уникальные генетические последовательности, например, гены бактериальной вирулентности. Разработаны различные тест-наборы на основе ПЦР, специфичные относительно разных генов, в том числе генов сальмонелл (invA, последовательности 165 рРНК, phoP, phoE и fimA), генов L. monocytogenes (hly, prfA и tap) и генов Е. coli О157 (еаеА, stx-1 и stx-2).
Использование методов обнаружения на базе РНК, в частности, ПЦР с обратной транскриптазой (RT-PCR, ОТ-ПЦР) и реакции транскриптационной амплификации РНК (NASBA) [130], может привести к обнаружению лишь жизнеспособных бактерий. Указанные методы основаны на конверсии РНК в ДНК-копию (cDNA, кДНК) с использованием обратной транскриптазы, однако РНК очень неустойчивая молекула, которая быстро деградирует, особенно после гибели микроорганизма. Эта ее особенность существенно затрудняет работу с РНК по сравнению с ДНК.
ПЦР в реальном времени
После появления в середине 1990-х гг. метода ПЦР в реальном времени он нашел самое разное применение в микробиологии. Стандартные тест-наборы на базе ПЦР обеспечивают конечные результаты анализа, в них продукты амплификации обнаруживают в конце процесса, тогда как в случае ПЦР в реальном времени продукты амплификации обнаруживают в ходе амплификации в одном и том же реакционном сосуде с помощью флуоресцирующих соединений (см. рис. 10.5). С возрастанием числа мишеней во время амплификации флуоресценция усиливается. Отмечая момент, когда флуоресценция переходит пороговый уровень (значение Ct), можно определить количество циклов для образцов с различными начальными концентрациями ДНК. Если начальная концентрация высока, то пороговый уровень наступит раньше, чем при низкой концентрации. Путем измерения значения Ct для образцов с известными концентрациями строятся стандартные кривые, которые затем можно использовать для количественной оценки (данный метод применялся к нескольким различным видам образцов и мишеней).
Для получения флуоресцентного сигнала в результате синтеза целевой последовательности обычно используют два основных подхода. В первом используется флуоресцентный краситель, например, SYBR® Green I (фирмы Molecular Probes Invitrogeri), который связывается с двухцепочечной ДНК и претерпевает конформацию, что приводит к усилению флуоресценции. Краситель флуоресцирует только тогда, когда он связан с ДНК, и эта особенность связывания используется для мониторинга процесса амплификации в ходе образования продукта ПЦР. В конце циклов может происходить неспецифическое связывание и наблюдаться помехи со стороны продуктов праймеров-димеров*. Подтверждение последовательностей нуклеотидов продукта амплификации состоит в анализе кривой плавления после ПЦР. К концу ПЦР-цикла температура в термокамере поднимается медленно, и в каждой пробирке измеряется флуоресценция. Как только двухцепочечная ДНК начинает денатурировать, краситель SYBRI® Green I высвобождается, что приводит к уменьшению флуоресценции. Так как каждый двухцепочечный ДНК-продукт характеризуется своей собственной температурой плавления, зависящей в том числе от размеров продукта содержания Г + Ц (гуанин+ цитозин), то анализ кривой плавления можно сопоставить с разделением ПЦР-продуктов по размерам в процессе гелевого электрофореза.
______________________
* Праймеры-димеры — это неспецифические продукты ПЦР, результат отжига праймеров друг с другом. — Примеч. перев.
Второй подход состоит в использовании метода резонансного переноса, энергии флуоресценции (FRET). В настоящее время разработано несколько тест-систем с флуоресцентными зондами, наиболее распространенными из которых являются гидролитические TaqMan®-зонды (фирмы Roche Molecular Systems Inc.), зонды для гибридизации и молекулярные маячки. Имеются тест-системы для целого ряда мишеней и микроорганизмов. TaqMan-зонаы состоят из флуоресцентного репортера на 5'-конце и гасящего красителя (гасителя) на З'-конце. Когда зонд гибридизируется с ампликоном, ДНК-полимераза Taq (термостабильная ДНК-полимераза) расщепляет зонд, отделяя краситель-репортер от гасителя. В результате гидролиза зонда интенсивность флуоресценции возрастает прямо пропорционально концентрации ампликона. Данная тест-система реализуется под названием TaqMan® (фирма Applied Biosystems).
В качестве зондов для гибридизации используют два специальных зонда со специфической последовательностью для каждого ампликона, помеченные двумя различными флуоресцентными красителями. Эти олигонуклеотиды сконструированы так, чтобы при отжиге занимать положение «голова-к-хвосту». Обнаружение основано на генерации флуоресцентного сигнала при связывании двух зондов друг за другом с последовательностью-мишенью. Реализуется данная тест-система под названием LightCyclet® (фирма Roche Diagnostics).
Зонды-маячки («биконы») представляют собой одноцепочечные молекулы нуклеиновой кислоты, имеющие структуру в виде петли с ножкой; они гасят флуоресценцию, находясь в растворе в свободном состоянии. В присутствии комплементарных целевых ДНК или РНК бикон развертывается и гибридизуется с ними; при этом проявляется флуоресценция. В настоящее время описано лишь несколько примеров использования зондов-маячков в целях обнаружения патогенов в пищевых продуктах, так как они дороже большинства других методов на базе FRET (это может препятствовать широкому их применению для ускоренного обнаружения патогенных микроорнизмов).
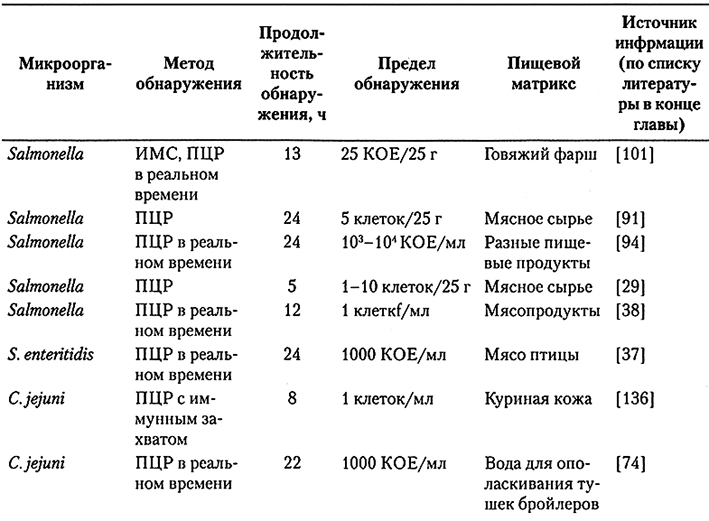
В настоящее время существует несколько тест-наборов для ПЦР в реальном времени, в том числе ABI-PRISM® 7000 (фирма Applied Biosystems), RotorGene™ 3000 (фирма Corbett Research), iCycler iQ® ( фирма Bio-Rad Laboratories) и LightCyclet®. В большинстве из них предусмотрено 2-4 оптических канала, что позволяет решать сложные задачи и использовать интерактивное программное обеспечение с удобными для пользователя возможностями анализа данных, включая количественную оценку ПЦР, кривые плавления и т.д. Из-за сложного состава ингредиентов в образцах пищевых продуктов применимость ПЦР в реальном времени для обнаружения патогенных микроорганизмов нуждается в верификации, причем для каждого типа пищевых продуктов необходимо разработать оптимизированную процедуру приготовления образцов. В последние несколько лет разработано много ДНК-праймеров и зондов, специфичных относительно разных пищевых патогенов. Описаны также процедуры приготовления образцов для определенных типов пищевых продуктов. Непрерывно разрабатываются новые тест-системы зондов – так, появилась технология Scorpions™ (фирма DXS), которая является вариантом метода молекулярного маячка и технология использование источника света D-LUX™ (фирма Invitrogen Corporation) при удлинении праймеров. Примеры использования ПЦР-методов, в том числе в реальном времени, для обнаружения патогенов в пищевых продуктах приведены в табл. 10.8. Для одновременного обнаружения разных патогенов разработаны несколько мультисистемных ПЦР-анализов, например, для одновременного обнаружения Salmonella и L. monocytogenes, Salmonella, L. monocytogenes и E. coli О157 : H7, а также E. coli О157: H7, Salmonella и Shigella.
Таблица 10.8.
Примеры ПЦР-анализов для обнаружения в пищевых продуктах бактериальных патогенов

Микромассивы
Микромассив – это упорядомеино распределенные на носителе последовательности нуклеиновых кислот, что дает возможность для сопоставления известных и неидентифицированных последовательностей. Массив олигонуклеотидов синтезируют либо in situ (на чипе), либо обычным образом (с последующей иммобилизацией на чипе). Массив подвергают экспозиции с меченым образцом ДНК и гибридизации, после чего идентичность комплементарных последовательностей определяют количественно. Метод микромассивов ДНК доказал свое диагностическое значение в клинической микробиологии и микробиологии окружающей среды, так что, по всей вероятности, он может применяться и в пищевой микробиологии для обнаружения патогенов. Относительно недавно был разработан микромассив для обнаружения Campylobacter spp., который был использован для прямого обнаружения этих бактерий в курином помете.
Промышленно выпускающиеся тест-наборы на базе ПЦР
В настоящее время выпускаются несколько основанных на ПЦР тест-наборов для обнаружения пищевых патогенов. К ним относятся система В АХ® (фирма DuPont Qualicon), Probelia® (фирма Bio-Rad Laboratories), LightCyclet® Detection Kit (фирма Roche Diagnostics), TaqMan® Pathogen Kit (фирма Applied Biosystems) и Assurance GDS® (фирма BioControlSystems Inc.). В большинстве этих тест-наборов анализ ПЦР упрощается объединением всех реагентов, включая праймеры, ферменты и зонды, в одну реакционную смесь. ПЦР-тест-наборы автоматизированы, так что оператор может не иметь профессиональной квалификации в области молекулярной биологии. В работе показано, что системы LightCycler® Е. coli (eae) Detection Kit, Assurance GDS™ для E. coli О157 : H7 и BAX® E. Coli О157 : Н7 MP характеризуются одинаковыми возможностями обнаружения Е. coli О157:Н7 в говяжьем фарше. Тест-системы, основанные на культивировании бактерий, позволяют выявлять больше положительных образцов, чем системы на основе ПЦР, но продолжительность обнаружения (21-48 ч) у них намного дольше (более чем на 9 ч), чем у ПЦР-систем (7,5-12 ч). Для различных пищевых матриксов требуется дополнительная оценка и сопоставление разных тест-систем – только на основе такой информации типовые микробиологические лаборатории могут гарантировать, что используемый тест-набор отвечает их конкретным потребностям.
Стандартизация
Несмотря на быстроту обнаружения методом ПЦР пищевых патогенов, пищевая промышленность отнюдь не спешила брать данный метод на вооружение. Одной из причин этого стало отсутствие стандартизованных критериев валидизации методов приготовления ПЦР-образцов, подбора реакционных компонентов и их сочетание, а также условий амплификации патогенов в различных пищевых матриксах. Появление таких стандартизированных методов будут способствовать внедрению ПЦР-систем в деятельность обычных микробиологических лабораторий наряду с продолжением использования ими традиционных диагностических методов.
Относительно недавно появились международные ISO- и CHV-стандарты на количественные ПЦР-методы, в которых описаны основные положения, понятия и термины ПЦР, требования к приготовлению образцов, проведение амплификации и обнаружения, а также процедуры проверки эксплуатационных свойств термоциклеров. В стадии разработки находится стандарт на основные требования к ПЦР в реальном времени.
Критерии для стандартизированного диагностического ПЦР-метода были разработаны в рамках Общеевропейского исследовательского проекта FOOD-PCR ; кроме того, были описаны стандартизированные ПЦР-методы для обнаружения термотолерантных Campylobacter spp., Salmonella, I. monocytogenes и E. coli О157. Эффективность этих тест-наборов оценивалась в ходе межнациональных испытаний, и их диагностическая специфичность и чувствительность составили, соответственно: 100 и 96,7% – для Campylobacter в пробах воды для ополаскивания куриных тушек, 97,5 и 97,5% – для Salmonella в пробах мяса, 100 и 92,2% – для Е. coli О157 в смывах с туш крупного рогатого скота и 81,8 и 89,4% – для L. monocytogenes в сыром молоке.
10.4. ВЫБОР КОНКРЕТНОГО МЕТОДА АНАЛИЗА
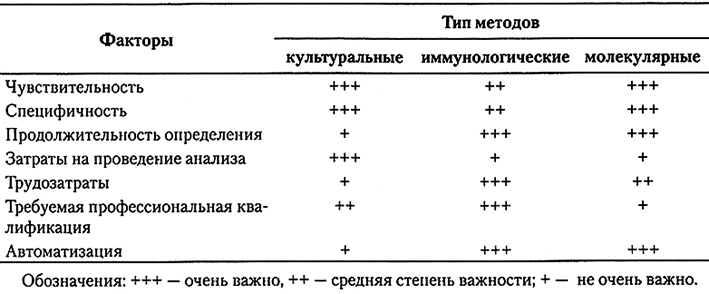
Основным преимуществом ускоренных методов анализа, включая иммуноанализ и ПЦР-методы, является возможность с их помощью быстро выявлять образцы, являющиеся отрицательными по контролируемому патогенному организму. Положительные образцы все равно приходится проверять путем культивирования, получая изоляты для выполнения подтверждающих тестов, субтипирования, тестирования на стойкость к действию антибактериальных препаратов и т.д. Для повышения уверенности производителей пищевых продуктов, что контаминированный продукт будет не допущен к реализации, необходимо использовать надежную тест-систему, не дающую ложноотрицательных результатов. Желательно, чтобы число ложно-положительных результатов было низким – в этом случае предотвращается отбраковка продукта °Сзапасом». Выбранный метод анализа должен давать результаты быстро прежде всего при анализе скоропортящихся продуктов. При выборе того или иного тест-набора или системы необходимо учитывать: чувствительность, специфичность, воспроизводимость, степень унификации, валидизацию результатов, скорость, возможность автоматизации и компьютеризации, матрикс образца и простоту его приготовления, затраты на оборудование, реагенты, прочие расходные материалы и на техническое обслуживание, производительность, гибкость, простоту использования, требования к помещениям и необходимость профессиональной подготовки операторов. Степень важности основных факторов, влияющих на выбор диагностических методов (культуральных, иммунолических, молекулярных) приведена в табл. 10.9.
Таблица 10.9.
Факторы, влияющие на выбор аналитического метода
10.4.1. Методы культивирования
Преимущества
Методы культивирования очень чувствительны и недороги; с их помощью можно получить как качественную, так и количественную информацию о природе и численности присутствующих в пищевом образце микроорганизмов.
Недостатки
Для получения результатов традиционными культуральными методами требуется нескольких суток, так как они основаны на способности микроорганизма к размножению и формированию видимых колоний. Сами анализы довольно трудоемки и требуют высокой профессиональной квалификации лаборантов.10.4.2. Иммунологические методы
Преимущества
По сравнению с традиционными методами посева на чашки применение иммунологических тест-наборов позволяет сократить время получения отрицательного результата до 24-30 ч. Для анализа по методу ELISA обычно требуется 1-2 ч, но необходимость проведения предварительного обогащения увеличивает общее время анализа примерно до суток. Кроме того, метод ELISA снижает трудозатраты и позволяет проанализировать больше проб.
Недостатки
Чувствительность иммунологических методов относительно невелика. Метод ELISA обычно требует наличия аналитической пробы, содержащей 104-105 бактерий/мл, для чего необходимо провести селективное обогащение образца. При вероятном присутствии поврежденных клеток целевого микроорганизма степень обнаружения можно значительно повысить путем введения дополнительной неселективной стадии предварительного обогащения (с увеличением общего времени, требуемого на проведение анализа). Конкурирующая микробиота или некоторое компоненты образцов пищевого продукта могут вызвать неспецифические реакции, что приводит к ложноположительным результатам анализа (особенно велика вероятность этого при использовании в ELISA поликлональных антител). Затраты на проведение иммуноанализа выше, чем на соответствующие культуральные тесты.
10.4.3. Молекулярные методы
Преимущества
Молекулярные методы обнаружения микроорганизмов являются довольно точными, так как они действительно выявляют генетический материал микроорганизма и не зависят от его физиологического состояния, воздействий окружающей среды или экспрессии любых специфических антигенов. Возможность использования в качестве мишени различных генов позволяет получить дополнительную информацию для описания свойств выявлемого патогенного микроорганизма. Потенциальная возможность последующего типирования микроорганизма может помочь предприятиям пищевой промышленности обнаружить источник(и) контаминации продукта. Для проведения микробиологического анализа молекулярными методами требуется меньше времени.
Недостатки
Для большинства ПЦР-методов из-за низкого количества микроорганизмов в пробе необходимы более или менее продолжительная стадия культивирования и дополнительная стадия для удаления ингибиторов ПЦР. Довольно велики затраты на лабораторное оборудование и реагенты, причем для разработки протоколов испытаний требуется высокий уровень квалификации сотрудников или привлечение сторонних специалистов. Разработка международных стандартов на молекулярные методы обнаружения патогенов все еще находится в начальной фазе. В отличие от культуральных с помощью молекулярных методов нельзя получить изоляты для дальнейшего изучения и типирования.
10.5. НЕКОТОРЫЕ ТЕНДЕНЦИИ
Дальнейшее совершенствование методов обнаружения микроорагнизмов будет направлено на обеспечение безопасности поставок пищевого сырья и продуктов. Особое внимание при этом будет уделяться следующим направлениям.
1. В производстве скоропортящихся пищевых продуктов и микробиологических исследованиях животных на бойне на наличие специфических патогенов ощущается необходимость в применении ускоренных методов, позволяющих получать результаты в течение не более нескольких часов. Эти методы не должны давать ложноотрицательных результатов и очень редко – ложноположительные (или, что еще лучше, вообще их не давать).
2. Может оказаться необходимым проведение количественного определения патогенных микроорганизмов, например, при контроле эффективности корректирующих воздействий и оценке рисков для здоровья человека. Подсчет численности некоторых патогенов, в частности Salmonella и Е. coli О157, по-прежнему основывается на трудоемких методах определения наиболее вероятного числа (НВЧ). Предстоит разработать более удобные количественные методы определения, включая методы на основе ПЦР в реальном времени.
3. Необходимо иметь больше информации относительно преобладающих в тех или иных звеньях пищевой цепи патогенных микроорганизмов, включая звено поставки пищевого сырья. Современные методы их обнаружения в конкретных пищевых продуктах могут оказаться не оптимальными для других сред и пищевых матриксов (фекалий, перьев, проб окружающей среды и т.д.). Относительно недавно появились методы обнаружения Campylobacter в фекалиях, а также Е. coli О157 в фекалиях и пробах окружающей среды.
4. Большинство существующих методов предназначены для обнаружения только одного конкретного патогенного микроорганизма в данном пищевом матриксе, и лишь очень немногие методы можно использовать для обнаружения нескольких патогенов одновременно.
5. Помимо микробиологических анализов на хорошо известные патогены больше внимания будет уделяться новым их типам (так называемым «эмерджентным»), которые, как правило, не охватываются стандартными микробиологическими исследованиями.
6. Стандартизация новых методов будет способствовать расширению их применения – так, уже разработаны рекомендации по нормализации ПЦР-анлизов проб из фекалий животных.
7. В настоящее время промышленно выпускается ряд тест-наборов для обнаружения пищевых патогенов, однако явно не хватает данных по их сравнительной эффективности и возможности их применения для анализа различных матриксов, что затрудняет выбор нужной тест-системы.
Что касается культуральных методов, то дальнейшее их совершенствование может касаться применения новых хромогенных компонентов сред, используемых при посеве на чашки, что облегчит распознавание колоний целевых микроорганизмов и сократит потребность в их подтверждении. К другим возможным инновациям можно отнести появление таких систем на основе культивирования, как Salmosysll® (фирма Merck KGaA), S.P.R.I.N.T Salmonella (фирма Oxoid), SimPlate"1 (фирма BioControl Systems Inc.), FlexiPlate™ (фирма Himedia Laboratories) и Compact Dry (фирма Hyserve). Особенно необходим универсальный бульон для предварительного обогащения, который можно было использовать для одновременного обогащения поврежденных клеток патогенных бактерий различных родов.
По-прежнему важную роль во многих типовых микробиологических лабораториях будут играть простые агглютинационные экспресс-тесты для идентификации предполагаемых патогенов. Дальнейшая автоматизация иммуноанализов позволит повысить их производительность, то есть даст возможность обрабатывать больше проб, и снизит трудозатраты. Будут совершествоваться и тестовые полоски, существующие для экспресс-скрининга патогенов в обогащенных культурах путем радиальной диффузии комплекса «антиген-антитело». Что касается экспресс-методов обнаружения микроорганизмов (как на основе иммуноанализа, так и молекулярных), то ощущается большая потребность в замене традиционных процедур обогащения ускоренными, более эффективными методами, которые могли бы отделять и концентрировать клетки конкретных патогенных микроорагнизмов до уровней их непосредственного обнаружения в пробах пищевых продуктов. В настоящее время успешно применяются несколько методов, включая центрифугирование и иммуномагнитную сепарацию, но их необходимо усовершенствовать и верифицировать. Большие возможности в деле обнаружения патогенов в пищевых образцах сулит использование биосенсоров, но необходимо повысить их чувствительность.
Современные техники ПЦР в реальном времени могут быть усовершенствованы на базе новейших компьютерных технологий с применением портативных устройств. Кроме того, ожидаются инновации в конструировании зондов с увеличением их чувствительности и специфичности. Повысить чувствительность приборов можно с помощью сочетанного применения методов, основанных на различных принципах. Так, тест-наборы на основе ПЦР со стадией иммуномагнитной сепарации перед обнаружением целевых микроорганизмов дают меньше ложноположительных результатов. Нуждаются в совершенствовании технологии микромассивов и «ДНК-чипов», то есть всех молекулярных исследований – они должны стать более удобными для пользователя и найти применение в типовых микробиологических лабораториях.

