6.5.1 Определение общего количества мезофильных аэробных и факультативно-анаэробных микроорганизмов
Сущность метода
Метод основан на подсчете колоний мезофильных аэробных и факультативно-анаэробных микроорганизмов, вырастающих на плотной питательной среде КМАФАнМ при (30±1) °С в течение 72 ч.
Проведение анализа
Выбор разведений для посева
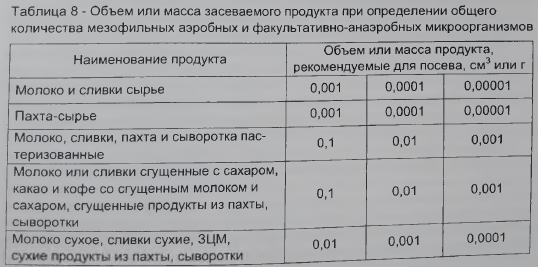
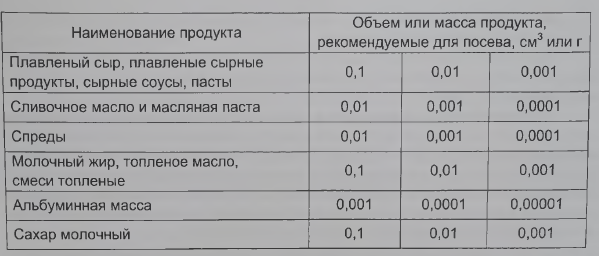
Количество засеваемого продукта устанавливают с учетом наиболее вероятного микробного обсеменения в соответствии с таблицей 8.
Посев
Для определения общего количества мезофильных аэробных и факультативно-анаэробных микроорганизмов выбирают те разведения, при посевах которых на чашках вырастает не менее 30 и не более 300 колоний. Из каждой пробы делают посев на две-три чашки из разведений, указанных в таблице 8 в соответствии с 5.6.1. Каждое из разведений должно быть засеяно в количестве 1 см3 в одну чашку Петри с заранее маркированной крышкой и залито (14±1)см3 расплавленной и охлажденной до температуры 40-45 °С питательной средой для определения общего количества мезофильных аэробных и факультативно-анаэробных микроорганизмов.
Допускается посев исследуемого продукта на чашки Петри из одного и того же разведения в количестве 1 и 0,1 см3.
Культивирование
После застывания агара чашки Петри переворачивают крышками вниз и ставят в таком виде в термостат с температурой (30±1) °С на 72 ч.
Обработка результатов
Каждую чашку помещают вверх дном на темном фоне и проводят подсчет количества выросших колоний, пользуясь лупой с увеличением в 4-10 раз. Каждую подсчитанную колонию отмечают на дне чашки чернилами.
При подсчете колоний рекомендуется пользоваться счетчиками.
При большом числе колоний и равномерном их распределении дно чашки Петри делят на четыре и более одинаковых сектора, подсчитывают число колоний на двух-трех секторах (но не менее чем на 1/3 поверхности чашки), находят среднее арифметическое число колоний и умножают на общее количество секторов всей чашки. Находят общее количество колоний, выросших на одной чашке.
Число КОЕ в 1 см3 или 1 г продукта Х1 вычисляют по формуле
X1 = n•10m
где n - количество колоний, подсчитанных на чашке Петри; m - число десятикратных разведений.
За окончательный результат анализа принимают среднее арифметическое, полученное по всем чашкам.
Картина роста мезофильных аэробных и факультативно-анаэробных микроорганизмов молока-сырья представлена в приложении Г.
6.5.2 Определение общего количества психротрофных аэробных и факультативно-анаэробных микроорганизмов
Сущность метода
Метод основан на подсчете колоний психротрофных аэробных и факультативно-анаэробных микроорганизмов, вырастающих на плотной питательной среде КМАФАнМ при (7±1) °С в течение 7-10 сут и предназначен для оценки санитарногигиенических условий получения, хранения и транспортировки молока-сырья, а так же выявления причин микробиологической порчи продуктов.
Проведение анализа
Выбор разведений для посева
Количество засеваемого продукта устанавливают с учетом наиболее вероятного микробного обсеменения в соответствии с таблицей 9.
Посев
Для определения общего количества психротрофных аэробных и факультативно-анаэробных микроорганизмо выбирают те разведения, при посевах которых на чашках вырастает не менее 30 и не более 300 колоний. Из каждой пробы делают посев на две-три чашки из разведений, указанных в таблице 9 в соответствии с 5.6.1. Каждое из разведений должно быть засеяно в количестве 1 см3 в одну чашку Петри с заранее маркированной крышкой и залито 10-15 см3 расплавленной и охлажденной до температуры 40-45 °С питательной средой КМАФАнМ.

Допускается посев исследуемого продукта на чашки Петри из одного и того же разведения в количестве 1 и 0,1 см3.
Культивирование
После застывания агара чашки Петри переворачивают крышками вниз и ставят в таком виде в термостат с температурой (7+1) °С на 7-10 сут.
Обработка результатов
Каждую чашку помещают вверх дном на темном фоне и проводят подсчет количества выросших колоний, пользуясь лупой с увеличением в 4-10 раз. Каждую подсчитанную колонию отмечают на дне чашки чернилами.
При подсчете колоний рекомендуется пользоваться счетчиками.
При большом числе колоний и равномерном их распределении дно чашки Петри делят на четыре и более одинаковых сектора, подсчитывают число колоний на двух-трех секторах (но не менее чем на 1/3 поверхности чашки), находят среднее арифметическое число колоний и умножают на общее количество секторов всей чашки. Находят общее количество колоний, выросших на одной чашке.
Количество выросших колоний подсчитывают на каждой чашке аналогично 6.5.1.
За окончательный результат анализа принимают среднее арифметическое, полученное по всем чашкам.
Картина роста психротрофных аэробных и факультативно-анаэробных микроорганизмов молока-сырья представлена в приложении Г.
6.5.3 Определение общего количества термофильных аэробных и факультативно-анаэробных микроорганизмов
Сущность метода
Метод основан на подсчете колоний термофильных аэробных и факультативно-анаэробных микроорганизмов, вырастающих на плотной питательной среде КМАФАнМ при (44±1) °С в течение 72 ч, и предназначен для оценки санитарно-гигиенических условий получения молока-сырья и выявления источника микробиологической порчи продукта.
Проведение анализа
Выбор разведений для посева
Количество засеваемого продукта устанавливают с учетом наиболее вероятного микробного обсеменения в соответствии с таблицей 10.
Посев
Для определения общего количества термофильных аэробных и факультативно-анаэробных микроорганизмов выбирают те разведения, при посевах которых на чашках вырастает не менее 30 и не более 300 колоний. Из каждой пробы делают посев на две-три чашки из разведений, указанных в таблице 10 в соответствии с 5.6.1. Каждое из разведений должно быть засеяно в количестве 1 см3 в одну чашку Петри с заранее маркированной крышкой и залито 10-15 см3 расплавленной и охлажденной до температуры 40-45° С питательной средой КМАФАнМ.

Культивирование
После застывания агара чашки Петри переворачивают крышками вниз и ставят в таком виде в термостат с температурой (44±1) °С на 72 ч.
Обработка результатов
Количество выросших колоний подсчитывают на каждой чашке аналогично 6.5.1.
За окончательный результат анализа принимают среднее арифметическое, полученное по всем чашкам.
Картина роста термофильных аэробных и факультативно-анаэробных микроорганизмов молока-сырья представлена в приложении Г.
6.5.4 Определение общего количества микроорганизмов, обладающих протеолитической активностью (протеолитических микроорганизмов)
Сущность метода
Метод основан на подсчете колоний протеолитических аэробных и факультативно-анаэробных микроорганизмов, вырастающих на плотной питательной среде (водный агар или КМАФАнМ) при (30±1) °С в течение 48 ч и дающих зоны просветления вокруг колоний в результате разложения белка под действием протеолитических ферментов, выделяемых микроорганизмами, и предназначен для выявления источника микробиологической порчи продукта.
Проведение анализа
Выбор разведений для посева
Для определения количества протеолитических микроорганизмов обычно проводят посев 0,1-0,001 см3(г), независимо от вида продукта.
Посев
Для определения количества протеолитических микроорганизмов вносят по 1 см3 каждого из выбранных разведений на чашки Петри, добавляют по 1 см3 стерильного обезжиренного молока, приготовленного по 4.6.2.14, и заливают водным агаром (4.6.2.13) или средой КМАФАнМ (4.6.2.1).
Культивирование
Чашки Петри с посевами выдерживают в термостате при 30 °С в течение 48 ч и после этого подсчитывают число выросших колоний протеолитических микроорганизмов.
Обработка результатов
Количество выросших колоний подсчитывают на каждой чашке аналогично 6.5.1. Подсчет ведут только тех колоний, вокруг которых образовались зоны просветления.
За окончательный результат анализа принимают среднее арифметическое, полученное по всем чашкам.
Картина роста протеолитических микроорганизмов представлена в приложении Г.
6.5.5 Определение общего количества микроорганизмов, обладающих липолитической активностью (липолитических микроорганизмов)
Сущность метода
Метод основан на подсчете колоний липолитических аэробных и факультативно-анаэробных микроорганизмов, вырастающих на плотной питательной среде КМАФАнМ при 20-23 °С в течение 5-6 сут и дающих зоны просветления вокруг колоний в результате разложения жира под действием липолитических ферментов, и предназначен для выявления источника микробиологической порчи продукта.
Проведение анализа
Выбор разведений для посева
Для определения количества липолитических микроорганизмов обычно проводят посев 0,1-0,001 см3 (г), независимо от вида продукта.
Посев
На дно подогретой чашки Петри наливают стерильный расплавленный горячий жир и сразу сливают. На дне остается тонкий слой застывшего жира.
Для определения количества липолитических микроорганизмов проводят посев по 1 см3 каждого из выбранных разведений на чашки Петри с последующей заливкой посевов расплавленной и охлажденной до 40-45 °С средой КМАФАнМ по 4.6.2.1 (рекомендации к применению для липолитических микроорганизмов).
Культивирование
Чашки Петри с посевным материалом выдерживают в течение 5-6 сут при температуре 20-23 °С. После этого подсчитывают число выросших колоний.
Обработка результатов
Количество выросших колоний подсчитывают на каждой чашке аналогично 6.5.1. Подсчет ведут только тех колоний, вокруг которых образовались зоны просветления.
За окончательный результат анализа принимают среднее арифметическое, полученное по всем чашкам.
Картина роста липолитических микроорганизмов представлена в приложении Г.
6.5.6 Определение спор аэробных и факультативно анаэробных мезофильных или термофильных микроорганизмов
Сущность метода
Метод основан на посеве предварительно прогретого при температуре (88+2) °С в течение (12±2) мин посевного материала в плотную питательную среду с последующим культивированием посевов для выявления спор мезофильных микроорганизмов в течение 3 сут при (30±1) °С и для выявления спор термофильных микроорганизмов при (55±1) °С и подсчете всех видимых колоний, характерных для спорообразующих бактерий. Метод предназначен для оценки санитарногигиенических показателей сырья и выявления источника микробиологической порчи продукта.
Проведение анализа
Выбор разведений для посева
Для определения количества спор аэробных и факультативно анаэробных мезофильных или термофильных микроорганизмов обычно проводят посев 0,1-0,01 см3 (г), независимо от вида продукта.
Посев
Посевной материал прогревают в водяной бане при температуре (88±2) °С в течение (12±2) мин, охлаждают до температуры (23+1) °С.
Из каждой пробы делают посев по 1 см3 разведений на чашки Петри. В каждую чашку Петри с заранее промаркированной крышкой добавляют не позднее чем через 15 мин 10-15 см3 питательной среды КМАФАнМ, охлажденной до (45±1) °С, тщательно перемешивают и оставляют до застывания.
Культивирование
После застывания сред чашки Петри переворачивают вверх дном и ставят в таком виде в термостат с температурой (30±1) °С для выявления спор мезофильных и (55+1) °С для выявления спор термофильных микроорганизмов на 3 сут.
Обработка результатов
Каждую чашку помещают вверх дном на темном фоне и проводят подсчет количества выросших колоний, пользуясь лупой с увеличением в 4-10 раз.
Каждую подсчитанную колонию отмечают на дне чашки чернилами. Учитывают колонии, характерные для спорообразующих микроорганизмов. Спорообразующие микроорганизмы образуют на поверхности среды сухие шероховатые или морщинистые колонии, с неровными краями. В ряде случаев рост спорообразующих микроорганизмов распространяется по всей поверхности агара. Спорообразующие микроорганизмы могут врастать в агар, образуя на поверхности слизистые вздутия.
Количество выросших колоний подсчитывают на каждой чашке аналогично 6.5.1.
За окончательный результат анализа принимают среднее арифметическое результатов, полученных по всем чашкам.
Картина роста споровых мезофильных аэробных и факультативноанаэробных микроорганизмов представлена в приложении Г.
6.5.7 Определение бактерий группы кишечных палочек (БГКП)
6.5.7.1 Определение БГКП на среде Кесслер Сущность метода
Метод основан на способности БГКП сбраживать в питательной среде лактозу при температуре (37±1) °С в течение 24 ч с образованием кислоты и газа и предназначен для оценки санитарно-гигиенических показателей сырья, производственного процесса, готового продукта и выявления источника микробиологической порчи продукта.
Проведение анализа
Посев в среду Кесслер
В среду Кесслер проводят посев продуктов в количествах, указанных в таблице 11.
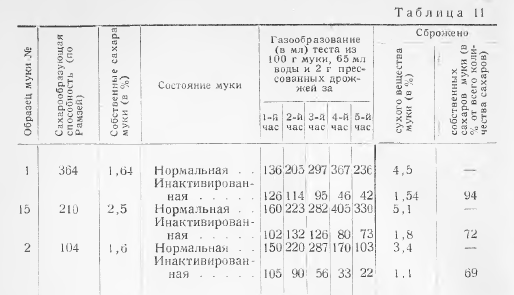
По 1 см3 соответствующих разведений продукта засевают в пробирки с 5 см средыКесслер.
Посев 10 см3 пастеризованного молока, отобранного после пастеризатора, и 10 см3 закваски проводится в колбочки с 40-50 см3 среды Кесслер.
Культивирование
Пробирки с посевами помещают в термостат при (37±1) °С на 18-24 ч. При исследовании продуктов, хранящихся при минусовой температуре, пробирки с посевом выдерживают в термостате при (37±1) °С в течение 48 ч.
Обработка результатов
Просматривают пробирки или колбы с посевами и определяют наличие бактерий группы кишечных палочек по газообразованию. При отсутствии газообразования в наименьшем из засеваемых объемов дают заключение об отсутствии БГКП. При наличии газообразования в наименьшем из засеваемых объемов считается, что БГКП обнаружены в нем.
Картина роста бактерий группы кишечных палочек на жидкой среде Кесслер представлена в приложении Г.
6.5.7.2 Определение БГКП на плотной среде Кесслер
Сущность метода
Метод основан на способности БГКП сбраживать в питательной среде лактозу при температуре (37±1) °С в течение 24 ч с образованием кислоты и газа, которое фиксируется разрывами столбика среды. Метод применяется для внутрипроизводственного контроля и предназначен для оценки санитарно-гигиенических показателей сырья, производственного процесса, готового продукта и выявления источника микробиологической порчи продукта.
Проведение анализа
В пробирку с расплавленной и охлажденной до 40-50 °С плотной средой Кесслер вносят 1 см3 разведения продукта; а при взятии смыва - весь смывной раствор вместе с тампоном. Затем путем встряхивания пробирки хорошо размешивают среду с внесенным посевным материалом, дают ей застыть.
Культивирование
Посевы помещают в термостат с температурой (37±1) °С на 18-24 ч.
Обработка результатов
При наличии небольшого количества бактерий группы кишечных палочек в плотной среде Кесслер появляются трещины, при большом количестве этих бактерий в среде образуются пузырьки газа и агар разрывается.
Картина роста бактерий группы кишечных палочек на плотной среде Кесслер представлена в приложении Г.
6.5.7.3 Определение количества БГКП на среде АЖФК
Сущность метода
Метод основан на способности БГКП образовывать типичные колонии на плотной среде при температуре (37±1) °С в течение 24 ч и предназначен для оценки санитарно-гигиенических показателей готового продукта, в частности сыра, и выявления источника микробиологической порчи.
Проведение посева
Перед выполнением поверхностного посева среду расплавляют на водяной бане (или пользуются свежеприготовленной средой), охлаждают до 50 °С и разливают в стерильные чашки Петри примерно по 10-12 см3, чтобы среда ровно покрывала дно чашки. Чашки оставляют полуоткрытыми на 1 ч для подсушивания. Потом закрывают, маркируют и используют для анализа.
Разведения пастеризованного молока, сыра готовят в соответствии с таблицей 12. Каждое из выбранных разведений засевают по 0,1 см3 поверхностным способом. После посева чашки Петри переворачивают крышками вниз и ставят в таком виде в термостат с температурой 37 °С на 16-24 ч, но не более 24 ч. Подсчитывают розовато-фиолетовые колонии диаметром больше 0,5 мм с более светлым по сравнению с центром ореолом.
Посев на АЖФК можно проводить глубинным способом. Каждое разведение должно быть засеяно на 1 см3 в отдельную чашку Петри и залито расплавленным и охлажденным до 45 °С агаром желчным фиолетово-красным.
Сразу после заливки агара содержимое чашки следует тщательно перемешать путем легкого вращательного покачивания для равномерного распределения посевного материала. После застывания агара чашки Петри переворачивают крышками вниз и ставят в таком виде в термостат при температуре (37±1) °С на 16-24 ч.
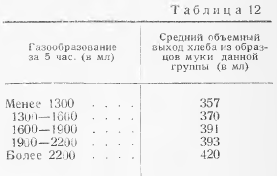
При определении БГКП в других молочных продуктах на среде АЖФК для проведения посева рекомендуется выбирать разведения, начиная с того, в котором БГКП должны отсутствовать, и два предыдущих.
Обработка результатов
При поверхностном посеве число колоний, выросших на каждой чашке Петри, для подсчета БГКП в 1 г или 1 см3 образца, умножают на 10 и на соответствующее разведение.
При глубинном посеве число колоний, выросших на каждой чашке, пересчитывают на 1 г или 1 см3 продукта с учетом разведения.
Картина роста бактерий группы кишечных палочек на среде АЖФК представлена в приложении Г.
6.5.7.4 Индикация БГКП на среде КОДА
Сущность метода
Метод основан на способности БГКП сбраживать в питательной среде лактозу при температуре (37±1) °С в течение 24 ч с образованием кислоты, что приводит к изменению цвета индикатора с зеленого на желтый при развитии цитратотрицатель- ных БГКП. Метод предназначен для оценки санитарно-гигиенических условий производства и выявления источника микробиологической порчи продукта.
Проведение анализа
Смывную жидкость с тампоном или тампон, которым отбирали смыв, помещают в пробирки с 5 см3 среды КОДА.
Культивирование
Пробирки с посевами помещают в термостат при (37±1) °С на 18-24 ч.
Обработка результатов
Просматривают пробирки с посевами и определяют наличие бактерий группы кишечных палочек по изменению окраски. При отсутствии изменения окраски дают заключение об отсутствии бактерий группы кишечных палочек в смыве.
Картина роста бактерий группы кишечных палочек на среде КОДА представлена в приложении Г.
6.5.7.5 Метод дифференциации энтеробактерий на среде Эндо
Сущность метода
Метод основан на способности ферментирующих лактозу энтеробактерий (БГКП) образовывать на среде темно-красные колонии с характерным металлическим блеском вследствие взаимодействия образующихся альдегидов с фуксином в присутствии сульфита натрия при температуре (37±1) °С в течение 24 ч. Метод предназначен для дифференциации энтеробактерий по виду образуемых на среде колоний.
Проведение анализа
На среду Эндо делают посевы с накопительных сред (Кесслер, Кода, ГПС, ЛПС) с признаками роста БГКП.
Перед выполнением посева среду по 4.6.2.6 расплавляют на водяной бане (или пользуются свежеприготовленной средой), охлаждают до 50 °С и разливают в стерильные чашки Петри примерно по 10-12 см3, чтобы среда ровно покрывала дно чашки. Чашки со средой подсушивают по 5.6.2, закрывают, маркируют и используют для анализа.
Из пробирок и/или колбочек с накопительными средами с признаками роста БГКП, проводят посев петлей на среду Эндо. Исследуемый материал отбирают бактериальной петлей. Бактериальную петлю кладут на поверхность питательной среды и проводят штрихи по поверхности среды, располагая штрихи как можно ближе друг к другу для получения в конце штриха изолированных колоний. Для выполнения нескольких посевов на одной чашке дно чашки предварительно делят на равные сектора (рекомендуется не более 4 секторов). Техника посева описана в 5.6.2.2.
Культивирование
Чашки с посевами переворачивают вверх дном и помещают в термостат при (37±1)°С на 18-24 4.
Обработка результатов
Результаты посевов оценивают визуально по характеру образовавшихся колоний:
- образование красных или темно-красных колоний с металлическим блеском на среде Эндо свидетельствует о принадлежности микроорганизмов, давших рост на накопительных питательных средах, к лактозоположительным энтеробактериям (БГКП);
- образование полупрозрачных бесцветных или бледно-розовых колоний свидетельствует о принадлежности микроорганизмов, давших рост на накопительных питательных средах, к лактозоотрицательным энтеробактериям.
При появлении на среде полупрозрачных бесцветных или бледнорозовых колоний необходимо проводить контроль на предмет наличия патогенных энтеробактерий (сальмонеллы, шигеллы). Контроль проводится в лабораториях, лицензированных на право работы с патогенными микроорганизмами.
Чашки с посевами упаковываются в стерильную бумагу и/или контейнеры и передаются в лаборатории, лицензированные на право работы с патогенными микроорганизмами, для дальнейшего контроля.
Картина роста тест-культуры E.coli на среде Эндо представлена в приложении Г.
6.5.7.6 Определение БГКП с использованием микробитестов для определения редуцирующих бактерий
Сущность метода
Метод предназначен для контроля БГКП, коррелирующих с содержанием редуцирующих тетразолий хлористый бактерий, в неферментированных молочных продуктах (масле) и смывах с оборудования и основан на изменении цвета индикатора 2,3,5-трифенилтетразолиум хлорида (ТТХ) при развитии редуцирующих бактерий, в том числе БГКП.
Проведение анализа
Из светонепроницаемого пакета, содержащего полиэтиленовые пакеты с микробитестами, вынимают один пакет с микробитестом и с одной стороны разрезают его ножницами. Микробитест вместе с полиэтиленовым пакетом перегибают вдоль по середине, вынимают из пакета, беря за перфорированный конец. Микробитест смачивают в исследуемом разведении путем однократного погружения, которое длится 5 с. Излишек влаги удаляют путем прикосновения конца микробитеста к стенке пробирки или колбы с разведением. При намачивании микробитест впитывает 0,2 см3 разведения продукта или смыва. Затем микробитест вновь помещают в полиэтиленовый пакет, перфорированный конец удаляют. После помещения микробитеста в пакет для удаления воздуха из пакета его следует тщательно прогладить рукой, чтобы полиэтиленовая пленка с обеих сторон плотно прилегла к смоченному микробитесту. Разрезанную сторону пакета зажимают между двумя пластинками из негорючего материала, запаивают на пламени горелки и помещают в пакет из светонепроницаемого материала.
Культивирование
Пакет из светонепроницаемого материала с микробитестом помещают в термостат и выдерживают при температуре 37 °С в течение (43+2) ч. Микробитест в термостате должен находиться в строго горизонтальном положении.
Обработка результатов
После культивирования проводят подсчет колониеобразующих единиц (красных точек) на обеих сторонах микробитеста.
Количество редуцирующих бактерий Х2 в 1 см3 (г) исследуемого объекта подсчитывают по формуле
Х2 = 5· а·10В,
где а — количество колониеобразующих единиц (красных точек) на микробитесте;
в — разведение продукта.
Примечания
Если подсчет невозможно провести сразу по извлечении микробитеста из термостата, микробитест хранят в холодильнике при температуре (5±1) °С не более 24 ч.
Микробитесты для определения редуцирующих бактерий хранят только в светонепроницаемых пакетах, а при работе предохраняют от действия солнечного света. Микробитесты для определения редуцирующих бактерий должны иметь белый или слегка кремовый цвет. Розовый цвет микробитеста указывает на его засвеченность, и для проведения испытаний он не пригоден.
Картина роста бактерий группы кишечных палочек на микробитесте представлена в приложении Г.
6.5.8 Метод определения дрожжей и плесневых грибов
6.5.8.1 Определение количества дрожжей и плесневых грибов на плотных питательных средах
Сущность метода
Метод основан на высеве продукта или гомогената продукта и (или) их разведений в питательные среды (среда Сабуро, среда агаровая для определения дрожжей и плесеней и др.), определении принадлежности выделенных микроорганизмов к плесневым грибам и дрожжам по характерному росту на питательных средах и по морфологии клеток. Метод предназначен для оценки санитарно-гигиенических показателей сырья, производственного процесса, готового продукта и выявления источника микробиологической порчи продукта.
Проведение анализа
Выбор разведений для посева
Количество засеваемого продукта устанавливают с учетом наиболее вероятного микробного обсеменения.
Для определения количества дрожжей и плесневых грибов выбирают те разведения, при посевах которых на чашках вырастает от 15 до 150 колоний дрожжей и (или) от 5 до 50 колоний плесневых грибов.
Посев
Из каждой пробы делают посев по 1 см3 продукта или его соответствующих разведений на 2-3 чашки Петри. В каждую чашку с заранее промаркированной крышкой добавляют не позднее чем через 15 мин (14±1) см3 питательной среды, охлажденной до (45±1) °С, содержимое чашки Петри немедленно тщательно перемешивают и оставляют на горизонтальной поверхности до застывания питательной среды.
Культивирование
После застывания сред чашки Петри переворачивают вверх дном и ставят в таком виде в термостат с температурой (24±1) °С на 5 сут.
Через 3 сут термостатирования проводят подсчет типичных колоний, а через 5 сут окончательный подсчет, наблюдая за ростом дрожжей и плесневых грибов визуально, а при необходимости проводят микроскопирование выросших колоний.
Обработка результатов
Каждую чашку помещают вверх дном на темном фоне и проводят подсчет количества выросших колоний, пользуясь лупой с увеличением в 4-10 раз.
Каждую подсчитанную колонию отмечают на дне чашки.
Колонии дрожжей на агаровых средах образуют выпуклые, блестящие серовато-белые колонии с гладкой поверхностью и ровным краем. В среде агаровой для определения дрожжей и плесневых грибов дрожжи могут образовывать глубинные колонии белого цвета звездообразной формы с четким краем.
Плесневые грибы имеют различную окраску и образуют на питательных средах пушистый мицеллий.
При необходимости проводят микроскопические исследования. Препараты готовят способом раздавленной капли и/или способом фиксирования и окрашивания по 6.4.
Результаты микроскопирования оценивают, пользуясь характеристикой дрожжей и плесневых грибов, указанной в таблице 13.

Если при испытании продукта на питательных средах обнаружен рост дрожжей и плесневых грибов и их присутствие подтверждено микроскопированием, то дают заключение о присутствии этих микроорганизмов в продукте.
Результаты обрабатывают и пересчитывают отдельно для дрожжей и плесневых грибов.
Количество дрожжей и плесневых грибов Х3 в 1 г или в 1 см3 продукта вычисляют по формуле

Картина роста дрожжей и плесневых грибов на плотных питательных средах представлена в приложении Г.
6.5.8.2 Определение дрожжей и плесневых грибов в атмосфере производственных помещений при производственном контроле с использованием микробитестов
Сущность метода
Метод основан на способности дрожжей и плесеневых грибов образовывать колонии на поверхности микробитестов при температуре (25±1) °С в течение (72±6)ч.
Проведение анализа
Из светонепроницаемого пакета, содержащего полиэтиленовые пакеты с микробитестами, вынимают один пакет с микробитестом и с одной стороны разрезают его ножницами.
Микробитест вынимают из полиэтиленового пакета профламбированным пинцетом, затем его смачивают в стерильной воде и помещают в стерильную чашку Петри.
Чашки Петри со смоченными микробитестами размещают в производственных помещениях, открывают и выдерживают открытыми в течение 5 мин, затем закрывают и помещают в термостат.
Примечание - Микробитесты для определения дрожжей и плесневых грибов хранят только в светонепроницаемых пакетах, а при работе предохраняют от действия солнечного света. Микробитесты должны иметь светло-голубой цвет с зеленоватым оттенком.
Культивирование
Для предотвращения возможного высыхания микробитестов чашки с микробитестами перед термостатированием рекомендуется поместить в полиэтилленовый пакет. Пакеты с чашками помещают в термостат в горизонтальном положении крышками вверх.
Чашки с микробитестами выдерживают в термостате при температуре (25±1)°С в течение(72±6)ч.
Обработка результатов
После термостатирования проводят подсчет колоний дрожжей и плесневых грибов на верхней стороне микробитеста.
Дрожжи растут на микробитестах в виде точек розового или кремового цвета, а плесневые грибы - колониями разной окраски, по внешнему виду аналогично колониям плесневых грибов на агаровой среде для определения дрожжей и плесеней. При появлении на микробитестах колоний, нехарактерных по внешнему виду для колоний дрожжей и плесневых грибов, проводят микроскопирование для выявления и исключения споровых аэробов.
Картина роста дрожжей и плесневых грибов на микробитестах представлена в приложении Г.
6.5.9 Определение общего количества спор мезофильных анаэробных бактерий
Сущность метода
Метод основан на способности спор мезофильных анаэробных бактерий, сохранившихся после тепловой обработки исследуемого материала или его разведений при температуре (75±1) °С в течение 30 мин, прорастать, размножаться и давать видимые признаки роста в питательных средах. Метод предназначен для оценки сыропригодности молока - сырья и выявления источника микробиологической порчи продукта.
Подготовка образцов к анализу
Подготовка образцов жидких молочных продуктов
От пробы жидких молочных продуктов (молоко-сырье, восстановленное молоко и другие, аналогичные по консистенции продукты) отбирают для анализа по 15 см3 и переносят пипеткой в стерильные пробирки, которые закрывают стерильными ватными пробками. При этом необходимо следить, чтобы капельки продукта не попадали на стенки пробирок.
Подготовленные пробирки с исследуемыми образцами вместе с контрольной пробиркой, в которой находится 10 см3 продукта и термометр, помещают в водяную баню. Уровень воды в водяной бане должен быть выше уровня продукта на 10-15 мм. Пробирки выдерживают при температуре (75±1) °С в течение (30±3) мин, затем быстро охлаждают до комнатной температуры, погружая их в холодную воду.
В зависимости от обсемененности исследуемого жидкого молочного продукта спорами мезофильных анаэробных бактерий из прогретых проб готовят десятикратные разведения.
Перед проведением посева допускается прогрев как исходных образцов продукта, так и их разведений.
Подготовка проб сыра и аналогичных по консистенции молочных продуктов.
Подготовленные пробирки с разведениями проб сыра вместе с контрольной пробиркой, в которой находятся термометр и 10 см3 раствора хлористого натрия по 4.3.3 или воды, помещают в водяную баню и выдерживают при температуре (75±1) °С в течение (30±3) мин.
Проведение анализа
Для определения количества спор мезофильных анаэробных бактерий проводят посев 1 см3 исследуемого образца (для молока - нулевое, первое и второе, для сыра - первое и второе разведения) в пробирку с (10±2) см3 питательной среды СДА, приготовленной по 4.6.2.9, выдержанной перед анализом в кипящей водяной бане в течение 30 мин и охлажденной до температуры (40±1) °С.
Каждое из выбранных разведений исследуемого продукта засевают в две пробирки с питательной средой, внося посевной материал на дно пробирки, не допуская взбалтывания среды и не выдувая посевной материал.
Сверху посевы заливают слоем водного агара по 4.6.2.13, предварительно расплавленного до температуры (45±1) °С. Высота слоя водного агара должна быть не менее (20±5) мм.
При использовании для посева пробирок со средой, разлитой высоким столбиком, допускается не заливать посевы защитным слоем водного агара.
Пробирки с посевом помещают в термостат при температуре (37±1) °С на 72 ч.
Обработка результатов
Наличие спор мезофильных анаэробных бактерий в засеянных объемах исследуемого продукта определяют по появлению разрывов агарового столбика (газообразованию), образуемых при росте этих бактерий газами, а также изменению окраски среды с красной на желтую.
В посевах без защитного слоя рост мезофильных анаэробных бактерий определяют по пенообразованию, образованию «карманов» в столбике среды и изменению цвета питательной среды с красного на желтый. В данном случае основным признаком роста является изменение окраски, т.к. процесс газообразования может быть не зафиксирован.
Наиболее вероятное число спор мезофильных анаэробных бактерий при анализе молока определяют по числу пробирок, в которых они дали рост (см. таблицу 14).
Наиболее вероятное число спор мезофильных анаэробных бактерий при анализе сыра определяют по числу пробирок, в которых они дали рост с посевом 0,1 и 0,01 см3 (см. таблицу 14).
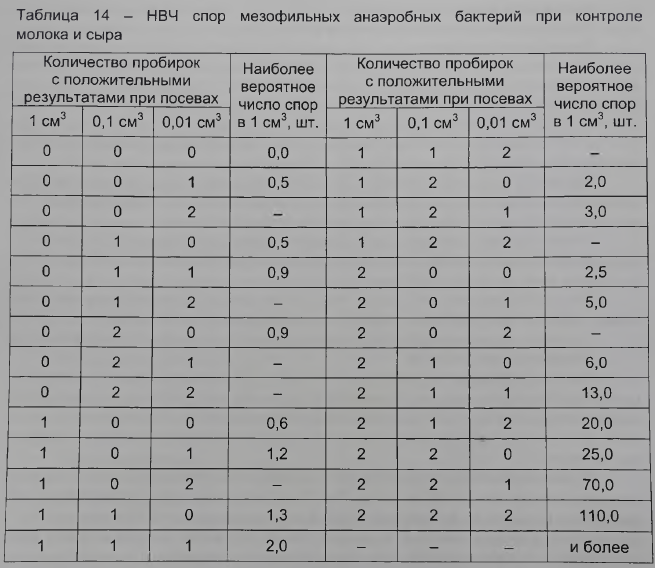
Результаты, в которых количество пробирок с видимыми признаками роста мезофильных анаэробных бактерий при посевах 1; 0,1 и 0,01 см3 молока или сыра соответственно равно 002, 012, 021, 022, 102, 112, 122, 202, не могут быть использованы для расчета, так как в 95 % случаев они вызваны несовершенной техникой приготовления разведений или присутствием антибактериальных веществ. В данных случаях исследования повторяют.
Картина роста споровых анаэробных бактерий на среде СДА представлена в приложении Г.
6.5.10 Определение спор мезофильных анаэробных лактатсбраживаю- щих бактерий в молоке и сырах
Сущность метода
Метод основан на способности спор мезофильных анаэробных лактатсбражи- вающих бактерий, сохранившихся после тепловой обработки исследуемого материала или его разведений при температуре (75±1) °С в течение 30 мин, прорастать, размножаться и давать видимые признаки роста в питательных средах. Метод предназначен для оценки сыропригодности молока-сырья и выявления источника микробиологической порчи продукта.
Подготовка образцов к анализу
Подготовка образцов проводится по 6.5.9.
Проведение анализа
Для определения количества спор мезофильных анаэробных лактатсбражи- вающих бактерий в молоке и сырах проводят посев 1 см3 исследуемого образца (для молока - нулевое, первое и второе, для сыра - первое и второе разведения) в пробирку с (10±2) см3 питательной среды ПАССА, приготовленной по 4.6.2.10, выдержанной перед анализом в кипящей водяной бане в течение 30 мин и охлажденной до температуры (40±1) °С.
Каждое из выбранных разведений исследуемых молока или сыра засевают в две пробирки с питательной средой, внося посевной материал на дно пробирки, не допуская взбалтывания среды и не выдувая посевной материал.
Сверху посевы заливают слоем предварительно расплавленного до температуры (45±1) °С водного агара, приготовленного по 4.6.2.13. Высота слоя водного агара должна быть не менее (20±5) мм.
При использовании для посева пробирок со средой, разлитой высоким столбиком, допускается не заливать посевы защитным слоем водного агара.
Пробирки с посевом помещают в термостат при температуре (37±1) °С на 72 ч.
Обработка результатов
Рост мезофильных анаэробных лактатсбраживающих бактерий в посевах на среду ЛАССА определяют по образованию разрывов столбика агара и изменению цвета питательной среды с красного на соломенно-желтый. Образование в среде желтых пятен или точек также указывает на наличие лактатсбраживающих анаэробных бактерий.
В посевах без защитного слоя рост мезофильных анаэробных лактатсбраживающих бактерий в посевах на среду ЛАССА определяют по пенообразованию, образованию «карманов» в столбике среды и изменению цвета питательной среды с красного на соломенно-желтый. В данном случае основным признаком роста является изменение окраски, т.к. процесс газообразования может быть не зафиксирован.
Наиболее вероятное число спор лактатсбраживающих анаэробных бактерий рассчитывают в соответствии с 6.5.9.
6.5.11 Методы выявления технически вредных термоустойчивых микроорганизмов (термофильных молочнокислых палочек и дрожжей)
При появлении ряда характерных пороков вкуса и консистенции молочных продуктов, связанных с чрезмерным развитием термостойких молочнокислых палочек и дрожжей, проводят усиленный контроль по их выявлению.
Критическими контрольными точками являются оборудование и пастеризованное молоко или сливки. Метод предназначен для оценки санитарногигиенического состояния сырья, производственного процесса, готового продукта и выявления источника микробиологической порчи продукта.
6.5.11.1 Выявление термоустойчивых микроорганизмов (молочнокислых палочек и дрожжей) на технологическом оборудовании
Сущность метода
Метод основан на способности термофильных молочнокислых палочек и дрожжей развиваться в молоке при температуре (42±2) °С с образованием сгустка (или без него в случае развития дрожжей) в течение 16-24 ч.
Проведение анализа
Стерильным тампоном, смоченным стерильным раствором хлористого натрия или стерильной водой, протирают исследуемый участок оборудования. Тампон опускают в пробирку со стерильным молоком.
Культивирование
Посевы выдерживают в течение 16-24 ч при температуре (42+2) °С (для выявления палочек) или при (24+1) °С (для выявления дрожжей).
Обработка результатов
После окончания культивирования просматривают пробирки с посевами и готовят микроскопические препараты.
Образование сгустка молока и наличие в микропрепарате палочек свидетельствуют о наличии термофильных молочнокислых палочек.
Наличие дрожжей определяют по микропрепарату.
6.5.11.2 Выявление термоустойчивых микроорганизмов (молочнокислых палочек) в пастеризованном молоке или сливках
Сущность метода
Метод основан на способности термостойких молочнокислых палочек развиваться в молоке при температуре (42+2) °С с образованием сгустка.
Проведение анализа
Готовят разведения исследуемого образца пастеризованного молока или сливок в стерильном растворе хлористого натрия или стерильной воды. Полученные разведения засевают в стерильное обезжиренное молоко по 4.6.2.14 (до 6 разведения).
Культивирование
Посевы выдерживают при температуре (42+2) °С в течение 72 ч.
Обработка результатов
Полученные сгустки микроскопируют и устанавливают наличие в них палочек.

