6.6.1 Методы определения молочнокислых микроорганизмов
6.6.1.1 Метод определения общего количества молочнокислых микроорганизмов на среде КМАФАнМ
Сущность метода
Метод основан на подсчете колоний молочнокислых микроорганизмов, вырастающих на плотной питательной среде КМАФАнМ при (30+1) °С в течение 72 ч.
Проведение анализа
Выбор разведений для посева
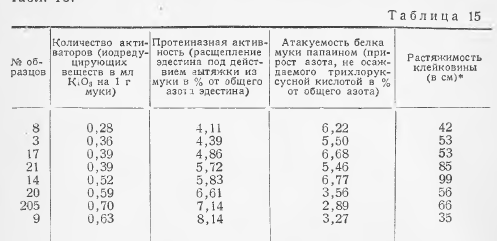
Количество засеваемого продукта устанавливают с учетом наиболее вероятного содержания молочнокислых микроорганизмов в соответствии с таблицей 15.
Посев
Для определения общего количества молочнокислых микроорганизмов выбирают те разведения, при посевах которых на чашках вырастает не менее 30 и не более 300 колоний. Из каждой пробы делают посев на две-три чашки из разведений, указанных в таблице 15 в соответствии с 5.6.1. Каждое из разведений должно быть засеяно в количестве 1 см3 в одну чашку Петри с заранее маркированной крышкой и залито (14±1) см3 расплавленной и охлажденной до температуры 40-45 °С питательной средой для определения общего количества мезофильных аэробных и факультативно-анаэробных микроорганизмов.
Культивирование
После застывания агара чашки Петри переворачивают крышками вниз и ставят в таком виде в термостат с температурой (30+1) °С на 72 ч.
Обработка результатов
Каждую чашку помещают вверх дном на темном фоне и проводят подсчет количества выросших колоний, пользуясь лупой с увеличением в 4-10 раз.
Каждую подсчитанную колонию отмечают на дне чашки чернилами.
Количество выросших колоний подсчитывают на каждой чашке аналогично 6.5.1.
За окончательный результат анализа принимают среднее арифметическое, полученное по всем чашкам.
6.6.1.2 Метод определения общего количества термофильных молочнокислых микроорганизмов
Сущность метода
Метод основан на подсчете колоний молочнокислых микроорганизмов, вырастающих на плотной питательной среде КМАФАнМ при (45±1) °С в течение 72 ч.
Проведение анализа
Анализ проводится аналогично 6.6.1.1, за исключением температуры культивирования, которая составляет (45±1) °С.
6.6.1.3 Метод определения общего количества молочнокислых микроорганизмов на стерильном молоке
Сущность метода
Метод основан на способности мезофильных молочнокислых бактерий развиваться при температуре (30±1) °С, а термофильных при (45±1) °С в обезжиренном молоке, выделяя кислоту. В результате чего молоко сворачивается, образуя сгусток в течение 72 ч.
Проведение анализа
Выбор разведений для посева, количество засеваемого продукта устанавливают с учетом наиболее вероятного содержания этих микроорганизмов в продукте.
Посев
Из каждой пробы делают ряд последовательных разведений (до 10). Из последних трех-четырех разведений вносят по 1 см3 в 2 параллельные пробирки со стерильным обезжиренным молоком (4.6.2.14).
Культивирование
Пробирки с посевами помещают в термостат и выдерживают при температуре (30±1) °С для учета мезофильных молочнокислых бактерий или при температуре (45±1) °С для учета термофильных молочнокислых бактерий. Посевы выдерживают 72 ч.
Обработка результатов
В результате развития молочнокислых микроорганизмов в молоке образуется сгусток. Процесс образования сгустка фиксируется визуально.
Для проведения анализа состава молочнокислых микроорганизмов готовят микропрепараты. По микроскопическому препарату отмечают три последних разведения, содержащие определяемую группу микроорганизмов (палочки или кокки).
При подсчете количества бактерий пользуются методом НВЧ по 5.6.4.
Картина роста мезофильных и термофильных молочнокислых микроорганизмов представлена в приложении Г.
6.6.1.4 Определение общего количества ароматообразующих микроорганизмов
Сущность метода
Метод основан на способности цитратсбраживающих ароматообразующих микроорганизмов при развитии их на плотных питательных средах с цитратом кальция в течение 48-72 ч при температуре (30±1) °С образовывать зоны просветления вокруг колоний.
Проведение анализа
Выбор разведений для посева
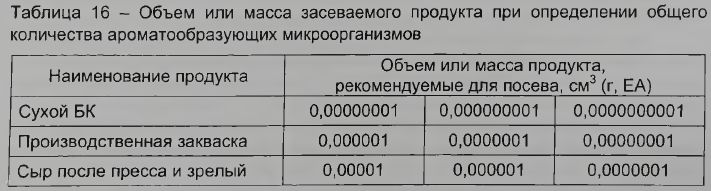
Количество засеваемого продукта устанавливают с учетом наиболее вероятного содержания ароматообразующих микроорганизмов в соответствии с таблицей 16.
Посев
Для определения общего количества ароматообразующих мезофильных факультативно-анаэробных микроорганизмов выбирают те разведения, при посевах которых на чашках вырастает не менее 20 и не более 200 колоний. Из каждой пробы делают посев на две-три чашки из разведений, указанных в таблице 16 в соответствии с 5.6.1. Каждое из разведений должно быть засеяно в количестве 1 см3 в одну чашку Петри с заранее маркированной крышкой и залито (14±1) см3 расплавленной и охлажденной до температуры 40-45 °С питательной средой, приготовленной по 4.6.2.15. Осадок нерастворимого цитрата кальция в среде перед заливкой чашек необходимо тщательно перемешать до его равномерного распределения в среде.
Культивирование
После застывания агара чашки Петри переворачивают крышками вниз и ставят в таком виде в термостат с температурой (30±1) °С на 48-72 ч.
Обработка результатов
Каждую чашку помещают вверх дном на темном фоне и проводят подсчет количества колоний, образовавших зоны просветления, пользуясь лупой с увеличением в 4-10 раз.
Каждую подсчитанную колонию отмечают на дне чашки чернилами.
Количество колоний, образовавших зоны просветления, подсчитывают на каждой чашке аналогично 6.5.1.
За окончательный результат анализа принимают среднее арифметическое, полученное по всем чашкам.
Картина роста цитратсбраживающих ароматообразующих микроорганизмов представлена в приложении Г.
6.6.1.5 Определение молочнокислых микроорганизмов можно проводить на средах, предусмотренных в ГОСТ 10444.11. Данные среды могут быть использованы в качестве арбитражных.
6.6.2 Определение количества бифидобактерий
6.6.2.1 Определение количества бифидобактерий в плотных питательных средах
Сущность метода
Метод основан на способности бифидобактерий размножаться в анаэробных условиях на питательных средах при температуре (37±1) °С с образованием типичных колоний.
Проведение анализа
Перед проведением анализа среду по 4.6.2.11, разлитую высоким столбиком, нагревают в кипящей водяной бане до полного расплавления агара в среде и выдерживают в кипящей водяной бане в течение (25±5) мин для снижения в ней растворенного кислорода с целью усиления анаэробных свойств.
При определении бифидобактерий в смешанных с молочнокислыми бактериями культурах перед расплавлением в среду вносят стерильный раствор неоми- цина (4.5.5.1) или диклоксациллина (4.5.5.2). После расплавления среды пробирки охлаждают в водяной бане до температуры (45±2) °С.
Готовят разведения продукта с 1 по 7 (при посеве бифидосодержащего БК - с 1 по 9). Для выявления максимально возможного количества бифидобактерий, при необходимости, можно засевать вплоть до 12-го разведения.
Затем из трех-четырех последних разведений берут пипеткой по 1 см3 и вносят в пробирки со средой. Пипетка с отобранным разведением опускается на дно пробирки, а затем медленно поднимается вращательным движением, таким образом, чтобы тщательно перемешать разведение со средой, не допустить попадание воздуха и ограничить пристеночный рост.
Проводят два параллельных определения.
Выращивание
Посевы выдерживают в термостате при температуре (37±1) °С в течение 2-3 сут, в случае определения бифидобактерий в смешанных с молочнокислыми бактериями культурах - 3-5 сут.
Обработка результатов
По окончании инкубирования учитывают последние пробирки, в которых выросли типичные для бифидобактерий колонии - в виде крупных «дисков» или «гречишных зерен». Отмечают разведение и подсчитывают количество выросших колоний.
Подтверждение принадлежности образовавшихся типичных колоний к бифидобактериям проводят методом микроскопирования.
Из типичных колоний последнего разведения готовят мазки, окрашенные метиленовым голубым по 4А.2.2. При приготовлении микропрепарата на чистое предметное стекло наносят петлей небольшую каплю стерильной воды или физраствора и исследуемый материал, взятый с колонии. Материал тщательно размешивают и распределяют на площади около 1 см2. Препарат высушивают при комнатной температуре, фиксируют в пламени горелки и красят метиленовым голубым. Бифидобактерии в препаратах имеют вид тонких, мелкозернистых, слегка изогнутых палочек с утолщениями на концах или без них; располагаются группами, в виде римских пятерок (V), скоплениями в виде китайских иероглифов, и могут образовывать короткие цепочки.
Вычисление содержания живых бифидобактерий Х4 в 1,0 см3 (г) продукта проводят по формуле
Х4 = а•10n,
где Х4 - количество живых бифидобактерий в 1,0 см3 (г) продукта;
а - среднее количество колоний в учитываемом разведении продукта, засеянном в 2 параллельных ряда;
10 - коэффициент децимального разведения;
n - показатель разведения продукта, в котором отмечен рост бифидобактерий.
Для определения истинного количества бифидобактерий в среде с неомицином результат следует удвоить.
Картина роста бифидобактерий на плотных питательных средах представлена в приложении Г.
6.6.2.2 Определение количества бифидобактерий в полужидких питательных средах
Сущность метода
Метод основан на способности бифидобактерий давать рост в питательных средах, разлитых высоким столбиком в пробирках, с образованием колоний при температуре (37±1) °С в течение 24-72 ч.
Проведение анализа
Перед проведением анализа среду для учета клеток бифидобактерий (4.6.2.12) следует разогреть в кипящей водяной бане в течение (20±5) мин.
При определении бифидобактерий в смешанных с молочнокислыми бактериями культурах перед расплавлением в среду вносят стерильный раствор неоми- цина (4.5.5). После расплавления пробирки охлаждают в водяной бане до температуры (45±2) “С.
Готовят разведения продукта с 1 по 7 (при посеве бифидосодержащего БК - с 1 по 9).
Затем из трех-четырех последних разведений берут пипеткой по 1 см3 и вносят в пробирки со средой. Проводят два параллельных определения, при этом пробирки располагают в два параллельных ряда.
Пипетка с отобранным разведением опускается до дна пробирки, а затем медленно поднимается вращательным движением, чтобы тщательно перемешать разведение со средой, не допустить попадания воздуха и ограничить пристеночный рост.
Культивирование
Посевы выдерживают в термостате при температуре (37±1) °С в течение (72±1) ч. Допускается предварительный учет через (48±1) ч с последующим окончательным учетом через (72±1) ч.
Обработка результатов
По окончании инкубирования учитывают последние пробирки, в которых выросли типичные для бифидобактерий колонии — в виде «гвоздиков», «вытянутых веретен», иногда в виде «полос», расположенных вдоль пробирки.
Подтверждение наличия бифидобактерий - методом микроскопирования.
Из типичных колоний последнего разведения и со дна пробирки последующего разведения (без видимого роста типичных колоний бифидобактерий) готовят препараты, окрашенные метиленовым голубым (по 4.4.2.2). При приготовлении микропрепарата на чистое предметное стекло наносят петлей небольшую каплю исследуемого материала и распределяют на площади около 1 см2. Препарат высушивают при комнатной температуре, фиксируют в пламени горелки и красят метиленовым голубым. Бифидобактерии имеют вид тонких, мелкозернистых, слегка изогнутых палочек с утолщениями на концах или без них; располагаются группами, в виде римских пятерок (V), скоплений в виде китайских иероглифов, могут образовывать короткие цепочки.
Поскольку анализируемые продукты, обогащенные бифидобактериями, являются кисломолочными, в мазках, в зависимости от вида продукта, могут присутствовать микроорганизмы молочнокислых заквасок (молочнокислые лактококки и палочки).
Вычисление содержания живых бифидобактерий Х5 в 1,0 см3 (г) продукта проводят по формуле
Х5 = а•10n,
где а - среднее количество колоний в последнем разведении продукта, засеянном в 2 параллельных ряда:
10 - коэффициент децимального разведения;
n — показатель последнего разведения продукта, в котором отмечен рост бифидобактерий.
При обнаружении бифидобактерий микроскопией мазков придонного материала из того разведения, в котором не отмечено видимого роста колоний, учитывают степень этого разведения.
Для определения истинного количества бифидобактерий в среде с не- омицином результат следует удвоить.
Картина роста бифидобактерий в полужидких питательных средах представлена в приложении Г.
6.6.3 Определение пропионовокислых бактерий
Сущность метода
Метод основан на подсчете колоний пропионовокислых бактерий, вырастающих в высоком столбике плотной питательной среды при (30±1) °С в течение 5-7 сут.
Проведение анализа
Подготовка к анализу
Перед проведением анализа среду по 4.6.2.17, разлитую при приготовлении высоким столбиком в пробирки П1-21-200ТС или П2-21-200ТС с диаметром (21±2) мм и высотой (200+2) мм, нагревают в кипящей водяной бане до полного расплавления агара в среде и выдерживают в кипящей водяной бане в течение (25±5) мин для снижения в ней растворенного кислорода с целью усиления анаэробных свойств. После расплавления пробирки охлаждают в водяной бане до температуры (45±2) °С.
Посев
При исследовании продукта или БК, содержащего пропионовокислые бактерии, готовят разведения с 1 по 7, при посеве моновидовых БК пропионовокислых бактерий готовят разведения с 1 по 9.
Затем из трех-четырех последних разведений берут пипеткой по 1 см3 и вносят в пробирки со средой. Пипетка с отобранным разведением опускается до дна пробирки, а затем медленно поднимается вращательным движением, таким образом, чтобы тщательно перемешать разведение со средой, не допустить попадание воздуха и ограничить пристеночный рост. Пробирки с посевами охлаждают до застывания агара.
Проводят два параллельных определения.
Культивирование
После застывания агара пробирки с посевами помещают в термостат с температурой (30±1) °С на 5-7 сут.
Обработка результатов
По окончании инкубирования учитывают последние пробирки, в которых выросли типичные для пропионовокислых бактерий колонии - в виде крупных «дисков» или «гречишных зерен» обычно светло-кремового цвета. Колонии могут быть белыми, серыми, розовыми, красными, желтыми или оранжевыми. Отмечают разведение и подсчитывают количество выросших колоний.
Подтверждение принадлежности образовавшихся типичных колоний к пропионовокислым бактериям проводят методом микроскопирования и пробой на каталазу.
Из типичных колоний последнего разведения готовят мазки, окрашенные метиленовым голубым по 4.4.2.2. При приготовлении микропрепарата на чистое предметное стекло наносят петлей небольшую каплю стерильной воды или физраствора и исследуемого материала, взятого с колонии. Материал тщательно перемешивают с водой или физраствором и распределяют на площади около 1 см2. Препарат высушивают при комнатной температуре, фиксируют в пламени горелки и красят метиленовым голубым. Пропионовокислые бактерии в препаратах имеют вид дифтеро- идных или булавовидных палочек с одним округленным концом, другой конец может быть конусообразным или заостренным, окрашивающимся менее интенсивно. Клетки некоторых культур могут быть кокковидными, удлиненными, раздвоенными и даже разветвленными. Клетки обычно располагаются поодиночке, парами, в виде букв V и Y, короткими цепочками или группами в виде «китайских иероглифов».
Проверку каталазной активности колоний, взятых для микроскопирования, проводят по 6.3.1. Пропионовокислые бактерии являются каталазоположительными.
Вычисление содержания пропионовокислых бактерий Хв в 1,0 см3 (г) продукта проводят по формуле
Х6= а •10n,
где Х6 - количество пропионовокислых бактерий в 1,0 см3 (г) продукта;
а - среднее количество колоний в учитываемом разведении продукта, засеянном в 2 параллельных ряда;
10 - коэффициент децимального разведения;
n — показатель разведения продукта, в котором отмечен рост пропионовокислых бактерий.
6.6.4 Методы определения дрожжей в кисломолочных напитках (кефир и др.)
Определение дрожжей в кисломолочных напитках проводят в соответствии с 6.5.8 или ГОСТ 10444.12.

