Ферменты являются биологическими катализаторами белковой природы. Реакции, катализируемые ферментами, протекают в мягких условиях (в отношении pH и температуры), с большой скоростью и избирательностью. Очень незначительные изменения в строении или пространственной конфигурации молекул субстрата могут сделать его. невосприимчивым к действию фермента [И, 43]. Ферментативные свойства молекулы ферментного белка, его активность и специфичность зависят ог определенной части этой молекулы, которую обозначают обычно термином «активный центр». Активный центр состоит из ряда функциональных групп, определенным образом ориентированных в пространстве. Он представляет собой структуру, приспособленную для тесного сближения и взаимодействия с молекулой субстрата. Однако отграничение активного центра, как такового, от остальных частей молекулы фермента носит довольно относительный характер, так как эти части играют роль в обеспечении трехмерной конформации активного центра и влияют на реакционную способность его групп [И]-, Учитывая специфичность действия ферментов, представлялось возможным применить определенные ферменты для гидролиза именно тех веществ пива, которые вызывают помутнение. Поскольку вначале доминирующую роль в процессе помутнения приписывали белкам, то исследования в области применения ферментов для стабилизации пива проводили в направлении поиска и изучения протеолитических ферментов. Поэтому подавляющее большинство работ в этой области касается применения ферментов, гидролизующих белки (полипептиды).
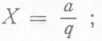
Рис. 30. Схема действия пептид-гидролаз.
Ферментативный гидролиз белков (полипептидов). Протеолитические ферменты (пептид-гидролазы) катализируют гидролиз пептидных связей —СО—NH—. Они подразделяются на эндопептидазы (пептид-пептид-гид- ролазы) и экзопептидазы [37]. Первые гидролизуют связи внутри молекулы белка, переводя ее в довольно высокомолекулярные полипептиды, вторые воздействуют на терминальные пептидные связи с отделением от молекулы белка определенных аминокислот. В зависимости от того, где происходит гидролиз пептидной связи: около концевой карбоксильной или аминной группы, экзопептидазы подразделяются на карбоксипептидазы и аминопептидазы (рис. 30). Большинство протеолитических ферментов гидролизует преимущественно связь между строго определенными- аминокислотами. Так, трипсин гидролизует только те пептидные связи, которые образованы при участии карбоксильных групп аминокислот лизина или аргинина.
Ферментные препараты применяются для стабилизации пива довольно давно [71]. В 1911 г. Валлерстейн получил ряд патентов на применение для стабилизации пива препаратов протеолитических ферментов, активных в слабокислой среде. Он использовал препараты из солода и поджелудочной железы животных, а также папаин и бромелин, к протеолитическим препаратам добавлял особым образом приготовленный водны!/ раствор лупулина [71].
В настоящее время за рубежом производится и применяется (там, где это разрешено) значительнее число различных препаратов-стабилизаторов [179]: Чилко— фирма «Зибель» (США); Коллупулин — «Валлерстейн» (США); Кристаллаза — «Интерекс» (ФРГ); Мальтолизин—«Байрол» (ФРГ); Протезал — «Шварц» (США); Симбиаза — «Интермаг» (ФРГ); Стабилозим— «Байрол» (ФРГ). Некоторые из этих препаратов содержат животные протеазы, но большинство приготовляется с использованием растительных протеолитических ферментов: папаина, бромелина и фицина. Из протеаз животного происхождения используют пепсин (3.4.4.1) [37] — фермент желудочного сока с молекулярной массой 34 400. Расщепляет он главным образом белки (протеины), являясь эндопептидазой. Пепсин активен в кислой среде (оптимум pH 1,5—2,0), на белки пива действует главным образом при пастеризации, при низкой температуре действие его незначительно.
Наиболее широко в промышленных препаратах-стабилизаторах используются растительные протеиназы типа папаина (3.4.4.10) [37]. Этот фермент находится в млечном соке плодов дынного дерева Carica papaja, откуда и получил свое название. Папаин активен в слабокислой, нейтральной и щелочной средах (оптимум pH 5,0—6,5). Молекулярная масса его 20 700. Папаин получен в кристаллическом виде. В настоящее время строение молекулы папаина довольно хорошо изучено, установлена первичная структура молекулы, т. е. последовательность аминокислот. Молекула папаина состоит из 212 аминокислотных остатков, содержит 3 дисульфидных мостика и одну сульфгидрильную группу. Для ферментативной активности папаина нужны не все аминокислоты, входящие в молекулу. Показано, что можно удалить из нее 120 аминокислот и ферментативная активность не будет потеряна [41].
Отличительной особенностью ферментов типа папаина является их способность увеличивать свою активность (активироваться) различными восстанавливающими агентами (цианиды, сероводород, сульфгидрильные соединения) и инактивироваться окисляющими агентами (перекись водорода, йодацетат и др.).
При окислении папаина происходит, очевидно, соединение двух молекул белка через дисульфидную связь активного центра. Восстановление приводит к образованию сульфгидрильной группы, что переводит фермент в каталитически активное состояние. Папаин гидролизует белки, пептиды, естественные и синтетические амиды и эфиры аминокислот, особенно по связям между основными аминокислотами — аргинином и лизином, а также между лейцином и глицином. Поэтому различные белки в зависимости от содержания в них этих аминокислот могут гидролизоваться с различной интенсивностью.
В пивоварении папаин целесообразно вносить в лагерный танк при дображивании, так как низкое значение гН, устанавливающееся в пиве к концу этого периода, создает условия для активации фермента восстанавливающими веществами, имеющимися в пиве. Однако часто папаин добавляют в специальный танк после предварительной фильтрации пива, а более чистые, хорошо растворимые препараты можно вносить в сборник фильтрованного пива. Последнее возможно еще и потому, что многие препараты на основе папаина содержат в своем составе необходимые активаторы.
Японские исследователи [135] сообщили о способности папаина свертывать белки пива. На свертывающую способность папаина влияют температура пива (или модельных растворов) и продолжительность действия. О наличии свертывающей активности судили по увеличению мутности раствора. В опытах Окада и Ашида [175] мутность растворов, содержащих выделенные и очищенные белки солода, сначала увеличивалась (до 1 мин), а затем падала. Эти исследователи полагают, что соединение папаина с белками (солодовый белок, казеин, яичный альбумин) обусловлено различием их зарядов: папаин в пределах pH 4,3—7,0, где происходит наиболее сильное свертывание, заряжен положительно, белки — отрицательно, что объясняется различием их изоэлектрических точек (папаин — 8,5, казеин — 4,6).
При внесении содержащих папаин препаратов, так же как и других протеолитических препаратов, применяемых для стабилизации пива, Необходимо избегать слишком больших доз. Де Клерк подчеркивает, что ферменты в больших дозах сами могут отрицательно влиять на коллоидную стойкость.
В табл. 51 приведены данные Драверта и др. [109] о зависимости стойкости пива к холодному помутнению от дозы препарата.
Т а б л и ц а 51 Зависимость стойкости пива от дозы препарата
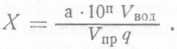
Из данных табл. 51 видно, что оптимальное действие оказывает препарат в дозе 0,1 мг. С увеличением дозы интенсивность действия препарата снижается. Аналогичные данные получены и другими исследователями (Вайсслер и Гарза, Покровская, Кислякова и др.) [64, 242].
Доза препаратов, содержащих папаин, зависит от чистоты препарата. Обычно промышленные препараты используются в дозе 2—10 г/гл пива.
Бергман [86] указал,- что при приготовлении суспензии препарата необходимо уменьшить возможный контакт с воздухом или добавить к воде небольшое количество (0,1%) метабисульфита натрия для уменьшения окислительной инактивации.
Действие протеолитических ферментных препаратов тем эффективнее, чем лучше осветлено пиво. Поэтому их, так же как и адсорбенты, целесообразно добавлять к пиву после предварительной фильтрации по схеме, приведенной на с. 170.
К числу растительных протеолитических ферментов, применяемых для стабилизации пива, относятся препараты протеаз из солодовых ростков, полученные во ВНИИПБПе [44].
Валлерстейн отмечает, что препараты микробной природы можно также с успехом применять для стабилизации пива [71].
Получение ферментных препаратов путем культивирования микроорганизмов — значительно более простой способ, чем выделение ферментов из растительного или животного сырья. Быстрое размножение микроорганизмов, использование ими простых, дешевых питательных сред, исключительная пластичность этих организмов привели к тому, что все больше ферментных препаратов производится с использованием культур микробов. Многие бактерии и плесневые грибы образуют вне- и внутриклеточные протеазы, имеющие различное строение и действие, а также, что особенно важно, различную способность гидролизовать разные белки. Последнее зависит от способности фермента преимущественно атаковать связи между определенными аминокислотами в белковых молекулах.
Гидролиз различных субстратов, например казеина, желатина, альбумина, гемоглобина и других белков, протекает неодинаково при действии различных препаратов. Активность папаина, фицина, бромелина, бактериальной и грибной протеиназ, измеренная по изменению вязкости раствора желатина, резко отличается от активности, определенной на казеине. Еще больше препараты протеолитических ферментов различаются по интенсивности гидролиза белков растительного и животного происхождения [6, 64].
Протеолитические ферменты микроорганизмов тлеют широкий спектр свойств. Поэтому среди ферментов можно найти такие, которые будут гидролизовать только те полипептидные соединения пива, которые участвуют в образовании коллоидной мути, не затрагивая другие, необходимые для пенистых свойств и полноты вкуса пива.
Японские исследователи [214] разработали метод «скриннинга», т. е. быстрого, отсеивающего анализа на способность микроорганизмов продуцировать протеазы, снижающие или предотвращающие появление в пиве коллоидного помутнения. Они проверили большое число, в основном японских, протеолитических препаратов на их способность предотвращать помутнение пива на холоде. Проверка показала, что, несмотря на высокую протеолитическую активность, определенную на казеине и гемоглобине, препараты животного и микробного происхождения не проявили способности стабилизировать пиво. Авторы считают, что эти ферменты не способны атаковать полипептиды пива, участвующие в образовании сложных комплексов. Из 1670 штаммов различных микроорганизмов они выявили 38 штаммов, обладающих способностью продуцировать соответствующие протеазы. Наиболее сильно образовывали ферменты несколько видов Pseudomonas и некоторые штаммы Serratia marcescens (Bacterium prodigiosum). Остальные виды бактерий, плесневые грибы и актиномицеты такой способностью не обладали. Однако, по нашему мнению, методические детали проведения этих исследований ставят под сомнение категоричность полученных выводов. Поиск эффективных для стабилизации пива препаратов микробной поироды продолжается во многих странах [15, 26, 64, 87].
Большое внимание обращается на культуры плесневых грибов, особенно Asp. oryzae. При выращивании штаммов этого гриба поверхностным способом на отрубях или глубинным способом на средах различного простого состава образуется целый набор протеолитических ферментов. Поэтому попытки использовать культуру этого гриба для получения стабилизаторов пива [17] продолжаются. Другие плесневые грибы также образуют ферменты, гидролизующие полипептиды пива. В табл. 52 приведены результаты обработки пива препаратами из культур различных микроорганизмов [41].
Под влиянием препаратов из культур Asp. oryzae, Asp. flavus и Asp. terricola сильно уменьшалась фракция высокомолекулярных полипептидов пива и увеличивалась фракция пептидов средней молекулярной массы (фракция В). Пепсин в этих опытах действовал слабо, а препарат из культуры Вас. mesentericus почти не оказывал никакого влияния.
Протеолитические ферменты гриба Asp. oryzae изучались многими авторами. Движение [3] установил наличие в неочищенном препарате из поверхностной культуры этого гриба пять протеолитических фракций с оптимумом pH 4,5—5,0—7,2—10,0. Фракции различались по способности к гидролизу синтетических ди- и трипептидов. Одна фракция сильно расщепляла глицил- глицин, другая — глицил-фенилаланин, глютаминил- аспарагин и а-аланил-глицил-глицин, третья — глицил- тирозин и а-аланил-глицил-глицин. Остальные 2 фракции почти не расщепляли испытанные пептиды. Эти данные могут указывать на преимущественные точки гидролиза белковых молекул ферментами Asp. oryzae. Молекулярная масса выделенных фракций колебалась от 26 000 до 89 000. Но не все фракции обладали способностью гидролизовать полипептиды пива (табл. 53).
Влияние ферментных препаратов микробного происхождения на азотистые вещества пива
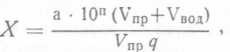
Только одна из фракций (IV) проявила способность значительно снижать величину фракции А и увеличивать время хранения пива на холоде без помутнения.
На способность грибов Asp. oryzae синтезировать кислые, нейтральные и щелочные протеазы (по оптимуму pH для их действия) указывают и многие другие исследователи.
Действие фракций препарата из культуры Asp. oryzae на полипептиды пива [4]
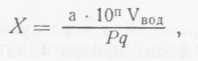
Протеиназы бактериальной природы, как правило, более термостойки по сравнению с грибными, и оптимум pH их активности сдвинут несколько в щелочную сторону (6,5—8,0). Наиболее изучены и применяются ферменты, образуемые бактериями Вас. subtilis и Вас. mesen- tericus [5].
В Японии фермент, придающий пиву холодоустойчивость, выделен из культуральной жидкости бактерии Serratia marcescens В 103. Молодое пиво хранили с раствором фермента при 0°С в течение 30 дней. Было установлено, что способность фермента стабилизировать пиво сходна с действием папаина [87].
Препараты, вносимые в готовое пиво для его стабилизации, не должны, по возможности, содержать большого количества других ферментов, помимо протеолитических. Однако промышленная выработка таких чистых препаратов сложна и дорога, поэтому обычно применяются препараты, частично освобожденные от клеток продуцентов, остатков питательной среды и некоторых метаболитов. Тем не менее все препараты содержат в большей или меньшей степени целый комплекс различных ферментов.
Во ВНЙИПБПе [62] было установлено, что некоторые грибные препараты, особенно Амилоризин ШОх и Г Юх, гидролизуют полисахариды и полипептиды сусла и пива как при высокой (50° С), так и при низкой (6° С) температуре. В результате гидролиза препаратами олигосахаридов и декстринов до глюкозы и частично до мальтозы значительно повышается конечная степень сбраживания сусла (рис. 31, 32).
В дальнейшем изложении препараты, содержащие комплекс ферментов (главным образом а- и (5-глюкозидазы и глюкоамилазы), под действием которых из олигосахаридов и декстринов сусла образуются сбраживаемые сахара, будут для краткости называться сахарогенными препаратами.
Многочисленные опыты, проведенные в лабораторных и производственных условиях (на Москворецком пивоваренном заводе), показали, что пиво, полученное с использованием препаратов Амилоризин П10х и Ами- лоризин Г Юх, содержит больше спирта и меньше действительного экстракта; оно, как правило, лучше осветлено и имеет хорошие органолептические качества.

Рис. 31. Изменение редуцирующей способности раствора декстринов сусла под влиянием ферментных препаратов:
/ — Амилоризин ПЮх; 2 — Амилоризин ГЮх; 3 — Амилосубтилин ГЮх. Сплошная линия — при /=«50° С и продолжительности в часах; пунктирная — при /=6" С и продолжительности в сутках.

Рис. 32. Изменение конечной степени сбраживания сусла в зависимости от дозы препаратов.
Эти препараты были рекомендованы ВНИИПБПом для повышения сбраживаемости сусла (61, 63].
Поскольку таниновый показатель в опытном пиве был ниже, чем в контрольном, в последующей работе изучалось главным образом влияние ферментных препаратов на показатели, характеризующие коллоидную стойкость пива. Было испытано около 20 различных грибных и бактериальных препаратов на их способность понижать в пиве содержание высокомолекулярных полипептидов и предотвращать или снижать интенсивность помутнения пива на холоде (при 0°С).
Многие исследователи отмечают, что для оценки действия протеолитических препаратов на пиво обычные методы анализа, такие, как фракционирование по Лундину, высаливание сульфатом аммония или магния, определение коагулируемого азота или других фракций азотистых, веществ, малопригодны. Единственным тестом, который дает наиболее правильную информацию о склонности пива к помутнению и, тем самым, о его стойкости, является определение интенсивности помутнения пива на холоде (при 0° С).
Рис. 33. Влияние фермент ых препаратов на таниновый юказатель пива:
1 — контроль; 2 — Глюкоамилаза; 3 — Кол- лупулин; 4 — Амилоризин ГЮх; 5 — Прото- субтилин ГЮх; 6 — Амилоризин П10х; 7 — Чилко.
Обычно с этой целью используют так называемые ускоренные тесты (см. с. 247). Для оценки содержания в пиве высокомолекулярных полипептидов во ВНИИПБПе использовали быстрый и достаточно точный метод, разработанный там же (см. с. 235) и основанный на способности полипептидов образовывать осадок с танином. Этот метод особенно удобен для быстрой оценки препаратов при их отборе. Метод позволяет выявить наиболее опасную для коллоидной стойкости фракцию полипептидов, т. е. фракцию, чувствительную к танину (к полифенолам).
В табл. 54 приведена ферментативная активность (в ед./г) некоторых испытанных препаратов (активность Чилко указана в ед./мл).
Данные табл. 54 показывают комплексную природу всех препаратов, причем протеолитическая активность их, определенная на казеинате натрия при pH 5,0, колебалась от 4,3 до 320 ед./r. Взятые для сравнения импортные стабилизаторы Коллупулин и Чилко обладали невысокой протеолитической активностью, чем большая часть других препаратов. На рис. 33 приведена динамика снижения танинового показателя пива при действии некоторых ферментных препаратов.
Рис. 34. Влияние дозы препарата на таниновый показатель и холодное помутнение пива в ускоренном тесте:
1 — Протосубтилин ГЮх; 2 — Амилоризин ШОх; 3 — Глюкоамилаза;-- таниновый показатель.- величина холодного помутнения.
На рис. 34 показана зависимость танинового показателя и интенсивности холодного помутнения пива от дозы препаратов. Из рис. 33—34 видно, что многие ферментные препараты, как грибные, так и бактериальные, вызывают снижение в пиве количества высокомолекулярных полипептидов, чувствительных к танину. Однако интенсивность холодного помутнения изменяется не параллельно снижению количества этих полипептидов, отчетливой корреляции между двумя этими показателями нет. На рис. 34 видно, что в то время как таниновый показатель с увеличением дозы препарата постепенно снижается, интенсивность холодного помутнения сначала понижается, а затем повышается. Это говорит о том, что существует оптимальная доза препаратов, выше которой их эффективность снижается.
Наблюдаемая закономерность может быть следствием как уже упоминавшегося проявления белковой природы самих вносимых ферментов, так и того, что наряду с протеолитическими ферментами препараты содержат другие ферменты, под действием которых увеличивается мутность.
Особенно сильное помутнение в условиях лабораторных опытов вызывали препараты Амилоризина, причем это действие было неодинаково в разных опытах. В табл. 55 приведены результаты двух опытов, отличавшихся условиями проведения ускоренного теста: в одном пиво выдерживалось 5 сут при 55° С, затем на сутки помещалось при 0° С, во втором перед помещением на 24 ч при 0°С пиво выдерживали при температуре 55° С всего 2 сут.
Таблица 5.5
Влияние Амилоризина ПЮх на таниновый показатель и интенсивность холодного помутнения, пива в ускоренных тестах
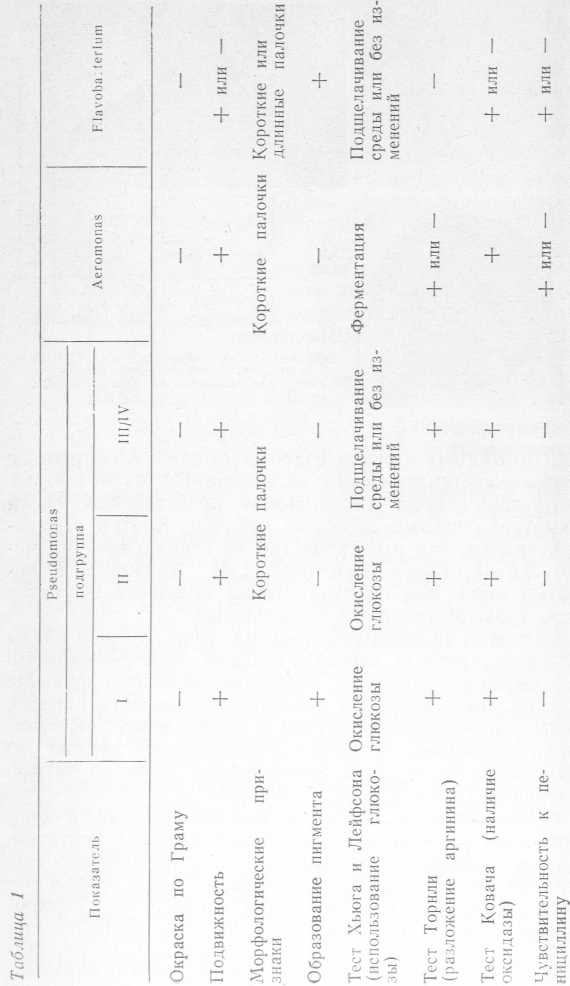
Из данных табл. 55 отчетливо видно увеличение помутнения пива с повышением дозы препарата, несмотря на снижение танинового показателя. Для выяснения вопроса о влиянии на помутнение белка самого препарата была проведена специальная проверка с добавлением различных доз препарата Амилоризина к обычному жигулевскому пиву и к пиву импортному, очень стойкому (вероятно, стабилизированному). Образцы пива с препаратом исследовались по ускоренному тесту.
Таблица 56.
Влияние Амилоризина ПЮх на помутнение пива
В табл. 56 приведены результаты проверки.
Проверка показала, что белок препарата незначительно усиливает помутнение пива (1,5 ед. ЕВС в импортном пиве при внесении препарата в дозе 10 мг/100 мл). Резкое увеличение мутности жигулевского пива при добавлении такой же дозы препарата обусловлено, очевидно, сопутствующим действием.
Как показали многочисленные опыты, увеличение мутности при использовании препаратов Амилоризин ПЮх и Амилоризин Г Юх объясняется происходящими под влиянием этих препаратов окислительными процессами. Например, добавление к пробе пива Амилоризина и некоторых других препаратов совместно с препаратами глюкозооксидазы значительно снижало интенсивность холодного помутнения (табл. 57).
Таблица 57
Влияние глюкозооксидазы на стабилизирующее действие препаратов
* Доза препарата в мл/100 мл.
Из данных табл. 57 видно, что добавление глюкозооксидазы почти не оказывает какого-либо влияния на таниновый показатель пива, но снижает интенсивность холодного помутнения, особенно сильно в случае применения Амилоризина ПЮх и Протосубтилина ГЮх.
Определение активности полифенолоксидазы в этих препаратах по методу Штайнера в модификации Нарцисса и Сёкина [166] с пирокатехином в качестве субстрата подтвердило предположение о наличии во многих грибных и бактериальных препаратах ферментов, окисляющих полифенолы.
Таким образом, при отборе препаратов для стабилизации пива против коллоидного помутнения необходимо производить проверку препаратов не только на протеолитическую активность, но и на содержание в них окислительных ферментов типа полифенолоксидаз. При наличии таких ферментов необходима дополнительная очистка препаратов от оксидаз или обязательное применение одновременно с препаратом какого-либо антиоксиданта. Недоучет этого обстоятельства часто снижает значимость исследовательских работ по подбору ферментных препаратов для стабилизации пива.
В обычных препаратах-стабилизаторах всегда содержится некоторое количество окислительных ферментов. Поэтому при использовании ферментных препаратов необходимо, как подчеркивают многие исследователи, принимать меры предосторожности против контакта пива с воздухом. Отрицательное действие на стойкость пива окислительных ферментов, содержащихся во многих препаратах-стабилизаторах, может проявляться не всегда, а только в тех случаях, когда пиво содержит много воздуха и большое количество полифенолов типа полигидроксифлаванов, особенно легко подвергающихся окислительной полимеризации. От присутствия в препаратах-стабилизаторах окислительных ферментов зависит способ их применения: такие препараты опасно вносить в фильтрованное пиво, их надо добавлять или в начале брожения или в молодое пиво во время перекачивания.
Ферментативный гидролиз углеводов. В работе [64] было установлено сильное стабилизирующее действие препарата Глюкоамилазы фирмы «Рапидаз». Это можно было объяснить гидролизом декстринов, что могло привести к повышению стойкости. Однако, помимо снижения интенсивности холодного помутнения, этот препарат приводил к очень сильному уменьшению танинового показателя, т. е. производил гидролиз высокомолекулярных полипептидов, несмотря на то, что при определении на казеине он не обнаружил протеолитической активности.
Проверка нескольких других препаратов глюкоамилаз показала, что, несмотря на очень сильное расщепление декстринов пива, эти препараты не снижали таниновый показатель пива и почти не уменьшали интенсивность холодного помутнения (табл. 58).
Таблица 58
Коллоидная стойкость пива, обработанного глюкоамилазами [36]
Продолжение табл. 58
Примечание. Буквой А обозначен препарат Глюкоамилаза фирмы «Рапидаз», остальными буквами обозначены препараты из культур Endomycopsis.
Эти данные заставляют предположить, что стабилизирующий эффект препарата Глюкоамилазы фирмы «Рапидаз» обусловлен в основном наличием в нем протеолитических ферментов, гидролизующих растительные белки.
Исследование, проведенное во ВНИИПБПе, показало, что при подборе ферментных препаратов для стабилизации пива необходимо не только принимать во внимание наличие в них ферментов, окисляющих полифенолы, но и учитывать протеолитическую активность по способности препаратов гидролизовать высокомолекулярные полипептиды растительного происхождения.
Протеолитическая активность, определенная на белках животного происхождения, не может быть основанием для дозировки препаратов по единицам этой активности. Эффект действия препаратов нужно оценивать по интенсивности холодного помутнения.
Проверка различных препаратов в производственных условиях. В результате многочисленных исследований ВНИИПБПа в качестве наиболее перспективных стабилизаторов отобраны следующие препараты: Протосуб- тилин Г10х, Глюкоамилаза фирмы «Рапидаз», препарат из Asp. oryzae А-4, полученный Татаренко в УкрНИЙППе, и Амилорпзины ШОх и ГЮх. Эффективность двух последних препаратов может быть повышена после дополнительной очистки или при использовании в сочетании с антиоксидантами.
Добавление Амилоризина ШОх в дозе 1 г/гл в начале брожения совместно с глюкозооксидазой (0,5 г/гл.), вносимой при розливе, позволило в производственных условиях на Москворецком пивзаводе получить пастеризованное пиво, остававшееся прозрачным 5 мес, в то время как контрольное помутнело уже через 2 мес. Стойкость пива, обработанного одним Амилоризином, составила 3,5 мес.
В работе Ежова и др. {26] показана возможность повышения коллоидной стойкости пива в 2 паза с помощью четырех ферментных препаратов: Проторизин ШОх, Амилоризин ШОх, Гигролитин Б, Протосубтилин ГЮх. Препараты в дозе 2—3 г вносили в сусло температурой 30° С на 30 мин, затем сусло охлаждали и засевали дрожжами.
Веселовым и Грачевой с сотрудниками для повышения коллоидной стойкости пива применен препарат кислой протеиназы из культуры гриба Asp. oryzae 8Fj. Препарат добавляли в молодое пиво в дозе 5 г/гл перед перекачиванием в лагерный подвал. Количество высокомолекулярных белков в опытном пиве снижалось почти в 1,5 раза. Стойкость непастеризованного пива, прошедшего обеспложивающую фильтрацию, увеличилась в 2—3 раза по сравнению с контрольным [19].
Михайловская и Середина [47] проводили испытания двух грибных препаратов — Амилоризина ШОх и Прототерризина ШОх, выработанных Московским опытным заводом ферментных препаратов. Опыты проводили в производственных условиях на нескольких заводах, причем препараты вносили в дозах 0,2—0,4 г/гл или в молодое пиво при перекачивании, или в сборник. Увеличение доз не усиливало стабилизирующего действия, но отрицательно сказывалось на ценообразовании. Контрольное пиво содержало от 15 до 24,5 мг/100 мл азота фракции А по Лундину, и стойкость его составляла 1—2 мес. В опытном пиве фракция А уменьшалась на 7—45%, а стойкость повышалась до 2—3,5 мес. В среднем по 20 опытам повышение стойкости пастеризованного пива составило 38% от контроля.
Основная опасность при использовании ферментных препаратов-стабилизаторов протеолитического действия состоит в том, что недостаточно специфичный и слишком глубокий гидролиз высокомолекулярных полипептидов может приводить к ухудшению пенистых свойств. Следовательно, необходимо найти такую дозу каждого конкретного препарата и условия его действия (продолжительность, температура), при которых будет проходить ограниченный, но специфичный гидролиз только тех полипептидов, которые участвуют в образовании коллоидной мути.
Многие ферменты не полностью инактивируются при пастеризации пива и могут продолжать действовать во время хранения разлитого пива [123]. Было установлено, что довольно значительная активность сохраняется после выдержки пива при 75° С: в течение 5 мин остается 77—87% первоначальной активности; в течение 15 мин — 23—70%; в течение 30 мин—12—45% (в зависимости от дозы).
Остающаяся активность во время хранения пива может привести к слишком глубокому гидролизу и ухудшению пенистых свойств. Поэтому представляется перспективным применение для стабилизации пива препаратов нерастворимых, так называемых иммобилизованных ферментов.
Применение препаратов иммобилизованных ферментов. В таких препаратах фермент фиксирован на определенном нерастворимом носителе, причем связь фермента с носителем настолько прочная, что фермент не переходит в жидкую фазу, но сохраняет свои каталитические свойства.
Для иммобилизации используются различные типы связи фермента с носителем: 1) чисто физическая адсорбция ферментов на носителях (пористое стекло, древесный уголь, целлюлоза, синтетические ионообменные смолы, диатомит, бентонит и др.); 2) включение в гель полимера — полиакриламида или кремниевой кислоты; 3) ковалентное связывание ферментов с би- или поли- функциональными веществами — непосредственно или после активирования поверхности носителя. В качестве носителей используются пористое стекло, силикагель, коллоидный кремнезем, карбоксиметилцеллюлоза, ами- ноалкилцеллюлоза, полимеризаты малеиновой кислоты, дериваты акриламида, полиаминостирол. По мнению большинства исследователей, именно ковалентное связывание ферментов представляется лучшей формой иммобилизации; 4) микрокапсулирование; 5) закрепление фермента на клеточной стенке микроорганизмов посредством ковалентной связи между активными группами ферментного белка и маннаном клеточной стенки при участии солей тяжелых металлов.
Активность иммобилизованных ферментов и возможность их практического использования зависят как от формы связи, так и от физико-химических свойств носителя. Для успешного превращения высокомолекулярных субстратов большое значение имеет пористость носителя. По мнению Гаина и др. [70], для пищевой промышленности необходимо ориентироваться на разработку высокопористого, механически прочного стекла с достаточным числом реакционных групп и недорогой технологией производства, а также на использование полимерных носителей, устойчивых к микробиальной атаке и не снижающих гигиенических свойств продуктов.
Фиксированные на носителе ферменты могут несколько, изменять свои свойства в отношении термостойкости, температурного оптимума действия, оптимума pH и т. д. Наиболее важным изменением является повыше- дне стабильности ферментов, которое и придает им совершенно новое качество — пролонгированность действия. Активность иммобилизованных ферментов остается высокой при хранении в соответствующих условиях в течение нескольких лет.
Необходимо отметить, что при иммобилизации значительная часть активности фермента теряется и в полученном комплексе остается примерно 30% активности, иногда и значительно меньше. Неправильный подбор условий иммобилизации может привести к полной инактивации ферментов на носителе, что может быть связано с конформационными изменениями молекулы ферментного белка, экранированием активного центра фермента или высоким диффузионным сопротивлением, затрудняющим контакт фермента и субстрата. Несмотря на эти трудности, а также на сложность аппаратурного решения гетерогенного катализа, иммобилизованные ферменты начинают находить практическое применение. В настоящее время имеются публикации и патенты о применении иммобилизованных ферментов для разжижения и осахаривания крахмала, изомеризации глюкозы во фруктозу, инверсии сахарозы. Подробный обзор по иммобилизованным ферментам и их применению в пищевой промышленности, в том числе и в пивоварении, опубликован Гаина и др. [70].
Некоторые исследователи [248, 252] предлагают использовать иммобилизованную амилоглюкозидазу для повышения сбраживаемости сусла, иммобилизованные протеолитические ферменты — для гидролиза полипептидов пива с целью повышения его коллоидной стойкости.
Драверт с сотрудниками [109] приводят результаты испытания иммобилизованного папаина — энцигеля папаина (Boeringer Mannheim) для повышения коллоидной стойкости пива. В качестве носителя в этом препарате использован сополимеризат акриламида, N.N1— метилен-бисакриламида и малеиновой кислоты. Удельная активность препарата — примерно 80 ед./г. Эффективность препарата сравнивалась с действием растворимого препарата папаина, имеющего удельную активность 30 ед./мг (т. е. 30 000 ед./г).
Рис. 35. Устойчивость к холоду (метод 40°С/0°С) пива, обработанного иммобилизованным папаином:
1 — контроль; 2 — доза 20 г/гл (активность 16 ед./л); 3 — доза 48 г/гл (38 ед./л); 4 — доза 72 г/гл (58 ед./л).
В опытах было установлено, что иммобилизованный фермент довольно быстро терял активность — за 24 ч действия на осветленное пивное сусло активность снизилась до 34 ед./г, а после 52 ч—до 18 ед./г. Однако было показано, что после инкубации возможна реактивация препарата посредством обработки активирующим раствором, состоящим из фосфатного буфера с pH 6,5; 0,01 М цистеина и 0,01 М ЕДТА (тетраацетат). Пятидневная инкубация в присутствии активирующего раствора при 4° С дала только незначительное уменьшение активности — с 63 до 57 ед., в другом случае отмечалось даже увеличение активности до 78 ед.
На рис. 35 показано достигнутое в опытах повышение стойкости обработанного пива к холоду (устанавливалось по определению мутности в результате 24-часового попеременного нагревания при 40° С и охлаждения до 0° С).
Необходимо отметить, что в опытах с иммобилизованным препаратом стойкость улучшалась пропорционально увеличению дозы препарата. В этом случае не наблюдалось установленного при использовании растворимого папаина снижения эффекта при увеличении дозы (см. с. 178). Однако и при использовании нерастворимых ферментов надо выбирать такую дозу, которая бы приводила к повышению стойкости, но не снижала пенистые свойства пива.
Физико-химические свойства носителя определяют также особенности аппаратурного оформления процесса. Наиболее прогрессивным, нетрудоемким было бы применение колонок, наполненных иммобилизованным ферментом, через которые непрерывным потоком протекало пиво или сусло. Но в этом случае должен использоваться достаточно крупнодисперсный препарат с хорошей дренирующей способностью. Однако при этом может быть снижена ферментативная эффективность препарата. Кроме того, использование колонок в пивоварении усложняется необходимостью применения давления углекислоты и тщательной предварительной фильтрации пива. Поэтому может быть изучен и затем использован другой способ — обработка пива иммобилизованными ферментами в реакторе. После одного цикла обработки пиво может быть декантировано с осадка препарата, а реактор заполнен новой порцией пива.
Сообщалось [235] об иммобилизации папаина на коллагене и применении коллаген-папаиновых мембран (пленок) для повышения коллоидной стойкости пива. Пиво пропускали через биокаталитический модульный реактор спиралевидной формы, на внутреннюю поверхность которого наносили 15 г коллаген-папаиновой пленки. Скорость пропускания пива колебалась от 8,7 до 605 мл/мин. Обработанное пиво обладало удовлетворительной прозрачностью на протяжении 1—3 мес, при этом вкус, цвет и пеностойкость его не менялись. Активность биокаталитического реактора после 5 мес использования сохранялась на 56%.
Исследования по разработке и испытанию иммобилизованных ферментов, аппаратурного решения, их практического применения продолжаются во многих странах, в том числе и в СССР. Во ВНИИПБПе совместно с другими организациями (ВНИИбиотехника) проводятся исследования возможности и эффективности применения иммобилизованных протеаз и глюкоамилаз для повышения стойкости пива.

