Расположение генов в хромосомах и их картирование
В начале ХХ в. Саттон и Бовери установили, что хромосомы содержат факторы, которые в 1860 г. открыл Мендель, а в 1909 г. Иогансен назвал генами. Исследования Моргана и его коллег, особенно работы Стертеванта, начатые в 1911 г., показали, что гены располагаются линейно вдоль хромосомы. Кроме того, ученые выяснили, что относительные расстояния между двумя генами на Хромосоме можно вычислить исходя из частот рекомбинации признаков, определяемых этими генами, в потомстве·двух родителей. В том же 1911 г. Вильсон (один из помощников Моргана в Колумбийском университете) впервые локализовал ген, определяющий способность различать цвета, на Y хромосоме человека. Число хромосом в клетках человека (22 пары неполовых хромосом, или аутосом, и пара половых хромосом, или гоносом, которые представлены в клетке либо двумя Х-хромосомами, либо одной Х- и одной Y-хромосомой) было определено в 1956 г. С 1968 г. начались интенсивные исследования по локализации конкретных генов на хромосомах для построения хромосомных карт.
Как полагают, в геноме человека имеется около 50 000 различных структурных генов, т. е. генов, в которых закодирована информация об аминокислотной последовательности белков; количество же ДНК в ядре клетки таково, что соответствует числу генов, которое в 50-100 раз больше. Значительное количество ДНК приходится на повторяющиеся последовательности нуклеотидов, которые могут играть в хромосоме регуляторную, структурную или функциональную роль.
Регистрируя нарушения, вызываемые мутациями генов, удалось выявить более 900 генных локусов. В общее число (50 000) структурных генов входят гены, кодирующие все ферменты внутреннего метаболизма, все структурные белки и все белки, имеющие специальные функции, такие, как гемоглобины и иммуноглобулины, а также ферменты, участвующие в образовании фибрилл коллагена (проколлагенпептидаза, глюкозилтрансфераза, лизилоксидаза) и в образовании нуклеиновых кислот (ДНКи РНК-полимеразы). Существенная часть постулированного количества (50 000), по-видимому, приходится на регуляторные гены.
Охарактеризовано более 100 локусов на Х-хромосоме и более 1100 локусов на аутосомах. Показано, что у морской свинки, мыши и человека имеются антигены гистосовместимости, определяемые Y-хромосомой (Н - Y). Соответствующие гены у человека расположены, видимо, около центромеры Y-хромосомы. Установлено, что гены, определяющие Rh-фактор и АВО-группы крови, находятся на хромосомах 1 и 9 соответственно.
Положение генных локусов на хромосомах человека определяли на основе анализа гетерозигот · и изучения семей (вариации в пределах вида), а позднее с помощью гибридных клеток, образующихся в результате слияния соматических клеток. Удобным инструментом исследования был также метод гибридизации нуклеиновых кислот: таким способом на хромосомах 13, 14, 15, 21 и 22 были локализованы гены 18S и 28S рРНК, а на хромосоме 1 - гены 5S рРНК. Этим же методом установлено, что гены α-и β-цепей гемоглобина находятся на хромосомах 2 и 4 или 5. Метод гибридизации нуклеиновых кислот позволил картировать гены гистонов, иммуноглобулинов и коллагенов.
Клонирование нуклеиновых кислот и последующая гибридизация их с фрагментами хромосом также могут оказаться весьма полезными для точной локализации генов и построения подробной карты генома.
Результаты подобных исследований окажутся весьма важными для прогресса медицины, который во многом будет зависеть от все более полного понимания функционирования генома. Действительно, ряд болезней связан с наличием дефектов определенных генов. Лечение или предупреждение генеmческих нарушений предполагает детальные знания структуры, функционирования и регуляции работы генов.
Структура генов: интроны и экзоны
Пониманию структурной организации генов в клетках эукариот в значительной степени способствовали методы клонирования и соединения ДНК (Крик). В этой связи особенно важна научная работа Шамбона и его коллег из лаборатории молекулярной генетики эукариот в Университете Луи Пастера в Страсбурге. Ученым Удалось очисmть информационную РНК овальбуминабелка яйцевода курицы, состоящего из 386 аминокислот. Из 1872 нуклеотидов этой информационной РНК 1158 нуклеотидов кодировали 386 аминокислот белка, в то время как 64 нуклеотида у 5'-конца и 650 нуклеотидов у 3'-конца молекулы РНК не транслировались. С информационной РНК была сделана ДНК-копия, соответствующая гену овальбумина, которую можно было встраивать в nлазмиду и клонировать в клетках В. coli. Французские Ученые смогли получить достаточное количество материала для изучения структуры такого гена. ДНК-копия не расщеплялась рестриктазами EcoI и HindIII, т. е. не содержала ни одной (из двух) последовательности ДНК размером в шесть нуклеотидов каждая, узнаваемых этими ферментами. В конце 1977 г. французские исследователи предположили, что в геномной ДНК, с которой транскрибируется информационная РНК овалъбумина, содержатся участки, отсутствующие в информационной РНК.
Аналогичная гипотеза о прерывистом строении гена была выдвинута для генов β-глобина кролика и мыши, генов легких цепей -х и λ и генов тяжелых цепей иммуноглобулинов мыши (Ледер, Национальный институт здоровья и развития детей, США; Тонегава, Базельский институт иммунологии. Кэри и его коллеги из лабораторий «Сёрл» в Великобритании также пришли к выводу, что ген овальбумина может быть прерывистым.
Позднее Шамбон и Курилъски (Институт Пастера, Париж) показали, что ДНК гена овалъбумина только частично реассоциирует с информационной РНК: семь участков ДНК не гибридизуются с РНК, и эти участки гена, отсутствующие в мРНК и названные нитронами, разделяют последовательность ДНК, кодирующую овальбумин, на восемь фрагментов (так называемые экзоны). Методом Максама и Гилберта было проведено сравнение последовательностей нуклеотидов этих экзонов с установленной другими исследователями последовательностью нуклеотидов информационной РНК и кодонов этой РНК, определяющих аминокислоты в цепи овальбумина. Определенная Шамбоном с соавторами последовательность нуклеотидов соответствовала последовательности нуклеотидов информационной РНК овалъбумина, установленной·О'Мэлли (Медицинский КОJmедж Бэйлора) и Браунли (Совет медицинских исследований Великобритании). Поэтому Бенуа, О'Хар и Бретнах (Университет Луи Пастера, Страсбург) пришли к выводу, что ген овальбумина имеет размер 7700 нуклеотидных пар, т. е. в четыре раза больше, чем информационная РНК (1872 пары нуклеотидов). Позднее Ганнон, Перрэн и Елч показали, что структура гена овальбумина не изменяется в процессе дифференцировки клеток яйцевода (исследование· этой дифференцировки было первоначальной темой работы Шамбона и его коллег). Это наблюдение вполне согласовывалось с результатами, полученными в друmх лабораториях при исследовании генов высокоспециализированных клеток, таких, как гены глобина и фиброина шелка. Однако, по мнению Тонегавы и Ледера с сотр., гены иммуноглобулинов перестраиваются в процессе дифференцировки лимфоцитов, причем такого рода перестройки играют ключевую роль в образовании очень большого разнообразия антител.
Для исследованных к настоящему времени генов млекопитающих, птиц и земноводных удалось установить, чтоони являются расщепленными, иными словами, состоят из экзонов и нитронов. Исключение составляют гены гистонов и интерферонов. Расщепленные гены обнаружены у насекомых и дрожжей, а также у вирусов, содержащих ДНК и размножающихся в ядрах эукариотических клеток, и ретровирусов, в цикле размножения имеющих стадию, на которой их ДНК-копии попадают в ядро.
Группа ученых, возглавляемая Голдбергом (Калифорнийский университет в Лос-Анджелесе), исследовала гены, кодирующие основные белки семян сои, на которые приходится 80% общего белка семени и которые включают два запасных белка, лектин и ингибитор трипсина. В этих генах мало или совсем нет интронов, в то время как друmе гены, которые не экспрессируются в семенах и информационные РНК которых синтезируются в незначительных количествах, имеют несколько нтронов, и, возможно, как считает Голдберг, такая структура генов более характерна для высших растений.
Интроны пе только часто встречаются в определенных генах (2-5 интронов в гене), они имеют большой размер, от 100 до нескольких тысяч пар нуклеотидов. В среднем ИНТроны, по-видимому, длиннее экзонов. Шамбон с сотр. насчитали до 16 интронов в гене овотрансферрина цъшленка, а Шимке из Станфордского университета показал, что один из генов мыши в 20 раз длиннее, чем соответствующая ему информационная РНК. В случае генов, кодирующих рибосомальную РНК у плодовой мушки Drosophila, также установлена расщепленная организация (Хогнесс, Медицинская школа Станфордского университета). Единственный ген рибосомальной РНК (ARNr) в митохондриях дрожжей, по-видимому, содержит нитрон. Интроны в транспортных РНК дрожжей очень короткие, их длина в определенных к настоящему времени случаях составляет всего 14, 18, 19 и 34 нуклеотида.
И О'Мэлли, и Шамбон обнаружили в ядре клеток яйцевода курицы молекулы РНК, такие же длинные, как ген овальбумина, а также более короткие молекулы. Было высказано предположение, что сплайсинг РНК (сращивание) происходит постепенно, шаг за шагом до тех пор, пока не образуется конечная молекула информационной РНК овальбумина. Сплайсинг происходит только в ядре клетки. Он определяется как процесс, посредством которого в результате удаления одного или более участков РНК из первоначально транскрибированной молекуль (перв·ичного транскрипта) образуется функциональная молекула РНК. Сплайсинг происходит при образовании не только информационной РНК, но и некоторых транспортных РНК дрожжей, хотя их интроны имеют очень скромный размер. Слонимски (Жиф-сюр-Иветт, Франция) предположил, что в случае транскрипта гена цитохрома Ь митохондрий дрожжей определенные интроны удаляются белками («матуразами»), аминокислотные последовательности которых закодированы частично в этих же интронах.
Исследователи Университета Пастера совместо с Курильски установили, что ген овальбумина является членом семейства из трех близких по структуре и расположенных рядом генов. Для клонирования они использовали космидные векторы, созданные Коллинзом из Общества биотехнологических исследований (ФРГ) и Хоном из Базельского университета. Такие космиды сочетают свойства плазмид и фага λ. Они позволили клонировать из генома клеток яйцевода курицы фрагменты ДНК длиной около 40 000 нуклеотидных пар, содержащие не только ген овальбумина, но и два других гена, Х и Y. Шамбон с сотр. исходя из числа различий в последовательностях трех генов и обычной частоты возникновения мутаций вычислили, что ген овальбумина образовался в результате дупликации 50 млн. лет назад. Другим примером удивительной консерва· тивности интрон-экзонной структуры в процессе эволюции служит семейство генов глобинов. В последовательности генов α- и β-глобинов, которые, вероятно, образовались в езультате дупликации около 500 млн. лет назад, имеется о два интрона, которые расположены в идентичных местах в обоих генах.
Последовательности экзонов, по-видимому, эволюционируют медленно, путем точковых мутаций, изменяющих на каждом этапе один-единственный нуклеотид, в то время как интроны могут изменяться гораздо быстрее посредством делеций и вставок (инсерций) различной длины. Таким образом, расщепленные гены состоят из стабильных элементов, кодирующих белки, которые находятся в более нестабильном окружении. В случае гена овальбумина длиной 40 000 нуклеотидных пар не более 9% нуклеотидов кодируют структуру этого белка, а 91% приходится на окружение. Этим в значительной степени объясняется противоречие между размером генома эукариот и числом функциональных генов.
Сплайсинг первичного транскрипта, вероятно, является для эукариот универсальным процессом; не исключено, что он происходил уже в первой эукариотической клетке. Тот факт, что некоторые эукариотические гены и гены прокариот не содержат нитронов, не означает, что последние появились в процессе эволюции геномов, состоящих из неразделенных генов. Эти непрерывные гены могли быть расщепленными, и их интроны позже могли быть утеряны. Хотя точная делеция нитрона рассматривается как очень редкое событие, Гилберт и его коллеги показали, что такая делеция произошла в одном из генов инсулина мыши.
Согласно Шамбону, существующие в настоящее время прокариоты не являются предками эукариотических клеток. Они могли бы быть потомками клеток, которые в процессе эволюции постепенно теряли избыточную ДНК, не кодирующую белки, и, таким образом, увеличивали скорость своего роста благодаря уменьшению количества ДНК, реплицируемой в каждой клеточной генерации. Когда все нитроны были удалены, сплайсинг стал ненужным. Однако в эукариотических клетках сплайсинг совершенствовался, что позволило им использовать новые направления эволюции. Интроны сохранились в клетках эукариот потому, что не могли бьпь удалены; таким образом, вместе с другими фрагментами ДНК, точная функция которых неизвестна, их, по словам Шамбона, можно считать «эволюционными реликвиями». Вместе с тем нитроны дают некоторые преимущества: как предположил Гилберт, их присутствие повышает частоту рекомбинации между экзонами одного и того же гена. Это означает, что присутствующие в различных аллелях гена особо благоприятные мутантные экзоны могут чаще рекомбинировать с образованием нового, еще более благоприятного аллеля. Продолжающиеся исследования могут привести к открытию у интронов других функций, связанных с организацией и функционированием геномов эукариот.
Дальнейшее изучение различных этапов процессинга молекул информационной РНК в ядре клетки перед выходом в цитоплазму позволит лучше понять биохимические механизмы этих этапов. Но важнее всего в первую очередь исследовать транскрипцию ДНК в РНК и регуляцию этого процесса. Любое новое открытие в этой области значительно расширит наши знания о структуре, регуляции и эволюции генов эукариот.
По-видимому, большинство генов в клетках эукариот, транскрибируемых РНК-полимеразой 11, имеют сходную последовательность ДНК длиной около 30 нуклеотидов, расположенную перед участком, где начинается транскрипция. Эта последовательность обогащена нуклеотидами, содержащими аденин (А) и тимин (Т), и обычно называется «ТАТА-блок», или «Голдберга-Хоmесса блок» (так как была обнаружена Хогнессом и Голдбергом в Станфордском университете в 1979 г.).
Как показали исследования Шамбона в Университете Луи Пастера (Страсбург) для гена кональбумина цыпленка, Цая (Хьюстон) для гена овальбумина цыпленка, Флавелла из Национального института медицинских исследований (Лондон) для гена β-глобина, эта последовательность нуклеотидов важна для транскрипции генов in vitro: удаление последовательности уменьшает или полностью предотвращает транскрипцию; такой же эффект оказывает мутация внутри ее. Изучение транскршщии in vivo, проведенное несколькими группами исследователей, показало, что другие последовате-лъности нуклеотидов, расположенные перед ТАТА-блоком, могут модулировать транскрипцию, осуществляему-? РНК-полимеразой II; делеции этих последовательностеи значительно снижали транскрипцию in vivo, однако этого не происходило для систем in vitro. Шамбон установил, что такая последовательность в случае вируса SV40 расположена за НЮ нуклеотидов перед ТАТА-блоком (43]. Хенчель (Цюрих) установил, что делеция фрагмента ДНК перед участком инициации транскрИIЩИИ гена гистона Н2А, захватывающая последовательность от 184-гo до 520-гo нуклеотида перед стартовой точкой, уменьшала транскрипцию этого гена в 15-20 раз.
Перетасовка генов и генетическое разнообразие: гены антител
Принято считать, что геном эмбриональных клеток в целом не меняется в процессе дифференцировIСИ соматических клеток при образовании различных тканей организма и что разнообразные формы и функции дифференцированных клеток обусловлены различиями в экспрессии одних и тех же генов. Однако, исследуя систему иммунитета млекопитающих, генетики и молекулярные биологи подвергли эти принципы сомнению. Эксперименты показали, что необычное разнообразие молекул антител, образуемых зрелыми лимфоцитами, вызвано перетасовкой нескольких сотен генов в клетках-предшественниках лимфоцитов. Такая перетасовка генов создает гораздо большее их разнообразие, чем это возможно в неизменяющемся геноме. Подобное явление может происходить и в клетках других типов. Эти исследования стали возможными благодаря развитию методов разделения, гибридизации и клонирования нуклеиновых кислот, а также в результате изучения новейших данных относительно структуры генов эукариот. Они также показали, что рекомбинация ДНК, которая, являясь инструментом в руках специалистов по генной инженерии, позволяет изменять геном клетки и таким образом направлять ее метаболизм на производство нужного вещества, может происходить и в природе, обусловливая увеличение генетического и метаболического разнообразия, т. е. клеточную специализацию.
Молекула антитела образуется в результате сборки из нескольких белковых цепей. Так как синтез любого белка определяется соответствующим геном, можно предполагать, что существуют миллионы генов, соответствующих очень большому числу молекул антител, вырабатываемых организмом млекопитающих. Однако геном млекопитающих содержит около 1 млн. генов, и только небольшая их часть вызывает синтез антител. Казалось бы, парадоксально, что за необычайное разнообразие синтезируемых в организме антител должно отвечать ограниченное число генов Но это объясняется следующим: стволовые, или эмбриональные, клетки не содержат полного набора генов всех антител, а обладают набором генетических элементов, которые перетасовываются в процессе дифференцировки и созревания клеток иммунной системы (Влимфоцитов); это приводит к образованию миллионов клеточных линий, вырабатывающих различные антитела. Возникающее в результате разнообразие антител усиливается индивидуальными мутациями в геноме. В дифференцированных и зрелых клетках каждой линии имеется собранный из элементов ген с определенной структурой и синтезируются молекулы антител с уникальной последовательностью.
Молекула антитела собирается из двух пар белковых цепей двух видов, называемых легк.ими и тяжелыми цепями. Каждая цепь имеет вариабельную область (которая соответствует примерно половине длины легкой цепи и примерно четвертой части тяжелой цепи) и постоянную область. Именно в вариабельных областях двух видов цепей находится участок связывания антитела с антигеном. Этот участок имеет особую структуру и связывается с антигеном, против которого нацелено антитело. Замены в аминокислотной последовательности вариабельных областей изменяют структуру участка связывания и влияют на сродство антител к антигену.
У большинства позвоночных животных имеются два типа легких цепей, а именно х и λ; каждая молекула антитела содержит легкие цепи только одного типа. Постоянные области х или λ-цепей идентичны у всех одноименных цепей всех видов животных. Тяжелые цепи представлены пятью типами: µ, δ, ε и α. Эти типы определяют пять классов иммуноглобулинов, обнаруженных у млекопитающих: IgM, IgD, IgG, IgE и IgA. Например, в антителах класса IgM все тяжелые цепи имеют одну и ту же постоянную область µ, а легкие цепи содержат Х или λ постоянную область; с другой стороны, их вариабельные области у разных молекул антител различны и отражают их антигенные свойства. Константная область тяжелых цепей определяет способ действия антитела в организме: если она δ-типа, т. е. антитело, принадлежит к классу IgD, то оно остается связанным с поверхностью синтезирующей его клетки; если тяжелая цепь ϒ-типа, то соответствующее антитело принадлежит к классу IgG и циркулирует в крови; если же тяжелая цепь - типа, то соответствующее антитело IgE может связываться с поверхностью специализированной клетки, способной выделять гистамин, что приводит к появлению симптомов астмы или лихорадки, когда антитело взаимодействует с антигеном (например, с пыльцой).
В середине 60-х гг. Дрейер и Беннетт из Калифорнийского технологического института выдвинули предположение, которое произвело переворот в науке: взамен представления о том, что генетическая информация для синтеза легкой цепи антитела существует в форме непрерывной нуклеотидной последовательности, они предложили модель, согласно которой эта информация находится в двух разобщенных участках ДНК, причем один из них кодирует вариабельную, а другой-постоянную область. Они также предположили, что в стволовых клетках имеются сотни и даже тысячи отдельных генов, кодирующих вариабельные области, но только по одному гену для постоянной области.
В 1971 г. Ледер и Свои из Национального института здоровья и развития детей (США) попытались проверить гипотезу Дрейера и Беннетта. Они выделили информационную РНК гена антитела, затем с помощью обратной транскриптазы получили ДНК-копию этой РНК и использовали ее в качестве пробы для выявления генов антител в эмбриональных клетках и оценки их числа. ДНК-проба была синтезирована на РНК, определяющей постоянную область легкой цепи антитела мыши. Два американских исследователя в сотрудничестве с Хоньё из Киотского университета показали, что в каждой эмбриональной клетке число генов, кодирующих эту постоянную область легкой цепи, не превышает двух. Аналогичные результаты были получены другими учеными. Тем самым гипотеза Дрейера и Беннетта до определенной степени была подтверждена.
Если эмбриональные клетки содержат очень небольшое число генов, кодирующих постоянную область, и много удаленных друг от друга генов, кодирующих вариабельную область, то простейший способ объединить эту информацию в непрерывную последовательность ДНК, вероятно, заключается в соединении двух отдельных последовательностей ДНК в одну при дифференцировке эмбриональных клеток в лимфоциты. Такая перестройка называется соматической рекомбинацией. Тонегава и Хоцуми из Института иммунологии в Базеле сравнили структуру ДНК из эмбриональных клеток мыши со структурой ДНК клеток плазмоцитомы (рака В-лимфоцитов, которые ·в случае такой патологии синтезируют антитела только одного типа с уникальной специфичностью). Если бы ДНК генов антитела претерпевала соматическую рекомбинацию в процессе дифференцировки, ее структура должна была бы отличаться от структуры ДНК в эмбриональных клетках. Тонегава и Хоцуми действительно установили, что в этих двух типах клеток гены легкой цепи расположены по-разному и что в процессе клеточной дифференцировки гены перетасовываются. Они также обнаружили, что у мышей ген, кодирующий постоянную область, и гены, кодирующие вариабельные области легких λ-цепей, в ДНК клеток, не образующих антитела {эмбриональных клеток), удалены друг от друга на значительные расстояния, тогда как в клетках плазмоцитомы они сильно сближены. Однако перетасовка не приводит к соединению двух типов генов с образованием непрерывной последовательности ДНК: ген вариабельной области (V) все же находится на расстоянии около 1500 нуклеотидов от гена постоянной области (С); между ними, примыкая к гену V, находится участок J, который является соединяющей последовательностью.
Ледер и его коллеги сконцентрировали свои усилия на исследовании генов легких х-цепей мыши, поскольку у этого вида животных более 90% антител содержат легкие цепи х-типа. Они клонировали гены постоянной и вариабельной областей из эмбриональных и зрелых клеток и определяли нуклеотидные последовательности методом Максама и Гилберта. Результаты этого исследования, а также работ Перри из Института исследования рака в Фокс-Чейзе (шт. Пенсильвания) привели к выводу о том, что в ДНК эмбриональных клеток мыши имеется несколько сотен генов, кодирующих вариабельную область легких X- и λ-цепей. Каждый из V-генов разделен на два экзона, разобщенные коротким нитроном; первый экзон кодирует гидрофобную последовательность длиной 17-20 аминокислот, которая может играть важную роль в транспорте молекулы антитела через клеточную мембрану (при прохождении через мембрану этот участок полипептидной цепи отщепляется от молекулы); второй экзон V-гена кодирует основную часть вариабельной области легкой X-цепи длиной 95-108 аминокислот. Остальная часть вариабельной области кодируется нуклеотидной последовательностью, расположенной за V-геном вблизи гена С постоянной области в месте соединения С- и V-генов, которое осуществляется при образовании активного гена иммуноглобулина. Эта короткая последовательностьген j-повторяется пять раз (с интервалом около 300 нуклеотидов) с незначительными, но важными вариациями.
Если в эмбриональной клетке присутствует около 150 V-генов, то соединение одного из них с одним из пяти генов J может привести к образованию 150 Х 5 = 750 различных генов вариабельной области легкой х-цепи. Как показали результаты, полученные несколькими группами исследователей, перетасовка генов происходит следующим образом: один из генов V соединяется с одним из генов J, а остальные гены V и J, так же как и длинные некодирующие последовательности между ними, удаляются. В итоге активный ген анmтела складывается из трех сегментов, а именно короткого так называемого лидерного гена L, кодирующего гидрофобный полипептид, генов V и J и гена С. После транскрипции такого активного гена антитела синтезированный транскрипт подвергается сплайсингу с образованием информационной РНК, на которой будет транслироваться легкая х-цепь (рис. 4). Еще больwего разнообразия можно достигнуть с помощью другого источника вариабельности: гены V и J могут быть соединены в различных точках так, что кодон 96-й аминокислоты легкой цепи (в области которого соединяются два гена) и соседние с ним кодоны могут изменяться в зависимости от способа соединения г нов V и J. Область вокруг кодона для 96-й аминокислоты является одной из трех гипервариабелъных областей вариабельного района легкой цепи, образующих участок связывания антитела с антигеном. Если предположить, что альтернативные участки соединения способны увеличивать разнообразие антител на порядок, то общее число возможных комбинаций между генами V и J составит 750 х 10=7500.
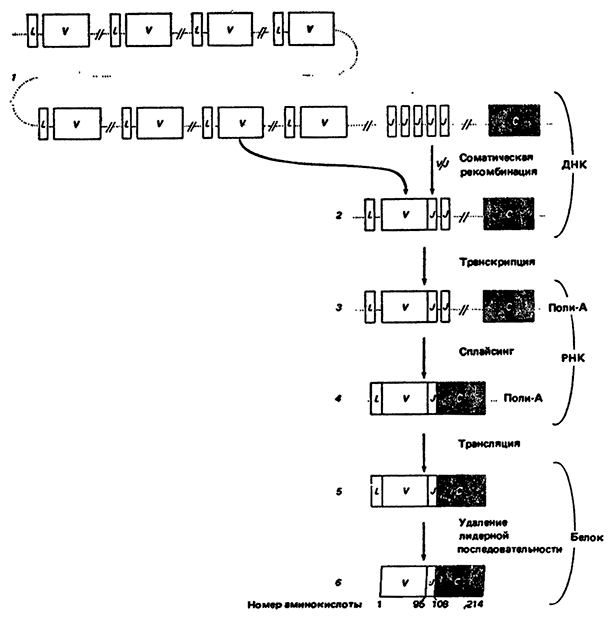
Рис. 4. Схематическое изображение этапов, ведущих к образованию
и экспрессии активного гена легкой цепи (x) молекулы иммуноглобулина человека.
V - гены вариабельных областей х-цепи;
С - ген контактной области х-цепи
J - соединяющая последовательность между генами V и С.
L лидирующая nоследовательность.
Такое разнообразие имеет и оборотную сторону: в случае если гены V и J соединяются неправильно, образуются неактивные гены. Этим отчасти объясняется явление, называемое аллельным исключением. Каждая соматическая клетка имеет два набора хромосом, унаследованных от клеток родителей, и копии определенного гена на двух хромосомах из разных наборов называются аллелями. В клетке, синтезирующей антитела, соматическая рекомбинация с образованием активного гена антитела происходит обычно только на одной хромосоме; этот ген в конечном итоге и определяет синтез белков. Аллельный ген на гомологичной хромосоме не перестраивается и не экспрессируется. Однако иногда клетка, синтезирующая антитела, имеет два набора активных перестроенных генов антител.
Такие же принципы определяют образование вариабельных областей в тяжелых цепях, причем разнообразие в этом случае больше, чем у легких цепей. Рэббитс с коллегами из лаборатории молекулярной биологии Совета медицинских исследований (Кембридж) подсчитал, что в эмбриональных клетках человека имеется 80 V-генов тяжелых цепей. Равеч обнаружил шесть генов J в пределах 8000 нуклеотидов от гена С, кодирующего тяжелую µ-цепь иммуноглобулина человека. Короткая последовательность из 13 нуклеотидов в месте соединения V- и J-генов вносит дополнительный вклад в увеличение разнообразия. Если принять, что существует 50 различных генов D (от англ. divesity-paзнooбpaзиe), то в результате соматической рекомбинации генов вариабельной области тяжелой цепи может образовываться 80 х 6 х 50 = 24 000 комбинаций генов. Другим фактором, который, по оценкам, увеличивает вариабельность в 100 раз, являются участки альтернативного соединения генов V и D. Суммарное число различных тяжелых цепей, которые могли бы синтезироваться, составляет 2,4 млн. Комбинации двух типов цепей, взятые вместе, должны дать 2,4 х 106 х 750 000 = 18 млрд. возможных антител, которые могли бы быть образованы при участии 300 отдельных сегментов ДНК в эмбриональных клетках. Такое огромное разнообразие антител может быть увеличено благодаря другому механизму-соматическим мутациям. И действительно, гены иммуноглобулинов мутируют с удивительной скоростью, составляющей одну мутацию на 10 000 клеток за поколение.
Организацию генов тяжелых цепей в ДНК клеток эмбрионов мыши, занимающих область более 100 ООО нуклеотидов, изучали несколько групп исследователей: группа Худа в Калифорнийском технологическом институте и группа Тонегавы в Базельском институте иммунологии сосредоточили свои усилия на изучении структуры генов µ-, ϒ и α- цепей; группа Блэттнера из Висконсинского университета (Мэдисон) установила местоположение гена δ-цепи; исследователи группы Хоньё (медицинский факультет университета в Осаке) клонировали и картировали гены ϒ-цепей (существуют четыре класса lgG) и определили их расположение друг относительно друга, а затем относительно генов ε и α-цепей. Эти гены располагаются в следующем порядке (в направлении от 5'-конца к 3'-концу полинуклеотидной цепи): µ, δ, ϒ3, ϒ1, ϒ2Ь, ϒ2а, ε и а.
Согласно Ледеру, образование антител проходит через следующие стадии: в клетках-предшественниках В-лимфоцитов (пре-В-лимфоцитах) сначала синтезируется участок гена, кодирующий постоянную область тяжелой µ-цепи, который затем соединяется с участком, кодирующим специфическую вариабельную область (он образуется в результате соматической рекомбинации между генами V, D и J). После синтеза легких цепей и тяжелых δ-цепей в результате их соединения образуются целые антитела классов lgM и lgD. Следующая стадия дифференцировки лимфоцитов характеризуется одновременным появлением антител lgM и lgD на поверхности клетки. Оба класса антител имеют одинаковую вариабельную область и направлены против одного и того же антигена. На последующие стадии созревания лимфоцитов, повидимому, влияет антиген. Он связывается с рецептором, т. е. с наиболее подходящим участком среди миллионов или миллиардов иммуноглобулинов на поверхности лимфоцитов. Такое взаимодействие дает толчок пролиферации клетки, несущей на поверхности избранный иммуноглобулин. В результате образуется клон В-лимфоцитов, синтезирующих специализированные антитела (клональная селекция). В процессе созревания лимфоцитов иммуноглобулины классов D и М исчезают с поверхности клетки и клетка начинает секретировать иммуноглобулины lgM, IgG, lgE или lgA. Эти классы иммуноглобулинов имеют различные постоянные области тяжелых цепей, но антитела каждого класса, синтезируемые в данной клетке, имеют одинаковые вариабельные области, т. е. те, которые синтезировались в прелимфоцитах и участвуют в образовании участка связывания, отбираемого антигеном.

