Выбор гена определяется необходимостью передачи растению определенного хозяйственно-полезного признака. В настоящее время для трансформации растений используются в основном гены, определяющие моногенные признаки, такие, как устойчивость к гербицидам и пестицидам, устойчивость к некоторым другим видам стрессов. Большинство генов, определяющих эти признаки, выделены из бактериальных геномов. В последнее время в качестве доноров генов, определяющих признаки устойчивости, выбирают геномы диких видов. Такие гены не могут быть введены в геном растений-реципиентов путем половой гибридизации из-за биологической несовместимости растений, относящихся к разным видам, родам и даже семействам. Еще более сложной является проблема получения признаков, относящихся к группе количественных признаков: продуктивность, качество зерна, устойчивость к засухе, низким и высоким температурам.
2.2. ПОДБОР ГЕНОТИПА РАСТЕНИЯ-РЕЦИПИЕНТА
В идеальном варианте в качестве реципиента подбираются растения такого сорта или линии, которые отвечали бы требованиям производства по урожайности, качеству плодов, устойчивости к биотическим и абиотическим стрессам но имели бы лишь одно отрицательное свойство, например неустойчивость к насекомым. Тогда введение в геном растений этого сорта, например, бактериального гена bt2 (cry2А), экспрессирующего белок прототоксин, вызывающий гибель насекомых, приводил бы к значительному улучшению выбранного сорта. Выбор генотипа растения-реципиента определяется способностью его клеток к регенерации в целое фертильное растение, так как показано, что это свойство значительно зависит от генотипа.
2.3. ВВЕДЕНИЕ ГЕНА И ЕГО ЭКСПРЕССИЯ
В ГЕНОМЕ РАСТЕНИЯ-РЕЦИПИЕНТА
Проблема переноса чужеродных генов в геном растений существенно облегчается в связи с обнаружением Ti-плазмид почвенных агробактерий Agrobacterium tumefaciens, позволяющих вводить чужеродные гены в геном двудольных и некоторых однодольных растений. В последнее время довольно широко, особенно для трансформации клеток однодольных растений, используется метод биобаллистической трансформации. Важно обеспечить экспрессию чужеродного гена в геноме растения-реципиента и стабильное наследование признака в поколениях. Экспрессия введенного гена зависит от ряда причин, в том числе от места интеграции гена в геном растения, последующего метилирования промоторной области и введенного гена и т. п.
2.4. ФАКТОРЫ, ВЛИЯЮЩИЕ
НА РЕГЕНЕРАЦИОННУЮ СПОСОБНОСТЬ
ТРАНСФОРМИРОВАННЫХ КЛЕТОК
Эффективность получения трансгенных растений напрямую зависит от регенерационной способности клеток растения-реципиента. В свою очередь регенерация взрослых растений из трансформированных клеток зависит от тотипотентности клеток определенных тканей и поэтому регенерационная способность отдельных тканей значительно различается. Кроме того, виды и даже сорта растений могут отличаться по способности к регенерации. Тотипотентность хорошо выражена у клеток двудольных растений, таких как табак, картофель, свекла, соя, рапс, люцерна, томаты, морковь, капуста, некоторых плодовых, в то время как получить регенерацию трансгенных растений из клеток большинства бобовых, перца, баклажана крайне тяжело. У однодольных, особенно злаков, свойство тотипотентности клеток выражено гораздо слабее, в связи с чем процесс регенерации клеток в целое растение затруднен. В настоящее время разработаны методики регенерации трансформированных клеток некоторых основных зерновых культур, таких как кукуруза, рис, пшеница, ячмень. Однако необходимо отметить, что с каждым годом методы регенерации разрабатываются для все большего числа растений.
2.5. ВВЕДЕНИЕ ЧУЖЕРОДНЫХ ГЕНОВ
В РАСТИТЕЛЬНУЮ КЛЕТКУ ПРИ ПОМОЩИ
АГРОБАКТЕРИАЛЬНЫХ ВЕКТОРОВ
Одной из основных проблем при получении трансгенных растений был способ введения чужеродных генов в хромосомы растений, т. е. трансформация растительных клеток. Значительный прорыв был сделан при открытии возможности использования природной системы трансформации растений Ti-плазмидами почвенных агробактерий.
Ранее было известно, что некоторые виды почвенных бактерий (Agrobacteria) могут заражать двудольные растения и вызывать при этом образование специфических опухолей – корончатых галлов. Опухоли состоят издедифференцированных клеток, интенсивно делящихся и растущих в месте заражения. При культивировании in vitro клетки опухоли могут расти в отсутствие гормонов, необходимых для роста нормальных растительных клеток. Было показано, что опухолевый рост связан с более высокими уровнями ауксинов и цитокининов, детектируемых в клетках корончатых галлов. Кроме того, было показано, что если после заражения все агробактерии инактивировать добавлением антибиотика, то клетки корончатых галлов сохраняют способность к неограниченному и неконтролируемому росту в месте заражения. Если фрагмент опухолевой ткани, не содержащей агробактерий, привить на незараженное растение, то в месте прививки также развивается опухоль, т. е. присутствие агробактерии необходимо только для индуцирования образования опухоли (рис. 2.1).
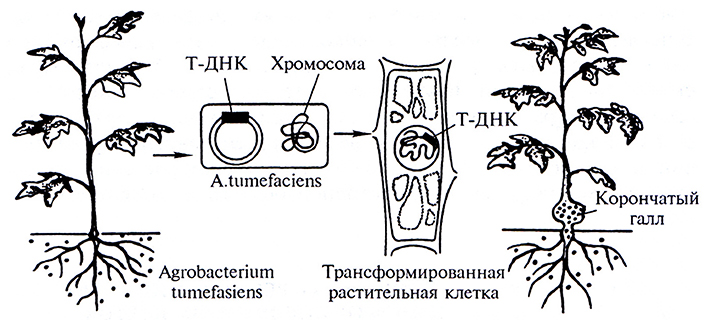
Рис. 2.1. Интеграция Т-ДНК в хромосому растений и образование опухоли
(корончатого галла) (по Э.С. Пирузян)
Помимо повышенного синтеза фитогормонов, опухолевые клетки корончатых галлов начинают синтезировать необычные для растения соединения – опины (производные аминокислоты аргинина), которые используются агробактериями в качестве источника азота и углерода. Агробактерии сами синтезировать опины не могут, так как промежуточные продукты синтеза ингибируют рост бактериальной клетки и используют растительные клетки как «фабрики» по производству опинов. При заражении растения агробактерией происходит перестройка метаболизма трансформированных растительных клеток, и они начинают синтезировать соединения, необходимые только для бактерий. Опины не могут утилизироваться растительной клеткой и выделяются в межклетники, где и поглощаются агробактерией. Также ряд бактерий могут содержать агропиновые Ti-плазмиды, кодирующие агропин, также относящийся к опинам.
Молекулярно-генетические исследования показали, что все Ti-плазмиды имеют сходное строение и содержат последовательности, которые можно поделить на две группы: 1) необходимые для метаболизма самой агробактерии (гены катаболизма опинов, точка начала репликации плазмиды и т. д.); 2) необходимые для трансформации растительной клетки (см. ниже).
Гены первой группы имеют прокариотический тип промотора, т. е. могут функционировать только в бактериальной клетке, а второй группы – могут экспрессироваться в эукариотической растительной клетке. Ко второй группе относятся гены, ответственные за индукцию опухоли и синтез опиновых аминокислот.
Трансформация растения в результате агробактериального заражения происходит в несколько этапов. Было показано, что сама агробактерия не входит в растительную клетку, она располагается в межклетниках. Не входит в клетку растений и Ti-плазмида, но часть Ti-плазмиды переносится в ядро растительной клетки и может встраиваться в растительный геном. Этот фрагмент Ti-плазмиды был назван Т-ДНК (от англ. Transforming DNA – трансформирующая ДНК). Роль Т-ДНК при трансформации растений была показана в 1977 г. М. Чилтон с сотр.
Было установлено, что длина Т-ДНК составляет ~23 т. н. п. На концах Т-ДНК находятся прямые высоко консервативные повторы (25 н. п.), составляющие так называемые левый и правый пограничные районы, которые необходимы для вырезания ее из состава плазмиды и интеграции в геном растений (рис. 2.2). Непосредственно границы области Т-ДНК, а также последовательности, примыкающие к этим районам, оказывают влияние на результативность трансформации. При этом показано, что именно последовательность правой границы необходима для интеграции Т-ДНК в геном растения. Делеция левой границы, как было показано опытным путем, не оказывала существенного эффекта на перенос Т-ДНК. Также рядом с правой границей внутри области Т-ДНК располагается специфическая область, влияющая на вирулентность Ti-плазмиды. Делеция этой области приводит к тому, что такие Ti-плазмиды не способны индуцировать опухолеобразование. Кроме того, около правой границы Т-ДНК с внешней стороны находится небольшая (24 п. н.) последовательность, называемая overdrive, которая узнается одним из vir-белков, что также влияет на эффективность трансформации.
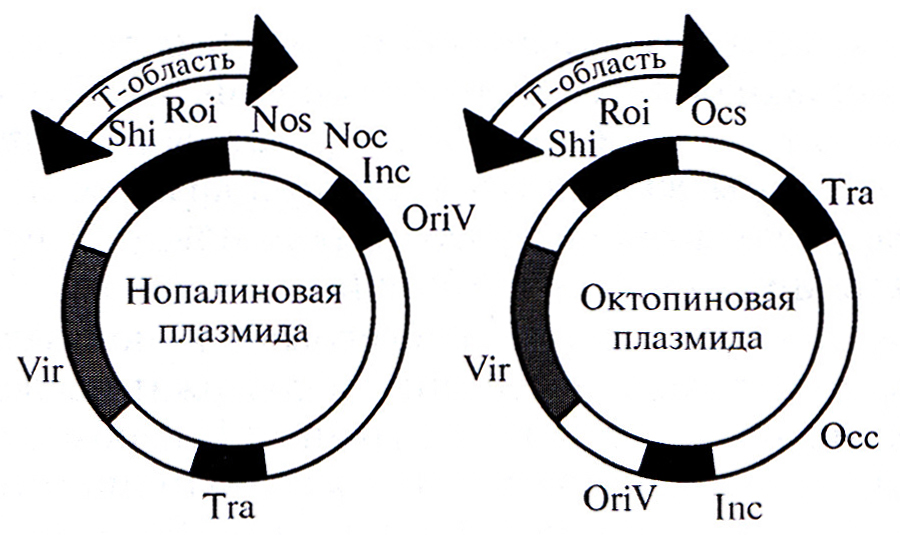
Рис. 2.2. Структура Ti-плазмиды
Область Т-ДНК несет семь генов: ген, кодирующий синтез одного из опинов [гены nos (нопалинсинтетаза) или ocs (октопинсинтетаза)], а также шесть генов, кодирующих признаки опухолеобразования, причем два из них (iaaM и iaaH) кодируют ферменты, вовлеченные в синтез ауксина (индолилуксусной кислоты), а один (itp) – синтез цитокинина. В результате экспрессии этих генов в трансформированных клетках меняется гормональный статус, что и приводит к их дедифференцировке и опухолеобразованию.
Наличие Т-ДНК необходимо, но недостаточно для трансформации. За собственно вырезание Т-ДНК из состава Ti-плазмиды и перенос ее в геном растения отвечает другая область Ti-плазмиды, лежащая вне Т-ДНК – vir-область (область вирулентности). vir-Область состоит из семи локусов – virA, virB, virC, virD, virE, virG, virF, составляющих район ~ 35 т.н.п. Большинство этих локусов включают несколько генов и считается, что в vir-области находится до 40 генов.
По своим функциям vir-гены можно поделить на два класса:
1) гены virA и virG – регуляторные, которые экспрессируются в агробактериальных клетках постоянно (конститутивно), хотя и в небольших количествах;
2) гены virB, virC, virD, virE, virF кодируют белки, непосредственно вовлеченные в перенос Т-ДНК в растения, и экспрессируются только после непосредственной активации их промоторов.
Для трансформации растений с помощью агробактерий необходимо выполнение трех условий:
- активация четырех генов (chvA, chvB, chvE, pscA) на хромосоме агробактерий, осуществляющих синтез специальных полисахаридовна поверхности бактериальной клетки, необходимых для присоединения бактерии к растительной клетке;
- активация vir-области Ti-плазмиды, необходимой для инициации переноса Т-ДНК в ядро растительной клетки;
- наличие Т-ДНК.
Процесс трансформации растения начинается с экспрессии хромосомных генов (chvA, chvB, chvE, pscA) агробактерии, вовлеченных в стадию ранней вирулентности и генов virA и virG Ti-плазмиды. Агробактерия прикрепляется к растительной клетке в области поранения последней. При поранении растительная клетка выделяет во внешнюю среду небольшие молекулы фенольных производных и Сахаров, в том числе специфическое фенольное соединение – ацетосирингон. Как было сказано выше ген virA экспрессируется в клетке агробактерии постоянно, и белок virA является мембранным рецептором ацетосирингона, образуя с белком ChvE комплекс, пронизывающий мембрану. Ацетосирингон, выделяемый растениями, узнается белком virA, связывается с ним, что приводит к активации белка virA путем самофосфорилирования (транслокации фосфорного остатка с одного участка virA белка на другой). Это в свою очередь активизирует другой постоянно экспрессирующийся в агробактериальной клетке белок – virG. Белок virG – белок регуляторный и является активатором транскрипции всех остальных vir генов – vir С, D, В, Е, F. Активированный белок virG, связываясь с промоторными областями этих генов, приводит к их экспрессии.
Белковые продукты генов vir С, D, В, Е, Fсвязываются с Т-ДНК, приводят к ее вырезанию из состава Ti-плазмиды и встраиванию в растительный геном. Этот процесс начинается белками virD1,2, которые, являясь эндонуклеазами, узнают последовательности правой и левой границ и virD2 делает одноцепочечный специфичный разрез в одной из цепей между 3 и 4 нуклеотидом правого 25 н.п., а затем и левого повтора пограничной области Т-ДНК, что стимулирует репликацию новой цепи Т-ДНК. Белок virC, связываясь с областью overdrive вблизи правой границы Т-ДНК, совместно с virD1,2 инициируют вырезание одноцепочечного фрагмента Т-ДНК. В результате старая цепь Т-ДНК вытесняется. Полученная одноцепочечная нить Т-ДНК, связанная на 5'-конце с virD2, защищается белком vir E2, который может соединяться с одноцепочечной ДНК. Молекулы virE2 закрывают одноцепочечную Т-ДНК, тем самым защищая ее. virF белок также способствуют переносу и интеграции Т-ДНК в ядро растительной клетки. Как минимум три (virB2, virB5 и virB6) из 11 белков virB образуют специфический трансклеточный мостик – Т-пили, по которому Т-ДНК переносится из агробактерии в растительную клетку. Белки virB7–10 вовлечены в образование контакта между Т-пилей и мембраной растительной клетки. После проникновения через образованный мостик в цитоплазму растительной клетки Т-комплекса: Т-ДНК/белок virD2/белки virE2, узнаются специфическими сигнальными рецепторами, что способствует проникновению комплекса в ядро растительной клетки. Энергия, необходимая для образования и переноса Т-комплекса в растительную клетку поставляется за счет АТФазного действия белков virB4 и virB11 совместно с virD4.
В ядре одноцепочечная нить Т-ДНК, по всей видимости, восстанавливает свою двуцепочечную структуру, может встраиваться в геном растения по механизму гомологичной рекомбинации. Для встраивания необходимы микрогомологии длиной 2–5 нуклеотидов между пограничными районами Т-ДНК и участками генома растений. Таким образом, теоретически встраивание Т-ДНК может происходить в любые участки генома, хотя рядом авторов показан неслучайный характер встраивания и в отдельные районы генома растений интеграция Т-ДНК происходит гораздо чаще, чем в другие. Установлено, что часто область хромосомы растений, граничащая с местом встраивания Т-ДНК, богата А/Т-последовательностями. А/Т-богатые последовательности часто встречаются в районах генных промоторов, что может объяснять частое встраивание Т-ДНК в участки, граничащие с генами.
Приведенная схема генетической трансформации растительной клетки лишь в общем виде описывает механизмы этого сложного и не до конца исследованного процесса.
Векторы для трансформации растений
на основе Ti-плазмид
Уникальные биологические свойства Ti-плазмиды делают ее идеальным природным вектором для переноса генов. Ti-Плазмида имеет широкий круг хозяев, встраивает Т-ДНК в хромосомы растений, где она может реплицироваться, и ее гены транслируются с образованием белка. Существенно также, что границы Т-ДНК обозначены прямыми повторяющимися последовательностями длиной 25 нуклеотидных пар, и любой фрагмент чужеродной ДНК, вставленный между этими повторами, будет перенесен в растительную клетку. Однако манипуляции с Ti-плазмидой затруднены из-за больших размеров, вставить ген в плазмиду традиционными методами не представляется возможным. Поэтому Ti-плазмида была модифицирована генно-инженерными путями, и на ее основе были получены векторы для трансформации растений.
Кроме того, надо отметить, что после трансформации растений природной Ti-плазмидой трансформированные клетки не будут способны к регенерации, поскольку в них подавлена дифференцировка за счет активности шести генов Т-ДНК области, кодирующих признаки опухолеобразования. Если же последовательности генов, блокирующих дифференцировку, вырезать из Т-ДНК, трансформированные клетки обретут способность к регенерации. Поэтому при использовании Ti-плазмид для получения векторных конструкций последовательности генов, ответственных за опухолеобразование и синтез опинов, вырезают, оставляя только фрагменты Т-ДНК, необходимые для ее переноса в растительный геном (прежде всего последовательности левого и правого пограничного повторов). В область Т-ДНК вдальнейшем и встраиваются чужеродные гены, которые желательно ввести в геном растения.
Основные белки, отвечающие за перенос Т-ДНК, кодируются генами vir-области. В векторах для трансформации vir-область может находиться как в составе одной плазмиды с областью Т-ДНК, так и в разных.
Таким образом, вектора для трансформации растений на основе Ti-плазмид агробактерий должны содержать следующие структурные элементы:
- последовательности правой и левой границы Т-ДНК, а также последовательности, необходимые для переноса и встраивания области Т-ДНК в геном растительной клетки;
- последовательность гена селективного маркера, что позволит проводить селективный отбор трансгенных растений. В качестве селективного маркера могут использоваться гены устойчивости к антибиотикам (nptll – устойчивость к канамицину, hptll – устойчивость к антибиотику гигромицину), ген bar устойчивость к гербициду фосфинотрицину (BASTА) и ген ALS (устойчивость к гербициду хлорсульфорону), ген бета-глюкуронидазы (фермент расщепляющий субстрат X-Gluc) и ряд других;
- последовательности, облегчающие встраивание целевого гена (полилинкерные последовательности, промоторные и терминаторные последовательности);
- сайты инициации для репликации в бактериальных клетках.
Коинтегративный вектор. Один из способов, облегчающий введение чужеродной ДНК в геном растения, заключается в использовании коинтегративных векторов. Смысл подхода состоит в следующем (рис. 2.3). Весь процесс введения чужеродного гена в геном растений делится на два этапа: клонирование гена, который следует встроить в растительный геном, и собственно трансформация растительной клетки. Эти два этапа осуществляются с помощью различных векторов.
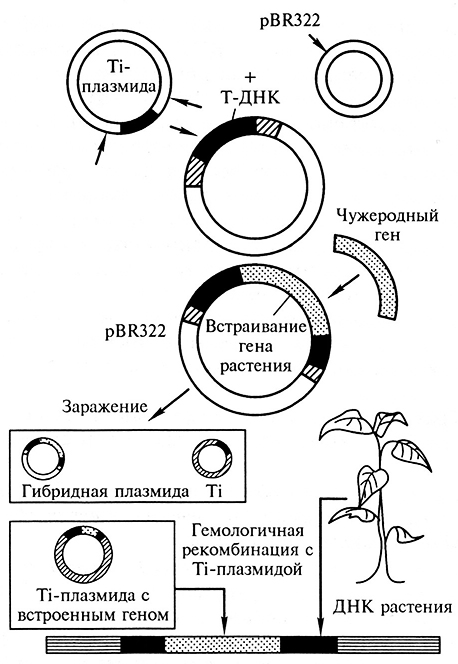
Рис. 2.3. Использование Ti-плазмиды в качестве вектора для переноса генов в растительные клетки
(по Э.С. Пирузян)
В качестве вспомогательного (промежуточного) вектора, в котором проводят клонирование нужного нам гена, используют векторы на основе плазм иды Е. coli, в которые вставляют фрагмент Т-ДНК с пограничными последовательностями Т-ДНК и ген селективного маркера (обычно ген, кодирующий устойчивость к антибиотику (канамицину, гифомицину или гербициду), что в будущем позволит проводить селективный отбор трансгенных растений. Такой вектор обладает небольшими размерами, и его используют для клонирования в нем нужного гена, вставляя его последовательность в область Т-ДНК.
С помощью конъюгации такой промежуточный вектор переносят в клетки специальных штаммов A. tumefaciens, содержащих другой вектор, несущий гены, необходимые для интеграции области Т-ДНК в геном растения. Этот вектор имеет значительные размеры и представляет собой фрагмент Ti-плазмиды, несущей vir-область, пограничные последовательности Т-ДНК и фрагменты плазмиды, аналогичные промежуточному вектору. После конъюгации происходит рекомбинация между гомологичными участками двух векторов, в результате фрагмент промежуточного вектора, содержащий нужный ген и селективный маркер, переносятся во второй вектор с vir-областью и пограничными последовательностями Т-ДНК. Таким образом, в результате рекомбинации между двумя плазмидами получается коинтегративный вектор. Клетки агробактерий, содержащие такой коинтегративный вектор, отбираются на селективных средах и используются в дальнейшем для трансформации растений.
Бинарный вектор. Другой, более простой и поэтому более часто применяемый метод введения чужеродной ДНК заключается в использовании бинарных векторов. Как уже упоминалось, для заражения и трансформации растительных клеток агробактериям необходима vir-область, ответственная за перенос ДНК, и прямые повторы, ограничивающие район Т-ДНК. Более того, vir-область и пограничные повторы Т-ДНК не обязательно должны находиться в одной плазмиде. Система бинарных векторов основана на том, что в агробактериальной клетке, используемой для трасформации растений, одновременно находятся две плазмиды. Одна содержит область пограничных повторов Т-ДНК, а другая – vir-область. Обе плазмиды могут независимо реплицироваться в клетках агробактерии, однако, поодиночке не могут приводить к трансформации растений. При этом плазмида, несущая Т-ДНК, содержит в своем составе фрагменты плазмиды Е. coli (в том числе и точку начала репликации), что позволяет проводить все манипуляции по клонированию в клетках Е. coli и намного упрощает весь процесс. Аналогично коинтегративному вектору целевой ген и ген селективного маркера встраиваются в область Т-ДНК, и затем такая рекомбинантная плазмида вводится в клетки агробактерии, которые уже несут другую плазмиду с vir-областью. В отличие от коинтегративных векторов не происходит гомологичной рекомбинации между двумя плазмидами и их объединения в единую векторную молекулу. Белки, экспрессируемые vir-генами одной плазмиды, вырезают и встраивают в растительный геном области Т-ДНК с чужеродными генами другой плазмиды. В настоящее время такие бинарные векторы наиболее часто используются для трансформации растительных клеток.
Векторы для трансформации растений
на основе Ri-плазмид
Помимо Ti-плазмид A. tumefaciens способностью трансформировать растительные клетки обладают также и Ri-плазмиды (от англ. Root inducing – индуцирующая [избыточное] корнеобразование), выделенные из агробактерии A. rhizogenes. Ri-плазмиды вызывают усиленное образование корней и, также как Ti-плазмиды, приводят к синтезу опинов. Однако Ri-плазмиды в большинстве случаев не онкогенны, и после трансформации растительные клетки способны регенерировать здоровые плодовитые растения. В настоящее время на основе Ri-плазмид также получены вектора для генной инженерии растений.
Векторы на основе ДНК-содержащих вирусов растений
Подавляющее большинство фитовирусов в качестве носителя генетической информации содержат РНК. Лишь 1–2 % от числа вирусов, инфицирующих растения, относятся к ДНК-содержащим. Именно они наиболее удобны для использования в технологии ре комбинантных ДНК и рассматриваются главными кандидатами на роль векторов для переноса генов в растения.
Наиболее перспективным в этом отношении является вирус мозаики цветной капусты CaMV (cauliflowermosaic virus), поражающий в основном растения семейства Капустных. Частицы этого вируса имеют диаметр около 50 нм и содержат кольцевую ДНК длиной 8000 н. п. Небольшой размер генома CaMV дает возможность манипулировать in vitro с вирусной ДНК, как с бактериальной плазмидой и затем вводить ее в растения путем втирания в листья. Инфицирование небольшого числа клеток приводит к заражению всего растения, так как вирус быстро распространяется, передаваясь от клетки к клетке. Использованием 1–5 мкг ДНК для инфицирования одного растения достигается почти 100%-я эффективность инфекции, что значительно выше, чем при агробактериальном заражении.
Прямая интеграция ДНК CaMV в геном хозяина после инфекции не показана. Разработан методический прием – агроинфекция, позволяющий осуществить прямое встраивание вирусной ДНК после инокуляции. Для этого геном CaMV встраивается в Т-ДНК и в ее составе интегрирует в ядерный геном различных растений, при этом из состава CaMV вырезаются последовательности, обеспечивающие его вирулентность.
К преимуществам векторных систем на основе вирусов можно отнести следующие: малый размер генома, что дает возможность легко манипулировать вирусной ДНК; высокая копийность вирусной ДНК в клетках зараженных растений (до 50 000 на клетку); наличие сильных промоторов, которые могут обеспечить эффективную экспрессию чужеродных генов.
Среди недостатков следует отметить небольшую емкость вектора (800–1000 н.п.) и ограниченный круг хозяев – крестоцветные.
В заключение следует отметить, что хотя векторы на основе вирусов редко применяются для трансформации растений, вирусные промоторы, и прежде всего промотор 35S-PH К СаМV, широко используются для экспрессии чужеродных генов в других векторных системах. Промотор 35S-PHК вируса мозаики цветной капусты является сильным промотором, кроме того, он активен не только в клетках крестоцветных, но и в клетках других семейств, не проявляет тканеспецифичности и экспрессируется во всех клетках трансформированного растения.
Векторы на основе мобильных элементов
(транспозонов)
В 90-х годах стали использовать для трансформации растительных клеток векторы на основе мобильных элементов – последовательностей ДНК, имеющих специфическое строение и способных к транспозициям по геному. Какие преимущества дает применение таких векторов по сравнению с другими векторными конструкциями? Метод основывается на том, что мобильные элементы могут после первичной интеграции в хромосому растений перемещаться по геному путем встраивания и последующего вырезания. Наиболее широко для растений используется система Ac/Ds векторов.
Ac (Activator) – это мобильный элемент растений, впервые идентифицированный генетическими методами в середине 1940-х годов Барбарой Мак Клинток по его способности вызывать хромосомные разрывы в специфических участках генома кукурузы и вызывать явление ксинильности. Aс-Элемент относится к группе мобильных элементов, способных к активным транспозициям по геному. К этому же семейству транспозонов относится и гетерогенная группа Ds-элементов, родственных по своей первичной структуре Ас-элементу, однако, из-за делеций внутренних районов не способная к самостоятельным перемещениям в геноме, при этом возможные транспозиции происходят только в присутствии специфичного белка – транспозазы Ас-элемента.
Как было показано, Ас-элемент может быть активен помимо кукурузы и в геномах других растений, таких, как арабидопсис, морковь, картофель, томаты, рис и др. Недавние эксперименты по исследованию закономерностей транспозиции Ас-элемента в геноме арабидопсиса показали возможность использования конструкций на основе Aс-мобильного элемента для получения систем маркированных транспозиций, а также для создания так называемых линий ловушек генов (enhances trap lines), позволяющих идентифицировать новые гены, в том числе и группу генов, имеющих тканеспецифичную экспрессию, т. е. тех, которые транскрибируются и транслируются не во всех, а только в определенных тканях. Таким образом можно идентифицировать (и в будущем найти практическое применение) тканеспецифичные гены и белки, характерные только для конкретных тканей, например корней, зародышевого мешка и т. д. Использование в таких векторах репортерных генов позволит маркировать новые сайты интеграции транспозонных конструкций и идентифицировать те места инсерций, которые произошли около или непосредственно в последовательность функционального гена, для его последующего клонирования и секвенирования, что и позволило называть такие типы плазмид – вектора – ловушки генов.
2.6. МЕТОДЫ ТРАНСФОРМАЦИИ РАСТИТЕЛЬНЫХ КЛЕТОК
Метод кокультивации с агробактерией
Является одним из самых распространенных методов получения трансгенных двудольных растений (рис. 2.4, а). Он основан на трансформации растительных эксплантов агробактериями, несущими векторную конструкцию, содержащую чужеродный ген, встроенный в область Т-ДНК. Его популярность связана с относительной простотой проведения трансформации и довольно высоким выходом полученных трансгенных растений (10–60% в зависимости от вида растения).
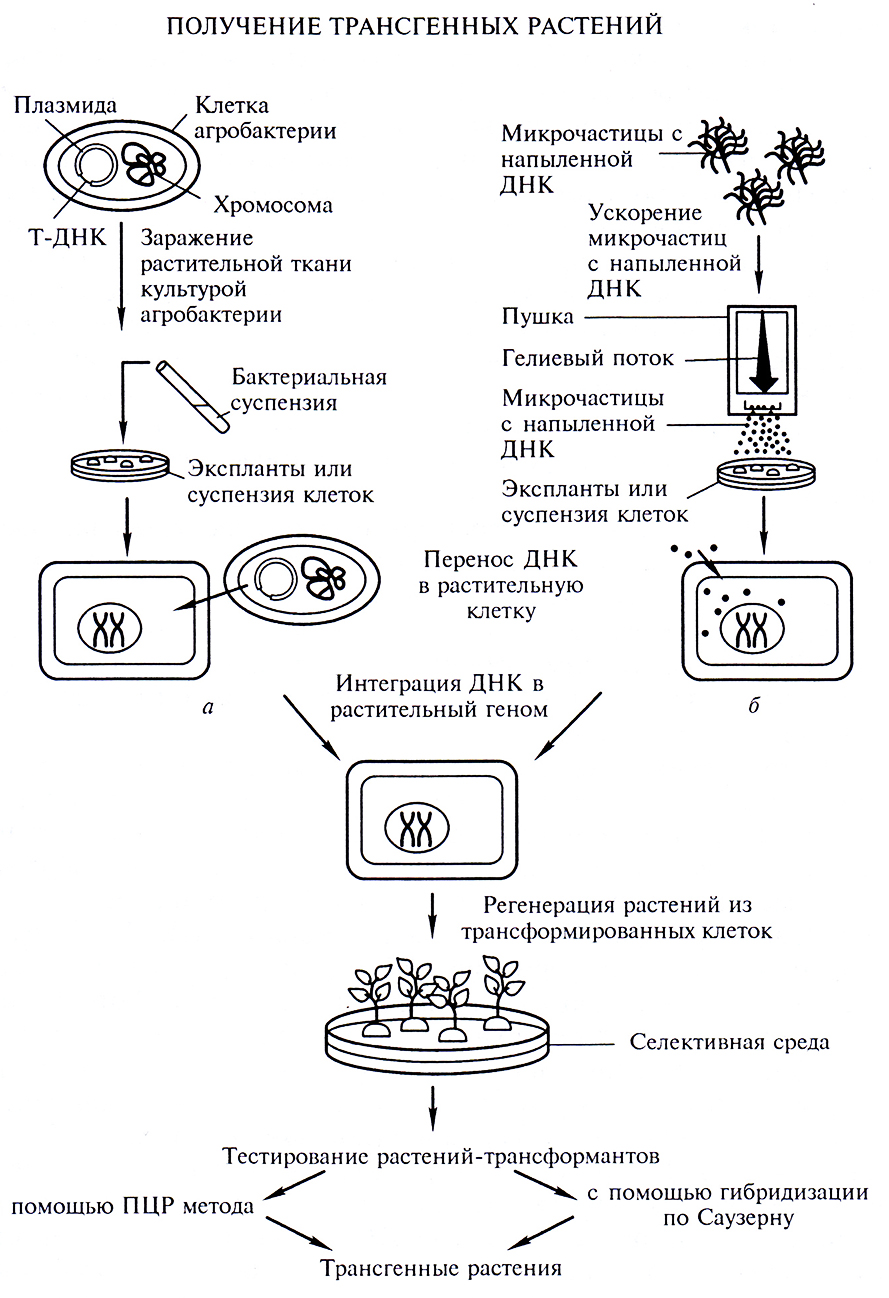
Рис. 2.4. Схема получения трансгенных растений:
а – кокультивацией с агробактерий; б – методом биобаллистики
В качестве исходного материала необходимо иметь штамм агробактерии с векторной конструкцией (бинарной, коинтегративной или другой, приемлемой для этого типа трансформации). Вектор должен содержать последовательность гена, который необходимо ввести в геном растения. Происхождение гена (прокариотический или эукариотический) не столь важно для трансформации, однако он должен находиться под контролем промотора, способного экспрессироваться в растительной клетке. Кроме функционального гена вектор должен содержать селективный маркер трансформации. В качестве такого маркера обычно используются гены устойчивости к антибиотикам канамицину (ген npt), гигромицину (ген hpt) и/или гербицидам хлорсульфорону (ген ALS), фосфинотрицину (BASTA) (ген bar). Кроме того, должны быть подобраны сорта растения-реципиента. В качестве эксплантов для трансформации обычно берут стерильные листовые диски. Однако можно брать и молодые корешки (арабидопсис), гипокотили (томаты), семядоли (томаты, баклажаны), междоузлия (картофель).
Экспланты инокулируют жидкой средой, содержащей агробактерию с векторной конструкцией. Время инокуляции подбирается для каждого вида растений индивидуально. При этом происходит заражение клеток раневой поверхности экспланта, и после 24–48 ч кокультивирования в некоторых клетках происходит встраивание в растительный геном фрагмента Т-ДНК с чужеродным (выбранным) геном. Далее экспланты переносят на среду с антибиотиком (карбенициллин или цефотаксим), что приводит к избирательной гибели клеток агробактерий. Кроме того, в среду добавляют соответствующие фитогормоны (для прямой регенерации или каплусообразования) и антибиотик/гербицид для проведения селективного отбора трансформированных клеток. Такие трансгенные растения, экспрессирующие ген устойчивости к антибиотику или к гербициду, будут расти на среде с добавлением селективного агента, в то время как нетрансгенные растения погибнут. Через 2–5 недель на трансформированном экспланте развиваются побеги, которые в дальнейшем отсаживают или переносят в почву для проведения дополнительного молекулярного анализа.
Сходным образом трансформируют протопласты, однако такого рода трансформация значительно менее эффективна из-за низкой способности к регенерации самих протопластов.
Методом кокультивации с агробактериями к настоящему времени получены трансгенные растения практически всех сельскохозяйственных двудольных растений. Этот метод применим также и для некоторых однодольных (пшеница, кукуруза, рис).
Методы прямого переноса генов в растение
Для прямого переноса генов в растительные клетки очень часто используется трансформация растительных протопластов. При обработке клеточной стенки растения ферментами (целлюлазой, пектиназой) клеточная оболочка разрушается и остается один протопласт. Разработаны методы прямой трансформации протопластов с помощью ДНК. Наибольшей эффективности трансформации (10-2) удалось достигнуть методом электропорации и добавления полиэтиленгликоля. Хотя частота трансформации значительно ниже, чем, например, при агробактериальной трансформации, метод прямого переноса обладает рядом преимуществ. Вектор может не содержать специальных биологических сигналов и функций трансформации (пограничных областей Т-ДНК и vir-области). Для трансформации может быть использован практически любой ДНК-вектор, несущий чужеродный ген. При этом гибридный ген интегрирует в ядерную ДНК растения и экспрессируется (при наличии соответствующих регуляторных областей), особенно в случае прямой инъекции в ядро протопласта, используя механизмы клеточной рекомбинации. Однако основным недостатком такого метода является крайне низкая частота трансформации.
В настоящее время более 140 видов растений были протрансформированы путем прямого переноса ДНК вектора в протопластные клетки различными методами.
Микроинъекции ДНК. В ряде экспериментов было показано, что метод микроинъекций может успешно применяться для трансформации растительных клеток аналогично микроинъекциям в животные клетки. Это стало возможным после преодоления ряда технических трудностей, в частности, разработки метода получения протопластов для инъекций путем прикрепления их к стеклам полилизином. Перенос ДНК в цитоплазму или ядро растительной клетки осуществляют микроинъекциями раствора, содержащего ДНК целевого гена. Микроинъекции очень трудоемкий процесс, требующий специального оборудования. Для этого используют специальные микроманипуляторы и микроиглы.
Трансформация растительных протопластов происходит с эффективностью не более 10–15 %, независимо от типа вектора, и подходит как для двудольных, так и для однодольных растений.
Электропорация. Этот метод основан на том, что импульсы высокого напряжения обратимо увеличивают проницаемость биомембран. Для растительных протопластов процедура электропорации оказалась очень эффективной. Метод состоит в следующем: на растительные протопласты, находящиеся в растворе большой концентрации, содержащем ДНК-векторы, действуют высоковольтным импульсом (напряжение 200–350 В, длительность импульса 54 мс). В результате молекулы ДНК поглощаются клетками через поры в клеточной мембране. После разведения раствора протопласты высеваются на соответствующую среду для регенерации. Эффективность переноса определяется через 24–48 ч после электрошока.
Упаковка в липосомы. Это один из методов, используемых для защиты экзогенного генетического материала, который вводится в протопласты растений, от действия нуклеаз, которые разрушают нуклеиновые кислоты.
Липосомы – это сферические образования, оболочки которых состоят из фосфолипидов. Их можно получить в результате резкого встряхивания или обработки ультразвуком водных эмульсий фосфолипидов. С помощью липосом в протопласты растений были введены РНК вируса табачной мозаики, ДНК Ti-плазмиды A. tumefaciens, а также целые метафазные хромосомы. К преимуществам систем переноса с помощью липосом можно отнести их низкую токсичность по отношению к клеткам и возможность использования на множестве растений, клетки которых способны утилизировать липосомы. В настоящее время этот способ трансформации применяется все реже из-за его технической сложности и низкой трансформирующей активности (0,5–1 %).
Основные проблемы при описанных выше методах прямой трансформации обычно связаны с низкой регенерационной способностью протопластов и, следовательно, крайне низким выходом растений-трансформантов.
Вакуумная инфильтрация. Метод трансформации растений с помощью вакуумной инфильтрации был разработан относительно недавно и используется как для трансформации побегов, так и семян. Метод основан на том, что верхушечные части молодого растения или предварительно обработанные семена (с частично разрушенным перикарпом) помешаются в раствор агоробактериальных клеток, несущих вектор с целевым геном. Емкость с раствором и эксплантами помещается в камеру, где создается отрицательное давление. В результате этого агробактерия проникает в межклетники растительного экспланта, что в дальнейшем приводит к трансформации. Метод вакуумной инфильтрации довольно дешев и достаточно эффективен. Так как, в отличие от методов трансформации с помощью липосом, микроинъекций или электропорации, при вакуумной трансформации в качестве эксплантов используются не протопласты, он не требует дополнительных реактивов.
Метод биобаллистической трансформации. Метод биобаллистики, являясь одним из самых эффективных на сегодняшний день методов трансформации однодольных, может также с успехом применяться на двудольных (см. рис. 2.4, б). В качестве исходного материала для трансформации берется суспензионная культура, каллусная ткань или культивируемые незрелые зародыши однодольных.
Суть метода заключается в том, что на мельчайшие частички вольфрама, платины или золота диаметром 0,6–1,2 мкм напыляется ДНК вектора, содержащего необходимую для трансформирования генную конструкцию. Вольфрамовые платиновые или золотые частички, несущие ДНК, на целлофановой подложке помещаются внутрь биобаллистической пушки. Каллус или суспензия клеток вносится в чашку Петри с агаризированной средой и помещается под биобаллистическую пушку на расстоянии 10–15 см. В пушке вакуумным насосом уменьшается давление до 0,1 атм. В момент сбрасывания давления вольфрамовые или золотые частички с огромной скоростью выбрасываются из пушки и, разрывая клеточные стенки, входят в цитоплазму и ядро клеток. Обычно клетки, располагающиеся непосредственно по центру, погибают из-за огромного количества и давления вольфрамовых или золотых частиц, в то время как в зоне 0,6–1 см от центра будут находиться трансформированные клетки. Далее клетки осторожно переносят на среду для дальнейшего культивирования и регенерации.
С помощью биобаллистической пушки были трансформированы однодольные растения, такие, как кукуруза, рис, пшеница, ячмень, и получены стабильные трансгенные растения.
Кроме успехов в получении трансгенных однодольных, биобаллистическая трансформация применяется для прямого переноса ДНК в эмбриогенную пыльцу и получения трансгенных дигаплоидных растений, которые являются важным этапом в селекционной работе. Этим методом была проведена трансформация растений табака и после регенерации гаплоидных растений получены стабильные трансформанты.
Доказательства трансформации растений
В состав векторов для трансформации растений помимо функционального гена входит ген селективного маркера. Это обычно ген, кодирующий устойчивость к антибиотикам канамицину (ген nptII) или гигромицину (ген hptII), и поэтому первичную селекцию трансгенных растений проводят на среде с соответствующим антибиотиком. На такой среде регенерируют растения, в геноме которых присутствует ген селективного маркера. Однако выживание на селективной среде не может быть абсолютным доказательством трансгенной природы растения. Для полного доказательства присутствия в их геноме последовательности Т-ДНК проводят анализ при помощи полимеразной цепной реакции (ПЦР) и молекулярного анализа, основанного на блот-гибридизации хромосомной ДНК трансгенного растения с использованием в качестве радиоактивного зонда фрагмента Т-ДНК. Проведение такого анализа является более трудоемким и дорогим, но полученные результаты позволят убедиться в том, что произошла трансформация, а также в том, сколько Т-ДНК-конструкций встроено в геном растения. Кроме того, проводят дополнительный анализ экспрессии функционального гена методом выявления соответствующей мРНК или белка.

