Основная форма существования жизни – клетка, в которой протекают все физиологические процессы как у одноклеточных, так и у многоклеточных организмов. Рост и размножение организмов связаны с образованием новых клеток. Совокупность биохимических процессов, обеспечивающих рост и развитие клетки, называется обменом веществ, или метаболизмом. Каждая клетка на определенной стадии делится и дает начало двум дочерним клеткам. Клетки разнообразны по форме, величине, степени дифференциации и функциям.
Клетка
Является элементарной единицей жизни: в ней имеется все необходимое для поддержания обмена веществ и размножения. Соматические и половые клетки многоклеточных животных и растений, а также одноклеточные организмы сходны по строению. Среди живых организмов встречаются два типа организации клеток. Наиболее простое строение имеют клетки бактерий и сине-зеленых водорослей, которые объединяются в прокариотическую группу. У них нет морфологически выраженного ядра. Клетки всех остальных представителей живого мира относятся к эукариотической группе, потому что у них обязательной структурой является клеточное ядро, отделенное от цитоплазмы ядерной оболочкой. Кроме ядра и вакуолей, в цитоплазме существует целый набор специальных структур, или органелл, выполняющих специфические функции.
Ядро – центр, управляющий жизнедеятельностью всей клетки и координирующий ее. Оно имеет сложное строение, изменяющееся на разных этапах жизненного цикла клетки. Ядро окружено ядерной оболочкой (мембраной), пронизанной порами, через которые осуществляется обмен веществ между ядром и цитоплазмой. Внутри ядра находятся хроматин, одно или несколько ядрышек и ядерный сок – кариолимфа, или нуклеоплазма. Ядрышки – тельца, связанные с хромосомами, – содержат большое количество рибонуклеиновой кислоты (РНК), в них происходит синтез рибосомной РНК.
Энергия в клетке вырабатывается митохондриями – особыми сферическими или палочковидными образованиями разнообразной величины и сложной структуры. При исследовании цитоплазмы при помощи электронной микроскопии была открыта система мембран и канальцев, служащих продолжением клеточной мембраны и связанных с внешней мембраной ядерной оболочки. Эта система получила название эндоплазматической сети или ретикулума. По эндоплазматической сети канальцев, образуемых мембранами, передвигаются вещества внутри клетки. Здесь же открыты субмикроскопические частицы – рибосомы, состоящие из белков и РНК.
Важнейшими структурными элементами клетки являются пластиды– хлоропласты, лейкопласты, хромопласты и другие, характерные для цитоплазмы растительных клеток. Хлоропласты содержат хлорофилл и участвуют в процессе фотосинтеза; бесцветные пластиды синтезируют крахмал; хромопласты – пигменты; эупласты – жиры и пластидные нуклеиновые кислоты.
В цитоплазме клетки имеются специфические органиоды: аппарат Гольджи – производное эндоплазматической сети – обеспечивает выделительную и секреторную функцию клетки; лизосомы – тела, содержащие ряд ферментов и выполняющие функцию пищеварения внутри клетки; центросомы – клеточный центр которых состоит из небольших телец центриолей и центросферы – особым образом дифференцированного участка цитоплазмы.
Клеточная мембрана имеет сложное строение, приспособленное к выполнению определенных функций: защитной, избирательной проницаемости и активного втягивания частиц и молекул. Активный транспорт молекул через клеточную мембрану осуществляется при помощи ионных каналов.
Передача наследственных признаков потомству как при вегетативном, так и при половом размножении осуществляется делением клеток. Изучение процессов деления эукариотических клеток показало, что из всех клеточных компонентов только хромосомы распределяются поровну между дочерними клетками (Дубинин, 1976, и др.). Это указывает на участие хромосом в передаче наследственных признаков: в результате деления ядра каждая дочерняя клетка получает точно такой же набор хромосом, как у исходной родительской клетки. В этом уравнительном распределении хромосом ядра заключается генетическое значение митоза. Пластиды и митохондрии также размножаются путем деления, но их распределение по дочерним клеткам не подчиняется строгой закономерности.
Деление клетки состоит из двух основных этапов: деление ядра – митоз (кариокинез) и деление цитоплазмы (цитокинез). Ядро клетки при делении проходит последовательные стадии: интерфазу, профазу, метафазу, анафазу и телофазу. Между двумя последовательными делениями клетки ядро находится в стадии интерфазы. Хотя интерфазу и называют стадией покоящегося ядра, но метаболические процессы в ядре в этот период протекают наиболее активно.
Продолжительность всего митотического цикла – от 30 мин до 3 ч – зависит от вида и физиологического состояния организма, типа ткани, внешних факторов – температуры, света и др. Скорость прохождения отдельных фаз митоза также различна.
Новый организм при половом размножении возникает из зиготы – оплодотворенной яйцеклетки, которая образуется при слиянии гамет, т. е. мужской и женской половых клеток. Если бы каждая гамета вносила в зиготу полный набор хромосом родительского организма, тогда бы их число увеличивалось вдвое за каждое поколение. Мейоз, предшествующий образованию как женских, так и мужских половых клеток, является регулирующим механизмом, позволяющим сохранять постоянное число хромосом.
Мейоз
Процесс деления клетки, при котором наблюдаются соединение (конъюгация) гомологичных хромосом попарно и редукция (уменьшение) их числа в клетках – продуктах деления. При мейозе ядро делится дважды. В результате первого мейотического деления образуются два ядра с половинным – гаплоидным числом хромосом. Во втором делении каждое вновь образовавшееся ядро делится еще раз, но уже митотическим путем – расходятся хромосомы, которые образовались из сестринских хроматид. Таким образом, из каждой клетки, вступившей в мейоз, после двух последовательных делений образуются четыре клетки с половинным числом хромосом.
При мейозе не только вдвое уменьшается число хромосом, но и происходит распределение компонентов парных гомологичных хромосом по разным клеткам. При этом каждая пара ведет себя независимо. Редукции хромосом в мейозе предшествует слияние – конъюгация гомологов, которое позволяет каждой паре гомологичных хромосом обмениваться участками. Это создает дополнительный резерв наследственных комбинаций при половом размножении организмов. Процесс обмена гомологичных хромосом своими частями получил название кроссинговера.
Таким образом, через комбинаторику гомологов из разных пар и кроссинговер мейоз резко увеличивает наследственную изменчивость нового поколения диплоидных организмов, возникающих после слияния гамет.
Возникшая после слияния отцовского и материнского ядер зигота содержит программу развития будущего организма, записанную в структурах молекул ДНК. Дочерние клетки развивающейся зиготы получают информацию, которая позволяет им во взаимодействии с условиями внешней среды формировать новый организм. Многочисленные факты и специально поставленные эксперименты показывают, что в процессе индивидуального развития и специализации растительных клеток генетическая информация в них не уменьшается, все гены, как правило, сохраняются и при соответствующих благоприятных условиях из каждой соматической клетки растения может развиться целый организм. Это явление называется тотипотентностью. В этом заключается отличие клеток растений от клеток высших животных, для которых невозможна способность восстанавливать целый организм.
Все паренхимные клетки растения, в каких бы тканях они не находились, содержат полный набор генов, такой же, какой имела зигота. Но в каждой ткани действует только часть генов, связанная с дифференциацией данного типа клеток. Одни гены функционируют во всех клетках организма, например гены, контролирующие дыхание, проницаемость мембран, синтез АТФ; другие – только в определенных. Каждая специализированная клетка характеризуется своим набором активных генов. Чем более специализированы клетки, тем меньше в них активных генов. Разные гены работают не только в различных клетках, но и в разное время, на разных стадиях развития особи. В однотипных клетках одной и той же ткани на разных стадиях развития организма непрерывно меняется набор активных генов. Одни гены включаются, синтезируя и-РНК определенных белков, другие выключаются из этой работы.
Образование в процессе развития из однородных клеток зародыша разнообразных по морфологическим признакам и функциям типов клеток, тканей и органов называется дифференциацией. В основе дифференциации тканей лежат различия в активности генов. Центральная проблема онтогенетики – анализ действия гена при формировании признака и установление промежуточных звеньев в цепи ген – признак.
В специализированных клетках работает ограниченная группа генов, большая часть их репрессирована. Но ДНК и гены во всех растительных клетках одинаковы, поэтому их активность должна определяться другими механизмами, включение которых не связано с действием генов. Такими механизмами активизации генов являются различия в структуре цитоплазмы, тканевая индукция и гормоны. Яйцеклетка созревает под контролем генов, определяющих разнокачественность частей цитоплазмы, что приводит к неравноценности продуктов первых делений и при дальнейшем размножении клеток – к тканевой дифференциации. Затем в процесс вступает эмбриональная индукция – воздействие одних тканей зародыша на другие. Это воздействие выражается в активации новых генов. Предполагают, что клетки ранее образующейся ткани выделяют вещества, способные активизировать работу генов, необходимых для дифференциации другой ткани, – тканевая индукция.
Гормональная регуляция
Наиболее хорошо изученный механизм активизации генов. Гормоны могут воздействовать на гены непосредственно или вызывать появление в цитоплазме каких-то специфических веществ, действующих затем на гены. Одни гормоны – очень сложные белки; другие – короткие цепочки полипептидов; третьи – простые производные аминокислот. Проникая в клетку, гормоны воздействуют на комплекс гистоны-ДНК и активируют отдельные локусы.
Особую роль в дифференциации тканей играют гомеобоксовые гены, группы которых содержат одинаковые элементы «гомеобоксы». Они служат адресом для гормональных веществ-регуляторов, определяя одновременную активацию или репрессию целого семейства генов. У растений гомеобоксовые гены были открыты в 1980-х годах. Показано, что и у растений они контролируют порядок возникновения и специализации метамеров (Э.Е. Хавкин, 1998).
Таким образом, растительная клетка – весьма сложное образование, включающее различные микроскопические и субмикроскопические структуры, отличительной особенностью которых является высокая динамичность, способность закономерно изменяться под влиянием условий существования.
3.2. КУЛЬТУРА КЛЕТОК И ТКАНЕЙ
Клеточная биотехнология базируется на способности клеток к существованию и размножению in vitro, их тотипотентности и регенерации. Метод культивирования изолированных тканей на искусственных питательных средах в стерильных условиях (in vitro) применяют в растениеводстве для сохранения и размножения ценных генотипов, в эмбриогенезе, оздоровлении посадочного материала, для получения продуктов вторичного метаболизма, в создании форм растений, устойчивых к абиотическим и биотическм факторам окружающей среды, и т.д.
Роль культуры изолированных клеток и тканей в биотехнологии следует рассматривать в трех направлениях.
Первое направление связано со способностью изолированных растительных клеток продуцировать ценные для медицины, парфюмерии, косметики и других отраслей промышленности вещества вторичного синтеза: алкалоиды, стероиды, гликозиды, гормоны, эфирные масла и др. Как правило, вторичные вещества получают из каллусной ткани, выращенной на твердой (агаризованной) или жидкой (суспензионная культура) питательной среде. На основе клеточных технологий получают такие медицинские препараты, как диосгенин из клеток диоскореи, аймолин из клеток раувольфии змеиной, тонизирующие вещества из клеток женьшеня, используемые в медицине и парфюмерии. Продуктивность культивируемых клеток в результате клеточной селекции может значительно превышать продуктивность целых растений. Преимуществом такого способа получения веществ вторичного синтеза является также возможность использовать для этой цели растения, не произрастающие в наших природных условиях, и получать продукцию круглый год.
Второе направление – это использование культуры изолированных тканей для размножения и оздоровления посадочного материала. Этот метод, названный клональным микроразмножением растений, позволяет получать от одной меристемы сотни тысяч растений в год.
Третье направление – использование изолированных клеток в селекции растений, дающее возможность получать быстрорастущие растения, устойчивые к различным неблагоприятным факторам среды: засуха, засоление, низкие и высокие температуры, фитопатогены, тяжелые металлы и др. Вместе с тем это направление предусматривает создание новых растений путем слияния изолированных протопластов и получения неполовых (соматических) гибридов. Перенос в изолированные протопласты чужеродных генов методами генной инженерии позволяет получать в дальнейшем растения с новыми наследуемыми свойствами. Культивирование изолированных пыльников и семяпочек на искусственных питательных средах дает возможность получать гаплоиды, культивирование зародышей позволяет получать растения из невсхожих (с плохо развитым эндоспермом) гибридных семян. Оплодотворение в пробирке позволяет преодолеть нескрещиваемость некоторых растений.
Успех в применении культуры клеток и тканей в первую очередь зависит от оптимизации физиологических процессов, обеспечивающих нормальное деление клеток, их дифференцировку и регенерацию из них взрослых растений. Наиболее сложной является регенерация растений из отдельных клеток. В первую очередь это касается злаковых растений. Поэтому важнейшее значение имеет выяснение механизма морфогенеза in vitro, регенерации и лежащих в их основе процессов.
Попытки культивировать изолированные от растений ткани делались давно, и в истории развития этого метода можно выделить несколько этапов.
I этап (1892–1902 гг.) связан с именами таких немецких исследователей, как Г. Хаберландт, X. Фёхтинг, С. Рехингер. Они пытались культивировать в растворе сахарозы различные растительные ткани. Для сегментов стеблей одуванчика и тополя был получен первичный каллус и определен минимальный размер сегмента, способного к каллусогенезу. Не достигнув положительных результатов, эти исследователи высказали ряд идей и гипотез, которые подтвердились значительно позже. Так, Г. Хаберландт выдвинул гипотезу о тотипотентности любой живой растительной клетки, т. е. способности клеток реализовывать свой потенциал развития и давать начало образованию целого растения при определенных условиях культивирования.
II этап (1902–1922 гг.) ознаменовался созданием первых питательных сред для культивирования тканей животных. Эти среды были природного происхождения и содержали, как правило, плазму крови и зародышевую жидкость. Попытки вырастить изолированные растительные ткани на искусственных питательных средах, содержащих растительные экстракты, оказались неудачными, так как в экспериментах использовались мало подходящие для проявления ростовой активности клетки и ткани высших растений.
III этап (1922– 1932гг.). В этот период независимо друг от друга американский ученый В. Робине и немецкий ученый В. Котте показали возможность культивирования на твердых питательных средах меристемы кончиков корня томатов и кукурузы. Однако через определенное время растительные ткани бурели и погибали. Подлинное развитие метода культуры тканей растений началось с 1932 г.
IV этап (1932–1940 гг.) связан с именем французского ученого Р. Готре, который показал возможность долгого культивирования в условиях in vitro растительных тканей за счет периодического пересаживания их на свежую питательную среду. Это открытие дало новый толчок в работе по культуре ткани, который ознаменовался нарастающим числом новых объектов, успешно введенных в культуру.
V этап (1940–1960 гг.). С открытием в 1955 г. нового класса фитогормонов-цитокининов, и в частности кинетина, была получена возможность стимулировать деление клеток кусочка ткани сердцевинной паренхимы табака, лишенной проводящих пучков и камбия.В зависимости от концентрации и соотношения стимуляторов роста можно было усиливать деление клеток экспланта, поддерживать рост каллусной ткани, индуцировать морфогенез. В этот период было оценено положительное действие натуральных экстрактов типа эндосперма кокосового ореха, каштана, кукурузы и других растений для поддержания неорганизованного клеточного роста и стимуляции процессов морфогенеза в культуре каллусных тканей и клеточных суспензий.
VI этап (1960–1975 гг.). Наиболее важным событием этого периода была разработка профессором Ноттингемского университета Э.К. Коккингом метода получения ферментативным путем изолированных протопластов из корней и плодов томата и культивирования их в контролируемых условиях. Позже в 1970 г. в той же лаборатории С. Пауэром и сотрудниками было осуществлено искусственное слияние протопластов, что открыло новый путь к созданию соматических гибридов. В этот же период разработан метод клонального микроразмножения растений в условиях in vitro с использованием меристемной культуры. Основоположником данного направления был французский ученый Ж. Морель, который получил оздоровленный посадочный материал орхидей и картофеля.
VII этап (1975 г.– по настоящее время). Продолжается быстрое развитие техники in vitro, изучение биологии культивируемых объектов, разрабатываются методы электрослияния изолированных протопластов, методы мутагенеза и клеточной селекции, методы получения гаплоидных растений, совершенствуется метод глубинного культивирования клеток с использованием изолированных протопластов и векторов, созданных на основе Ti- и Ri-плазмид Agrobacterium tumefaciens и A. rhizogenes. При помощи методов генной инженерии разработан эффективный метод переноса генов для двудольных растений. Таким образом, за последние десятилетия был сделан большой шаг вперед в развитии технических приемов работы с изолированными тканями и клетками растений. Однако объектом исследования, как правило, служили одно- и двудольные травянистые растения и в редких случаях – древесные.
3.3. ТЕХНИКА ВВЕДЕНИЯ В КУЛЬТУРУ IN VITRO
И КУЛЬТИВИРОВАНИЕ ИЗОЛИРОВАННЫХ КЛЕТОК
И ТКАНЕЙ РАСТЕНИЙ
Необходимым условием работы с культурой изолированных тканей является соблюдение строгой стерильности. Богатая питательная среда является прекрасным субстратом для развития в ней микроорганизмов, а изолированные от растения фрагменты (экспланты), которые помещают на питательную среду, легко поражаются микроорганизмами. Поэтому надо стерилизовать как эксплант, так и питательную среду. Все манипуляции с изолированными тканями (введение в культуру, пересадка на свежую питательную среду) проводят в асептическом помещении (ламинар-боксе) стерильными инструментами. Стерильность надо соблюдать и во время культивирования изолированных тканей, особенно при перепаде температуры и влажности, так как при этом пробки становятся влажными и по ним в пробирку могут проникать микроорганизмы.
Стерилизацию экспланта и семян проводят, выдерживая их 5– 20 мин в стерилизующих растворах с последующей многократной промывкой экспланта стерильной водой. Время стерилизации зависит от характера экспланта и от стерилизующей активности раствора. Семена стерилизуют 10–20 мин, а вегетативные части 5–10 мин. Примеры стерилизующих растворов приведены в табл. 3.1.
Таблица 3.1. Стерилизация исходного растительного материала (Р.Г. Бутенко, 1990)
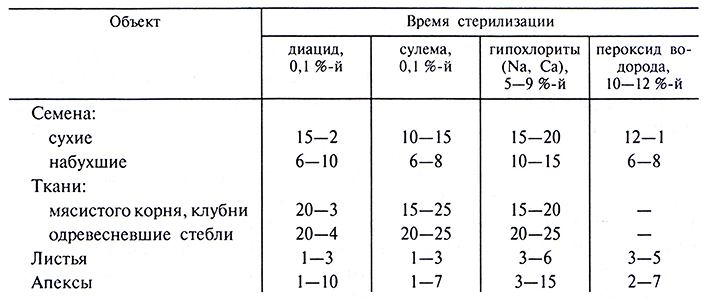
Органы растений, из которых берут эксплант для введения в культуру, предварительно моют щеткой в мыльном растворе и споласкивают дистиллированной водой, а затем погружают на несколько секунд в 70 %-й этанол. Семена погружают в спирт на 1–2 мин. Кроме собственно стерилизующего действия спирта обработка тканей этанолом перед помещением в основной стерилизующий раствор повышает стерилизующий эффект последнего.
После стерилизации растительные объекты должны быть тщательно промыты стерильной водой.
Поверхностная стерилизация освобождает эксплант только от наружной инфекции. Если же ткани экспланта имеют внутреннюю инфекцию, то его необходимо обработать антибиотиками. Особенно богаты внутренней инфекцией ткани тропических и субтропических растений с крупными сосудами. Загрязнение культур грибами или бактериями обычно выявляется через 1–14 дней после посадки. Загрязненные культуры необходимо тотчас же удалить, чтобы избежать заражения воздуха в световой комнате.
Питательные среды стерилизуют в автоклаве при температуре 120 °С и давлении 0,75–1 атм в течение 20 мин. Если в состав питательной среды входят вещества, разрушающиеся при высокой температуре, их подвергают холодной стерилизации, пропуская через бактериальные фильтры с диаметром пор 0,22–0,45 мкм, после чего добавляют в проавтоклавированную охлажденную до 40 °С основную среду.
Посуду, предварительно завернутую в фольгу или оберточную бумагу, стерилизуют сухим жаром в сушильном шкафу при 160 °С в течение двух часов.
Питательные среды
Для культивирования изолированных клеток и тканей должны включать все необходимые растениям макроэлементы (азот, фосфор, калий, кальций, магний, серу, железо) и микроэлементы (бор, марганец, цинк, медь, молибден и др.), а также витамины, углеводы, фитогормоны или их синтетические аналоги. Некоторые питательные среды содержат гидролизат казеина, аминокислоты. Кроме того, в состав питательных сред входит ЭДТА (этилендиамин-тетрауксусная кислота) или ее натриевая соль, которые улучшают доступность железа для клеток.
Для получения каллусной ткани в отдельных случаях к питательной среде добавляют жидкий эндосперм кокосового ореха (кокосовое молоко), каштана и др.
Углеводы являются необходимым компонентом питательных сред для культивирования изолированных клеток и тканей, так как в большинстве случаев последние не способны к автотрофному питанию. Чаще всего в качестве углевода используют сахарозу или глюкозу в концентрации 2–3 %.
Фитогормоны необходимы для дедифференцировки клеток и для индукции клеточных делений. Поэтому для получения каллусных тканей в состав питательных сред должны обязательно входитьауксины, вызывающие клеточную дедифференцировку, и цитокинины, индуцирующие деление клеток. В случае индукции стеблевого морфогенеза содержание ауксинов в среде может быть снижено или они могут быть полностью исключены из питательной среды.
На безгормональной среде растут опухолевые и «привыкшие» ткани. Автономность по отношению к обоим гормонам или к одному из них связана со способностью этих клеток синтезировать гормоны.
В качестве источников ауксинов в питательных средах используют 2,4-дихлорфеноксиуксусную кислоту (2,4-Д), индолил-3-уксусную кислоту (ИУК), α -нафтилуксусную кислоту (НУК). Для получения рыхлого хорошо растущего каллуса чаще применяют 2,4-Д, так как ИУК почти в 30 раз менее активна, чем 2,4-Д.
В качестве источников цитокининов в искусственных питательных средах используют кинетин, 6-бензиламинопурин (БАП), зеатин. 6-БАП и зеатин проявляют более высокую активность в поддержании роста изолированных тканей и индукции органогенеза по сравнению с кинетином. В состав некоторых сред входит аденин.
В настоящее время известно большое число различных по составу питательных сред, но наиболее часто применяемая при выращивании изолированных растительных тканей в условиях in vitro среда Т. Мурасига и Ф. Скуга, впервые составленная в 1962 г. Эта среда содержит хорошо сбалансированный состав питательных веществ и отличается от других, как правило, соотношением аммонийного и нитратного азота (табл. 3.2).
Таблица 3.2. Состав питательных сред для культивирования изолированных тканей растений
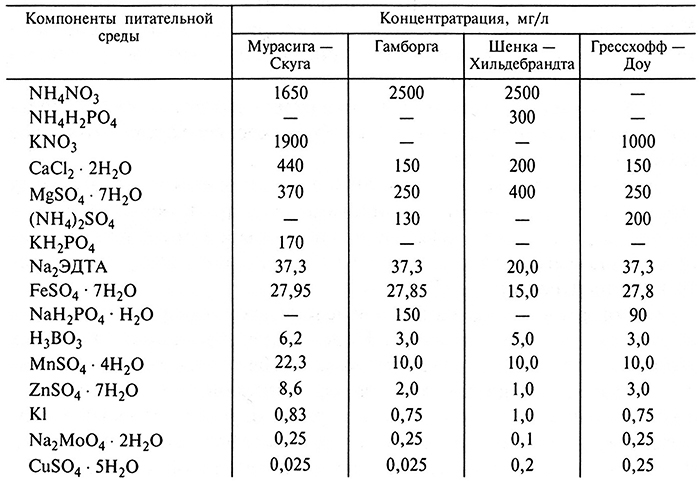
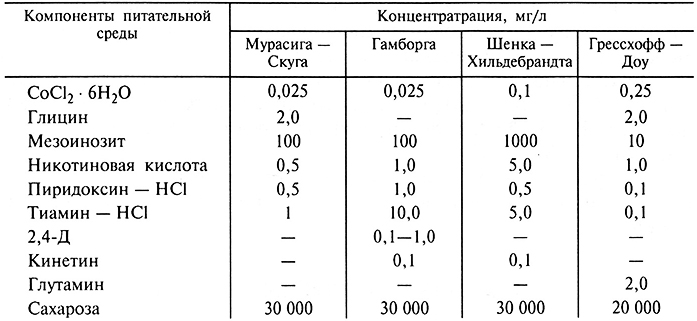
Для приготовления твердых питательных сред используют агар-агар, который представляет собой полисахарид, получаемый из морских водорослей.
С целью рационального использования времени растворы солей макро- и микроэлементов, а также витаминов и фитогормонов готовят более концентрированными, что позволяет многократно их использовать. Концентрированные (маточные) растворы хранят в холодильнике.
Условия культивирования
Для успешного культивирования изолированных клеток и тканей растений необходимо соблюдать определенные условия выращивания. Большинство каллусных тканей не нуждается в свете, так как не имеют хлоропластов и питаются гетеротрофно. Исключение составляют некоторые зеленые каллусные ткани, такие, как каллусная ткань мандрагоры. В некоторых случаях каллусные ткани, не способные к автотрофному питанию, все же выращивают на непрерывном освещении, что является необходимым условием дальнейшего успешного морфогенеза, как у люцерны. Большинство же каллусных тканей получают в темноте или при рассеянном свете.
Детерминированные к морфогенезу ткани переносят на свет и далее культивируют их при освещенности 1000–4000 лк.
Культивирование изолированных меристем и их микроразмножение также происходит на свету. Освещенность факторостатной (световой) комнаты должна составлять в зависимости от культуры 3000–10 000 лк. Необходимо учитывать фотопериод, который требуется для данного культивируемого объекта. Влажность в световой комнате должна составлять 60–70 %. Более сухой воздух способствует усыханию питательной среды в пробирках и колбах, если они закрыты ватными пробками, изменению ее концентрации и нарушению условий культивирования. Для повышения влажности в комнате можно использовать поддоны с водой.
Оптимальная температура для большинства культивируемых тканей 25–26 °С, для культуры тканей тропических растений она может достигать 29–30 °С. В случае индукции морфогенеза температуру понижают до 18–20 °С.
Наилучшие световой и температурный режимы, а также режим оптимальной влажности можно создать при помощи климатических камер.
3.4. КУЛЬТУРА КАЛЛУСНЫХ ТКАНЕЙ
Общие положения
Культура изолированных тканей обычно бывает представлена каллусными или реже опухолевыми тканями. Каллусная культура – это неорганизованная пролиферирующая ткань, состоящая из дедифференцированных клеток. В дальнейшем они специализируются как каллусные, т. е. становятся особым образом дифференцированными. Каллус, что означает «мозоль», может образовываться как на изолированных кусочках ткани (эксплантах) in vitro, так и на растении при поранении.
Каллусная ткань in vitro в основном бывает белого или желтоватого, реже светло-зеленого цвета. Очень редко она может иметь интенсивную зеленую окраску (у мандрагоры). Темно-коричневая окраска возникает чаще при старении каллусных клеток и связана с накоплением в них фенолов. Последние окисляются в хиноны. Для избавления от них в питательные среды вносят антиоксиданты.
Каллусная ткань аморфна и не имеет конкретной анатомической структуры, но в зависимости от происхождения и условий выращивания она может быть разной консистенции: 1) рыхлой, состоящей из сильно оводненных клеток, легко распадающейся на отдельные мелкие агрегаты; 2) средней плотности с хорошо выраженными меристематическими очагами; 3) плотной, в которой дифференцируются элементы камбия и проводящей системы.
Обязательным условием дедифференцировки растительной клетки и превращения ее в каллусную является присутствие в питательной среде представителей двух групп фитогормонов: ауксинов и цитокининов. Ауксины вызывают процесс дедифференцировки клетки, подготавливающий ее к делению, а цитокинины – пролиферацию (деление) дедифференцированных клеток (рис. 3.1). Если в питательную среду без гормонов поместить кусочек стебля, листа, корня (без верхушки) или любой другой растительный эксплант, состоящий из специализированных (дифференцированных) клеток, то деления клеток не произойдет и каллусная ткань не образуется. Это связано с неспособностью дифференцированных клеток к делению. Каждая клетка проходит три фазы роста: I) деление; 2) растяжение; 3) дифференцировку. Характерной чертой заключительной фазы роста является утолщение вторичной клеточной оболочки и потеря клеткой способности к делению. Для того чтобы дифференцированные клетки вновь приобрели способность к делению, необходимо, чтобы произошла их дедифференцировка, т. е. клетки как бы возвратились в меристематическое состояние. Размножение дедифференцированных клеток приводит к анархическому, неорганизованному росту, в результате чего образуется каллусная ткань. Таким образом, превращение специализированной клетки в каллусную связано с индукцией клеточного деления, способность к которому она потеряла в процессе дифференцировки.
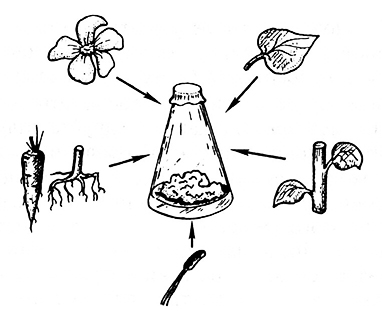
Рис. 3.1. Получение культуры каллусной ткани из различных эксплантов:
фрагментов стебля, корня, листа, лепестков, тычинок
У сердцевинной паренхимы табака (СПТ) отсутствие цитокининов в питательной среде блокирует клеточный цикл в премитотическом периоде. Поэтому, если в питательной среде присутствует только ауксин, клетки не делятся и после четырехдневной латентной фазы переходят к росту растяжением. Одни цитокинины без ауксинов приводят к такому же старению тканей СПТ, как и на среде без гормонов. Приведенные данные, полученные для СПТ, не всегда могут объяснить всех случаев, когда каллусная ткань получается на среде с одним гормоном, например каллусообразование на среде с 2,4-Д без цитокининов у незрелых зародышей пшеницы или получение каллуса на семядолях подсолнечника на среде с цитокининами, но без ауксинов. Установлено, что результаты во многом зависят от эндогенных гормонов, содержащихся в клетках того или иного экспланта, т. е. связаны с особенностями их гормонального статуса.
Имеются новые представления, согласно которым не ауксины и цитокинины, а полисахариды и какие-то другие индукторы вызывают деление клеток, приводящее к образованию каллуса.
Процесс перехода к каллусному росту в базальной части апекса начинается с остановки клеточных делений. Лаг-фаза продолжается 24–48 ч. В течение этого времени клетки увеличиваются в размерах и ткань разрыхляется. После лаг-фазы клетки начинают быстро делиться, образуя каллусную ткань. Таким образом, если дедифференцировка специализированной клетки связана с индукцией деления под влиянием фитогормонов, то дедифференцировка делящейся меристематической клетки связана с остановкой делений, деспециализацией клетки и только после этого – с индукцией делений, приводящей к каллусообразованию.
Эффект, вызываемый действием одних и тех же фитогормонов, может быть различным в зависимости от физиологической характеристики ткани-мишени. Компетентность ее в рассмотренных примерах определяется степенью дифференцировки клеток.
Переход клетки in vitro из дифференцированного состояния к дедифференцировке и активным клеточным делениям обусловлен изменением активности генов (эпигеномной изменчивостью). Активирование одних генов и репрессирование других приводит к изменению в белковом составе клеток. В каллусных клетках появляются специфические белки и одновременно исчезают или уменьшаются в количестве белки, характерные для фотосинтезирующих клеток листа. У двудольных растений процесс репрессии и дерепрессии генов, лежащий в основе дедифференцировки, происходит легче, чем у однодольных.
При переходе дедифференцированной клетки к неорганизованному анархическому размножению, приводящему к образованию каллусной ткани, в клетках происходят биохимические и цитологические изменения. Дедифференцировка начинается с использования запасных веществ и разрушения специализированных клеточных органелл. Через 6–12 ч после индукции дедифференцировки клеточная стенка разрыхляется и разбухает, увеличивается число свободных рибосом, число элементов аппарата Гольджи, а также размеры и число ядрышек. Все эти изменения предшествуют началу делений, которые начинаются через 48–72 ч. Следует учитывать, что в клетках экспланта в начале культивирования могут наблюдаться изменения в метаболизме, вызванные как дедифференцировкой, так и травматическими синтезами. Для разделения этих процессов лучше проводить прединкубацию экспланта на безгормональной среде 3–6 сут. Каллусная клетка имеет свой цикл развития и повторяет развитие любой клетки, включая деление, растяжение и дифференцировку, после чего наступает старение и гибель клетки. Каллусную дифференцировку можно назвать вторичной, но ее не следует путать со вторичной дифференцировкой клетки, лежащей в основе морфогенеза.
Для того чтобы не произошло старения, утраты способности к делению и гибели каллусных клеток, первичный каллус, возникающий на эксплантах, через 4–6 недель переносят на свежую питательную среду. Эту операцию называют пассированием. При регулярном пассировании способность к делению может поддерживаться в течение десятков лет.
Ростовая кривая каллусных клеток имеет S-образную форму (рис. 3.2). Такой характер роста легко обнаружить у суспензиозных культур каллусных клеток. Кривая роста включает пять фаз. Во время 1 -й латентной или лаг-фазы увеличения числа или массы клеток не происходит. Клетки в этот период подготавливаются к делениям. Следующая, 2-я фаза – логарифмическая, или экпоненциального роста – характеризуется наибольшей митотической активностью и увеличением массы каллусной культуры, кроме того, рост происходит с ускорением. 3-я фаза – линейная, в которой скорость роста клеток постоянна. Далее наступает 4-я фаза – замедленного роста, когда митотическая активность клеток резко снижается. В 5-й – стационарной – фазе ростовая кривая выходит на плато. В этот период начинается деградация клеток, однако она еще уравновешивается возрастанием числа клеток за счет их деления; в целом же скорость нарастания клеточной массы равна нулю. После стационарной фазы наступает гибель (деградация) клеток, во время которой число и масса живых клеток уменьшается.
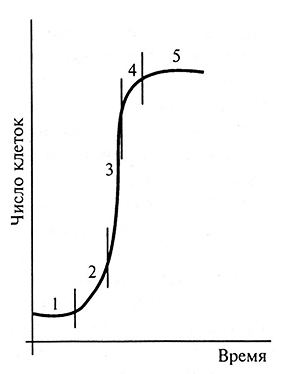
Рис. 3.2. Модельная кривая ростового цикла при периодическом выращивании каллусных тканей. Фазы роста:
1 – латентная; 2 – логарифмическая; 3 – линейная; 4 – замедления; 5 – стационарная
Особенности каллусных клеток
Каллусные клетки in vitro сохраняют многие физиолого-биохимические свойства, присущие нормальным клеткам, входящим в состав растительного организма. Каллусные клетки сохраняют способность к синтезу вторичных метаболитов. Морозостойкость и способность к закаливанию присущи каллусным клеткам, полученным от морозостойких растений. Этим свойством не обладают каллусные ткани, полученные от тропических и субтропических культур. Таким образом, устойчивость к низким температурам сохраняется при переходе клетки к каллусному росту. Каллусным тканям свойственна и фотопериодическая реакция, что связано с сохранением активности фитохрома.
Общим у каллусных и нормальных клеток растения является и еще ряд признаков, в частности, устойчивость к действию высоких температур, осмотически активных веществ, засолению.
Вместе с тем каллусные клетки обладают отдельными свойствами, отличающими их от нормальных. В них появляются специфические белки и уменьшается количество белков, характерных для фотосинтезирующих клеток листа, или они совсем исчезают. Каллусные клетки отличаются большой генетической гетерогенностью и физиологической асинхронностью.
В результате выхода из-под контроля организма рост каллусных клеток происходит неорганизованно, асинхронно и является неограниченным. При пересадках на свежую питательную среду культура каллусной ткани моркови, полученная Р. Готре более 60 лет назад, до сих пор растет в коллекции.
Клеточный цикл у каллусных клеток более длительный, чем у растений, произрастающих в открытом грунте.
Особенностью каллусных клеток является гетерогенность по возрасту. В каллусной ткани одновременно присутствуют клетки молодые в G1-фазе, старые в G2- и S-фазах цикла клеточныхделений.
Значительные отличия наблюдаются в энергетическом обмене каллусных клеток. Они потребляют меньше кислорода по сравнению с нормальными. Еще в 1938 г. Рамсторн обнаружил такую же особенность у меристематических клеток, следовательно, это свойство активно делящихся клеток. Дыхательный коэффициент (Д.К) каллусных клеток более 1. Так, в каллусе гороха Д.К > 3,5 (А.В. Романова и др., 1988). Это свидетельствует о сдвиге соотношения между дыханием и брожением в сторону усиления брожения, т. е. о снижении эффекта Пастера. Под эффектом Пастера понимают подавление брожения дыханием в присутствии кислорода. Увеличение дыхательного коэффициента при неизменном дыхательном субстрате говорит о том, что дыхание перестает подавлять брожение и даже в присутствии кислорода в каллусных клетках наряду с дыханием идет бескислородное расщепление углеводов – брожение. О бескислородном расщеплении углеводов при неорганизованном росте свидетельствует накопление этилового спирта в делящихся клетках. Такие данные получены при индукции неорганизованного роста на интактных проростках гороха (Г.М. Артамонова, 1975, 1978).
Митохондрии в каллусных клетках так же, как и в меристематических, являются слабо развитыми, в них мало крист, что не может не оказывать влияния на активность аэробного дыхания.
Наиболее выражено нарушение эффекта Пастера в опухолевых клетках животных. Это явление было обнаружено Варбургом, но до настоящего времени не имеет четкой интерпретации. Возникающий вследствие нарушения эффекта Пастера аэробный гликолиз, под которым понимают бескислородное расщепление углеводов в присутствии кислорода, приводит к очень резкому (в 19 раз) усилению потребления углеводов опухолевыми клетками.
Наряду с изменением характера дыхания в каллусных клетках в направлении усиления бескислородного расщепления углеводов происходит также сдвиг в сторону пентозофосфатного пути, который является источником пентоз, необходимых для делящихся клеток.
Генетика каллусных клеток
Длительное время считали, что каллусные клетки генетически строго однородны. Однако в 60-х годах было выяснено, что клетки каллусной ткани обладают выраженной генетической гетерогенностью. Генетическая неоднородность каллусных клеток выражается прежде всего в различной плоидности, т. е. каллусные клетки отличаются по числу хромосом. Генетически стабильными in vitro являются меристематические ткани.
В каллусных и суспензионных культурах встречаются клетки, имеющие диплоидный набор хромосом, свойственный исходному растению, а также полиплоидные клетки, содержащие 3, 4, 5 и более хромосомных наборов. Наряду с полиплоидией в культуре каллусных тканей можно нередко наблюдать анеуплоидию (возрастание или уменьшение хромосомного набора на несколько хромосом). Чем дольше культивировать каллусные клетки, тем больше они различаются по плоидности. В каллусных клетках табака через четыре года культивирования совсем не остается диплоидных клеток: все клетки становятся полиплоидными или анеуплоидными. Этот факт указывает на то, что изменение плоидности происходит под влиянием условий культивирования и прежде всего входящих в состав питательной среды веществ. Однако можно интерпретировать его и иначе. Полиплоидные клетки имеют меньшую лаг-фазу и поэтому быстрее переходят к делениям, чем диплоидные. Вследствие этого они и получают преимущество в дальнейших пассажах. Скорее всего влияние оказывают обе причины.
Кроме изменения плоидности, культивирование клеток и тканей растений in vitro вызывает появление в клетках хромосомных аббераций. Последние сказываются на биологических особенностях культивируемых тканей, изменяя их внешний вид, обмен веществ, скорость роста. Наряду с видимыми под микроскопом хромосомными мутациями в культивируемых клетках могут возникать изменения, не выявляемые микроскопически. Эти изменения могут затрагивать как незначительные участки хромосом, так и структуру генов. Генные мутации выявляются по изменению морфологии и физиолого-биохимических свойств клеток.
Каковы же причины генетической нестабильности культивируемых клеток? Таких причин несколько. Прежде всего – это генетическая неоднородность исходного материала (гетерогенность экспланта). У многих растений дифференцированные ткани характеризуются наличием клеток разной плоидности и лишь активно пролиферирующие в течение онтогенеза ткани; такие, как верхушечные меристемы, камбий и другие остаются всегда диплоидными. Другой причиной может быть длительное пассирование тканевых и клеточных культур, приводящее к накоплению в них генетических изменений, в том числе к неравномерному изменению плоидности. Нарушение коррелятивных связей при изолировании участков тканей растений и помещении их на питательную среду также приводит к генетической нестабильности клеток. Подобные результаты могут быть связаны и с влиянием на генетический аппарат клетки входящих в состав питательных сред фитогормонов. В качестве гормонов в питательные среды для каллусообразования обязательно входят ауксины и цитокинины. О мутагенном действии этих веществ известно из целого ряда работ. Наиболее активным мутагенным препаратом является 2,4-Д, входящий в состав большинства питательных сред. Цитокинины, в частности кинетин, способствуют полиплоидизации клеток.
Генетическое разнообразие каллусных клеток позволяет использовать их для клеточной селекции на устойчивость к неблагоприятным факторам среды, фитопатогенам и на повышенную продуктивность.
3.5. ГОРМОНОНЕЗАВИСИМЫЕ РАСТИТЕЛЬНЫЕ ТКАНИ
Каллусные клетки могут делиться только при наличии гормонов в питательной среде. Однако при длительном культивировании они в ряде случаев могут приобрести способность расти на среде без гормонов, т. е. становятся автономными по отношению к ауксинам и цитокининам. Такие клетки называются «привыкшими». Нередко ткани, образованные «привыкшими» клетками, называют химическими опухолями. «Привыкшие» ткани, как и опухолевые, в большинстве случаев не способны к нормальной регенерации и образуют лишь тератомы, хотя по некоторым данным из них в отдельных случаях получаются нормальные регенеранты.
Следует отметить, что у всех каплусных тканей в процессе культивирования, у некоторых культур уже начиная с 4-го пассажа, заметно снижается, а затем и полностью утрачивается способность к регенерации. Из старых пересадочных культур получить растения-регенеранты не удается.
Пока нет четкого ответа о причинах «привыкания». Возможно, что оно связано с длительным действием на клетки гормонов, поддерживающих их в дедифференцированном или активно пролиферирующем состоянии.
Кроме «привыкших» тканей, представляющих собой химические опухоли, существуют опухоли растительного происхождения, вызванные бактериями, вирусами, а также генетические опухоли, возникающие на межвидовых гибридах различных растений. Наиболее распространенными в природе и представляющими наибольший интерес для исследователей являются корончатые гаплы-опухоли, индуцированные у двудольных растений агробактериями (Agrobacterium tumefaciens). Часто встречаются еще два вида истинных опухолей у растений – бородатый корень (заболевание, вызываемое А. rhizogenes) и стеблевой галл, вызываемый A. ruby, сходный с корончатым галлом.
Общим свойством «привыкших» и опухолевых растительных тканей является их гормононезависимость, т. е. способность расти на средах без гормонов. Это основное их отличие от каллусных тканей, для которых присутствие гормонов в питательной среде является необходимым условием дедифференцировки и пролиферации клеток.
В «привыкших» тканях так же, как и в опухолевых, идет интенсивный синтез собственных гормонов, поэтому они не нуждаются во внесении их в питательные среды.
Внешне гормононезависимые ткани не отличаются от каллусных, и основным их отличием является приобретение способности к интенсивному синтезу гормонов. Это свойство является общим как для «привыкших», так и для опухолевых клеток. Однако пути для решения этой задачи у них различны. У «привыкших» тканей гормононезависимость достигается в результате изменения активности генов, отвечающих за синтез ферментных белков, участвующих в построении молекул гормонов, следовательно, отвечающих за синтез гормонов. Таким образом, изменения в данном случае имеют эпигеномный характер, хотя нельзя исключить и возможность мутаций. Для того чтобы ответить на вопрос, являются ли изменения в «привыкших» клетках эпигеномными или генетическими, можно проверить, сохраняется ли свойство гормононезависимости в ряду: клетка – растение – клетка. С этой целью необходимо получить регенерацию в «привыкшей» ткани, а затем эксплант от регенерировавшего растения поместить на питательную среду без гормонов или без одного из гормонов. Если в такой среде клетки будут делиться, т. е. окажутся автономными по отношению к гормонам, то это означает, что свойство гормононезависимости передается по наследству следующим поколениям, следовательно, оно имеет генетическое происхождение. Если же на безгормональной среде клетки делиться не будут и каллусной ткани не образуют, т. е. гормононезависимость не наследуется, то это позволяет сделать вывод об эпигеномном характере изменений. Проведенные эксперименты говорят в пользу эпигеномного характера гормононезависимости в «привыкших» тканях. Однако таким путем можно проверить только те «привыкшие» клетки, которые не утратили способность к регенерации. В то же время подавляющее большинство «привыкших» клеток теряет способность к регенерации, что затрудняет использование предложенного метода для определения характера природы гормононезависимости.
В опухолевых тканях синтез гормонов связан с переносом в растительную клетку бактериального гена, отвечающего за этот процесс.
В 40-х годах XX в. Б. Браун, ученик Ф. Уайта, показал, что культура ткани корончатогалловой опухоли даже в отсутствие агробактерий, например после гибели их под воздействием повышенной температуры, сохраняет опухолевые свойства. На искусственной питательной среде без гормонов ткань корончатого галла, лишенная бактерий, продолжала интенсивно пролиферировать. Ткани корончатых галлов содержат более высокие уровни ауксинов, чем нормальные, и продуцируют несколько цитокининов. На основании своих опытов Б. Браун пришел к выводу, что растительные клетки каким-то образом трансформируются (превращаются) в опухолевые после воздействия Agrobacterium tumefaciens. Было выдвинуто предположение, что агробактерии вводят в клетки растения фактор Tip (Tumor inducing principle), который за 36 ч превращает нормальные клетки в опухолевые. В дальнейшем оказалось, что Tip представляет собой ДНК и находится в большой плазмиде агробактерии (Ti-плазмида). Онкогенная активность может быть утрачена в результате удаления из бактериальной клетки всей Ti-плазмиды или ее определенной части.
В 1977 г. Чилтон с сотр. доказали, что опухоли корончатого галла возникают в результате включения определенного фрагмента Ti-плазмиды агробактерии в растительную ядерную ДНК.
Таким образом, сегмент Ti-плазмиды (Т-ДНК) интегрируется в хромосому и становится частью наследственного аппарата трансформированной (опухолевой) растительной клетки. Интеграция Т-ДНК Ti-плазмиды агробактерии в хромосому растения приводит к появлению опухоли и гормононезависимому росту опухолевых клеток на искусственных питательных средах. Оба эти явления тесно связаны друг с другом, так как именно гор мононезависимость, являющаяся следствием экспрессии генов, контролирующих синтез ауксинов и цитокининов, приводит к дедифференцировке и пролиферации клеток.
Ti-плазмида является природным вектором (переносчиком) новых генов в растения. Путь синтеза ауксинов и цитокининов клетками опухолей, индуцированных агробактериями, иной, чем у нормальных и «привыкших» клеток. Он более простой и короткий. С помощью мутагенов стало возможным идентифицировать участки Т-ДНК, контролирующие изменения гормональной активности. Было выяснено, что не один локус, а ряд генов ответственны за опухолевый рост.
Кроме ауксинов и цитокининов Т-ДНК детерминирует синтез галлами нового класса аминокислот, не встречающихся в природе, – опинов. Эти вещества не являются причиной возникновения опухолей: они синтезируются в уже образовавшейся опухолевой ткани. Опухоли начинают синтез опинов в возрасте нескольких дней, например, на коланхоэ синтез опинов начинается на 7-й день с момента индукции опухолей. Опины – производные аминокислот, различных кетокислот и Сахаров. Они являются биологически активными соединениями нового типа, обнаруживаемыми только в тканях корончатых галлов у растений, поэтому их можно рассматривать как биохимические маркеры для клеток корончатых галлов. Опины служат питательным веществом для агробактерии, однако опухоли продолжают продуцировать эти соединения и в стерильных культурах, не содержащих агробактерии. Известно три типа опинов: нопалин, октопин и агропин. Одни штаммы бактерий индуцируют октопинпродуцирующие опухоли, другие – нопалинпродуцирующие.
Итак, первое общее свойство «привыкших» и опухолевых тканей, индуцированных агробактериями, заключается в гормононезависимости, связанной с приобретением способности интенсивно синтезировать гормоны. В галловых опухолях такая способность возникает в результате переноса чужеродного гена из бактериальной клетки в растительную. В клетках химических опухолей («привыкших» тканях) это же свойство связано, как полагают, с депрессией генов, отвечающих за синтез гормонов, однако оно может быть связано и с мутациями.
Второе общее свойство, которое вытекает из первого,– потеря способности «привыкших» и опухолевых клеток, индуцированных агробактериями, регенерировать фертильные растения. Галловые опухоли в подавляющем большинстве случаев не способны к регенерации нормального растения. Иногда они образуют тератомы (уродливые органоподобные структуры), которые не могут развиваться нормально.
«Привыкшие» ткани обычно также не регенерируют нормальных растений, их клетки утрачивают способность ко вторичной дифференцировке и морфогенезу. Однако в некоторых случаях, варьируя составы питательных сред, удается отодвинуть порог «привыкания». Следовательно, имеется резерв, использование которого позволит получать растения-регенеранты из все более длительно пассируемых тканевых культур.

