Для семенных растений характерно два способа размножения: семенной и вегетативный. Оба эти способа имеют как преимущества, так и недостатки. К недостаткам семенного размножения следует отнести, в первую очередь, генетическую пестроту получаемого посадочного материала и длительность ювенильного периода. При вегетативном размножении сохраняется генотип материнского растения и сокращается продолжительность ювенильного периода. Однако для большинства видов (в первую очередь для древесных пород) проблема вегетативного размножения остается до конца не решенной. Это обусловлено следующими причинами: 1) не все породы, даже на ювенильной стадии, могут размножаться вегетативным способом с требуемой эффективностью (дуб, сосна, ель, орехоплодные и др.); 2) практически невозможно черенкованием размножать многие виды древесных пород в возрасте старше 10–15 лет; 3) не всегда удается получать стандартный посадочный материал (возможность накопления и передачи инфекции); 4) трудоемкостью и сложностью операций при размножении взрослых (древесных) растений при помощи прививок; 5) неэффективностью разработанных технологий для получения необходимого количества генетически однородного материала в течение года.
Достижения в области культуры клеток и тканей привели к созданию принципиально нового метода вегетативного размножения – клонального микроразмножения (получение в условиях in vitro (в пробирке), неполовым путем растений, генетически идентичных исходному экземпляру). В основе метода лежит уникальная способность растительной клетки реализовывать присущую ей тотипотентность, т. е. под влиянием экзогенных воздействий давать начало целому растительному организму. Этот метод, несомненно, имеет ряд преимуществ перед существующими традиционными способами размножения:
- получение генетически однородного посадочного материала;
- освобождение растений от вирусов за счет использования меристемной культуры;
- высокий коэффициент размножения (105–106 – для травянистых, цветочных растений, 104 –105 – для кустарниковых древесных, 104 – для хвойных);
- сокращение продолжительности селекционного процесса;
- ускорение перехода растений от ювенильной к репродуктивной фазе развития;
- размножение растений, трудно размножаемых традиционными способами;
- возможность проведения работ в течение года и экономия площадей, необходимых для выращивания посадочного материала;
- возможность автоматизации процесса выращивания.
Первые достижения в области клонального микроразмножения были получены в конце 50-х годов XX столетия французским ученым Жоржем Морелем, которому удалось получить первые растения-регенеранты орхидей. Успеху Ж. Мореля в микроразмножении способствовала уже разработанная к тому времени техника культивирования апикальной меристемы растений в условиях in vitro. Как правило, исследователи в качестве первичного экспланта использовали верхушечные меристемы травянистых растений: гвоздики, хризантемы, подсолнечника, гороха, кукурузы, одуванчика, салата и изучали влияние состава питательной среды на процессы регенерации и формирования растений. Ж. Морель в своих работах также использовал верхушку цимбидиума (сем. орхидные), состоящую из конуса нарастания и двух-трех листовых зачатков, из которой при определенных условиях наблюдал образование сферических сфер – протокормов. Сформировавшиеся протокормы можно было делить и затем культивировать самостоятельно на вновь приготовленной питательной среде до образования листовых примордиев и корней. В результате им было обнаружено, что этот процесс бесконечен и можно получать в большом количестве высококачественный и генетически однородный, безвирусный посадочный материал.
В нашей стране работы по клональному микроразмножению были начаты в 60-х годах XX в. в лаборатории культуры тканей и морфогенеза Института физиологии растений им. К.А. Тимирязева РАН. Под руководством проф. Р.Г. Бутенко были изучены условия микроразмножения картофеля, сахарной свеклы, гвоздики, герберы, фрезии и некоторых других растений и предложены промышленные технологии.
Таким образом, первые успехи в клональном микроразмножении связаны с культивированием апикальных меристем травянистых растений на соответствующих питательных средах, обеспечивающих в конечном итоге получение растений-регенерантов.
Однако область применения микроразмножения разнообразна и имеет тенденцию к постоянному расширению. Это в первую очередь относится к размножению in vitro взрослых древесных пород, особенно хвойных, и использованию техники in vitro для сохранения редких и исчезающих видов лекарственных растений. В настоящее время в этом направлении наметился положительный сдвиг.
Первые работы по культуре тканей древесных растений были опубликованы в середине 20-х годов XX столетия и связаны с именем французского ученого Р. Готре. В них сообщалось о способности камбиальных тканей некоторых видов вяза и сосны к каллусогенезу in vitro. В последующих работах 40-х годов было выяснено о способности различных тканей вяза листового к образованию адвентивных почек. Однако дальнейший рост и формирование побегов авторами не были получены. Лишь к середине 60-х годов Э. Матесу удалось получить первые растения-регенеранты осины, которые были доведены до почвенной культуры. Культивирование тканей хвойных пород in vitro долгое время не использовалось как объект исследования. Это было связано со специфическими трудностями культивирования ювенильных и тем более взрослых тканей, изолированных с растения. Известно, что древесные, и особенно хвойные, характеризуются медленным ростом, трудно укореняются, содержат большое количество вторичных соединений (фенолы, терпены и другие вещества), которые в изолированных тканях окисляются различными фенолазами. В свою очередь, продукты окисления фенолов обычно ингибируют деление и рост клеток, что ведет к гибели первичного экспланта или к уменьшению способности тканей древесных пород к регенерации адвентивных почек, которая с возрастом растения-донора постепенно исчезает полностью. Однако, несмотря на все трудности, ученые все чаще используют в качестве объектов исследований различные ткани и органы древесных растений. В настоящее время насчитывается более 200 видов древесных растений из 40 семейств, которые были размножены in vitro (каштан, дуб, береза, клен, осина, гибриды тополей с осиной, сосна, ель, секвойя и др.), а работы в этом направлении ведутся в научных учреждениях Москвы, Санкт-Петербурга, Воронежа, Уфы, Новосибирска, Архангельска, Киева, Одессы, Ялты и др.
Этапы и методы клонального микроразмножения растений
Процесс клонального микроразмножения можно разделить на четыре этапа: 1) выбор растения-донора, изолирование эксплантов и получение хорошо растущей стерильной культуры; 2) собственно микроразмножение, когда достигается получение максимального количества мериклонов; 3) укоренение размноженных побегов с последующей адаптацией их к почвенным условиям, а при необходимости депонирование растений-регенерантов при пониженной температуре (+2°, + 10 °С); 4) выращивание растений в условиях теплицы и подготовка их к реализации или посадке в поле (рис. 3.10).
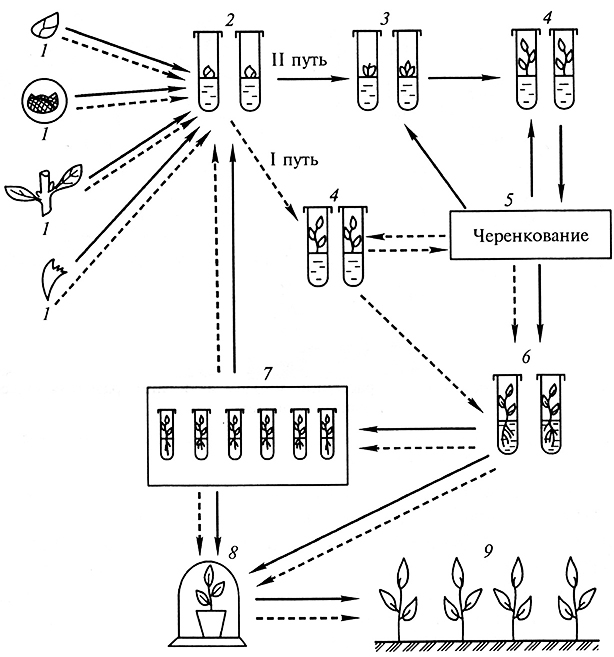
Рис. 3.10. Схема клонального микроразмножения растений методом активации развития
существующих меристем (1 путь), индукции возникновения адвентивных почек на экспланте (II путь):
1 – выбор исходного эксплантна; 2– получение стерильной культуры;
3– образование адвентивных почек непосредственно на первичном экспланте;
4 – рост почек и формирование микропобегов;
5– размножение микропобегов (черенкование);
6– укоренение микропобегов;
7–депонирование растений-регенерантов при пониженной температуре;
8– перевод растений в тепличные условия; 9– высадка растений-регенерантов в поле
Существует много методов клонального микроразмножения. Различные авторы, проводя индивидуальные исследования по влиянию условий культивирования эксплантов на процессы морфогенеза, наблюдали разные ответные морфогенетические реакции на изменение условий выращивания, что в свою очередь привело к созданию новых классификаций методов клонального микроразмноженя. Исходя из предложенных в литературе методов микроразмножения растений, этот процесс возможно осуществлять следующими путями:
- активация развития уже существующих в растении меристем (апекс-стебля, пазушные и спящие почки и интеркамерные зоны стебля);
- индукция возникновения адвентивных почек непосредственно тканями экспланта;
- индукция соматического эмбриогенеза;
- дифференциация адвентивных почек в первичной и пересадочной каллусной тканях.
Основной метод, используемый при клональном микроразмножении растений,– это активация развития уже существующих в растении меристем, основывающийся на снятии апикального доминирования (рис. 3.11). Это может быть достигнуто двумя путями: а) удалением верхушечной меристемы стебля и последующим микрочеренкованием побега in vitro на безгормональной среде; б) добавлением в питательную среду веществ цитокининового типа действия, индуцирующих развитие многочисленных пазушных побегов. Как правило, в качестве цитокининов используют6-бензиламинопурин (БАП) или 6-фурфуриламинопурин (кинетин), а также 2-изопентениладенин (2ip) и зеатин. Полученные таким образом побеги отделяют от первичного материнского экспланта и вновь культивирует на свежеприготовленной питательной среде, стимулирующей пролиферацию пазушных меристем и возникновение побегов более высоких порядков. В настоящее время этот метод широко используется в производстве безвирусного посадочного материала сельскохозяйственных культур как технических (сахарная свекла, хмель, табак, топинамбур, стахис), так и овощных (томаты, картофель, огурец, перец, тыква, спаржа и др.), а также для размножения культур промышленного цветоводства (гвоздика, хризантема, роза, гербера), тропических и субтропических растений (рододендрон, азалия, камелия, чай и др.), плодовых и ягодных культур (яблоня, слива, вишня, груша, виноград, малина, смородина, крыжовник и др.) и древесных растений (тополь, ива, ольха, береза, рябина, секвойя, туя, можжевельник и др.) (рис. 3.12, а, б). Для некоторых сельскохозяйственных культур, таких, как картофель, технология клонального микроразмножения поставлена на промышленную основу. Применение метода активации развития существующих в растении меристем позволяет получать из одной меристемы картофеля более 105 растений в год, причем технология предусматривает получение в пробирках микроклубней – ценного безвирусного семенного материала (рис. 3.12, в).
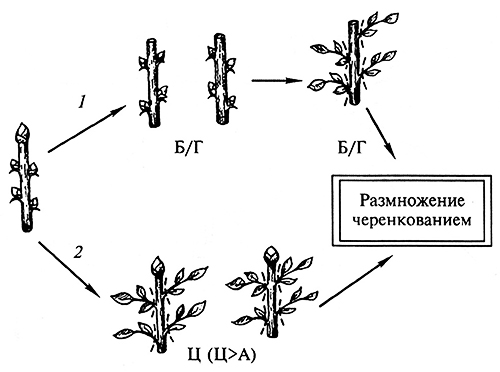
Рис. 3.11. Схема размножения растений методом активации развития существующих меристем:
1 – удаление верхушечной меристемы;
2 – добавление в питательную среду цитокининов (Б/Г –безгормональная среда, Ц – цитокицины, А –ауксины)

Рис. 3.12. Размножение растений in vitro методом активации развития существующих меристем:
а – роза; б – гранат; в – картофель
Второй метод – это индукция возникновения адвентивных почек непосредственно тканями экспланта (рис. 3.13, а, б). Он основан на способности изолированных частей растения при благоприятных условиях питательной среды восстанавливать недостающие органы и таким образом регенерировать целые растения. Образования адвентивных почек можно добиться почти из любых органов и тканей растения (изолированного зародыша, листа, стебля, семядолей, чешуек и донца луковицы, сегментов корней и зачатков соцветий), если их удается получить свободными от инфекции. Этот процесс, как правило, происходит на питательных средах, содержащих один цитокинин или в сочетании с ауксином, находящихся в соотношении 10 : 1 или 100 : 1. В качестве ауксина в этом случае наиболее часто используют Р-индолил-З-уксусную кислоту (ИУК) или α-нафтилуксусную кислоту (НУК). Это наиболее распространенный метод микроразмножения высших растений, которым были размножены многие луковичные цветочные растения (нарциссы, лилии, гиацинт, гладиолусы, тюльпаны) из луковичных чешуй, сегментов базальной части донца луковиц, эксплантов листьев; представители рода Brassica (капуста цветная, кочанная, брюссельская, листовая, брокколи – из сегментов гипокотиля, семядолей, листьев; лук, чеснок – из верхушечной меристемы, ткани донца луковиц; томаты – из апикальных или пазушных меристем; салат цикорный – из сегментов листовых пластинок; петуния – из сегментов корней; глоксиния, фиалки – из сегментов листовых пластинок, а также некоторые представители древесных растений – из изолированных зрелых и незрелых зародышей (рис. 3.13, в).

Рис. 3.13. Размножение растений in vitro методом индукции возникновения адвентивных почек
а – гиацинт; б – орхидея; в – сосна
Хорошо разработана технология клонального микроразмножения земляники, основанная на культивировании апикальных меристем (рис. 3.14). Меристематические верхушки изолируют из молодых свободных от вирусных болезней растений и выращивают на модифицированной питательной среде Т. Мурасига и Ф. Скуга, содержащей БАП в концентрации 0,1–0,5 мг/л. Через 3–4 недели культивирования меристема развивается в проросток, в основании которого формируются адвентивные почки, которые быстро растут и дают начало новым почкам. В течение 6–8 недель образуется конгломерат почек, связанных между собой соединительной тканью и находящихся на разной стадии развития. Появляются листья на коротких черешках, в нижней части которых формируются новые адвентивные почки. Эти почки разделяют и пересаживают на свежую питательную среду. На среде с цитокинином продолжается пролиферация придаточных побегов, а на среде без регуляторов роста в течение 4–6 недель формируются нормальные растения с корнями и листьями.
Морфогенетическая активность экспланта сохраняется в течение 3–4 лет. Таким образом, от одного матери некого растения можно получать несколько миллионов растений-регенерантов в год.

Рис. 3.14. Клональное микроразмножение земляники
Несомненный интерес у исследователей вызывает вопрос, связанный с происхождением адвентивных почек, и, в частности, какие клеточные слои участвуют в дифференциации меристем. Единого мнения по этому вопросу пока нет. Так, Тран Тан Ван в своих работах с тканями табака показала, что именно эпидермис является наиболее активной тканью, способной образовывать почки, каллус или корни в зависимости от гормонального баланса питательной среды. Цитологические исследования, проведенные на сегментах базальной части донца луковиц тюльпанов и нарциссов показали, что адвентивные побеги формируются из поверхностных слоев меристематических клеток, прилегающих к донцу, а для растений глоксинии процесс формирования адвентивных почек, как правило, происходит в субэпидермальных клеточных слоях листовых пластинок. Единого мнения по этому вопросу также нет и среди исследователей, работающих с древесными растениями. Так, было показано, что образование почек на изолированной хвое ели обыкновенной происходит в эпидермальном слое культивируемого экспланта, для псевдотсуги – в субэпидермальных слоях, а при культивировании семядолей сосны замечательной на среде, содержащей один цитокинин (БАП), этот процесс происходит одновременно как в эпидермальном, так и в субэпидермальном слоях. Для сосны обыкновенной также было отмечено образование адвентивных почек в эпидермальном и субэпидермальном слоях семядолей зародыша (рис. 3.15), и этот процесс для сосны не зависит от применяемых цитокининов.

Рис. 3.15. Образование адвентивных почек в эпидермальном и субэпидермапьном клеточных слоях экспланта
Третий метод, практикуемый при клональном микроразмножении, основывается на дифференциации из соматических клеток зародышеподобных структур, которые по своему внешнему виду напоминают зиготические зародыши. Этот метод получил название – соматический эмбриогенез. Основное отличие образования зародышей in vitro от in vivo (в естественных условиях) заключается в том, что соматические зародыши развиваются асексуально вне зародышевого мешка и по своему внешнему виду напоминают биополярные структуры, у которых одновременно наблюдается развитие апикальных меристем стебля и корня. Согласно Ф. Стэварду, соматические зародыши проходят три стадии развития: глобулярную, сердцевидную, торпедовидную и в конечном итоге имеют тенденцию к развитию в проросток. Это явление впервые было отмечено в культуре клеток моркови еще в середине 50-х годов XX в., а в настоящее время используется для размножения большинства растений из семейства Orchidaceae и Rutaceae, некоторых представителей злаковых (пшеница, ячмень), люцерны, редиса, винограда, а также некоторых видов древесных пород (осина, эвкалипт, дуб, ель обыкновенная).
Формирование эмбриоидов в культуре тканей происходит в два этапа. На первом этапе клетки экспланта дифференцируются за счет добавления в питательную среду ауксинов, как правило, 2,4-дихлорфеноксиуксусной кислоты (2,4-Д) и превращаются в эмбриональные. Наследующей стадии необходимо заставить сформировавшиеся клетки развиваться в эмбриоиды, что достигается уменьшением концентрации ауксина или полного его исключения из состава питательной среды. Соматический эмбриогенез возможно наблюдать непосредственно в тканях первичного экспланта, а также в каллусной культуре. Причем последний способ менее пригодный при клональном микроразмножении, так как посадочный материал, полученный таким методом, будет генетически нестабилен по отношению к растению-донору. Как правило, соматический эмбриогенез происходит при культивировании каллусных клеток в жидкой питательной среде (суспензия) и является наиболее трудоемкой операцией, так как не всегда удается реализовывать свойственную клеткам тотипотентность. Однако этот метод размножения имеет свои преимущества, связанные с сокращением последнего (третьего) этапа клонального микроразмножения, не требующего подбора специальных условий укоренения и адаптации пробирочных растений, так как соматические зародыши представляют собой полностью сформированные растеньица. При использовании соответствующей техники их капсулирования из этих эмбриоидов возможно получать искусственные семена.
Четвертый метод клонального микроразмножения – дифференциация адвентивных почек в первичной и пересадочной каллусной тканях. Он мало используется для получения посадочного материала in vitro. Это связано с тем, что при периодическом пересаживании каллусной ткани на свежую питательную среду часто наблюдаются явления, нежелательные при микроразмножении: изменение плоидности культивируемых клеток, структурные перестройки хромосом и накопление генных мутаций, потеря морфогенетического потенциала культивируемыми клетками. Наряду с генетическими изменениями растений наблюдаются и морфологические: низкорослость, неправильное жилкование листьев и их расположение по стеблю, образование укороченных, утолщенных междоузлий, уродливость, пониженная устойчивость к болезням и вредителям. Причем длительное культивирование каллусных клеток усугубляет эти изменения, поэтому период неорганизованного роста при микроразмножении должен быть сведен к минимуму.
Однако, несмотря на некоторые недостатки, данный метод имеет положительные стороны и преимущества. Во-первых, он является эффективным и экономически выгодным, так как в процессе размножения из каждой индивидуальной каллусной клетки при благоприятных условиях культивирования может сформироваться адвентивная почка, дающая начало новому растению. Во-вторых, в ряде случаев он является единственно возможным способом размножения растений в культуре тканей. В-третьих, представляет большой интерес для селекционеров, так как растения, полученные данным методом, различаются генетически и морфофизиологически. Это дает возможность селекционерам проводить отбор растений по хозяйственно-важным признакам и оценивать их поведение в полевых условиях. Этот метод целесообразно применять лишь к тем растениям, для которых показана генетическая стабильность каллусной ткани, а вариабельность между растениями-регенерантами не превышает уровня естественной изменчивости. К таким растениям можно отнести амариллис, томаты, спаржу, некоторые древесные породы и другие культуры. Через каллусную культуру были размножены сахарная свекла, некоторые представители рода Brassica, кукуруза, рис, пшеница и другие злаковые, подсолнечник, лен, разработаны условия, способствующие регенерации растений из каллуса огурца, картофеля, томатов.
Оздоровление посадочного материала от вирусов
Основное преимущество клонального микроразмножения – это получение генетически однородного, безвирусного посадочного материала. Этого возможно достичь, используя меристемные ткани апексов и пазушных почек органов стеблевого происхождения. Как правило, меристема состоит из конуса нарастания, а также одного или двух листовых зачатков (примордиев) и является свободной от инфекции.
Предположение о возможности отсутствия вирусов в меристематических тканях больных растений впервые высказано Н. Чунгом (1938) и П. Р. Уайтом (1943). Начиная с 50-х годов XX века были предприняты первые успешные опыты по получению свободных от вирусов растений георгина из точки роста. Авторы этого метода Ж. Морель и С. Мартин полагали, что в больном растении вирус распространяется с отставанием от быстро растущих молодых органов, особенно в молодых недифференцированных тканях, где концентрация вируса может снижаться, вплоть до полного отсутствия. Теоретические концепции, положенные в основу этого метода, стали проясняться в последнее время.
Структурной основой используемого на практике явления служит специфика строения точки роста растений; дистальная ее часть, представленная апикальной меристемой, у разных растений имеет средний диаметр до 200 мкм и высоту от 20 до 150 мкм. В более нижних слоях дифференцирующиеся клетки меристемы образуют прокамбий, дающий начало пучкам проводящей системы. Известно, что успех кпонального микроразмножения зависит от размера меристематического экспланта, чем больше листовых зачатков и тканей стебля, тем легче идет процесс морфогенеза, заканчивающийся получением целого, нормального пробирочного растения. Вместе с тем зона, свободная от вирусных частиц, очень различна для разных вирусов. Это зависит также от вида и сорта растения. В колеоптиле злаков, например, размеры участка верхушки, не содержащей сосуды, могут достигать до 250 мкм. Такая особенность строения апикальной меристемы исключает проникновение в нее вируса путем быстрого транспортирования по проводящей системе, но допускает возможность медленного распространения через плазмодезмы, соединяющие меристематические клетки. При культивировании апикальной меристемы картофеля величиной 200 мкм на питательной среде и дальнейшее получение из нее растений-регенерантов показали, что среди полученных растений только 10 % были свободны от Х-вируса, но 70 % – от Y-вируса.Применение электронной микроскопии часто обнаруживает наличие вирусов в меристеме пораженных ими растений, это, впрочем, подтверждает общеизвестный факт, что число лишенных вируса растений после подобной операции чрезвычайно мало, и многие меристемы пораженных растений инфекционны.
Таким образом, эффективность применения апикальной меристемы в качестве метода оздоровления зараженных вирусами растений оказывается низкой. Это было доказано результатами, полученными рядом меристемных лабораторий Российской Федерации и Крыма, показывающими, что из апикальных меристем растений гвоздики, цимбидиума, пораженных вирусами CarMV и CarVMV, в условиях in vitro получают инфицированные мериклоны.
Практически возможно получение безвирусной апикальной меристемы от больного растения, но при этом риск попадания вирусов в здоровые ткани должен быть снижен до нуля. Это может быть достигнуто путем применения предварительной термотерапии исходных растений или хемотерапии.
Метод термотерапии применяется как в условиях in vivo, так и in vitro и предусматривает использование сухого горячего воздуха. Для объяснения механизма освобождения растений от вирусов в процессе термотерапии существуют различные гипотезы. Согласно одной из них, высокие температуры воздействуют непосредственно на вирусные частицы через их рибонуклеиновую кислоту и белковую оболочку, вызывая физическое разрушение и лишая вирусные частицы инфекционности. Вторая гипотеза состоит в том, что высокая температура действует на вирусы через метаболизм растений. Под влиянием высоких температур нарушается равновесие между синтезом и деградацией вирусных частиц. Если преобладает синтез, то концентрация вируса в зараженных тканях растет, и наоборот.
Растения, подвергающиеся термотерапии, помещают в специальные термокамеры, где в течение первой недели повышают температуру от 25 до 37 °С путем ежедневного увеличения температуры на 2 °С. Не менее важно при термотерапии создавать и поддерживать на протяжении всего процесса оптимальные режимы: температуру 37 °С, освещенность лампами дневного света 5 тыс. лк, фотопериод в зависимости от культуры 14–16 ч в сутки при относительной влажности воздуха в термокамере 90 %.
Продолжительность термотерапии всецело зависит от состава вирусов и их термостойкости. Если, например, для гвоздики достаточно 10–12-недельного воздействия теплом, то для освобождения хризантемы от Б-вируса этот период длится 12 недель и более. Однако существуют растения, например луковичные культуры, цимбидиум, розы и другие, рост которых угнетается в результате длительной термотерапии in vivo. Для таких растений целесообразно проводить термотерапию растений-регенерантов in vitro.
Помимо положительного действия термотерапии на освобождение растений от вирусов выявлен положительный эффект высоких температур на точку роста и процессы морфогенеза некоторых цветочных культур (гвоздики, хризантемы, фрезии) в условиях in vitro. Применение термотерапии позволяет увеличить коэффициент размножения на 50–60 %, повысить адаптацию пробирочных растений-регенерантов к почвенным условиям, а также получить более высокий процент безвирусных маточных растений.
Применение термотерапии в сочетании с меристемной культурой позволяет оздоровить более 70 % растений-регенерантов хмеля от вирусного хлороза, 90 % растений земляники, 25 % – черной и красной смородины, 50 % – малины, более 80 % – картофеля. Проверку растений на наличие вирусов, как правило, проводят при помощи иммуноферментного анализа, электронной микроскопии и травянистых растений-индикаторов.
Другой способ, применяемый для освобождения растений от вирусов,– хемотерапия. Он заключается в добавлении в питательную среду, на которой культивируют апикальные меристемы, аналога гуанозина – 1Р-Д-рибофуранозил-1,2,4-триазол-3-карбоскимид (коммерческое название вирозол) в концентрации 20–50 мг/л. Это противовирусный препарат широкого спектра действия. При использовании вирозола в культуральной среде процент безвирусных меристемных растений для ряда обычных для этих растений вирусов увеличивался до 80–100 % при 0–41 % в контроле. Положительные результаты хемотерапии были получены для сливы, черешни, малины, некоторых цветочных и других растений. Термо- и хемотерапевтические методы оздоровления посадочного материала от вирусов экономически малоэффективны. Поэтому в настоящее время с помощью методов трансгеноза создаются формы растений с генетической устойчивостью к вирусам.
Техника культивирования растительных тканей
на разных этапах клонального микроразмножения
Для культивирования тканей на каждом из четырех этапов требуется применение определенного состава питательной среды.
1 э т а п. На этом этапе необходимо добиться получения хорошо растущей стерильной культуры. Это осуществляется путем стерилизации растительных тканей ртутьсодержащими растворами (сулема, или диацид, 0,1–0,2%-я) или хлорсодержащими (хлорамин 10– 15%-й, гипохлорит натрия или кальция 5–10%-й) в течение 5– 10 мин для нежных, легко повреждаемых тканей растений и 10–12 мин – для тканей, имеющих более плотную оболочку. После этого растительные ткани необходимо тщательно промыть в стерильной дистиллированной воде, как правило, в трех порциях и перенести на заранее приготовленную стерильную питательную среду. Если исходную стерильную культуру экспланта получить трудно, рекомендуется вводить в состав питательной среды антибиотики (тетрациклин, бензилпенициллин и др.) в концентрации 100–200 мг/л. Это в первую очередь относится к древесным растениям, у которых наблюдается тенденция к накоплению внутренней инфекции.
На I этапе, как правило, используют среду, содержащую минеральные соли по рецепту Т. Мурасига и Ф. Скуга, а также различные биологически активные вещества и стимуляторы роста (ауксины, цитокинины) в различных сочетаниях в зависимости от объекта. В случае, когда наблюдается ингибирование роста первичного экспланта за счет выделения им в питательную среду токсичных веществ (фенолов, терпенов и других вторичных соединений), усилить его рост можно, используя антиоксиданты. Это возможно двумя способами: омывкой экспланта слабым раствором антиоксиданта в течение 4–24 ч; непосредственным добавлением антиоксиданта в питательную среду. В качестве антиоксидантов используют: аскорбиновую кислоту (1–60 мг/л), глютатион (4–5 мг/л), дитиотриэтол (1–3 мг/л), диэтилдитиокарбамат (2–5 мг/л), поливинилпирролидон (5000– 10 000 мг/л). В некоторых случаях целесообразно добавлять в питательную среду адсорбент – древесный активированный уголь в концентрации 0,5–1 %. Продолжительность первого этапа – от одного до двух месяцев, в результате которого наблюдается рост меристематических тканей и формирование первичных побегов.
II этап – собственно микроразмножение. На этом этапе необходимо добиться получения максимального количества мериклонов, учитывая при этом, что с увеличением субкультивирований увеличивается число растений-регенерантов с неправильной морфологией и возможно образование растений-мутантов. Как и на первом этапе, используют питательную среду по рецепту Т. Мурасига и Ф. Скуга, содержащую различные биологически активные вещества, а также регуляторы роста. Основную роль при подборе оптимальных условий культивирования эксплантов играют соотношение и концентрация внесенных в питательную среду цитокининов и ауксинов. Из цитокининов наиболее часто используют БАП в концентрациях от 1 до 10 мг/л, а из ауксинов – ИУК и НУК в концентрациях до 0,5 мг/л. При долгом культивировании растительных тканей на питательных средах с повышенным содержанием цитокининов (5–10 мг/л) происходит постепенное накопление их в тканях выше необходимого физиологического уровня, что приводит к появлению токсического действия и формированию растений с измененной морфологией.
Вместе с тем возможно наблюдать такие нежелательные для клонального микроразмножения эффекты, как подавление пролиферации пазушных меристем, образование витрифицированных (оводненных) побегов и уменьшение способности растений к укоренению. Отрицательное действие цитокининов возможно преодолеть, по данным Н.В. Катавой и Р.Г. Бутенко, используя питательные среды с минимальной концентрацией цитокининов, обеспечивающих стабильный коэффициент микроразмножения, или чередованием циклов культивирования на средах с низким и высоким уровнем фитогормонов.
III–IV этапы – укоренение микропобегов, их последующая адаптация к почвенным условиям и высадка в поле являются наиболее трудоемкими этапами, от которых зависит успех клонального микроразмножения. На третьем этапе, как правило, меняют основной состав среды: уменьшают в два, а иногда и в четыре раза концентрацию минеральных солей по рецепту Мурасига и Скуга или заменяют ее средой Уайта, уменьшают количество сахара до 0,5–1 % и полностью исключают цитокинины, оставляя один лишь ауксин. В качестве стимулятора корнеобразования используют β-индолил-3-масляную кислоту (ИМК), ИУК или НУК. Укоренение микропобегов проводят двумя способами:
1) выдерживание микропобегов в течение нескольких часов (2–24 ч) в стерильном концентрированном растворе ауксина (20– 50 мг/л) и последующее их культивирование на агаризованной среде без гормонов или непосредственно в подходящем почвенном субстрате (импульсная обработка);
2) непосредственное культивирование микропобегов в течение 3–4 недель на питательной среде, содержащей ауксин в невысоких концентрациях (1–5 мг/л в зависимости от исследуемого объекта).
В последнее время предложен пока мало практикуемый метод укоренения пробирочных растений – в условиях гидропоники. Этот метод позволяет значительно упростить этап укоренения и одновременно получать растения, адаптированные к естественным условиям. Для картофеля возможно использовать бессубстратную гидропонику для получения миниклубней. Затенение нижней части культуральных сосудов плотной черной материей или добавление в питательную среду активированного угля способствует укоренению микропобегов.
Пересадка растений-регенерантов в субстрат является ответственным этапом, завершающим процесс клонального микроразмножения. Наиболее благоприятное время для пересадки пробирочных растений – весна или начало лета. Растения с двумя-тремя листьями и хорошо развитой корневой системой осторожно вынимают из колб или пробирок пинцетом с длинными концами или специальным крючком. Корни отмывают от остатков агара и высаживают в почвенный субстрат, предварительно простерилизованный при 85–90 °С в течение 1–2 ч. Для большинства растений в качестве субстратов используют торф, песок (3 : 1);торф, дерновую почву, перлит (1 : 1 : 1); торф, песок, перлит (1 : 1 : 1). Исключение составляют семейство орхидных, для которых готовят субстрат, состоящий из сфагнового мха, смеси торфа, листьев бука или дуба, сосновой коры (1:1:1). Приготовленным заранее почвенным субстратом заполняют пикировочные ящики или торфяные горшочки, в которых выращивают растения-регенеранты. Горшочки с растениями помещают в теплицы с регулируемым температурным режимом (20–22 °С), освещенностью не более 5 тыс. лк и влажностью 65–90 %. Для лучшего роста растений создают условия искусственного тумана. В тех случаях, когда нет возможности создать такие условия, горшочки с растениями накрывают стеклянными банками или полиэтиленовыми пакетами, которые постепенно открывают до полной адаптации растений.
Через 20–30 дней после посадки хорошо укоренившиеся растения подкармливают растворами минеральных солей Кнудсона, Мурасига и Скуга, Чеснокова, Кнопа (в зависимости от вида растений) или комплексным минеральным удобрением. По мере роста растения рассаживают в большие емкости со свежим субстратом. Дальнейшее выращивание акклиматизированных растений соответствует принятой агротехнике выращивания для каждого индивидуального вида растений.
Процесс адаптации пробирочных растений к почвенным условиям является наиболее дорогостоящей и трудоемкой операцией. Нередко после пересадки растений в почву наблюдается остановка в росте, опадение листьев и гибель растений. Это связано, в первую очередь, с тем, что у пробирочных растений нарушена деятельность устьичного аппарата, вследствие чего происходит потеря большого количества воды. Во-вторых, у некоторых растений в условиях in vitro не происходит образования корневых волосков, что приводит, в свою очередь, к нарушению поглощения воды и минеральных солей из почвы. Поэтому целесообразно на третьем или четвертом этапах клонального микроразмножения применять искусственную микоризацию растений (для микотрофных), учитывая их положительную роль в снабжении растений минеральными и органическими питательными веществами, водой, биологически активными веществами, а также в защите растений от патогенов. Существует два способа заражения растений микоризообразующими грибами: 1) in vitro (в стерильных условиях); 2) in vivo (в естественных условиях). Первый способ более благоприятен, так как в этом случае исключается возможность загрязнений почвы другими микроорганизмами. Кроме того, в условиях in vitro есть возможность контролировать условия культивирования (свет, температура, влажность) и подбирать субстрат (рН, аэрация), обеспечивающий нормальное формирование микоризы. Растения, размноженные in vitro, развиваются значительно лучше, если их корневая система находилась в контакте с микоризообразующими грибами. В этом случае улучшалось снабжение их азотом, увеличилась в 1,5–2 раза приживаемость растений при их пересадке в почву, а также повышался прирост надземной биомассы. Такие работы были проведены с березой, эвкалиптом, каштаном, сосной, лохом и разными клонами ольхи.
Индийскими учеными предложен простой метод предотвращения быстрого обезвоживания листьев растений, выращенных in vitro, во время их пересадки в полевые условия. Метод заключается в том, что листья в течение всего акклиматизационного периода следует опрыскивать 50 %-м водным раствором глицерина или смесью парафина, или жира в диэтиловом эфире (1 : 1). Применение этого метода помогает избежать длинных и затруднительных процессов закаливания пробирочных растений и обеспечивает 100 %-ю приживаемостью.
В Институте физиологии растений им. К.А. Тимирязева РАН разработан упрощенный способ адаптации пробирочных растений винограда. Он состоит в том, что адаптацию растения безболезненно проходят в пробирках – для этого достаточно снять пробки с тех пробирок, в которых растения достигают пробки. В таком состоянии растения оставляют на 1,5–2 недели. К концу этого периода верхушка растения и два развитых листочка появляются над пробиркой и такое растение готово к пересадке в почву. Растения пересаживают в стерильной почвенный субстрат вместе с агаром для предотвращения механических повреждений корневой системы. Побег заглубляют в почвенный субстрат так, чтобы над поверхностью оставался стебельс одним-двумя развитыми листочками, не более. Применение этого способа для адаптации растений винограда к почвенным условиям позволяет упростить и удешевить технику акклиматизации растений. Это достигается вследствие того, что в этом случае туманообразующая установка не используется (А.Б. Бургутин, 1988).
Оптимизация условий клонального
микроразмножения растений
Важнейшее условие успешного культивирования изолированных клеток и тканей – сбалансированность питательных сред по минеральным солям, углеводам, фитогормонам и т. д. При введении в культуру нового вида растений исследователи нередко испытывают большое число сред. Этот процесс длителен и часто не приносит должного результата. Для определения оптимального состава питательной среды применяют методы математического планирования эксперимента, позволяющие быстро при небольшом объеме экспериментов определить условия культивирования, обеспечивающие высокую скорость размножения, изучить зависимость микроразмножения от совокупности факторов, действующих на процесс, а также установить наличие и оценить эффективность межфакторных взаимодействий. В зависимости от поставленной цели эксперименты проводят по полному или дробному плану первого или второго порядка.
Успех оптимизации зависит оттого, насколько правильно выбран критерий оптимизации. На первом этапе микроразмножения критерием может служить количественная оценка любой морфогенетической реакции экспланта, ведущей в дальнейшем к формированию целого растительного организма. Например, высота побега, число дифференцирующихся стеблевых апексов, побегов, эмбриоидов. На втором этапе учитывается общее число развившихся побегов, эмбриоидов, которое должно отражать эффективность размножения. Критерием оптимизации третьего этапа может служить процент укорененных растений, длина корневой системы, число корней на один микропобег. При этом также необходимо учитывать высоту и общее состояние растения и приживаемость его при пересадке в почву.
Математическое планирование необходимо начинать с выбора факторов, действующих на изучаемый процесс (X1, Х2, Х3,... и т. д.), их предельных значений (верхний и нижний уровни) и схемы эксперимента (матрицы). После чего отбирают экспланты, используемые в эксперименте. При этом необходимо учитывать неоднородность исходного растительного материала и гетерогенность культивируемых тканей. Поэтому растительный материал необходимо равномерно распределять между разными вариантами эксперимента. Оптимальные условия культивирования должны обеспечить удовлетворительный рост всех эксплантов.
Обработку результатов многофакторных экспериментов проводят статистически, и для получения уравнений регрессии рассчитывают следующие показатели:
1) коэффициент регресии свободного члена;
2) коэффициенты регрессии изучаемых факторов;
3) коэффициенты регрессии межфакторных взаимодействий;
4) построчные дисперсии;
5) значение критерия Кохрена;
6) адекватность результатов.
Подробное и обстоятельное изложение принципов постановки, проведения и обработки результатов многофакторных экспериментов можно найти в руководстве по математическому планированию, изложенному в книге П.Н. Максимова «Многофакторный эксперимент в биологии».
Так, при оптимизации начальных условий культивирования гипокотилей шести генотипов томатов был поставлен опыт первого порядка по матрице полного факторного эксперимента 24//16, где 2 – число уровней, на которых испытывались факторы; 4 – число изучаемых в эксперименте факторов (X1 – инозит, Х2 – сахароза, Х3 – зеатин, Х4 – ИУК); 16 – число опытов по схеме эксперимента.
В результате статистической обработки были получены следующие уравнения регрессии:
Y = 3,756 + 1,619Х2 – 0,419Х1Х2 – 0,244Х2Х3Х4 (по размеру каллуса);
Y1 = 2,438 + 0,738Х2 – 0,662Х3 – 0,438Х4 + 0,433Х2Х3 + 0,462Х1Х2Х3 + 0,437Х1Х4 + 0,537Х1Х2Х4 – 0,312X1X2X3X4 (по числу почек на один каллус).
Из уравнений видно, что все факторы, за исключением X1, оказывают прямое положительное или отрицательное действие на изучаемые процессы. Так, значение фактора Х2 в обоих уравнениях свидетельствует о том, что добавление его в питательную среду стимулирует рост каллуса и образование адвентивных почек, а уменьшение концентрации зеатина и ИУК (Х3 и Х4 соответственно) увеличивает выход адвентивных почек с одного каллуса. Таким образом, за один эксперимент были определены факторы, влияющие на образование каллуса и адвентивных почек, и определен оптимальный состав питательной среды для начального этапа клонального микроразмножения томатов через первичный каллус.
В последние годы многофакторные эксперименты широко используются для оптимизации условий культивирования каллусных тканей сахарной свеклы, бобов, раувольфии, женьшеня; процессов клонального микроразмножения герберы, фрезии, каперсов, полыни лимонной, сосны обыкновенной и некоторых других растений. Методы математического планирования являются эффективным и экономически выгодным способом оптимизации культивирования растительных тканей in vitro и микроразмножения растений.
Влияние генетических, физиологических,
гормональных и физических факторов
на микроразмножение растений
При разработке методов клонального микроразмножения растений необходимо учитывать влияние генетических, физиологических, гормональных и физических факторов. Это связано с тем, что разработанная методика для определенного клона одного вида не всегда может быть применена для размножения других представителей этого вида и тем более растений другого вида. На микроразмножение влияют генотип, возраст исходного растения, сезонность изоляции, а также размер первичного эксплаита. Из гормональных – соотношение цитокининов и ауксинов, состав питательной среды по минеральным веществам, витаминам, сахарозы, а из физических факторов влияние оказывают консистенция среды (жидкая или агаризованная), ее кислотность, условия освещения, а также температурный режим и относительная влажность воздуха.
Генетические и физиологические факторы. Из факторов, определяющих успех клонального микроразмножения, наибольшее значение имеет генотип исходного растения. Экспериментально доказано, что двудольные травянистые растения обладают большими морфогенетическими потенциями, т. е. имеют более выраженную способность к индукции заложения адвентивных почек, росту побегов, укоренению и, в конечном итоге, получению более высокого коэффициента размножения, чем ткани и органы однодольных травянистых и, тем более, древесных растений. На примере сахарной свеклы было показано, что наибольшее число регенерантов получено от тетраплоидных форм, меньше всего от диплоидных, а триплоидные гибриды занимают промежуточное положение. Аналогичные результаты были получены с 11 генотипами перуанского картофеля, работы были проведены на кафедре сельскохозяйственной биотехнологии РГАУ–МСХА им. К.А. Тимирязева.
Существенное влияние на реализацию морфогенетического потенциала в процессе микроразмножения оказывают сортовая и родовая специфика исходного экспланта. Известно, что виды растений, хорошо размножающихся вегетативно, обычно проявляют высокую регенерационную способность в культуре in vitro. Среди видов, обладающих значительным морфогенетическим потенциалом, представители семейств Solanaceae, Umbelliferae, Cruciferae, Compositae; трудно регенерируют растения из семейства Gramineae. Генотип материнского растения значительно влияет на ход клонального микроразмножения. В пределах вида некоторые генотипы размножаются легче, чем другие.
Для растений хмеля было показано, что изолированные апексы различных сортов по-разному реагируют на присутствие в питательной среде регуляторов роста: для сорта Смолистый оптимальной была концентрация БАП 1 мг/л, для сорта Истринский-15 – 0,5–1,5 мг/л БАП и 0,05 мг/л ИУК. Апексы сорта Смолистый не реагировали на добавление в питательную среду ИУК и 2,4-Д, а у сорта Истринский-15 увеличивался рост побегов на среде с 0,05 мг/л ИУК и 0,05 мг/л 2,4-Д. Для изолированных апексов крыжовника также были отмечены сортовые различия в морфогенетических реакциях на условия культивирования. Так, апексы, культивируемые на питательной среде, содержащей минеральные соли по Т. Мурасига и Ф. Скуга, БАП 0,5 мг/л сорта Финик пролиферировали каллус, из которого затем формировались побеги, а апексы сортов Русский, Колобок, Розовый обладали способностью к прямой регенерации побегов.
Зависимость морфогенетического потенциала от родовой специфики растений была обнаружена на злаковых травах, таких, как ежа сборная, житняк гребенчатый, овсяница луговая и бороздчатая, колосняки гигантский, узколистный, мягкий, пырейник ситниковый, пшеница Саратовская-29, Палестинка-6, неполные пшенично-колосняковые амфидиплоиды 98, 99, 101. В результате экспериментов были отмечены различные потребности в макро- и микроэлементах, органических компонентах (аминокислот, гидролизата казеина, дрожжевого экстракта, биотина), регуляторах роста. Установлено, что гибриды обладают более высокой морфогенетической активностью, чем исходные родительские формы.
Среди древесных примером родовой специфики могут служить хвойные. Так, например, культивирование изолированных зародышей сосны замечательной, сосны желтой, сосны приморской, ели обыкновенной, ели колючей на модифицированной питательной среде Т. Мурасига и Ф. Скуга, содержащей цитокинин (БАП), наблюдается образование почек de novo. Причем в одних и тех же условиях выращивания процент образования адвентивных почек для перечисленных выше представителей рода Pinus колебался от 20 до 35 %, в то время как для Picea это значение не превышало 10 %.
Сортовая специфика может проявляться и при укоренении микропобегов. Так, например, для микропобегов вишни было отмечено, что сорт Шубинка после обработки ИМК (50 мг/л) укоренился на 52 %, сорт Владимирская – на 18 %, а сорт Любская – на 13 %. Для разных сортов черной смородины также наблюдается достоверное различие в корнеобразовательной способности изолированных верхушек побегов.
Физиологический возраст исходного экспланта имеет несомненное значение в проявлении способности к морфогенезу. Зрелые зародыши, 20–30-дневные проростки или различные их части (ювенильный материал) обладают высокими морфогенетическими потенциями по сравнению с тканями взрослых растений и способны образовывать в большом количестве адвентивные почки, стимулировать развитие пазушных меристем, которые в дальнейшем формируют хорошо растущие побеги, способные к укоренению. В этом случае, например, из одного изолированного зародыша лиственных пород возможно получить до 10–100 тыс. растений в год, в то время как при культивировании пазушных или апикальных почек взрослых растений коэффициент размножения уменьшается на 1–2 порядка.
Возраст первичного экспланта оказывает существенное влияние и на укоренение микропобегов,размноженных in vitro. С увеличением возраста исходного материала, как правило, снижается способность побегов и черенков к укоренению. Так, при работе с восемью видами яблонь было получено 80–90 %-е укоренение микропобегов из ювенильного материала, 50 % – из апикальных почек, изолированных с 2–3-летних растений, и 20–30 % – из растений более старшего возраста.
Несомненно, с практической точки зрения целесообразно размножать растения, и в частности древесные, в возрасте старше 20 лет, т. е. после проведения оценки по хозяйственно важным признакам. Однако размножение их in vitro в таком возрасте представляет большие трудности. Во-первых, все типы тканей и органов у взрослых растений эндогенно заражены грибами и бактериями, что значительно затрудняет получение асептической культуры. Во-вторых, почки или другие органы одного и того же взрослого дерева различаются между собой по поведению в условиях in vitro гораздо больше, чем имеет место у травянистых растений. Это приводит к проведению специальных экспериментов, по подбору оптимальных условий культивирования, обеспечивающих нормальный рост и развитие вновь введенных эксплантов в культуру.
В настоящее время преодоление возрастного барьера осуществляется путем реювенилизации – сочетание работ in vivo и in vitro. Реювенилизацию (омоложение) можно проводить несколькими способами:
1) многократная обработка растущего дерева или отдельных ветвей раствором цитокинина перед эксплантированием;
2) повторное черенкование;
3) частая подрезка деревьев для индукции роста побегов непосредственно из ствола дерева или для стимуляции корневых отпрысков;
4) проведение повторных прививок;
5) путем серии субкультивирований (in vitro);
6) создание густых насаждений, обеспечивающих боковое затенение, которое будет стимулировать развитие спящих почек.
Або Эл Нил предложил технологию реювенилизации, первый этап которой состоит в многократной обработке цитокинином деревьев, находящихся в состоянии покоя. Однако можно использовать и другие – кинетин, 2ip. Выбор цитокинина зависит от реакции обрабатываемого вида, которую устанавливают экспериментально.
В сочетании с цитокинином можно использовать и другие регуляторы роста. Например, у некоторых видов отмечается повышенная реакция, когда с БАП применяют N-диметиламиноянтарную кислоту в небольшой концентрации. Обрабатывают in vivo все растущее дерево или его отдельные ветви. Срезанные ветви погружают в раствор цитокинина или его вводят непосредственно в сосудистую систему дерева, например, через конец срезанной ветки путем инъекции. Обработку проводят через 4–5 дней, так как более частые обработки гормонами могут вызвать отравление растений. Такие обработки индуцируют образование почек или побегов, которые приобретают морфологию, сходную с морфологией молодых особей. Побеги или короткие отрезки стебля, содержащие почки, затем помещают на питательную среду (in vitro) для индукции роста почек и побегов. Впоследствии сформировавшиеся побеги переносят либо на среду для размножения, либо на среду для укоренения. Промежуточной стадией при этом является среда, способствующая раскрытию вновь образовавшихся почек и развитию их в побеги.
К физиологическим факторам также относится и время (сезонность) изоляции экспланта. Ткани и органы, изолированные в момент вегетации растений, обладают более высокой чувствительностью к составу питательной среды и способны с высокой частотой образовывать адвентивные почки, формировать побеги и укореняться, чем ткани, изолированные в период глубокого и вынужденного покоя. Например, весенняя посадка апексов крыжовника сорта Финик на питательную среду Т. Мурасига и Ф. Скуга, содержащей БАП 0,5 мг/л, способствовала пролиферации каллуса, из которого затем индуцировались с высокой частотой побеги. В то время как летняя изоляция апексов стимулировала более интенсивную пролиферацию каллуса, но при этом уменьшался процент регенерации побегов.
Размер экспланта является еще одним фактором, определяющим успех микроразмножения. Чем меньше эксплант, тем меньшей регенерационной способностью он обладает, и наоборот. Экспланты большего размера, состоящие из паренхимы, проводящей ткани и камбия, могут независимо от соотношения фитогормонов в питательной среде спонтанно образовывать почки. С другой стороны, в крупном экспланте увеличивается возможность появления в его клетках вирусов и других патогенов, что препятствует оздоровлению размноженных в культуре тканей растений. Оптимальная величина экспланта зависит от видовых особенностей растения-донора и свойств органа, служащего источником первичного экспланта. Так, для малины был установлен размер первичного экспланта 2 мм, при котором 60 % апикальных верхушек растения регенерировали на среде Мореля. Для хмеля этот показатель колеблется от 0,1 до 0,2 мм, а для лука и чеснока оптимальный размер меристемы составляет 0,5–0,8 мм.
У многих растений морфогенетическая способность изолированных тканей, и в частности меристематических, зависит от расположения почек на побегах. Так, исследования регенерационной способности терминальных и латеральных почек побегов крыжовника сорта Русский показали, что наибольшим морфогенетическим потенциалом обладают три верхние почки (45–65 %), а для растений спаржи было установлено, что почки нижней части побега обладают большей регенерационной способностью, чем почки средней и апикальной частей.
Гормональные факторы. Немаловажный фактор, влияющий на успех клонального микроразмножения,– гормональный баланс питательной среды. При высоком соотношении гормонов (цитокинин – ауксин) происходит развитие пазушных меристем или образование адвентивных почек, при низком – индуцируется корнеобразование, а при среднем – наблюдается образование и пролиферация каллуса. Наиболее часто при клональном микроразмножении используют ИУК, реже НУК в качестве ауксиновых компонентов, кинетин и БАП представляют при этом цитокинины. Кроме перечисленных цитокининов применяют и другие, у которых активность в стимуляции образования побегов выше. Цитокинины, используемые в микроразмножении растений, по своей активности можно расположить в следующем порядке: кинетин < 6-бензиламинопурин (БАП) < 2-изопентениладенин (2ip) < зеатин.
Кроме цитокининов и ауксинов в питательную среду иногда добавляют гибберелловую кислоту, которая стимулирует рост и вытягивание (элонгацию) сформировавшихся почек и способствует получению растений с хорошо развитой надземной частью.
Принципиально возможна индукция и стимуляция различных морфогенетических реакций в культуре тканей низкими концентрациями экзогенных фитогормонов и угнетение общей активности вплоть до гибели растительных тканей при высокой гормональной насыщенности питательной среды. Эту специфику реакций культивируемых тканей и органов растений на введение фитогормонов следует учитывать при использовании регуляторов роста с целью размножения растений.
На клональное микроразмножение наряду с гормонами влияют минеральные соли, витамины и углеводы. При микроразмножении растений in vitro часто используют среды Мурасига и Скуга, Линсмаера и Скуга, Грессхоффа и Доу, Нича, Хеллера, Шенка и Хильдебрандта и других, отличающиеся друг от друга соотношением аммонийного и нитратного азота. В большинстве случаев исследователи отдают предпочтение среде Мурасига и Скуга с более высоким содержанием неорганического азота. Использование сред, обогащенных азотом, не только ведет к неорганизованному росту каллусной ткани, но и стимулирует процессы органогенеза и особенно соматического эмбриогенеза. Например, NH4NO3 влияет на морфогенетический потенциал зародышей разных видов Brassica. Процент выживания зародышей и частота образования побегов увеличиваются при уменьшении концентрации NH4NO3 в среде, а максимальное число побегов на зародышах формируется в случае полного исключения NH4NO3 из среды. Снижение содержания KNО3 и NH4NO3 до 6,7 мМ улучшало морфогенез крыжовника сортов Инвикта и Карлз. Для томатов экспериментально было установлено, что среды с повышенным содержанием минерального азота ингибируют пролиферацию каллуса и приводят к гибели эксплантов. Для глоксинии была отмечена зависимость образования вегетативных или репродуктивных структур от концентрации компонентов питательной среды. Так, при высокой концентрации KNО3 (20 мМ) и сахарозы (100 мМ) преимущественно развиваются вегетативные почки, а цветочные только у 28 % эксплантов. При низком содержании KNО3 (2 мМ) и сахарозы (15 мМ) на всех эксплантах образуются только цветочные почки.
Значительное влияние на процесс микроразмножения оказывают биологически активные вещества негормональной природы, а также углеродное питание. Как правило, присутствие в составе питательной среды витаминов, аминокислот, растительных экстрактов, гидролизата казеина необходимо для индукции пролиферации каллуса и регенерации из него побегов или эмбриоидов. Когда же развитие побегов происходит из существующих пазушных меристем или сформировавшихся почек и эмбриоидов, то обычно влияние биологически активных добавок становится несущественным, ибо побеги сами способны к синтезу нужных для их жизнедеятельности веществ. Замечено, что высокие концентрации биологически активных веществ приводят к гипервитаминозу, что проявляется в угнетении роста, побурении и высыхании листьев, в изменении морфологии растений.
На всех этапах клонального микроразмножения в качестве источника углеродного питания используют 3 %-ю сахарозу. Однако эта концентрация не является оптимальной для всех вводимых в культуру in vitro растений. Так, экспериментально доказано, что сахароза является фактором, способным направить развитие побегов каперса in vitro, и что можно получать либо вегетирующие побеги, либо пурпурные почки возобновления. При культивировании апикальных и боковых почек на среде, содержащей сахарозу в концентрации 3 % и более, наблюдается появление антоциановой окраски почек, что является первым признаком перехода почек в состояние зимнего покоя. При использовании же пониженных концентраций (менее 3 %) происходит формирование зеленых почек, способных в дальнейшем к размножению (С.А. Сафразбекян, В.В. Урманцева, Н.В. Катева, 1991).
В работах с изолированными зародышами ели обыкновенной былотакже выявлено отрицательное влияние высокой концентрации сахарозы (2–3 %) на процесс образования адвентивных почек. Показано, что уже на втором пассаже этот процесс практически не происходит, а к четвертому пассажу наблюдается гибель всех эксплантов. Пониженное содержание сахарозы в среде стимулировало не только образование адвентивных почек, но и дальнейшее их развитие в побеги. При 0,5–1 %-й концентрации сахарозы побеги через 2–3 месяца культивирования имели высоту 1–1,5 см и затем использовались для дальнейшего размножения или укоренения.
Помимо сахарозы в качестве источника углеродного питания возможно использовать глюкозу, фруктозу, галактозу и др. Известно, что после сахарозы наиболее часто применяемым источником углеродного питания для культивирования in vitro тканей растений является глюкоза. Из 38 исследованных культур (травянистых и древесных) 85 % имели отличный и хороший рост на среде с глюкозой. На третьем месте по эффективности использования культурами тканей растений находится фруктоза. По мнению Д. Миноха, 2/3 культур успешно использовали для своего роста фруктозу. Галактоза заметно отличается от глюкозы и фруктозы по действию на рост изолированных тканей растений. Более половины изученных культур слабо или почти не используют галактозу для роста. Однако есть данные, отмечающие положительную роль галактозы для культивирования тканей и органов растений.
Таким образом, проблема использования гормонов, биологически активных веществ и минеральных солей не должна сводиться к простому включению этих соединений в состав питательной среды по готовым стандартным рецептам, а должна решаться с учетом конкретных морфогенетических реакций, используемых для микроразмножения того или иного вида растений.
Физические факторы. Консистенция среды является важным фактором, влияющим на процессы роста эксплантов и образование адвентивных почек. Известно, что при культивировании эксплантов верхушки побегов в жидких питательных средах на аппаратах роллерного типа значительно стимулируется их рост, не наблюдается ярко выраженного апикального доминирования побегов, сокращается период выращивания и количество пересадок, что обусловливается хорошим снабжением растений питательными веществами. С другой стороны, в этих условиях возрастает возможность образования аномальных, верифицированных побегов. Использование твердых агаризованных сред способствует преодолению витрификации, но, вместе с тем, этот способ выращивания ухудшает условия питания эксплантов и препятствует удалению продуктов метаболизма.
На клональное микроразмножение и рост растений также влияет и кислотность среды, определяющая доступность для растений питательных веществ. Известно, что сильно кислые или щелочные среды лимитируют поступление некоторых элементов, например фосфора и железа, делая их относительно нерастворимыми и этим ограничивая рост растений. В то же время при высокой кислотности большое количество этих элементов переходит в растворенное состояние и становится токсичным для эксплантов.
Как правило, ткани и органы растений культивируют на питательной среде с рН 5,6–5,8. Однако эти условия не всегда могут быть оптимальными. Например, для культуры зародышей сосны обыкновенной было показано, что изменение кислотности питательной среды от 4,7 до 5,2 позволяет увеличить в 2,5–3 раза способность зародышей образовывать адвентивные почки, а для культуры ели обыкновенной наиболее благоприятный рН среды находился в пределах 5,2–5,6. Эти данные полностью совпадают с кислотностью почвы, на которых успешно произрастают данные породы в естественных условиях. Поэтому биотехнологи должны учитывать в экспериментах по культуре ткани кислотность почв естественного произрастания исследуемых растений.
Обычно изолированные ткани растений выращивают при освещении люминесцентными лампами с учетом требований материнского растения к интенсивности и фотопериоду. Т. Мурасига рекомендует на первом и втором этапах клонального микроразмножения растений культивировать ткани при 1–5 тыс. лк и 14–16-часовом фотопериоде, такие условия освещения способствуют инициации побегов и корней у большинства растений.
Многие исследования свидетельствуют, что интенсивность освещения играет важную роль в индукции органогенеза. Увеличение освещенности с 3 до 6 тыс. лк способствовало интенсивному побегообразованию в культуре бегонии. Максимальное образование побегов и корней в культуре тканей аспарагуса отмечено при 1 тыс. лк (16-часовой фотопериод), снижение или увеличение интенсивности освещения угнетало органогенез тканей.
Интенсивность и характер роста изолированных тканей зависят и от спектрального состава света. Так, белый, красный и голубой свет более интенсивно индуцируют образование почек у ткани Heloniopsis orienatalis, чем зеленый. Красный свет стимулирует образование цветочных почек у ткани табака, а темнота – образование корней. Адвентивные почки в каллусе табака индуцируются ультрафиолетовым, голубым и фиолетовым светом. У эксплантов салата красный свет вызывает образование побегов. Для пробирочных растений картофеля было установлено, что присутствие в среде НУК или ИУК значительно сильнее стимулировало клубнеобразование при красном свете, чем на синем, тогда как БАП или кинетин стимулировали клубнеобразование активнее на синем по сравнению с красным светом (Т.Н. Констанинова и др., 1988). Наиболее благоприятное действие на укоренение побегов березы, активацию существующих меристем оказывает красный свет, при котором практически 100 % микрочеренков образуют корни. При белом свете этот процесс идет менее активно, а при синем корни образуются только у половины черенков, и в темноте–у еще меньшего числа. Сочетание красного света с введением в среду ИУК значительно ускоряет процесс корнеобразования и повышает интенсивность роста побегов. Синий свет увеличивает содержание цитокининов в тканях растений и тем самым стимулирует образование побегов.
Температура оказывает значительное влияние на рост и регенерацию изолированных тканей растений, способствуя активации метаболических процессов. Для большинства растительных тканей температурный оптимум составляет 23–25 °С. Однако существуют различия между растениями в отношении их требований к температуре. Так, образование луковичек у Lilium auratum наиболее эффективно при 20 °С. Охлаждение эксплантов, предшествующее культивированию ткани гладиолуса, улучшает ее регенерационную способность. Низкие температуры (15–18 °С) в течение двух недель необходимы для индукции образования побегов в культуре черешков бегонии. Для почек цветоносов фаленопсиса отмечается влияние температуры на тип морфогенеза: при +28 °С из почек регенерируют вегетативные побеги, а при +20 °С – генеративные.
Температурный режим зависит, главным образом, от вида растений. Например, для тропических растений оптимальная температура выращивания приближается к 27 °С, для растений альпийских лугов – 18–20 °С, для большинства других – 25 °С. При клональном микроразмножении пробирочные растения выращивают в климатических камерах, где поддерживается 16-часовой фотопериод и 70 %-я относительная влажность воздуха.
Таким образом, для повышения коэффициента размножения растений необходимо каждому виду с учетом его естественного ареала произрастания подбирать индивидуальные условия культивирования.
Следовательно, клональное микроразмножение является новым перспективным способом вегетативного размножения растений, позволяющим получать генетически однородный, оздоровленный посадочный материал, иметь высокий коэффициент размножения, сокращать селекционный процесс, проводить работы в течение круглого года, экономя при этом площади, необходимые для выращивания растений. Во многих странах мира биоиндустрия микроклонального размножения поставлена на поточную промышленную основу и представлена десятками активно функционирующих предприятий. Например, во Франции 94 % всей продукции цветочных культур получают методом культуры изолированных тканей. В США около 100 коммерческих предприятий получают посадочный материал декоративных, овощных, полевых, плодовых и лесных культур методом клонального микроразмножения. Ведущим производителем оздоровленного посадочного материала цветочных растений является Голландия, а подвоев яблони, сливы и персика – Италия (до 250– 500 тыс. ежегодно). В нашей стране также ведутся интенсивные работы по клональному микроразмножению растений, и в настоящее время многие научно-исследовательские институты и промышленные лаборатории разрабатывают и усовершенствуют методы микроразмножения и оздоровления различных декоративных плодовых, ягодных, овощных, кормовых и древесных культур. Например, методы ускоренного размножения винограда, разработанные во Всесоюзном научно-исследовательском институте виноделия и виноградарства «Магарач», позволяют получать из одного одноглазкового черенка 8 тыс. растений в течение четырех месяцев. Оздоровление промышленных посадок малины от комплекса вирусных заболеваний путем сочетания термотерапии и культуры меристемы повышает продуктивность культуры в 6–8 раз. Размножение и получение безвирусного посадочного материала гвоздики, хризантемы, антуриума Андре, розы, бегонии Элатиор и других ведется в специализированных цветоводческих хозяйствах «Элита» Российской Федерации и в меристематическом комплексе Республиканского концерна «Крымзеленстрой».
КЛОНАЛЬНОЕ МИКРОРАЗМНОЖЕНИЕ
ДЕКОРАТИВНЫХ, ПЛОДОВО-ЯГОДНЫХ И ХВОЙНЫХ РАСТЕНИЙ
Цветочные, плодово-ягодные культуры
Необходимость использования здорового посадочного материала в промышленном садоводстве, цветоводстве и лесном хозяйстве не вызывает сомнений. В настоящее время существует несколько методов получения оздоровленных растений: тестирование большого количества исходного растительного материала; размножение в условиях in vitro с последующим их тестированием; термотерапия или хемиотерапия, тестирование, размножение in vitro и снова тестирование.
Выбор метода зависит от вида вирусной инфекции, а также от генотипических особенностей исследуемых объектов. Трудоемкость проведения таких работ обусловила разработку индивидуальных методов размножения растений в условиях in vitro для каждого конкретного растения, относящегося к разным таксономическим группам. Основным методом, применяемым для сохранения и размножения ценных экземпляров, остается метод, основанный на снятии апикального доминирования. Из плодовых и ягодных культур подобным образом в промышленных масштабах размножают землянику, ежевику, малину, яблоню, сливу, вишню, подвои и скелетообразователи груши, а также некоторые декоративные культуры, такие, как сирень, жимолость, кизильник, роза, хризантема и др. Данный метод считается универсальным и имеет хорошую воспроизводимость результатов в пределах вида и рода растений; минимальную степень риска в отношении получения генетически неоднородного посадочного материала (Н.Е. Павловская и др., 1998).
Второй распространенный метод клонального микроразмножения для практических целей цветочно-декоративных культур и некоторых плодовых – развитие адвентивных почек/побегов. Как правило, в качестве первичного экспланта используют чешуи или сегменты базальной части донца луковиц, сегменты листовой пластинки и междоузлий побегов. Таким методом размножают, главным образом, луковичные цветочные культуры (гиацинты, лилии, гладиолусы, тюльпаны, нарцисы и др.).
В настоящее время в коммерческих целях метод клонального микроразмножения применяется для растений семейства Орхидных, для которых размножаемые растения являются сложными гибридами. Некоторые из них сочетают геномы трех-четырех разных родов. В обычных условиях осуществить вегетативное размножение этих растений сложно, а в случае завязываемости семян и их прорастания, растение достигает фазы цветения лишь через 3–5 лет.
В последние годы резко возрос спрос на многие цветочные и декоративные культуры. Вместе с тем некоторые ценные виды находятся на грани исчезновения и занесены в Красную книгу. Сокращение и размножение редких, исчезающих и декоративных видов растений возможно при помощи методов клеточной инженерии, и в частности клонального микроразмножения. На кафедре сельскохозяйственной биотехнологии РГАУ–МСХА им. К.А. Тимирязева разработаны технологии быстрого размножения цветочных и декоративных растений в условиях in vitro. Создан банк редких, декоративных, цветочных и исчезающих видов растений, разработаны лабораторные технологии размножения декоративно-лиственных и красиво-цветущих бегоний (16 сортов), хризантем (10 сортов), гиацинтов (8 сортов), фиалок (12 сортов), эписций (6 сортов), лилий (20 сортов), гладиолусов, фритиллярий и других растений.
Как правило, первичным эксплантом служат сегменты чешуи (луковичные культуры), листья (розеточные культуры) и пазушные почки (для растений с вертикальным ростам). Разработанные технологии позволяют в течение 1,5–2 месяцев получать на одном экспланте от 8 шт. (гиацинты) до 70 шт. (бегонии) адвентивных почек, способных впоследствии развиваться в нормальные растения. По предварительным расчетам можно получить в течение 6 месяцев 1250 микролуковиц фритиллярии (рябчик императорский) из 15 сегментов луковицы. В течение года из одной луковицы можно вырастить до 8 тысяч лилий. Эти технологии основываются на микрочеренковании или на индукции образования дополнительных почек или луковиц непосредственно на первичном экспланте.
Коммерческое микроразмножение растений становится быстрорастущим промышленным производством (табл. 3.5). Однако созданию коммерческих фирм-лабораторий должно предшествовать прогнозирование рентабельности и социальной необходимости производства данного вида продукции. Перед принятием решения по организации коммерческих лабораторий должны быть учтены такие факторы, как стоимость продукции, рыночная цена, емкость рынка, сезонность поставки, выбор сортов.
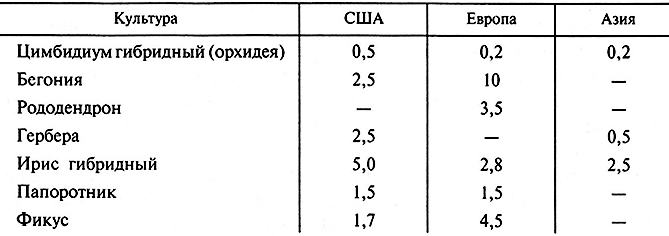
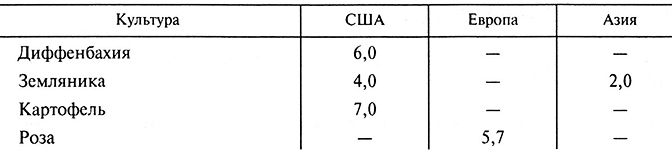
Таблицa3.5. Промышленные культуры (млн шт.), выращенные in vitro в США, странах Азии и Европы в 2000 году
Практический интерес представляют исследования, объектами которых являются зародыши плодовых растений раннего срока созревания. Объясняется это тем, что селекционно-генетическая работа с такими сортами затрудняется из-за формирования у них неполноценных семян с недоразвитыми зародышами, которые в обычных условиях не образуют всходы. Поэтому среди значительного числа сортов разных плодовых культур очень мало раннеспелых (Н.Е. Павловская, Л.В. Голышкин, Л.В. Голышкина, 1998). Во многих научно-исследовательских институтах по плодовым культурам разрабатываются методические приемы культивирования зародышей in vitro (например, для преодоления покоя семян черешни и персика), в результате чего из изолированных зародышей получают стерильные проростки (груша, миндаль, хурма, персик, черешня и др.), а также их межвидовые гибриды (например, миндаль и хурма), которые в дальнейшем размножают in vitro. Размноженные формы и ультраранние и ранние по срокам созревания сорта урожайные, с плодами хорошего качества, включаются в государственное сортоиспытание и районируются (например, персик сорт Пламенный).
Хвойные породы
Интерес к работе с хвойными породами вызван главным образом необходимостью сохранения генофонда некоторых пород, их декоративными свойствами и трудностью размножения черенками. Для можжевельника, например, применение клепального микроразмножения является наиболее перспективным способом, так как семена данной породы обладают низкой всхожестью, наблюдается дегенерация зародышей, а при черенковании процент укорененных черенков не превышает 5—8 %. Введение в культуру криптомерии и ее последующее размножение необходимо с целью получения достаточного количества посадочного материала, который используется главным образом для посадки в садах и парках, где она ценится из-за декоративных свойств. Хвоя криптомерии очень густая, обладает способностью изменять окраску в зимний период, что делает эту породу еше более привлекательной. Что же касается остальных пород, за исключением некоторых видов семейства сосновых, то размноженный посадочный материал в основном используется при озеленении городов.
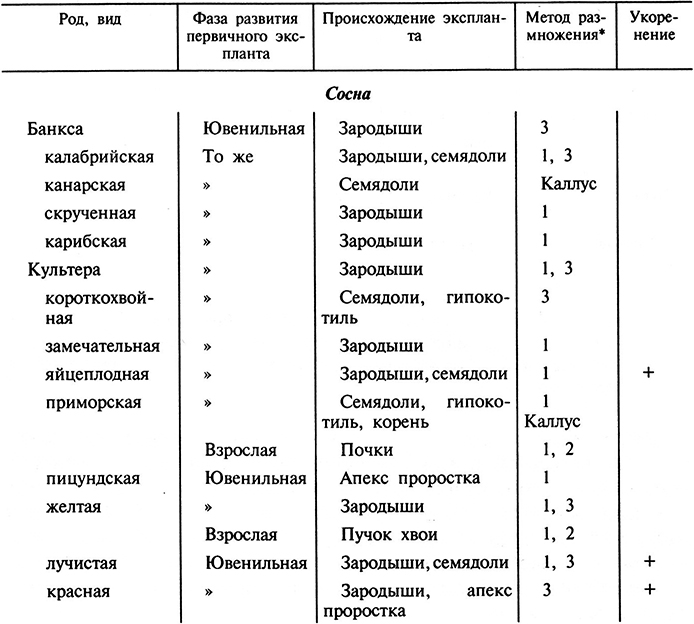
В табл. 3.6 и 3.7 представлены некоторые древесные хвойные породы, для которых разработана техника культивирования изолированных тканей в условиях in vitro.
Таблица 3.6. Применение культуры тканей для размножения хвойных пород


Таблица 3.7. Применение культуры in vitro для клонирования растений представителей рода сосна и ель

Для основных лесообразующих пород России, и прежде всего сосны обыкновенной и ели европейской, в перспективе возможно включение способа культуры изолированных зародышей в систему селекции. В данном случае сокращается примерно в 3,5–4 раза срок получения посадочного материала (рис. 3.16.). Так, в Канаде (Онтарио) ежегодно высаживают на лесокультурную площадь более 60 млн саженцев ели черной, выращенных из изолированных зародышей в стерильных условиях.
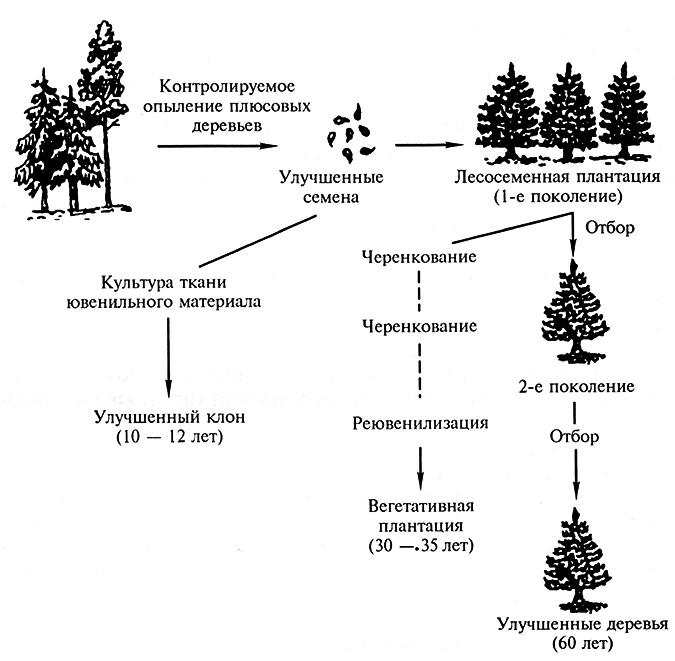
Рис. 3.16. Практическое применение способа клонального микроразмножения в селекции хвойных пород

