4.2.1. ТРАНСПЛАНТАЦИЯ ЭМБРИОНОВ
разработка метода искусственного осеменения сельскохозяйственных животных и его практическое применение обеспечили большой успех в области улучшения генетики животных. Использование этого метода в сочетании с длительным хранением семени в замороженном состоянии открыло возможность получения десятков тысяч потомков от одного производителя в год. Этот прием, по существу, решает проблему рационального использования производителей в практике животноводства.
Что касается самок, то традиционные методы разведения животных позволяют получать от них лишь несколько потомков за всю жизнь. Низкий уровень воспроизводства у самок и длительный интервал времени между поколениями (6–7 лет у крупного рогатого скота) ограничивают генетический процесс в животноводстве. Решение этой проблемы ученые видят в применении метода трансплантации эмбрионов. Суть метода состоит в том, что генетически выдающиеся самки освобождаются от необходимости вынашивания плода и вскармливания потомства. Кроме того, их стимулируют с целью увеличения выхода яйцеклеток, которые затем извлекают на стадии ранних зародышей и пересаживают менее ценным в генетическом отношении реципиентам.
Технология трансплантации эмбрионов включает такие основные звенья, как вызывание суперовуляции, искусственное осеменение донора, извлечение эмбрионов (хирургическое или нехирургическое), оценка их качества, кратковременное или длительное хранение и пересадка.
Стимуляция суперовуляции
Самки млекопитающих рождаются с большим (несколько десятков и даже сотен тысяч) числом половых клеток. Большинство из них постепенно погибают в результате атрезии фолликулов. Только небольшое число примордиальных фолликулов переходят в антральные в процессе роста. Однако практически все растущие фолликулы реагируют на гонадотропную стимуляцию, которая приводит их к конечному созреванию. Обработка самок гонадотропинами в фолликулярной фазе полового цикла или в лютейновой фазе цикла в сочетании с индуцированием регрессии желтого тела простагландином Ф2а (ПГФ2а) или его аналогами приводит к множественной овуляции или так называемой суперовуляции.
Крупный рогатый скот
Индукцию суперовуляции у самок крупного рогатого скота проводят обработкой гонадотропинами, фолликулостимулирующим гормоном (ФСГ) или сывороткой крови жеребой кобылы (СЖК), начиная с 9–14-го дня полового цикла. Через 2–3 дня после начала обработки животным вводят простагландин Ф2а или его аналоги, чтобы вызвать регрессию желтого тела.
Проведены многочисленные испытания разных схем гормональной обработки коров и телок с целью индукции полиовуляции. Наиболее широко в этих целях используют СЖК в дозе 2,5–3,0 тыс. и.е. Известно, что период полужизни эндогенного СЖК у кобыл, установленный гистеректомией, составляет около 6 дней, а при использовании радиоиммунологического метода выявлено наличие двух комплексов в СЖК – один с периодом полужизни 40,0–51,2 ч, второй – 118,4-129,4 ч.
Это свойство СЖК позволяет ограничиться однократным введением его животным при вызывании суперовуляции и вместе с тем может иметь отрицательный эффект вследствие длительного действия на функцию яичников не только в период, предшествующий охоте, но и после нее. Это приводит к нарушению нормального уровня половых гормонов и особенно их соотношения в организме животных.
Для устранения этого нежелательного свойства СЖК в последнее время применяют антитела к гонадотропину с целью увеличения числа и улучшения качества эмбрионов, полученных при суперовуляции.
Введение во время охоты коровам, обработанным 3000 и.е. СЖК на 10-й день цикла и 37,5 мг ПГФ2а на 12-й день, моноклональных антител или овечьей антисыворотки к СЖК уменьшило число неовулировавших фолликулов (1,7 и 2,7 против 6,5 фолликула в контроле) и повысило оплодотворяемость (>80 % против 60 % в контроле). Уровень эстрогенов в крови коров резко понижался вскоре после введения антисыворотки и оставался низким до извлечения эмбрионов, тогда как у контрольных животных уровень эстрогенов не снижался до базального уровня во время охоты и снова увеличивался после охоты (Дж. Мауэрт и др., 1985).
Для стимуляции полиовуляции у коров наряду с СЖК применяют гипофизарные гонадотропины. С этой целью используют очищенный ФСГ отдельно или в сочетании с ЛГ. В отличие от СЖК препараты ФСГ и ЛГ вводят дважды в день в течение 4–5 сут.
Наиболее распространенная схема гормональной обработки коров-доноров, применяемая в коммерческих целях, представлена в табл. 4.2. При этом охота наступает через 40–50 ч после первой инъекции ПГФ2а. Осеменение проводят через 12 и 24 ч после наступления охоты. Эмбрионы извлекают нехирургическим способом через 7–7,5 дней после осеменения.
Таблица 4.2. Схема обработки коров гонадотропинами (по В. Хансел, Б.А. Хилва, 1985)
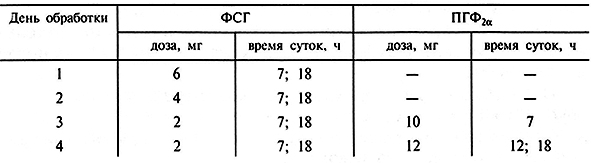
В связи с тем, что сроки овуляции у гормонально обработанных животных увеличиваются, изменяется и технология их осеменения. Первоначально рекомендовалось многократное осеменение коров с использованием нескольких доз спермы. Обычно вводят 50 млн живых сперматозоидов в начале охоты и через 12–20 ч осеменение повторяют. Более детальное изучение этого вопроса показало, что высокая эффективность оплодотворения может быть достигнута и при использовании одной дозы семени, если ее вводить через 24 ч после начала охоты.
Овцы
Принципы вызывания суперовуляции у овец те же, что и у крупного рогатого скота: СЖК или ФСГ вводят в конце лютеиновой фазы полового цикла (на 11–13-й день) или в лютеиновую фазу цикла – вместе с обработкой простагландином или во время окончания обработки прогестагенами. СЖК вводят в дозе 20–45 и.е. на 1 кг массы тела, или до 2000 и.е. на одну овцу. Например, аналог простагландина простенол в дозе 100 мкг вводят между 4-м и 13-м днями полового цикла через 24–72 ч после обработки СЖК. Охота наступает через 2–4 дня после обработки простагландином. ФСГ предпочтительнее вводить два раза в день в течение двух дней в уменьшающейся дозе (6,5–3,2 мг) по сравнению с обработкой равными дозами.
Свиньи
У свиней, являющихся многоплодными животными, большое число эмбрионов может быть получено без гормональной обработки. Однако число овуляций у свиней может быть увеличено после гормональной обработки.
Лошади
Еще не разработаны надежные методы индукции суперовуляции у кобыл, однако получение достаточного числа эмбрионов у них не составляет большого труда ввиду простоты нехирургического извлечения и повторного получения эмбрионов в каждый половой цикл.
Извлечение эмбрионов
Эмбрионы крупного рогатого скота поступают из яйцевода в матку между 4-м и 5-м днем после начала охоты (между 3-м и 4-м днем после овуляции), хотя у суперовулировавших коров небольшая часть эмбрионов остается в яйцеводе до 7-го дня. Сроками продвижения эмбрионов в половом тракте коровы и определяется извлечение их из яйцевода или рогов матки.
В связи с тем, что нехирургическое извлечение возможно только из рогов матки, то эмбрионы извлекают не ранее 5-го дня после начала охоты.
Несмотря на то, что при хирургическом извлечении эмбрионов у крупного рогатого скота достигнуты отличные результаты, этот метод неэффективен – относительно дорогостоящий, неудобный для применения в условиях производства.
Нехирургическое извлечение эмбрионов состоит в следующем (рис. 4.1). Гибкий катетер с надувной манжеткой вводят во влагалище и через шейку матки в один из рогов матки. Манжетка надувается и закрывает каудальный выход рога матки, тем самым ограничивая промывную полость. Катетер может быть двухканальным, что позволяет проводить проточное прохождение промывной жидкости. При использовании одноканального катетера промывная жидкость вводится несколько раз (5–8 раз) и затем вытекает из рога матки. В обоих случаях вводят 200–300 мл фосфатного буфера Дюльбекко.
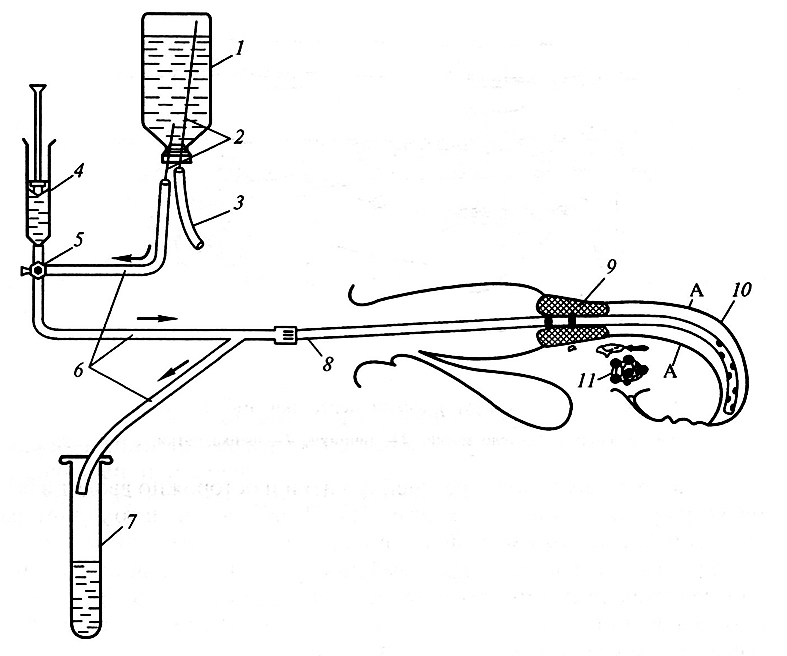
Рис. 4.1. Схема промывания матки крупного рогатого скота:
1 – флакон с физиологической средой; 2 – иглы; 3 – воздушный фильтр; 4 – шприц; 5 – двух-позиционный краник или клапанное устройство;
6 – трубки; 7– сосуд для сбора смыва; 8– безманжетный катетер, введенный в рог матки; 9– шейка матки; 10– рог матки;
11 – яичник (стрелками показано направление движения жидкости; А – место пережатия рога матки)
Наиболее оптимальные сроки для извлечения эмбрионов – 6–8-й день после начала охоты, так как ранние бластоцисты этого возраста наиболее пригодны для глубокого замораживания и могут быть с высокой эффективностью пересажены нехирургическим способом. Корову-донора используют 6–8 раз в год, извлекая по 3–6 эмбрионов.
У овец и свиней нехирургическое извлечение эмбрионов невозможно ввиду трудности прохождения катетера через шейку в рога матки. Однако хирургическая операция у этих видов животных относительно проста и непродолжительна. Доступ к репродуктивному тракту осуществляется лапаротомией по белой линии живота. У свиней 1 -, 2- и 4-клеточные эмбрионы извлекают из яйцеводов в течение 40 ч после овуляции. При этом стеклянную канюлю вставляют в истмус через маленькое отверстие в верхушке рога матки. Через канюлю вводят 20–30 мл промывной жидкости и собирают ее из ампулярного конца яйцевода в чашку Петри. Для извлечения эмбрионов из матки промывают яйцевод и верхушку рога матки. Рог матки пережимают и канюлю вставляют в рог матки. Обычно для вымывания используют среду Дюльбекко с лактатом, пируватом и бычьим сывороточным альбумином. Эмбрионы свиней можно извлекать до 12-го дня после начала охоты. Эффективность извлечения эмбрионов обычно высокая (около 95 %). Можно делать 3–4 операции на одном животном (С. Полдж, 1982).
При извлечении эмбрионов у овец в ампулярный конец яйцевода вводят стеклянную или полиэтиленовую канюлю и промывают из рога матки в яйцевод. Независимо от времени вымывания поле охоты эффективность извлечения эмбрионов составляет около 80 %.
Пересадка эмбрионов
Параллельное разработкой хирургического метода извлечения эмбрионов у крупного рогатого скота значительный прогресс был достигнут и в нехирургической пересадке эмбрионов (рис. 4.2). В пайету набирают свежую питательную среду (столбик длиной 1,0–1,3 см), затем небольшой пузырек воздуха (0,5 см) и далее основной объем среды с эмбрионом (2–3 см). После этого засасывают немного воздуха (0,5 см) и питательную среду (1,0–1,5 см). Пайету с эмбрионом помещают в катетер Кассу и до момента пересадки хранят в термостате при 37 °С. Далее под ректальным контролем катетер пропускают через шейку матки и осторожно вводят в рог матки на расстоянии 5–7 см от ее тела. Нажатием на шток катетера выдавливают содержимое пайеты вместе с эмбрионом в рог матки.
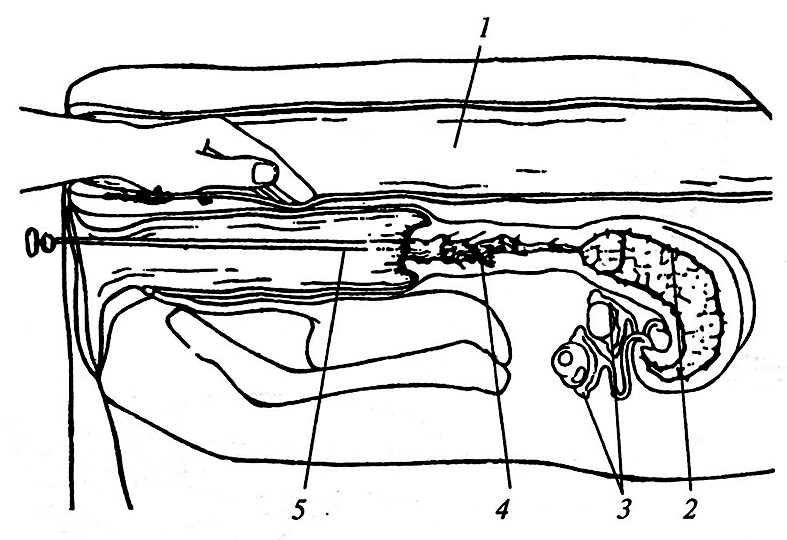
Рис. 4.2. Схема нехирургической пересадки эмбрионов корове:
1 – прямая кишка; 2 – тело матки; 3 – яичники; 4 – шейка матки; 5 – катетер
Эффективность пересадки эмбрионов в значительной степени определяется синхронностью проявления охоты у донора и реципиента. У крупного рогатого скота максимальное число беременностей получают после синхронной пересадки.
Введение эмбрионов в оба рога матки обеспечивает высокую эффективность пересадки. Этот прием успешно используют для получения двойневости. Процедура получения двойневости включает пересадку 7-дневных эмбрионов осемененному животному в рог, противоположный яичнику с желтым телом.
Нехирургическая пересадка эмбрионов разработана также для кобыл. Высокая эффективность нехирургической пересадки эмбрионов у лошадей была достигнута между 6-м и 8-м днями после овуляции.
У овец и свиней пересадку эмбрионов проводят только хирургическим способом. У реципиентов используется аналогичный хирургический подход, как и у доноров. Эмбрионы пересаживают в яйцевод или матку в зависимости от стадии развития.
Эмбрионы овцы, извлеченные на 1–4-й день после охоты, пересаживают в яйцевод, а эмбрионы более старшего возраста – в матку. Приживляемость составляет 70–75 %.
У свиней приживляемость эмбрионов не снижается, если двухклеточные эмбрионы извлекают из яйцевода и пересаживают в матку реципиента на той же стадии развития. Эмбрионы свиньи рекомендуется пересаживать только в один рог матки, так как они мигрируют и распределяются в обоих рогах матки. После пересадки 2–5-дневных эмбрионов приживляемость составляет 60–70 %. Пересадка эмбрионов свиней на более поздних стадиях развития (7–8-дневных) сопровождается либо отсутствием беременности, либо значительным снижением приживляемости (С. Полдж, 1982).
Хранение эмбрионов
Применение метода трансплантации эмбрионов потребовало разработки эффективных методов их хранения в период между извлечением и пересадкой. В производственных условиях эмбрионы обычно извлекают утром, а пересаживают в конце дня. Для хранения эмбрионов в течение этого времени используют фосфатный буфер с некоторыми модификациями при добавлении эмбриональной сыворотки крупного рогатого скота и при комнатной температуре или температуре 37 °С.
Наблюдения показывают, что эмбрионы крупного рогатого скота можно культивировать in vitro до 24 ч без заметного снижения их последующей приживляемости.
Пересадка эмбрионов свиней, культивируемых 24 ч, сопровождается нормальной приживляемостью. Выживаемость эмбрионов в определенной степени может быть увеличена охлаждением их ниже температуры тела. Чувствительность эмбрионов к охлаждению зависит от вида животного.
Эмбрионы свиней особенно чувствительны к охлаждению. Пока не удалось сохранить жизнеспособность эмбрионов свиней на ранних стадиях развития после охлаждения их ниже 10–15 °С (С. Полдж, 1982).
Эмбрионы крупного рогатого скота на ранних стадиях развития также очень чувствительны к охлаждению до 0 °С. Однако на более поздних стадиях развития, таких как морула или бластоциста, они хорошо выдерживают охлаждение.
Эмбрионы овец хорошо переносят охлаждение до 0 °С на любых стадиях развития, от одно-, двухклеточной стадии до бластоцисты. Понижение температуры хранения эмбрионов от 37 °С до 10 и 0 °С угнетает или останавливает их развитие, но обменные процессы протекают на уровне, обеспечивающем хранение до 5–6 сут. Для длительного хранения эмбрионов необходимо не только затормозить их развитие, но и значительно снизить или полностью остановить обменные процессы. Такое состояние эмбрионов достигается при температуре -195 °С или ниже.
Эксперименты последних лет позволили определить оптимальные соотношения между скоростью охлаждения и оттаивания эмбрионов крупного рогатого скота. Установлено, что если эмбрионы охлаждают медленно (1 °С/мин) до очень низкой температуры (ниже –50 °С) с последующим переносом в жидкий азот, то они требуют и медленного оттаивания (25 °С/мин или медленнее). Быстрое оттаивание таких эмбрионов может вызвать осмотическую регидратацию и разрушение. Если эмбрионы замораживают медленно (1 °С/мин) только до –25 и 40 °С с последующим переносом в жидкий азот, то их можно оттаивать очень быстро (300 °С/мин). В этом случае остаточная вода при переносе в жидкий азот трансформируется в стекловидное состояние (С. Вилладсен, 1980).
Выявление этих факторов привело к упрощению процедуры замораживания и оттаивания эмбрионов крупного рогатого скота. В частности, оттаивают эмбрионы, как и сперму, в теплой воде при 35 °С в течение 20 с непосредственно перед пересадкой без применения специального оборудования с заданной скоростью повышения температуры.
В последние годы установлено, что замороженные и оттаявшие эмбрионы могут быть успешно разбавлены одноступенчато в пайете, где они были заморожены. Сущность метода состоит в следующем. Замороженно-оттаянные эмбрионы переносят одноступенчато из раствора криопротектора, в частности 1,5 М глицерина в фосфатном буфере, в котором они были заморожены, в среду, содержащую гипертонический раствор не проникающего в клетку соединения, каким является сахароза. Это обеспечивает постепенное удаление криопротектора из эмбриона без нарушения осмотического равновесия в 0,02 мл 1,5 М глицерина.
При помощи воздушных пузырьков пайету делят на три камеры: в первой – раствор криопротектора; во второй – эмбрион в растворе криопротектора; в третьей – растворитель (1,08 М раствор сахарозы). После замораживания и оттаивания содержимое пайеты перемешивают встряхиванием. Затем эмбрион может быть пересажен из пайеты нехирургическим способом реципиенту. Этот метод позволяет пересаживать замороженно-оттаянные эмбрионы по типу искусственного осеменения. Сравнение методов одноступенчатого и многоступенчатого оттаивания эмбрионов показало, что оба они дают одинаковые результаты.
Успешное замораживание и оттаивание эмбрионов овец впервые было проведено С. Вилладсен и др. (1974). Эмбрионы медленно охлаждали (от 0,3 до 2,0 °С/мин) и медленно оттаивали (от 4 до 25 °С/ мин). В качестве криопротектора применяли ДМСО. Позднее установлено, что при использовании 1,5 М ДМСО в фосфатном буфере замораживание со скоростью 1 °С/мин до –120 °С сопровождалось выживаемостью эмбрионов только в том случае, если применялось быстрое оттаивание (360 °С/мин). Однако при замораживании со скоростью 0,3 °С/мин была сохранена выживаемость эмбрионов как при быстром так и при медленном оттаивании (10 или 4 °С/мин). При дальнейшем уменьшении скорости замораживания до 0,1 °С/мин в интервале температур между -30 и –60 °С медленное оттаивание было обязательным.
Первый жеребенок был получен после пересадки 11 замороженно-оттаянных эмбрионов, извлеченных на 6-й день после овуляции. Сообщалось о получении двух жеребят после хирургической пересадки четырех шестидневных замороженных эмбрионов трем реципиентам.
Таким образом, установлено, что эмбрионы крупного рогатого скота в первые дни развития особенно чувствительны к охлаждению, но когда они достигают стадии бластоцисты, то устойчивы к охлаждению в более широком диапазоне стадий развития. У свиней ни на одной стадии развития эмбрионы не выживают после охлаждения их до температуры ниже 10–15°С. Достигнуто успешное замораживание до -196°С и оттаивание эмбрионов крупного рогатого скота, овец и лошадей на стадиях морулы и бластоцисты с получением живого потомства у всех трех видов животных. На практике этот прием используют пока при разведении крупного рогатого скота.
4.2.2. ОПЛОДОТВОРЕНИЕ ЯЙЦЕКЛЕТОК
ВНЕ ОРГАНИЗМА ЖИВОТНОГО
Разработка системы оплодотворения и обеспечения ранних стадий развития эмбрионов млекопитающих вне организма животного (in vitro) имеет огромное значение в решении ряда научных задач и практических вопросов, направленных на повышение эффективности разведения животных.
Система оплодотворения in vitro может быть использована прежде всего как ценный аналитический инструмент для изучения биохимических и физиологических факторов, включающихся в процесс оплодотворения, соединения мужской и женской гамет. Только с освоением техники оплодотворения вне организма появилась реальная возможность для широкого развертывания исследований по генной и клеточной инженерии и особенно сельскохозяйственных животных. Для этих целей необходимы эмбрионы на ранних стадиях развития, которые можно извлечь только хирургическими методами из яйцеводов, что является трудоемким и не дает достаточного числа зародышей для проведения этой работы. К тому же существующие методы гормональной регуляции воспроизводительной функции у сельскохозяйственных животных не позволяют достичь высокой точности контроля времени овуляции и вследствие этого получить достаточное число эмбрионов на желаемой стадии развития. Методы клеточной и генной инженерии на животных предусматривают также проведение длительных манипуляций с гаметами и эмбрионами вне организма. Все эти проблемы могут быть решены в значительной степени с использованием системы оплодотворения яйцеклеток млекопитающих вне организма.
Оплодотворение яйцеклеток млекопитающих in vitro включает следующие основные этапы: созревание ооцитов, капацитацию сперматозоидов, оплодотворение и обеспечение ранних стадий развития.
Созревание ооцитов in vitro
Большое число половых клеток в яичниках млекопитающих, в частности у крупного рогатого скота, овец и свиней с высоким генетическим потенциалом, представляет источник огромного потенциала воспроизводительной способности этих животных в ускорении генетического прогресса по сравнению с использованием возможностей нормальной овуляции. У этих видов животных, как и других млекопитающих, число ооцитов, овулирующих спонтанно во время охоты, составляет только незначительную часть от тысяч ооцитов, находящихся в яичнике при рождении животного. Остальные ооциты регенерируют внутри яичника или, как говорят обычно, подвергаются атрезии. Естественно возникал вопрос, нельзя ли выделить ооциты из яичников путем соответствующей обработки и провести их дальнейшее оплодотворение вне организма животного. В настоящее время не разработаны методы использования всего запаса ооцитов в яичниках животных, но значительное число ооцитов может быть получено из полостных фолликулов для дальнейшего их созревания и оплодотворения вне организма.
Явление спонтанного возобновления мейоза ооцитов, выделенных из фолликулов кролика и помещенных в культуральную среду, было впервые открыто Г. Пинкусом и Н. Энзманом (1935).
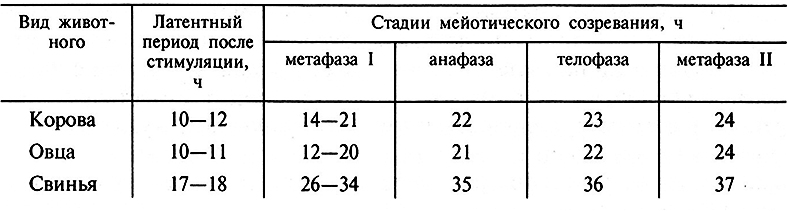
Известно, что после выделения ооцита из фолликула, как и после выброса эндогенного ЛГ в организме животного перед овуляцией, ооцит освобождается из состояния мейотического торможения, что сопровождается так называемым разрывом зародышевого пузырька. В организме крупного рогатого скота разрыв зародышевого пузырька происходит примерно через 5 ч после выброса Л Г, ооцит достигает метафазы I через 12 ч и метафазы II через 24–25 ч. Вне организма ядерная мембрана зародышевого пузырька крупного рогатого скота также исчезает через 5–6 ч, через 12 ч хромосомы достигают метафазы I и через 20–24 ч – метафазы II.
Видовые различия в проявлении мейотического созревания ооцитов у коров, овец и свиней показаны в табл. 4.3.
Таблица 4.3. Временные параметры проявления стадий мейоза ядра ооцнтов видов животных
на предовуляторный выброс гонадотропинов (Ч. Хангер, 1980)
Хотя большинство ооцитов, извлеченных из фолликулов яичников, возобновляют мейоз и достигают метафазы II, оплодотворение их часто не обеспечивает полноценного развития зародышей. Предполагают, что основной причиной этого является неполноценное созревание ооцитов. Одной из причин может быть то, что при созревании ооцита in vitro в цитоплазме не вырабатывается в достаточной мере фактор, контролирующий формирование и развитие мужского пронуклеуса. Считают, что для появления в цитоплазме ооцита фактора, вызывающего созревание мужского пронуклеуса, необходимо обеспечить индуктивное влияние нормального окружения ооцита в фолликуле в течение не менее 6 ч после начала мейотического созревания.
Это было подтверждено в опытах по оплодотворению in vitro ооцитов свиней, извлеченных из фолликулов на разных стадиях мейоза. С прогрессированием стадии развития в момент извлечения ооцита из фолликула повышался процент нормально оплодотворенных зародышей: нормальное оплодотворение имело место у 31,7; 51,6 и 78,2 % культивируемых ооцитов со стадии зародышевого пузырька, диакинеза и метафазы соответственно.
Установлено, что стероидные гормоны не требуются для запуска мейоза у млекопитающих, но необходимы для полного физиологического созревания ооцита.
В связи с тем, что стероидные гормоны и другие факторы, вырабатываемые фолликулярными клетками, оказывают влияние на созревание ооцитов, было сделано предположение, что культивирование ооцитов с фолликулярными клетками может повысить их способность к нормальному оплодотворению и последующему эмбриональному развитию. Многие явления внутри фолликула, включая биосинтез стероидов и синтез белков, регулируют гонадотропные гормоны. Поэтому при культивировании ооцитов внутри фолликулов или с фолликулярными клетками гонадотропины должны быть обязательной составной частью среды.
Необходимость прямого контакта между соматическими (фолликулярными) и половыми клетками обусловлена целым рядом причин. Фолликулярные клетки играют важную роль в питании ооцита. Они обеспечивают энергетический субстрат ооциту, участвуют в переносе некоторых предшественников аминокислот, нуклеотидов и фосфолипидов в ооцит, генерируют инструктивные сигналы, которые влияют на ядро и прямой синтез определенных структурных белков. Инструктивные сигналы, требуемые для созревания ооцитов, как было показано выше, наиболее важны в первые 6–8 ч после инициации.
В настоящее время применение на практике нашло созревание in vitro только ооцитов крупного рогатого скота. Ооциты получают из яичников коров после убоя животных и путем прижизненного извлечения 1–2 раза в неделю. В первом случае яичники берут от животных после убоя, доставляют в лабораторию в термостатированном контейнере в течение 1,5–2,0 ч. В лаборатории яичники дважды промывают свежим фосфатным буфером. Ооциты извлекают из фолликулов, диаметр которых 2–6 мм, путем отсасывания или разрезания яичника на пластинки. Ооциты собирают в среду ТСМ 199 с добавлением 10 % сыворотки крови от коровы в охоте, затем дважды промывают и отбирают для дальнейшего созревания in vitro только ооциты с компактным кумулюсом и однородной цитоплазмой.
В последнее время разработан способ прижизненного извлечения ооцитов из яичников коров с помощью ультразвукового прибора или лапароскопа. При этом ооциты отсасывают из фолликулов, диаметр которых не менее 2 мм, 1–2 раза в неделю от одного и того же животного. В среднем получают однократно 5–6 ооцитов на животное. Менее 50 % ооцитов пригодны для созревания in vitro.
Несмотря на низкий выход ооцитов, при каждом извлечении возможность многократного использования животного, с учетом информации о происхождении полученных ооцитов, открывает новые перспективы применения метода оплодотворения in vitro в практических целях.
Отобранные ооциты с компактным кумулюсом созревают в течение 24 ч в среде ТСМ 199 с добавлением 20 %-й обработанной теплом сыворотки крови от коровы в охоте, гранулезных клеток (3–5 • 106 клеток в 1 мл) и небольшого количества антибиотиков (50 и.е. пенициллина, 50 мкг стрептомицина на 1 мл). Гранулезные клетки собирают из среды, в которой ооциты отделяют от фолликулов и центрифугируют дважды по 5 мин при 500 g. Осадок гранулезных клеток суспендируется в среде для созревания. Сокультивирование ооцитов и гранулезных клеток проводят при 38,5 °С в атмосфере 5 % СО2 в чашках Петри в 2 мл среды.
Капацитация сперматозоидов
Важным этапом в разработке метода оплодотворения у млекопитающих было открытие явления капацитации спермиев. В 1951 г. М.К. Чанг и одновременно с ним Г.Р. Аустин установили, что оплодотворение у млекопитающих наступает только втом случае, если спермии в течение нескольких часов до овуляции находятся в яйцеводе животного. Основываясь на наблюдениях по изучению проникновения спермиев яйцеклетки крысы в различные сроки после спаривания Г.Р. Аустин ввел термин капацитации. Он означает, что в спермии должны произойти некоторые физиологические изменения до того, как сперматозоид приобретет способность к оплодотворению.
В последующих исследованиях в лаборатории М.К. Чангабыли не только определены оптимальные условия капацитации спермиев в половом тракте самки, но и продемонстрирована возможность декапацитации спермиев кролика, извлеченных из матки, обработанной семенной плазмой кролика, человека и быка, рекапацитации этих спермиев при внесении их в яйцеводы и, наконец, удаления декапацитирующего фактора из семенной плазмы центрифугированием.
Капацитация включает начальное изменение мембраны спермия, что позволяет ему пройти вторую фазу (акросомную реакцию), а также слияние плазменной и внешней акросомной мембран. В настоящее время первую фазу обозначают, как собственно, капацитацию, а вторую – как акросомную реакцию.
Показано, что у спермиев крупного рогатого скота происходит акросомная реакция исключительно в ампуле яйцевода, расположенной ипсилатериально к стороне яичника с овуляцией, и только во время или непосредственно после овуляции. Эти наблюдения дают основание предполагать, что капацитация происходит преимущественно в яйцеводе, расположенном на той же стороне, что и яичник с овулирующим фолликулом. Установлено также, что содержимое, извлеченное из яйцевода во время эструса, но не влютеиновую фазу полового цикла у овец, вызывает капацитацию и акросомную реакцию спермиев быка.
Глюкозоаминоглюканы in vitro вызывают акросомную реакцию или капацитацию бычьих эпидидимальных спермиев. При анализе глюкозоаминокл юканов в смывах яйцеводов крупного рогатого скота выявлена концентрация гепариноподобного материала.
В опытах in vitro установлено, что гепарин – наиболее потенциальный глюкозоаминоглнжан по способности вызывать акросомную реакцию уэпидидимальных спермиев быка и капацитацию эякулированных спермиев.
В организме коровы все спермии, прикрепленные к прозрачной оболочке, были с акросомной реакцией. Кроме того, при помощи электронной микроскопии обнаружено, что спермии быка, найденные в окружении и непосредственно в кумулюсной массе, в яйцеводе сохранили акросомы в полном объеме и только спермии, прикрепленные к прозрачной оболочке, имели акросомную реакцию. Эти данные свидетельствуют о том, что спермии быка капацитируются в яйцеводе, а оплодотворяющий спермий завершает акросомную реакцию около или в прозрачной оболочке.
Разработано несколько методов капацитации эякулированных спермиев домашних животных. Для удаления белков с поверхности спермиев, которые, по-видимому, тормозят капацитацию спермиев, была использована среда с высокой ионной силой.
Однако наибольшее признание получил способ капацитации сперматозоидов с использованием гепарина (Дж. Парриш и др., 1985). Пайеты с замороженным семенем быка оттаивают в водяной бане при 39 °С втечение 30–40 с. Примерно 250 мкл оттаянного семени подслаивают под 1 мл среды для капацитации. Среда для капацитации состоит из модифицированной среды Тиройда, без ионов кальция. После инкубации в течение одного часа верхний слой среды объемом 0,5–0,8 мл, содержащий большинство подвижных сперматозоидов, удаляют из пробирки и промывают дважды центрифугированием при 500g втечение 7–10 мин. После 15 мин инкубации с гепарином (200 мкг/мл) суспензию разбавляют до концентрации 50 млн сперматозоидов в 1 мл.
В Биотехцентре (Н.М. Сураева) было показано, что концентрация спермиев при всплывании стабилизируется уже в первые 5 мин и не меняется в течение последующего часа (табл. 4.4).
Таблица 4.4. Эффективность всплывания спермиев
в зависимости от продолжительности инкубации (Н.М. Сураева)
Таким образом, согласно табл. 4.4, можно значительно сократить продолжительность всплывания с 45–60 до 5–15 мин, что, в свою очередь, ускоряет, а значит, и облегчает оплодотворение. Были проведены опыты по оплодотворению вне организма яйцеклеток крупного рогатого скота спермой, подвергшейся процедуре всплывания в течение 15 и 60 мин. Эксперименты с использованием двух интервалов инкубации показали, что продолжительность инкубации заметно не влияет на эффективность дробления оплодотворенных вне организма яйцеклеток крупного рогатого скота.
Полученные результаты открывают перспективы повышения выхода живых спермиев из одной дозы размороженной спермы, так как появилась возможность проведения процедуры всплывания спермиев с одним и тем же осадком несколько раз без потери их жизнеспособности.
Используя прием многократной смены среды, можно в несколько раз (в наших опытах в пять раз) увеличить эффективность использования одной порции эякулята, что особенно важно при применении спермы от высокоценных быков-производителей.
Оплодотворение in vitro
и обеспечение ранних стадий развития эмбрионов
Оплодотворение яйцеклеток у млекопитающих осуществляется в яйцеводах. Это затрудняет доступ исследователя к изучению условий среды, в которой происходит процесс оплодотворения. Поэтому система оплодотворения in vitro была бы ценным аналитическим инструментом для изучения биохимических и физиологических факторов, включающихся в процесс успешного соединения гамет. Более того, предполагалось, что эта система найдет применение в технологии разведения животных.
Крупный рогатый скот
Применяют следующую схему оплодотворения in vitro и культивирования ранних эмбрионов крупного рогатого скота. Оплодотворение in vitro проводят в капле модифицированной среды Тироида. После созревания in vitro ооциты частично очищают от окружающих экспандированных кумулюсных клеток и переносят в микрокапле по пять ооцитов в каждой. Суспензия сперматозоидов объемом 2–5 мкл добавляется к среде с ооцитами, чтобы достичь концентрации сперматозоидов в каплях млн/мл. Через 44–48 ч после осеменения определяют наличие дробления ооцитов. Затем эмбрионы помещают на монослой эпителиальных клеток для дальнейшего развития в течение 5 дней.
Овцы
Оплодотворение у овец исследовали двумя путями: in vitro и введением фолликулярных ооцитов в яйцевод осемененной овцы. Как и у крупного рогатого скота, число оплодотворенных яйцеклеток было больше в том случае, когда фолликулярные и овулировавшие ооциты помещали в яйцевод со спермиями. При использовании системы оплодотворения in vitro таких клеток было меньше.
Ооциты культивировали в среде ТСМ 199 с 10 %-й инактивированной фетальной сывороткой с добавлением гонадотропинов (ЛГ и ФСГ) и эстрадиола – 17р. Затем ооциты оплодотворяют in vitro эякулированными спермиями, капацитированными в течение 8 ч в модифицированной среде ДМ с добавлением 10 мМ буфера Хепеса. Хирургическим путем переносят 2–4-клеточные эмбрионы в яйцеводы ложнобеременным кроликам. Через три дня ооциты из яйцевода кролика извлекают и пересаживают в матку постоянного реципиента.
Свиньи
К настоящему времени неизвестны какие-либо данные об оплодотворении in vitro ооцитов свиней. Вместе с тем некоторые исследователи наблюдали проникновение спермиев в ооциты свиней после созревания их in vitro и пересадки осемененной эстральной свиньи, но ни один ооцит не продолжал развитие и у многих из них проявилась полиспермия.
Другие авторы сообщали о нормальном оплодотворении и развитии в аналогичной системе ооцитов, полученных из яичников свиней, обработанных ХГ за 12 ч до ожидаемой овуляции. Можно полагать, что только после полного созревания ооцита в организме животного происходит блокирование полиспермии, нормальное оплодотворение и дальнейшее развитие эмбрионов этого вида.
Более успешные результаты достигнуты при культивировании ранних эмбрионов свиней in vitro. Так, после 48 ч культивирования 1–4-клеточных эмбрионов свиней и последующей их хирургической пересадки были получены беременности у двух из 13 свиней. После культивирования 8-клеточных эмбрионов в течение 48 ч до стадии бластоцисты и затем пересадки 19 свиньям-реципиентам 10 животных были беременны во время убоя через 21 день, но только 51 из 229 эмбрионов были представлены живыми плодами.
4.2.3. МЕЖВИДОВЫЕ ПЕРЕСАДКИ ЭМБРИОНОВ
И ПОЛУЧЕНИЕ ХИМЕРНЫХ ЖИВОТНЫХ
Принято считать, что успешная пересадка эмбрионов может быть осуществлена только между самками одного вида. Пересадка эмбрионов, например, овец козам и наоборот сопровождается их приживляемостью, но не завершается рождением потомства. Во всех случаях межвидовых беременностей непосредственной причиной абортов является нарушение функции плаценты, по-видимому, за счет иммунологической реакции материнского организма на инородные антигены плода. Эта несовместимость может быть преодолена получением химерных эмбрионов с помощью микрохирургии.
Сначала были получены химерные животные путем объединения бластомеров из эмбрионов одного вида. С этой целью получали сложные химерные эмбрионы овец объединением 2-, 4-, 8-клеточных эмбрионов. Каждый сложный объединенный эмбрион состоял из равного числа бластомеров эмбрионов от 2–8 родителей. При этом общее число клеток колебалось от четырех до восьмикратного увеличения нормального числа клеток. Эмбрионы вводили в агар и переносили в лигатированные яйцеводы овец для развития до стадии ранней бластоцисты. Нормально развивающиеся бластоцисты пересаживали реципиентам и получали живых ягнят, большинство из которых оказались химерными по данным анализа крови и внешним признакам.
Получены химерные овцы путем инъекций внутренней клеточной массы, выделенной иммунохирургическим путем из эмбрионов доноров в бластоцисты эмбрионов реципиентов. Зону пеллюциду у бластоцист доноров удаляли инкубированием в 0,5 %-й проназе и пипетированием.
Для восстановления их функции после обработки проназой эмбрионы культивировали в течение 3 ч. Затем эмбрионы без прозрачной оболочки культивировали в течение 1 ч в антисыворотке к клеткам печени овцы, три раза отмывали и помещали в раствор (1:4) сыворотки крови морской свинки на 1 ч. Лизированные клетки трофобласта удаляли пипетированием, а изолированную внутреннюю клеточную массу вводили проколом инъекционной пипетки через зону пеллюциду в трофобласт бластоцисты реципиента. После пересадки этих бластоцист получены химерные ягнята как по признакам групп крови, так и по внешним признакам.
Получены химеры и у крупного рогатого скота (Г. Брем и др., 1985) соединением половинок 5–6,5-дневных эмбрионов. Пять из семи телят, полученных после нехирургической пересадки агрегированных эмбрионов, не имели признаков химеризма. Один теленок был химерой двух пород – бурой швицкой и голштинофризской. Однако масть бурой швицкой породы доминировала. Анализ крови этого теленка показал присутствие групп крови только от родителей голштинофризской породы. Другой теленок был химерой неопределенного происхождения.
Показана высокая эффективность получения химер крупного рогатого скота объединением морул без зоны пеллюциды. Авторы получили химеры крупного рогатого скота с «двойной мускулатурой». И этих исследованиях показано, что передача химерам родительского типа имеет случайный характер, т. е. потомство может развиваться из клеток, происходящих или от любого эмбриона, или от сочетания эмбрионов. Половина всех химер представляет особый интерес.
Наиболее показательно получение химер от объединенных частей эмбрионов разных видов, например овцы и козы.
Исследования С.В. Фехилли и др. (1984) показали, что бластомеры овцы и козы, заключенные в агар и помещенные на 4–5 сут в лигатированный яйцевод овцы, могут формировать комбинированные бластоцисты. Эти бластоцисты жизнеспособны и могут развиваться до рождения нормального потомства. В первом опыте в результате объединения по одному бластомеру из 4-клеточных эмбрионов овцы и козы получено 17 бластоцист, пересадка которых завершилась получением семи потомков. Все потомки были похожи в основном на ягнят, но у трех из них руно имело поперечные валики и лоскуты волос, резко контрастирующие с плотно вьющейся шерстью.
4.2.4. КЛОНИРОВАНИЕ ЖИВОТНЫХ
Число потомков от одной особи, как правило, у высших животных бывает небольшим, а специфический комплекс генов, определяющий высокую продуктивность, возникает редко и в последующих поколениях претерпевает значительные изменения.
Вместе с тем известно, что ядро соматической клетки обладает полной генетической информацией о данном организме, и если создать условия для реализации этой информации, то можно получить практически неограниченное число генетических копий (клонов) определенной особи. Поскольку ядра большинства соматических клеток находятся в дифференцированном состоянии, то эту задачу на первом этапе решали, используя эмбриональные клетки на определенной стадии развития зародыша, когда еще не произошла их дифференциация. Пересадка ядер (бластомеров) в зрелые ооциты дает такую возможность, потому что цитоплазма ооцитов содержит специфические факторы, способные репрограммировать пересаженное ядро и запускать программу развития нового эмбриона.
Получение однояйцовых близнецов
Имеет большое значение для животноводства. С одной стороны, увеличивается выход телят от одного донора, а с другой – появляются генетически идентичные двойни. Получение идентичных двоен в большом количестве могло бы облегчить оценку быков по качеству потомства, уменьшить стоимость спермопродукции, ускорить и удешевить тестирование препаратов и упростить исследования в области кормления животных.
Возможность микрохирургического разделения эмбрионов млекопитаюших на ранних стадиях развития на две и более части, чтобы каждая в последующем развивалась в отдельный организм, была вымазана несколько десятилетий назад. Первое потомство однояйцовых мышей было получено из механически изолированных бластомеров двухклеточных эмбрионов в 1970 г. Используя ту же технику разделения, но с применением метода заключения в агар, С.М. Вилладсен (1979) описал получение однояйцовых двоен у овец разделением 2-клеточных эмбрионов. Последующие эксперименты показали, что одинаковые двойни могут быть также получены из 4- и 8-клеточных эмбрионов разделением бластомеров на две группы (С.М. Вилладсен, 1980). Половинки из 2-, 4- и 8-клеточных эмбрионов так же жизнеспособны, как и нормальные эмбрионы овец. Их можно хранить в замороженном состоянии, что позволило применить их в эксперименте для получения монозиготных двоен разного возраста.
Выживаемость четвертей эмбрионов клетки или 8-клеточных эмбрионов на четыре пары клеток ниже, чем нормальных. Выживаемость эмбрионов, полученных из отдельных бластомеров 8-клеточных эмбрионов, почти нулевая.
Установлено, что бластоцисты, полученные из половинок эмбрионов, состоят из 32 клеток, т. е. составляют л ишь 50 % нормального числа клеток. Отдельные бластомеры из 4-клеточного эмбриона также способны развиться в бластоцисту. Однако бластоциста из такой четверти состоит из 16 клеток и меньше.
На 8-клеточной стадии каждый бластомер имеет потенциальную возможность развиваться в бластоцисту, но очень маленького размера, примерно из восьми клеток. При пересадке таких бластоцист менее 10 % из них развиваются до стадии рождения.
На основе этих исследований можно предположить, что резкое уменьшение числа клеток эмбриона является основным фактором, понижающим способность этих эмбрионов развиваться в жизнеспособные бластоцисты, хотя стадия развития, на которой происходит разделение, имеет малое значение.
После того как для эмбрионов большинства животных заканчивается компактизация морулы, защита со стороны зоны пеллюциды становится несущественной. Поэтому последующие разработки по получению монозиготных двоен были направлены на использование поздних морул и бластоцист.
В настоящее время применяют простую технику разделения эморионов на различной стадии развития (от поздней морулы до вылупившейся бластоцисты) на две равные части одновременно с разрезом зоны пеллюциды. При этом не выявлена существенная роль присутствия зоны пеллюциды для эффективности развития разделенных бластоцист.
Использование эмбрионов на более поздних стадиях развития у крупного рогатого скота для получения однояйцовых близнецов облегчается тем, что их извлекают нехирургическим способом.
Простая техника разделения разработана и для 6-дневных эмбрионов свиней. При этом стеклянной иглой разрезают внутреннюю клеточную массу эмбриона и примерно 40 % зоны пеллюцида. Затем разрезают слой трофоэктодермы внутри зоны пеллюциды. Одну половинку эмбриона в собственной зоне пеллюциды, а другую без зоны пеллюциды пересаживают в рог матки 6-дневного реципиента на расстоянии 5 см от маточно-трубного соединения.
Техника разделения на половинки эмбрионов успешно применяется на овцах и на козах.
Деление на стадии поздней бластоцисты считается более удобным, так как блестящая оболочка тоньше и цитоплазма эластичнее, чем у ранней бластоцисты.
При разработке оптимальных условий получения монозиготных близнецов большое внимание уделялось продолжительности культивирования in vitro после разделения и трансплантации половинок эмбрионов, а также их хранению в замороженном состоянии.
Установлено, что продолжительность культивирования половинок эмбрионов более 4 ч снижает результативность их последующей приживляемости. Культивирование in vitro половинок эмбрионов крупного рогатого скота в течение 24 ч снижает их приживляемость примерно в три раза по сравнению с культивированием in vitro в течение 4–6 ч.
Разделенные эмбрионы коров могут храниться в замороженном состоянии.
Клонирование эмбрионов
путем пересадки одер эмбриональных клеток
в энуклеированные яйцеклетки
После пересадки ядер эмбриональных клеток в энуклеированные яйцеклетки ядро репрограммируется таким образом, что начинает развиваться новый эмбрион. Теоретически все бластомеры из эмбриона донора имеют одну и ту же генетическую основу и, таким образом, способны обеспечить развитие идентичных особей. Эмбрионы, развившиеся после пересадки ядер, в свою очередь, могут быть использованы как доноры ядер. После нескольких генераций создается возможность получения сотен и даже тысяч идентичных эмбрионов.
Клонирование эмбрионов путем пересадки ядра включает три основных этапа: выделение интактного ядра донора, энуклеацию ооцита, пересадку ядра в энуклеированную яйцеклетку. В отличие от амфибий пересадка ядра у млекопитающих не стимулирует ооцит. Поэтому требуется четвертый этап – активация ооцита и слияние мембран яйца и ооцита. Под действием электрического импульса происходит активация ооцита и слияние мембран между ядром клетки донора и энуклеированным ооцитом-реципиентом. Технология пересадки ядер клетки способствовала успешному получению клонированных живых кроликов, мышей, овец, коз, крупного рогатого скота и свиней. Было показано, что только эмбрионы на предимплантационной стадии являются тотипотентными, но эффективность этой технологии пока низка. У крупного рогатого скота была продемонстрирована следующая эффективность этой технологии на каждом этапе (%): энуклеация – 70–80, развитие морулы-бластоцисты клонированных эмбрионов – 20–30. В исследованиях К.Р. Вондиоли (1991) 190 эмбрионов с пересаженными ядрами были получены из одного эмбриона путем многократной пересадки ядер из последовательно клонированных эмбрионов. Однако последовательные пересадки ядер после четвертого цикла сопровождались высокими эмбриональными потерями в матке. В итоге не удалось получить телят от пересадки эмбрионов, полученных после третьего цикла клонирования.
При использовании в качестве доноров ядер более продвинутых в развитии эмбрионов крупного рогатого скота 6-дневного возраста (47–68 бластомеров), по сравнению с использованием малоклеточных эмбрионов того же возраста (около 30 бластомеров), достигается более высокая эффективность слияния бластомера и ооцита, дробления эмбрионов и развития до стадии бластоцисты (В. И. Захарченко и др., 1996). Эффективность развития клонированных эмбрионов крупного рогатого скота выше при использовании в качестве источника бластомеров морул на стадии прекавитации. При этом свежевымытые морулы являются лучшими донорами ядер, чем развившиеся in vitro.
Осложняет пересадку ядер эмбриональных клеток получение телят с большой живой массой примерно на 15–30 % больше, чем у контрольных животных. Это приводит к тяжелым родам (рождение мертворожденных телят, задержка выхода последа).
Пересадка ядер эмбриональных клеток в энуклеированные яйцеклетки имеет много преимуществ по сравнению с технологией разделения эмбрионов. Эти преимущества следующие: отдельные эмбриональные клетки, полученные из эмбриона на стадии до 64 клеток, могут быть репрограммированы в одноклеточные зиготы и давать множественные копии генетически одинаковых животных; повторное клонирование путем пересадки ядер от клонированных эмбрионов повышает потенциальные возможности технологии в производстве большего числа клонов.
Клонирование животных
путем пересадки ядер соматических клеток
в энуклеированные яйцеклетки
Накопленный опыт клонирования эмбрионов путем пересадки ядер тотипотентных клеток из эмбрионов в энуклеированные яйцеклетки послужил базой для разработки метода клонирования животных путем пересадки ядер соматических клеток в энуклеированные яйцеклетки. Принципиальное отличие состоит в том, что клонирование путем пересадки ядер эмбриональных клеток обеспечивает получение идентичных животных между собой, тогда как пересадка ядер соматических клеток взрослого животного обеспечивает получение не только одинаковых между собой животных, но и идентичных по генотипу с животным-донором соматических клеток. Это открывает возможность получать неограниченное число генетически идентичных потомков уже в первом поколении. Нет необходимости объяснять, насколько революционным может быть этот прием в селекции и разведении сельскохозяйственных животных.
Возможность получения клонов животных с использованием ядер соматических клеток была впервые продемонстрирована в 1997 г. получением овцы Долли (Wilmul et al., 1997). Н. Вильмут с коллегами трансплантировали ядра клеток молочной железы в энуклеированные яйцеклетки овцы.
С этого момента работа многих лабораторий мира была направлена на исследование способности репрограммирования клеток плода и взрослого животного.
Talbot et al. (1998) получили культуру фетальных фибропластов 100-дневного плода коровы и использовали для трансплантации ядер. Получены четыре стельных реципиента (7 %), которые впоследствии абортировали.
Heyman et al. (1998) получили двух телят из клонированных эмбрионов с ядрами фибропластов, взятых из мышцы и кожи плода. Однако эффективность развития клонированных эмбрионов до стадии бластоцисты была очень низкой (3–8 %).
В опытах Zakhartcheto et al. (1999) эпителиальные клетки молочной железы и фибробластно-подобные клетки уха были получены от 2–3-летних симментальских коров и культивировались в среде ДМЕМ с 10 %-й фетальной сывороткой теленка. После одного-пяти пассажей концентрация фетальной сыворотки уменьшалась с 10 до 0,5 % в течение 4–6 дней, чтобы вызвать голодание. Созревание ооцитов проводили по обычной методике (Stojkovic et al., 1995). Комулюсные клетки удаляли через 18–20 ч после созревания путем микропипетирования или обработкой гиалуронидазой. Ооциты с полярным тельцем энуклеировали путем удаления минимального цитоплазматического объема. Через 20–22 ч отдельные донорские клетки сливали с энуклеированными ооцитами, используя двойной электрический импульс 2,1 кВ/см втечение 10 с. Через24чслившиеся капиопласт-цитопласт комплексы активировались 5-минутной инкубацией в 7 %-м этаноле с последующим 5-часовым культивированием в 10 мкг/мл цитоксимида и 5 мкг/мл цитохалазина В. Конструированные эмбрионы культивировали в среде CRJ (Rosenkrans a. First, 1991) с добавкой 10 %-й эстральной сыворотки коровы в течение 7 дней.
После пересадки бластоцист, полученных из клеток молочной железы и уха, соответственно 100 % (2/2) и 42 % (5/12) исследованных реципиентов были беременны на 42-й день. Во время публикации два реципиента имели беременность более 4 месяцев (клетки молочной железы) и пять реципиентов – от 1,5 до 3 месяцев (клетки из уха) (табл. 4.5). Результаты показывают, что взрослые клетки крупного рогатого скота могут быть успешно использованы для пересадки ядер, но клеточные линии, используемые в этих исследованиях, отличаются по потенциальным возможностям и развитию. Различия в способности быть программированными, наблюдаемые с этими двумя линиями клеток, могут быть из-за их импринтинга (отпечатка) или модификации хроматина.
Таблица 4.5. Развитие in vitro эмбрионов с пересаженными ядрами,
полученными из клеток взрослых животных (по Zakharteheto et al., 1999)

Целью исследований Wells et al. (1999) было проклонировать последнюю оставшуюся островную корову в Исландии на острове Индерби с целью сохранения генетики самок этой эндогенной породы крупного рогатого скота, приспособленного к субтропическим условиям. Несмотря на то, что семя от девяти уже не живущих быков было заморожено, попытки в последние шесть лет добиться воспроизводства у этой коровы завершились рождением одного бычка, который был получен в результате оплодотворения in vitro прижизненно извлеченных ооцитов. Качество яйцеклеток этой коровы было низкое, возможно связанное с ее возрастом (13 лет) или генетикой. Поэтому клонирование взрослого животного, возможно, являлось единственным приемом получения самок, которые потом могут быть осеменены семенем исландского быка, и создания возможности дальнейшей племенной работы с этой породой.
Клеточная линия была получена из гранулезных клеток, собранных путем аспирации фолликулов, используя ультразвуковой прибор. Клетки культивировали в OMEM/F12, содержащей 10% фетальной сыворотки, и использовали для пересадки ядра между 4 и 8 пассажами. Донорские клетки были индуцированы голоданием сыворотки крови в течение 9–23 дней и подвергнуты электрическому слиянию с энуклеированными ооцитами, полученными после созревания in vitro.
Реконструированные эмбрионы затем активировали и стимулировали одновременно слиянием. Слившиеся эмбрионы культивировали в SOFa BSA, и бластоцисты пригодного качества пересаживали по паре синхронизированным реципиентам коровам через 7–8 дней после охоты.
После пересадки 74 эмбрионов выживаемость эмбрионов на 30, 55 и 150 дни была 38, 30 и 23 % соответственно. Из первых пересаженных 22 эмбрионов родились два теленка. Однако один пал через два дня. Выживший теленок здоров. Микросателлитный анализ ДНК подтверждает, что телята являются генетически идентичными с островной коровой Индерби. Дополнительные беременности развиваются.
Корейские ученые использовали в качестве доноров ядер фетальные фибробласты (от плодов 60–70-дневного возраста). Линии клеток культивировали, по меньшей мере, 7 пассажей. Эти клетки фибробласты были определены нормальными по результатам хромосомного анализа (окрашивание 5 %-й гимзой). Клетки были простимулированы голоданием сывороткой крови в течение 4–5 дней до пересадки ядер. Все манипуляции проводили при комнатной температуре в течение 3 ч в конце созревания in vitro. Созревшие in vitro ооциты были энуклеированы после 22 ч созревания. Энуклеация была подтверждена под ультрафиолетом после 10 мин инкубации с 5 мг/мл Hochest 33342. Реконструированные эмбрионы помещали в камеру для слияния в 0,28 М раствора манитола. Одиночный электрический импульс 1,75 кВ/см втечение 20 мкс применялся для одновременного слияния клеток и активации оопласта. Слившиеся клетки культивировали в течение 1 ч в 5 мг/мл цитохалазина В. Успешно слившиеся эмбрионы помещали в TALP, содержащий 4 мг/мл БСА без жирных кислот, для культивирования in vitro эмбрионов, развившихся до компактной морулы.
Реконструированные эмбрионы успешно сливались (50/67; 77 8 ± 13,4), дробились (26/50; 55,3 ± 21,5 %) и развивались до морулы/бластоцисты (11/26; 44,3 ± 13,8 %). В предварительном исследовании две из вылупившихся бластоцист были окрашены 5 %-й гимзой для подсчета клеток. В одной было 100, а в другой 70 клеток. Одиннадцать компактных морул, или бластоцист, были пересажены девяти реципиентам. Четыре реципиента были беременными (44,4 %), подтверждено ультразвуком на 40–50-й день. Один реципиент абортировал на 60-й день, а у других беременность продолжается.
Начиная с конца 80-х и в течение 90-х годов проводились широкие исследования по изучению возможности репрограммирования герминативных клеток млекопитающих.
Stewart et al. (1994) получили линию эмбриональных герминативных клеток, которые имели характеристики эмбриональных стволовых клеток, и использовали эти клетки при создании химер. Причем клетки с геномом этой клеточной линии обнаруживались в популяции половых клеток.
Однако первые эксперименты по трансплантации ядер герминативных клеток млекопитающих были мало эффективны. Лишь 1,6–16,3 % реконструированных эмбрионов развивались до стадии бластоцисты (Delhaise et al., 1997; Heiman et al., 1998; Tsunoda et al., 1998). У кроликов клонированные эмбрионы не имплантировались (Moens et al., 1996). У мышей имплантировались, но не развивались до рождения потомства (Tsunode et al., 1989; Kato, Tsunoda, 1995). У коров реконструированные эмбрионы имплантировались, но на ранних стадиях развития (до 40 дней) беременность прекращалась (Delthaise et al., 1995; Moens et al., 1996; Laveir et al., 1997).
В 1998 г. на конференции «Генетическая инженерия и клонирование животных» в штате Юта (США) Strelchenko et al. (1998) доложили о рождении теленка, полученного методом трансплантации ядер герминативных клеток герминативной складки плода коровы 40–45-дневного возраста.
Исследователи использовали не свежевыделенные герминативные клетки, а после продолжительного культивирования, а также применили реклонирование первоначально полученных морул.
В следующем году Zakharteheto et al. (1999) использовали свежевыделенные герминативные клетки для трансплантации ядер в неактивированные оопласты. В результате развитие клонированных эмбрионов до стадии бластоцисты достигло 38 % и завершилось получением телят.
В наших экспериментах у кроликов ядра фетальных фибробластов репрограммировались и обеспечивали развитие эмбрионов до стадии бластоцистов с высокой эффективностью – 51 % (Galat et al. 1999) (рис. 4.3, 4.4, 4.5, 4.6).

Рис. 4.3. Соматические клетки (фетапьные фибробласты), используемые для клонирования кроликов
Рис. 4.4. Неоплодоттворенная яйцеклетка кролика с направительным тельцем
Рис. 4.5. Энуклеация: удаление ядерного материала из яйцеклетки кролика
Рис. 4.6. Клонированные бластоцисты кролика, полученные в результате пересадки
ядер соматических клеток в энуклеированные яйцеклетки (Биотехцентр, РАСХН)
В Биотехцентре РАСХН показаны различия в эффективности ре программирования фибропластов, взятых из плода и взрослого кро лика.
Фетальные фибробласты в качестве доноров ядер для трансплантации в энуклеированные яйцеклетки были использованы и в работе со свиньями Du et al. (1999).
Собирали ооциты от суперовулировавших свиней-доноров через 50–54 ч после инъекции ХГ и удаления кумулюса пипетированием и обработкой гиалуронидазы. Ооциты активировали и сливали одновременно через 54–56 ч, используя два повтора ВС пульсов (1,5 кВ/см, 60 мкс х 2) с интервалом 30 мин с применением 0,3 М раствора маннитола, содержащего 0,1 мМ СаС12,0,1 м М MgS04 и 0,01 % PVA. Фибробласты получали от 25-дневных плодов и кульивировали в ДМЕМ плюс 10 % фетальной сыворотки- Клетки с 3-5 пассажами были подвергнуты голоданию при культивировании в течение 5 дней с 0,5 % фетальной сыворотки. Эмбрионы с пересаженными ядрами культивировали в течение 7 дней с 10 % фетальной сыворотки, добавленной на 96 ч. Эффективность развития очень низкая.
Аналогичная, низкая эффективность развития до стадии бластоцисты была в опытах Tao et al. (1999) –до 7%.
Таким образом, в настоящее время показано, что к репрограммированию и обеспечению развития до стадии бластоцисты способна многие клетки взрослого организма: фибробласты (кролик – Mitalipovetal., 1998; Dinnyesetal., 1999; Lagutinaetal., 1999; корова – Zakhartchenkoetal., 1999; Vignonetal., 1999), клетки эпителия молочной железы (овца – Wilmut et al., 1997; Zakhartchenko et al.; 1998, 1999), гранулезные клетки (мышь – Wakayama et al., 1998; корова – Collas, Barnes, 1994; Kato et al., 1998; Wells et al., 1999), клетки эпителия яйцевода (корова – Kato et al., 1998); клетки Сертоли и нейрональные клетки (мышь – Wakayama et al., 1998). Однако потомтство получено только при трансплантации ядер клеток эпителия молочной железы (овца – Wilmut et al., 1997; корова – Zakharteheto el al., 1999), фибробластов (корова – Zakharteheto et al., 1999; Vignon el al., 1999), гранулезных клеток (мышь – Wakayama et al., 1998; корова – Kato et al., 1998; Wells et al., 1999) и клеток эпителия яйцевода (корова –Kato et al., 1998).
Успешная демонстрация пересадки ядер соматических клеток у животных расширяет возможности применения этой технологии для решения новых задач в области воспроизводства и селекции сельскохозяйственных животных. При использовании удобных источников ооцитов и суррогатных самок эта технология может быть использована для сохранения других исчезающих пород животных, подобно тому, как это было продемонстрировано для сохранения эндогенной породы крупного рогатого скота, приспособленного к субтропическим условиям в Исландии (Wells et al. 1999), и будет способствовать разработке метода внутривидовой пересадки ядер клеток в будущем.
Использование этой технологии открывает большие возможности в повышении эффективности получения трансгенных животных и биомедицине.
Резюмируя накопленные данные по клонированию животных, можно отметить, что успех развития реконструированных эмбрионов в значительной степени обеспечивается согласованием стадии клеточного цикла донора ядер и цитоплазмой реципиента. Неадекватный выбор фазы клеточного цикла реципиента или донора во время реконструкции может привести к разрушению ДНК и неправильной плодии реконструированного эмбриона. Взаимосвязи между ядром донора и цитоплазмой реципиента происходят на многочисленных уровнях, которые в настоящее время изучаются. Установлено, что сихронизация отдельных бластомеров на ранней стадии развития является полезным инструментом для изучения взаимосвязи клеточных циклов у разных видов животных, включая кроликов (P. Collas et аl 1992), крупный рогатый скот (К.Н. Campbell et al., 1993) и мышей (P.j. Otaegu et al., 1994). Синхронизация бластомеров на Gl/S-фазе и пересадка в ооциты на М II повышают эффективность развития эмбрионов у многих видов животных, включая кроликов (P. Collas et al., 1992) и крупный рогатый скот (Н. Tanaka et al., 1995). Однако в качестве рутинного метода для клонирования эмбрионов эта техника недостаточно надежна, так как во время раннего развития в любой период времени большинство ядер в эмбрионе находятся на S-фазе клеточного цикла (F.L. Barnes et al., 1993).
Если используются несинхронизированные бластомеры в качестве ядерных доноров, то наблюдается увеличение частоты развития, когда цитоплазма реципиента активирована и активность фактора, стимулирующего мейоз, понижена перед реконструкцией эмбриона (К.Н. Campbell et al., 1994). Предварительно активированный ооцит будет принимать Gl (GO), S- или С2-фазы клеточного цикла и определяется термином «Универсальный реципиент» (К.Н. Campbell et al., 1993).
Анализ данных различных исследований, в которых были использованы синхронизированные эмбриональные бластомеры в качестве ядер доноров, показывает, что донорские клетки на поздних стадиях G2 или ранней G1 клеточного цикла являются наиболее пригодными для повышения эффективности развития (O.Y. Kwen etal., 1996).
Техника клонирования крупного рогатого скота
путем пересадки соматических клеток в энуклеированные
яйцеклетки с применением микроманнпулятора
Техника микроманипуляций для пересадки ядра была впервые разработана S.M. Willadsen (1986) для клонирования эмбриональных клеток и в последующем приспособлена без значительных изменений для клонирования соматических клеток. Это техника используется в настоящее время почти во всех лабораториях мира несмотря на дорогостоящее оборудование, трудоемкость, потребность в высококвалифицированных кадрах и низкой эффективности.
Техника клонирования состоит из нескольких этапов: извлечение °оцитов из фолликулов, их дозревание in vitro, энуклеация ооцитов, приготовление соматических клеток, пересадка и электрослияние соматической клетки с ооцитом, активация реконструированного ооцита, культивирование эмбриона и пересадка реципиенту.
Извлечение и дозревание ооцитов
Яичники транспортируют с мясокомбината в термосе в среде PBS без белка в течение 2–5 ч при начальной температуре +30 °С. Ооциты отсасывав ют из видимых фолликулов диаметром 2–8 мм при помощи шприца или иглы, присоединенной к ваккуумному насосу. Аспирированную фолликулярную жидкость переносят в чашку Петри или пробирку промывают средой 199 с 10 % фетальной сыворотки крови. Созревание ооцитов проводят в среде 199 с добавкой 10 % фетальной сыворотки ФСГ (0,005 ед/мл), ЛГ, эстрадиола (1 мкг/мл) при 39 °С в 5 % СО2 в увлажненной атмосфере воздуха.
Через 18–20 ч после созревания in vitro удаляют кумулюсный клетки комплекса ооцит-кумулюсные клетки путем многократного» пипетирования в 0,1 %-м гиалуронидазе и отбирают ооциты с первый направительным тельцем.
Приготовление соматических клеток
а) Фибробласты взрослого животного. Проводят биопсию уха у взрослого животного. Кусок ткани разрезают на мелкие кусочки (3 мм2) и культивируют в ДМЕМ плюс 10 % фетальной сыворотки крупного рогатого скота плюс 1 % пеницилина (10 000 уд/мл) и 1 % стрептомицинай (10 000 мкг/мл) и затем культивируют при 37 °С в воздухе с 5 % СО2. При культивировании в течение недели формируется монослой клеток фибробластов вокруг кусочков ткани. Кусочки ткани удаляют и фибробластные клетки культивируют до слияния (монослоя). Когда слияние клеток будет достигнуто, клетки трипсинизируют (0,1 % трипсин) в течение 5 мин и подсчитывают общее число клеток. Извлеченные клетки центрифугируют и осадок ресуспендируют до концентрации 1 млн клеток на 1 мл. Жидкую суспензию замораживают в ДМЕМ-Р12, содержащей 10 % диметилсульфоксида (DMSO), и хранят при –80 °С или 250 000 клеток переносят в новую чашку, культивируют до слияния. Клетки пассируют путем трипсинизации и снова подсчитывают.
Таким образом проводят 5–6 пассажей. Для пересадки в ооцит используют клетки, подвергнутые или не подвергнутые голоданию. Для получения клеток, подвергнутых голоданию, проводят их культивирование в ДМЕМ, содержащей 0,5 % фетальной сыворотки, в течение 2–3 дней. Затем отбирают отдельные клетки путем трипсинизации монослоя и ресуспендирования клеток после центрифугирования в PBS с добавкой 0,5 % фетальной сыворотки.
б) Фибробласты плода. 40–50-дневный плод удаляют хирургическим путем или после убоя из матки коровы. Голову и внутренние органы удаляют, оставшуюся ткань плода разрезают на кусочки размером 2–5 мм. Эти кусочки затем культивируют какописано выше.
в) Гранулезные клетки. Гранулезные клетки получают из комплекса кумулюс-ооцит после созревания in vitro. Кумулюсные клетки культивируют в среде ДМЕМ с добавкой 10 % фетальной сыворотки в течение 3 дней или дополнительно 5 дней в ДМЕМ с добавкой 0,5 % фетальной сыворотки.
Непосредственно перед пересадкой ядра суспензия донорских клеток обрабатывается стандартной трипсинизацией. Клетки отделяют и ресуспендируют в среде SOF плюс 0,5 % фетальной сыворотки и оставляют в этой среде до инъекции в ооцит.
Энуклеация
Ооциты энуклеируют через 17–19 ч после созревания. Перед энуклеацией ооциты помещают на 15 мин в среду SOF, забуференную Хепесом с 4 мг/мл BSA и 5 мкг/мл прижизненного красителя Hoechst 33342. В это время отбирают ооциты с полярными тельцами и гомогенизированной цитоплазмой. Пригодные ооциты энуклеируют в среде SOF с 7,5 мкг/мл цитохалазина, используя заостренную стеклянную пипетку с внешним диаметром 25 мкм. Только ооциты, у которых будут удалены оба направительных тельца и метафазная пластинка, подтвержденные ультрафиолетовым облучением, включают в эксперимент.
Электрослияние
Каждую донорскую клетку инъецируют в перивителиновое пространство энуклеированного ооцита и помещают ооциты в 0,27 М раствор манитола без Са2+ и Mg2+ (среда У и мирермана). Слияние проводят путем применения двойного импульса 1,75 kv/см в течение 15 мкс. Реконструированные ооциты переносят в среду CR.
Активация
Активацию ооцитов проводят через 3–5 ч после слияния путем 4-минутной инкубации в 5 мкм мономицина с последующей обработкой их 1,9 шМ диметиламинопурина (ДМАР) в течение 4 ч.
Культивирование
Культивируют 5–10 реконструированных ооцитов, обработанных ДМАР в 25 мкл капле CR с добавкой 3 мг/мл DSA. На 4-й день переносят в среду с добавкой 10% фетальной сыворотки и 0,15 mМ глюкозы. Культивируют в течении 7 дней после активации.
Пересадка эмбрионов
Пересаживают бластоцисты коровам-реципиентам. Половые циклы реципиентов синхронизируют с тем, чтобы они соответствовали 7-дневному возрасту эмбрионов после реконструирования ооцитов. Затем проводят нехирургическую пересадку одного или двух бластоцист 6 раз на стороне желтого тела яичника. Диагностику беременности проводят через 30 и 60 дней.
Техника клонирования крупного рогатого скота
путем пересадки соматических клеток в яйцеклетки
без применения мнкроманипулятора
Техника пересадки ядер соматических клеток в яйцеклетки без применения микроманипулятора (Vajta G et. al. 2003) может быть жизнеспособной альтернативой традиционным методам. Она отличается высокой эффективностью, меньшей трудоемкостью и низкой стоимостью, что может иметь важное значение для более широкого применения пересадки ядер как для исследовательских целей, так и для производства.
Техника пересадки включает следующие основные этапы: извлечение и дозревание ооцитов in vitro, удаление зоны пеллюциды и инкубация в демиколцине, приготовление цитопласта и соматических клеток, электрослияние, активация и культивирование эмбрионов.
Полученные на мясокомбинате ооциты коров подвергают созреванию как описано выше. Через 21–22 ч после начала созревания 100–150 комплексов ооцит–кумулюсные клетки помещают в 2 мл эпиндорфовскую пробирку, содержащую 0,5 мг/мл гиалуронидазы, растворенной в 500 мкл в среде 199 с Хэпесом (ТО) без добавки сыворотки крови крупного рогатого скота (СК). После двух минут инкубации при 39 °С кумулюсные клетки удаляют сначала осторожным пипетированием, используя 1 мл автоматическую пипетку в течение 1 мин, а затем вортекс с максимальной скоростью 3 мин. С этого момента все манипуляции проводят при 39 °С. Ооциты отделяют от диспергированных клеток кумулюса путем двух промывок в 35 мм чашках Петри, каждая из которых содержит4 мл Т2 (Т + 20 % СК).
Все инкубации проводят в лунках 4-луночных чашек в среде забуферной Хэпесом без покрытия маслом.
Ооциты переносят сначала в раствор проназы (1,5 мг/мл) в 600 мкл Т10 (Т + 10 % СК), и чашку двигают круговым движением, используя горизонтальное вращение при 150 об/мин при 39 °С в течение 10–15 мин, затем при 80 об/мин в течение 1 мин. В результате вращения с медленной скоростью ооциты с удаленной зоной пеллюцида, собирают в середине лунки и затем переносят в другую лунку, содержащую 2,5 мкг/мл цитохалазина В, растворенного в 800 мкл Т20 (Т + 20 % СК), где их инкубируют 3 мин.
40–50 ооцитов с удаленными зонами пеллюцидами выстраивают в одну линию в 35 мм чашки Петри с Т20 и 2,5 мкг/мл концентрацией цитохалазина В. Деление пополам проводят под стереомикроскопом ультраострым лезвием. Разделенные пополам ооциты собирают в середине чашки Петри путем кружения чашки и переносят в 800 мкл Т2 для хранения.Все половинки ооцитов окрашивают 10 мкг/мл флюорохрома Hoechst 33342, растворенного в Т2 в течение 5 мин. Окрашенные половинки быстро отмывают в Т2, помещают в 3 мкл капли в Т2 на дно 60 мм чашки Петри и покрывают маслом (3 половинки в капле). Используя инвертированный микроскоп и ультрафиолетовое облучение регистрируют положение цитопластов без окрашенного хроматина, используя магнитофон. Эти цитопласты затем собирают под стереомикроскопом и переносят в 800 мкл Т20 капли для временного хранения.
Готовят монослой соматических клеток как описано выше.
Слияние проводят через 23–24 ч после начала созревания. Для первого слияния половину от общего числа приготовленных цитопластов переносят в первую лунку 4-луночной чашки, содержащей 800 мкл Т20.
На дно в середине 4-луночной чашки, наполненной 4 мл Т2, осаждают 5 мкл суспензии соматических клеток.
Цитопласты затем переносят по одному во вторую лунку, содержащую 500 мкг/мл фитогемоаглютинина, растворенного в400 мкл Т2 на 3 с и затем быстро капают на единичную соматическую клетку, посаженную на дно чашки.
После прикрепления пару цитопласт–соматическая клетка снова втягивают в пипетку и переносят в камеру слияния с расстоянием между электродами 0,5 мм.
До применения удаляют клей из центральной 2-сантиметровой зоны электродов при помощи хирургического лезвия. Электроды покрывают 2 мл среды для слияния (0,3 М манитола 0,1 мМ MgSО4, 0,05 мМ СаСl2) при 26–27 °С. После инкубации в течение 2–3 мин в среде для слияния пару (ооцит + фибробласт) присоединяют к одному из электродов, используя 15v АС и 700 KHz. Соматическую клетку каждой пары позиционируют в дальнем конце от электрода. Слияние проводят двумя импульсами по 65 v каждый в течение 20 мкс с интервалом 0,1 с.
Пару затем осторожно удаляют и переносят в 3-ю или 4-ю лунку 4-луночной чашки, которые содержат по 800 мкл Т20. Пары инкубируют здесь 15–30 мин, чтобы определить, произошло ли слияние.
После слияния 15–20 пар среду для слияния заменяют, чтобы предотвратить разрушение, вызванное испарением.
Для второго слияния все оставшиеся цитопласты и слившиеся пары переносят в среду для слияния, покрывающую камеру для слияния. Чтобы избежать смешивания, цитопласты помещают севернее от электродов (т. е. как можно дальше от оператора), а пары помещают южнее от электродов.
После инкубации примерно в течение 2 мин 10 цитопластов выравнивают в линию к одному электроду, используя тот же АС, как и для первого слияния. Одну слившуюся пару дня затем прикрепляют к каждому цитопласту. Проводят двойной импульс с теми же параметрами, но при 45 v ДС. Затем триплеты двойных цитопластов–гранулезная клетка – инкубировали в Т20 в течение 20 мин. Эти слившиеся реконструированные эмбрионы переносят в лунку 4-луночной чашки, содержащей 400 мкл культуральной среды, покрытой маслом, и инкубируют в 5 % С02 в воздухе при 39 °С.
Активацию начинают через 28 ч после начала созревания (примерно через 4 ч после слияния). Реконструированные эмбрионы сначала инкубируют в 1 мл Т20 содержащем 2 мкМ Са ионофора А23187 в течение 5 мин при комнатной температуре. После двух последовательных промываний в Т20 реконструированные эмбрионы инкубируют отдельно (чтобы сохранить их от прикрепления одного к другому) в 5 мкл каплях культуральной среды, содержащей 2 мМ G-dimethylamino-purin (6-ДМАР), и покрывают маслом, инкубируют в атмосфере 5 % СО2 в воздухе при 39 °С в течение 6 ч. Эмбрионы затем отмывают дважды в культуральной среде и культивируют раздельно в углублении лунки (WOWS) в 400 мкл культуральной среды, покрытой 400 мкл масла. Эмбрионы культивируют при 39 °С в 5 % СO2, 5 % O2 и 90 % N2.
Через 7 дней после реконструкции определяют число бластоцист и проводят их пересадку нехирургическим путем или замораживанием.
Высокая эффективность этой технологии и низкая стоимость оборудования (не требуется микроманипулятор или связанные с ним инструменты, такие как микрокузница и капиллляры) делают эту технологию очень экономичной даже для лабораторий с ограниченным финансированием. Эта технология клонирования эмбрионов крупного рогатого скота в модифицированном виде в нашей стране разработана в отделе Биотехцентра ВНИИ ПЗК (Г. Моленкоидр., 2006).

