10.1. ФУНКЦИОНАЛЬНЫЕ УРОВНИ
Генетический
Характер процессов роста и развития, соотношение между ними обусловлены, прежде всего, генетическими факторами. Тип развития каждого индивидуума определяется программой, заложенной в его коде. Физиологическая функция генов заключается в передаче информации клетке через матричную рибонуклеиновую кислоту (мРНК) и ферменты. Причем, никогда не происходит одновременной передачи всей имеющейся информации, т. е. не синтезируются одновременно все потенциально возможные ферменты. В связи с этим существуют одновременно активные (продуцирующие РНК) и неактивные гены. Благодаря генной регуляции происходит активация генов (индукция) и инактивация (репрессия) (Н.П.Дубинин, 1986; Льюин, 1987). Таким образом, рост и развитие растений представляет собой процесс, связанный с избирательной экспрессией генов.
Общий генетический контроль осуществляется через биосинтез белка, ответные функциональные и двигательные реакции у растения, проявляющиеся через свойство раздражимости протоплазмы, множественные коррелятивные связи между процессами и органами, а также атграгирующие и распределительные функции ростовых процессов, обеспечивающие постоянное взаимодействие всех органов и систем, экологическую адаптацию и реализацию морфогенеза в соответствии с многовариантной генетической программой развития.
В основе продукционного процесса лежит постоянное взаимодействие организма и среды. Генетическая программа и потенциал продуктивности растений реализуются через эндогенные регуляторные механизмы и системы, которые во взаимодействии с экзогенными факторами и технологическими приемами формируют определенный тип морфоструктуры растений, уровень продукционного процесса и конечную величину урожая, его качество (B.C. Шевелуха, 1992).
В зависимости от генетической детерминации и влияния напряженности природных факторов, приемов выращивания растений наблюдаются циркадные (околосуточные), сезонные, годовые онтогенетические, эволюционные ритмы и другие колебания интенсивности и направленности продукционного процесса у растений.
Доминирование экзогенных компонентов в суточных ритмах роста создает объективную основу для практического регулирования продукционного процесса у растений приемами агротехники в целях повышения урожайности и устойчивости посевов.
В современном растениеводстве главная задача состоит в том, чтобы с помощью методов генетической трансформации и ре комбиногенеза получить новые, в том числе трансгенные гибриды и сорта, в первую очередь экономически важных сельскохозяйственных культур с более высокой потенциальной продуктивностью и устойчивостью; далее потребуется разработать и реализовать методы максимальной реализации этого потенциала в производстве путем оптимизации хода и соотношения физиологических процессов, обеспечивающих формирование высокого урожая и качества продукции.
Гормональный
Природные фитогормоны и синтетические регуляторы роста и развития растений, или фиторегуляторы, являются мощным химическим средством управления онтогенезом и продукционным процессом растений и посевов (JI. Дж. Никелл, 1984). Поэтому они широко применяются в биотехнологии сельскохозяйственных растений и в практическом растениеводстве. Фиторегуляторы – важное средство регулирования дифференцировки клеток, клеточных делений, образования новых тканей и органов, темпов роста и развития растений, их продуктивности и качества урожая. Генетическая инженерия растений также опирается на знания о фиторегуляторах. Решающее значение в управлении онтогенезом растений и их продуктивностью имеет изучение и мониторингфитогормонального статуса.
В современном растениеводстве фиторегуляторы применяются для повышения урожайности и устойчивости агроценозов к неблагоприятным факторам среды, позволяют существенно облегчить ряд технологических операций.
Гормональная система растений
Понятие о фитогормонах
Гормональной регуляции живого организма принадлежит важная роль в реализации наследственной программы и адаптации к меняющимся условиям среды (К. Дерфлинг, 1985).
Впервые мысль о наличии у растений веществ регуляторной природы высказана Ч. Дарвиным в работе «Способность к движению у растений» (1880) на основании экспериментов с изгибами проростков по направлению к источнику света. Одновременно с Ч. Дарвиным выдающийся немецкий ботаник и физиолог растений Ю. Сакс постулировал присутствие в растении веществ, ответственных за формирование и развитие стебля, листа и корня. Однако эти предположения не получили признания ученых того времени.
Интенсивные исследования по изучению и выделению регуляторных веществ растений начались в XX в. В 1909–1910 гг. Г. Фиттингом было обнаружено вещество, вызывающее разрастание завязи и образование бессемянных плодов орхидей, названное им, по аналогии с регуляторными веществами животных, гормоном. За несколько лет до этого была установлена высокая рострегулирующая активность этилена, а в конце 20-х годов – выделен из растений ауксин. В это же время Н.Г. Холодным и Ф. Вентом была разработана теория тропизмов растений, названная по именам ее создателей, а в конце 30-х годов М.Х. Чайлахян выступил с гипотезой флоригена – гипотетического фиторегулятора, обусловливающего переход растения к формированию генеративных органов и цветению.
Продуктивными в изучении гормонов растений оказались 50–60-е годы, когда были выделены гиббереллины, цитокинины и абсцизовая кислота и описаны их свойства. В наше время выделено еще несколько эндогенных регуляторных веществ – брассиностероиды, фузикокцины, жасминовая и салициловая кислоты, некоторые олигосахариды, негормональные регуляторы роста растений – полиамины, ряд фенольных соединений, другие вещества.
Одновременно предпринимались попытки поиска, создания и использования ряда регуляторных веществ в растениеводстве. Вначале это были синтетические аналоги ауксина для индукции корнеобразования при вегетативном размножении растений. На рубеже 60-х годов были открыты ретарданты – вещества, замедляющие осевой вегетативный рост. Они являются наиболее распространенными фиторегуляторами, применяемыми в сельском хозяйстве. В настоящее время ведется активный поиск фиторегуляторов с другими ценными свойствами, особенно препаратов с антистрессовым и репаративным действиями.
Согласно современным представлениям о регуляторах роста и развития растений фитогормонами называют вещества, которые синтезируются в растениях, транспортируются по ним и в малых концентрациях способны вызывать ростовые или формативные эффекты по месту образования и на расстоянии от него.
Таким образом, первая особенность фитогормонов – эндогенное происхождение. Большинство фитогормонов образуется из органических кислот, в частности – аминокислот. Изменения в интенсивности синтеза того или иного фитогормона, вызванные внутренними или внешними причинами, приводят и к ответной реакции растения – изменению показателей ростовых или формативных процессов.
Вторая особенность фитогормонов – передвижение их по растению. Биологический смысл этого условия заключается в том, что фитогормон, образовавшийся в одном органе, например в апикальной меристеме стебля, обладает свойством регуляции ростовых процессов в других органах, например в корне. Именно таким образом достигается взаимовлияние органов и целостность растения. Ряд веществ, обладающих высокой регуляторной способностью, например некоторые фенольные соединения, не могут быть признаны фитогормонами, так как неспособны к передвижению по растению и воздействуют лишь в месте своего синтеза.
Третья особенность – способность в малых концентрациях вызывать заметные ростовые или формативные эффекты. Фитогормоны действуют на растение в малых концентрациях (Ю-13–10-7 М). Примером ростового эффекта может служить ускорение или замедление роста стебля, а формативного – дефолиация.
Четвертая особенность – действие не только в местах образования, но и на расстоянии от них.
Не следует смешивать понятия гормона животных и гормона растений (фитогормона). Гормоны животных синтезируются в специальных органах – железах внутренней секреции, в то время каку растений такая специализация тканей и органов отсутствует. Гормоны животных не действуют в месте своего синтеза, а фитогормоны способны влиять на клетки, в которых они образуются. В этом отношении фитогормоны близки к гистогормонам животных.
Молекулярные механизмы действия фитогормонов
Практическое использование фитогормонов основано на глубоком знании молекулярных механизмов их действия, изучению которых в связи с этим придается большое значение. В настоящее время выявлена общая принципиальная схема образования фитогормонов, реализации их регуляторного действия, включающая биосинтез предшественников, связывание со специфичным к данному гормону белковым рецептором с образованием активированного гормон-рецепторного комплекса, воздействие этого комплекса на геном растения и (или) на активность определенных ферментативных систем.
Фитогормоны синтезируются в растении из органических кислот, причем у нескольких фнтогормонов может быть один и тот же предшественник. Так, мевалоновая кислота является исходным веществом для синтеза четырех классов фитогормонов: стимуляторов – гиббереллинов, цитокининов, брассиностероидов и ингибитора – абсцизовой кислоты (рис. 10.1).
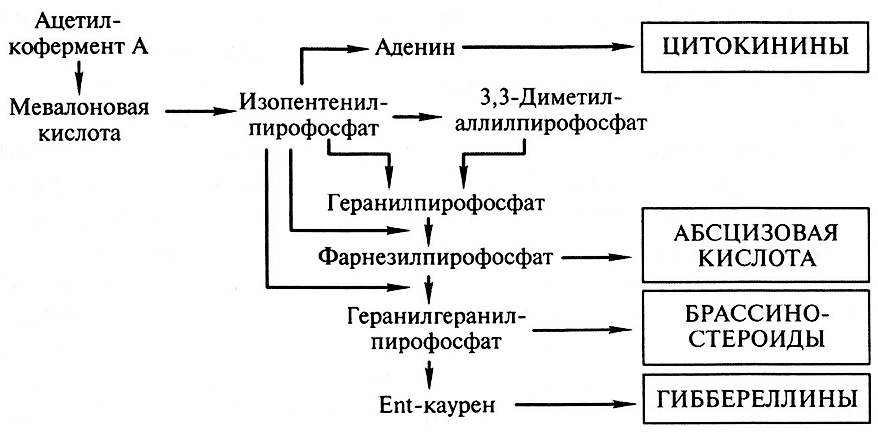
Рис. 10.1. Схема биосинтеза фнтогормонов (Г.С. Муромцев и др., 1987, дополненная)
При изменении условий внешней среды в растении происходят изменения в синтезе того или иного фитогормона. Ключевые ферменты, действующие на развилках путей биосинтеза фитогормонов, проявляют высокую чувствительность к изменению факторов среды (освещенность, температура и др.), что приводит к преимущественному синтезу определенного фитогормона. Примером такого воздействия внешних условий может служить повышенный синтез гиббереллинов при увеличении продолжительности освещения и наоборот, снижение содержания ауксина и увеличение уровня фенольных ингибиторов роста при избыточной инсоляции.
Образовавшаяся молекула фитогормона транспортируется по растению от места своего синтеза к клеткам-мишеням, т. е. клеткам, чувствительным к данному фитогормону. Транспорт фитогормонов происходит по проводящей системе растения, с током пасоки и ассимилятов, а также по межклеточному пространству.
Молекулы фитогормонов способны проникать в клетки-мишени двумя способами: перемещаться в соответствии с градиентом концентрации по плазмодесмам – протопластным каналам, связывающим соседние клетки; путем активного транспорта через пограничную мембрану клетки – плазмалемму.
Установлено, что гормональные эффекты реализуются путем конформационных изменений белковых молекул (варьирование формы и пространственной структуры), занимающих в клетке стратегически важное положение. Такие белки могут функционировать как рецепторы фитогормонов, преобразователи сигнала между рецептором и определенной ферментативной системой, а также как ферменты, активаторы или ингибиторы ферментов, компоненты мембранных транспортных систем. Гормональные эффекты во всех чувствительных клетках можно представить как цепь скоординированных изменений формы множества специфичных для данной клетки белков.
Первичная структура белка (определенная последовательность аминокислот) уже содержит необходимую информацию для приобретения белковой молекулой вторичной и третичной структур.
В клетке молекула фитогормона взаимодействует со своим специфическим белковым рецептором и обратимо связывается с ним, образуя гормон-рецепторный комплекс (ГРК), вследствие чего происходит активация белковой молекулы рецептора за счет его взаимодействия с фитогормоном.
Рецепторы фитогормонов в настоящее время еще недостаточно изучены. Имеющиеся данные указывают, что, по-видимому, большая их часть представляет собой глобулярные белки с очень высоким сродством, связывающие фитогормоны. В одной клетке может находиться несколько видов рецепторов одного и того же фитогормона, что обусловливает и различные виды реакции растения на один и тот же фитогормон, т. е. полифункциональность действия фитогормона.
Интенсивность реакции на фитогормон определяется не только собственно концентрацией фитогормона, но и концентрацией его рецептора, так как полной физиологической активностью обладает их комплекс, а не отдельные компоненты. Это обусловливает различную чувствительность клеток к одному и тому же гормону. Как правило, клетки-продуценты данного фитогормона имеют малую чувствительность к нему, обусловленную низкой концентрацией рецепторов.
С момента образования гормон-рецепторного комплекса возможны два основных пути реализации фитогормональной активности.
Первый путь связан с появлением новых ферментов или значительным изменением в содержании уже существующих ферментов клетки. Он обусловлен воздействием фитогормонов на генетические процессы. В связи с тем что в этом случае происходит репрограммирование работы генов и синтез новых белков, проходит значительное время (от десятков минут до нескольких часов) от момента изменения концентрации фитогормона до проявления его эффекта.
Второй путь обусловлен изменением активности белков, главным образом – ферментов, уже существовавших в клетке до изменения концентрации фитогормона, за счет изменения их пространственной конформациИ. Поскольку второй путь не связан с синтезом новых белков, время проявления эффекта фитогормона в этом случае гораздо меньше – всего несколько минут.
Регуляция экспрессии генов. Фитогормональная регуляция экспрессии генов обусловливает такие важнейшие процессы в жизни растительной клети, как дифференцировка и дедифференцировка, деление, рост и адаптация к новым метаболическим условиям. Среднее время фитогормональной регуляции работы генома исчисляется несколькими часами. В то же время растение способно ответить на изменение уровня некоторых гормонов всего за несколько десятков минут. Эти «быстрые» реакции связаны со способностью фитогормонов регулировать активность уже существующих ферментов растительной клетки.
Регуляция активности ферментов. Вторичные посредники фитогормонов. В этом случае реакция на фитогормон проявляется в течение нескольких минут с момента резкого повышения его концентрации. Такие эффекты объясняются изменением активности ферментов, причем общее число молекул того или иного фермента практически не меняется, но их активность возрастает или снижается вследствие взаимодействия с аллостерическим эффектором, в роли которого может выступать фитогормон или его метаболит, что приводит к изменению сродства фермента к субстрату. Таким образом, быстрые ответные реакции на фитогормон объясняются изменением активности уже существующих в клетке ферментов.
Ярким примером «быстрых» реакций растения на фитогормон может служить стимуляция растяжения клеток колеоптиля под действием ауксина, которая отмечается уже через 5 мин после начала обработки. Данный эффект объясняется тем, что ауксин при взаимодействии со своим рецептором, локализованным в плазмалемме, активирует работу протонной помпы – ферментативной транспортной системы, производящей перенос протонов из клетки в область клеточной стенки. Происходящее при этом подкисление гем и целлюлоз и пектиновых веществ, входящих в состав клеточной стенки, приводит к тому, что связи между ее компонентами ослабляются и за счет тургорного давления, создаваемого вакуолью, клетка растягивается.
В последнее время активно проводятся исследования вторичных посредников (мессенджеров) фитогормонов. В общем виде действие вторичного посредника заключается в том, что небольшое число молекул гормона в клетке вызывает продукцию гораздо большего числа молекул вторичного посредника, а последние в свою очередь положительно или отрицательно влияют на активность белковых молекул. Таким образом происходит умножение сигнала, возникшего при связывании гормона с рецептором.
Классификация, структура и функции фитогормонов
В настоящее время известно семь групп фитогормонов: ауксины, цитокинины, гиббереллины, этилен, абсцизовая кислота, брассиностероиды, фузикокцины. По-видимому, список гормонов растений ими не исчерпывается. Открытие нового фитогормона – очень редкое событие, так как эти вещества присутствуют в растении в очень небольших концентрациях. Тем не менее, очевиден прогресс в изучении регуляторных систем растения, связанный с совершенствованием методов исследования.
Ауксины открыты в 20-е годы как фактор тропизмов растений. В начале 30-х годов Ф. Кегль выделил в чистом виде и установил химическое строение природного ауксина – индолил-3-уксусной кислоты (ИУК).
Основным местом синтеза ауксинов являются апикальные меристемы стебля, откуда они поступают в другие органы. В меньшей степени синтез этого фитогормона происходит в листьях, причем в молодых листьях ауксина образуется больше, чем в старых.
Механизм поглощения ауксина клеткой включает две фазы: 1) быстрое обратимое поглощение, происходящее по механизму, бл изкому к диффузии, когда между клеткой и окружающей ее средой устанавливается равновесие в концентрации ауксина. Достижение этого равновесия зависит не только от разницы концентраций ИУК в растворе и клетке, но и от рН раствора и цитоплазмы. Возможно, что в поступлении ИУК в клетку участвуют и специфические переносчики, роль которых особенно велика при рН, близком к нейтральному. Продолжительность этой фазы 25–30 мин; 2) метаболическое накопление. В это время ауксин связывается с различными компонентами клетки, чаще всего с образованием глюкозного эфира или индолил-3-ацетиласпарагиновой кислоты. Связанный ауксин не участвует в клеточной регуляции и представляет собой запасную форму гормона.
Физиологические эффекты ауксина связаны с его действием на клеточном уровне, которое проявляется в регуляции растяжения, деления и дифференцировки.
Как уже отмечалось, механизм растяжения клеток под действием ауксина обусловлен активацией протонной помпы, приводящей к подкислению клеточной стенки, и ее последующим растяжением за счет тургорного давления вакуоли.
Растяжение клеток и размягчение клеточных стенок под действием ауксин-активируемой протонной помпы может играть важную роль в процессах дедифференцировки и последующего деления наряду с активацией ферментов, участвующих в разрыхлении клеточной стенки – целлюлазы и пектиназ.
Индукция ауксином клеточных делений также обусловлена и тем, что он создает условия, необходимые для репликации ДНК, включающие в себя стимулирование дыхания, синтеза РНК и белков.
Ауксин вызывает не только дедифференцировку. Он способен стимулировать дифференциацию меристематических или дедифференцированных клеток в клетки проводящих тканей. Под действием ауксина отмечается формирование проводящих флоэмных и ксилемных элементов в каллусной ткани, что имеет большое значение в биотехнологии и практике растениеводства.
Атграгирующее (т. е. притягивающее) свойство ауксина определяет и такое важное в жизни растения свойство, как апикальное доминирование. Апекс, продуцирующий этотфитогормон, представляет собой мобилизационный центр, к которому притекают питательные вещества и другие фитогормоны (гиббереллины и цитокинины). Вследствие этого питательные вещества и фитогормоны практически не поступают к пазушным почкам, которые поэтому не растут или растут гораздо медленнее, чем верхушечная почка (A.JI. Курсанов, 1976). Механизм аттрагирующего действия практически не изучен. Есть основания полагать, что он связан с активацией протонной помпы.
Цитокинины открыты в 1955 г. как факторы, стимулирующие деление клеток. Первый природный цитокинин был назван зеатином, так как это вещество выделено из незрелых семян кукурузы. Сейчас известно еще 12 цитокининов, их химическое строение близко к строению зеатина. Показана высокая цитокининовая активность у дифен ил мочевины и ряда ее производных.
Цитокинины синтезируются главным образом в апикальных меристемах корня, откуда активно транспортируются с пасокой по ксилеме. Поэтому скорость передвижения цитокининов гораздо выше, чем ауксинов. Направление транспорта – акропетальное, особенно много цитокинннов обнаруживается в активных меристемах и семенах.
Стабильность цитокининов в растении невысока, время полураспада зеатина составляет в зависимости от вида растения и его органа от 6 до 20 ч. Скорость разрушения в молодых тканях ниже, чем в старых. Медленнее всего этот процесс идет в корнях. Деструкция цитокининов начинается с конъюнгирования с сахарами (рибоза, глюкоза) и аминокислотой аланином. При этом путь образования О-глюкозидов цитокинина можно рассматривать как запасание этого гормона, а другие – как необратимую деструкцию. Недавно открыт фермент цитокининоксидаза, окисляющий цитокинин без предварительного гликозидирования. Окисление при этом происходит по месту присоединения алифатической части к аденину.
Основной физиологический эффект цитокинина заключается в активации клеточных делений. В отличие от ауксина, создающего необходимые условия для митоза, выражающиеся вдедифференцировке и репликации ДНК, т. е. в инициировании митоза, цитокинин активирует следующие стадии: работу РНК-полимераз, образование РНК и синтез белков. Возможно, что эти эффекты связаны с атграгирующим действием цитокинина.
Атграгирующее действие частично обусловливает и ряд других эффектов данного фитогормона, к числу которых можно отнести стимулирование роста клеток листьев и семядолей, снятие апикального доминирования, задержку старения листьев и регуляцию передвижения веществ в растении.
Значительную роль цитокинин играет и в регуляции органогенеза. Преобладающая концентрация этих гормонов задерживает образование корней и ускоряет закладку стеблевых почек. Они также способны индуцировать зацветание некоторых видов растений в условиях неблагоприятного фотопериода.
Под действием цитокинина покоящиеся семена и клубни ряда культур выходят из состояния покоя. Возможно, что это связано с активацией синтеза гидролитических ферментов.
Цитокинины не только задерживают старение листьев, но и регулируют формирование хпоропластов на ранних стадиях развития листа, а также их рост и деление за счет стимулирования синтеза хлоропластных РНК и белков.
Цитокинины участвуют также в регуляции транспирации листьев, открывая устьица, что наряду со стимулированием формирования хлоропластов и задержкой старения листьев приводит к большей фотосинтетической активности.
Очень важным свойством цитокининов является их способность повышать устойчивость клеток растения к различным неблагоприятным воздействиям – повреждающим температурам, недостатку воды, повышенной засоленности, рентгеновскому излучению, фитотоксичным воздействиям пестицидов. Механизм такого защитного действия еще не совсем ясен. Однако установлено, что повышение уровня цитокининов при неблагоприятных условиях жизни растения стимулирует синтез стрессовых белков, защищающих клетку.
Гибберемины были открыты (1926) и выделены (1938) в Японии как продуценты патогенного гриба Gibberella fujjcuroi, вызывающие чрезмерный вегетативный рост риса. В середине 50-х годов была установлена их химическая структура и присутствие этих веществ во многих видах растений.
Изучение гиббереллинов активно продолжается. Уже известно около 70 представителей этих веществ, в том числе 45 выделены из растений.
Известен ряд соединений, которые способны блокировать биосинтез гиббереллинов. Практически все эти вещества обладают ретардантным действием, т. е. тормозящим рост. Прерывание биосинтеза гиббереллина происходит за счет блокирования определенных ферментов. Так, хлорхолинхлорид и другие четвертичные аммониевые соединения прерывают образование энт-каурена, блокируя первую стадию реакции образования каурена, происходящую в цитоплазме, в отличие от второй стадии, происходящей в хлоропластах. Обе стадии осуществляются одним и тем же ферментом – энт-кауренсинтазой. Триазольные вещества прерывают образование энт-кауреновой кислоты, блокируя три последовательные реакции окисления энт-каурена.
Транспорт гиббереллинов неполярен. Они перемещаются акропетально и базипетально по сосудам ксилемы и флоэмы с током водных растворов. В связи с таким характером транспорта скорость распространения этого фитогормона сравнительно высока.
Физиологическое действие гиббереллинов проявляется главным образом в стимуляции ростовых процессов за счет усиления растяжения клеток и повышения митотической активности меристематических тканей. Стимулирование растяжения клеток поддействием гиббереллина не связано с активацией протонной помпы, в отличие от действия ауксинов, а обусловлено усилением синтеза материала клеточной стенки.
Наблюдается определенная специфика в ростовых реакциях растений различных семейств на тот или иной гиббереллин. Так, растения семейства тыквенных и некоторые крестоцветные не изменяют своего роста под действием ГК3, но активно реагируют на ГК4, который, в свою очередь, не изменяет интенсивность роста представителей ряда других семейств.
Помимо видовой специфичности на гиббереллин ярко выражена специфичная реакция органов одного и того же растения на повышение уровня этого фитогормона. Вызывая активный рост стебля, гиббереллин практически не влияет на рост листа и угнетает рост корней. Отрицательное действие гиббереллина на корни может быть связано с перераспределением питательных веществ на преимущественное развитие активно растущей надземной системы.
Дефицит гиббереллинов может определять карликовость растений. Причины карликовости в этом случае, как правило, обусловлены нарушением работы ферментативной системы биосинтеза этих фитогормонов.
Гиббереллины играют большую, но недостаточно изученную роль в процессах перехода к формированию генеративных органов и зацветанию. Показано на многолетних растениях, что повышение уровня гиббереллинов на стадии детерминации генеративного пути развития меристем приводит к подавлению образования генеративных органов. В то же время снижение уровня гиббереллинов на более поздних этапах формирования элементов цветка в меристеме так же неблагоприятно сказывается на генеративном развитии.
У некоторых розеточных растений обработка гиббереллином индуцирует зацветание даже в условиях неблагоприятного светового дня. Это дало основания академику М.Х. Чайлахяну (1988) для представления гиббереллина как необходимой части гипотетического гормона флоригена. Предполагается, что помимо гиббереллина в состав флоригена входят антезины – еще не выделенные фитогормоны.
Введение гиббереллина извне часто вызывает угнетание развития семян и формирование партенокарпических плодов. У растений с раздельнопольными цветками отмечен эффект сдвига сексуализации в сторону преобладающего формирования мужских цветков.
Гиббереллины способны выводить семена и клубни растений из состояния покоя. Это связано с индуцированием ими синтеза ряда гидролитических ферментов, главным образом а-амилазы, расщепляющей запасной крахмал и делающий его доступным для питания зародыша.
Этилен. В 1901 г. Д.Н. Нелюбов из Петербургского университета сообщил о том, что этилен, входящий в состав светильного газа, стимулирует опадение листьев и нарушает фототропизм проростков гороха. В 1934 г. этилен был обнаружен в газообразных выделениях храняшихся яблок. Это послужило основанием для того, чтобы считать его фитогормоном.
Этилен – единственный известный газообразный фитогормон очень простого строения. Дезактивация этилена кроме выделения его в окружающую среду происходит путем образования окиси этилена. Установлено, что максимальная активность этилена совпадает по времени с его максимальным окислением, а искусственное прекращение окисления останавливает действие этого фитогормона. Все это дает возможность предполагать, что окисление этилена каким-то образом связано с реализацией его фитогормональной активности.
Способностью к биосинтезу этилена обладают практически все живые клетки растения. В онтогенезе характер образования этого фитогормона резко изменяется. У ювенильного растения этилен синтезируется главным образом в меристематических тканях. В дальнейшем наибольшие количества этилена образуют созревающие плоды. Биосинтез этилена также резко усиливается при травмах или стрессовых воздействиях на растение.
Как и большинство фитогормонов, этилен обладает широким спектром регуляторных эффектов, причем даже в пределах одного растения возможны различные реакции клеток на этот фитогормон.
Этилен способен вызывать изодиаметрическое растяжение клеток (утолщение), что связано с изменением ориентации микротрубочек, вследствие чего вновь синтезируемые микрофибриллы целлюлозы располагаются вдоль новой оси растяжения.
Ряд эффектов этилена объясняется его антиауксиновым действием. В отличие от ауксина, этилен вызывает формирование отделительного слоя, т. е. приводит к опадению листьев, цветков, завязей и плодов. Это обусловлено тем, что он индуцирует синтез ферментов эндополигалуктороназы и целлюлазы, разрушающих клеточные стенки. Под действием этилена прекращается индуцированное ауксином растяжение клеток, подавляется митотическая активность. Этилен также блокирует транспорт ауксина.
Этилен не только вызывает опадение плодов, но и ускоряет их созревание. Под действием этого фитогормона повышается выход латекса у каучконосных растений.
По-разному действует этилен на рост растений. У большинства растений он тормозит вегетативный рост, подавляя процессы деления и растяжения клеток. Однако в ряде случаев, например для проростков риса, повышение его концентрации приводит к активации роста.
Значительный интерес представляет защитное действие этилена. Как уже отмечалось, образование этилена резко увеличивается при стрессовых воздействиях и механических повреждениях. Возможно, что это первый ответ растения на потенциальную опасность. Стрессовый этилен индуцирует синтез фитоалексинов (защитных веществ) и фермента хитиназы, разрушающего клеточные стенки патогенных грибов, а также некоторых фенольных соединений.
Кроме того, повышение уровня этилена приводит к стимуляции образования другого фитогормона, также принимающего участие в защитной реакции растений – абсцизовой кислоты.
Абсцизовая кислота (АБК) впервые выделена в 1964 г. из молодых коробочек хлопчатника. Она представляет собой сесквитерпен, синтезируемый в растении из мевалоновой кислоты.
Возможно также образование АБК из продуктов распада ксантофилла виолаксантина под действием света или фермента липоксигеназы. Это, по-видимому, объясняет резкое увеличение данного фитогормона при стрессе. АБК синтезируется во всех органах растения. Интенсивность ее образования увеличивается по мере старения, а также при неблагоприятных воздействиях, особенно при недостатке влаги. Наибольшее содержание этого фитогормона в хлоропластах старых листьев, зрелых плодах, покоящихся семенах и почках. По мере созревания зародыш семени сам приобретает способность синтезировать АБК, регулируя таким образом процесс собственного покоя и устойчивости. Синтез АБК имеет четкую фоторитмичность, возрастая в 50–60 раз ночью по сравнению с днем. На уровень АБК стимулирующе действует снижение температуры и уменьшение в составе света синих и ультрафиолетовых квантов.
АБК транспортируется акропетально и базипетально по флоэме и ксилеме. Скорость передвижения довольно высока. Атграгирующими центрами для АБК являются активно делящиеся меристемы. Метаболизм АБК может осуществляться через образование конъюгата с сахарами (гликозидирование), которое может быть обратимым и необратимым, а также окислением через фазеевую кислоту.
Фитогормональные эффекты АБК весьма разнообразны. Они связаны как с ингибированием, так и со стимуляцией важнейших физиологических процессов. Абсцизовая кислота – фитогормон с мощным ингибиторным действием. Она ускоряет распад нуклеиновых кислот, белков, хлорофилла, ингибирует активность протонной помпы. Под действием АБК закрываются устьица и прерывается фотосинтетическое фосфорилирование.
Покой семян, почек и клубней регулируется АБК: стимуляция развития партенокарпических плодов у розы и образования клубней картофеля, удлинение гипокотиля огурца, образование корней у черенков фасоли. Значительные изменения вызывает этот фитогормон и в составе запасных белков зерновых культур.
Очень важна роль абсцизовой кислоты в устойчивости растений к стрессу. Она, Так же как и цитокинин, индуцирует синтез стрессовых белков, в том числе и особой группы – белков синикации. Данные вещества ответственны за обезвоживание семян, что обеспечивает их покой. Растения, не способные к синтезу этого гормона, быстро погибают.
Брассиностероиды. Этот класс фитогормонов открыт сравнительно недавно и сейчас активно изучается. Особый интерес исследователей вызывал тот факт, что брассиностероиды до недавнего времени были единственными известными гормонами растений стероидной природы. Учитывая, что у насекомых и животных стероиды играют огромную роль в процессах гормональной регуляции, сведения о брассиностероидах могли бы быть очень важными для осмысления эволюции гормональных систем растительного и животного мира.
Процессы биосинтеза и транспорта брассиностероидов слабо изучены. Известно, что малые количества этих фитогормонов содержат ткани цветка, листья и молодые стебли растений. Максимальная концентрация брассиностероидов отмечена в пыльце, из которой они и были выделены в 1970 г.
Физиологическое действие брассиностероидов близко к действию других фитогормонов. Подобно ауксину, брассиностероиды стимулируют растяжение клеток, подобно гиббереллину – стимулируют рост изолированных семядолей огурца. Брассиностероиды обладают также некоторыми факторами, сходными с этиленом. Специфичным действием этих фитогормонов можно считать регуляцию роста семяпочки. Микроколичества брассиностероидов, попадая с пыльцой в семяпочку, стимулируют ее развитие и образование семян. Большой интерес вызывает недавно обнаруженный эффект стимулирования брассиностероидами устойчивости растений к стрессам и грибным заболеваниям. Причины такого действия скорее всего связаны с повышением образования стрессовых белков, а также фитоалексинов и других компонентов системы фитоиммунитета. В настоящее время исследования брассиностероидов активно проводятся во многих странах в целях повышения продуктивности и устойчивости сельскохозяйственных растений.
Фузикокцины. Фузикокцин – стероидное вещество, ранее известное лишь как продуцент жизнедеятельности грибов, является фитогормоном, т. е. синтезируется в растении и регулирует ростовые процессы (Г.С. Муромцев, 1996). Важнейшие эффекты фузикокцина: стимуляция растяжения клеток, усиление транспирации, огкрывание устьиц в темноте, выведение семян из состояния покоя, ускорение их прорастания и др.
Взаимодействие фитогормонов в растениях
Гормоны растений активно влияют на синтез, распад и транспорт друг друга. Изменение уровня одного из компонентов фитогормональной системы неизбежно приводит к изменениям всей системы (рис. 10.2).
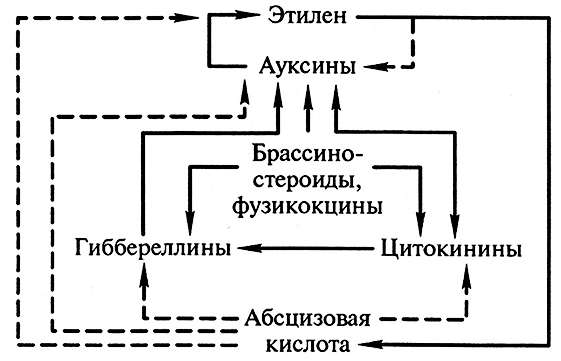
Рис. 10.2. Гормональные взаимодействия, приводящие к повышению (сплошные линии) или к понижению (пунктирные линии) уровня того или иного гормона (по D.S. Letham, 1978, дополненный)
Гормональный статус у растений
Гормональный статус – состояние фитогормональной системы в онтогенезе растений, уровни фитогормонов и соотношение между ними в процессах образования, передвижения, использования и инактивации в ответ на внешние воздействия. Гормональные статусы изучены слабо. Это объясняется трудностью количественного определения фитогормонов. Исследования гормонального статуса сельскохозяйственных растений развернуты на кафедре сельскохозяйственной биотехнологии МСХА им. К.А. Тимирязева с использованием современных приборов и методов анализа (B.C. Шевелуха, В.М. Ковалев, П.Б. Курапов, 1995).
Синтетические регуляторы роста и развитие растений
Знание механизмов фитогормональной регуляции представляет большие возможности для регуляции роста и развития растений с целью достижения большей продуктивности, устойчивости и технологичности.
Направленное воздействие на фитогормональную систему растения осуществляется при помощи регуляторов роста и развития растений (см. приложение).
Фиторегулятором называют природное или синтетическое вещество, способное вызывать ростовые или формативные эффекты и не являющееся в применяемых концентрациях источником питания или фитотоксином. Таким образом, любое вещество, влияющее на рост и развитие растений, если оно не стимулирует рост как удобрение и не угнетает его как гербицид, является фиторегулятором. Известно около 5 тыс. соединений, обладающих регуляторной активностью, однако в практике применяется лишь несколько десятков (около 1 %).
Физиологическая активность подавляющего большинства фиторегуляторов обусловлена их способностью влиять на какой-то компонент фитогормональной системы. Это достигается за счет повышения уровня фитогормона при введении извне его аналога; воздействия на биосинтез фитогормона (стимулирование или подавление); блокирования транспорта фитогормона; воздействия на систему инактивации фитогормона (стимулирование или подавление); конкуренции за присоединение к рецептору фитогормона; инактивации фитогормонрецепторного комплекса.
Действие синтетических регуляторов на гормональную систему растения
Аналоги и антагонисты ауксинов. Среди регуляторных соединений, влияющих на ауксины, наиболее широкое применение нашли синтетические аналоги этих фитогормонов, используемые для стимулирования корнеобразования: индолил-3-уксусная кислота (ИУК), индолил-3-масляная кислота (ИМК), 1-нафтилуксусная кислота (НУК), ее соли и амид. Эти соединения используют при вегетативном размножении растений методом черенкования в биотехнологическом процессе и в классическом растениеводстве. Обработку проводят введением препарата в питательную среду с концентрацией от 1 до 10 мг/л, кратковременным погружением базального конца черенка в спиртовой раствор препарата концентрацией около 200 мг/л или 12–24-часовым замачиванием черенков в водном растворе концентрацией 25–50 мг/л. Все эти соединения малотоксичны, а то, что их применение не связано напрямую с получением пищевых продуктов, делает их полностью безопасными.
Среди аналогов ауксина особое место занимает группа фенилпроизводных: 2,4-дихлорфеноксиуксусная кислота (2,4-Д); 4-хлорфеноксиуксусная кислота (4-Х); 2,4,5-трихлорфеноксиуксусная кислота (2,4,5-Т); 2(2,4,5-трихлорфенокси) пропионовая кислота (2,4,5-ТП). Все эти соединения обладают крайне высокой ауксиновой активностью в том участке спектра действия этого фитогормона, который связан с активностью протонной помпы и обусловливает процессы тропизмов, растяжения клеток, дедифференцировки. В малых концентрациях (0,5–2,0 мг/л) указанные вещества применяют при получении каллусной ткани, а в больших – как гербициды, действие которых основано на необратимой разбалансировке гормональной системы растений. Токсичность аналогов ауксина данной группы несколько ниже, чем у представителей других групп, однако они имеют существенную экологическую опасность из-за мощного мутагенного воздействия.
Известен ряд фиторегуляторов, являющихся антиауксинами, действие которых связано с блокированием транспорта этих гормонов: морфактины, нафтилфталаминовая кислота и ее соли, а также 2, 3, 5-трииодбензойная кислота (ТИБК). Действие ТИБК выражается в нарушении апикального доминирования, обусловленного ауксином, что выражается в увеличении пробудимости почек и на некоторых культурах, например сое, способно привести к значительному повышению урожая за счет увеличения числа продуктивных побегов.
Аналоги и антагонисты цитокининов. В последнее время резко возрос интерес к цитокининовым препаратам в связи с установлением их антистрессового эффекта. Этим свойством обладают близкие синтетические аналоги цитокининов ряда зеатина (кинетин, 6-бензиламинопурин) и весьма отдаленные (картолины). В меньшей степени антистрессовым свойством обладает аналог цитокининового ряда дифенилмочевины – дропп (тидиазурон).
В биотехнологии растений цитокинины применяют для активации деления клеток при получении каллусных тканей, индукции дифференцирования побегов в каллусе, а также для снятия апикального доминирования и повышения коэффициента размножения при клональном микроразмножении. Особенно часто с этими целями применяют 6-БАП и кинетин.
Аналоги цитокининов вследствие их аттрагирующей способности применяют для снятия апикального доминирования у плодовых саженцев в питомнике с целью более ранней и качественной закладки кроны, а также для увеличения размера и массы ягод бессемянных сортов винограда. Наилучшие результаты в этих случаях достигаются при использовании аналогов цитокинина совместно с синтетическими гиббереллинами.
Препарат дропп хорошо зарекомендовал себя как дефолиант хлопчатника. Его действие основано на стимулировании образования эндогенного этилена, который и обусловливает данный эффект. По данным наших исследований, применение этого препарата эффективно в биотехнологии для изменения морфогинезом растений in vitro (В.М. Ковалев, Т.Н. Глушкова, Е.А. Калашникова, 2002).
Аналоги цитокининов в весьма ограниченных объемах применяют и для задержки старения срезанных зеленых овощей, сдвига пола в женскую сторону, а также для прерывания состояния покоя и стимулирования прорастания семян. Антагонисты цитокининов известны, но в практике пока не применяются и имеют лишь научную значимость.
Аналоги и антагонисты гиббереминов. Аналоги гиббереллинов получают путем микробиологического синтеза из патогенного гриба Gibberella fujicuroi. Они представляют собой точные копии гиббереллинов, продуцируемых растениями. Наиболее распространены в промышленном применении гиббереллины ГК3, ГК4, ГК7. Основные объемы использования этих веществ связаны со стимулированием роста ягод бессемянных сортов винограда.
Другим прогрессирующим аспектом применения гиббереллинов является снятие состояния покоя семян и клубней, что обеспечивает их лучшую всхожесть. Эти препараты используют также для сдвига пола растений в мужскую сторону.
В биотехнологии растений гиббереллины применяют для получения безвирусного посадочного материала, для стимуляции деления и растяжения клеток апикальной меристемы, что создает дополнительные благоприятные условия для освобождения от вирусной инфекции.
Антагонисты гиббереллинов применяют в сельскохозяйственном производстве несравненно шире аналогов. Практически все антагонисты гиббереллина обладают ретардантным действием.
Аналоги и антагонисты брассиностероидов. Одновременно с выделением из растительных источников, начались работы по химическому синтезу аналогов брассиностероидов (БС).
Большинство синтезированных к настоящему времени аналогов БС отличаются от их природных фитогормонов структурой боковой цепи. К наиболее распространенному типу аналогов БС относятся соединения 22S, 23S – изомеры: гомобрассинолиды, норбрассинолиды (В.А. Хрипач и др., 1993).
Имеются данные о том, что БС и их аналога могут успешно конкурировать с экдистероидами за связывание с экдизоновыми рецепторами, выступая в роли антиэкдизонов. Наряду с экдизонами, близкородственны к БС в структурном отношении также некоторые другие представители класса гомоксистероидов (хиограстерины, азерарахол).
Аналоги и антагонисты фузикокцинов. Характер физиологической активности фузикокцина (ФК), типичный для фитогормонов, позволил рассматривать его как имитатор, физиологический аналог последних. Особенно велика аналогия ФК с гиббереллинами, они оба обладают высокой и разносторонней регуляторной активностью, продуцируются в значительных количествах фитопатогенными грибами и относятся к одной группе химических соединений – дидитерпенам.
К терпеноидам принадлежат брассиностероиды и абсцизовая кислота, эти фитогормоны также синтезируются фитопатогенными грибами. На основе этого Г.С. Муромцев (1987) высказал предположение о гормональной природе ФК и обнаружил его в высших растениях.
А. Баллио с сотр. (Ballio et al., 1979) обнаружили в плазматической мембране рецептор ФК – гликопротеин с молекулярной массой 40 тыс. дальтон. Эти исследователи обнаружили в корнях проростков кукурузы эндогенный ингибитор активного транспорта протонов – антагонист ФК. Высказана возможность косвенной активации ФК транспортной мембранно-связанной АТФ-азы. ФК взаимодействует с локализованными в плазмалемме дыхательными цепями, которые могут регулировать функционирование системы активного транспорта протонов.
Аналоги и антагонисты этилена. Применение аналогов этилена в растениеводстве стало возможным вследствие открытия свойств 2-хлорэтилфосфоновой кислоты (2-ХЭФК, этефон) распадаться с выделением этилена при рН > 4,0.
На основе 2-ХЭФК разработаны многие препараты, в частности этрел, кампозан, флордимекс, гидрел, дигидрел, декстрел. 2-ХЭФК и препараты на ее основе практически не токсичны для теплокровных (LD50 для крыс при пероральном введении составляет более 4000 мг/кг). Исключением являются гидрел и дигидрел, при синтезе которых используют несимметричный диметилгидразин, следовые количества которого в данных препаратах обусловливают их большую токсичность, мутагенность и тератогенность.
Этиленпродуценты применяют для самых различных воздействий: как ретардант, как вещество, стимулирующее образование отделительного слоя, как индуктор и стимулятор состояния покоя растений и устойчивости.
В последнее время разработан ряд этиленпродуцентов на основе кремнийорганики, наиболее перспективным из которых является ситрел. Он практически лишен недостатков, присущих 2-ХЭФК, а кроме того, менее токсичен для теплокровных организмов.
В ряде случаев необходимо снизить уровень эндогенного этилена в растении. В частности, это необходимо для предотвращения сброса завязи на ряде плодовых культур, а также при некоторых биотехнологических операциях. Для этого используют вещества, блокирующие биосинтез этилена. К ним относятся Ag+ аминооксиуксусная кислота (ЛУК), ризобиотоксин и аминоэтоксивинилглицин (АВГ). Однако из-за высокой стоимости перечисленные препараты не получили широкого применения.
Аналоги и антагонисты абсцизовой кислоты. Структурные аналоги абсцизовой кислоты, обладающие физиологической активностью, не применяются в сельском хозяйстве из-за высокой стоимости. Однако уровень этого фитогормона можно повысить, активировав его образование в растении. В качестве индуктора и стимулятора образования абсцизовой кислоты выступает другой фитогормон – этилен или его продуценты.
Увеличение уровня абсцизовой кислоты представляет интерес в связи с индукцией этим фитогормоном синтеза стрессовых белков, ответственных за связывание воды, а также его способностью стимулировать состояние покоя, что обеспечивает сокращение потерь растениеводческой продукции при хранении.
Специфические антагонисты абсцизовой кислоты пока неизвестны, а к числу неспецифичных можно отнести все гормоны со стимуляторным характером действия.
Генетический риск применения регуляторов роста в растениеводстве
В целях экологически безопасного применения регуляторов роста важное место должно уделяться оценке генетического риска их применения уже на этапе государственного испытания. Работы в этом направлении развернуты в МСХА им. К.А. Тимирязева на кафедре сельскохозяйственной биотехнологии (B.C. Шевелуха, И.К. Блиновский, Л.И. Хрусталева, 1992).
В лабораторных опытах мутагенный эффект ССС не был обнаружен ни на одном из испытанных сортов ячменя. При использовании ХЭФК цитогенетический эффект проявлялся на сортах Московский 3, Московский 2, Носовский 9. Доля анафаз с нарушениями в 3,3–7,3 раза превышала этот показатель в контроле. Сорт ячменя Московский 121 оказался устойчивыми к воздействию ХЭФК. Цитогенетическое действие регуляторов роста сохранялось в следующем семенном поколении, хотя доля аберрантных анафаз была несколько ниже, чем в год обработки.
На пшенице цитогенетический эффект был отмечен при применении картолина. В следующем поколении это действие сохранялось. Данные исследования указывают на необходимость обязательной оценки цитогенетического действия перспективных, а также уже применяемых в производстве регуляторов роста растений в целях сохранения их генофонда. Препараты, вызывающие нарушения хромосом, должны быть исключены из использования в семеноводстве.
Фитогормоны и синтетические регуляторы роста
и развития растений в биотехнологии
Фиторегуляторы занимают особое место в арсенале средств биотехнологии растений, поскольку являются главными инструментами, позволяющими управлять процессами каллусообразования, дифференцировки, роста и развития растений-регенерантов.
Регуляция органогенеза
Ю. Сакс еще в 1880 г. предсказал наличие регуляторных веществ, ответственных за дифференцировку и развитие основных органов растения – корня, стебля и листа, назвав их соответственно ризоколином, кауликолином и фолиоколином. Время во многом подтвердило справедливость таких взглядов, не поддержанных его современниками. Дальнейшим развитием их стала теория флоригена, предложенная выдающимся отечественным исследователем М.Х. Чайлахяном (1988). И хотя поиски флоригена еще не увенчались успехом, они показали правомочность этой теории, так же как и современные данные о регуляции развития и роста корня под действием ауксина, а побега – под действием цитокинина подтверждают справедливость взглядов Ю. Сакса.
В связи с развитием биотехнологии сельскохозяйственных растений значимость сведений о фитогормональной регуляции органогенеза неуклонно возрастает, поскольку именно фитогормоны являются основным инструментом при различных манипуляциях с культурами клеток и тканей растений in vitro.
Корнеобразование. Искусственное укоренение побега, листа или стебля широко применялось в растениеводстве во все времена, однако этот путь размножения был пригоден далеко не для всех случаев, трудоемок и дорог. Лишь с открытием ауксина в начале 30-х годов и его способности индуцировать образование адвентивных корней и стимулировать развитие корневой системы появилась возможность массового размножения практически всех видов растений черенкованием.
В настоящее время, несмотря на значительную модернизацию, суть данного способа размножения осталась неизменной – обработка черенков аналогом ауксина перед высадкой на укоренение.
Образование адвентивного корня происходит из клеток камбия, причем строго в зоне сочленения его с сердцевинным лучем. Наиболее эффективно этот процесс идет в период максимальной пролиферирующей активности камбиальной ткани. Формирование корня из клеток меристематической ткани детерминировано генетически. Изменение транскрипции генетических программ, приводящее к ризогенезу, контролируется ауксином, который после взаимодействия с определенным рецептором и образования соответствующего гормон-рецепторного комплекса запускает систему ответа, приводящую к снятию репрессорной блокады с оперонов генов ферментов, изменяющих метаболизм и приводящих к корнеобразованию.
Не все синтетические аналоги ауксина обладают способностью индуцировать корнеобразование. Так, ризогенная активность индолил-3-масляной (ИМК) и нафтилуксусной (НУК) кислот, синтетических аналогов ауксина, значительно превышает то же действие настоящего природного фитогормона – ИУК. Это связано с большей стабильностью синтетических регуляторов в клетке, обусловленной меньшим сродством их к ферментам дезактивации гормона. В то же время другой аналог ауксина – 2,4-дихлорфеноксиуксусная кислота (2,4-Д) – практически неспособна вызывать ризогенез, и при длительном применении этого вещества обработанная ткань утрачивает способность к корневому морфогенезу.
Корнеобразующая активность синтетических ауксинов стимулируется при совместном применении с ними витаминов, в частности аскорбиновой кислоты, которая в этом случае, вероятно, действует как антиоксидант, препятствующий деструкции ауксина.
Значительное стимулирование корнеобразования дает предварительная обработка маточных растений ретардантами. Этот эффект показан на многих культурах: землянике, картофеле, яблоне, вишне, смородине, крыжовнике и др. Во всех случаях обработка маточных растений перед срезкой черенков или выделением меристем приводила к лучшему формированию корневой системы растения. Объяснение этого факта может быть связано с рядом причин, наиболее вероятной из которых является антагонизм между ауксином и гиббереллином в их влиянии на процесс корнеобразования. Ретарданты, являющиеся антигиббереллинами, изменяют соотношение гормонов в пользу ауксинов, стимулируя тем самым процесс ризогенеза.
Побегообразование. Органогенез побега главным образом контролируется другой группой фитогормонов – цитокининами. Это показано на каллусной культуре практически всех растительных видов. Повышение уровня цитокинина в среде приводит к индуцированию закладки зачатков почек в каллусе. При направленном стимулировании формирования зачатков вегетативных почек в каллусе особое внимание следует уделить абсолютному уровню ауксинов и цитокининов в питательной среде и соотношению этих фитогормонов.
Внимания биотехнологов заслуживает альтернативность морфогенеза из каллуса: начавшийся корневой органогенез подавляет формирование зачатков почек, и наоборот.
Участие цитокининов в регуляции органогенеза у недифференцированной ткани каллуса табака было впервые показано Ф. Скугом и К.О. Миллером. В опытах при помощи ИУК и кинетина вызывали образование у каллуса корней и побегов. Причем дифференциация каждого из этих органов требовала определенных концентраций обоих фитогормонов.
Одним из частных случаев побегового органогенеза, имеющим важнейшее значение для сельскохозяйственного производства, является клубнеобразование. Этот процесс блокируется ауксинами, что допускает проведение параллелей с органогенезом в каллусной культуре – как и в том случае, под действием повышенных доз ауксинов стимулируется корнеобразование и подавляется формирование клубней.
По мнению М.Х. Чайлахяна, получившему подтверждение других исследователей, фитогормональная регуляция клубнеобразования осуществляется гиббереллинами и абсцизовой кислотой (АБК) в следующей последовательности: сначала под действием гиббереллинов стимулируется образование и рост столонов, а на следующем этапе под действием АБК рост столонов прекращается, при этом они утолщаются и формируют клубень на столоне. Обработка растений картофеля АБК существенно повышает урожайность за счет увеличения массы клубня.
Гормональная регуляция камусообразования. Один из основных этапов работы биотехнологов растений связан с получением каллусной ткани из дифференцированных тканей листа, побега, корня. Основа получения каллуса – дедифференцировка растительных клеток экспланта, их возврат в меристематическое, пролиферирующее состояние. Для этого должно произойти следующее: 1) модификация тех элементов структуры клетки, которые мешают процессу деления (прежде всего – истоньшение толстой вторичной клеточной стенки); 2) экспрессия генов, ответственных за процесс митоза.
Каллусообразование происходит в растительном мире довольно широко. Открытые раны растений способны достаточно быстро затянуться каллусной тканью, которая впоследствии дифференцируется. В подавляющем большинстве каллус образуется из меристематической ткани, главным образом камбия. При этом не возникает необходимость в модификации клеточной структуры.
При получении каллуса in vitro часто применяется посадка экспланта на питательную среду с высоким содержанием синтетического аналога ауксина – 2,4-Д, который стимулирует процесс дедифференцировки. Механизм такого стимулирования можно объяснить регуляторными эффектами ауксина: активацией протонной помпы и связанного с ним истоньшения клеточной стенки за счет эффекта «кислого роста», индукцией синтеза ряда ферментов, вызывающих частичный гидролиз клеточной стенки, а также индукцией репликации ДНК. Кроме того, следует отметить, что именно 2,4-Д способен стимулировать деление клеток по способу действия цитокинина, стимулируя синтез нуклеиновых кислот.
При длительном пассировании каллусной ткани возможно ее перерождение в опухолевую, т. е. ткань, рост которой не контролируется организмом. Причина этого явления заключается в приобретении способности синтезировать фитогормоны (ауксины и цитокинины), необходимые для ее деления внутри себя, а не получать их от других органов. Опухолевая ткань в культуре in vitro, не реагирующая на изменение концентрации фитогормонов во внешней среде, называется гормоннезависимой или «привыкшей».
Явление приобретенной гормоннезависимости существенно ограничивает возможности биотехнологии растений, поскольку клетки тканей, обладающие данным свойством, практически не способны к дифференцировке, а следовательно, и к регенерации целого растения. Изучение причин и механизмов приобретения гормоннезависимости крайне важно, поскольку может дать ключ не только к решению проблем сельскохозяйственной биотехнологии, но и к лечению онкологических заболеваний человека.
Возможные подходы к преодолению гормоннезависимости каллуса при длительном пассировании могут быть связаны с блокированием синтеза избыточного количества как фитогормонов, так и их рецепторов. Очень интересные результаты по индукции морфогенеза ауксин независимого каллуса табака получены немецкими исследователями, показавшими, что при введении в гормональную среду других фитогормонов – брассиностероидов каллус приобретает способность к образованию эмбриоидных структур. Эмпирически был найден и другой путь повышения морфогенной способности каллуса при пассировании – включение в питательную среду азотнокислого серебра, блокирующего образование этилена.
Получение трансгенных растений с измененным гормональным статусом
Процесс получения трансгенной растительной ткани с измененным фитогормональным статусом происходит в природе без вмешательства человека. В ходе эволюции у двух видов агробактерий (Agrobacterium tumifaciens и A. rizogenes) сформировался механизм, позволяющий им не только синтезировать необходимые белки, используя генетический аппарат растения-хозяина, но и обеспечивать постоянный приток пластических веществ, дедифференцировку и пролиферацию зараженных клеток.
Основа паразитического механизма агробактерий – введение в растительную клетку плазмиды, встраивающейся в хромосомную ДНК растения и содержащей наряду с генами специфических бактериальных белков (наполина и октапина) гены ферментов синтеза фитогормонов – ауксина и цитокинина. При этом уровень этих гормонов повышается, специализированная растительная клетка дедиффеч ренцируется и бесконечно делится, образуя галл при заражении A. tumifaciens и множество нитевидных воздушных корней при заражении A. rizogenes. Значительный интерес представляют новейшие научные данные, свидетельствующие о том, что при внедрении плазмиды в геном растения-хозяина подавляется синтез фитогормонов* ранее присущих данной клетке.
На основе плазмид агробактерий созданы векторные системы для переноса генов в хромосомный геном растения.
В настоящее время работы в области генетической инженерии растений связаны главным образом с получением исходных форм, обладающих устойчивостью к гербицидам, патогенам или насекомым-вредителям. Такая достаточно узкая направленность обусловлен на, в основном, двумя причинами. Во-первых, придание растениям вышеперечисленных свойств значительно сокращает необходимость применения ядохимикатов и, следовательно, обеспечивает большую экологическую безопасность растениеводства; а во-вторых, уровень развития генетической инженерии растений сегодня позволяет вводить в растительный геном и добиваться экспрессии лишь крайне ограниченного числа генов.
В практике промышленного растениеводства бывает крайне важно получить растение не только высокопродуктивное и устойчивое, но и имеющее определенный характер роста, что делает его приспособленным к погодным и агротехническим условиям выращивания и сельскохозяйственной технике. Особое значение это имеет при механизации процессов уборки урожая. По всей видимости, в подобных ситуациях перспективно управлять фитогормональным статусом, увеличивая или уменьшая продукцию того или иного фитогормона за счет изменения «дозы» генов ферментов его синтеза или за счет замены промотора.
В связи с очевидной перспективностью создания растений с измененным фитогормональным статусом эта работа активно проводится во многих лабораториях мира, в том числе и в России (В.М. Юсибов, Э.С. Пирузян и др., 1991). Например, во ВНИИ кормов им. В.Р. Вильямса (РАСХН) получены трансгенные растения люцерны изменчивой с другим фитогормональным статусом (И.В. Корнеева, В.В. Мазин, М.Н. Агафодорова, 1999). В работе использовали семена и растения сорта Рамбер клона 868. Трансформацию растений проводили при помощи штамма Ag. tumefaciens С 58 с «разоруженной» Ti-плазмидой pGV3850 и бинарным вектором GLTr4, несущим гены NPT II, и синтеза изопентиниладенина (ipt), который был получен из ИМГ (РАН) в отделе профессора Э.С. Пирузяна.
Трансформанты отличались по габитусу надземной части, продолжительности сохранения зеленого цвета листьев, длине побега, числу междоузлий и стеблей в кусте, массе корней, способности к ризогенезу, морфофизиологическим характеристикам репродуктивных органов, по содержанию свободного пролина, сырого протеина, хлорофиллов и каротиноидов. Авторы объясняют эти отличия корреляционными и адаптивными процессами в растениях в ответ на экспрессию гетерологичных генов и сдвигами в концентрациях и соотношениях фитогормонов й гормоноподобных веществ в растениях. Длительное сохранение листьями зеленого цвета связано с повышенным содержанием в них цитокинина, задерживающего старение и распад хлорофилла в листьях.
Трансформированные растения могут использоваться как ценный селекционный материал в качестве источников хозяйственно-ценных признаков: улучшение кормовых качеств люцерны, повышение семенной продуктивности и устойчивости к стрессам, создание пастбищевыносливых и конкурентоспособных ее сортов.
Биотехнологические методы
получения фитогормонов и фиторегуляторов
Очень часто перед учеными и практиками стоит задача получить тот или иной фиторегулятор. Учитывая сложность строения некоторых аналогов фитогормонов, наладить их синтез in vitro или не представляется возможным, или связано с высокими затратами. Решение проблемы в таких случаях часто находят, полностью или частично синтезируя необходимую молекулу при помощи микроорганизмов. Именно таким образом получают все гиббереллины, фузикокцин, налаживают производство абсцизовой кислоты, производят необходимые продукты для дальнейшего синтеза брассиностероидов.
В последнее время появилось много высокоэффективных фиторегуляторов, как правило, общестимуляторного действия, выделенных из микроорганизмов, особенно из компонентов комплекса везикулярно-арбускулярной микоризы, а также и других симбионтов высших растений. Примером удачного препарата этой группы может служить выделенный в нашей стране симбионт-2 и эмистим. Эти соединения проявляют эффективность действия по типу ауксинов и цитокининов, а также имеют ряд особенностей, по-разному проявляющихся на той или иной культуре.
Большинство распространенных препаратов микробиологического синтеза оказывает действие по типу витаминов, активируя ряд биохимических реакций, в результате приводящих к повышению урожайности или к проявлению каких-либо других желательных признаков. К серьезным недостаткам таких препаратов относится их многокомпонентность, существенно затрудняющая выделение действующего начала, определение токсичности компонентов регуляторной смеси, всего препарата в целом и контроль за уровнем остаточных количеств.
Фитогормоны и регуляторы роста в растениеводстве
Регуляторы роста и развития растений, промышленное применение которых, начатое в 50–60-х годах, сначала – для стимуляции корнеобразования черенков некоторых многолетних культур, затем – для борьбы с полеганием зерновых, в настоящее время распространилось практически на все интенсивные технологии выращивания сельскохозяйственных растений. При помощи фиторегуляторов удается значительно повысить устойчивость растений к неблагоприятным внешним воздействиям, увеличить продуктивность сельскохозяйственных культур, устранить некоторые недостатки высокоурожайных сортов.
Регуляция онтогенеза
Покой и способы его регуляции. Состояние покоя – эволюционное приспособление к перенесению организмом неблагоприятных внешних условий. Оно сформировалось как способ переживания низкой температуры зимой. Известны и другие условия формирования состояния покоя, к наиболее значимым из которых относится засуха в полупустынях. В этих условиях сформировались растения-эфемеры с очень коротким периодом вегетации, укладывающимся в несколько десятков дней от прорастания запасающего органа (как правило – луковицы или клубнелуковицы) до образования семян. Переход растения в состояние покоя может индуцироваться как эндогенными, так и внешними факторами, наибольшее значение из которых имеет изменение длины дня, указывающее организму на предстоящее изменение температуры и влажности.
В состояние покоя может вступать как все растение целиком, так и его отдельные части или органы. Примерами такого состояния являются покой луковиц и клубней, покой почек и семян растений во время продолжения активного роста надземной и корневой систем.
Существуют различные формы покоя. В случае когда рост растения прекращается под действием неблагоприятных факторов и немедленно возобновляется с улучшением условий произрастания, принято говорить о вынужденном покое. Многие травянистые растения, например различные злаки и двудольные сорняки, в средних широтах зимой пребывают в состоянии вынужденного покоя, обусловленного низкой температурой, близкой к 0 °С, и недостаточной для вегетации. При повышении температуры такие растения вновь переходят к росту.
Глубокий (физиологический, внутренний) покой не зависит от внешних условий. Многие древесные растения в течение лета и осени, т. е. при вполне благоприятных для роста условиях, образуют покоящиеся, снабженные защитными чешуями семена и зимующие почки. Выход растения из состояния глубокого покоя в большинстве случаев связан с достаточно длительным (250–1000 ч) пребыванием в условиях пониженной температуры (0–5 °С). После этого наступает так называемый дополнительный покой, который по сути соответствует вынужденному покою, так как в этой фазе при благоприятных внешних условиях рост может возобновиться.
Возможность управления состоянием покоя растений, а в конечном итоге такими основополагающими процессами, как прорастание семян, распускание почек, открывает большие возможности перед агрономами, так как позволяет обеспечить начало ростовых процессов в оптимальных условиях, что в конечном итоге приводит к лучшему развитию растений и повышению урожайности.
Повышение прорастания семян может быть достигнуто за счет ряда воздействий, как регуляторного, так и других. Так, у семян многих плодовых культур, принадлежащих к семейству Розанных, длительность покоя семян определяется во многом непроницаемостью семенных оболочек, и лишь длительное пребывание в условиях с повышенной деятельностью микрофлоры, выделяющей вещества, способные растворить семенной покров, стимулирует прорастание семян в естественных условиях. В таком случае ускорить прорастание можно с помощью скарификации, т. е. каким-либо образом разрушить семенной покров.
Как правило, основной причиной медленной всхожести семян являются ингибиторные вещества, присутствующие в семени. По мере формирования зародыша ингибиторы роста накапливаются непосредственно в нем или окружающих его тканях, постепенно поступая туда с ассимилятами за счет аттрагирующей способности зародыша или непосредственно синтезируясь в тканях, прилегающих к зародышу. В качестве природных ингибиторов роста выступают как фито гормоны – абсцизовая и жасминовая кислоты, так и ряд фенольных соединений, недостаточно изученных в настоящее время.
Другой причиной низкой всхожести семян является недостаток стимуляторных веществ, прежде всего гиббереллинов, повышающих активность гидролаз, которые расщепляют запасные вещества до легко растворимых мономеров, необходимых для роста зародыша, и цитокининов, активирующих процессы деления клеток. Недостаток стимуляторных веществ может быть обусловлен ранним отторжение ем зародыша от материнского растения, недостаточной способностью зародыша продуцировать собственные фитогормоны, низкой, активностью ферментов, переводящих фитогормоны из запасной формы в активную, высокой активностью гормон-разрушающия ферментативных комплексов.
Соответственно, фиторегуляторы, повышающие уровень стимул ляторов или снижающие уровень ингибиторов, будут ускорять прорастание семян и наоборот.
Стимулирование прорастания семян при помощи фиторегулятой ров широко используется на многих культурах. При этом повышаете! использование почвенной влаги, конкурентоспособность с сорняками, что приводит к повышению урожайности. Особенно хорошие peзультаты в этом направлении получены на овощных культурах и сахарной свекле.
Значительный практический интерес представляет и обратный прием – подавление прорастания. Особенное значение это имеет для культур со слабо выраженным покоем семян, способных при повышенной влажности в период сбора к энзимо-микозному истощению (ЭМИС) или прорастанию их еще на материнском растении, что приводит к большим потерям урожая. Для борьбы с отмеченным достатком перспективно применение фиторегуляторов антигиббереллинового действия, снижающих уровень или активность этого фитогормона и, следовательно, активность гидролитических ферментов, а также фиторегуляторов, повышающих уровень ингибитор ров роста, например продуцентов этилена. Превентивная обработка фиторегуляторами против ЭМИС также обладает дополнительным положительным воздействием – снижением потерь зерна при хранении.
Стимулирование покоя семян существенно и при подзимних посевах сельскохозяйственных растений. В этом случае семя, высеянное осенью, прорастает рано весной, при этом проросток получит возможность использовать для своего роста и развития большую часть влаги растаявшего снега, что обеспечивает и больший урожай, особенно в резко континентальном климате с изобилием осадков в виде снега зимой и сухим жарким летом. В то же время в случае продолжительной оттепели семена, вышедшие к этому времени из состояния глубокого покоя, могут прорасти, а последующий возвратный заморозок может нанести непоправимый урон такому посеву. Возможность регулирования продолжительности глубокого покоя в данном случае позволила бы найти оптимальные условия, уберегающие семя от провокации оттепелей, но в то же время позволяющие в максимальной степени использовать почвенную влагу. В связи с этим перспективно применение фиторегуляторов ростингибиторного действия совместно с предпосевным покрытием семян гидрофобной пленкой.
Механизмы управления покоем и прорастанием для вегетативных органов и семян практически идентичны. Идентичны также цели и приемы такой регуляции.
Наибольшее практическое значение при стимулировании прорастания имеет снятие состояния покоя с клубней картофеля для получения второго урожая в южных районах нашей страны. В данном случае состояние глубокого покоя клубней первого урожая легко снимается при их кратковременном замачивании в растворе гиббереллина и тиомочевины.
Обратный прием – стимулирование состояния глубокого покоя – предотвращает прорастание клубней, корнеплодов и луковиц сельскохозяйственных культур, что резко сокращает их потери при хранении. Пролонгирование состояния покоя достигается за счет обработки продуцентами этилена клубней перед закладкой на хранение или растений в поле непосредственно перед уборкой урожая. В данном случае используется способность этилена стимулировать биосинтез другого фитогормона, ответственного за покой,– абсцизовой кислоты. Повышение качества хранения обусловливается также и тем, что этилен индуцирует образование фитоалексинов – веществ, при помощи которых растение борется с грибами-патогенами, а также активирование хитиназы – фермента, лизирующего клеточные оболочки патогенных грибов.
Приемы управления покоем и прорастанием имеют особое значение для культуры многолетних древесных растений, чья крона не защищена снежным покровом от действия низкой температуры, а их защита от неблагоприятных условий зимой полностью обусловлена нахождением растений в состоянии покоя. В настоящее время ведутся активные поиски приемов стимуляции покоя плодовых.
Регуляция роста стебля. Рост растения – комплексный биологический процесс, складывающийся из процессов деления и растяжения клеток, обеспечиваемых дыханием, фотосинтезом, транспортом веществ в растении, поступлением воды и минерального питания. Применение любого фиторегулятора так или иначе влияет на рост.
В мире растений наблюдаются факты гигантизма и карликовости, получившие широкое применение в практическом растениеводстве. Основной причиной этого являются нарушения в системе фитогормональной регуляции, приводящие к разбалансировке роста и, соответственно, избыточному или недостаточному росту.
Существует четкая специфичность фитогормонов по стимуляции и подавлению роста отдельных органов. Так, рост корневой системы стимулируется главным образом ауксином, стебля – гиббереллинами, генеративных органов – брассиностероидами, гиббереллинами и цитокининами. Преобладание какого-либо из этих фитогормонов определяет преимущественное развитие соответствующего органа за счет других.
Рост побегов большинства растений стимулируется гиббереллином, активирующим деление клеток и растяжение в субапикальной зоне, а ингибируется этиленом, абсцизовой кислотой и некоторыми фенольными веществами. Характер роста побега определяется ауксинами, стимулирующими апикальное доминирование, и цитокининами, подавляющими этот процесс. Увеличение уровня гиббереллинов при введении в растение их аналогов существенно стимулирует рост, приводя к удлинению побега главным образом за счет увеличения длины междоузлий. Однако при этом уменьшается диаметр побега, снижается его механическая прочность и степень одревеснения. Следует отметить различную чувствительность представителей отдельных семейств к гиббереллинам. Так, рост побегов тыквенных активируется лишь ГК4 и ГК7, а рост злаков – ГK1 и ГК3.
В практике прием активации вегетативного роста побегов пока не получил распространения, что обусловлено высокой стоимостью аналогов гиббереллина. С разработкой более дешевой технологии получения этих препаратов их применение может быть перспективно при выращивании зеленой массы растений.
Увеличение роста побега отмечается и при обработке растений аналогами брассиностероидов и фузикокцином, однако этот прием не применяется из-за высокой стоимости этих препаратов.
Активация роста побега может быть достигнута при обработке растений препаратами гуминовых и фульвокислот, а также рядом препаратов микробиологического синтеза, полученных из симбиотических бактерий и грибов. Механизмы действия этих препаратов еще во многом не ясны.
В практике растениеводства несравненно большее распространение получил противоположный прием – замедление избыточного роста побега.
Значительное место среди фиторегуляторов занимают препараты, тормозящие вегетативный рост,– ретарданты. Первый препарат этого класса фиторегуляторов, имеющий промышленное значение, был синтезирован в конце 50-х годов в США профессором Толбертом и практически сразу нашел применение как эффективное средство борьбы с полеганием пшеницы. В последующие годы этот класс фиторегуляторов дополнился представителями других групп химических соединений, обладающими рострегулирующей активностью на культурных растениях других семейств.
Различия в механизме действия ретардантов позволили разработать композиции этих препаратов с синергическим действием компонентов. Синергизмом обладают смеси этиленпродуцентов с четвертичными солями аммония и с триазолпроизводными, а также гидразинпроизводными. Синергизм проявляется при определенных концентрациях и соотношениях компонентов и основан на воздействии препаратов, входящих в состав смеси, на различные этапы биосинтеза или реализации фитогормональной активности гиббереллинов.
Применение ретардантов для борьбы с полеганием зерновых многократно показало свою высокую эффективность.
Регуляция фотосинтеза. Все компоненты фитогормональной системы так или иначе влияют на фотосинтез. Однако в наибольшей степени этот процесс контролируется цитокининами и абсцизовой кислотой.
Цитокинины стимулируют синтез хлорофилла и дифференцировку хлоропластов, индуцируют открытие устьиц. АБК приводит к закрыванию устьиц.
Действие фиторегуляторов на процессы фотосинтеза может быть связано с морфологией, например продуктивность фотосинтеза может значительно варьировать при изменении угла наклона листовой пластинки относительно стебля.
В последнее время появились новые фиторегуляторы отечественного и зарубежного производства (активатор фотосинтеза, брассиностероиды), позволяющие в некоторой степени управлять процессами ассимиляции углекислоты (В.М. Ковалев, 1995).
На процессы фотосинтеза влияют ретарданты. Применение этих препаратов для сокращения вегетативного роста и стимулирования п роцессов закладки генеративных органов часто сопровождается увеличением площади листа, содержания хлорофилла, большей концентрацией Сахаров в листьях.
Особое место среди препаратов, повышающих суммарную продуктивность фотосинтеза, занимают регуляторы фотодыхания.
Механизм действия фиторегуляторов, снижающих фотодыхание (миксталол и др.), в настоящее время изучен недостаточно. Представляется маловероятным, что они оказывают действие непосредственно на строение РДФК, весьма консервативного фермента.
Регуляция транспорта веществ и качества урожая. Вопросы гормональной регуляции транспорта веществ в растениях пока мало исследованы. Ясно, что в управлении этим процессом участвуют во взаимодействии ауксины, гиббереллины и цитокинины.
Установлен факт аттрагирующего действия фитогормонов, но до настоящего времени практически ничего не известно о механизме этого действия. Скорее всего он связан с регуляцией фитогормонами проницаемости клеточных мембран.
Создан ряд синтетических фиторегуляторов, способных стимулировать отток продуктов фотосинтеза из листьев в запасные органы. Наиболее эффективными среди них являются метиловый эфир 3,6-дихлор-2-метоксибензойной кислоты (дизугран или ракуза) и N,N-бис-(фосфонометил)глицин (глифосин или лоларис). Первый более эффективен на сахарной свекле, второй – на сахарном тростнике. Активируя отток ассимилятов из листьев, фиторегуляторы косвенно повышают суммарную продуктивность фотосинтеза, улучшают качество урожая.
Регуляция устойчивости к абиотическим стрессам. Глобальное потепление климата Земли и обусловленное этим увеличение площади засушливых регионов уже в ближайшее время может привести к существенному сокращению производства сельскохозяйственной продукции. Для того чтобы этого не допустить, ведется селекция устойчивых сортов растений, разрабатываются агроприемы, направленные на преодоление неблагоприятного действия недостатка влаги и повышенной температуры. Большое внимание при этом уделяется фиторегуляторам, обладающим антистрессовым действием. .
Известно, что фитогормоны – цитокинины, абсцизовая кислота и брассиностероиды – повышают устойчивость растений к стрессовым воздействиям. Такое повышение устойчивости связано со способностью данных фитогормонов стимулировать синтез стрессовых белков.
Стрессовые белки – особый механизм самозащиты живого организма от стрессового воздействия, присущий большому числу биологических объектов, от простейших до человека. Эти вещества вырабатываются организмом в ответ на резкое изменение условий внешней среды, причем в зависимости от вида стресса можно выделить общую часть стрессовых белков, появляющуюся при любом виде стресса, и специальную, т. е. характерную именно для этого вида раздражения.
Интенсивное изучение стрессовых белков растений началось во второй половине 80-х годов. Получено некоторое представление о роли и строении этих веществ, хотя еще в данном вопросе много неясного. Наиболее полно изучена группа белков теплового шока (БТШ).
БТШ были впервые открыты в 1974 г. у животных, а несколько позже – и у растений. Большой интерес представляет тот факт, что ряд БТШ одинаков у простейших, растений, насекомых, птиц, млекопитающих. Это свидетельствует о консервативности и древности происхождения белков данной группы. БТШ начинают синтезироваться в организме при наступлении температурного стресса – повышении температуры на 8–10 °С выше нормы. При этом у разных растений температурные оптимумы синтеза БТШ неодинаковы, например у арабидопсиса – 37 °С, пшеницы – 40 °С, риса – 45 °С. Скорость синтеза БТШ довольно высока: мРНК БТШ появляется спустя 5 мин после начала стресса, а еще через 10 мин обнаруживаются сами БТШ. Максимальной концентрации в клетке БТШ достигают через 1,5–2 ч после начала стресса, и этот уровень поддерживается около 2–4 ч. При продолжении стрессового воздействия, как правило, наступает гибель организма. Через 2 ч после снятия стресса биосинтез БТШ прекращается, а сами БТШ обнаруживаются в растении еще в течение примерно двух суток.
Регуляция биосинтеза БТШ осуществляется на генном уровне при помощи особого регуляторного элемента (RE), расположенного в промоторной области генов БТШ, а также регуляторного белка транс-фактора (tF). При наступлении стресса транс-фактор обратимо взаимодействует с регуляторным элементом и разрешает тем самым синтез БТШ.
Общность и древность происхождения БТШ подтверждается тем, что строение регуляторного элемента и транс-фактора у простейших, растений и животных очень похоже, а следовательно, консервативен и механизм регуляции работы генов этих белков.
С началом синтеза БТЩ синтез других белков в клетке замедляется или останавливается. Это может быть связано со следующими особенностями: как правило, у гена БТШ интроны отсутствуют, что резко сокращает временное и энергетические затраты на процессинг; матрицы БТШ имеют преимущество перед мРНК других белков при образовании полисомы. Это связано со строением их лидирующей последовательности и З'-конца.
Абсолютное количество БТШ и других стрессовых белков даже в максимуме их концентрации весьма незначительно и фиксируется лишь при помощи радиоактивной метки. Всего описано около 100 различных индивидуальных БТШ.
Помимо БТШ, синтез которых стимулируется главным образом цитокининами и брассиностероидами, растение способно синтезировать еще ряд групп стрессовых белков, большое внимание среди которых вызывают белки синикации (БС), активируемые абсцизовой кислотой. Эти белки обеспечивают связывание воды в растении, а следовательно, и такие процессы, как высыхание семян, противостояние осмотическому и солевому стрессам, резким потерям воды при усиленной транспирации.
БС изучены гораздо хуже БТШ, о них пока известно лишь то, что они представляют собой белки с очень высокой степенью гидрофильности. Это обусловливает их свойство образовывать коллоидные растворы, создавая в клетке запас воды, подобно губке.
Уровень БС, образующихся в ответ на осмотический или солевой стресс, все чаще используют в качестве показателя засухои солеустойчивости растений.
В практике растениеводства давно используется закаливание, позволяющее, постепенно воздействуя внешними факторами, подготовить растение к пересадке в более жесткие условия выращивания. Физиологическая суть закаливания заключается именно в постепенном увеличении уровня стрессовых белков, что обеспечивает выживание организма в изменившихся условиях внешней среды. С открытием этого свойства фитогормонов появились дополнительные возможности по повышению устойчивости растений к абиотическим стрессам.
Химики и физиологи растений во всем мире сейчас активно ищут препараты, обладающие антистрессовым действием. Показано, что аналоги цитокин ина могут успешно проявлять такой эффект. Однако близкие структурные аналоги цитокининов (6-БАП, кинетин) из-за высокой стоимости не получили широкомасштабного применения. Возможно, что выход из создавшегося положения найден с производством в стране картолинов – отдаленных структурных аналогов цитокининов. Общий характер регуляторного действия в этом случае достигается близкой конфигурацией молекул и сходным расположением вероятных сайтов связывания с белковым рецептором.
Картолины были вначале отобраны как заменители цитокининов для поддержания роста культуры растительных клеток. При последующих исследованиях оказалось, что эти вещества обладают широким спектром действия, например придают обработанным растениям зерновых (ячмень, пшеница, рожь) устойчивость к недостатку влаги, высоким и низким температурам, а также к грибным патогенам.
Такая полифункциональность обусловлена присущим картолинам свойствам стимулировать синтез различных стрессовых белков, активность генома и метаболизм растений. Повышение морозоустойчивости озимой пшеницы и ячменя, обработанных картолином, достигается за счет возрастания отношения сухой массы к сырой, количества связанной в клетках воды к свободной, а также накопления углеводов и водорастворимых белков. Это указывает на интенсификацию биосинтетических процессов, вследствие которой задерживается рост клеток растяжением, а следовательно, их вакуолизация, растет объем цитоплазмы, поддерживается структурная и пространственная организация, позволяющая тканям переносить сильное промораживание.
Активизация метаболизма отмечается и при развитии засухоустойчивости у обработанных картолином растений. Она является' результатом стимулирования в клетках, испытывающих водный дефицит, РНК-полимеразной активности, ускорения синтеза белков и повышения температурного порога их денатурации, предотвращения распада полисом, стабилизации мембранной системы хлоропластов, обеспечивающей поддержание биосинтеза хлорофилла и его фотохимической активности.
Другой возможностью повысить устойчивость растений к стрессовым воздействиям является применение адаптогенов. В нашей стране разрешены для промышленного применения два представителя данного класса препаратов – кремнийорганические соединения – мивал и крезацин. Это экологически безвредные препараты, обладающие широким спектром действия.
Адаптогенное действие данных препаратов связано с их способностью в стрессовых условиях стабилизировать клеточные мембраны, причем их действие проявляется как на растительных организмах, так и на животных. При повышении температуры до 40–45 °С снижается степень упорядоченности мембранных липидов, а следовательно, нарушается один из основных биологических процессов – избирательное проникновение веществ через мембраны, резко активируется окисление липидов мембран пероксидами, образующимися в аэробной стадии дыхания.
Мивал в растительной клетке метаболизируется на два основных структурных компонента – триэтаноламин и хлорметилполисилоксан. Фундаментальное свойство полисилоксанов – гидрофобизация смачиваемых поверхностей. Именно это и определяет тот факт, что под действием мивала упрочняются белково-липидные связи и усиливается структурная целостность мембран. Положительное действие мивала прослеживается на все мембраны клетки, однако особенно благоприятно он действует на мембрану хлоропласта, что обеспечивает большую продуктивность фотосинтеза при повышенной температуре и общую прибавку массы растения.
Крезацин стимулирует образование витамина Е в растении (в животном организме кроме того и витамина А) – основных компонентов антиоксидантного комплекса. Витамин Е (токоферол) ингибирует перекисное окисление липидов мембран.
Усиление антиоксидантных свойств клеток может приводить к синхронизации клеточной популяции в G1-периоде клеточного цикла, в котором клетки наиболее устойчивы также к низким температурам, и, следовательно, крезацин способен выступать как криопротектор.
Антиоксидантное действие крезацина стимулирует генеративное развитие как животных, так и растений, что подтверждают многие исследователи. В частности, урожай зерновых культур и картофеля повышался в опытах под действием крезацина на 40–60 %.
Фиторегуляторы в системе защиты растений. Возможность использования фиторегуляторов в борьбе с вредителями и болезнями сельскохозяйственных растений была показана уже на рубеже 40–50-х годов, однако только сейчас, с развитием современных представлений о гуляторных взаимоотношениях между патогеном или вредителем, с одной стороны, и растением-хозяином, с другой, появляется реальная возможность эффективно и направленно использовать фиторегуляторы в системе защиты растений.
Вредители и возбудители заболеваний оказывают регуляторное действие на растение-хозяина, создавая тем самым для себя благоприятные условия.
Очень многие паразитические организмы синтезируют аналоги цитокининов, обогащают ими зараженные клетки и тем самым обеспечивают приток к месту своего развития питательных веществ из других частей растения. Например, повышенным содержанием цитокининов отличаются участки развития грибной инфекции на листьях, в результате чего эти участки остаются «зелеными островками» на пожелтевших листьях, из которых они оттягивают питательные вещества. Такие же «зеленые островки» образуют на листьях растений личинки насекомых, которые впрыскивают в клетки листа из слюнных желез цитокинины. Паразитическое растение повилика (Cuscuta reflexa) также обладает высоким содержанием цитокининов, которые, по-видимому, помогают ей получать питательные вещества из клеток растения-хозяина.
В ряде исследований, проведенных в последние годы, показано, что насекомые нуждаются для своего развития в некоторых гормонах растений, которые в организме насекомого превращаются в их собственные регуляторные вещества. Впервые это было показано на пустынной саранче, требующей для нормального полового созревания гиббереллин ГКз, в норме поступающий с кормом. Другой фитогормон, брассинолид, ускоряет время наступления линьки насекомых, что, по-видимому, связано со схожестью химического строения брассиностероидов и экдизона. Сходным строением обладают абсцизовая кислота с ювенильным гормоном насекомых и триспоровой кислотой – гормоном полового развития низших грибов.
Необходимость получения гормонов растений с пищей для нормального развития вредителей обратили внимание исследователей на необходимость применения данных или близких по строению веществ как нового поколения инсектицидов. При использовании этих препаратов снижение численности насекомых или сокращение вызываемых ими повреждений может достигаться не за счет блокирования какого-либо необходимого звена метаболизма, а за счет изменения времени наступления метаморфоза или влияния на половое созревание.
В ходе эволюции растения выработали собственную систему защиты от патогенов и вредителей. Сигнальным и регуляторным центром этой системы является фитогормон этилен. Биосинтез этилена резко усиливается под действием повреждений, вызываемых вредителем или патогеном. Свойство автокатализа синтеза этилена приводит к тому, что концентрация этого фитогормона повышается не только в зоне поражения, но и во всем растении. При этом может наблюдаться и аллелопатический эффект этилена, обусловленный его способностью диффундировать из растения и разноситься ветром, увеличивая, вследствие автокатализа, уровень данного гормона в растениях, находящихся в зоне его распространения.
Повышение уровня этилена в растении стимулирует образование фитоалексинов (веществ, выполняющих роль антибиотиков у растений), повышает активность хитиназы (фермента, разрушающего хитин пищеварительного тракта насекомых или хитиноподобное вещество, из которого состоят стенки гифов патогенных грибов, после чего их протопласты лизируюгся ферментами растительной клетки), стимулирует синтез другого фитогормона – абсцизовой кислоты, затормаживающей процессы роста и деления клеток и стимулирующей синтез стрессовых белков. У некоторых растений этилен увеличивает содержание фенольных веществ, вредных для многих животных и ингибирующих рост растений.
Защитное действие этилена успешно применяется для сокращения потерь от болезней при хранении некоторых видов продукции растениеводства: картофеля, луковичных культур, корнеплодов. Обработку с этой целью проводят методом замачивания или опрыскивания продукции растворами этиленпродуцентов перед закладкой на хранение. Проведенные в МСХА им. К.А. Тимирязева исследования показали, что такой же эффект при хранении картофеля оказывает обработка вегетирующих растений в фазе бутонизации и клубней брассиностероидами, что связано с повышением интенсивности образования фитоалексинов.
При испытании регуляторов роста и развития растений исследователи часто отмечали, наряду с собственно регуляторным ростовым или формативным эффектом препаратов, также и повышение устойчивости растений к вредоносным организмам. Это может быть обусловлено следующими причинами:
1) препарат, помимо регуляторного действия, является токсином для какого-либо паразита. Таким свойством в отношении мучнистой росы и парши яблони и груши обладает ретардант паклобутразол (культар);
2) улучшение каких-либо морфологических показателей и общего состояния растения под действием фиторегулятора делает его менее уязвимым для атаки вредителями и болезнями. Например, предотвращение полегания растений пшеницы, некоторое утолщение листа и более глубокое заложение узла кущения значительно снижает повреждение грибными заболеваниями при применении хлорхолинхлорида;
3) неблагоприятное для паразита изменение под влиянием фиторегулятора метаболизма растения-хозяина;
4) изменение фазы развития растения-хозяина относительно фазы паразита, что обеспечивает сокращение периода питания, а следовательно, и снижение вредоносного действия (как правило, подобный эффект отмечается при ускорении развития культурного растения за счет стимулирования всхожести семян и ранних этапов роста проростка).
В целом, изучение и применение регуляторов роста и развития сельскохозяйственных растений в системе защиты их от болезней и вредителей находится в самом начале своего развития, но несомненно, что в самом близком будущем позволит значительно сократить потери растениеводческой продукции.
Физиологический
Интенсификация фотосинтетической деятельности растений в посевах
Фотосинтез – это процесс поглощения и трансформации энергии света в химический потенциал богатых энергией органических соединений в виде углеводов, жиров, белков. Из определения следует, что в практических целях важно повышать КПД использования солнечной энергии растениями. Для решения этой задачи важное значение имеет создание трансгенных растений, обладающих «сильными» хлоропластами, с «мощными» реакционными центрами. Примером могут быть С4-растения, более «сильные» растения эволюционно приспособленные к новым условиям.
А. Ничипорович (1982) разработал количественную теорию фотосинтетической продуктивности растений, основанную на оптимизации размеров листовой поверхности, радиационного режима, аэрации, минерального питания, водообмена и других факторов. Показано, что даже в современных условиях ведения земледелия можно увеличить коэффициент использования физиологически активной радиации (ФАР) от 0,5–1 до 3–5 %.
Голландский ученый Ван Нильв 1937–1941 гг. высказал предположение, что первичная фотохимическая реакция фотосинтеза состоит в диссоциации воды, а не в разложении СО2, как предполагалось ранее (В.В. Полевой, 1989). Так как весь кислород фотосинтеза выделяется из воды, общее уравнение фотосинтеза имеет вид:
6СО2 + 12Н2О + свет → С6Н12О6 + 6Н2О + 6О2
Из этого уравнения можно рассчитать максимальный теоретически возможный КПД ФАР. На усвоение одной молекулы СО2 в процессе фотосинтеза требуется порядка 8–10 квантов света. Энергия поглощенных 10 моль квантов ФАР в среднем равна 500 ккал, а на усвоение одной грамм-молекулы СО2 используется 112 ккал, что составляет 22,4 % поглощенной энергии. На дыхание растения затрачивают 20–30 % запасенной энергии. Таким образом, теоретически возможный максимальный КПД поглощенной ФАР может быть равен 16,8 % (А.А. Ничипорович, 1978).
Поданным наших опытов, за период вегетации многолетние травы и уплотненные посевы однолетних культур при оптимальных температурных условиях, влажности и питании могут усвоить 55–60 % приходящей ФАР. Коэффициент полезного действия ФАР в таком случае составляет 9–10 %. Из этого количества усвоенной ФАР у многолетних трав в среднем 55% аккумулируется в урожае, 30–35 % – в корнях и пожнивных остатках, 5–10 % затрачивается на корневые выделения, отмирания корней и листьев, азотфиксацию у бобовых культур; у кукурузы в урожае аккумулируется около 65 % усвоенной ФАР. Следовательно, КПД приходящей ФАР для многолетних трав и уплотненных посевов однолетних культур равен в среднем 5 %, для кукурузы около 6 % (В.М. Ковалев, 1995).
Среди факторов, оказывающих большое влияние на КПД фотосинтеза, одним из решающих является аттрация продуктов фотосинтеза органами растений, выраженная во временных характеристиках ростовой функции.
На рис. 10.3 приведены наши результаты исследований суточного хода роста, фотосинтеза и дыхания у озимой пшеницы (B.C. Шевелуха, В.М. Ковалев, 1973). Наблюдается тесная корреляция суточной периодичности роста с суточной динамикой интенсивности дыхания растений (r = 0,92 ± 0,14), а между интенсивностью роста и фотосинтеза отсутствует постоянная временная связь (r = 0,105 ± 0,37). С повышением температуры в утренние часы процессы роста и дыхания усиливаются и достигают максимума соответственно в 14 и 16 ч. Наибольшая относительная интенсивность наблюдаемого фотосинтеза отмечалась в данном опыте в утренние (10) и вечерние (18) часы, а в дневное время имела место его депрессия. Однако при сравнении показателей роста и фотосинтеза за достаточно продолжительные промежутки времени (3–5 сут и более) проявлялась между ними довольно четкая корреляция.
Рис. 10.3. Суточная динамика интенсивности фотосинтеза, дыхания и роста у озимой пшеницы
на IV этапе органогенеза (сорт Мироновская 808):
1 – интенсивность фотосинтеза, Ф, 2– интенсивность дыхания. Л, 3 – линейная скорость роста растений, V;
4 – температура воздуха, t, 5 – относительная влажность воздуха, W; 6 – продолжительность солнечного сияния, R
Дневная депрессия фотосинтеза обусловлена нарушением деятельности фотосинтетического аппарата и оттока ассимилятов при перегреве, поскольку температура листа в этот период может превышать температуру воздуха на 5–10 °С. Если потери воды в тканях велики и наблюдается усиление фотодыхания, то устьица в это время закрываются (В.В. Полевой, 1989). Засухоустойчивые формы сельскохозяйственных растений характеризуются менее выраженной депрессией в полуденные часы и соответственно более плавным ходом суточной кривой фотосинтеза. Установлено, что в условиях достаточного увлажнения засухоустойчивые виды растений по интенсивности фотосинтеза уступают неустойчивым. Однако у последних при выращивании в районах с умеренным климатом в случае наступления засухи показатели этого процесса в 1,5–2 раза ниже, чем у растений, менее чувствительных к недостатку воды (Б.А. Рубин, 1979).
Выравненность суточного хода важнейших физиологических процессов характерна для более пластичных и продуктивных сортов, способных в диапазоне значений каждого фактора внешних условий обеспечивать устойчивую продуктивность растений. Так, показано, что продуктивные сорта зерновых культур в отличие от менее продуктивных характеризуются более равномерным суточным ходом ростовых процессов. Они имеют более высокие значения индекса равномерности суточного хода скорости роста, который представляет собой отношение минимальных (ночных) к максимальным (дневным) приростам. Коэффициент корреляции межцу индексом равномерности суточного хода скорости линейного роста и продуктивностью сортов пшеницы, ячменя, овса, ржи составляет в среднем 0,75 и выше в зависимости от погодных и других условий (B.C. Шевелуха, В.М.Ковалев, 1988).
Установлены существенные видовые и сортовые различия по интенсивности газообмена. В табл. 10.1 приведены обобщенные количественные и качественные характеристики фотосинтетической продуктивности С3- и С4-растений. Скорость фотосинтеза различных видов растений в значительной мере зависит от большого числа внешних факторов, среди которых наиболее важными являются: свет (интенсивность и спектральный состав), температура, концентрация СО2 и О2, водный режим, минеральное питание, а также внутренних особенностей – возраста, содержания хлорофилла и ферментов, количества воды в листе, структуры листа, степени открытости устьиц и т. д.
Таблица 10.1. Количественные и качественны характеристики
фотосинтетической продуктивности С3- и С4-растений

В литературе приводятся данные, свидетельствующие о возможности повышения активности первичных реакций фотосинтеза физиологически активными веществами, относящимися к группе цитокининов, гиббереллинов и ауксинов (Н.И.Якушина с сотр. 1971, 1982).
В наших опытах опрыскивание растений в период бутонизации клевера цитокининоподобным препаратом картолин 2 существенно повышало активность первичных реакций фотосинтеза и других физиологических процессов: заметно возрастала интенсивность фотосинтетического фосфорилирования и фотохимическая активность в хлоропластах, в 1,5–2 раза повышалась азотфиксирующая способность клубеньков и аттрагирующая активность соцветий. При этом отмечено увеличение числа семян в головке, количества зрелых головок, а сбор семян повышался на 12,5–13,0 %(В.М. Ковалев, 1995).
Как отмечает А.Т. Мокроносов (1988), на протяжении столетий до последнего времени практическая селекция обеспечивала выведение все более продуктивных сортов растений, основываясь на экстенсивном типе продукционного процесса. Иными словами, создавались сорта, позволяющие разместить все большее количество фотосинтезирующих единиц (хлоропластов, площади листьев) в единице объема и площади посева при максимально возможной продолжительности активного фотосинтеза. Эти сорта отличались способностью формировать в фитоценозе высокий ассимиляционный потенциал (м2 сут), но их фотосинтетический аппарат, его активность почти не затрагивались и сохранялись на уровне, близком к фотосинтезу исходных форм.
Однако положительная взаимосвязь между фотосинтетической продуктивностью и площадью листовой поверхности ограничивается определенными размерами последней. Например, у зерновых культур этот показатель равен 4 –5 м2/м2 посева, у сортов с улучшенной формой листьев и оптимальным распределением их в пространстве при достаточном уровне питания – 6–7 м2/м2 (А.А. Ничипорович, 1982; В .А. Кумаков, 1980; И.С. Шатилов, А.Г. Замараев, Г.В. Чаповская, 1988). Дальнейшее увеличение фотосинтетического аппарата на единице площади ограничивается прежде всего в обеспечении листьев ФАР.
Сорта с повышенной продуктивностью фотосинтеза способны более эффективно использовать солнечную энергию, элементы питания, воду и формировать высокий урожай при относительно небольшой площади листьев, что снижает опасность полегания посевов. Показано, что у современных сортов зерновых культур с уменьшением высоты стебля и фотосинтезирующей поверхности листьев усиливается перемещение продуктов фотосинтеза в генеративные органы. Это способствует лучшему питанию цветков, увеличению процента оплодотворения и завязывания семян и росту продуктивности колоса.
Со времени открытия С4-метаболизма и факта практического отсутствия у С4-видов фотодыхания при хороших условиях роста существенный интерес вызвала перспектива включения такого метаболизма или хотя бы части его в важные сельскохозяйственные культуры с С3-метаболизмом (С3-типа). По расчетам исследователей, повышение продуктивности фотосинтеза у зерновых умеренной климатической зоны до уровня наиболее продуктивных тропических и субтропических культур (тип фотосинтеза С4) позволило бы поднять их физиологический потенциал до 150–200 ц/га зерна (Austin, 1982).
Характер фотосинтеза – генетически детерминированный признак. Тот факт, что С4-тип фотосинтеза широко распространен и часто варьирует по проявлению внутри одного и того же таксона, свидетельствует о том, что генетическими или селекционными методами его можно передать в системы, где он отсутствует. В США, Японии, Канаде, Австралии и других странах ведется детальное изучение биохимической и генетической сущности фотосинтеза См4-типа, с тем чтобы с помощью метода рекомбинантной ДНК повысить его продуктивность в первую очередь у зерновых культур (Bodde, 1982).
Как показали многочисленные исследования, большинство фотосинтетических показателей полигенны и поддаются селекционному улучшению наряду с традиционно селектируемыми признаками (Ю.С. Насыров, 1982; 1986; М. Джиффорд, Л.Д. Дженкинс, 1987; Быков, Зеленский, 1987; Зеленский, 1995). Установлены статистически достоверные сортовые различия по фотосинтетической активности (интенсивность ассимиляции СО2, содержание хлорофилла, площадь флагового листа зерновых, фотовосстанавливающая и кислородовыделяющая активность хлоропластов, чистая продуктивность фотосинтеза) у пшеницы, ячменя, овса, кукурузы, сои, вики и др. Показан широкий размах изменчивости по этим признакам и выделены лучшие образцы, характеристики которых стабильно превосходили средний уровень на 30–60 %. Поэтому поиск форм с высокой фотосинтетической активностью и вовлечение их в селекционный процесс, по мнению ряда авторов (А.А. Ничипорович, 1972; В.А. Кумаков, 1980; Образцов, 1981 и др.), является важнейшей задачей исследования.
Активность ферментов, принимающих участие в ассимиляции СО2, является одним из важнейших факторов интенсивности фотосинтеза и может служить селекционным признаком для отбора генотипов на продуктивность и качество. Изменение активности ключевых карбоксилирующих ферментов фотосинтеза – РДФК в цикле Кальвина и ФЕП-карбоксилазы в цикле Хетча–Слэка является одним из важнейших механизмов регуляции фотосинтеза растений (Доман, 1972; Андреева, 1974). Установлено, что не только интенсивность фотосинтеза зависит от количества и активности карбоксилируюшего фермента, но и сам фотосинтез контролирует его уровень в ткани (Б.А. Рубин, 1977).
Ю.С. Насыровым (1986) предложена модель генетической модификации реакций карбоксилирования и активации транспорта углерода в клетках для повышения эффективности фотосинтеза С3-растений. В основу этой модели положены представления о том, что в цитоплазме С3-растений имеются ферменты ФЕП-системы, но их активность в несколько раз ниже, чем у С4-растений. Путем экспериментального мутагенеза, с последующим генетическим отбором мутантов и «разложением» генотипа гибридов в жестких условиях (хлоридный солевой стресс) выделены формы сахарной свеклы и хлопчатника с высокой активностью ФЕП-системы, включающие механизмы регенерации акцептора СО2 через ФЕП-карбоксилазу или пируватдикиназу. Эта система, по-видимому, служит дополнительным каналом цитоплазматического связывания и переноса СО2 в хлоропласты, ограничивает оксигеназную функцию РДФ-карбоксилазы – оксигеназы и обеспечивает реассимиляцию СО2 фотодыхания.
У отобранных форм сахарной свеклы и хлопчатника была выше активность фотосинтетического аппарата и ниже фотодыхание. Полученная форма сахарной свеклы имела большую массу корнеплода и повышенную сахаристость корня (на 0,8 %). Формы хлопчатника ИФ и БР-1, БР-2 по качеству волокна относились к IV и V типам соответственно, превосходили контрольные растения по урожайности на 10–15 %, а созревание их ускорялось на 5–7 дней.
Важным аспектом проблемы отбора по признаку активности фотосинтеза является влияние на этот процесс интенсивности роста, т. е. лимитирование фотосинтеза аттрагирующими центрами (А-А. Ничипорович, 1988; А.Т. Мокроносов, 1987; М.Джиффорд, Л.Д. Дженкинс, 1987; М.И. Зеленский, 1995 и др.). Бесполезно повышать интенсивность фотосинтеза, если активные потребители ассимилятов (аттрагирующие органы) не соответствуют увеличенному потоку ассимилятов. Поэтому предварительным условием отбора желательных форм растений на повышенную интенсивность фотосинтеза является наличие сильного лимитирования аттрагирующих органов продуктами фотосинтеза.
Селекционно-технологический
Достижения в области химии, генетики, физиологии растений и других фундаментальных наук в последние десятилетия явились базой для создания в экономически развитых странах широкого спектра химических удобрений, пестицидов, регуляторов роста, новых сортов. Это и послужило основой интенсификации производства, особенно в последние 25–30 лет (Wittwer, 1979). Однако повышение урожайности в 2–3 раза в США и странах Западной Европы сопровождалось ростом затрат невосполнимой энергии (на удобрения, пестициды, орошение, технику) в 10–15 раз и более (Pimentel, 1981). Наиболее затратным фактором в техногенной интенсификации растениеводства явилось азотное удобрение, на долю которого приходится до 1/3 расхода энергии, получаемой из ископаемого топлива. Второе место занимает орошение – до 20 % используемой энергии. На долю пестицидов приходится примерно 5 % в общем балансе расходуемой энергии. Кроме того, возникающие энергетические противоречия преимущественно техногенной интенсификации растениеводства обострились его экологической безопасностью.
В настоящее время общепризнанным является необходимость перехода к так называемой «биологизации» технологий, т. е. максимального согласования их с биологическими требованиями культуры, к стратегии адаптивной интенсификации растениеводства, предусматривающей более дифференцированное и комплексное использование генетических, природных ресурсов и техногенных факторов для обеспечения устойчивого роста продуктивности, ресурсосбережения и экологической безопасности (Th. US Drummond, 1975; S.H. Wittwer, 1979; С.Б. Маркарьян, 1987; A.A. Жученко, 1989, 1990).
Такой подход предполагает оптимизацию генетических параметров растений, повышение их устойчивости к абиотическим и биотическим стрессам (засолению и повышенной кислотности почв, высоким и низким температурам, вредным организмам и др.). При этом, чем менее благоприятны почвенно-климатические и погодные условия, тем роль биологических факторов должна повышаться. Применение техногенных факторов (удобрений, пестицидов, регуляторов роста, орошения и др.) не заменяет, а лишь дополняет интенсификационные процессы в растениеводстве, базирующиеся на селекционном улучшении выращиваемых растений, их оптимальном агроэкологическом районировании, конструировании продуктивных и устойчивых агроэкосисгем.
Селекция растений на повышение
продуктивности и устойчивости к стрессам
В 50–60-е годы XX столетия достижения биологической и сельскохозяйственной науки обеспечили в экономически развитых странах увеличение урожайности зерновых культур в 2–3 раза и более.
При этом в среднем треть прироста урожайности была получена за счет внедрения короткостебельных сортов, повышения устойчивости растений к болезням и вредителям, отзывчивости на факторы интенсификации земледелия (В.М. Ковалев, 2003).
В развивающихся странах (Индия, Мексика) быстрый рост урожайности зерновых в 60–70-х годах связывают с сортосменой. В экономически развитых странах, где темпы роста урожайности в этот период были не менее значительными, а абсолютные приросты – намного выше (табл. 10.2), ведущая роль в увеличении производства зерна отводилась интенсификации земледелия, которая требовала создания более отзывчивых на данные факторы сортов. Так, в ФРГ в период с 1952 по 1975 гг. ежегодный прирост урожайности озимой пшеницы составил 92 кг/га, в том числе 62 % обусловило совершенствование технологии и 38 % – внедрение новых сортов; яровой пшеницы – соответственно 82 кг/га, 68 и 32 %; озимого ячменя – 93 кг/га, 81 и 19 %; ярового ячменя – 59 кг/га, 49 и 51 %; овса – 58 кг/га, 59 и 41 %; кукурузы на зерно – 196 кг/га, 65 и 34 %; озимой ржи – 62 кг/га, 13 и 87 % (Schuster, 1978).
Таблица 10.2. Среднегодовые приросты урожайности зерновых культур в мире
и некоторых зернопроизводящих странах с 1948 по 1988 it. (по данным ФАО)
По данным Национального института агроботаники Великобритании, до 1957 г. основную роль в росте урожайности зерновых в стране играли гербициды и удобрения, в последующее десятилетие – повышение норм азота при возделывании новых, устойчивых к полеганию сортов, после 1967 г.– сортосмена. Удельный вес селекции в приросте урожайности пшеницы по этим периодам составлял соответственно 38,42 и 60 % (Silvey, 1978). Созданные в Великобритании в 70–80-е годы короткостебельные высокопродуктивные сорта озимой пшеницы позволили полностью обновить сортимент культуры. Потенциал продуктивности современных сортов английской селекции достиг 140 ц/га. Они толерантны к повышению уровня азотного питания, высокой плотности стеблестоя и практически не нуждаются в применении ретардантов.
Уборочный индекс английских пшениц (0,6) приблизился, по мнению специалистов, к максимально возможному (Austin, 1982).
В США наиболее резкое повышение продуктивности зерновых наблюдалось в 50–70-е годы в результате изменения структуры посевов в пользу более урожайных культур, сортосмены, использования лучших семян, широкого применения удобрений, пестицидов и орошения, совершенствования сельскохозяйственной техники (Heady, Auer, 1966; Smith, 1985).
В бывшем СССР наибольшие среднегодовые приросты урожайности зерновых культур наблюдались в 60-х и 80-х годах, соответственно, 0,59 и 0,55 ц/га (табл. 10.2). В 60-х и примерно до середины 70-х годов прогресс в селекции зерновых соответствовал возросшему уровню интенсификации и культуры земледелия. С появлением сортов полуинтенсивного типа – пшеницы Мироновская 808, Безостая 1, ячменя Московский 121, ржи Восход 1 и Восход 2 и др., существенно возросли в стране урожайность и валовые сборы зерна. Однако в дальнейшем это равновесие было нарушено. Быстрые успехи селекции в создании высокопродуктивных короткостебельных сортов интенсивного типа, требовавших высокого агрофона и дифференцированной агротехники, максимально точного учета биологии сорта и растений, не сопровождались соответствующим прогрессом земледелия в производственных условиях. В результате сорта, обеспечивающие весомые прибавки урожая в условиях высокой культуры земледелия на этапах их создания и сортоиспытания, в производстве резко снизили урожайность. С другой стороны, адаптивные свойства интенсивных сортов часто не отвечали экологическим условиям возделывания. Например, повсеместная замена в конце 70-х – начале 80-х годов в Нечерноземной зоне России сорта ячменя Московский 121 на высокопродуктивные, более устойчивые к полеганию сорта зарубежной селекции (Надя, Эльгина, Дворан и др.) на 80 % площадей посева не дали должной отдачи из-за несоответствия культуры поля требованиям этих сортов и их биологии в более экстремальных условиях Нечерноземья (Неттевич, 1986).
Повышение среднегодовых приростов урожайности зерновых в 80-х годах обусловлено широкомасштабным применением в этот период интенсивных технологий их возделывания, связанных с резким увеличением уровня техногенных факторов. Однако, как показал опыт освоения интенсивных технологий за ряд лет, их отдача в целом по стране оказалась намного ниже нормативной. Тормозом на пути технологического обновления производства во многих случаях стали недостаточно устойчивые к стрессовым факторам среды сорта и гибриды сельскохозяйственных культур. В решении этой проблемы большое значение имеют методы биотехнологии и биоинженерии.
10.2. МОНИТОРИНГ ПРОДУКЦИОННОГО ПРОЦЕССА
Продукционный процесс следует рассматривать как сумму и взаимодействие между собой одновременно протекающих в растении физиологических, биохимических, биофизических и других процессов, обеспечивающих формирование хозяйственно-ценных органов растения и продуктов вторичного обмена путем оптимизации и координации этих процессов на основе генетической, гормональной детерминации и донорно-акцепторных отношений.
Для принятия необходимых мер в ходе формирования урожая требуется диагностика состояния посевов. Этой цели служит биологический контроль – система мониторинга показателей биологических процессов у растений в онтогенезе, коррелирующих с ходом формирования урожая посевами в конкретных условиях выращивания.
С целью получения непрерывной информации о ходе продукционного процесса у растений разрабатываются и применяются методы автоматической прижизненной регистрации важнейших его показателей: фотосинтеза (А.Т. Мокроносов, 1988), роста (B.C. Шевелуха, 1992), проводится диагностика минерального питания растений в онтогенезе (Церлинг, 1990) и др.
На основании полученной информации принимаются решения о необходимости применения соответствующих технологических и других приемов (орошение, удобрение, регуляторы роста, средства защиты растений и т. п.) для управления продукционным процессом у растений, ходом формирования урожая и его качеством.
С позиций комплексного подхода растительный организм представляет собой открытую, неравновесную, саморегулирующуюся и саморазвивающуюся систему, способную к самовоспроизведению. Его целостность обеспечивается генетической детерминацией и функционированием гормональной, трофической, электрофизиологической и других систем регуляции. Усиливая или ослабляя рост, развитие и другие процессы, эти системы во взаимодействии с факторами внешней среды и приемами агротехники определяют тип морфогенеза, структуру, продуктивность, качество и адаптацию растений.

