Геном эукариотических клеток устроен значительно сложнее, чем у прокариот, что определяется большим объемом информации, необходимой для нормальной жизнедеятельности многоклеточного организма, состоящего из специализированных клеток, органов, тканей. Поэтому в ходе эволюции по мере усложнения клетки как правило возрастает масса ДНК в хромосомах и становится более сложной вся система управления и регуляции экспрессией генов.
Гены и геном эукариотических клеток в целом экспрессируются через генетические и биохимические процессы.
В хроматине ядра ДНК связаны с комплексами основных белков (гистонов), а также с негистоновыми белками, РНК и небольшим количеством липидов. Гистоны и двойная спираль ДНК вместе представляют собой правильную структуру, состоящую из нуклеосом и участков молекулы ДНК между ними. Нуклеосома – это комплекс из восьми молекул гистоновых белков, на который «нанизаны» петли ДНК из 140...200 пар нуклеотидов. В составе нуклеосом ДНК менее доступна действию эндонуклеаз, которые легче расщепляют ДНК, занимающие междунуклеосомные участки.
Почти все гены (цистроны) эукариот, кодирующие функционально связанные белки, находятся на разных участках хромосом. Исключение составляют только гистоновые гены и гены рРНК. Напротив, у прокариот все гены объединены в опероны.
Почти все молекулы РНК синтезируются в виде более высокомолекулярных предшественников (проРНК). После синтеза первичного транскрипта происходит его процессинг (созревание), включающий в себя кэпирование, метилирование, полиаденилирование, фрагментацию и сплайсинг. Полупериод жизни большинства молекул мРНК эукариот составляет 3–48 ч.
Как правило, в ДНК эукариот наряду с уникальной последовательностью нуклеотидов обнаруживается огромное количество повторов, т. е. повторяющихся последовательностей. В большинстве геномов растений число уникальных участков в геноме составляет всего 20–30 %. Ученые считают, что повторы также важны с биохимической точки зрения, так как они необходимы для регуляции экспрессии генов.
11.2. БИОХИМИЧЕСКИЕ И БИОТЕХНОЛОГИЧЕСКИЕ
ПРОЦЕССЫ В АЗОТНОМ И БЕЛКОВОМ ОБМЕНАХ У РАСТЕНИЙ
Первичным источником белка на нашей планете являются растительные организмы с их замечательной способностью синтезировать белок из углекислоты, воды и неорганических источников азота. Поэтому понятно, какое большое теоретическое значение имеет исследование генетических и биохимических механизмов процессов, лежащих в основе усвоения азота растениями и его превращений в аминокислоты и белки. Ассимиляция нитрата у большинства культур – это основной способ превращения неорганического азота в органические соединения. При этом нитрат превращается в аммоний за счет действия механизма поглощения нитрата и двух ферментов: нитратредуктазы (HP) и нитритредуктазы (НИР). Таким образом, азот становится доступным для многих биосинтетических процессов, наиболее важным из которых с количественной точки зрения является синтез белка. Известно, что в регуляции процессов на этом пути определенную роль играют доступность нитрата и гормонов, свет и конечные продукты реакции. Данные физиологических и биохимических исследований, однако, почти не раскрывают молекулярные механизмы, лежащие в основе развития и регуляции реакций, входящих в этот процесс. Такая информация очень важна, если ученые стремятся понять, каким образом новые методы молекулярной биологии могут быть использованы для повышения эффективности ассимиляции нитрата и, следовательно, повышения содержания белка в растениях.
За последние 10–15 лет в изучении генетики ассимиляции нитрата достигнут значительный прогресс, поэтому этот процесс – наиболее подробно охарактеризованный путь метаболизма высших растений. Генетические исследования представляют собой первый важный шаг в изучении данного метаболического пути на молекулярном уровне.
Кодирование белков HP и НИР
Среди двух ключевых ферментов ассимиляции нитратов HP и НИР последняя изучена лучше с точки зрения генетического контроля ее биосинтеза. Среди высших растений лучше всего охарактеризована НИР шпината, имеющая один четырехядерный кластер, содержащий железо и серу (Fe4S4), и один сирогем на каждую пептидную цепь с молекулярной массой 60 000. Сирогем представляет собой диметилуротетрагидропорфирин изобактериохлоринового типа. Сейчас известны некоторые характеристики, касающиеся кодирования белка НИР. Например, НИР овса кодируется ядром, НИР пшеницы с молекулярной массой 60 500 синтезируется на рибосомах цитоплазмы в виде предшественника с молекулярной массой 64 000. Известно, что ряд других локализованных в хлоропластах белков синтезируется в цитоплазме в виде продуктов с более высокой молекулярной массой, а затем переносится в хлоропласты, где происходит их процессинг с образованием зрелой формы.
Исследователи считают, что отбирать HP-дефицитные или HP-минус мутанты на уровне культуры клеток – дело трудное. Недостатком отбора мутантов в культуре клеток является то, что не всегда удается регенерировать целые фертильные растения. Это мешает изучению мутаций при помощи обычного генетического анализа. Известно, что наиболее убедительным доказательством того, что мутация действительно произошла, служит возможность регенерации фертильных растений из клеточных линий и передачи признаков полученного варианта потомству от половых скрещиваний. Пока это не будет сделано, полученные изоляты можно описывать как «фенотипические варианты» или «клеточные линии», а не как мутанты. Невозможность регенерации мутантов препятствует изучению физиологии и биохимии интактного растения и ограничивает их ценность для соматической гибридизации и трансформации растений.
Биосинтез аминокислот
Исходными веществами для синтеза аминокислот являются органические кислоты и аммиак, которые поступают из почвы, атмосферы в результате распада белков или же образуются в цепи редукции нитратов.
Аминокислоты – основные структурные единицы, из которых построены молекулы всех белковых веществ. Это производные кислоты жирного или ароматического рядов, содержащие одновременно аминогруппу NH2 и карбоксильную группу–СООН
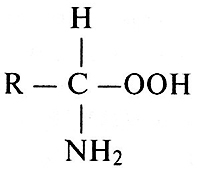
Аминогруппа может быть расположена в α-,β- и у-положениях по отношению к карбоксилу. Существуют разнообразные способы классификации аминокислот, основанные на различной природе R-групп. Этот способ касается «слов» генетического кода, который соответствует определенным аминокислотам, встречающимся в белках. Обычно аминокислоты обозначают трехбуквенными символами. Недавно была принята однобуквенная система, чтобы облегчить сравнение аминокислотных последовательностей в гомологичных белках. Например, написание незаменимых кислот выглядит так:
Лизин – Лиз Lys – К;
Триптофан – Три Try – W;
Гистидин – ГС His – Н;
Лейцин – Лей Leu – L;
Изолейцин – Иле lieu – I;
Треонин – Тре Thr – Т;
Метионин – Мет Met – М;
Валин – Вал Val – V.
Для каждой из 20 аминокислот имеется соответствующая аминоацил-тРНК-лигаза, которая в цитоплазме соединяет аминокислоту с тРНК (tRNA) (рис. 11.1). Процесс активации аминокислот осуществляется в две стадии.
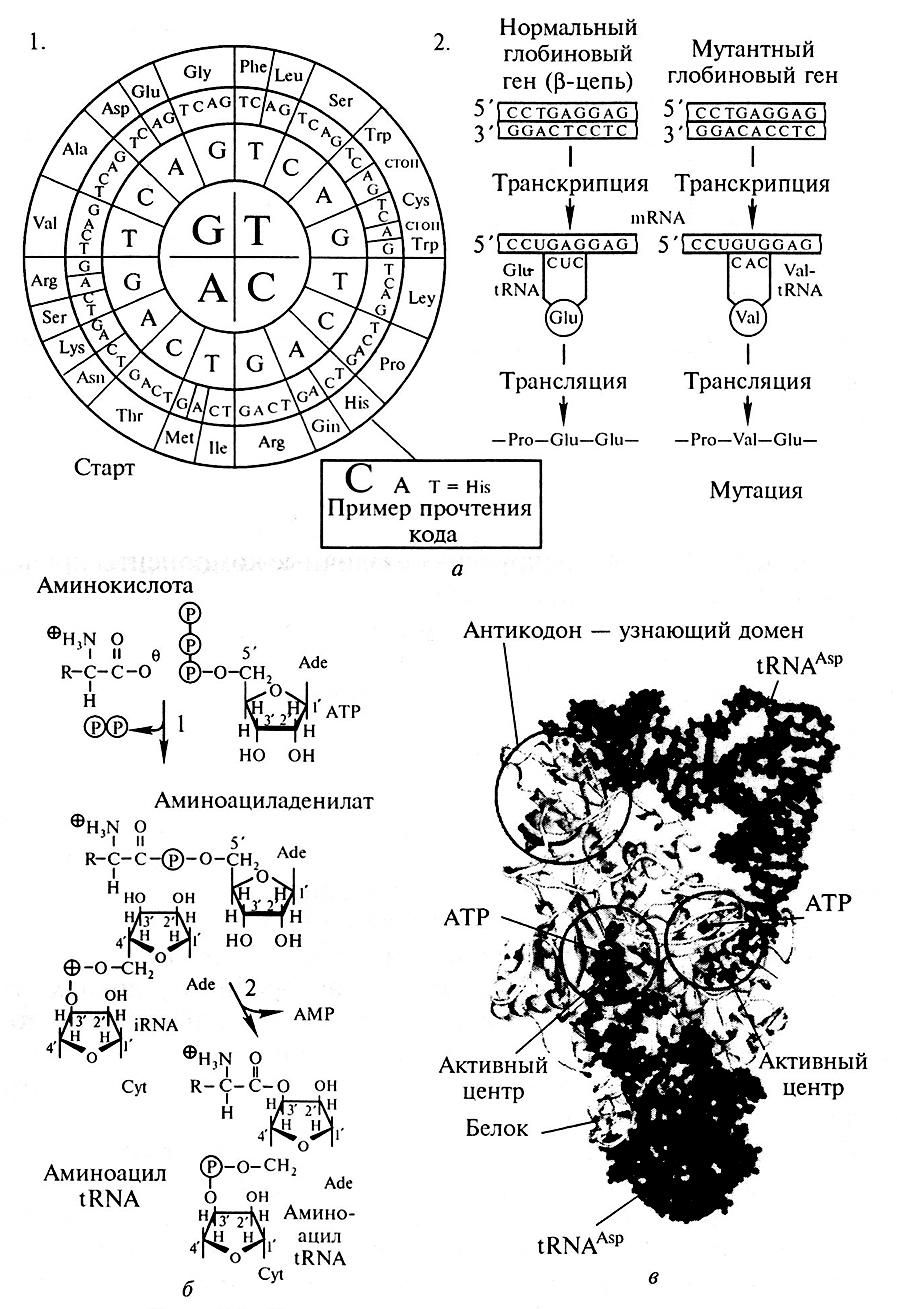
Рис. 11.1. Генетический код, активация трансляции:
а – генетический код; б– активация аминокислот; в – Asp-tRNA-лигаза (димер) (Koolman J., Rohm К.Н., 2004)Нитрогеназа
Элементы биохимической генетики азотфиксации
За последние годы достигнуты большие успехи в биохимической генетике азотфиксации. Первоначально ученые предполагали, что имеется немного генов, кодирующих нитрогеназу (nif-гены). Было установлено, что nif-гены у К. pneumoniae располагаются в хромосоме рядом с генами, кодирующими биосинтез гистидина, и если гистидиновый оперон (his) с прилегающим к нему участком ДНК перенести путем конъюгации в Е. coli, то этот последний микроб приобретает способность к фиксации азота. Было показано, что гены азотфиксации располагаются рядом с his-опероном (рис. 11.2). При дальнейших исследованиях было обнаружено, что nif-оперон устроен гораздо сложнее, чем это предполагали сначала. В настоящее время у К. pneumoniae известно по крайней мере 17 генов, кодирующих различные компоненты процесса азотфиксации (A. Dixon, 1984).
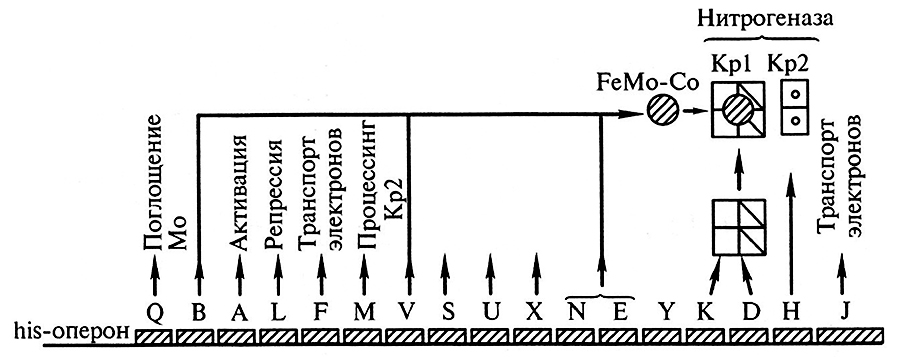
Рис. 11.2. Схема организации nif-генов з хромосоме Klebsiella pneumoniae (Denarii etal, 1981):
FeMo-co – железомолибденовый кофактор; KPI – FeMo-белок нитрогеназы Klebsiella pneumoniae; Kp2 – Fe-белок К.I. pneumoniae (no A. Dixon, 1984)
Расположение этих генов в хромосоме К. pneumoniae схематически показано на рис. 11.2: гены располагаются в один ряд, один за другим и сгруппированы они в 8 оперонах.
Ген nif-F кодирует флаводоксин, a nif-J – восстановление в анаэробном метаболизме йод действием пируват-флаводоксин-оксидоредуктазы. Три гена (nif-H, nif-D, nif-K), расположенные в одном опероне, кодируют структурные белки нитрогеназы, а гены nif-B, nif-N, nif-V кодируют кофакторы FeMo-co. От гена nif-Q зависит поглощение молибдена, необходимого для синтеза нитрогеназы. Гены nif-L и nif-A регулируют процесс транскрипции компонентов nif-oneрона. Доказано, что экспрессия nif-генов у К. pneumoniae происходит только в отсутствие ионов аммония и в анаэробных условиях, что свидетельствует о том, что переносятся не только структурные, но и регуляторные гены нитрогеназы. «Перенос» nif-генов был осуществлен не только в Е. coli, но и в Salmonella typhimurium, Pseudomonas sp., Agrobacterium tumefaciens и др.
Среди азотфиксирующих организмов ученые обнаружили существенные различия. У некоторых Rhizobium в зависимости от скорости их роста nif-гены локализованы в плазмиде с молекулярной массой от 35 000 до 300 000. Существенно различаются по своей структуре участки ДНК, кодирующие nif-гены у Rhizobium и К. pneumoniae: у К. pneumoniae участок ДНК, содержащий nif-гены, охватывает сегмент, состоящий из 24 килооснований, например, у Rh. melioti подобный участок содержит всего 14–15 килооснований, причем некоторые гены располагаются в других участках ДНК. Намечаются существенные различия и в локализации структурных генов нитрогеназы. Например, у Klebsiella, Anabaena и медленнорастущих ризобиумов структурные гены нитрогеназы находятся в хромосоме, а у быстрорастущих Rhizobium они расположены в плазмидах.
Нитрогеназа – это фермент со смешанными функциями: она катализирует не только восстановление N2 до аммиака, но и восстановление других соединений и частиц, в том числе частиц до молекулярного водорода клубеньками гороха, корневыми клубеньками сои, красного клевера. Как было показано исследованиями Г. Жизневской (1985), корневые клубеньки красного клевера с высоким содержанием фитоглобина до 68 % энергии расходовали на выделение Н2, причем этот процесс блокировался, если усиливалась азотфиксация. Ученые доказали, что гидрогеназа, сосредоточенная в бактероидах некоторых сортов сои, способна не только выделять водород, но и активно поглощать его и окислять, т. е. катализирует его рециклизацию. Такая система названа hup-гидрогеназой (hydrogen uptake).
Сейчас доказано, что главная функция Ьир-гидрогеназы заключается в предохранении нитрогеназы от повреждения кислородом.
Кроме nif- и hup-генов в клубеньках содержатся также nod-гены, от которых зависит процесс образования клубеньков и содержащихся в них специальных белков – нодулинов. Это гены растительного происхождения. Например, в клубеньках сои содержится по крайней мере три типа нодулинов:
– белки, обеспечивающие структуру клубенька,
– белки-ферменты, необходимые для ассимиляции азота,
– белки, обеспечивающие функционирование бактероидов.
К последней группе принадлежит фитоглобин, найденный в клубеньках всех бобовых растений.
Биохимический и молекулярный анализы
функций растений
В процесс образования клубеньков и азотфиксации включено большое количество генных продуктов, многие из которых выполняют в растениях «нормальные» функции и используются в иных метаболических путях развития. Другие продукты могут быть более или менее специфичными. В последние десять лет молекулярный анализ был сосредоточен на специфических белках. К нодулину можно также отнести белки, накапливающиеся в клубеньке. В настоящее время данное определение в основном относится к корням как контрольным тканям, но не всегда, потому что в некоторые симбиотические функции могут быть включены гены, которые экспрессируются только в других тканях и в другое время в процессе онтогенеза растений.
Биохимики достигли больших успехов при изучении нодулинов гороха, сои. У гороха Бисселинг с сотр. (1985) идентифицировали восемь нодулинов, которые согласованно экспрессировались вместе с леггемоглобином тогда, когда клубенек инфицирован бактерией, способной или неспособной к азотфиксации. Подобным образом хромосомальный репликон (в сравнении с плазмидой) был необходим для полной экспрессии нодулинов Rhizobium, в то время как трансконъюганты Agrobacterium tumefaciens содержали только один нодулин. Такие же результаты известны для сои и люцерны.
11.3. БИОСИНТЕЗ БЕЛКА И ЕГО РЕГУЛЯЦИЯ
НА ГЕНЕТИЧЕСКОМ УРОВНЕ
Белки занимают первое место среди органических соединений, встречающихся в клетке, – на их долю приходится не менее 50 % сухого веса клетки. Они играют первостепенную роль в структуре и функции клетки, так как именно они являются теми «молекулярными инструментами», при помощи которых реализуется генетическая информация.
Генетический код, активация аминокислот
А. Генетический код. Большая часть генетической информации, содержащейся в ДНК, кодирует последовательность аминокислот. Процесс экспрессии генетической информации включает транскрипцию «текста», записанного на «языке белков». Таково происхождение термина трансляция (дословно – перевод), используемого для обозначения процесса биосинтеза белков. Правила, которым следует трансляция, называют генетическим кодом.
Поскольку в биосинтезе участвуют 20 аминокислот, называемых протеиногенными, «язык» нуклеиновых кислот должен содержать по крайней мере 20 слов (кодонов). Однако в аминокислотном «алфавите» имеется только четыре «буквы» (А, Г, Ц и У или Т (или в англ. транскрипции: A, G, С и U или Т), так что для получения 20 различных слов каждое должно состоять по крайней мере из трех букв. Кодоны действительно включают три азотистых основания (триплет нуклеотидов). На схеме 1 (см. рис. 11.1, а) представлен стандартный код ДНК (последовательность триплетов в некодирующей цепи), изображенный в виде круга. Схема читается от центра наружу, так что, например, триплет CAT кодирует аминокислоту гистидин. ДНК-кодоны идентичны таковым в мРНК (mRNA), за исключением того, что 4-е азотистое основание в РНК – это урацил, а в состав ДНК вместо урацила входит тимин (Т). В качестве примера прочтения кода на схеме 2 (см. рис. 11.1, а) показаны короткие участки нормального и мутантного гена β-глобина вместе с соответствующими последовательностями мРНК и аминокислот. Здесь показаны относительно часто встречающиеся такие мутации, в результате которых остаток глутаминовой кислоты в положении 6 β-цепи заменен на валин. Такой мутантный гемоглобин в дезоксиформе склонен к агрегации, что вызывает деформацию эритроцитов и уменьшает эффективность транспорта кислорода (серповидноклеточная анемия).
В триплетном генетическом коде для 20 аминокислот существует 43 = 64 кодона. Таким образом, большинство аминокислот записывается несколькими кодонами, т. е. генетический код является вырожденным. Кроме того, имеются три триплета, которые обозначают конец транскрипции (стоп-кодоны). Еще один специальный кодон, стартовый (инициирующий) кодон, маркирует начало трансляции. Генетический код, показанный на рис. 11.1 ,а схема 1, является почти универсальным. Этому стандарту не полностью соответствуют только митохондрии и некоторые микроорганизмы.
Б. Активация аминокислот. Ранее упоминалось, что процесс активации аминокислот осуществляется в две стадии (см. рис. 11.1, б). Сначала аминокислота связывается с ферментом (соответствующей аминоацил-тРНК-лигазой) и реагирует с АТФ (АТР), образуя макроэргический смешанный ангидрид – аминоациладенилат. Затем аминоацильный остаток переносится на концевую З'-ОН-группу концевого остатка рибозы тРНК (другой группой лигаз аминоацил переносится на 2'-ОН-группу). В аминоацил-РНК карбоксильная группа аминокислотного остатка этерифицируется остатком рибозы З'-концевого остатка аденозина, входящего в последовательность.... ССА-3'.
Точность трансляции зависит от субстартной специфичности аминоацил-тРНК-лигаз. Корректирующий механизм активного центра лигазы обеспечивает немедленное удаление ошибочно присоединенных аминокислотных остатков. В среднем встречается только одна ошибка на 1300 аминокислотных остатков – поразительно высокая точность «работы», если представить, насколько близки структуры некоторых аминокислот.
В. Asp-tPHK-лигаза (димер). Процесс активации аминокислот рассмотрим на примере лигазы, специфичной для аспарагиновой кислоты (см. рис. 11.1, в). Молекулы фермента связаны между собой вдимер, причем каждая субъединица ассоциирована с одной молекулой тРНК. В активном центре присутствует остаток АТФ, связанный с З'-концом тРНК. Другой домен белка (слева вверху) отвечает за «узнавание» антикодона тРНК.
Генетическое кодирование
аминокислотных последовательностей в белках
Известно, что последовательность аминокислот в каждом белке определяется последовательностью мононуклеотидных строительных блоков в отдельных отрезках линейной молекулы дезоксирибонуклеиновой кислоты (ДНК). Определенные триплеты мононуклеотидов в цепи ДНК, так называемые кодоны, соответствуют определенным аминокислотам. Последовательность кодонов в ДНК коллинеарна аминокислотной последовательности кодируемой ею полипептидной цепи. Участок молекулы ДНК, кодирующий одну полную полипептидную цепь, называется цистроном или геном. В настоящее время накоплено много сведений о белках и их биологической активности на основе исследования молекулярных взаимодействий между генами и белками, поскольку структура и функция белков в конечном итоге являются отражением их аминокислотной последовательности. Установление взаимосвязи генов и белков позволило ученым по-новому взглянуть на проблемы биохимии белков и эволюции белковых молекул.
В процессе биосинтеза белка случаются ошибки, следствием которых является изменение нормальной последовательности аминокислотных остатков. Образующийся аномальный белок, лишенный биологической активности, является результатом генетической мутации. Она происходит, если в ДНК, кодирующей данную полипептидную цепь, химически изменяется или выпадает одно мононуклеотидное звено или же если в эту ДНК включается один лишний мононуклеотид. При этом нормальная, непрерывная последовательность кодирующих триплетов в гене изменяется и соответствующим образом изменяется аминокислотная последовательность полипептидной цепи, кодируемой этим геном. В большинстве случаев процесс ограничивается заменой одной-единственной аминокислоты на другую. Исследование таких мутантных белков (т. е. белков с каким-либо изменением, являющимся результатом мутации) представляется очень важным, так как оно дает возможность обнаруживать те аминокислотные остатки полипептидной цепи, которые играют существенную роль в определении структуры и функции белка.
Рибосомы: инициация трансляции
Биосинтез белка (трансляция), как и активация аминокислот, происходит в цитоплазме. Она осуществляется нуклеопротеидными частицами, называемыми рибосомами.
А. Структура рибосом эукариот. Рибосомы состоят из двух различных субчасгиц, каждая из которых построена из рибосомальнойРНК [рРНК (rRNA)] и многих белков. Рибосомы и их субчастицы обычно классифицируют не по массам, а в соответствии с коэффициентами седиментации. Коэффициент седимендации зависит от молекулярной массы (М) частицы, ее формы (коэффициент трения f), парциального удельного объема v (величина, обратная плотности частицы) и выражается в единицах Сведберга S (1S = 10-13 с). Так, коэффициент седиментации полной эукариотической рибосомы составляет около 80 единиц Сведберга (80S), а коэффициент седиментации ее субчастиц составляет 40S и 60S.
Меньшая 405-субчастица состоит из одной молекулы 18S – РНК и 30–40 белковых молекул. Большая 60S-субчастица содержит три типа рРНК с коэффициентами седиментации 5S; 5,8S и 28S и 40–50 белков (например, рибосомы гепатоцитов некоторых животных включают 49 белков). В присутствии мРНК (mRNA) субчастицы объединяются с образованием полной рибосомы, масса которой примерно в 650 раз больше массы молекулы гемоглобина. Рибосомы имеют диаметр 20–200 нм и их можно видеть в электронный микроскоп. Структурная организация рибосом полностью не выяснена. Однако известно, что молекулы мРНК проходят через щель около характерной структуры в виде «рога» на малой субчастице, причем эта щель ориентирована как раз в промежуток между двумя субчастицами. тРНК также связываются вблизи этого участка. Для сравнения на схеме (рис. 11.3) в том же масштабе показана молекула тРНК.
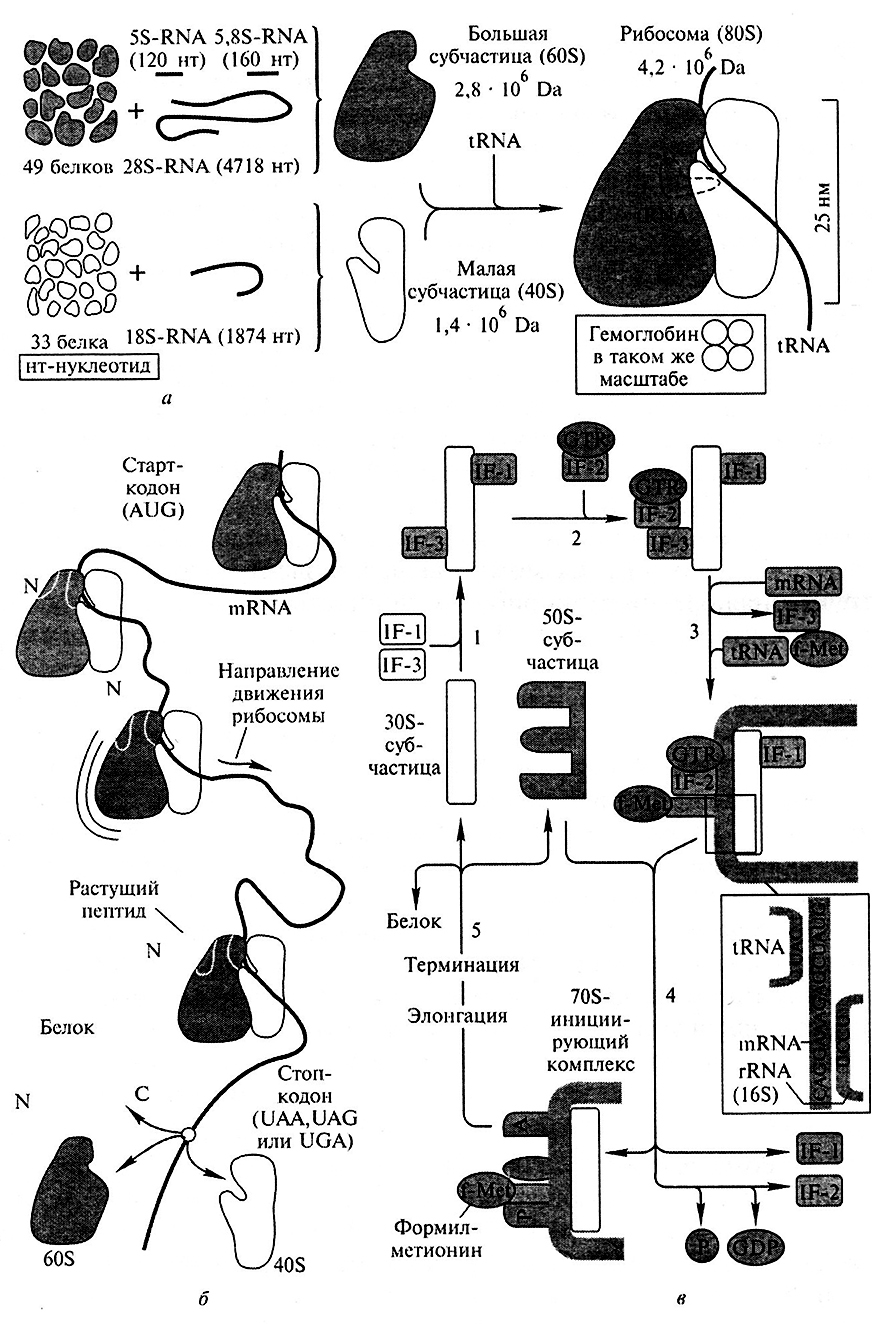
Рис. 11.3. Рибосомы – инициация трансляции:
а – структура рибосом эукариот; б – полисома; в – инициация трансляции в Е. coli (Koolman, J., Rohm K.H., 2004)
Рибосомы прокариот имеют аналогичную структуру, но они несколько мельче, чем эукариотические (коэффициенты седиментации полной рибосомы 70S, а субчастиц – 30S и 50S). Рибосомы митохондрий и хлоропластов близки к прокариотическим.
Б. Полисома. Клетки, в которых происходит активный синтез белков, часто содержат рибосомы, расположенные одна задругой подобно жемчужинам на нитке, в виде так называемой полисомы. Это объясняется тем, что одна молекула мРНК может трансформироваться одновременно несколькими рибосомами. Первой стадией трансляции является связывание рибосомы со стартовым (инициирующим) кодоном (AUG) вблизи 5'-конца тРНК (см. выше). По мере трансляции рибосома движется по направлению к З'-концу до тех пор, пока не дойдет до терминирующего кодона (стоп-кодона) (UAA, UAG или UGA). Как только рибосома достигает стоп-кодона, происходит освобождение синтезированного белка и диссоциация рибосомы на отдельные субчастицы (рис. 11.3).
В. Инициация трансляции в Е. coli. Синтез белка у прокариот в основном аналогичен синтезу у эукариот. Здесь все этапы синтеза белка обсудим на примере бактерии Е. coli.
Первую фазу трансляции – инициацию – можно разделить на несколько стадий (рис. 11.3, в). На первой стадии два белковых фактора инициации IF-1 и IF-2 связываются с 30S-субчасгицей (1). Затем еще один белковый фактор, IF-2, образует комплекс с ГТФ (GTP) (2), что облегчает ассоциацию ЗОS-субчастицы с мРНК (mRNA) и связывание тРНК (tRNA), соответствующей инициирующему кодону (3). У прокариот стартовая тРНК несет N-формилметионин (f-Met), у эукариот–метионин. В завершение 50S-субчастица связывается с вышеупомянутым комплексом (4). На третьей и четвертой стадиях идет освобождение факторов инициации и гидролиз связанного с IF-2 ГТФ до ГДФ (GDP) и неорганического фосфата Рi-. Таким образом, связанный с 70S-рибосомой инициирующий комплекс содержит формилметионин-тРНК в тРНК-связывающем участке, называемом пептидильным участком (Р). Второе место связывания, акцепторный участок (А), во время этой фазы трансляции остается свободным.
Рибосомы: элонгация, терминация
После завершения стадии инициации к растущей полипептидной цепи присоединяются другие аминокислоты (элонгация) до тех пор, пока рибосома не достигнет стоп-кодона на мРНК и процесс не прекратится (терминация).
А. Элонгация и терминация биосинтеза белка в Е. coli. Элонгацию можно разделить на три стадии. В первой пептидильной участок (Р) рибосомы занимает тРНК (tRNA), несущая на З'-конце растущую пептидную цепь (рис. 11.4). Затем вторая тРНК, соединенная с соответствующей аминокислотой (на рис. 11.4 показана Val-тРНК), взаимодействует своим антикодоном с кодоном мРНК, фиксированным на акцепторном участке А (в данном случае GUG).
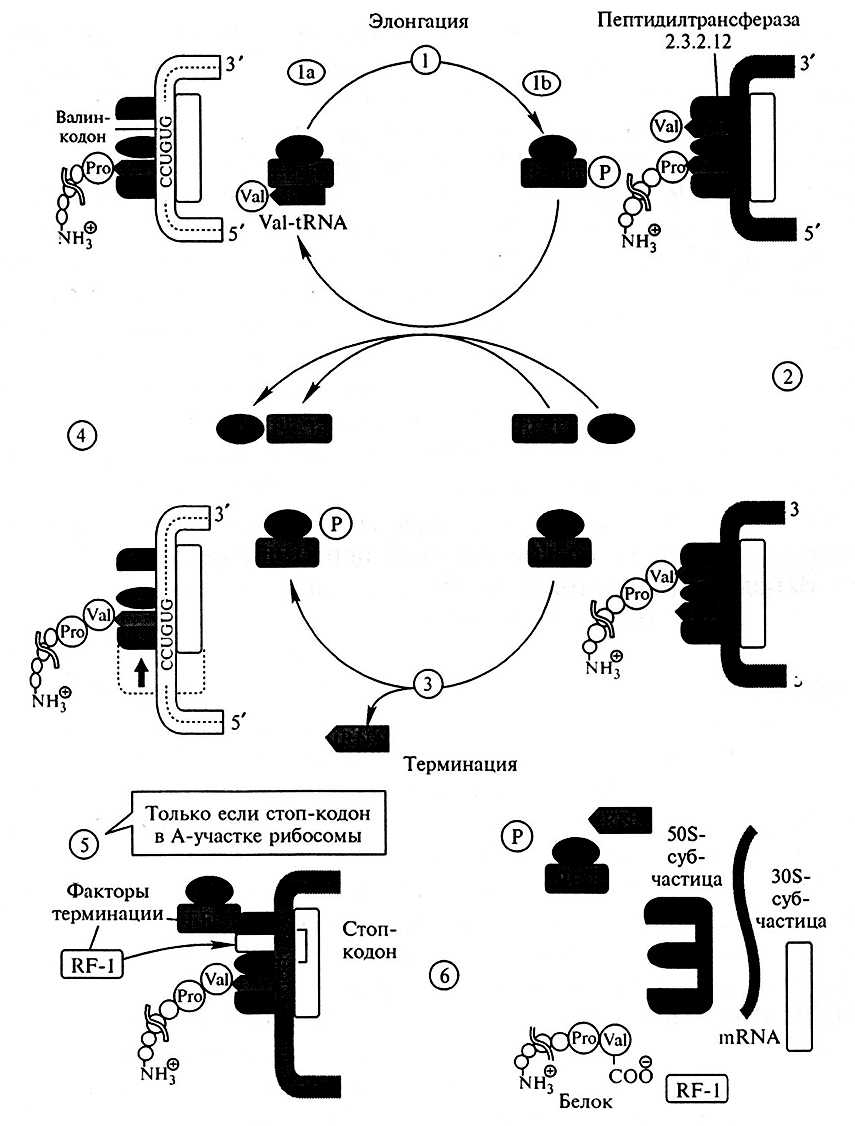
Рис. 11.4. Рибосомы: элонгация, терминация биосинтеза белка (Koolman, J., R6hm К.Н., 2004)
тРНК связывается в виде комплекса с ГТФ-содержащим белком, фактором элонгации Tu (EF-Tu) (1a). Диссоциация комплекса происходит только после того, как связанный ГТФ (GTP) гидролизуется до ГДФ (GDP) и фосфата (1b). До гидролиза ГТФ взаимодействие тРНК с мРНК (mRNA) относительно слабое. Таким образом, гидролиз ГТФ с участием комплекса является лимитирующим фактором, дающим время для проверки, правильно ли связана тРНК. Затем следующий белок, фактор элонгации Ts (EF-Ts), катализирует обмен ГДФ на ГТФ и таким образом регенерирует комплекс EF-Tu • GTP.
Собственно синтез пептидной связи происходит на следующей стадии (2). Рибосомальная «пептидилтрансфераза» катализирует (без потребления АТФ) перенос растущей пептидной цепи от тРНК, находящейся в Р-участке, на аминогруппу валинового остатка, присоединенного к тРНКVа1, связанной на А-участке. Пептидилтрансферазная активность рибосом зависит не от какого-либо рибосомального белка, а, скорее всего, связана с 28S-PHK. Каталитически активные РНК получили название рибозимов. Предполагают, что существующие рибозимы можно рассматривать как реликты «мира РНК» раннего периода биохимической эволюции, когда белки еще не получили такого распространения и не приобрели такого значения, как в последующие периоды.
После переноса растущей цепи в А-участок свободная аминоацил-тРНК диссоциирует от Р-участка (3) и с рибосомой связывается другой ГТФ-содержащий фактор элонгации (EF-gGTP). Гидролиз ГТФ этим фактором дает энергию для транслокации рибосомы (3). Во время этого процесса рибосома сдвигает мРНК на три основания в направлении З'-конца. Поскольку тРНК, несущая полипептидную цепь, не меняет положения относительно мРНК, она попадает в Р-участок рибосомы, в то время как следующий кодон мРНК (в данном случае GUG) попадает в А-участок. Теперь рибосома готова для вступления в следующий цикл элонгации (4).
Когда один из стоп-кодонов (UAG, UAA или UGA) попадает в А-участок, наступает терминация трансляции (5). Для стоп-кодонов нет соответствующих тРНК. Вместо этого с рибосомой связываются два белковых высвобождающих фактора (англ. relising factor, RF). Один из них, RF-1, катализирует гидролитическое расщепление эфирной связи между тРНК и С-концом пептида, тем самым высвобождая белок. Энергию для диссоциации комплекса на составляющие компоненты поставляет ГТФ-содержащий фактор RF-3 (6).
Синтез белка требует высоких энергетических затрат. При присоединении одной аминокислоты к растущему полипептиду гидролизуется четыре макроэргические связи. Две молекулы АТФ гидролизуются при активации аминокислоты (АТФ → АДФ + неорганический фосфат), и две молекулы ГТФ расходуются во время элонгации. Кроме того, при инициации и терминации на каждую молекулу белка расходуется по одной молекуле ГТФ.
Итак, синтез белка в рибосоме представленный в виде упрощенной схемы на рис. 11.5, протекает в такой последовательности:
1. Инициация:
а) мРНК связывается своим стартовым кодоном с малой субъединицей рибосомы (40S), что осуществляется при участии водородных связей между МНг-группами рРНК и фосфатными остатками мРНК;
б) первая аминоацил-тРНК связывается своим антикодоном со стартовым кодоном;
в) присоединяется большая субъединица рибосомы (60S).
2. Транслокация: мРНК продвигается по рибосоме на один кодон.
3. Спаривание оснований: следующая аминоацил-тРНК связывается со следующим кодоном.
4. Перенос: фермент большей субъединицы – пептидилтрансфераза – переносит первую аминокислоту (или уже готовый участок полипептидной цепи) с тРНК на присоединившуюся последней аминокислоту с образованием пептидной связи, после чего освободившаяся тРНК покидает рибосому. Этапы 16, 2 и 3 становятся энергетически возможными благодаря экзергоническому расщеплению гуанозинтрифосфата (ГТФ → ГДФ + Фн). Этапы 2, 3, 4 многократно повторяются с постепенной элонгацией полипептидной цепи, которая до длины приблизительно в 30 аминокислотных остатков, как считают ученые, располагается в бороздке 60SA-субъединицы и поэтому не может приобрести третичную структуру.
5. Терминация: когда терминирующий кодон (например, УАГ) достигает рибосомы, белоксинтезирующий комплекс сложным путем распадается на составные части: мРНК, тРНК, полипептид и обе рибосомные субъединицы (40S и 60S).
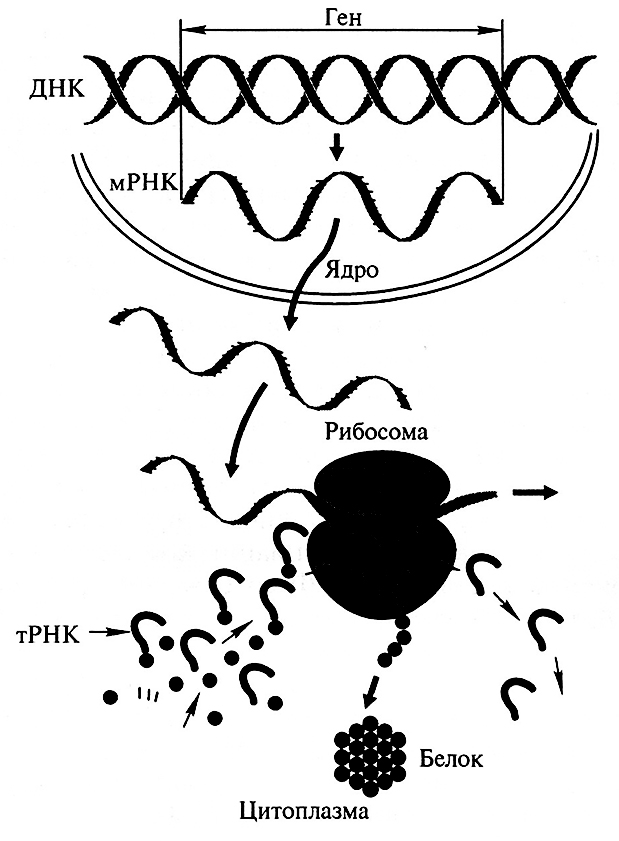
Рис. 11.5. Синтез белка в рибосоме (по А.С. Спирину, 1977)
Рибосома имеет два основных активных участка с различными свойствами: акцепторный участок, или вход, и донорный участок, или выход, а также участки инициации и терминации. Итак, в рибосомном белковом синтезе участвуют многочисленные белки цитоплазмы (некоторые окончательно не изучены) и рибосом, а именно: инициирующие факторы (этап 1), факторы связывания (этап 3), факторы транслокации, переноса и терминации.
Известно, что клетки эукариот содержат больше факторов инициации и вследствие этого имеют более сложную структуру комплекса инициации. Главную роль в инициации играет КЭП-структура 5'-конца эукариотической мРНК, хотя элонгация и терминация протекают по аналогичной схеме. Установлено также, что отдельные стадии трансляции в бактериях могут ингибироваться антибиотиками.

