Классификация механизмов внутриклеточной регуляции
Механизмы регуляции, замедляющие или ускоряющие реакции отдельных путей обмена веществ, связаны с переключением процесса обмена с одного пути на другой. Регулирующие факторы могут быть различными: промежуточные продукты, образующиеся в обмене веществ; неорганические и органические вещества, поступающие с пищей; факторы внешней среды; гормоны.
Тесно переплетающуюся сеть метаболических реакций часто называют «картой метаболизма». Наряду со сложным лабиринтом «каналов», по которым проходит путь метаболитов, существует и высококоординированная система «регулирования движения», благодаря которой скорости и направления метаболических потоков всегда согласуются с общими интересами клеточного «хозяйства». Без этих регуляторов, их соответствующей расстановки и надлежащего использования огромный каталитический потенциал всей системы метаболизма был бы совершенно бесполезен.
В настоящее время ученые пользуются следующей классификацией механизмов внутриклеточнй регуляции:
1) метаболитные регуляции (путем изменения концентраций метаболитов, не затрагивающие активности или числа ферментных молекул);
2) ферментные регуляции (путем изменения активности имеющихся молекул ферментов); регулирующие факторы в этом случае действуют непосредственно на фермент. Активность ферментов, независимо от того, катализируют ли они процессы биосинтеза или катаболизма, зависят от энергетического заряда адениловой системы:
![]()
где все компоненты приведены в молярной концентрации;
3) генные регуляции (путем включения или выключения синтеза ферментов); регулирующие факторы, действуют на генетический материал (ДНК) или непосредственный его продукт (РНК).
Ферментная регуляция затрагивает только один фермент, но происходит очень быстро (доля секунд) и служит для «тонкой настройки» путей обмена веществ. Генная регуляция, затрагивающая обычно несколько ферментов одновременно, более экономична по сравнению с ферментной, поскольку ферменты, в которых нет необходимости, просто не синтезируются; генная регуляция занимает больше времени, так как включается трансляция и чаще всего также и транскрипция. Эта форма регуляции служит для «грубой настройки» обмена веществ и имеет большое значение для процессов развития.
Генная регуляция биохимических процессов
Физиологическая функция генов заключается в передаче информации клетке через мРНК и ферменты. Никогда не происходит одновременной передачи всей имеющейся информации, иначе говоря, никогда не синтезируются одновременно все потенциально возможные ферменты. Следовательно, существуют одновременно активные (продуцирующие РНК) и неактивные гены. Благодаря генной регуляции осуществляется активация генов (индукция) и инактивация (репрессия); одним из самых первых, экспериментально уловимых, специфических последствий генной регуляции является появление или исчезновение того белка (фермента), за синтез которого отвечает регулируемый ген (индукция и репрессия ферментов).
Для регуляции на уровне генов справедливы те же закономерности, как и при ферментной регуляции:
- активации ферментов субстратом соответствует генетическая субстратная индукция;
- торможению ферментов конечным продуктом – репрессия генов продуктом реакции;
- оба механизма регуляции в равной степени запускаются метаболитами, различны лишь уровни, на которых осуществляется регуляция (рис. 11.6).
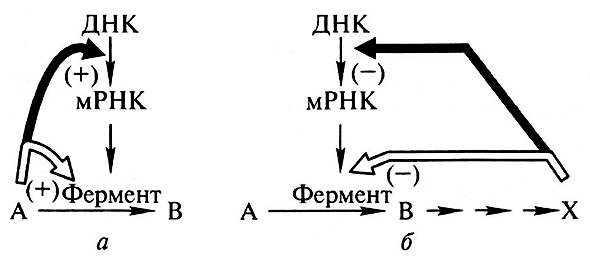
Рис. 11.6. Генная регуляция (регуляция активности генов):
а – активация субстратом (контурная стрелка) и индукция субстратом (черная стрелка);
б – торможение конечным продуктом (контурная стрелка) и репрессия продуктом (черная стрелка) (по Э. Лнбберту, 1976)
Генные регуляции вызываются, кроме того, стимуляторами развития, например, гормонами, светом, и играют важную роль в эмбриональном развитии эукариотических организмов. Экспериментально можно отличить генные регуляции от ферментных потому, что первые в отличие от вторых выключаются под действием ингибиторов синтеза белка и РНК (актиномицин D, у-метилпурин, пуромицин, этионин и др.).
Репрессия ферментов
Репрессия ферментов продуктами их действия встречается прежде всего в процессах анаболизма; репрессирующий метаболит (корепрессор) в первую очередь подавляет активность ферментов, катализирующих его синтез. Например, аргинин репрессирует все восемь ферментов, участвующих в его синтезе. Синтез гистидина подчиняется двойственному ретроингибированию:
– торможению конечным продуктом (гистидин аллостерически подавляет первый фермент в последовательности ферментов биосинтеза гистидина – рибозо-фосфат-пирофосфокиназу);
– репрессии продуктом (гистидин репрессирует все девять ферментов его биосинтеза).
Репрессия ферментов, как и индукция ферментов, свойственна всем живым организмам. Но относительно репрессии у высших организмов сведений мало. Предполагают, что:
– ионы аммония репрессируют нитратредуктазу, синтез которой индуцируется нитратом;
– фосфат репрессирует освобождающую фосфат фитазу (фитин → миоинозит + ФН;
– фруктоза репрессирует локализованную в вакуоли инвертазу (сахароза → глюкоза + фруктоза).
Во всех этих случаях мы имеем дело с репрессией катаболических ферментов продуктами их действия.
Механизм генной рефляции:
модель Жакоба – Моно
Согласно модели Жакоба – Моно (рис. 11.7), в ДНК существуют наборы нескольких генов («структурные гены»), объединенных в оперон и подлежащих общей регуляции. «Оперон лактозы», например, содержит гены для трех индуцируемых лактозой ферментов – β-галактозид-пермеазы, β-галактозидазы и ацетилтрансферазы. Оперон транскрибируется целиком; образующаяся мРНК содержит информацию для синтеза нескольких полипептидов (полигенная мРНК). Моногенной мРНК может быть только в том случае, если оперон содержит один ген.
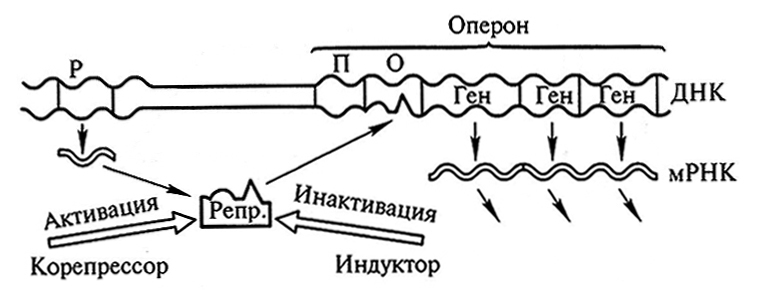
Рис. 11.7. Схема Жакоба – Моно, объясняющая механизм индукции и репрессии:
Р – регулятор; П – промотор; О – оператор; Репр. – репрессор (по Э. Либберту, 1976)
Транскрипция оперона начинается не с первого гена. Первому гену предшествуют две специфичные нуклеотидные последовательности, а именно промотор («промоторный ген»), который инициирует начало транскрипции и к которому присоединяется РНК-полимераза, и оператор («операторный ген») – место приложения регулирующих воздействий.
За пределами оперона в ДНК имеется подчиненный оперону регулятор («регуляторный ген»). Функцией его является синтез репрессора (называемого также апорепрессором), специфически связывающегося со «своим» оператором и тем самым ингибирующего транскрипцию оперона.
Свойства репрессоров
Репрессор – этоаллостерический белок. Репрессоры могут быть неактивными и могут активироваться путем взаимодействия с соответствующим корепрессором, принимая конформацию, позволяющую осуществляться реакции с оператором,– репрессия фермента. Репрессоры могут образовываться и в активной форме. Тогда действие соответствующего индуктора заключается в таком изменении молекул репрессора, при котором разрушается их связь с оператором,– индукция фермента. Гены ферментов, синтез которых не зависит от регуляции (конститутивные ферменты), вообще не имеют репрессора, или же он биологически неактивен. Выделенные до настоящего времени репрессоры (из бактерий) представляют собой кислые белки с молекулярной массой в пределах 30 000–150 000. В клетке одновременно присутствуют приблизительно 5–10 молекул репрессора. Репрессоры связываются только с двухцепочечной спиралью ДНК, но не с одноцепочечной, денатурированной ДНК. До сих пор до конца не выяснен механизм «распознавания» репрессором соответствующего оператора.
Реализация регуляторных механизмов
Самой главной предпосылкой для реализации регуляторных механизмов является быстрое исчезновение информации, поступившей от ДНК, т. е. малая продолжительность жизни мРНК и ферментов. В противном случае репрессия ранее активных генов была бы бесполезной, а однократная индукция продолжалась бы бесконечно. У бактерий, которые вообще очень легко перестраиваются в ответ на изменение условий внешней среды, мРНК характеризуется малой продолжительностью жизни (1–2 мин). У высших организмов, которые обычно сохраняют одно и то же состояние метаболизма в течение довольно длительного времени, существуют две формы мРНК: короткоживущая и долгоживущая, например у растений хлопчатника более 16 ч, у зеленой водоросли Acetabularia несколько недель. Время полужизни ферментов у высших растений составляет от одного часа до пяти суток.
Отступления от теории Жакоба – Моно
Экспериментально было показано, что теория Жакоба – Моно не всегда оправдывается.
1. При помощи этой модели трудно объяснить катаболическую репрессию, т. е. репрессию индуцибельного оперона промежуточными продуктами дыхания или брожения: репрессию оперона лактозы глюкозой или продуктами ее диссимиляции. Такого рода репрессия функционирует и при отсутствии репрессора, если наблюдается мутация регулятора. Вероятно репрессирующие метаболиты взаимодействуют с опероном непосредственно, хотя и неясно каким образом.
2. Совместно регулируемые гены не обязательно должны быть объединены пространственно в одном опероне. Например, у Е. coli все гены для восьми репрессируемых аргинином ферментов синтеза аргинина расположены в пяти пространственно разграниченных участках ДНК. Такое функциональное, но не пространственное, объединение генов называютрегулоном. Ученые считают, что перед всеми генами одного регулона пространственно подключены идентичные операторы. У эукариот, начиная с Neurospora (низшие грибы), число регулонов увеличивается за счет оперонов. У высших растений и животных регулоны вообще неизвестны.
3. У высших растений также обнаружены регуляторные гены. Например, если у кукурузы путем мутации модифицируется регуляторный ген синтеза антоцианов, то в эндосперме активируются ранее репрессированные гены для всех ферментов, участвующих в синтезе антоцианов. Но это еще не означает, что механизм регуляции осуществляется в соответствии с моделью Жакоба – Моно.
4. У гриба Aspergillus регуляторный ген HP, очевидно, вообще не дает репрессора, а наоборот регулирует образование какого-то положительно влияющего генного продукта, который, активируясь нитратом, инициирует синтез мРНК. Исследователи считают, что такого рода механизм имеется и у высших растений, HP которых известна как индуцибельный фермент (А. Ленинджер, 1985; Л. Страйер, 1985).
11.5. БИОХИМИЧЕСКИЕ ДОКАЗАТЕЛЬСТВА
ГЕНЕТИЧЕСКОЙ СУЩНОСТИ ДНК И ГЕНЕТИЧЕСКОГО КОДА
Рассмотрим доказательства генетической функции ДНК, которые были получены различными способами.
1. Показано, что содержание ДНК в любой клетке или организме строго постоянно и не зависит от условий среды, от питания или от воздействия различных факторов, влияющих на метаболизм клетки. Эта особенность ДНК вполне соответствует предполагаемым свойствам генетического материала.
2. Содержание ДНК в клетке, как правило, увеличивается с возрастанием сложности клетки и, следовательно, с возрастанием количества генетической информации в клетке (табл. 11.1).
Таблица 11.1. Приблизительное содержание ДНК в некоторых клетках и вирусах (Ленинджер А., 1974)
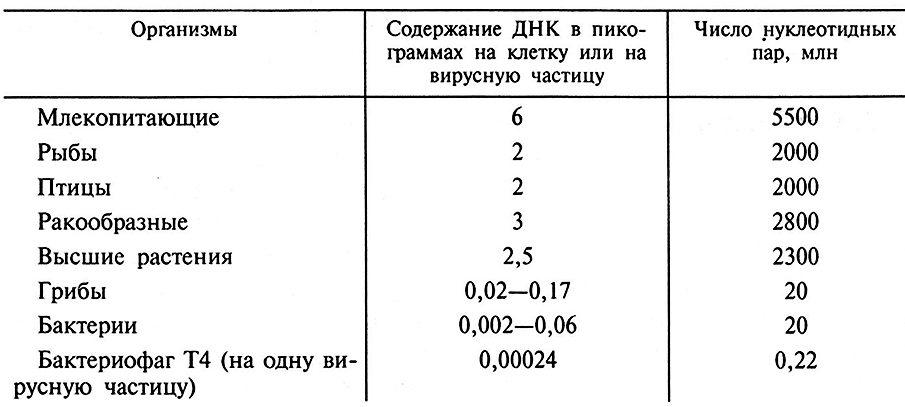
Данные, приведенные в табл. 11.1, свидетельствуют о том, что чем сложнее организм, тем больше ДНК содержится в его клетках. Бактерии содержат около 0,01 • 10-6 мкгДНК на клетку (примерно 1 % сырой массы), а у высших организмов содержание ДНК составляет приблизительно 6 • 10-6 мкг на клетку. ДНК-Содержащие вирусы бактерий (бактериофаги) и вирусы животных, имеющие лишь несколько генов, содержат очень мало ДНК.
3. Результаты экспериментов по репликации бактериофагов также свидетельствуют о генетической функции ДНК. Особенно показательными в этом отношении были опыты А.Д. Херши и М. Чейза. Они метили или только белок или только ДНК вирусных частиц, инкубируя инфицированные бактерии в среде, содержащей соответствующие радиоактивные предшественники. Используя меченые по белку или по ДНК вирусные частицы, АД. Херши и М. Чейз показали, что только вирусная ДНК (но не вирусный белок) проникает в бактериальную клетку. Позднее эти исследователи показали, что очищенная от примесей белков вирусная нуклеиновая кислота обладает инфекционностью, т. е. при введении в бактериальную клетку приводит к образованию полноценных вирусных частиц. В пользу генетической функции ДНК говорят также следующие аргументы:
- препараты ДНК, выделенные из различных тканей одного и того же организма, имеют одинаковый нуклеотидный состав;
- нуклеотидный состав ДНК у разных видов различен;
- нуклеотидный состав ДНК у организма данного вида не зависит от возраста организма, условий питания и внешней среды;
- почти во всех исследованных препаратах ДНК число остатков аденина равно числу остатков тимина (А = Т), а число остатков гуанина равно числу остатков цитозина (Г = Ц). Число пиримидиновых остатков равно числу пуриновых остатков, т. е. А + Г = Ц + Т;
- ДНК близких видов имеют весьма сходный нуклеотидный состав, тогда как эволюционно отдаленные организмы заметно отличаются один от другого по своему нуклеотидному составу. Таким образом, нуклеотидный состав ДНК может быть использован как таксономический признак.
11.6. БИОХИМИЧЕСКАЯ ХАРАКТЕРИСТИКА
ПРОЦЕССОВ ДИФФЕРЕНЦИРОВКИ (МОРФОГЕНЕЗА)
Дифференциальная активация генов
Эмбриональная, т. е. еще не специализированная, меристематическая клетка может развиваться различными путями. Это зависит от особого набора белков, поскольку каждая специализированная клетка вырабатывает лишь часть генетически возможных ферментов. Например, высокая концентрация а-амилазы наблюдается у ячменного зерна только в алейроновом слое. Фенолоксидазы содержатся в эндодерме, но не в коре корня, Поскольку синтез каждого белка, каждого фермента управляется при посредстве мРНК одним геном, а следовательно, ДНК, образование различных наборов ферментов в разных типах клеток является, веро-» ятно, следствием дифференциальной активации генов (активация одной группы генов при одновременной активации других).
В процессе развития при постоянной структуре ДНК последовав тельно изменяется состав РНК (состав оснований) и белков (электрофоретические свойства, ферментативная активность). Эта биохимическая дифференциация является не следствием, а причиной морфологической дифференцировки. Механизм активации и блокирования генов до конца не изучен. Ученые полагают, что по-видимому имеют место хромосомные регуляции при участии гистонов – ядерных белков и процессы индукции и репрессии согласно теории Жакоба – Моно.
Благодаря дифференциальной активации генов образуется мРНК, которая участвует в морфогенезе и называется морфогенетической. На примере ацетабулярии исследователи часто демонстрируют морфогенетическую функцию РНК в опытах с рибонуклеазой и актиномицином. Необходимость синтеза белка для проявления морфологического действия РНК доказывается опытами с пуромицином. При прививках или трансплантации ядер изменяется также специфический для каждого вида, электрофоретически различимый изоферментный спектр в соответствии с видовой принадлежностью имеющегося клеточного ядра.
В особо значительных процессах дифференциальной активации генов, например при детерминации развития эмбриональной клетки в определенном направлении, участвуют многие гены. Вряд ли можно представить, что включающий фактор, например гормон, отдельно активирует каждый ген или каждую группу генов (оперон), т. е. при упорядоченном ходе развития гены становятся активными один за другим. Многие гены объединены в функциональные единицы, которые можно сравнить с программами, заложенными в ЭВМ. Геном содержит ограниченное число программ, которые могут быть запущены определенными факторами. Как и в ЭВМ, в состав программы входят подпрограмма, подподпрограмма и т. д. Например, в программу «палисадная клетка» – формирование хлоропластов и синтез хлорофилла, в программу «цветок» – тычинка и пыльцевое зерно. Последний пример показывает, что такого рода программа предназначена для развития не только клеток, но и целых органов. Некоторые подпрограммы относятся только к одной-единственной программе (тычинка – к цветку), другие – к нескольким (ксилема – к побегу и к корню). Все имеющиеся в настоящее время схемы координированной активации генов объясняют два известных факта:
1. у высших организмов во многих участках ДНК последовательности азотистых оснований неоднократно повторяются – это могли бы быть гены-интеграторы (доноры) и рецепторы;
2. большая часть мРНК разрушается в ядре – это, возможно, РНК, образованная генами-интеграторами.
Уже упоминалось, что участвующие в процессе развития гены активируются друг за другом в определенной последовательности (временная генная модель).
Дифференциальная активация генов гормонами
1. Наиболее наглядным примером, свидетельствующим об активации генов гормонами, является индукция гиббереллином а-амилазы в семенах злаков, отвечающей за расщепление крахмала при прорастании зерна. К началу прорастания семян гиббереллин вызывает образование а-амилазы живым алейроновым слоем и выделение ее в мертвые клетки эндосперма, где откладывается запасной крахмал. Источником гиббереллина является зародыш. Опыты с С- и Н-изотопами доказывают, что а-амилаза не активируется, а синтезируется de novo из аминокислот. Для этого необходим синтез РНК. Активация генов под действием этого гормона является дифференциальной: наряду с α-амилазой гиббереллин индуцирует рибонуклеазу и протеазы.
2. Другие убедительные примеры активации генов гормонами. Цитокинины индуцируют изоцитратлиазу, протеиназы (эндопептидазы), нитратредуктазу и др. Ауксины индуцируют ферменты, синтезирующие целлюлозу, инвертазу и др. Ауксин и особенно цитокинины индуцируют ДНК-полимеразу, ответственную за синтез ДНК, и т. д.
3. Характер реакции зависит от воздействующего гормона и от генной модели воспринимающей клетки. Например, образование α-амилазы в алейроновом слое ячменя может индуцироваться гиббереллином только у зрелых зерен, а в гипокотиле фасоли оно вызывается цитокинином. В очень молодых проростках риса цитокинин индуцирует фосфоглюконатдегидрогеназу, а в более старых – рибулозодифосфаткарбоксилазу и триозофосфатдегидрогеназу.
Вызванная гормонами индукция ферментов может, конечно, повлечь за собой сопутствующие явления индукции и репрессии, ведущие к изменению метаболизма всей клетки.
Образование РНК, индуцированное гормонами
РНК выполняет функцию промежуточного звена между первинным действием гормонов и их влиянием на рост и развитие. Первичное действие проявляется не только в стимулировании синтеза РНК in vivo и in vitro, но и в изменении состава оснований РНК. Влияние гормонов на рост и развитие через индукцию синтеза РНК доказано в следующих экспериментах: обработка гормоном, экстрагирование РНК из обработанной ткани, введение этой РНК в ткань, не содержащую гормона, и наблюдение за специфичным для данного гормона действием в этой ткани. Такие эксперименты проводились с гиббереллином и животными гормонами – экдизоном и эстрогеном. Гиббереллин способствует тому, что дрожжи (а также ткани из топинамбура) приобретают способность реагировать на ауксин растяжением клеток. Такой же эффект вызывает экстрагируемая РНК, образующаяся в клетках дрожжей (или клубнях топинамбура) после обработки гиббереллином.
Биохимия эмбрионального роста
Под эмбриональным ростом объединяют два процесса: деление клеток и рост протоплазмы, происходящие в меристеме (эмбриональной зоне).
Рост протоплазмы
Клетка начинает свое существование вследствие деления эмбриональной материнской клетки, способной к делению. Благодаря росту протоплазмы она вырастает приблизительно до размеров материнской клетки. При этом все плазматические структуры, например пропластиды, митохондрии, субструктуры (элементарные мембраны) и вещества (ДНК, РНК, белки, липиды и т. д.), количественно удваиваются, т. е. достигают первоначального их количества в материнской клетке. Рост протоплазмы состоит из хорошо известных процессов:
– репликации ДНК;
– последовательности реакций ДНК → РНК → фермент (белок) → продукт, которые включают в себя транскрипцию, трансляцию и многие ферментативные реакции.
Продуктом считаются все плазматические структуры и вещества несмотря на то, что последний этап этой последовательности реакций, а именно связь на молекулярном уровне между структурой белков и плазматическими (субморфологическими) структурами изучена недостаточно.
Деление клеток
В профазе митоза, самое позднее в начале метафазы синтез РНК приостанавливается, рибосомы блокируются и рост протоплазмы приостанавливается, параллельно понижается интенсивность обмена веществ (например, дыхания и др.) во время митоза.
1. Состояние ДНК в процессе митоза. Между каждыми двумя митозами происходит удвоение (репликация) ДНК. Синтез ДНК, хотя и являющийся предпосылкой следующего митоза, не обязательно должен приводить к митозу. Об этом свидетельствует обнаружение эндорепликации (репликации ДНК без митоза), приводящей, как правило, к образованию чрезвычайно богатых ДНК (политенных) хромосом слюнных желез у двукрылых. Но если имеются все остальные условия для митоза, то синтез ДНК может быть ограничивающим фактором и, таким образом, служить причиной, вызывающей митоз. Например, у различных микроорганизмов можно вызвать синтез ДНК температурным шоком; в результате происходйт деление клетки.
2. Рефляция синтеза ДНК. Определенную роль играет фермент тимидинкиназа – индуцибельный фермент, индукция которого возможна только во время короткого периода интерфазы, незадолго до начала репликации ДНК. Вне этого промежутка времени фермент заблокирован. Ученые считают, что ген для тимидинкиназы имеет временную регуляцию. Это же касается и ДНК-полимеразы, которая активируется почти одновременно с тимидинкиназой. Тиминдинкиназа (тимидин → ТМФ) – фермент, необходимый для образования ТТФ, участвует в репликации ДНК. Как участник указанного пути обмена фермент включается в регуляцию процессов ядерного и клеточного деления.
Если бы эта временная регуляция вызывалась предшествующим митозом, то могбы существовать цикл следующих друг за другом процессов: митоз приводит к уменьшению числа ДНК на одну клетку; как следствие через механизм обратной связи (вышеупомянутая «временная регуляция») вызывается синтез ДНК, а затем опять митоз.
Дифференцировка клеток как процесс
репрессии и дерепрессии белкового синтеза
Ранее ученые считали, что процесс дифференцировки клеток в эмбриогенезе, приводящий к возникновению различных специализированных типов клеток, обусловлен избирательной необратимой утратой различных генов геномом эмбриона. В настоящее время твердо установлено, что все клетки высшего организма содержат полный набор генов, характерный для данного организма, но в клетках каждого типа большинство генов репрессировано («выключено»). Например, все клетки позвоночных, по-видимому, имеют гены для миозина, но эти гены «включены» только в мышечных клетках. Генетическую «универсальность» соматических клеток можно продемонстрировать на некоторых высших растениях: в определенных условиях из отдельной дифференцированной клетки растения томата можно вырастить целое растение. В пользу представления об идентичности геномов всех диплоидных клеток данного организма свидетельствует и тот факт, что все соматические диплоидные клетки организма содержат одно и то же число ДНК.
Регуляция синтеза генного продукта
в процессе развития идифференцировки(эпи-генетика)
Как упоминалось ранее, Жакоб и Моно обобщили гипотезу оперона и регуляторного гена для случая регуляции синтеза генного продукта в процессе развития и дифференцировки. Эта область исследований называется эпигенетикой. Применительно к высшим организмам гипотеза оперона должна быть изменена в нескольких отношениях.
1. Поскольку в большинстве клеток высшего организма репрессирована большая часть генома, в них должно использоваться огромное число различных типов репрессорных молекул. Поэтому механизмы репрессии, используемые у бактерий, в случае высших организмов могут оказаться «неэкономными».
2. Процесс клеточной дифференцировки характеризуется существенно меньшей степенью «обратимости» по сравнению с процессами индукции и репрессии ферментов.
Например, культивируемые in vitro нервные клетки продолжают оставаться морфологически и биохимически «похожими» на обычные нервные клетки, и до сих пор не удалось найти ни одной воспроизводимой методики «обратной дифференцировки» этих клеток к исходным «универсальным» (тотипотентным) клеткам или трансформации нервных клеток в другие «специализированные» клетки, например в клетки почек. Следовательно, если дифференцировка обусловлена репрессией определенных совокупностей оперонов, то соответствующие репрессоры должны быть весьма устойчивыми.
Биохимические механизмы стойкой репрессии
Биохимические механизмы гипотетических постоянно действующих репрессоров остаются не до конца изученными.
1. Роль гистонов в процессе дифференцировки. Функции постоянно действующих репрессоров частично или полностью выполняют гистоны – сильноосновные белки, связанные с ядерной ДНК в эукариотических клетках с молекулярной массой 10 000–21 000; молярное содержание лизина и аргинина в молекулах гистонов достигает 25–30 %. Гетерогенность гистонов по первичной структуре сравнительно невелика. В большинстве клеток эукариотов содержится пять основных гистоновых фракций, некоторые из которых можно разделить еще на 3–5 субфракций, гомогенных по аминокислотной последовательности. Общее число гомогенных по первичной структуре гистоновых фракций не превышает 10–12. Высокий, равномерно распределенный положительный заряд молекул гистонов обусловливает образование прочных комплексов гистон – ДНК. В ядрах эукариотических клеток значительная часть ДНК находится в форме дезоксирибонуклеогистонных комплексов. Например, прокариоты не обладают способностью к дифференцировке по причине отсутствия в них сильноосновных белков. Итак, присутствие больших количеств гистонов в ядрах эукариот указывает на существенную роль гистонов в процессе дифференцировки.
2. Ферментативное метилирование оснований ДНК. Другой возможный биохимический механизм стойкой репрессии генома – избирательное ферментативное метилирование определенных азотсодержащих оснований в молекуле ДНК. В настоящее время известны ферменты, например ДНК-метилаза, ответственные за метилирование ДНК в соответствии со следующим уравнением реакции:
ДНК + S-аденозилметионин → метил-ДНК + S-аденозилгомоцистеин.
11.7. БИОХИМИЧЕСКАЯ РЕГУЛЯЦИЯ КАЧЕСТВА
РАСТЕНИЕВОДЧЕСКОЙ ПРОДУКЦИИ
Основная цель возделывания сельскохозяйственных культур связана с получением полноценных продуктов питания, сбалансированных по содержанию белков, углеводов, жиров, минеральных элементов и витаминов. У любого вида растений особенности метаболизма и способность к запасанию определенных химических веществ сформировались в ходе эволюции и закреплены генетически. Изменения в метаболизме наблюдаются при воздействии различных факторов, в том числе и под воздействием мутагенов, в результате гибридизации и переноса генов. Это может послужить основой для создания новых сортов, новых генотипов растений, характеризующихся более высокой продуктивностью, лучшими показателями качества.
Биохимическая сложность
и генетическая изменчивость белков эндосперма
Основным источником пищевого белка для большинства жителей Земли являются злаки, поэтому становится понятным, почему количеству и качеству белка уделяется особое внимание во многих программах селекции зерновых культур, а их биохимия и генетика интенсивно изучаются. Многие ученые в своих опытах используют мутации, затрагивающие структурные гены белков эндосперма или гены, ответственные за образование этих белков, используют биохимические методы для выяснения структуры, процессов синтеза белка и его регуляции.
В процессе эволюции гены, в частности гены проламинов, дуплицировались и претерпели мутационные изменения, что привело к образованию семейств различающихся, но родственных генов. Со временем эти семейства частично разошлись за счет хромосомных перестроек:
– образовались индивидуальные сорта злаков, содержащих сложные по составу смеси белков эндосперма;
– проявилась значительная межсортовая изменчивость по типу белка.
Контроль за белковым составом эндосперма зерновых культур проводится различными методами. Например, при помощи двумерного электрофореза белков эндосперма одного из сортов мягкой пшеницы было обнаружено 60 основных компонентов и вдвое больше минорных. Состав белков у пшеницы осложняется из-за того, что она содержит три различных генома, причем запасные белки каждого генома различаются. Спектры белков одного из сортов диплоидного ячменя проще, хотя на фореграмме обнаруживается по меньшей мере 40 компонентов. Исследователи наблюдали, что сходной степенью сложности обладают спектры белков эндосперма кукурузы.
Этот метод электрофореза в полиакриламидном геле в присутствии додецилсульфата (SDS-PAGE) фракционирует белки в основном по молекулярной массе. На основании результатов такого разделения ученые пришли к выводу, что глобулиновые запасные белки злаков характеризуются меньшей сортовой изменчивостью, чем проламины. Метод SDS-PAGE обнаруживает незначительные различия среди 9 сортов овса и лишь немногим более – методом изоэлектрического фокусирования (IEF). Более выраженной оказалась изменчивость при анализе проламинов (авенинов) из тех же сортов вышеупомянутыми методами. Крайне низкой оказалась также электрофоретическая изменчивость глобулинов риса.
Возможное объяснение различий между результатами, полученными при исследовании глобулинов и проламинов, по мнению ученых заключается в том, что эволюционные изменения проламинов происходили быстрее. Они считают, что причиной этого является значительно более сложная система упаковки в белковые тельца у глобулинов по сравнению с проламинами. Полипептиды глобулинов уложены в упорядоченную структуру с молекулярной массой около 300 000, что накладывает определенные ограничения на форму молекулы с точки зрения аминокислотной последовательности. У проламинов, имеющих в основном намного более гидрофобную природу, отложение белков в белковых тельцах происходит, по результатам ученых, только за счет осаждения (Encycl. Plant Physiol., 1982).
Различия между сортами злаков по белкам эндосперма возникли несколько тысячелетий назад в результате мутаций структурных генов, а также мутаций генов, регулирующих синтез этих белков. Дальнейшие изменения регуляторных генов можно вызвать при помощи облучения или химических соединений. Мутации в единичных структурных генах мало изменяют состав запасных белков семян, поскольку почти всегда эти гены образуют большие семейства, однако в случае хромосомных мутаций этот эффект оказывается заметным.
Биологическая питательная ценность белков
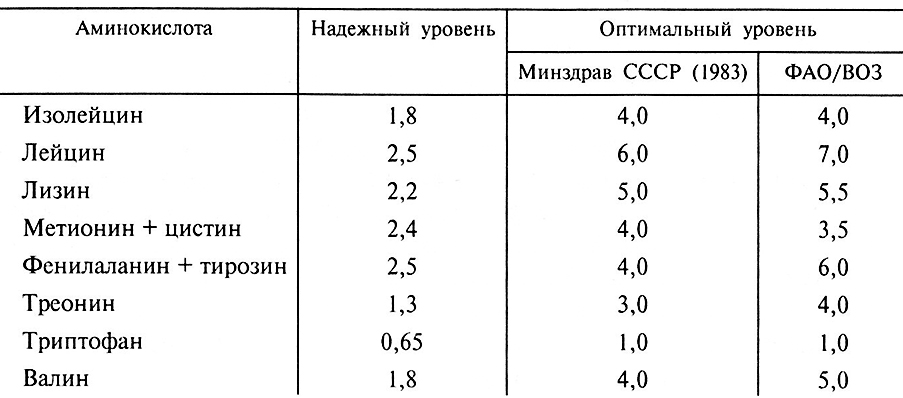
Определение белков и белковых фракций в растительной продукции связано с тем, что белки как компоненты пищи являются источниками аминокислот для человека и животных, в организмах которых отдельные аминокислоты не синтезируются. Это в первую очередь группа незаменимых аминокислот, о которых уже упоминалось. Для того чтобы организм был обеспечен незаменимыми аминокислотами, необходимо в сутки потреблять определенное количество белков: человеку – 60–100 г полноценного белка, животным – 100–110 г такого белка в расчете на каждую кормовую единицу (одна кормовая единица – это питательная ценность 1 кг овса, 0,6 кг крахмала). В100 г потребляемого белка должно содержаться следующее количество незаменимых аминокислот (табл. 11.2).
Таблица 11.2. Ориентировочная надежная н оптимальная потребность
взрослого человека в незаменимых аминокислотах
(г/100 г белка) (Г.А. Воробейков, 1990)
Использование методов генной инженерии
для улучшения питательной ценности белков растения
Направленная селекция растений со строгим наблюдением за фракционным и аминокислотным составом белков проводится с целью улучшения качества растительных белков, определяемых, например, большим содержанием в них определенных незаменимых аминокислот (см. 11.1). Еще в 60-е годы ученые приступили к работе над улучшением состава белков зерна кукурузы на генетической основе по созданию новых генотипов кукурузы, зеин которой изначально не содержит лизина и в нем очень мало триптофана. Американские исследователи Мертц и Нельсон вырастили мутанты кукурузы Опейк-2 и Флаури-2, в зерне которых по сравнению с обычной кукурузой содержится в два раза больше лизина и триптофана, на 30 % больше аргинина, аспарагиновой кислоты и глицина, а содержание аланина, глутаминовой кислоты, тирозина и фенилаланина снижено. В связи с этим мутанты имеют хорошо сбалансированный аминокислотный состав и биологическая питательная ценность их белков приближается к ценности белков молока.
В настоящее время во многих странах проводятся работы по скрещиванию этих мутантов с обычной кукурузой для получения новых форм высоколизиновой кукурузы, которые внедряются в производство. На основе высоколизинового ячменя Гипроли также проводятся работы по выведению новых сортов этой культуры, характеризующихся улучшенным аминокислотным составом.
Белковая инженерия (терапия)
Относительно новая ветвь физико-химической биологии, родившейся на стыке физики и химии белков, а также генетической инженерии. Если генно-инженерные операции не преследуют цель изменить первичную структуру синтезируемого продукта, то белковая инженерия решает задачу создания гибридных молекул белков или пептидов, которые бы обладали заданными характеристиками.
Создание гибридных белков и синзимов – искусственных ферментов
Для этого существует потенциальная возможность, так как в природе сходные биологические функции у разных организмов обеспечиваются белками, проявляющими самые разнообразные физико-химические свойства. Когда будут разработаны способы комбинирования этих свойств, можно будет получать гибридные белки, отвечающие определенным технологическим требованиям. У белков-ферментов при помощи генетической инженерии можно изменить следующие параметры:
- субстратную специфичность;
- температурный и рН-оптимум;
- термостабильность, стабильность и активность в неводных растворах;
- устойчивость к протеазам, способность к аллостерическому регулированию;
- молекулярную массу, число субъединиц.
Это возможно осуществить, если будут известны конкретные физико-химические свойства и функции белка, а также то, в какой степени они определяются его молекулярной структурой. На основе этой информации можно конструировать искусственные белки-ферменты, в частности синтетические ферменты, которые называются синзимами. Простейший путь к разрешению данной проблемы заключается в предсказании структуры, в осуществлении синтеза и в последующей экспрессии в реципиентных клетках гена, который кодирует такой белок.
Открытия и перспективы использования белковой инженерии
Это уже упомянутые высоколизиновые мутанты кукурузы и ячменя, это отработка новых технологий, позволяющих по структуре гена предсказать положение участков молекул белка, определяющих его антигенную активность. Например, такие участки выявлены у вирусных белков, что дало возможность синтезировать соответствующие им олигонуклеотиды (10–15 аминокислотных остатков) и использовать их при вакцинации животных.
Можно назвать следующие перспективы использования белковой инженерии:

В настоящее время намечаются следующие пути селекционного улучшения генотипов растений на основе белковой инженерии.
1. Снижение концентрации неполноценных белков и усиление экспрессии генов полноценных белков.
2. Улучшение аминокислотного состава неполноценных белков или путем изменения нуклеотидной последовательности генов, или путем синтеза искусственных генов с заданными свойствами и перенесение их в клетки растений. Например, американский исследователь Джейнс синтезировал ген, кодирующий белок, содержащий в своем составе 80 % незаменимых аминокислот. Разработаны пути переноса этого гена в клетки злаковых растений.
3. Стимуляция синтеза общего белка в растениях и разработка экспресс-методов оценки белкового статуса растений.
Создание перспективных штаммов микроорганизмов
методом генной инженерии
1. Бактериальные удобрения, которые поддерживают биологическую активность почв за счет:
- фосфобактерина – препарата бактерий, разлагающих органические соединения фосфора в почве;
- за счет азотогена или азотобактерина, обогащающего почву свободно-живущими азотфиксаторами;
- за счет нитрагина, содержащего клубеньковые бактерии, способствующие образованию клубеньков на корнях бобовых, что усиливает фиксацию неорганического азота;
- за счет силикатных бактерий, ответственных за разрушение почвенных калийных силикатов и улучшающих калийное питание растений.
2. Инокуляция в почву агрономически ценных новых штаммов микроорганизмов, созданных на основе генной инженерии. Такие микроорганизмы являются единственными биологическими организмами, способными разрушить (деструктурировать) поступившие в почву пестициды, которые по своей природе являются ксенобиотиками – органическими соединениями, созданными в результате синтеза. Механизм действия почти всех агрономически ценных бактерий, грибов и актиномицетов заключается в том, что последние используют углерод, азот, фосфор, входящие в состав ксенобиотиков в качестве питательных элементов.
11.8. ИНЖЕНЕРНАЯ ЭНЗИМОЛОГИЯ
Иммобилизация и стабилизация ферментов
Идея иммобилизации ферментов отнюдь не нова. Еще в 1916 г. английские химики Нельсон и Гриффин установили, что адсорбированная на алюмогеле инвертаза сохраняет свою активность. Однако широкие масштабы исследования по иммобилизации ферментов приняли лишь в 60–70-х годах, когда назрела потребность в разработке технологических ферментативных катализаторов.
Гетерогенные катализаторы обладают по сравнению с гомогенными рядом преимуществ. Они легко отделяются от реакционной среды, что позволяет их многократно использовать и получать продукты, не загрязненные ферментами. Они позволяют вести процесс непрерывно, что, как правило, значительно выгоднее, чем проведение периодического процесса. Но есть и свои особенности при иммобилизации ферментов: носитель может оказывать сильное влияние на стабильность и активность иммобилизованного фермента. При правильном использовании этого обстоятельства можно одновременно решить и проблему стабилизации фермента к действию температуры и среды.
Методы иммобилизации ферментов
Физические методы:
1) адсорбция фермента на твердом носителе неорганической (силикагель, оксид алюминия, активированный уголь и т. п.) или органической (иониты, полисахариды ит. п.) природы – самый простейший и наиболее старый метод. Неорганические носители обладают хорошими механическими свойствами. К недостаткам метода относятся значительная неспецифическая сорбция посторонних веществ и часто недостаточно прочное удерживание фермента на носителе;
2) включение ферментов в различные полимерные гели. Суть метода состоит в том, что фермент вводят в раствор мономера и подходящего сшивающего реагента, а затем проводят полимеризацию, в результате чего образуется трехмерная сетка геля, в ячейках которой «застревают» крупные молекулы фермента. В то же время для низкомолекулярных субстратов такой гель проницаем. Поэтому активность фермента по отношению к таким субстратам сохраняется, но в случае высокомолекулярных субстратов метод не пригоден;
3) включение ферментов в полиакриламидный гель. Фермент вводят в раствор акриламида (СН2 = CHCONH2) и сшивающего реагента бисакриламида (СН2 = CHCONHCOCH = СН2), добавляют инициатор полимеризации, например (NH4)2S2O8, получают гель с иммобилизованным ферментом, который обычно используют в виде гранул. Полимеризацию можно проводить и без инициатора поддействием γ- излучения (система не загрязняется продуктами распада инициатора и можно обойтись без сшивающего реагента). Кроме акриламидных гелей используют (в меньшей степени) гели поливинилового спирта, поливинилпирролидона, полиметакриловой кислоты и ряд других;
4) включение фермента в микрокапсулы и волокна. В обоих методах фермент остается в своем обычном водном окружении, что обеспечивает сохранение его активности и специфичности. При микрокапсулировании капельки водного раствора фермента диспергируют (распыляют) в органическом растворителе, и на границе раздела фаз возникает оболочка (мембрана) за счет межфазной полимеризации или понижения растворимости подходящего полимера, первоначально присутствующего в одной из фаз. Как и у гелей, мембрана микрокапсулы проницаема для фермента. Размеры капсул составляют десятки или сотни микрон и они легко отделяются от раствора фильтрованием. Технология включения ферментов в волокна предусматривает следующие этапы: сначала получают эмульсию водного раствора фермента (либо суспензию сухого фермента) в органическом растворителе, содержащем полимер, способный образовывать волокна (триацетатцеллюлоза, нитроцеллюлоза, этилцеллюлоза и т. п.); затем эту эмульсию продавливают через тонкие отверстия в другой растворитель, вызывающий коагуляцию полимера. Получаются волокна, содержащие микрокапельки (порядка 1 микрона) водного раствора фермента.
Не меньшее распространение, чем физические, получили химические методы иммобилизации ферментов. Суть их заключается в образовании ковалентных связей между носителем и ферментом. Ковалентная иммобилизация является наиболее надежным способом гетерогенизации (удержания фермента на носителе).
Очень перспективен метод сочетания ковалентной пришивки с включением в гель. В этом случае предварительно модифицируют фермент мономером, например остатком акриловой кислоты. Для этого ацилируют аминогруппы белка хлорангидридом акриловой кислоты. Затем сополимеризуют модифицированный белок с акриламидом и бисакриламидом.
Более сложной является проблема стабилизации ферментов, но для того, чтобы перейти к методам их стабилизации, нужно сначала затронуть следующие факторы, приводящие к инактивации ферментов.
1) Как все белки, ферменты могут быть «съедены» микроорганизмами, присутствующими в окружающей среде.
2) Может происходить межмолекулярная агрегация белковых молекул, а в случае гидролитических ферментов так называемый автолиз, т. е. гидролиз молекул фермента под его собственным воздействием.
3) Молекула фермента может потерять свою трехмерную структуру (конформацию) в результате нарушения взаимодействий боковых групп полипептидной цепи под действием теплоты, повышения или понижения кислотности среды, органических растворителей и т. д. Как правило, белковая глобула при этом разворачивается и переходит в клубок. Это приводит к разрушению активного центра фермента и потере его активности.
4) Инактивация может происходить за счет химической модификации функциональных групп, например вследствие аутоокисления или реакций с примесями.
Первая из указанных причин частично снимается при иммобилизации ферментов в пористых носителях, размеры пор которых таковы, что фермент как бы экранирован от действия микробов. Более универсальный путь – это проведение процесса в условиях пастеризации (при температурах около 70 °С). Но нагревание приводит к инактивации большинства ферментов по третьей из указанных выше причин. В настоящее время разработаны приемы стабилизации ферментов в условиях повышенных температур, препятствующие разворачиванию белковой глобулы.
Суть большинства этих подходов заключается в том, что искусственно закрепляют каталитически активную исходную конформацию фермента. Для этого обрабатывают фермент каким-либо сшивающим реагентом, например глутаровым диальдегидом (глутаровый альдегид – НОС(СН2)3СОН). В результате его взаимодействия с аминогруппами фермента появляются дополнительные связи между участками полипептидной цепи, которые и препятствуют ее разворачиванию. Активная конформация фермента будет стабилизироваться и тогда, когда при иммобилизации белковая глобула будет связываться не в одной, а в нескольких точках. Увеличение стабильности (замедление инактивации) ферментов коррелирует, как правило, с числом связей между носителем и ферментом.
Третий подход состоит в том, что фермент включают в небольшие «тесные» для него поры носителя. Тогда стенки поры препятствуют разворачиванию глобулы, однако при этом происходит резкое падение ее подвижности.
Иммобилизация на твердых носителях резко препятствует межмолекулярным процессам инактивации, в частности агрегации и автолизу.
В последнее время разработан метод реактивации денатурированных ферментов. Денатурированный белок, как правило, находится в промежуточном состоянии между полностью статистическим клубком и глобулой, так как часть внутримолекулярных связей, например дисульфидных связей –S–S– , при тепловой инактивации сохраняется. Если такую молекулу фермента полностью развернуть (а это достигается действием сильных, но обратных денатуратов, таких как мочевина или гуанидин, в сочетании с восстановителями типа дитиотреитола, восстанавливающими связи –S–S–до –SH), а затем дать ей возможность медленно свернуться (убрав денатураты и заменив восстановитель на окислитель, обычно кислород воздуха), то об-? разуется вновь активная молекула, т. е. восстанавливается исходная конформация глобулы.
Разработанными приемами можно достичь стабилизации ферментов в сотни, тысячи и даже миллионы раз. При помощи такой технологии можно увеличить время жизни фермента при 60–70 °С от нескольких минут до месяцев, что очень важно для практики.
В настоящее время ведется интенсивный поиск и культивирование микроорганизмов, живущих в горячих источниках Камчатки при температурах 60–70 °С (и даже до 110 °С), а также выделение из них ферментов.
Иммобилизуют не только выделенные ферменты, но и целые клетки микроорганизмов. Чаще всего их включают в полиакриламидный гель, либо в гель каррагинана – полисахарида из морских водорослей. Использование клеток по сравнению с выделенными ферментами имеет ряд преимуществ. Процесс обходится значительно дешевле, кроме того, ферменты в клетках намного стабильнее, чем в выделенном состоянии. К недостаткам применения клеток относится очень низкая проницаемость клеточных оболочек для субстратов.
Применение ферментов
1. Получение амино- и оксикислот. Химический синтез всех аминокислот – давно решенная и не очень сложная задача. Однако химические методы дают всегда рацемическую смесь аминокислот и, в связи с этим необходима дополнительная стадия разделения энантиомеров. Чисто химически это сделать очень трудно. В то же время ферменты способны «узнавать», а значит, и по-разному реагировать на L- и D-формы аминокислот или их производные. Преимущественное расщепление одного изэнантиомеров под действием ферментов настолько предпочтительно, что, как правило, они быстро реагируют с L-изомером, совершенно не затрагивая D-изомер. Это обстоятельство, т. е. энантиоселективность, и было положено в основу ферментативного разделения рацемических смесей аминокислот.
Промышленный процесс выглядит следующим образом. Исходными веществами служат модифицированные по аминогруппе 0,Ь-аминокислоты (такобозначается рацемическая смесь), полученные в процессе химического синтеза. На эту смесь воздействуют иммобилизованной аминоацилазой. Фермент гидролизует амидную связь только у L-изомера. В результате образуется свободная L-аминокислота, обладающая более высокой растворимостью, чем ацильное производное. Образовавшуюся смесь свободной L-аминокислоты и ацилированной D-аминокислоты разделяют простыми физическими методами, пользуясь их различной растворимостью. Оставшийся после разделения D-изомер рацемизируют при повышенной температуре, т. е. превращают в исходную 0,Ь-смесь, и снова пускают в реакцию с ацилазой. В итоге добиваются высокой концентрации L-аминокислоты. Фермент аминоацилаза мало чувствителен к типу аминокислоты, и поэтому одна установка с иммобилизованным ферментом может использоваться для получения самых разнообразных L-аминокислот.
Иммобилизацию аминоацилазы проводят адсорбированием на специально подобранном полимерном носителе. Когда активность аминоацилазы падает, в реактор добавляют свежую порцию фермента, которая тут же адсорбируется на носителе.
Введены в производство или находятся в стадии полупромышленной и лабораторной разработки процессы ферментативного получения L-аспарагиновой кислоты, L-тирозина, ДОФА (L-диоксифенилаланин – лекарство от болезней Паркинсона), L-триптофана, L– лизина, D,α – аминофенилуксусной кислоты. В этом технологическом процессе участвуют следующие ферменты: аспартаза, тирозинфеноллиаза, тирозиназа, триптофаназа, а-аминокапролактамгидролаза, гидантоиназа и другие ферменты. Главная проблема, встречающаяся здесь, – это регенерация кофакторов, которые нужны для прохождения большинства этих ферментативных реакций.
Наиболее успешно эта энзимологическая технология используется в синтезе органических кислот, например, L-яблочной кислоты, которая широко применяется как заменитель лимонной кислоты в пищевой промышленности. Химически может быть получена только рацемическая 0,Ь-яблочная кислота. В то же время чистую L-яблочную кислоту можно получать по реакции гидратации фумаровой кислоты в присутствии фумаразы. В качестве катализатора используют клетки микроорганизмов, иммобилизованные в геле каррагинана.
2. Превращение углеводов. В 70-х годах в производстве стали применять фермент глюкозоизомеразу, которая катализирует взаимопревращения глюкозы и фруктозы:
Глюкоза ⇄ Фруктоза
Процесс проходит следующим образом. В колонку высотой до 5 м загружают иммобилизованный фермент в виде гранул и затем непрерывным потоком пускают водный раствор глюкозы. На выходе получают так называемый глюкозо-фруктозный сироп. Этот сироп можно использовать непосредственно или же, отделив фруктозу, вновь изо-» меризовать оставшуюся глюкозу до смеси фруктозы и глюкозы и т. д, Прежде глюкозо-фруктозный сироп получали в результате гидролизе сахарозы под действием фермента инвертазы. Фруктозу применяю! для лечения больных сахарным диабетом, так как ее превращения в организме человека не связаны с наличием инсулина.
С помощью другого фермента – лактазы получают безлаюгозное молоко, предназначенное для людей, в организме которых лактаза отсутствует.
В последнее время потребление сахара возросло настолько, что его природные источники оказываются недостаточными. Это заставляет интенсивнее использовать другие источники глюкозы – высокомолекулярные углеводы крахмал и целлюлозу. Промышленная переработка крахмала идет под действием двух ферментов: а-амилазы и глюкоамилазы, катализирующих его гидролиз до глюкозы. Еще более мощный источник глюкозы – целлюлоза. Гидролиз целлюлозы до глюкозы идет под действием ферментов, называемых целлюлозами.
3. Модификация β-лактамных антибиотиков. В этой области производства весьма перспективен метод ферментативного катализа реакции гидратации бензинпенициллина до образования 6-АПК (6-аминопенициллиновой кислоты), под действием пенициллинамидазы:
Бензилпенициллин + Н2O ⇄ 6-АПК + Фенилуксусная кислота
Фермент пенициллинамидаза по механизму гидролиза близок х химотрипсину, легко включается в полиакриламидный гель, модифицированный глутаровым альдегидом, и обладает благодаря этому достаточно высокой активностью.
Внедрение этого процесса в практику в последние годы открыло доступ к широкомасштабному производству многих «полусинтетических» пенициллинов, обладающих высокой устойчивостью в кислых средах, высокой активностью по отношению к большому количеству микробов, низкой токсичностью для организма человека, а также устойчивостью к ферменту β-лактамазе, гидролизующему в отличие от пенициллинамидазы лактамное кольцо, что приводит к полной потере антибиотической активности (это очень важно, поскольку многие микробы содержат β-лактамазу).
На этом, однако, возможности инженерно-энзимологических подходов в данной области не исчерпываются. Пенициллинамидазе присуща уникальная специфичность также и по отношению к гидролизу цефалоспоринов: отщепляется только боковая группа, а β-лактамазный цикл остается нетронутым. Это свойство используют для получения 7-АДЦК (7-аминодезацетоксицефалоспорановой кислоты) в реакции гидролиза соответствующего фенилацетатного производного. Таким образом, открывается путь к получению очень перспективных лекарственных средств на основе «полусинтетических» цефалоспоринов.
4. Инженерная энзимология в тяжелом органическом синтезе. Некоторые из рассмотренных процессов, например получение аминокислот и антибиотиков, можно отнести к тонкому органическому синтезу. Рассмотрим некоторые перспективные направления развития инженерной энзимологии для целей тяжелого органического синтеза (крупнотоннажное производство кислот, мономеров, сшивающих агентов и т.д.).
Одно из направлений в этой области – синтез эпоксидов (окислы олефинов) из алкенов при помощи фермента монооксигеназы:
RCH СН2 + 1/202 ⇄ RCHCH2О
В этом процессе используют непосредственно клетки микроорганизмов, содержащих моноокдигеназу, включенную (иммобилизованную), например, в гель. Для ее функционирования необходим кофактор – восстановленный НАД (НАД-Н).
Если в качестве субстрата монооксигеназы использовать не алкен, а алкан, то этот фермент катализирует другую важную реакцию: концевое гидроксилирование углеводорода до первичного спирта
CnH2n + 2+ 1/2О2 ⇄ С n-1 Н2n СН2ОН
Первичные спирты – очень ценные полупродукты для получения различных моющих средств.
Еще один пример потенциально важного крупнотоннажного процесса – ферментативное получение акриламида и акриловой кислоты из акрилонитрила (СН2 = CHCN). Гидролиз нитрильной группы можно проводить и химически, но в довольно жестких условиях. Фермент нитрилгидратаза катализирует эту реакцию при комнатной температуре в нейтральной среде:
СН2= CHCN + Н2O ⇄ CH2CHCONH2
А в присутствии амидазы можно продолжить реакцию до получения акриловой кислоты:
СН2 = CHCONH2 + Н2O ⇄ СН2 = СНСООН + NH3
5. Биоэлектрокатализ. Ферменты, участвующие в биоэлектрокатализе, могут находиться как в растворе, так и в иммобилизованном состоянии прямо на поверхности электрода. К биоэлектрокатализу относят не только системы, в которых фермент ускоряет саму электродную реакцию, но и такие, в которых ферментативной является предшествующая реакция, генерирующая электрохимически активные частицы. К последнему типу реакций относятся реакции окисления глюкозы до глюконовой кислоты с участием глюкозооксидазы и последующее окисление иодид-иона до иода за счет пероксида водорода, выделившегося в пероксидазной реакции.
Ферменты, участвующие непосредственно в катализе электродных процессов (гидрогеназа, лактаза и т. д.), могут быть как растворимыми, так и иммобилизованными на электроде. Очень удачным способом иммобилизации оказалась адсорбция фермента на саже, идущая практически необратимо и почти с полным сохранением его активности.
6. Фотографические материалы на основе ферментов. Еще одна довольно неожиданная область применения иммобилизованных ферментов – создание на их основе фотографических материалов. Принцип ферментативной фотографии, часто называемой «фотоэнзография», основан на том, что подходящий фермент Е превращают в неактивную форму Е", причем обратный переход может быть осуществлен под действием кванта света: Е" ⇄ Е.
Активный фермент может переработать практически сколько угодно молекул субстрата (S) в продукт (Р): S ⇄ Р.Таким образом достигается усиление светового сигнала, так как один квант света генерирует много молекул продукта Р. Если этот продукт будет окрашен, то попадание света на пластинку или пленку, содержащую фермент и субстрат, будет сопровождаться появлением окраски. Ее интенсивность пропорциональна количеству образованной активной формы Е, т.е. интенсивности освещения отдельных участков пленки. Таким образом возникает изображение. Чтобы оно не расплылось, необходимо подобрать субстрат, дающий не только окрашенный, но и нерастворимый продукт. Например, одна из первых и очень удачных систем была основана на реакциях взаимодействия гидрол итического фермента химотрипсина с производными коричной кислоты.Чувствительность фотоэнзографических материалов выше, чем серебряных. Кроме того, они обладают и более высокой разрешающей способностью, так как в них нет зерен, которые формируют изображение в обычной фотографии. Есть у фотоэнзографии и свои трудности. Главная из них – получение фоточувствительных предшественников ферментов, реактивируемых видимым светом (например, та же система на основе производных коричной кислоты работает только в ультрафиолетовой области спектра).
7. Другие области применения и перспективы инженерной энзимолегии. Чтоже касается аналитического применения ферментов, то здесь надо сказать о биолюминесцентных методах анализа, позволяющих определять до 10–14 моль/л АТФ, а также НАД. Они основаны на том, что под действием фермента люциферазы, выделяемой из некоторых светлячков, происходит окисление довольно сложной молекулы люциферина, которое сопровождается испусканием кванта света и гидролизом одной молекулы АТФ. Лучше всех изучен люциферин светляка Luciofa mingrelica, наиболее часто используемого в технологии биолюминесцентного определения АТФ.
Современные приборы позволяют регистрировать излучение совершенно ничтожной интенсивности, и это дает возможность определять очень низкие концентрации АТФ.
Широко внедряются в медицинскую практику методы иммуноферментного анализа (ИФА). Они предназначены для определения низких концентраций разнообразных биологически активных веществ (лекарств, гормонов, иммуноглобулинов, вирусных и бактериальных антигенов, антител к различным антигенам и т. д.) по их иммунохимическим свойствам. Дело в том, что попадание в организм постороннего вещества (антигена) вызывает ответную реакцию – выработку антител, предназначенных для данного антигена, и взаимодействуют с ним в очень низких концентрациях. Этими свойствами иммунной системы и пользуются для создания ИФА (определять можно как антитела, так и антигены).
Одними из основных методов ИФА являются твердофазный метод ELISA (ensyme linked immunosorbent assay) и обладающий более высокой экспрессивностью гомогенный метод EMIT (ensyme multiplay immunotechnic). Последний применяется для быстрого определения отравлений лекарственными и наркотическими средствами.
Еще одна область применения ферментов в медицине – устранение дефицита некоторых ферментов в организме с целью компенсации функциональной недостаточности; удаление уже отмерших денатурированных структур под действием, главным образом, гидролитических ферментов, лизис тромбов и детоксикация организма.
Также ферменты применяются для катализа реакций синтеза кофакторов, необходимых для активации некоторых ферментов. Например, синтез АТФ в реакции диспропорционирования 2 моль АДФ с участием аденилаткиназы (в растениях) или миокиназы (в животных тканях):
2АДФ ⇄ АТФ + АМФ
Из всех рассмотренных процессов инженерной энзимологии, созданных в последнее время, внедрено в практику лишь производств во пищевых продуктов и медицинских препаратов. Такое ограничение современных реальных возможностей инженерной энзимологи^ вызвано, например, сильной конкуренцией со стороны уже существ вующих химических и микробиологических производств, технология! которых за длительный период доведенадо определенного совершенства.

