Ферменты - это высокомолекулярные вещества белковой природы, активность которых зависит от состава и последовательности аминокислот.
Ферменты - функциональные единицы клеточного метаболизма. Действуя в строго определенной последовательности, они катализируют сотни многостадийных реакций, в ходе которых расщепляются молекулы питательных веществ, запасается и преобразуется химическая энергия и из простых молекул-предшественников строятся макромолекулы, входящие в состав клетки. С помощью ферментов обеспечивается гармоничное равновесие между различными метаболическими процессами, необходимыми для поддержания жизнеспособности отдельных клеток и организма в целом.
В настоящее время известно и изучено почти 2000 различных ферментов, многие из которых успешно применяются в медицине, пищевой технологии, перерабатывающей промышленности, бытовой химии и других отраслях народного хозяйства.
Основное внимание в ранний период развития энзимологии было сосредоточено на исследовании ферментов пищеварения (пепсин, трипсин, хи- мотрипсин) и брожения, поэтому именно они наиболее изучены. Сейчас осознана важная роль внутриклеточных ферментов. Современный уровень развития энзимологии характеризуется открытием их новых представителей, которое позволило понять механизм многих фундаментальных жизненных процессов. Знания о закономерностях развития автолитических процессов, например, при переработке промышленных животных значительно пополнились благодаря выделению и изучению свойств внутриклеточных протеиназ (катепсинов) и ферментов, ответственных за двигательную функцию клетки.
Насущной проблемой энзимологии является расшифровка механизма действия ферментов на основе изучения их химического строения, которое обеспечивает исключительно высокую и специфическую каталитическую активность.
По химическому составу различают однокомпонентные ферменты - простые белки, сходные с глобулинами, которые при гидролизе образуют только аминокислоты, и двухкомпонентные, представляющие собой сложные белки, в которых небелковыми компонентами являются нуклеотиды, витамины, металлы и т. д.
Именно благодаря ферментам клеток живого организма осуществляются различные химические превращения, обеспечивающие все процессы жизнедеятельности.
Свое название ферменты получили от латинского слова «fermentum», что означает закваска, перебродивший сахар. Это соответствует первым представлениям о ферментах, которые были получены при изучении брожения (fermentation означает брожение). Синоним термина «ферменты» - энзимы происходит от греческого слова «enzyme», что означает закваска, дрожжи, с помощью которых начали изучать спиртовое брожение.
Структура ферментов. На основе фундаментальных исследований установлено, что все ферменты обладают свойствами белков, причем их каталитическая активность зависит от степени сохранности нативной структуры белка.
Первичная структура ферментов, как известно, представлена последовательностью аминокислот, соединенных в цепь пептидными связями. Первичная структура расшифрована для таких протеолитических ферментов, как трипсиноген, химотрипсиноген, папаин и некоторых микробных протеиназ.
Вторичная структура молекул ферментов регулирует конформацию ее главной цепи. Она возникает в результате образования упорядоченной структуры в виде спирали посредством водородных связей между группами СО - и NH - и встречается в пептидных цепях на отдельных участках.
Под третичной структурой фермента понимают специфическую укладку регулярных и аморфных участков полипептидных цепей в глобулу. При этом углеводородные радикалы, направленные наружу по отношению к оси спирали, образуют гидрофобное ядро молекулы фермента.
В создании и стабилизации третичной структуры принимают участие все типы химических связей, включая ковалентные. Имеются сведения, что в формировании третичной структуры нередко важную роль играют катионы металлов, например в а-амилазах - это ионы кальция.
Для некоторых ферментов установлена четвертичная структура, которая возникает в результате ассоциации двух или более глобулярных субъединиц с образованием составной или комплексной глобулы (например, папа- ин или а-амилаза Bacillus subtilis).
Классификация ферментов. Современная классификация строится с учетом природы, катализируемой ими реакции. Различают 6 классов ферментов.
- Оксидоредуктазы - катализируют окислительно-восстановительные реакции (дегидрогеназы, электроназы, цитохромы).
- Трансферазы - катализируют перенос отдельных радикалов, частей молекул от одних соединений к другим (фосфотрансферазы, ацетилтрансфе- разы и т. д.).
- Гидролазы — катализируют реакции расщепления сложных органических соединений в присутствии воды (амилазы, протеазы, эстеразы, пектиназы, изомеразы, оксидазы, липазы и др.).
- Лиазы — катализируют реакции отщепления от субстратов определенных групп с образованием двойных связей или присоединением отдельных групп по месту двойных связей (например, карбоксилаза).
- Изомеразы - ферменты изомеризации, превращающие органические соединения в их изомеры (фосфогексоизомеразы и пр.)
- Лигазы - катализируют синтез сложных органических соединений из простых (например, карбоксилаза).
Учитывая значение в питании протеолитических ферментов пищеварительного тракта, а также катепсинов мышечной ткани, целесообразно остановиться на них более подробно. Тем более, что при переработке и хранении сырья и продуктов животного происхождения биокаталитические процессы под воздействием экзогенных аналогов различного происхождения в последнее время получили достаточно широкую популярность. Они применяются для интенсификации процессов, биомодификации сырья, улучшения качества продуктов, увеличения их выхода, привлечения нетрадиционных ресурсов при решении проблем экологической безопасности производств.
Согласно современной классификации, протеолитические ферменты относятся к классу гидролаз (III) и образуют подкласс протеаз. Протеазы обычно подразделяют на пептидазы и протеиназы. Однако, четкого разделения по этому признаку нет, так как установлено, что протеиназы (пепсин, трипсин, папаин и др.) гидролизуют пептидные связи не только в белках, но и в различных полипептидах. Позднее это было доказано для целого ряда протеиназ микробного происхождения.
За последние годы значительно изменились представления о протеолитических ферментах. Сейчас выяснено, что одни ферменты для своего действия не нуждаются в присутствии примыкающих концевых карбоксильных или аминных групп, а другим, наоборот, необходимо наличие свободных концевых групп.
Ферменты первой группы (эндопептидазы) могут действовать на центральные участки пептидной цепи и расщеплять молекулы белка на более мелкие фрагменты; небольшие пептиды они расщепляют только в том случае, когда их концевые группы искусственно, химическим путем блокированы.
Ферменты второй группы (экзопептидазы) не могут гидролизовать пептидные связи, находящиеся в середине цепи, и действуют (либо с карбоксильного, либо с аминного конца цепи), отщепляя последовательно одну за другой концевые аминокислоты.
Часто на практике протеолитические ферменты, известные и тем более мало изученные, подразделяют на группы в зависимости от оптимального значения рН действия на субстраты. Как правило, выделяют три группы.
- Щелочные протеиназы, которые стабильны и активно действуют в области рН 5-10, хотя максимальная их активность наблюдается при рН 9,510,5.
- Нейтральные протеиназы с оптимумом рН для протеолиза около 7,0.
- Кислые протеиназы - ферменты, активные при рН 2-5.
Протеолитические ферменты синтезируются практически всеми живыми существами. Они распространены в природе и широко используются в промышленной энзимологии. В качестве источника получения протеаз используются животные ткани, растения и клетки микроорганизмов.
Животные ферменты для различных целей получают из собираемого на мясокомбинатах сырья, среди которого наибольший интерес представляют поджелудочная железа и слизистая оболочка желудков и сычугов убойных животных (свиней и крупного рогатого скота). Эти ткани секретируют внеклеточные ферменты, из которых получают кристаллические медицинские и технические препараты пепсина, трипсина, химотрипсина, панкреатина, коллагеназы и эластазы. В технологии переработки мяса огромную роль играют внутриклеточные протеолитические ферменты, называемые катепсина- ми, локализованные в клеточных органеллах - лизосомах.
Из растений промышленный интерес представляют плоды дынного дерева, побеги и листья инжира и отходы переработки ананасов. Технология получения ферментных препаратов из растительного сырья отработана за рубежом, в странах, где успешно экспортируются препараты соответствующих протеолитических ферментов (папаин, фицин, бромелаин) различной степени чистоты.
Наиболее перспективным источником получения различных протеаз следует признать микроорганизмы, по ряду существенных преимуществ, связанных с неограниченностью источников, возможностью широко варьировать свойствами и методами селекции, генетической инженерии и подбором условий биосинтеза; широким спектром ферментных комплексов и глубиной воздействия на различные субстраты, включая труднодоступные, а также простотой и относительной дешевизной технологии.
Продуценты протеолитических ферментов обнаружены среди самых различных групп микроорганизмов: бактерий (Bacillus, Micrococcus, Pseudomonos), микромицетов (Aspergillus, Rhizopus, Penicillium), актиномицетов (Streptomyces, Actinomyces). На их основе у нас в стране и за рубежом создано крупнотоннажное производство ферментных препаратов протеолитического действия.
Ферментные препараты животного происхождения. Секрет поджелудочной железы и слизистые оболочки сычугов, желудков, кишечного тракта содержат сложный набор гидролитических ферментов, в том числе протеаз. Практически все животные протеазы синтезируются тканями в виде неактивных предшественников - зимогенов и превращаются в активные ферменты уже в самих секретах. В настоящее время эти ферменты получены в кристаллическом виде и достаточно изучены. Трипсин, пепсин пищевой свиной или говяжий вырабатываются мясной промышленностью. Однако, трипсин не нашел практического применения вследствие его низкого температурного оптимума и преимущественного воздействия на мышечные белки.
Трипсин. Кристаллический трипсин впервые получен Дж. Х. Нортро- пом в 1931 году путем насыщения раствора белка коммерческого препарата трипсина. Трипсин имеет оптимум активности в интервале рН от 7,0 до 9,0 при температуре 500С. Относительная молекулярная масса бычьего трипсина 23800. Первичная структура бычьего трипсина состоит из 229 аминокислотных остатков, соединенных пептидными связями. Трипсин гидролизует связи, в которых карбоксильные группы принадлежат основным аминокислотам - лизину или аргинину. Трипсин не способен гидролизовать эластин и коллаген. Его используют, в основном, для обработки сырья, имеющего грубую структуру мышечных волокон.
Пепсин - фермент слизистой оболочки желудков свиней и сычугов крупного рогатого скота, впервые получен Дж. Нортропом в 1929-1930 гг. Препараты кристаллического пепсина не отличаются высокой степенью однородности, что связано с наличием в слизистой желудка нескольких форм пепсиногена (неактивной формы пепсина), а также с самоперевариванием фермента.
Пепсин обнаружен в желудочном соке всех позвоночных.
Активация пепсиногена происходит с помощью соляной кислоты желудочного сока по схеме:
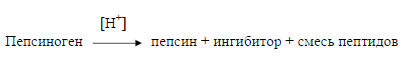
Относительная молекулярная масса пепсина равна 34163. Молекула пепсина имеет 321 аминокислотный остаток. Характерной особенностью аминокислотного состава пепсина является подавляющее преобладание дикарбоновых аминокислот над основными. Изоэлектрическая точка пепсина лежит около рН 1,0. Пепсин гидролизует белки и пептиды, но гораздо медленнее, чем другие протеиназы.
Возможность использования пепсина из-за того, что оптимум его действия при рН 1,5-2,5, ранее не рассматривалась вообще. Однако, позже было установлено, что пепсин имеет второй оптимум протеолитической активности в области значений рН 5,6-5,9. Действие пепсина заключается в его способности инактивировать водородные и дисульфидные связи между полипептидными цепями, что приводит к образованию «открытых» форм белковых молекул мясного сырья. В результате наблюдаются морфологические изменения мышечных, коллагеновых и эластиновых волокон и, как следствие, повышается скорость и равномерность фильтрационно-диффузионного распределения посолочных веществ по объему мяса в процессе его посола.
Коллагеназа - фермент, секретируемый в растущих или подвергающихся метаморфозу тканях земноводных и млекопитающих.
Впервые коллагенолитическая активность коллагеназы была выявлена в хвостовом плавнике головастиков в период метаморфоза, когда в течение нескольких дней происходит резорбция больших количеств коллагена в ткани.
Для определения этой активности маленькие кусочки хвостового плавника в период метаморфоза культивировали на слое коллагеновых волокон. Спустя несколько часов на непрозрачном фоне фиксировали прозрачные зоны, что указывало на высокую активность коллагеназы.
Коллагеназа головастика обладает весьма высокой специфичностью. Этот фермент расщепляет тропоколлаген, как бы делая срез через все три цепи в единственном месте - вблизи аминокислотного остатка 750 в последовательности из 1000 остатков. Два фрагмента, составляющие соответственно ^ и % исходной цепи, при температуре тела спонтанно развертываются и становятся доступными действию других протеолитических ферментов.
Кроме того, коллагеназа выделена из поджелудочной железы млекопитающих, которая имеет специфичность к гидролизу коллагена. Степень гидролиза коллагена достигает 75,0-87,5%.
Коллагеназно-эластазный комплекс получают на мясокомбинатах из экстрактов поджелудочной железы крупного рогатого скота, но из-за ограниченности использования препарат выпускается лишь для медицинских целей. На практике для обработки различных белковых субстратов, в том числе, с высокой массовой долей соединительно-тканных компонентов, применяют ферменты пепсин, трипсин, химотрипсин или комплекс ферментов поджелудочной железы.
Катепсины - тканевые ферменты, локализованные в лизосомах мышечного волокна. При посоле и созревании мяса они незаменимы, но при обработке мясного сырья не используются, так как источник катепсинов - ценнейший пищевой продукт. Однако, закономерности их воздействия на белки мышечной ткани имеют большое практическое значение и должны учитываться при дополнительном внесении ферментов той или иной специфичности. При разработке новых препаратов ферментов, для ускорения процессов созревания мяса, свойства катепсинов принимают за образец для сравнения.
Свойства катепсинов достаточно изучены при традиционном характере автолиза. В последнее время сведения значительно расширены в результате развития теории и практики различных аспектов созревания и посола мяса.
Ферменты, гидролизуюшие концевые участки полипептидных цепей, - катепсины В1, D, Н, L и G. Внутренние участки полипептидов активно расщепляют катепсины А, В2 и С. Очевидно, гетерогенность ферментных комплексов и их специфичность играют решающую роль в характере и глубине изменений мышечных белков при посоле и созревании мяса.
Катепсин В1- тиоловая (цистеиновая) протеиназа с оптимумом действия в области рН 6,0, проявляет более высокую, чем коллагеназа, способность к гидролизу коллагена в кислой зоне рН.
Катепсин D - карбоксильная протеиназа с оптимумом действия в области рН 2,8-4,0 и проявляющая низкую атакующую способность при расщеплении низкомолекулярных пептидов.
Катепсин Н - типичная аминопептидаза, способная гидролизовать белки и производные аминокислот с максимальной скоростью при рН 6,0.
Катепсин L - тиоловая эндопептидаза, локализованная в лизосомальной фракции и максимально расщепляющая белки при рН5,0.
Катепсин А - лизосомальный фермент, карбоксипептидаза, проявляющая максимальную активность по отношению к пептидам при рН 5,6-5,9. По отношению к белкам мяса катепсины А и D проявляют синергизм.
Катепсин В2 — относительно неспецифичная карбоксипептидаза, активируемая сульфгидрильными соединениями; оптимум действия лежит в пределах рН 5,5-5,6. Предполагается, что катепсин В2 осуществляет глубокий гидролиз полипептидных фрагментов, образующихся в результате действия эндопептидаз.
Катепсин С - типичная тиоловая экзопептидаза, максимально расщепляющая полипептиды и их производные при 5,0 - 6,0.
Предполагается, что катепсины L, В, Н и D играют определяющую роль в деградации белков, где важное место отводится катепсину D - ферменту с высокой активностью и широкой субстратной специфичностью, который в комплексе с другими протеиназами инициирует скорость процесса распада белков в лизосомах.
Среди ферментов, обнаруженных в саркоплазме, плазматических мембранах и в миофибриллярных структурах, идентифицированы фракции с протеолитической активностью при рН-оптимуме 7-8. Они инициируются поступлением ионов Са2+ в клетку.
Ферменты растительного происхождения действуют на волокна соединительной ткани, но не на нативный, а на денатурированный при нагревании коллаген. Растительные протеазы сначала разрушают мукополисахариды основного вещества ткани, а затем превращают его волокна в аморфную массу. К наиболее известным следует отнести следующие ферменты: папаин из дынного дерева, фицин из инжира, бромелаин из ананасов, к менее известным — асклепаин из ваточника, мацин из маклюры оранжевой и др.
Папаин представляет собой гетерогенную систему протеиназ, отличающихся молекулярной массой и изоэлектрической точкой, имеет оптимум действия при рН 5-7 и температуре 60-700С, подвергается инактивации при 80-85 °С. Наибольшую активность папаин проявляет в отношении актомиозина. При температуре 60°С хорошо гидролизует не только белки мышечной ткани, но и коллаген и эластин. На нативный коллаген, практически, не действует.
Кристаллы папаина получают из жидкого или сухого латекса дынного дерева. Несколько раз перекристаллизованный папаин ведет себя при электрофорезе как однородное вещество основного характера с изоэлектрической точкой около рН 9. Относительная молекулярная масса равна 20 700.
Фицин - протеолитический фермент, выделенный из плодов, стеблей и листьев тропических растений рода Ficus. Это протеиназа типа папаина, проявляющая активность в широких пределах рН, температурный оптимум активности находится в пределах 60-650С, инактивируется при 80 °С. Оказывает заметное воздействие на мышечную и соединительную ткань. Есть сведения, что фицин способен гидролизовать нативный коллаген, хотя активность его по отношению к этому субстрату, заметно слабее и хорошо проявляется при рН 3,0, резко возрастая при температуре выше 60 °С.
Кристаллы фицина отличаются по форме от кристаллов папаина. Подобно папаину, в акте катализа важную роль играет цистеин. Кроме того, структура молекулы фицина имеет некоторую аналогию с папаином. Относительная молекулярная масса фицина равна 25 000-26 000.
Фицин - единственный представитель группы растительных протеиназ, способный гидролизовать нативный коллаген. Вместе с тем он обладает высокой активностью по отношению к мукополисахаридному комплексу внутримышечной соединительной ткани; рН и температура в наибольшей степени влияют на активность фицина по отношению к коллагену и эластину.
Бромелаин выделен из плодов ананаса и по своему отношению к ингибиторам и активаторам, а также по ряду других свойств близок к папаину. Относительная молекулярная масса бромелаина - около 33 000. Молекула бромелаина содержит 285 аминокислотных остатков и представляет собой одну полипептидную цепь, стабилизированную пятью дисульфидными связями.
Бромелаин - сложный белок, содержащий в качестве небелковой части прочно связанный углеводный компонент. Его активность повышается в присутствии цистеина, цианида, маркаптоэтанола; угнетается веществами, специфически реагирующими с SH-группами.
Кроме белков бромелаин активно гидролизует и некоторые синтетические пептиды.
По способности гидролизовать белки мяса бромелаин напоминает папаин.
Бромелаин проявляет активность в широком диапазоне рН (от 4,5 до 8,5). Он, как и другие растительные ферменты, не способен гидролизовать нативные коллаген и эластин, однако проявляет высокую коллагеназную и эластазную активности при температурах 60°С и выше.
Однако следует подчеркнуть, что протеиназы растительного происхождения, подобно животным, не могут полностью удовлетворять потребности в протеолитических ферментах. В связи с этим будущее принадлежит протеиназам микробного происхождения.
Ферменты микробного происхождения. Многие широко распространенные микроорганизмы секретируют значительные количества протеолитических биокатализаторов в окружающую среду, что значительно облегчает задачу их выделения и очистки. Возможность управления образованием ферментов за счет подбора соответствующей питательной среды и условий культивирования позволяет не только увеличить выход протеолитических ферментов, но и получать ферментные препараты с определенными свойствами. Методы селекции и генной инженерии значительно увеличивают возможности целенаправленного биосинтеза ферментов. Микроорганизмы обладают способностью вырабатывать ферменты, уникальные по своей субстратной специфичности (например, кератиназы, коллагеназы, эластазы). Большое внимание, уделяемое изучению протеолитических ферментов микроорганизмов, привело к получению значительного числа препаратов бактериальных и грибных протеиназ в высокоочищенном состоянии.
Производство протеолитических препаратов организовано на основе микроскопических грибов родов Aspergillus и Rhizopus при поверхностном культивировании продуцентов, а также на основе бактерий Bacillus (subtilis, mesentericus, licheniformis, cereus и др.) при глубинном культивировании.
Семейство субтилиновых (на основе бактерий Bacillus) протеиназ относится к группе сериновых и характеризуется свойствами, близкими к хи- мотрипсину, трипсину, проявляя аналогичные действия на мясные белки. Известные стрептококковые протеиназы относятся к группе тиоловых, или, как их еще называют, «цистеиновых», к которой принадлежат папаин, фицин, бромелаин.
Наибольший интерес для обработки мясного сырья представляют различные коллагеназы. Продуценты этих ферментов были обнаружены среди обширного представительства (Actinomyces rimosus, Streptomyces griseus, Actinomyces fradiae 119 и др.), на основе некоторых разработаны бактериальные препараты протелин и проназа, специфичные к гидролизу тропоколлагена с образованием мономеров.
Изучены протеолитические ферменты, полученные из бактерий рода Bacillus. Определенный интерес представляют грибные коллагеназы, например, из Aspergillus.
Активное воздействие на коллагенсодержащее сырье установлено на примере ферментов, полученных из грибов рода Penicillium.
Экзогенные протеолитические ферменты, частично гидролизуя пептидные связи, способствуют повышению растворимости белков актомиозинового комплекса и увеличению продуктов их расщепления. Внесение ферментных препаратов в сырье в процессе посола мяса улучшает консистенцию готового продукта и облегчает атакуемость его белков ферментами желудочнокишечного тракта человека. Ферментативный гидролиз белков мясного сырья сопровождается деструктивными изменениями мышечных волокон, разрыхлением соединительно - тканных прослоек, что повышает качество готовых продуктов. Эффективность этого процесса зависит от температуры, концентрации вводимых растворов, рН среды и продолжительности воздействия на мясную систему. При этом может наблюдаться различная глубина протеолиза. Поверхностный протеолиз, при котором происходит частичная деструкция белковых молекул, приводит к росту содержания свободных аминокислот и сопровождается некоторым улучшением консистенции мяса при полной сохранности нативной макроструктуры. Глубокий протеолиз мяса выражается в деструкции всех четырех структурных уровней макромолекул белка, при этом резко увеличивается количество свободных аминокислот (до 20-30 % от общего их содержания в белке). Мясо сильно размягчается, практически полностью изменяя свою исходную структуру. С учетом этого факта, все более перспективным представляется ферментативная модификация мясного сырья с высоким содержанием соединительной ткани.

