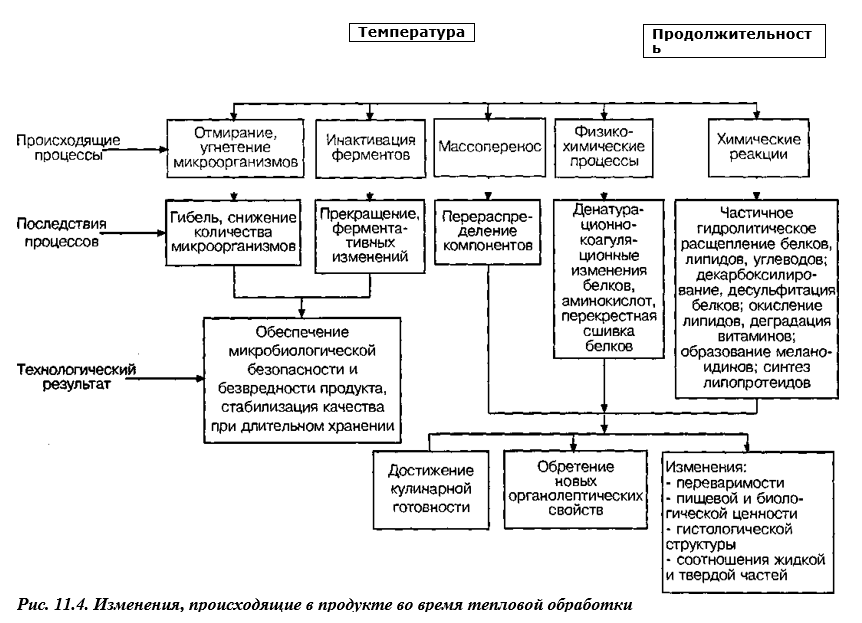
В процессе тепловой обработки в сырье и мясопродуктах происходят сложные изменения, связанные с проникновением теплоты в продукт и неоднозначно отражающиеся на качестве готового продукта (рис. 11.4).
Глубина этих изменений, зависит главным образом от достигаемой внутри продукта температуры, длительности и способа нагрева, наличия воды в самом продукте или в греющей среде и т. д.
Белки. Наиболее значительное влияние на продукт оказывают превращения белков — основной составляющей тканей мяса.
Изменения белков мяса носят разнонаправленный характер и зависят от температуры нагрева, его продолжительности, вида белка и т. п.
Белки животного происхождения термолабильны: их денатурация начинается при 40 °С и быстро возрастает с повышением температуры. В основном процесс денатурации большей части мышечных белков завершается при температурах 68-70 °С, а при 80 °С мышечные белки денатурируют практически полностью.
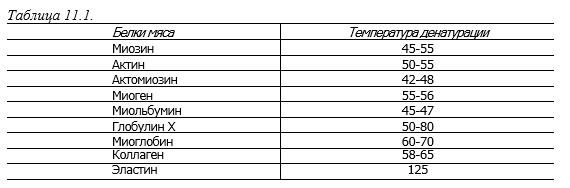
Температура денатурации основных белков мяса показана в табл. 11.1.
При температурах 65 68 °С белки теряют свои специфические биологические свойства, в том числе ферментативную активность.
В результате термоденатурации изменяется растворимость, степень гидратации и уровень эмульгирующей способности белков, их состояние, характер связей.
Изменения миофибриллярных белков протекают ступенчато, соответственно температурным интервалам. В диапазоне температур 52-70 °С наблюдаются собственно денатурационные изменения. Они сопровождаются разрывом части водородных связей и дезориентацией полипептидных цепочек. Глобулярные белки развертываются и по структуре приближаются к фибриллярным.
Для разрыва водородных связей и развертывания цепей необходимо присутствие воды, проникающей в пространства между складками цепей. В отсутствие воды нагрев даже выше 100 °С не вызывает денатурации.
Степень разрушения водородных связей, удерживающих полипептидные цепочки в молекуле белка, зависит от температуры и длительности нагрева.
На первой стадии тепловая денатурация белков обратима. Дальнейшее повышение температуры вызывает увеличение скорости движения воды, что приводит к дегидратации полярных групп боковых цепей белковой молекулы, вследствие чего становится возможным непосредственный контакт между ними. Это сопровождается ослаблением и частичным нарушением вторичных связей, обусловленных силами молекулярного взаимодействия. Природная конформация белковой молекулы исчезает. Раскручивание белковых цепей и их большее обводнение приводит к разрыхлению структуры и размягчению мяса.
Повышение температуры до 70-80 °С и некоторая выдержка при данной температуре сопровождается превалированием коагуляционных процессов над денатурационными. Это происходит в результате вторичного образования межмолекулярных мостиковых связей между пептидными цепями в белковой молекуле (рис. 11.5). Гидратация белков уменьшается.
Денатурированные белковые частицы переходят, как правило, из состояния золя в нерастворимый коагулянт за счет образования агрегатов молекул, что сопровождается выделением влаги и увеличением жесткости мяса.
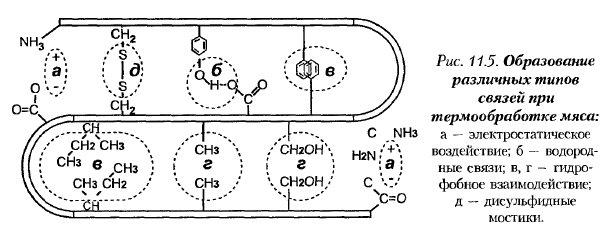
Денатурирующее действие тепла зависит от условий, в которых происходит нагрев. Устойчивость большинства животных белков минимальна при значениях pH, близких к изоэлектрической точке. Нейтральные соли щелочных металлов (например, хлористый натрий) повышают устойчивость белков к тепловой денатурации.
Нагрев при температурах стерилизации вызывает дальнейший гидролиз белков с образованием пептидов, низкомолекулярных пептидов, свободных аминокислот и азотистых оснований. Во время стерилизации развиваются процессы дезаминирования аминокислот, декарбоксилирования и десульфитации белковых веществ с образованием конечных продуктов распада — аммиака, углекислого газа, сероводорода.
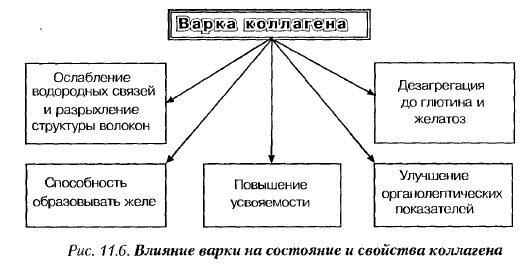
Белки соединительной ткани, как указывалось ранее, при тепловой обработке подвергаются существенным изменениям. В зависимости от разновидности соединительной ткани, коллаген при нагревании до 58-62 °С во влажном состоянии сваривается, что сопровождается деформацией коллагеновых волокон и снижением прочности (примерно в 5-6 раз), а также повышением усвояемости. При продолжительном нагреве сваренный коллаген дезагрегируется с образованием глютина и высокомолекулярных пептидов.
Чем выше температура, больше степень измельчения и продолжительнее нагрев, тем больше образуется низкомолекулярных продуктов дезагрегации коллагена и глубже выражены изменения его состояния (рис. 11.6). Полный гидролиз коллагена происходит при его нагреве в течение 3 ч при температуре 120 °С.
Структурные изменения коллагена при тепловой обработке мяса имеют положительное значение, т.к. им сопутствуют уменьшение жесткости мяса, увеличение выхода. Трансформация коллагена играет существенную роль в структурообразовании мясных продуктов, поскольку после охлаждения он способен образовывать желе. Сваренный коллаген и продукты его распада лучше усваиваются в организме, чем сам коллаген.
Липиды. Тепловая обработка тканей, содержащих жир, вызывает разрушение жировых клеток, плавление и коалесценцию жира.
При длительном нагреве в условиях контакта с водой возможны химические изменения жиров: гидролиз и окислительные процессы. Уровень гидролиза жиров с образованием жирных кислот незначителен при умеренном нагреве и несколько повышается при стерилизации (до 20 %).
Во время варки и стерилизации часть липидов переходит в бульон. Низкомолекулярные жирные кислоты, отщепляющиеся при гидролизе, положительно влияют на запах мяса. Однако при длительной термообработке возможно образование оксикислот, которые придают бульону запах осаливания и темный цвет.
Во время стерилизации липиды и продукты их окисления взаимодействуют с белками, образуя комплексы — протеолигшды и липопротеиды. Эти процессы наряду с образованием оксикислот снижают пищевую ценность мясопродуктов.
Витамины, содержащиеся в мясе, имея неодинаковую химическую природу, во время тепловой обработки подвергаются разрушению в разной степени. Из водорастворимых витаминов наименее устойчивые витамины В| и аскорбиновая кислота, из жирорастворимых — витамин Д. Наиболее устойчив витамин А.
Изменение содержания витаминов в мясе при нагревании зависит также от режимов и способов тепловой обработки. Нагрев при умеренных температурах приводит к некоторому снижению витаминной ценности, а при нагреве выше 120 °С степень разрушения витаминов достигает 40—70 %.
Сухой нагрев в контакте с воздухом, например, жарение мясопродуктов, сопровождается интенсивным разрушением всех витаминов, в особенности тех, которые легко окисляются (Е, С).
Ферменты. При нагреве до температуры завершения денатурационных процессов (70 °С) тканевые ферменты мяса утрачивают свою активность.
Инактивация ферментов является одним из важных факторов, определяющих длительность хранения мясопродуктов. В технологической практике эффективность тепловой обработки определяют по степени остаточной активности ферментов (кислой фосфатазы).

