В современном понимании биотехнология – это наука о технологиях создания и использования биологических объектов, способствующих интенсификации производства или получению новых видов продуктов различного назначения на основе методов клеточной и генетической инженерии.
В то же время биотехнологические производства представляют собой сложный комплекс биофизических, биохимических и физико-химических процессов, в котором тесно взаимосвязаны производство и биология. Может быть, даже правильнее называть биотехнологией применение в промышленности биологических систем или процессов.
Человек использовал биотехнологические процессы еще многие тысячи лет назад: люди занимались пивоварением, пекли хлеб; они придумали способы хранения и переработки продуктов путем ферментации (производство сыра, уксуса, соевого соуса), научились делать мыло из жиров, изготавливать простейшие лекарства и перерабатывать отходы.
Однако только разработка новых методов, являющихся основой биотехнологических процессов, позволила улучшить уже имеющиеся процессы и продукты, а также создавать оригинальные способы получения новых, ранее недоступных веществ и осуществлять новые процессы.
Применение научных достижений в биотехнологии тесно связано с фундаментальными исследованиями и осуществляется на самом высоком уровне современной науки, в том числе химии, физики, генетики, биохимии, микробиологии и др.
В наши дни определилась еще одна важная особенность развития отдельных перспективных разделов биотехнологии – необходимость тесного международного сотрудничества специалистов, ученых и технологов. Ярким примером тому служит интернациональность ряда основанных в последние годы крупней πι их международных биотехнологических фирм.
1.1. Основные этапы развития биотехнологии
Дли обозначения наиболее тесно связанных с биологией разнообразных технологий раньше использовали такие наименования, как «прикладная микробиология», «прикладная биохимия», «технология ферментов», «биоинженерия», «прикладная генетика», «прикладная биология».
Наши предки в течение тысячелетий успешно использовали метод микробиологической ферментации для сохранения и улучшения вкуса пищи, производства спиртных напитков. Так, пивоварение до сих пор остается наиболее важной (в денежном исчислении) отраслью биотехнологии: в мире ежегодно производится свыше 1011 л пива на сумму порядка 175 млн долларов. В основе процесса пивоварения лежат реакции обмена веществ, происходящие при росте и размножении некоторых микроорганизмов в анаэробных условиях.
Благодаря трудам Л. Пастера в конце XIX в. были созданы условия для дальнейшего развития прикладной (технической) микробиологии, а также в значительной мере и биотехнологии. Пастер установил, что микроорганизмы играют ключевую роль в процессах брожения, и показал, что в образовании отдельных продуктов участвуют разные их виды. Это послужило основой развития в конце XIX – начале XX в. бродильного производства органических растворителей (ацетона, этанола, бутанола, изопропанола) и других химических веществ, где использовались разнообразные виды микроорганизмов.
Процессы, в которых биомасса, т. е. возобновляемый источник сырья, используется для получения химических веществ, играли ведущую роль на первом этапе развития современной биотехнологии. По мере становления нефтехимии на смену многим из них пришли химические процессы. В тех случаях, когда некоторые химические соединения (например, цитрат, ацетат и итаконат) широко применяли мри производстве пищевых продуктов, их продолжали получать и путем брожения – самым выгодным с экономической точки зрения. В некоторых странах (например, в Италии) таким способом вырабатывали даже технический этиловый спирт. Сегодня под влиянием энергетического кризиса производство спирта из растительного сырья получает все более широкое распространение в США, Бразилии и других странах.
Следующим важным этапом в развитии биотехнологии хозяйственно ценных веществ была организация промышленного производства антибиотиков, основой которого стало открытие в 1940 г. А. Флемингом, X. Флори и Э. Чейном химиотерапевтической активности пенициллина. Сегодня годовой оборот этой отрасли составляет около 3,5 млрд долларов.
Как получение химических соединений и пищевых добавок путем брожения, так и синтез антибиотиков всегда велись в асептических условиях, но некоторые современные процессы (например, образование белка одноклеточными организмами) осуществляют в еще более жестком режиме. Обеспечение таких особых условий – многоплановая задача, и она решается инженерами-химиками и микробиологами.
Вместе с тем переработка отходов, например, не требует стерильных условий; напротив, чем больше разных микроорганизмов принимает участие в процессе, тем лучше. В наше время все более широко применяют переработку стоков в анаэробных условиях смешанной микрофлорой, в результате чего попутно образуется биогаз (он состоит в основном из метана и CO2). Этот способ энергетически высокоэффективен, позволяет сохранять и концентрировать энергию, содержащуюся в различных компонентах стоков (с газом регенерируется более 80 % свободной энергии), а в сельской местности с его помощью можно получать значительную часть столь необходимой энергии. Так, в Китае построено более 18 млн генераторов биогаза. В развитых странах с высоким потреблением энергии превращение отходов в биогаз может покрыть лишь несколько процентов их энергетических потребностей. На отдельных крупных заводах по переработке отходов биогаз часто сжигают в тепловых машинах, которые приводят в действие электрогенераторы. В последние годы созданы также небольшие установки, предназначенные для переработки отходов сельского хозяйства.
Таблица 1. Направления биотехнологии и получаемые с ее помощью продукты
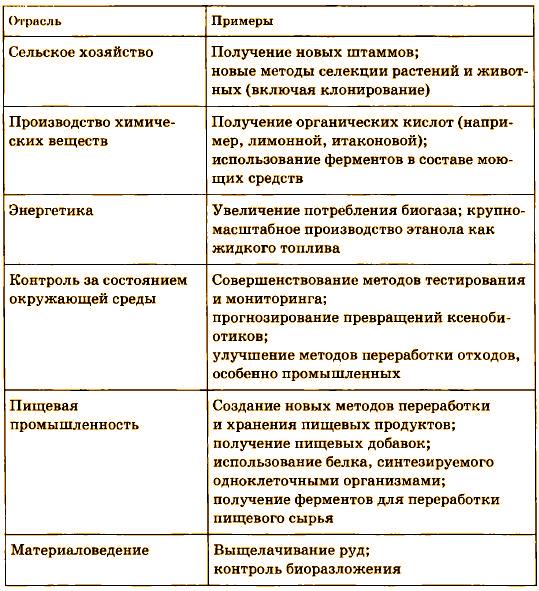
Широкое распространение получило производство аминокислот в аэробных микробиологических процессах. В основном это глутамат натрия (ежегодное производство в мире – около 150 тыс. т), который является усилителем вкуса, и лизин (ежегодное производство в мире – 15 тыс· т), который служит пищевой добавкой. За год в мире продается аминокислот на сумму 1,75 млрд долларов, причем большую часть поставляют японские фирмы.
В промышленных масштабах уже в течение многих десятилетий используется способность микроорганизмов превращать растительную биомассу с низким содержанием белка в пищевые продукты с высоким его содержанием. В Германии в период Первой мировой войны выращивали дрожжи Saccaharomyces Cerevisiaet которые добавляли в колбасу и супы, что компенсировало около 60 % довоенного импорта пищевых продуктов. Во время Второй мировой войны осуществляли сходные процессы, но уже на основе пищевых дрожжей Candida arborea и Candida utilis.
В 1960-х гг. некоторые нефтяные и химические компании начали проводить исследования с целью получения из одноклеточных организмов белка, предназначенного для добавления в пищу людям и животным. В какой-то мере это было связано с недостатком белковой пищи в мире. В качестве субстратов использовали нефть, метан, метанол и крахмал. Наиболее конкурентоспособными оказались процессы на основе метанола и крахмала. Основная масса полученных продуктов предназначалась для добавления в корм животным.
В западных странах компанией ICI был построен самый крупный завод, где в одном ферментере при участии метанолпотребляющей бактерии Methylophilus methylotrophus из метанола получают около 70 тыс. т белка прутина (Pruteen) в год. Модификация механизмов ассимиляции азота этими бактериями, достигнутая с помощью технологии рекомбинантных ДНК, привела к еще большему увеличению выхода продукта. Это стало одним из первых доказательств практической значимости и потенциальных возможностей генетической инженерии.
В России ежегодно производится более 1 млн т белка одноклеточных водорослей, в основном из углеводородов и отходов растениеводства.
Возрастает интерес к применению ферментов в медицинской промышленности (главным образом для диагностики), хотя в целом их использование остается сравнительно небольшим. Это обусловлено нестабильностью ферментов, сложностью выделения продуктов переработки и проблемами, связанными с добавлением или заменой кофакторов.
Однако в некоторых случаях эти сложности удается обойти путем использования интактных (целых) клеток микроорганизмов. Такой способ применили при крупномасштабном производстве лекарственных препаратов стероидной природы. Было установлено, что многие микроорганизмы способны строго направленно и стереоспецифически гидроксилировать сложные молекулы стероидов. Например, плесневый гриб Rhizopus arrhi2us способен стереоспецифически (по 11-му положению) гидроксилировать женский половой гормон прогестерон.
Существенно упростилось производство кортизона, который применяют для лечения артрита. До внедрения нового способа данное соединение получали с помощью химического синтеза, включавшего 37 стадий; при этом выход вещества составлял 0,02 %, а стоимость 1 г достигала 200 долларов. Благодаря введению в процесс получения кортизона этапа биотрансформации, синтез стал проще, а цена препарата составила 68 центов за 1 г.Впоследствии был обнаружен еще ряд микроорганизмов, способных специфически гидроксилировать другие углеродные атомы стероидного кольца. Микробные системы сейчас используют для превращения фитостероидов в С-19-стероидные гормоны с менее громоздкими молекулами. Они находят широкое применение, в частности как пероральные противозачаточные средства.
Освоение методов культивирования растительных и животных клеток в большом объеме повысило эффективность получения вакцин. Разработка метода слияния клеток различных линий позволила получить новые клоны масличных пальм, не только более урожайные, но и дающие продукцию более высокого качества.
1.2. Технологии и биотехнологии
Технология – это способы и приемы, используемые для получения из исходного материала (сырья) некоторого продукта. Очень часто для получения одного продукта требуется не один, а несколько источников сырья, не один способ или прием, а последовательность нескольких. Все многообразие технологий можно подразделить на три основных класса:
- физико-механические технологии;
- химические технологии;
- биотехнологии.
В физико-механических технологиях исходный материал (сырье) в процессе получения продукта меняет форму или агрегатное состояние без изменения своего химического состава (например, технология переработки древесины для производства деревянной мебели, различные методы получения металлических изделий: гвоздей, деталей машин и др.).
В химических технологиях в процессе получения продукта сырье претерпевает изменения химического состава (например, получение полиэтилена из природного газа, спирта – из природного газа или древесины, синтетического каучука – из природного газа).
Биотехнология – это целенаправленное получение ценных для народного хозяйства и человека продуктов за счет биохимической деятельности микроорганизмов, изолированных клеток или их компонентов.
Следовательно, биотехнология предполагает использование таких культур бактерий, клеток животных и растений, метаболизм и биологические возможности которых обеспечивают выработку специфических веществ. Например, в фармацевтической промышленности она охватывает разработку вакцин, синтез гормонов, ферментов, интерферонов, антибиотиков, аминокислот, витаминов, алкалоидов, полисахаридов и других биологически активных веществ (БАВ).
Цель биотехнологических исследований – повышение эффективности производства и поиск биологических систем, с помощью которых можно получить целевой продукт. Однако при использовании природных микробных штаммов выход конечного продукта часто оказывается существенно ниже оптимального.
Возможности биотехнологии значительно изменились с развитием технологии рекомбинантных ДНК. В 1973 г. американские ученые С. Коэн и Г. Бойер разработали стратегию переноса гена из одного организма в другой. Стало возможным не просто отбирать высокопродуктивные штаммы микроорганизмов и эукариотических клеток, но и создавать принципиально новые виды, используя их в качестве «биологических фабрик» по производству различных продуктов: инсулина, интерферонов, интерлейкинов, гормона роста, вирусных антигенов и множества других белков. Это быстродействующий, эффективный, мощный инструмент, обеспечивающий создание организмов с заранее заданными генетическими характеристиками. Технология рекомбинантных ДНК позволяет получать в промышленных масштабах ценные низкомолекулярные вещества и макромолекулы, которые в естественных условиях образуются в минимальных количествах.
Биотехнология дает возможность воспроизводить нужные продукты в неограниченных количествах, применяя новые технологии, позволяющие переносить гены в клетки-продуценты или в целый организм (трансгенные животные и растения), синтезировать пептиды, создавать искусственные вакцины.
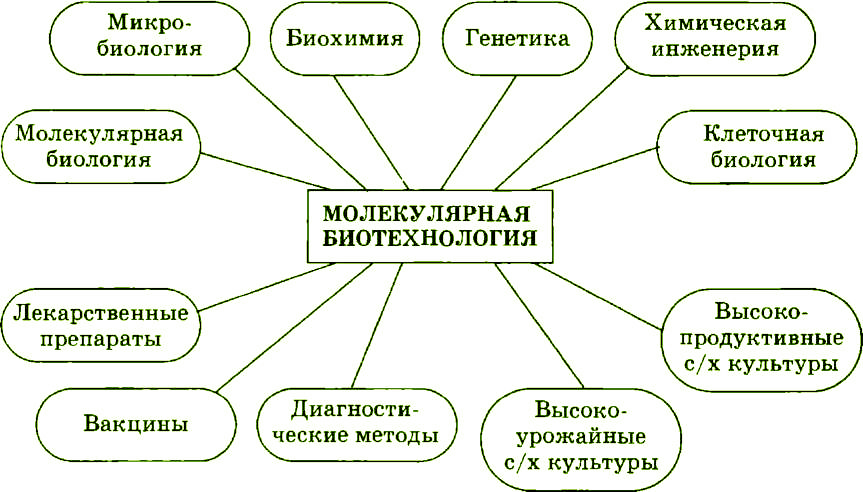
Рис. 1.1. Научные основы и продукты биотехнологии
Все эти основные биотехнологические процессы реализуются на уровне клетки или с участием отдельных клеточных структур. В промышленном масштабе биотехнология представляет собой биоиндустрию (рис. 1.1).
1.3. Основные направления развития биотехнологии
Расширение сфер применения биотехнологии существенно влияет на повышение уровня жизни человека (рис. 1.2). Быстрее всего внедрение биотехнологических процессов дает результаты в медицине, но, по мнению многих специалистов, основной экономический эффект будет получен в сельском хозяйстве и химической промышленности.
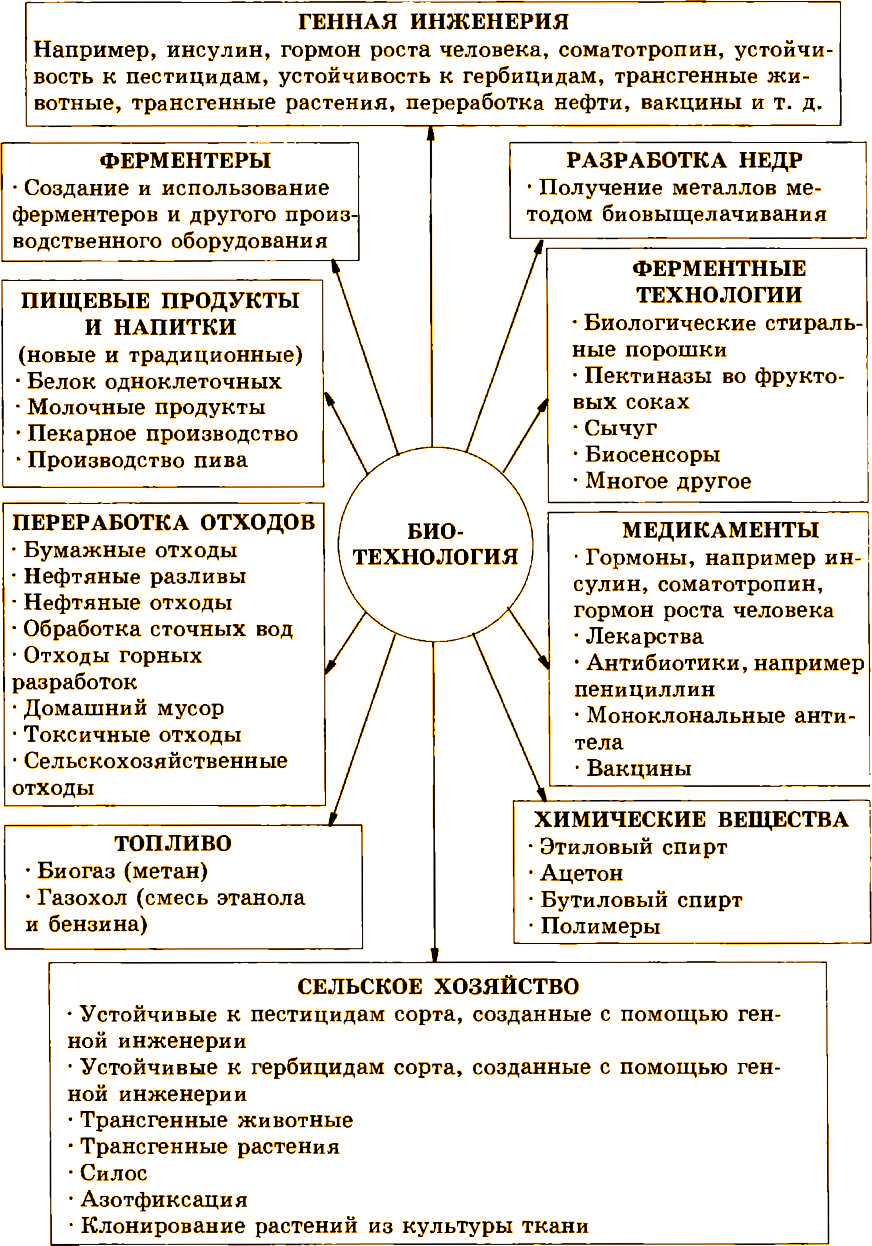
Рис. 1.2. Использование достижений биотехнологии в различных отраслях народного хозяйства
Микрочипы, клеточные культуры, моноклональные антитела и белковая инженерия – это лишь небольшая часть современных биотехнологических приемов, используемых на разных стадиях разработки многих видов продукции. Понимание молекулярных основ биологических процессов дает возможность значительно сократить затраты на разработку и подготовку производства определенного продукта, а также повысить его качество. Например, сельскохозяйственные биотехнологические компании, создающие устойчивые к насекомым сорта растений, могут измерять количество защитного белка в клеточной культуре и не тратить ресурсы на выращивание самих растений; фармакологические компании могут использовать клеточные культуры и микрочипы для проверки безопасности и эффективности препаратов, а также для выявления возможных побочных эффектов на ранних стадиях получения лекарственных средств.
Генетически модифицированные животные, в организмах которых происходят процессы, отражающие физиологию различных человеческих заболеваний, обеспечивают ученых вполне адекватными моделями для проверки действия того или иного вещества на организм. Это также позволяет компаниям выявлять наиболее безопасные и эффективные препараты на более ранних стадиях разработки.
Применение биотехнологических приемов может повысить прибыльность производства и за счет сокращения процесса получения продукта. Так, небольшой фрагмент ДНК, используемый учеными исследовательской лаборатории для установления локализации гена в геноме паразита растения, впоследствии может выступить в качестве компонента диагностического набора, выявляющего наличие данного патогена, а моноклональные антитела, синтезированные для идентификации терапевтического белкового агента, в дальнейшем можно использовать для выделения и очистки искомого соединения.
Все это свидетельствует о важном значении биотехнологии и широких возможностях ее применения в различных отраслях народного хозяйства. Какие же направления являются наиболее приоритетными в этой области? Рассмотрим их.
1. Повышение безопасности биотехнологического производства
для человека и окружающей среды.
Требуется создание таких рабочих систем, которые будут функционировать только в строго контролируемых условиях. Например, штаммы кишечной палочки, используемые в биотехнологии, лишены надмембранных структур (оболочек); такие бактерии просто не могут существовать вне лабораторий или вне специальных технологических установок. Повышенной безопасностью обладают и многокомпонентные системы, каждая из которых не способна к самостоятельному существованию.
2. Снижение доли отходов производственной деятельности человека.
Отходами производства называются его побочные продукты, которые не могут использоваться человеком или другими компонентами биосферы и применение которых нерентабельно или сопряжено с каким-то риском. Такие отходы накапливаются в пределах производственных помещений (территорий) или выбрасываются в окружающую среду. Следует стремиться к изменению соотношения «полезный продукт/отходы» в пользу полезного продукта. Этого достигают различными способами. Во-первых, отходам необходимо найти полезное применение. Во-вторых, их можно направить на вторичную переработку, создав замкнутый технологический цикл. И наконец, можно изменить саму рабочую систему так, чтобы уменьшить долю отходов.
3. Снижение энергетических затрат на производство продукта,
т. е. внедрение энергосберегающих технологий.
Принципиальное решение этой проблемы возможно в первую очередь за счет использования возобновляемых источников энергии. Например, годовое потребление энергии ископаемого топлива соизмеримо с объемом чистой валовой продукции всех фотосинтезирующих организмов на Земле. Для трансформации солнечной энергии в формы, доступные для современных силовых установок, создаются (в том числе методами клеточной инженерии) энергетические плантации быстрорастущих растений. Полученная биомасса используется для производства целлюлозы, биотоплива, а также биогумуса. Всесторонние выгоды подобных технологий очевидны. Использование методов клеточной инженерии для постоянного обновления посадочного материала обеспечивает получение в кратчайшие сроки большого количества растений, свободных от вирусов и микоплазм; при этом отпадает необходимость создания маточных плантаций. Снижается нагрузка на естественные насаждения древесных растений (в значительной мере они вырубаются для получения целлюлозы и топлива), уменьшаются потребности в ископаемом топливе (в общем-то, оно является экологически неблагоприятным, поскольку при его сжигании образуются недоокисленные вещества). При использовании биотоплива образуются углекислый газ и водяные пары, которые поступают в атмосферу, а затем вновь связываются растениями на энергетических плантациях.
4. Создание многокомпонентных растительных систем.
Качество сельскохозяйственной продукции значительно ухудшается при применении минеральных удобрений и ядохимикатов, которые наносят колоссальный ущерб природным экосистемам. Преодолеть негативные последствия химизации сельскохозяйственного производства можно различными способами. Прежде всего необходимо отказаться от монокультур, т. е. от использования ограниченного набора биотипов (сортов, пород, штаммов). Недостатки монокультуры были выявлены еще в конце XIX столетия; они очевидны. Во-первых, в монокультуре возрастают конкурентные отношения между выращиваемыми организмами; в то же время монокультура оказывает лишь одностороннее воздействие на конкурирующие организмы (сорняки). Во-вторых, происходит избирательный вынос элементов минерального питания, что ведет к деградации почв. И наконец, монокультура неустойчива к патогенам и вредителям. Поэтому в течение XX в. она поддерживалась за счет исключительно высокой интенсивности производства. Разумеется, использование монокультур интенсивных сортов (пород, штаммов) упрощает разработку технологии производства продукции. Например, с помощью высоких технологий созданы сорта растений, устойчивые к определенному пестициду, который при возделывании именно данных сортов можно применять в высоких дозах. Однако в этом случае возникает вопрос безопасности такой рабочей системы для человека и окружающей среды. Кроме того, рано или поздно появятся расы патогенов (вредителей), устойчивые к данному пестициду.
Следовательно, необходим планомерный переход от монокультуры к многокомпонентным (поликлональным) композициям, включающим разные биотипы культивируемых организмов. Многокомпонентные композиции должны включать оргшшзмы с разным ритмом развития, с различным отношением к динамике физико-химических факторов среды, к конкурентам, патогенам и вредителям. В генетически гетерогенных системах возникают компенсаторные взаимодействия особей с различными генотипами, снижающие уровень внутривидовой конкуренции и автоматически увеличивающие давление культивируемых организмов на конкурирующие организмы других видов (сорняки). По отношению к патогенам и вредителям такая гетерогенная экосистема характеризуется коллективным групповым иммунитетом, который определяется взаимодействием множества структурных и функциональных особенностей отдельных биотипов.
5. Разработка новых препаратов для медицины.
В настоящее время ведутся активные исследования в области медицины: создаются различные типы новых препаратов – целевые и индивидуальные.
Целевые препараты. Основными причинами онкологических заболеваний являются неконтролируемое деление клеток и нарушение процессов апоптоза. Действие препаратов, предназначенных для их устранения, может быть направлено на любую из молекул или клеточных структур, участвующих в этих процессах. Исследования, проведенные в области функциональной геномики, уже предоставили нам информацию о молекулярных изменениях, происходящих в предраковых клетках. На основе полученных данных можно создавать диагностические тесты для выявления молекулярных маркеров, сигнализирующих о начале онкологического процесса до того, как появляются первые видимые нарушения клеток или проявляются симптомы заболевания.
Большинство химиотерапевтических препаратов воздействует на белки, участвующие в процессе деления клетки. К сожалению, при этом погибают не только злокачественные клетки, но часто и нормальные делящиеся клетки организма, такие, как клетки системы кроветворения и волосяных фолликул. Чтобы предупредить появление этого побочного эффекта, некоторые компании начали разработку препаратов, которые останавливали бы клеточные циклы здоровых клеток непосредственно перед введением дозы химиотерапевтического агента.
Индивидуальные препараты. На сегодняшнем этапе развития науки начинается эпоха индивидуализированной медицины, в которой генетические различия пациентов будут учитываться для наиболее эффективного применения лекарств. Используя данные функциональной геномики, можно выявлять генетические варианты, отвечающие за предрасположенность конкретных пациентов к отрицательным побочным эффектам одних препаратов и за восприимчивость – к другим. Такой индивидуальный терапевтический подход, базирующийся на знании генома пациента, получил название фармакогеномики.
У разных людей варьируют скорость и характер протекания заболеваний. Некоторые патологические процессы при переходе из одной фазы в другую оставляют после себя «молекулярные отпечатки». Знание таких молекулярных маркеров позволяет врачам определять степень прогреесирования заболевания и подбирать наиболее подходящую терапию. Препараты, предназначенные для лечения ранних стадий процесса, будут неэффективны при прогрессировании заболевания.
Некоторые болезни также характеризуются разной степенью агрессивности. Например, одни типы рака груди гораздо агрессивнее других и требуют иных терапевтических подходов. Идентификация уникальных молекулярных маркеров различных типов рака позволит специалистам подбирать адекватные методы лечения и корректировать их в каждом конкретном случае в зависимости от обстоятельств.
1.4. Задачи биотехнологии
В современной биотехнологии используются биологические системы всех уровней – от молекулярно-генетического до биогеоценотического (биосферного); при этом создаются принципиально новые биологические системы, не встречающиеся в природе. Биологические системы, применяемые в биотехнологии, вместе с небиологическими компонентами (технологическое оборудование, материалы, системы энергоснабжения, контроля и управления) удобно называть рабочими системами.
Первоочередной задачей, стоящей перед биотехнологией, являются исследования в области разработки и получения:
- новых биологически активных веществ и лекарственных препаратов для медицины (интерферонов, инсулина, гормона роста человека, моноклональных антител и т. д.), повышающих качество жизни людей и позволяющих осуществлять раннюю диагностику и лечение тяжелых заболеваний – сердечно-сосудистых, злокачественных, наследственных, инфекционных, в том числе вирусных;
- микробиологических средств защиты растений от болезней и вредителей;
- бактериальных удобрений и регуляторов роста растений, повышения плодородия почв;
- новых, с заданными свойствами, высокопродуктивных и устойчивых к неблагоприятным факторам внешней среды сортов и гибридов сельскохозяйственных растений, полученных методами генетической и клеточной инженерии;
- ценных кормовых добавок и биологически активных веществ (кормового белка, аминокислот, ферментов, витаминов, ветеринарных препаратов и др.), необходимых для повышения продуктивности животноводства;
- новых методов биоинженерии для эффективной профилактики, диагностики и терапии основных болезней сельскохозяйственных животных;
- новых технологий получения хозяйственно ценных продуктов для использования в пищевой, химической, микробиологической и других отраслях промышленности;
- технологий глубокой и эффективной переработки сельскохозяйственных, промышленных и бытовых отходов; использования сточных вод и газовоздушных выбросов для получения биогаза и высококачественных удобрений; производства дешевых и эффективных энергоносителей (биотоплива).
К основным разделам современной биотехнологии относятся микробиологический синтез, клеточная инженерия, генетическая инженерия.
Микробиологическим синтезом называется синтез самых разнообразных веществ с помощью микроорганизмов. В настоящее время микроорганизмы применяют в различных высоких технологиях: для производства антибиотиков, кормового белка и аминокислот, биологически активных соединений (витаминов, гормонов, ферментов, стимуляторов роста) ит. д. Превращение одних веществ в другие с помощью микроорганизмов называется биоконверсией. При микробиологическом синтезе исходным сырьем служат разнообразные источники углерода (природные углеводороды, органические отходы), минеральные соли и атмосферный азот. В качестве микроорганизмов используют прокариоты (бактерии, актиномицеты) и грибы.
Применяя методы генетической и клеточной инженерии, современная биотехнология осуществляет широкое конструирование генетически модифицированных организмов (ГМО), в том числе микроорганизмов, растений и животных. В дальнейшем предполагается использование ГМО в природных условиях (в сельском хозяйстве, рыбоводстве, для биологической борьбы с вредителями сельского и лесного хозяйства и т. д.). Однако перед генетической инженерией стоит ряд этических и технологических проблем. При выпуске ГМО в окружающую среду они могут взаимодействовать с разнообразными организмами, сообществами и экосистемами конкретных территорий, в то время как процесс и исход таких взаимодействий не всегда поддается прогнозированию. В частности, существует опасность внедрения «искусственных генов» в геном природных организмов в результате скрещивания ГМО и «диких» форм. Из-за возможных непредсказуемых последствий необходимы исследования, направленные на изучение биобезопасности ГМО.
1.5. Биотехнологические основы высоких технологий
Современная биотехнология развивается настолько динамично, что пока невозможно разработать единую классификацию ее компонентов. Лишь в самом грубом приближении (по аналогии с промышленными небиологическими технологиями) можно выделить следующие типы технологий: технологии низкого и высокого уровня, экстенсивные и интенсивные, безотходные, безопасные, ресурсои энергосберегающие, трудоемкие, наукоемкие, прорывные. Современные биотехнологии различных направлений и различных уровней неразрывно связаны между собой в единую научно-производственную систему.
Технологии низкого уровня – это технологии традиционные, в известной мере устаревшие. К таковым относятся технологии биологической очистки сточных вод, получения биотоплива, некоторые виды микробиологического синтеза. Они характеризуются низкой наукоемкостью, т. е. базируются на использовании рабочих систем, полученных методами традиционной селекции. Такие технологии широко используются в традиционном сельскохозяйственном производстве, в частности в растениеводстве.
Технологии низкого уровня с минимальными затратами материальных ресурсов, энергии и человеческого труда называют экстенсивными (например, повышение плодородия почв путем вывоза на поля навоза и торфа, запашки пожнивных остатков и/или сидератов – специально выращенных бобовых растений). Подобные технологии показали свою неэффективность уже в первой половине XX столетия. Так, при их применении продуктивность агроэкосистем мало отличается от продуктивности природных экосистем, что компенсируется расширением площадей сельскохозяйственных угодий: вырубаются леса (древесина используется на топливо, для производства бумаги), распахиваются степи. Вырубка лесов и распашка степей неизбежно сопровождаются эрозией почв, оскудением водных ресурсов.
Более эффективны интенсивные технологии низкого уровня, и в первую очередь технологии внедрения новых сортов растений, пород животных и штаммов микроорганизмов. Качество сортов (пород, штаммов) определяется их повышенной продуктивностью при увеличении затрат человеческого труда, сырьевых и энергетических ресурсов, все более активном внедрении средств механизации, автоматизации и химизации.
Распространение подобных технологий характерно для второй половины XX в. Так, в Великобритании в период с 1950 по 1980 г. удалось увеличить урожайность зерновых в два раза (по 50 % прироста получено соответственно за счет внедрения новых интенсивных сортов и за счет увеличения затрат сырьевых и энергетических ресурсов). В настоящее время в экономически развитых странах на производство одной пищевой калории затрачивается пять – семь калорий ископаемого топлива.
Однако в результате применения интенсивных технологий низкого уровня многократно усиливается локальная нагрузка на природные экосистемы, происходит механическая эрозия почв, возрастает загрязненность их минеральными удобрениями и средствами защиты растений. Увеличивается и глобальная нагрузка на биосферу, в первую очередь за счет выбросов углекислого газа: количество CO2, образующегося при сжигании ископаемого топлива, в несколько раз больше, чем количество CO2, ассимилирующегося в ходе фотосинтеза в агроэкосистемах. Одним из самых существенных недостатков интенсивных технологий является резкое снижение качества продукции (такую продукцию часто называют экологически грязной).
Уже в 1970-е гг. стало ясно, что использование технологий низкого уровня – это тупиковый путь. Выходом из него стало использование прорывных технологий, базирующихся на самых современных достижениях науки и техники. В свое время таковыми стали технологии микробиологического синтеза (например, получение антибиотиков), технологии клеточной инженерии (например, гибридизация соматических клеток и клонирование организмов), технологии генетической инженерии (например, получение векторов переноса ДНК и создание трансгенных организмов).
Прорывные, принципиально новые технологии могут быть опасны для человека и окружающей среды, поскольку последствия их применения непредсказуемы. Внедрение прорывных технологий, как правило, сопровождается появлением новых видов продуктов и новых видов отходов. Любой новый пищевой или промышленный продукт должен проходить всестороннюю проверку на аллергенность, канцерогенность и мутагенность, на совместимость с другими продуктами, на безопасность для окружающей среды и т. д.
На основе прорывных технологий создаются биотехнологии высокого уровня (или просто высокие биотехнологии). В противоположность технологиям низкого уровня, высокие биотехнологии характеризуются высокой наукоемкостью, т. е. использованием систем, полученных самыми современными методами генетики, микробиологии, цитологии, экологии, молекулярной биологии. Материалы, применяемые в высоких биотехнологиях, часто нуждаются в специальной подготовке. Все это требует специального технологического оборудования и высококвалифицированных специалистов, а на современном этапе – автоматизации и компьютеризации производства. Такие технологии используют в сельскохозяйственном производстве, здравоохранении, в различных областях науки, при планировании и проведении природоохранных мероприятий.
Высокие биотехнологии также подразделяют на экстенсивные и интенсивные. Экстенсивные высокие биотехнологии характеризуются относительно низкими затратами сырьевых и энергетических ресурсов. К технологиям подобного типа относится большинство микробиологических производств, технологических процессов по подготовке и переработке промышленного сырья, а также часть производства продукции на основе тканево-клеточных культур. Эти технологии частично интенсифицируются за счет компьютеризации производства.
Интенсивные высокие биотехнологии (в противоположность экстенсивным) реализуются с привлечением специалистов высочайшей квалификации, с использованием уникального оборудования и самых современных материалов. Эти биотехнологии применяют в медицине, а также для создания организмов с заранее заданными свойствами. Нужно отметить, что интенсификация высоких технологий, в отличие от интенсификации технологий низкого уровня, заключается в повышении качества ресурсного и информационного обеспечения.
Технологии разных уровней неразрывно связаны между собой: с одной стороны, высокие технологии базируются на технологиях низкого уровня, для их осуществления требуется определенный ресурсный, энергетический и информационный фундамент, с другой – достижения высоких технологий используются на низших уровнях биотехнологических производств.
Высокие технологии представляют собой величайшее достижение человеческого разума. Однако по ряду параметров они не только не превосходят технологии низкого уровня, но даже и уступают им. В частности, высокие технологии требуют все больших вложений всех видов ресурсов, они не решают проблемы получения экологически чистой продукции, а само биотехнологическое производство может представлять угрозу для человека и окружающей среды.

