Генетическая инженерия – одно из наиболее быстро развивающихся направлений биотехнологии, зародившееся на стыке молекулярной биологии, генетики и биохимии и позволяющее осуществлять всевозможные манипуляции с генами различных организмов.
Впервые о нуклеиновых кислотах сообщил Ф. Мишер в 1869 г. Через 75 лет, в 1944 г., О.Т. Эвери с сотрудниками доказали, что именно молекула ДНК служит хранилищем наследственной информации. Они провели трансформацию невирулентного штамма пневмококка в вирулентный с помощью очищенного препарата дезоксирибонуклеиновой кислоты, выделенной из вирулентных клеток. В 1953 г. Д. Уотсон и Ф. Крик создали модель структуры ДНК, а в 1966 г. М. Ниренберг, С. Очоа и Х.-Г. Корана расшифровали генетический код и выделили ферменты (лигазы и реетриктазы), участвующие в метаболизме нуклеиновых кислот.
Датой основания генетической инженерии считается 1973 год, поскольку в 1972-1973 гг. П. Берг, Г. Бойер и С. Коэн с сотрудниками создали первую рекомбинантную ДНК, содержавшую фрагменты ДНК вируса SV40, бактериофага λ и лактозного оперона E. coli. Через 10 лет после этого были получены трансгенные растения, позднее – трансгенные мыши, а через 20 лет – трансгенные овцы.
4.1. Молекулярные основы генетической инженерии
Генетическая инженерия представляет собой конструирование in vitro функционально активных генетических структур (рекомбинантных ДНК), или, иначе, – создание искусственных генетических программ (академик А.А Баев). По Э.С. Пирузян, генетическая инженерия – это система экспериментальных приемов, позволяющих конструироватьлабораторным путем (в пробирке) искусственные генетические структуры в виде так называемых рекомбинантных, или гибридных, молекул ДНК. Следовательно, основным объектом генетической инженерии является молекула ДНК, в которой яякодировпна вся информация о строении и функционировании любой живой клетки.
ДНК – это полимерная двухцепочечная молекула, построенная по принципу комплементарности (рис. 4.1.), Комплементарноеть обеспечивает, во-первых, стабильность молекулы, во-вторых, точное воспроизведение при построении дочерних цепочек. Мономером ДНК служат четыре типа нуклеотидов, каждый из которых состоит из сахара – дезоксирибозы, фосфатной группы и азотистого основания.
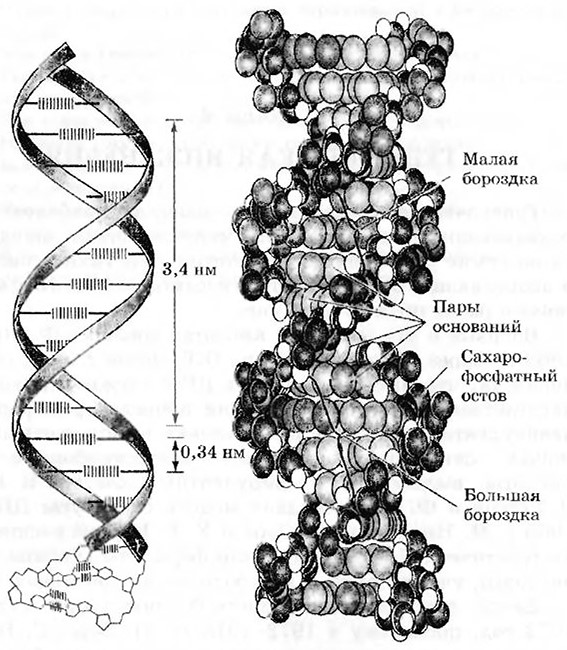
Рис. 4.1. Двойная спираль ДНК
Нуклеотиды различают по азотистым основаниям, которые подразделяют на две группы: пуриновые (аденин и гуанин) и пиримидиновые (цитозин и тимин); в молекулах другой нуклеиновой кислоты – РНК – вместо тимина встречается урацил (рис. 4.2). Между пуриновыми и пиримидиновыми основаниями возникают комплементарные взаимодействия (А – T и Г – Ц), которые удерживают цепочки, состоящие из дезоксирибозы и фосфатной группы, относительно друг друга.
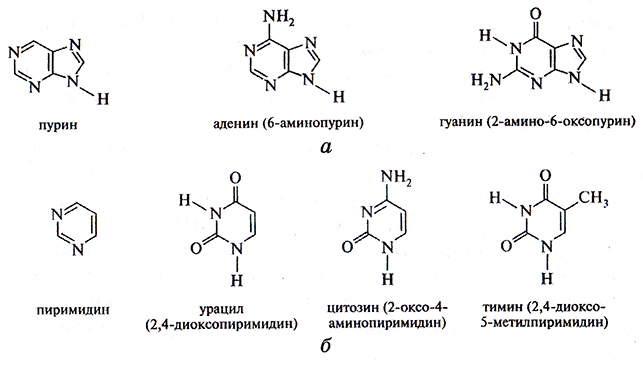
Рис. 4.2. Пуриновые (а) и пиримидиновые (б) азотистые основания
Размер молекулы ДНК измеряется числом пар комплементарных нуклеотидов – от нескольких тысяч пар нуклеотидов (т. п. н.) до миллионов пар нуклеотидов (м. п. н.). У человека длина ДНК, составляющей первую хромосому, составляет 263 м. п. н.
Молекулы ДНК представляют собой генетическую информацию, важной единицей которой являются гены – элементарные носители, кодирующие информацию о синтезе одного определенного продукта. Поэтому каждый ген характеризуется строго определенной последовательностью нуклеотидов. Большая часть генов содержит информацию о строении белков, а некоторые кодируют только определенные молекулы РНК (например, рибосомальную РНК).
Как уже отмечалось, в основе генетической инженерии лежит целенаправленное конструирование искусственных генетических систем вне организма и их введение в живой организм с целью создания нового организма (или модификации существующего). Это предполагает, что часть генов можно с помощью специальных ферментов вырезать из молекулы ДНК одного организма (донорная ДНК) и перенести в другой, реципиентный, организм. Такой перенос генов называется трансгенозом, а организмы, в ДНК которых включены чужеродные гены, носят название трансгенных.
Используемые для переноса генетические конструкции носят название рекомбинантных ДНК. В их состав входят фрагмент донорной ДНК (клонируемая ДНК) и векторная ДНК (вектор, который отвечает за перенесение и встраивание – интеграцию – клонируемой ДНК). Молекулы рекомбинантной ДНК создают для клонирования необходимых участков ДНК, картирования ДНК, создания трансгенных организмов, массового получения продуктов, закодированных данным участком ДНК. Рекомбинантные ДНК становятся составной частью генетического аппарата реципиентного организма и обеспечивают ему новые уникальные генетические, биохимические, а затем и физиологические свойства.
Технология получения рекомбинантных ДНК включает следующие методические подходы:
1. Специфическое расщепление ДНК эндонуклеазами рестрикции, ускоряющее выделение и манипуляции с отдельными генами.
2. Быстрое секвенирование всех нуклеотидов в определенном фрагменте ДНК, что позволяет определить границы гена и кодируемую им аминокислотную последовательность.
3. Конструирование рекомбинантной ДНК.
4. Гибридизация нуклеиновых кислот, позволяющая выявлять с большой точностью и чувствительностью специфические последовательности РНК или ДНК, основанные на их способности связывать комплементарные последовательности нуклеиновых кислот.
5. Клонирование ДНК путем введения ее фрагмента в бактериальную клетку, которая после такой трансформации воспроизводит этот фрагмент в миллионах копий, или амплификация in vitro; создание геномных библиотек.
6. Введение рекомбинантной ДНК в клетки или организмы.
Остановимся на этих технологиях более подробно.
Ферменты
Большинство ферментов выделяют из клеток бактерий и используют для «разрезания» или «сшивания» ДНК как прокариотических, так и эукариотических клеток.
Применяемые при конструировании рекомбинантных ДНК ферменты можно подразделить на несколько групп:
- ферменты, с помощью которых выделяют фрагменты ДНК (рестриктазы);
- ферменты, синтезирующие ДНК на матрице ДНК (ДНК-полимеразы) или РНК (обратные транскриптазы, ревертазы);
- ферменты, соединяющие фрагменты ДНК (лигазы);
- ферменты, изменяющие строение концов фрагментов ДНК.
Рестриктазы (эндонуклеазы рестрикции) – ферменты, с помощью которых выделяют фрагменты ДНК. Эти высокоспецифичные ферменты узнают и расщепляют определенные последовательности азотистых оснований в молекуле ДНК (сайты рестрикции). В генетической инженерии рестриктазы предназначены для вырезания необходимых участков из молекул донорной ДНК.
Рестриктазы выделяют из бактерий, но они также выявлены у дрожжей и одноклеточных водорослей. Номенклатура рестриктаз была предложена в 1973 г. С. Смитом и Д. Натансом. В соответствии с ней названия ферментам дают по тем бактериям, из которых они были выделены. Первая буква названия обозначает род микроорганизма, две следующие – его вид; далее идет порядковый номер данной рестриктазы в ряду других эндонуклеаз, выделенных из данного организма. Например: рестриктазы Ηρα I, Ηρα II – ферменты, выделенные из Haemophilus parainfIuenzae; Eco RI – рестриктаза, выделенная из E. coli. Иногда вставляют еще одну, четвертую, латинскую букву – как указатель штамма бактерий: Hind III – из Haemophilus influenzae. Если защитная система бактериальной клетки (система рестрикции – модификации) локализована в плазмиде, то указывают символ плазмиды – R, например: Eco RI.
Естественной функцией рестриктаз является защита бактерии от чужеродной ДНК (прежде всего от ДНК бактериофагов, которая может проникнуть в клетку и вызвать ее трансформацию). Они ограничивают возможность размножения фаговой ДНК, разрешая ее на части. Фермент рестрикции не может разрешить свою собственную ДНК, так как бактериальная ДНК модифицирована метилированием, осуществляемым ферментом ДНК метилаяой.
Определенные рестриктазы узнают в ДНК последовательности из нескольких (от четырех до восьми) нуклеотидов, осуществляя либо несимметричные, либо симметричные разрывы. При расщеплении молекула ДНК разрезается с образованием так называемых «липких» или «тупыхъ концов (рис. 4.3.). «Липкие» концы образуются, когда разрывы в разных цепочках ДИК прор*сходят со смещением друг относительно друга (рестриктазы Eco RI; Hind III), а «тупые» – когда разрывы в цепочках возникают друг против друга (рестриктазы Taq I; Hpa I; Sma I), В настоящее время выделено свыше 2000 рестриктаз, которые могут узнавать более 150 сайтов рестрикции.
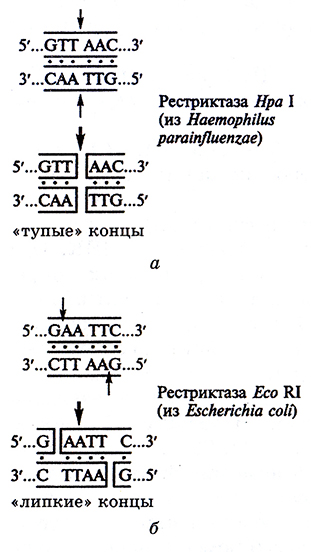
Рис. 4.3. Образование в ДНК
«тупых» (а) и «липких (б) концов
под действием рестриктаз
Обратные транскри птазы, ДНК-полимеразы – ферменты, синтезирующие ДИК на матрице ДНК, В генетической инженерии часто используется ДНК-полимераза I, выделенная А. Корнбергом и сотрудниками в 1958 г. из клеток E. coli. Этот фермент имеет трехдоменную структуру. При удалении N-концевого домена оставшаяся часть молекулы (фрагмент Кленова) сохраняет характерные для нее каталитические свойства. ДНК-полимераза в естественных условиях в клетке играет важную роль в репарации (восстановлении структуры) поврежденной ДНК, осуществляя так называемую ник-трансляцию (ник – разрыв в одной из цепей ДНК).
РНК-зависимая ДНК-полимераза, ревертаза – это ферменты, которые используют для синтеза комплементарной цепи ДНК с мРНК. Впервые их выделили Г. Темин и С. Мизутани в 1970 г. из вируса саркомы Рауса. Полученную двухцепочечную комплементарную молекулу ДНК (кДНК) можно затем встраивать в векторы, размножать в составе гибридных молекул ДНК и использовать для дальнейших исследований. Таким способом можно создавать кДНК-библиотеки. Следует отметить, что молекулы кДНК не содержат интронов, что позволяет клонировать ДНК эукариот в прокариотических системах.
Лигазы – ферменты, которые «сшивают» фрагменты ДНК за счет фосфодиэфирных связей, образующихся между З'-гидроксильной концевой группой одного фрагмента ДНК и 5'-фосфатной группой другого фрагмента.
Из двух типов существующих лигаз для лигирования фрагментов ДНК обычно используют более универсальную лигазу фага Т4, которая может «сшивать» как «липкие», так и «тупые» концы. ДНК-лигазы необходимы в естественных условиях в процессах репарации ДНК и репликации – при удвоении цепи ДНК.
Ферменты, изменяющие строение концов фрагментов ДНК. Например, щелочная фосфатаза отщепляет от линейного фрагмента молекулы ДНК 5'-фосфатные группировки, что значительно снижает количество образующихся случайных, нежелательных комбинаций фрагментов ДНК (в том числе тех, которые могут образоваться под действием ДНК-лигазы). Нуклеаза Bal 31 – это фермент, неспецифически удаляющий нуклеотиды из последовательности ДНК. Он позволяет «подтупить» несимметричные концы ДНК либо укоротить фрагменты ДНК, сближая их функционально значимые элементы.
Определение нуклеоттгдной последовательности (секвенирование) ДНК
Секвенирование позволяет довольно быстро определить полную нуклеотидную последовательность ДНК длиной 100-500 нуклеотидных пар. Это необходимо для выяснения структуры, функций, возможностей рекомбинации и амплификации молекул или фрагментов молекул нуклеиновых кислот.
С помощью ферментов ДНК разделяют на фрагменты и определяют в них позиции нуклеотидов химическим или энзиматическим методом.
Химический метод был предложен в 1976 гА, Максамом и У, Гилбертом (рис. 4.4). Он основан на химической деградации ДНК – специфической химической модификации пуриновых и пиримидиновых оснований с последующими выщеплением модифицированных нуклеотидов из цепи ДНК и анализом образовавшихся продуктов методом гель-электрофореза. Перед началом опыта один из концов фрагмента ДНК метят с помощью изотопа фосфора 32P. Полученные электрофореграммы проявляют с помощью рентгеновской пленки. Таким образом, фракционируя на одной гелевой пластине фрагменты, образовавшиеся после специфического выщепления каждого из четырех нуклеотидов (Α, Τ, Г и Ц), можно непосредственно читать нуклеотидную последовательность секвенируемой ДНК по проявленной электрофореграмме.
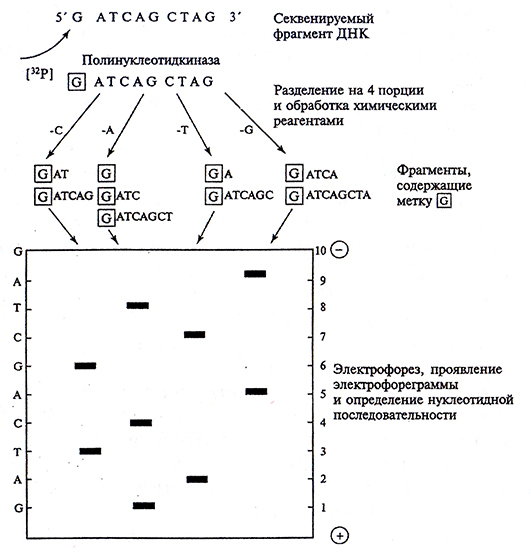
Рис. 4.4. Схема химического метода определения нуклеотидных последовательностей: 1-10 длина (число нуклеотидов) фракционируемых методом электрофореза радиоактивно меченных фрагментов
Энзиматический метод, разработанный М. Сэнгером, основан не на химическом, а на ферментативном подходе. Сэнгер использовал ДНК-полимеразу I (рис. 4.5). Анализируемый фрагмент ДНК используют в качестве матрицы в реакции полимеразного копирования (синтеза комплементарной цепи ДНК) с помощью ДНК-полимеразы I E. coli. Метод получил название «плюс-минус-метод», поскольку реакцию полимеризации в нем изначально проводили либо в отсутствие одного из четырех типов нуклеотидов («минус»-система), либо в присутствии только одного нуклеотида («плюс»-система), что ограничивает возможность наращивания полинуклеотидной цепи, т. е. останавливает (терминирует) ее синтез из-за недостатка соответствующего нуклеотида. Затем для остановки синтеза стали использовать специальные молекулы – терминаторы. Продукты реакций анализируют методом электрофореза, и секвенируемую последовательность считывают с радиоавтографа, так же как при анализе химического секвенирования.
В настоящее время определение точной нуклеотидной последовательности любого фрагмента ДНК вполне разрешимая задача. Уже определены последовательности не только сотен генов прои эукариот, но и геномы многих организмов (более 800). Зная последовательность гена и генетический код, легко определить аминокислотную последовательность кодируемого им белка.
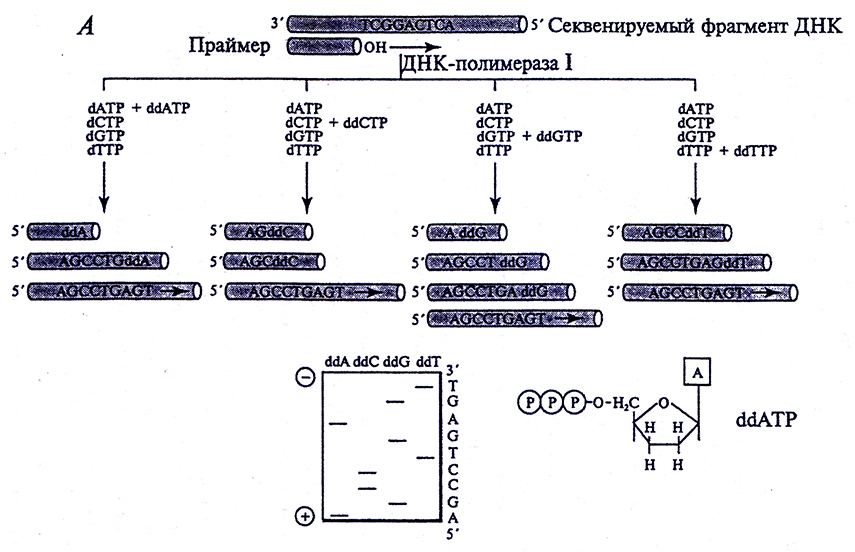
Рис. 4.5. Схема энзиматичоского метода определения нуклеотидтгых последовательностей. Представлена последовательность операций секвенирования и схема радиоавтографа геловой пластины после разделения фрагментов. Для синтеза фрагментов был использован α[32Р]-дезоксиNТР. Приведена структура ddATP
Конструирование фрагментов рекомбинантных ДНК («сшивка»)
Фрагменты рекомбинантных ДНК, полученные после действия рестриктаз и содержащие определенные гены, «сшивают» одним из трех основных методов, в зависимости от того, какие концы имеют фрагменты «сшиваемых» ДНК – «тупые» или «липкие».
«Сшивка» по одноименным «липким» концам. Это наиболее простой и популярный метод (рис. 4.6). Впервые этим методом гибридная ДНК была получена СКоэном с сотрудниками в 1973 г. Любые два фрагмента ДНК (независимо от их происхождения), образовавшиеся под действием одной и той же рестриктазы, дающей фрагменты рестрикции с «липкими» концами, могут «слипаться» за счет образования водородных связей между однонитиевыми участками комплементарных нуклеотидов. Однако после такого спаривания полная целостность двойной спирали не восстановится, поскольку останется два разрыва в фосфодиэфирном остове. Для его восстановления, т. е. «сшивания», или лигирования, нитей, используют ДНК-лигазу бактериофага Т4. Этот фермент в живой клетке выполняет ту же функцию: «сшивание» фрагментов ДНК, синтезирующихся при репликации.
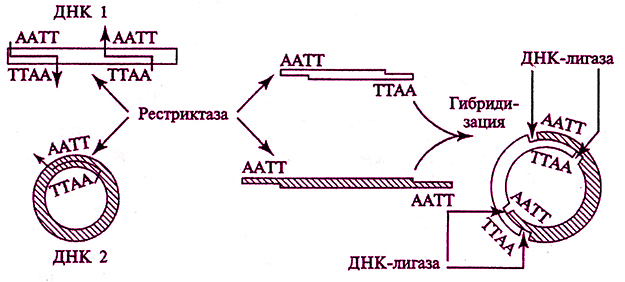
Рис. 4.6. Схема метода получения гибридных молекул ДНК за счет «сшибки» фрагментов по одноименным «липким» концам
«Сшивка» по «тупым» концам. «Тупые» концы можно соединять за счет действия ДНК-лигазы. В этом случае реакция лигирования имеет свои особенности и ее эффективноеть ниже, чем при «сшивке» по «липким» концам. Впервые такие эксперименты были выполнены в 1972 г. П. Бергом в Стэнфордском университете (США). В частности, этот метод используют при клонировании Д ПК-копий матричных РНК, которые доступны в ограниченных количествах.
«Сшивка» фрагментов с равноименными концами. В ситуации, когда необходимо «сшить» фрагменты, образованные разными эндонуклеазами рестрикции и имеющие разные, т. е. некомплементарпые друг другу, «липкие» концы, применяют так называемые линкеры (или «переходники»). Линкеры – это химически синтезированные олигонуклеотиды, представляющие собой сайты рестрикттии или их комбинацию. Впервые эту идею предложил Г. Шеллер с сотрудниками в 1977 г. Существуют большие наборы таких генных «переходников» «Липкие» концы также можно ферментативным путем присоединить к молекулам ДНК с «тупыми» концами. При этом первоначально «достраивают» недостающие фрагменты, чтобы образовались комплементарные «липкие» концы. Далее для ковалентного соединения двух фрагментов попользуют ДНК-лигазу. Поскольку можно формировать достаточно длинные взаимно-комплементарные одноцепочечные концы, гибридные молекулы образуются с высокой эффективностью (рис. 4.7).
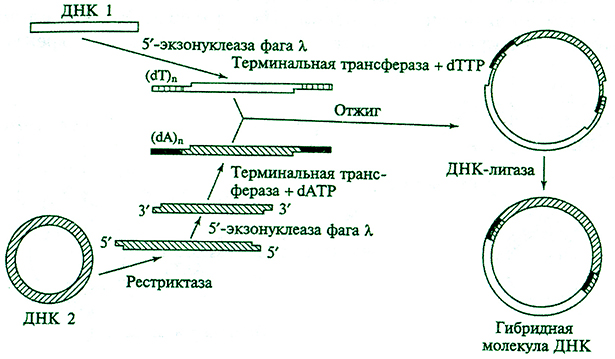
Рис. 4.7. Схема метода получения гибридных молекул ДНК счет «сшивки» фрагментов по разноименным концам
Гибридизация – метод выявления специфических последовательностей нуклеотидов
Реакция гибридизации используется в генетической инженерии для анализа гибридных молекул ДНК как весьма чувствительный метод выявления определенных последовательностей в ДНК и РНК.
Гибридизация основана на способности азотистых оснований образовывать комплементарные пары. Если солевой раствор ДНК нагреть до 100 °C и повысить рН до 13, то ДНК диссоциирует на две отдельные цепи (денатурирует, плавится), так как комплементарные связи между основаниями разрушаются. Этот процесс (его называют ренатурацией или гибридизацией, отжигом) обратим: выдерживание ДНК при температуре 65 °C приводит к восстановлению структуры двойной спирали. Процессы гибридизации происходят между любыми одинарными цепями, если они комплементарны: ДНК – ДНК, РНК – РНК, РНК – ДНК.
Для теста необходимо иметь одноцепочечный фрагмент ДНК, комплементарный той последовательности, которую хотим обнаружить. Этот фрагмент получают либо клонированием, либо путем химического синтеза. Одноцепочечная ДНК, используемая в качестве индикатора, называется ДНК-зондом. Она может содержать от 15 до 1000 нуклеотидов.
Методы клонирования ДНК
Методами клонирования фрагменты ДНК любого вида, полученные с помощью рестриктаз, можно ввести в плазмиду или в бактериофаг, получив таким образом вектор, а затем размножить эти генетические элементы в клетках бактерий или дрожжей, увеличивая их число в миллионы раз.
Методы клонирования ДНК основаны на двух подходах:
- использование бактериальных или дрожжевых клеток для размножения введенной в них чужеродной ДНК (клонирование ДНК in vivo), а также создание банка генов (геномной библиотеки);
- амплификация ДНК in vitro.
Для биотехнологических экспериментов часто необходимо идентифицировать гены, кодирующие определенные структурные белки. Искомые последовательности можно обнаружить и идентифицировать благодаря геномным библиотекам, используя три широко распространенных метода: гибридизацию с меченым ДНК-зондом (ДНК-гибридизация) с последующим радиоавтографическим анализом, иммунологический скрининг, скрининг по активности белка, кодируемого искомым геном.
ДНК-гибридизация состоит в комплементарном спаривании ДНК-мишени и меченого ДНК-зонда. Гибридные молекулы наиболее часто определяют радиоавтографическим методом.
Два других метода предполагают обнаружение ДНК-мишени благодаря продукту ее экспрессии – белку или его части. Присутствие белка обнаруживают иммунологическими методами (иммунологический скрининг) либо по активности белкового продукта, если таковая имеется (скрининг по активности белка).
Получение нужного гена, намеченного для переноса, возможно либо путем выделения его из подходящего генома, либо методами синтеза химическим или ферментативным путем, либо с помощью полимеразной цепной реакции (ПЦР). Часто нужный ген выделяют из банка генов.
Клонирование ДНК in vivo
Чтобы клонировать ДНК in vivo, создают банк генов (библиотеку ДНК), т. е. коллекцию клонов ДНК, включающих все фрагменты генома данного вида. Используя микроорганизмы, можно создавать два типа библиотек ДНК: геномную и клоновую (кДНК).
Геномная библиотека. Первую геномную библиотеку создал Т. Маниатис с сотрудниками в 1978 г. Они использовали ДНК из генома D. melanogaster, которую клонировали в клетках E. coli. Для создания банка генов выделяют всю геномную ДНК, разрезают ее с помощью рестриктаз или методом «дробовика» (ультразвуком) на отдельные фрагменты, присоединяют к плазмидным или вирусным векторам и вводят в реципиентные бактерии для их последующего клонирования.
Многие плазмиды-вектора несут ген устойчивости к антибиотикам, и если в рекомбинантной плазмиде есть такой ген, то трансформированные клетки (колонии) легко выявлять, выращивая их на среде с антибиотиком. Каждая такая колония представляет собой клон, или потомство, одной клетки. Плазмиды одной колонии содержат клон геномной ДНК, а совокупность плазмид, несущих разные участки генома, можно назвать библиотекой геномной ДНК. В таком виде банк можно сохранить.
Недостаток геномных библиотек в том, что фрагменты ДНК образуются в огромном количестве. Разрезание геномной ДНК определяется случаем, поэтому лишь часть фрагментов содержит полноразмерные гены. Некоторые фрагменты могут содержать только часть гена или же интронные последовательности.
Библиотека генов может храниться и использоваться неограниченно долго. В ней содержится вся наследственная информация организма. Банк генов – это не только источник для получения нужного трансгена, но и источник материала для изучения структуры, функции и регуляции индивидуальных генов, структуры и функций белков. С его помощью можно также решить проблему сохранения генофонда исчезающих видов.
Клоповая библиотека генов (кДНК). Помимо геномных, существуют библиотеки кДНК – молекул ДНК, которые являются комплементарными копиями зрелых мРНК, прошедших процессинг; они не содержат интронов. Создание кДНК начинается с синтеза на матрице РНК с помощью обратной транскриптазы комплементарной нити ДНК, Затем создают щелочные условия, разрушают цепь РНК на иуклеотиды, после чего с помощью ДНК-полимеразы синтезируют комплементарную цепь ДНК. При этом образуется фрагмент ДНК с «тупыми» концами. Такую ДНК встраивают в плазмиды и вводят в клетки бактерий. При амплификации плазмиды образуется клон комплементарной копии ДНК (кДНК).
Существенные преимущества библиотеки кДНК заключаются в том, что она представляет собой библиотеку транскрибируемых генов, которая ничем не прерывается, тогда как в геномной библиотеке не обязательно присутствуют только дискретные гены (рестриктазы могут разрезать ДНК и внутри гена).
Кроме того, гены эукариот содержат интроны, которые должны удаляться из транскриптной РНК перед превращением ее в матричную. Этот процесс называется сплайсингом (созревание – удаление последовательностей, не кодирующих белковые продукты). После чего следует сращивание. Бактериальные клетки не могут осуществлять такую модификацию РНК, образовавшуюся путем транскрипции гена эукариотической клетки. Поэтому если преследуется цель получения белка путем экспрессии клонированного гена, то лучше использовать банк кДНК, полученной на основе матричной РНК. Библиотека кДНК отражает спектр генетической активности в клетках, из которых она была выделена. Создание таких библиотек полезно для сравнения генетической активности в клетках разных тканей.
Поиск нужных генов в геномной библиотеке. Одним из методов поиска нужных генов в банке является гибридизация, включающая блоттинг (от англ. blotting – промокание). Блоттинг – это метод перенесения фрагментов нуклеиновых кислот на специальную пленку (мембрану) из нитроцеллюлозы, связывающую (иммобилизующую) эти молекулы.
Саузерн-блоттинг (назван по фамилии предложившего его автора) основан на перемещении фрагментов ДНК благодаря капиллярному эффекту. Процесс переноса фрагментов ДНК, находящихся в агарозном геле, на пленку из нитроцеллюлозы с помощью фильтровальной бумаги похож на промокание.
Анализ проводят в такой последовательности:
- выделенную ДНК разделяют в агарозном геле, где происходит электрофоретическое разделение ее фрагментов по массе и заряду;
- после разделения фрагментов ДНК в агарозном геле его обрабатывают растворами, денатурирующими ДНК (происходит образование одноцепочечных ДНК). Далее гель помещают на фильтровальную бумагу, смоченную концентрированным солевым (буферным) раствором;
- на гель накладывают нитроцеллюлозный фильтр, на который происходит иммобилизация (или адсорбция, или фиксация) одноцепочечных фрагментов ДНК;
- поверх фильтра накладывают стопку листов сухой фильтровальной бумаги, которая обеспечивает медленный ток буферного раствора через гель (т. е. служит своеобразным капиллярным насосом). Солевой раствор, проходя через агарозный гель, увлекает за собой фрагменты ДНК, которые задерживаются нитроцеллюлозой и связываются с ней, а раствор впитывается сухой фильтровальной бумагой;
- фильтр выдерживают в вакууме при температуре 80 °С, в результате чего одноцепочечные фрагменты ДНК необратимо иммобилизуются (фиксируются) на нитроцеллюлозе. При этом расположение полос иммобилизованной ДНК точно соответствует их расположению в геле;
- ДНК, связанную с фильтром, помещают в раствор с меченым ДНК-зондом, в котором происходит гибридизация. Гибридизироваться (образовывать водородные связи) со специфическим зондом будут только комплементарные ему фрагменты ДНК, которые можно обнаружить в виде темных полос на рентгеновской пленке, т. е. на радиоавтографии нитроцеллюлозного фильтра.
Для анализа РНК применяют Нозерн-блот гибридизацию, во многом похожую на Саузерн-блоттинг. В данном случае молекулы РНК, выделенные из клетки, разделяются по размерам с помощью гель-электрофореза, а затем переносятся на фильтр. После гибридизации с меченым одноцепочечным зондом выявляются места гибридизации (гомологии) РНК и зонда. В этом методе в качестве зонда обычно используют фрагменты ДНК.
Амплификация ДНК in vitro
Амплификация – это увеличение числа копий молекул ДНК. В отличие от клонирования ДНК in vivo, которое происходит в клетках прокариот, дрожжей, других эукариотических организмов, амплификация осуществляется вне клетки (in vitro) с помощью химических методов: полимеразной цепной реакции (ПЦР), лигазной цепной реакции, NASBAметода (Nucleic Acid Sequence – Base Amplification).
В 1985 г, К. Мюллис с сотрудниками разработал метод клонирования последовательностей ДНК in Uitrof который получил название полимеразной цепной реакции (ПЦР) (рис. 4.8). Амплификация фрагментов ДНК осуществляется благодаря работе особого фермента Taq-полнмеразы (термостабильная ДНК-пол и мераза из термофильной бактерии Thermas aquaticus) в присутствии четырех типов нуклеотидов и праймеров (коротких цепочек ДНК размером около 20 нуклеотидов, которые выступают в качестве затравок). Процесс циклический, проходит в несколько этапов: термическая денатурация (разделение комплементарных цепей ДНК при температуре 93-95 °С), охлаждение до 60 °С, связывание праймеров с одноцепочечными ДНК, синтез второй нити ДНК с помощью Taq-полимеразы. Повторяя циклы амплификации, можно получать миллионы копий фрагментов ДНК. Таким образом, в процессе рассматриваемой реакции эффективно амплифицируется только та последовательность ДНК, которая ограничена праймерами.
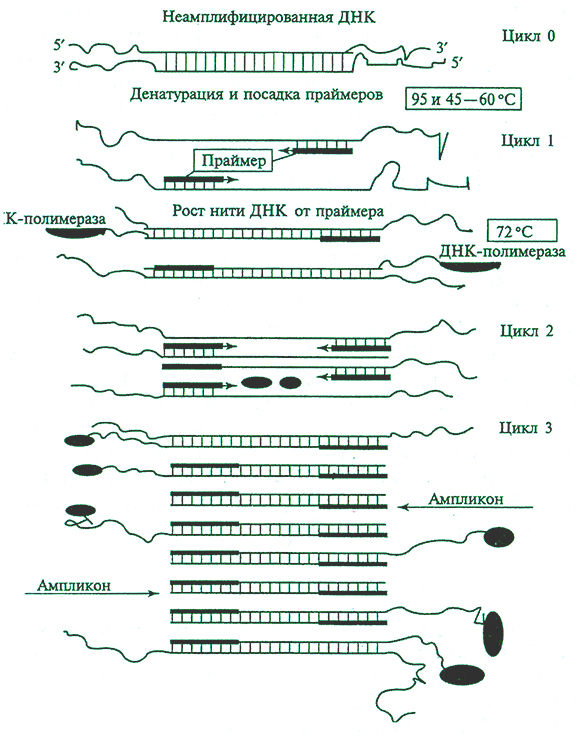
Рис. 4.8. Схема полимеразной цепной реакции (ПЦР)
Размноженный in vitro фрагмент получают в количествах, достаточных для его прямого секвенирования. Поскольку при этом не требуется промежуточный этап клонирования фрагмента ДНК в молекулярных векторах, ПЦР иногда называют бесклеточным молекулярным клонированием (cell-free molecular cloning). Автоматизированная процедура Taq-полимеразной цепной реакции, состоящая из 30 и более циклов, занимает 3-4 ч, что существенно быстрее и проще процедуры клонирования определенного фрагмента ДНК в составе векторных молекул.
Для лигазной цепной реакции используют другой фермент – термостабильную ДНК-лигазу.
Наиболее универсальным методом амплификации служит NASBA-метод. В отличие от ПЦР, он осуществляется при температуре 41 °C, т. е. является изотерма л ьным. Кроме того, в этом методе используют другие ферменты: РНК-полимеразу фага Т7, РНКазу H и обратную транскриптазу вируса птичьего миелобластоза. Метод крайне чувствительный, его можно использовать для контроля пищевых продуктов, в медицинской диагностике, в судебно-медицинской практике.
Введение нового (рекомбинантного) гена в клетку
Введение нового гена в клетку можно провести двумя способами: используя вектор или путем прямого введения.
Вектор – молекула ДНК или РНК, способная переносить включенные в нее чужеродные гены в клетку, где эти молекулы реплицируются автономно или после интеграции с геномом (хромосомой). Не каждая молекула ДНК или РНК может быть вектором.
Векторы должны обладать определенными свойствами, в числе которых:
1. способность к автономной (т. е. независимо от хромосомы реципиента) репликации в клетке реципиента. Например, для репликации в клетке бактерии вектор должен содержать сайт ori (участок инициации репликации);
2. наличие области, в которую возможно встраивание необходимого фрагмента ДНК. Для этого вектор должен содержать один или более участков (сайтов рестрикции), чувствительных к определенным рестриктазам, которые расщепляют вектор и позволяют встроить желаемую последовательность нуклеотидов (трансген);
3. небольшой размер, так как при длине более 15 т. п. н. значительно снижается эффективность клонирования чужеродной ДНК;
4. наличие маркерных генов, позволяющих отличить трансформированные клетки от исходных. Это могут быть селективные (придающие клеткам устойчивость к антибиотикам, гербицидам) или репортерные (клетки удобно тестировать по изменению окраски продуктов этих генов) гены;
5. наличие соответствующего промотора, под который необходимо поместить чужеродный ген для экспрессии в клетке бактерии.
Последовательности ДНК, расположенные перед началом структурного гена и определяющие степень активности РНК-полимеразы, называются регуляторными последовательностями. Одна из таких последовательностей представляет собой участок ДНК, с которым связывается РНК-полимераза. Этот участок называется промотором.
Регуляторные последовательности эукариотических генов отличаются от прокариотических, и бактериальная PHKполимераза не узнаёт их. Поэтому для экспрессии эукариотических генов в клетках прокариот нужно, чтобы гены находились под контролем бактериального промотора (т. е. промотора клетки-хозяина). В качестве промотора широко используют промотор гена, локализованного в коммерческих векторах, например pBR322, lac-промотор E. coli и др.
Таким образом создается вектор, т. е. создается целая генетическая конструкция, в состав которой, помимо трансгена, вводятся маркерные гены и соответствующие регуляторные последовательности.
Типы векторов. В качестве векторных молекул могут служить плазмиды бактерий или дрожжей (простых эукариотических организмов), ДНК бактериофагов или вирусов, искусственные хромосомы дрожжей (YAK) и бактерий (ВАК). Созданы также гибридные (искусственные) векторы – фазмиды, объединяющие преимущества плазмид и фагов. Для клонирования небольших фрагментов ДНК используют плазмиды, фаговые ДНК, а для крупных – космиды и искусственные хромосомы.
1. Плазмиды. Основой для создания вектора обычно служат бактериальные плазмиды· Это небольшие внехромосомные, автономно реплицирующиеся кольцевые молекулы ДНК, которые в количестве нескольких копий содержатся в клетках бактерий. Природные плазмиды часто содержат гены, полезные для бактерий: придающие устойчивость к антибиотикам и ионам тяжелых металлов (R-плазмиды); контролирующие способность разрушать различные трудноразлагаемые токсические соединения (нафталин, камфару, толуол, ксилол, различные пестициды и др.); плазмиды биодеградации, или D-плазмиды.
Некоторые плазмиды за счет специфического сайта инициации репликации могут реплицироваться в клетках только одного вида бактерий; это так называемые плазмиды с узким спектром хозяев. Другие плазмиды, с менее специфичным сайтом, могут реплицироваться в клетках разных видов бактерий; это плазмиды с широким спектром хозяев. Указанные особенности плазмид с успехом используют при создании векторов.
Однако есть свойства, которые не позволяют природным плазмидам выступать в качестве вектора. Так, их размер может достигать от 1 т. п. н. до 500 т. п. н., т. е. размер в большинстве случаев значительно превышает допустимый.
Кроме того, не все плазмиды несут в себе гены, которые могут служить маркерами для опознавания трансгенных клеток. Поэтому для эффективного трансгеноза приходится конструировать на основе плазмид с помощью методов генетической инженерии искусственные векторные системы (плазмидные векторы). В настоящее время предложен целый арсенал коммерческих векторов, созданных на основе бактериальных плазмид.
Например, плазмидный вектор pBR322 создан на основе плазмиды Е. coli (рис. 4.9), Плазмид a pBR322 имеет сайт on (область, ответственную за репликацию плазмиды), гены устойчивости к антибиотикам ампициллину и тетрациклину, причем б генах устойчивости к этим антибиотикам имеются сайты рестрикции. Если фрагмент чужеродной ДНК встраивается в один из генов устойчивости, то последний инактивируется. Следовательно, успешное встраивание фрагмента чужеродной ДНК в один из этих генов легко детектировать по исчезновению у бактерий устойчивости к данному антибиотику, так как при этом сохраняется устойчивость к другому антибиотику. То есть вектор дает возможность детектировать только те клоны бактерий, которые содержат рекомбинантную плазмиду.
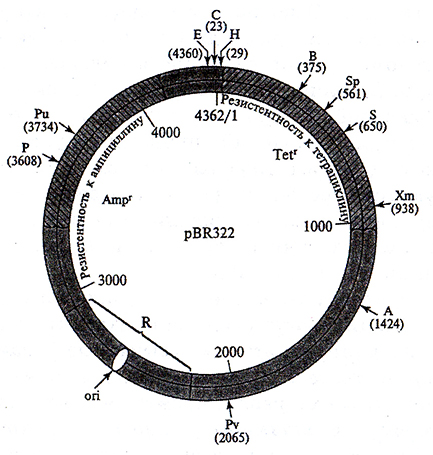
Рис. 4.9. Схема строения плазмидного вектора pBRU22: ori –
точка начала репликации; Ampr и Tetr – гены устойчивости
к ампициллину и тетрациклину (указаны сайты рестрикции
для различных рестриктаз, цифры обозначают число
нуклеотидных пар); R – реиликон
Строение векторов может быть разнообразным, но все они обязательно должны включать в себя несколько сайтов для встраивания фрагментов донорной ДНК и обеспечивать простую идентификацию трансформированных клеток. В плазмидах можно клонировать фрагменты ДНК размером не более 10 т. п. н.
2. Вирусы – самые маленькие и самые простые из всех патогенов. Они являются одними из главных кандидатов на роль векторов для введения чужеродной ДНК. Из них создают векторы на основе РНК, вироидоспецифичных ДНК, комбинации вироидоспецифичных ДНК с Ti-плазмидами. При вирусной инфекции каждая клетка может получить большое число копий чужеродного гена. ДНК можно встраивать так, чтобы она находилась под контролем сильного вирусного промотора, что обеспечит высокий уровень экспрессии гена, и его продукты будут более доступны для исследования. В генетической инженерии часто используют 35S-npомотоp вируса мозаики цветной капусты. Этот промотор не обладает тканевой специфичностью и активен не только в клетках крестоцветных, но и в клетках растений других семейств. Вирус должен быть жизнеспособным после рекомбинирования его ДНК. Легче всего вирусы вводятся в бактерии. Недостаток вирусов как векторов заключается в их небольшой емкости. Кроме того, они заражают небольшой круг хозяев.
3. Челночные векторы – это плазмидные векторы, предназначенные для работы в клетках разных организмов (животных и бактерий). Чаще всего для клонирования генов используют векторы с одним сайтом репликации для работы с Е. colL При необходимости использования других бактерий или эукариотических клеток в векторы встраивают второй сайт инициации репликации, обеспечивающий их работу и в других клетках. Именно такие векторные системы называются челночными. Наиболее распространенные векторы состоят из плазмиды pBR322 и интактного раннего района транскрипции ДНК вируса SV40, а нужный ген встраивается под контроль промотора поздних генов или дополнительного раннего промотора. Челночные векторные системы экспрессии разработаны для дрожжей, насекомых и клеток млекопитающих. Челночные векторы, созданные на основе бакуловирусов для работы в клетках Е. coli и насекомых, называются бакмидами.
4. Транспозоны – это сегменты ДНК, которые контролируют собственное перемещение из одного сайта ДНК в другой путем выхода из исходного сайта и внедрения в новый сайт хромосомы или плазмиды. Впервые транспозоны были открыты в 1940-х гг. американским ученым Барбарой Мак-Клинток у кукурузы. Транспозоны как бы передвигаются по всему геному растения. В течение многих лет кукуруза оставалась единственной системой, в которой обнаруживались такие подвижные генетические элементы. Сейчас они выявлены у бактерий, дрозофил и других организмов.
Механизм перемещения фрагментов ДНК по геному до конца не выяснен. Поскольку подвижные гены могут перемещаться в пределах генома с одного места на другое, то они могут быть весьма эффективными векторами для передачи рекомбинантной ДНК. Генетическая трансформация с помощью векторов на основе транспозонов была впервые осуществлена на дрозофиле. С их помощью можно переносить довольно крупные участки ДНК. Этот метод переноса генов имеет значительные преимущества, так как он осуществляется с высокой частотой и не сопровождается значительными перестройками в интегрируемой ДНК.
5. Векторные системы, предназначенные для клонирования крупных фрагментов ДНК:
- космиды – векторные системы, которые объединяют в себе участки плазмидных ДНК (ген-маркер и репликон плазмиды) и ДНК бактериофага. Термин обозначает, что вектор является плазмидой, внутри которой вставлен cosучасток фага λ (cos-site), представляющий собой нуклеотидную последовательность, отвечающую за упаковку фаговой ДНК в ее протеиновую капсулу. Космиды могут переносить до 40 т. п. н. клонируемой ДНК в клетки Е. coli;
- фазмиды – векторы, которые также представляют собой искусственные гибриды между фагом и плазмидой. В зависимости от условий, после встраивания чужеродной ДНК они могут размножаться как фаги или как плазмиды;
- бактериальная искусственная хромосома (ВАС – от англ. bacterial artificial chromosomes) – также способна переносить участки чужеродной ДНК от 150 до 300 т. п. н. Служит для трансформации животных клеток;
- дрожжевая искусственная хромосома (YAC – от англ. yeast artificial chromosomes) – сконструирована для переноса особо крупных участков чужеродной ДНК, вмещающих фрагменты геномной ДНК длиной от 100 т. п. н. до 1 м. п. н. Для их создания к плазмиде дрожжей «пришивают» центромерные последовательности, теломеры, последовательности для автономной репликации в дрожжевой клетке, сайты рестрикции и селективные маркеры.
В качестве возможных векторов для переноса генов предполагается использовать хлоропластные и митохондриальные ДНК.
Для идентификации трансформированных клеток, несущих рекомбинантную ДНК, вектор должен содержать один или несколько генов-маркеров. Выделяют две группы маркерных генов, позволяющих отличить трансформированные клетки от исходных, – это селективные и репортерные гены:
селективные гены – придают клеткам селективное преимущество, т. е. устойчивость к антибиотикам (канамицину, тетрациклину, неомицину и др.) или гербицидам (у растений). Основной принцип работы такого маркера – способность трансформированных клеток расти на селективной питательной среде с добавкой определенных веществ, ингибирующих рост и деление трансформированных, т. е. нормальных, клеток. Трансформанты отбирают на средах с высоким содержанием этих веществ. Например, в присутствии гена лактомазы бактериальная клетка приобретает устойчивость к ампициллину и на среде с этим антибиотиком образует клон (несущий данный ген), тогда как обычные клетки (без данного гена) на этой среде погибают;
репортерные гены – кодируют нейтральные для клеток белки, наличие которых в тканях легко обнаружить. В качестве репортерных чаще всего используют гены β-глюкуронидазы (UidAy другое название – gus), зеленого флюоресцентного белка (gfp), люциферазы (Iuc)9 хлорамфениколацетилтрансферазы (cat). Из них в большей степени применяют гены, кодирующие белки GUS и GFP, и в меньшей – кодирующие белки LUC и CAT.
Ген uidA (gus) является модифицированным геном из Е. Colit кодирующим β-глюкуронидазу. Он может гидролизовать обширный спектр природных и синтетических глюкуронидов, что позволяет подбирать соответствующие субстраты для спектрофотометрического или флюориметрического определения активности фермента, а также для гистохимического окрашивания тканей in situ (в синий цвет). В составе химерных белков, созданных генно-инженерными методами, GUS обычно сохраняет свою функциональную активность.
GFP (green fluorescent protein – зеленый флюоресцентный белок) был обнаружен Т. Шимомурой и соавторами в 1962 г. у люминесцирующей медузы Aequorea victoria. Он обладает особым свойством – способен флюоресцировать в видимой (зеленой) области спектра при облучении длинноволновым УФ. Для проявления флюоресценции не требуется субстратов или кофакторов. Ген gfp был клонирован в 1992 г. Г. Прашером и соавторами. Благодаря свойству белка, gfp является очень перспективным репортерным геном, позволяет проводить разнообразные прижизненные (недеструктивные) исследования с трансгенными организмами. Определяется гистохимически, по изменению окраски ткани при добавлении соответствующего субстрата.
Ген Iuc кодирует фермент люциферазу (клонирована из бактерий и светлячка). Люцифераза обеспечивает переход люциферинов из окисленной формы в основную, что вызывает свечение трансформированных клеток растений, накапливающих этот белок.
Ген cat отвечает за синтез хлорамфениколацетилтрансферазы (выделен из E. coli). Этот фермент катализирует реакцию переноса ацетильной группы от ацетил-КоА к хлорамфениколу. Определяется только радиоизотопными методами.
Область применения селективных генов в основном связана с простым контролем трансгеноза. Репортерные гены позволяют выявлять (по возможности количественно) временные и пространственные особенности экспрессии данного конкретного гена (собственного или чужеродного). Присоединение репортерного гена к одной лишь промоторной области позволяет исследовать в «чистом виде» ее роль в регуляции экспрессии изучаемого гена на уровне транскрипции.
Методы прямого переноса генов в клетку
В качестве реципиентов, в геном которых встраиваются чужеродные гены, используют клетки культуры, эмбриональные клетки млекопитающих, дрозофилы, пронуклеусы млекопитающих; у растений – протопласты, изолированные клетки и ткани, микроспоры, незрелые зиготические зародыши, проростки.
Для введения генетического материала в клетки разных организмов применяют ряд общих методов прямого переноса, таких, как трансформация, электропорация, микроинъекция и др.
Трансформация – метод введения рекомбинантной ДНК в клетку благодаря увеличению проницаемости ее клеточной оболочки (вероятно, за счет локального разрушения последней). Клетки обрабатывают ледяным раствором CaCl2, а затем выдерживают при температуре 42 °C в течение 1,5 мин.
Трансдукция – процесс переноса (передачи) бактериальной ДНК из одной клетки в другую бактериофагом. Общая трансдукция используется в генетике бактерий для картирования генома и конструирования штаммов.
Трансфекция – метод предполагает введение ДНК, адсорбированной на кристаллах фосфата кальция (кальциевый преципитат), в клетку путем фагоцитоза. Для трансфекции используют и ДЭАЭ-декстран – полимер, адсорбирующий ДНК. Эффект вхождения в клетки и время экспрессии высоки, но частота стабильной трансформации ниже, чем при использовании преципитата кальция. Частоту трансфекции увеличивает глицериновый шок (4 мин в 15%-м растворе глицерина в HEPES-буфере).
Электропорация – метод заключается в воздействии импульсов высокого напряжения электрического тока на клеточную мембрану, которое, скорее всего, вызывает временное образование большого количества пор, что обратимо увеличивает проницаемость мембран. Через образующиеся на короткое время поры чужеродная ДНК проникает в клетку. Это простой, эффективный и воспроизводимый метод. С его помощью были получены трансгенные растения кукурузы, риса и сахарного тростника.
Микроинъекции ДНК – метод позволяет с помощью тонких микроигл и микроманипулятора вводить в клетку или прямо в ядро векторную ДНК с включенным в нее трансгеном. С помощью микроинъекций осуществляется трансформация у дрозофилы и растений (ячмень, капуста). Метод, разработанный в начале 1970-х гг. А. Андерсоном и Г. Диакумакосом, дает небольшой выход трансформированных клеток. Его преимуществом является возможность вводить любую ДНК в любые клетки; кроме того, для сохранения в клетках введенного гена не требуется никакого селективного давления.
Упаковка в липосомы. Липосомы – сферические тельца, оболочки которых образованы фосфолипидами. Липосомы, содержащие внутри рекомбинантную ДНК, способны непосредственно сливаться с мембраной клетки или поглощаться клетками. В клетке происходит разрушение оболочки липосом и высвобождение ДНК. Это один из методов, позволяющих защитить трансформированный генетический материал от разрушения нуклеазами, присутствующими вне клеток. Метод применяется для введения нуклеиновых кислот в культивируемые животные клетки и растительные протопласты.
Биологическая баллистика – один из самых эффективных методов трансформации однодольных и хвойных растений (в которые не удается ввести чужеродную ДНК с помощью агробактерий), а также трансформации животных клеток. Метод базируется на напылении рекомбинантной ДНК на мельчайшие частицы золота или вольфрама (диаметр частиц 0,6-1,2 мкм), которыми бомбардируют клетки. Бомбардировку осуществляют с помощью генной пушки за счет перепада давления или под действием электрического разряда. При достаточной скорости эти частицы могут непосредственно проникать в ядро, что сильно повышает эффективность трансформации. Часть клеток, которые находятся в чашке Петри в центре непосредственно под пушкой, гибнет, а часть, расположенная по периферии чашки, выживает и трансформируется. С помощью генной пушки были трансформированы однодольные растения, такие, как кукуруза, рис, пшеница, ячмень. При этом были получены стабильные растения-трансформанты.
4.2. Основные этапы создания трансгенных организмов
Процесс создания трансгенного организма достаточно сложен и часто требует индивидуального подхода. Однако в любом случае его можно подразделить на несколько общих этапов:
1. Получение (выделение) нужного гена (трансгена), намеченного для переноса. Ген может быть выделен из естественных источников (из подходящего генома) или из геномной библиотеки; синтезирован искусственно – химическим (по имеющейся последовательности нуклеотидов) или ферментативным (с использованием механизма обратной транскрипции: синтез к ДНК на матрице мРНК с помощью обратной транскриптазы) путем; получен с помощью полимеразной цепной реакции (ПЦР).
2. Создание специальных генетических конструкций – векторов (переносчиков), в составе которых содержатся гены (трансгены), которые будут внедряться в геном другого вида или экспрессироваться в клетках проили эукариот. Для конструирования рекомбинантной ДНК (рекДНК) векторную ДНК (например, плазмиду) и чужеродную ДНК, содержащую интересующий ген (трансген), разрезают одной и той же рестриктазой; в результате образуются одинаковые концы. К генам, синтезированным химическим путем или полученным по матрице их мРНК, такие концы можно «пришить» искусственно. Затем производят смешивание фрагментов ДНК (вектора и трансгена) и «сшивание» их ДНК-лигазой. Концы чужеродной ДНК и плазмиды взаимодействуют друг с другом, образуя комплементарные пары оснований. Происходит гибридизация векторной и чужеродной ДНК. Концы фрагментов замыкаются с помощью водородных связей и ковалентно «сшиваются» с помощью фермента ДНК-лигазы.
3. Генетическая трансформация, т. е. перенос и включение рекДНК, содержащей трансген, в клетки реципиента (например, Е. coli). Плазмида, встроенная в бактерию, ведет себя, как вектор (переносчик) нового гена, который реплицируется в каждом новом поколении.
4. Молекулярная селекция – отбор трансформантов, т. е. клонов, несущих рекДНК. В процессе генетической трансформации Е. coli могут образоваться три типа клеток: клетки, не содержащие пламиду, содержащие плазмиду без встройки (без рекДНК), содержащие плазмиду с рекДНК. Для отбора трансформантов среди ^трансформированных клеток используют различные маркерные гены, которые находятся в векторной молекуле наряду с трансгеном.
Так, плазмида pBR322 имеет два гена устойчивости к антибиотикам ампициллину (Ampr) и тетрациклину (Tetr). Один из генов служит для идентификации бактерий, несущих плазмиду (вектор) путем отбора клеток, устойчивых к антибиотику, а другой – для отличия гибридной плазмиды (рекДНК) от исходного вектора. В гене Tetr имеется уникальный сайт, разрезаемый рестриктазой BamHl. Если разрезать вектор в гене Tetr рестриктазой BamHl и встроить в него фрагмент чужеродной ДНК, полученный с помощью той же рестриктазы, то ген Tetr инактивируется, и у бактерий, несущих плазмиду, исчезает устойчивость к тетрациклину, но сохраняется устойчивость к ампициллину. Отбор на среде с ампициллином покажет, содержит Е. coli плазмиду или нет. Содержащие плазмиду бактерии будут расти на среде с ампициллином. Для отбора клеток, несущих чужеродную ДНК (интересующий нас ген), бактерии выращивают на среде с тетрациклином. Трансформированные клетки устойчивы к ампициллину, но чувствительны к тетрациклину (такие колонии отсутствуют на среде с тетрациклином), так как ген устойчивости к тетрациклину разрушен в результате вставки фрагмента чужеродной ДНК. Помимо плазмиды pBR322, используется множество других векторов для клонирования (pUC19, рЕТ, pQE), причем для некоторых из них существуют весьма остроумные системы отбора рекомбинантных клонов (например, окрашивание колонии клеток, содержащих немодифицированную плазмиду pUC19).
5. Выращивание измененных клеток в целые трансгенные организмы. Синтез определенного белка – продукта введенного гена.
Первый, второй и третий из перечисленных этапов представляют собой последовательное создание рекомбинантной ДНК, четвертый и пятый – трансгеноз и выявление трансгенного организма.
После введения в реципиентную клетку фрагмента чужеродной ДНК происходит ее клонирование с целью получения большого числа копий или начинается синтез продукта, закодированного во введенном гене. Чаще всего эти процессы осуществляются в бактериальных клетках. Поэтому клонирование прокариотической ДНК в клетках прокариот не вызывает осложнений. Клонирование эукариотической ДНК требует дополнительных методических приемов, так как существуют различия в строении генома у прокариот и эукариот. У прокариот кодирующие домены структурных генов непрерывны, а у эукариот кодирующие области (экзоны) разделены некодирующими (интронами). Прокариоты не способны удалять интроны из первичных РНК-транскриптов, поэтому правильная трансляция эукариотических мРНК в бактериальных клетках невозможна. Для удаления интронов из эукариотической ДНК был предложен метод синтеза ДНК-копии (кДНК) на мРНК.
4.3. Генетическая инженерия прокариот
Клетки бактерий нашли широкое применение в биотехнологии. Методы генетической инженерии наиболее детально разработаны для микроорганизмов. В связи с этим появилась возможность более эффективно применять их многие полезные свойства. Используя генно-инженерные методы, можно конструировать микробные клетки, способные синтезировать продукты растительного и животного происхождения, имеющие большое значение для медицины и промышленности. Стало возможным превращать бактерии в своеобразные биологические «фабрики» по производству белковых препаратов, различных химических соединений, аминокислот и т. д.
Бактерии можно использовать как «фабрики» для синтеза белков и новых продуктов, изменяя метаболизм бактериальных клеток введением в них чужеродных генов или модификацией уже существующих; создавать рекомбинантные микроорганизмы, способные синтезировать самые разнообразные низкомолекулярные соединения: аскорбиновую кислоту, краситель индиго, аминокислоты, моноклональные антитела.
В современной биотехнологии широко используют трансгенные микроорганизмы, продуцирующие лекарственные препараты: антибиотики, гормоны, ферменты, витамины; различные препараты для диагностики наследственных и инфекционных заболеваний (например, ВИЧ, вирусного гепатита и др.); для производства незаменимых аминокислот, биодобавок, биополимеров (например, микробиологический синтез каучука), для биодеградации ксенобиотиков.
С помощью трансгенных бактерий можно получать различного рода вакцины:
- субъединичные вакцины, содержащие отдельные компоненты патогенного организма; для их разработки используют технологии рекомбинантных ДНК;
- аттенуированные вакцины, содержащие непатогенные микроорганизмы, синтезирующие антигенные детерминанты определенного патогенного организма, либо штаммы патогенных микроорганизмов, у которых модифицированы или удалены гены вирулентности;
- «векторные вакцины», получаемые в большом количестве путем встраивания генов или их сегментов, кодирующих основные антигенные детерминанты патогенных организмов, в экспрессионные векторы. Продукт используют как вакцину.
Бактериальные клетки применяют также для клонирования необходимых для встраивания генов, проведения фундаментальных исследований и других целей.
В настоящее время бактерия Е. coli – самая изученная клетка из всех существующих. У большинства наиболее полно изученных фагов клеткой-хозяином является также E. coli.
4.4. Генетическая инженерия растений
Трансформация растительного генома
Важным преимуществом растений, по сравнению с животными, является способность их клеток развиваться в целое растение (т. е. тотипотентность), что широко используется в работах по получению трансгенных растений.
Генетическая трансформация растений с помощью методов генетической инженерии может быть осуществлена векторным способом (с использованием агробактерий и вирусов) и путем прямого переноса генов.
Наиболее изученным примером работы плазмидных векторов служит введение чужеродных генов в геном растений с помощью Tiи Ri-плазмид почвенных бактерий рода Agrobacterium. С помощью этих плазмид бактерии могут интегрировать свой генетический материал в клетки двудольных растений.
Ti-плазмида (от англ. tumor inducing – индуцирующая опухоль) обнаружена в клетках некоторых штаммов Agrobacterium tumefaciens. Выделенная в чистой культуре, эта бактерия может приводить к образованию опухолей у двудольных растений, что, по существу, может рассматриватьСЯ KftK природная генно-инженерная система.
Ri-плазмида (от англ. root inducing – индуцирующая корни) присутствует в штаммах Agrobacterium rhizogenes.
В 1970-х гг. Дж. Шелл с сотрудниками выявил, что причиной опухолеобразования являются Ti-плазмиды, обнаруженные в клетках некоторых штаммов A. tumefaciens. Ti-илазмида проникает из клетки бактерии в растение, и часть ее, называемая Т-ДНК (от англ. transferred DNA – переносимая), ковалентно встраивается в хромосомы инфицируемого растения (рис. 4.10). В природе этот фрагмент переносит гены, которые способствуют размножению агробактерий и дают им возможность паразитировать на пораженном растении.
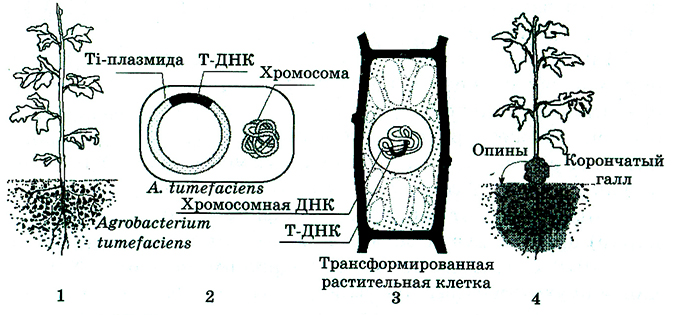
Рис. 4.10. Генетическая колонизация растения A. tumefaciens:
1 – агробактерий существуют в ризосфере; 2 – строение A. tumefaciens;
3 – встраивание Т-ДНК в геном; 4 – образование опухоли
Гены, входящие в состав T-ДНК, функционируют лишь после их переноса в растительную клетку. Будучи интегрированной с хромосомой, T-ДНК индуцирует в месте заражения образование опухоли {корончатых галлов, напоминающих раковые клетки животных), гиперпродукцию фитогормонов – цитокипинов и ауксина, а также синтез ряда производных аминокислот, опинов – веществ, которых нет в здоровых клетках ни у одного растения.
Опухоль возникает вследствие нарушения баланса фитогормонов, т. е. как результат функционирования онкогенов, продуктами которых являются ауксины и цитокинины. Опины, выделяемые клетками опухоли, бактерия использует в качестве источников углерода и азота для своего роста и размножения. Сама бактерия в клетку не проникает, а остается в межклеточном пространстве и использует клетку со встроенной T-ДНК как «фабрику», продуцирующую о пины. Такие отношения A tumefaciens и растения Дж. Шелл назвал генетической колонизацией, которая представляет собой эксперимент по генетической инженерии, поставленный самой природой.
Строение Ti-плазмид хорошо изучено. Они включают в себя:
T-ДНК – область ДНК, где содержатся гены, ответственные в итоге за морфологию опухоли и синтез фитогормонов, вызывающих неконтролируемый рост опухолевых клеток, а также гены, ответственные за синтез опинов – источников углерода и азота для питания бактерий. Именно все эти гены передаются в ядерный геном растительной клетки;
- vir-область – содержит гены, ответственные за вырезание, перенос и интеграцию T-ДНК в хромосомы растений. Индукция этих генов обратима, что очень важно для бактериальных клеток. Если зараженное растение уже больно и является нежизнеспособным организмом, то переноса Т-ДНК не происходит;
- ori-область – содержит гены, продукты которых обеспечивают репликацию Ti-плазмиды;
- tra-область – содержит гены, ответственные за конъюгацию бактерий.
Ti-плазмида оказалась идеальным природным вектором для введения чужеродных генов в клетки растения. Проще всего было бы заменить Т-ДНК на чужеродные (полезные) гены, ввести их в плазмиды агробактерий и заразить ими растения, так как гены, ответственные за индукцию опухоли, синтез опинов и подавление дифференциации клеток поражаемого растения, расположены близко друг от друга в Т-ДНК. В то же время гены, ответственные за перенос и интеграцию Т-ДНК в хромосомы растений, находятся в другой области Ti-плазмиды – в vir-области.
Итак, на основе Ti-плазмиды в условиях эксперимента создают искусственные векторы. Для создания трансгенных растений гены, кодирующие хозяйственно ценные признаки, встраивают в Т-ДНК. Эту же область снабжают маркерными генами (для отбора трансформированных растительных клеток), эукариотическим промотором (например, 35S-np0M0T0p вируса мозаики цветной капусты – CAMV) и уникальными сайтами рестрикции.
Однако размеры Ti-плазмид слишком велики и не позволяют использовать их в качестве вектора. Для решения этой проблемы была создана специальная технология – бинарная система.
Т-ДНК вырезают из Ti-плазмиды и встраивают, например, в плазмиду pBR322, способную к саморепликации в клетках Е. colu Таким образом осуществляют клонирование Т-ДНК (многократное увеличение числа копий) в составе pBR322. Векторную систему (Т-ДНК – pBR322) выделяют из клеток Е. coli и встраивают в Т-ДНК интересующие гены. Новую векторную систему снова размножают в клетках E. coli, а затем вводят в клетки Agrobacterium tumefaciens, в которых находятся нормальные Ti-плазмиды. В результате гомологичной рекомбинации векторная система и Ti-плазмида обмениваются участками Т-ДНК. Теперь клетки Agrobacterium tumefaciens несут в составе своих плазмид чужеродные гены, которые они могут передать в ядерный геном растительных клеток, что и приводит к созданию трансгенных растений.
В последние годы для создания искусственных векторов используют Ri-плазмиду (от англ. root inducing – индуцирующая корни), присутствующую в штаммах Agrobacterium rhizogenes, Ri-плазмиды выгодно отличаются от Ti-плазмид тем, что они являются естественными безвредными векторами. После встраивания Т-ДНК в хромосомную ДНК растительных клеток в области заражения наблюдается усиленное образование корешков («бородатость»), из которых легче регенерировать здоровые растения, чем из недифференцированной ткани опухоли.
Для трансформации устойчивых к агробактериям однодольных растений разработаны приемы прямого физического переноса ДНК в клетку. Эти методы достаточно разнообразны: бомбардировка микрочастицами, или баллистический метод; электропорация; обработка полиэтиленгликолем; микроинъекция; перенос ДНК в составе липосом и др.
Наиболее продуктивным и чаще всего используемым является метод бомбардировки микрочастицами.
В последнее время разработан и успешно применен также комбинированный метод трансформации, названный агролистическим. При этом чужеродную ДНК вводят в ткани каким-либо физическим методом, например баллистическим. Вводимая ДНК содержит как Т-ДНК вектор с целевым и маркерным геном, так и агробактериальные гены вирулентности под контролем эукариотического промотора. Временная экспрессия генов вирулентности в растительной клетке приводит к синтезу белков, которые правильно вырезают Т-ДНК из плазмиды и встраивают ее в хозяйский геном, как и при обычной агробактериальной трансформации.
После проведения тем или иным способом трансформации растительной ткани ее помещают in uitro на специальную питательную среду с фитогормонами, способствующую размножению клеток. Среда обычно содержит селективный агент, в отношении которого трансгенные клетки приобретают устойчивость. Регенерация чаще всего проходит через стадию каллуса, после чего при правильном подборе сред начинается органогенез (побегообразование). Сформированные побеги переносят на среду укоренения, часто также содержащую селективный агент для более строгого отбора трансгенных особей.
Достижения генетической инженерии растений
Методы генетической инженерии позволяют достаточно быстро создавать новые генотипы растений, т. е. значительно сокращают время, которое затрачивается на классическую селекцию. Кроме того, применение этих методов позволяет изменять генотип целенаправленно. В отношении растений роль генетической инженерии сводится, главным образом, к созданию сортов сельскохозяйственных растений, устойчивых к насекомым-вредителям, фитопатогенам, гербицидам, пестицидам, различным стрессовым факторам. Проводятся работы по введению генов, регулирующих созревание плодов, отвечающих за синтез витаминов или лекарственных препаратов и т. д.
Получение трансгенных растений значительно облегчается благодаря присущему растениям свойству тотипотентности, т. е. способности любой клетки растительного организма регенерировать целое растение. Следовательно, достаточно получить несколько трансформированных клеток, чтобы регенерировать из них растения-трансгены.
Однако возможности генетической инженерии растений ограничиваются рядом причин:
- во-первых, геном растений изучен хуже, чем геном млекопитающих;
- во-вторых, не для всех растений удается подобрать условия регенерации. Стабильно получают растения-регенеранты из протопластов картофеля, люцерны, томатов, моркови, табака, капусты и некоторых других двудольных растений. Регенерировать растения злаков удается не всегда;
- в-третьих, одной из лимитирующих причин служит размер фрагмента донорной ДНК, который предполагается ввести в клетку, а также появление химерных организмов, неспособных к развитию и размножению.
Не так давно была предпринята удачная попытка использовать пыльцу в качестве супервектора при трансформации, что позволяет исключить появление растений-химер. Имеются сообщения об использовании искусственной бактериальной хромосомы в качестве векторной системы, что позволяет переносить целые кассеты генов, кодирующие множественные ступени биохимических процессов. Это открывает такие широкие перспективы в трансформации растительных организмов, что на первое место выходят вопросы о возможных последствиях таких экспериментов и об их экологической безопасности.
Первая волна трансгенных растений, допущенных для практического применения, содержала дополнительные гены устойчивости (к болезням, гербицидам, вредителям, порче при хранении, стрессам).
Нынешний этап развития генетической инженерии растений относится к «метаболической инженерии». При этом ставится задача не столько улучшить те или иные имеющиеся качества растения (как при традиционной селекции), сколько научить растение производить совершенно новые соединения, используемые в медицине, химическом производстве и других областях. Этими соединениями могут быть, например, особые жирные кислоты, полезные белки с высоким содержанием незаменимых аминокислот, модифицированные полисахариды, съедобные вакцины, антитела, интерфероны и другие «лекарственные» белки, новые полимеры, не засоряющие окружающую среду, и т. д. Использование трансгенных растений позволяет наладить масштабное и дешевое производство таких веществ и тем самым сделать их более доступными.
Изменение пищевой ценности растений
1. Запасные белки. Основной задачей генетической инженерии считается улучшение аминокислотного состава белков. Как известно, в запасном белке большинства злаковых наблюдается дефицит лизина, треонина, триптофана, а в запасном белке бобовых – дефицит метионина и цистеина. Введение в эти белки дополнительных количеств дефицитных аминокислот могло бы ликвидировать аминокислотный дисбаланс. Методами традиционной селекции удалось существенно повысить содержание лизина в запасных белках злаковых. Во всех этих случаях часть проламинов (спирторастворимые запасные белки злаковых) заменялась другими белками, содержащими много лизина. Однако у таких растений уменьшались размеры зерен и снижалась урожайность. По-видимому, проламины необходимы для формирования нормального зерна и их замена другими белками отрицательно влияет на урожайность. Поэтому для улучшения качества запасного белка зерновых нужен такой белок, который не только отличался бы высоким содержанием лизина и треонина, но и мог бы полноценно заменить определенную часть проламинов при формировании зерна.
Эксперименты по трансформации пшеницы модифицированным геном, кодирующим одну из субъединиц запасного белка глютенина, привели к активному синтезу модифицированного белка, что способствовало улучшению хлебопекарского качества пшеничной муки.
Растения могут производить и белки животного происхождения. Было показано, что в растениях табака могут собираться полностью функциональные секреторные моноклональные иммуноглобулины. Секреторные иммуноглобулины обычно выделяются в ротовую полость и желудок человека и животных и служат первым барьером на пути кишечных инфекций. Из растений были получены моноклональные антитела, специфичные для Streptococcus mutans – бактерий, вызывающих зубной кариес. Предполагается, что на основе таких моноклональных антител, продуцируемых трансгенными растениями, удастся создать действительно антикариесную зубную пасту.
Из других белков животного происхождения, которые представляют интерес для медицины, показана продукция в растениях человеческого β-интерферона.
Разработаны также подходы, позволяющие получать бактериальные антигены в растениях и использовать их в качестве вакцин. Получен картофель, экспрессирующий олигомеры нетоксичной субъединицы токсина холеры. Эти трансгенные растения могут быть использованы для получения дешевой вакцины от холеры.
2. Жиры. Важнейшим сырьем для получения разного рода химических веществ являются жирные кислоты – основной компонент растительного масла.
Были получены трансгенные растения рапса с измененным составом растительного масла, включающего, вместе с обычными C16:0 и С18:0 жирными кислотами, также и до 45 % C12:0 жирной кислоты – лауриновой. Это вещество широко используется для производства стиральных порошков, шампуней, косметики.
Интересными представляются эксперименты с петрозелиновой кислотой C18:1 – изомером олеиновой кислоты Δ9 C18:1,у которой двойная связь находится в Δ6 С положении. Эта жирная кислота входит в состав масла кориандра и определяет его более высокую температуру плавления (33 °С), в то время как температура плавления олеиновой кислоты составляет только 12 °С. Предполагается, что после переноса генов, определяющих синтез петрозелиновой кислоты, в растения – продуценты растительного масла удастся производить диетический маргарин, содержащий ненасыщенную жирную кислоту.
Дальнейшее изучение специфики биохимического синтеза жирных кислот, по-видимому, приведет к возможности управлять этим синтезом с целью получения жирных кислот различной длины и различной степени насыщения, что позволит значительно изменить производство детергентов, косметики, кондитерских изделий, затвердителей, смазочных материалов, лекарств, полимеров, дизельного топлива и др.
3. Полисахариды. Проводится работа по созданию трансгенных растений картофеля, в которых крахмал будет находиться главным образом в виде амилопектина (разветвленной форме крахмала) или же только в виде амилозы (линейной формы крахмала). Так, например, крахмал, состоящий в основном из амилопектина, по-видимому, будет иметь спрос на рынке производителей различных питательных смесей (сейчас в качестве наполнителя используется модифицированный крахмал).
Создание гербицидоустойчивых растений
Гербициды очень широко применяются в интенсивных сельскохозяйственных технологиях для уничтожения сорняков. Однако гербициды экологически опасны, так как обладают широким спектром действия; они токсичны для млекопитающих и могут накапливаться в растениях и во внешней среде. Еще один существенный недостаток гербицидов: они подавляют рост не только сорняков, но и культурных растений. Кроме того, у многих сорняков отмечено появление устойчивости к различным гербицидам.
Такие высокоэффективные гербициды, как глифосат и атразины, интенсивно изучаются на предмет выявления механизма толерантности к ним некоторых сорняков. Изучение механизма устойчивости к гербицидам с целью получения методами генетической инженерии культурных растений, обладающих этим признаком, включает следующие этапы: выявление биохимических мишеней действия гербицидов в растительной клетке, отбор устойчивых к данному гербициду организмов в качестве источников генов устойчивости, клонирование этих генов, введение их в культурные растения и изучение их функционирования.
Установлено, что признак гербицидоустойчивости является моногенным, т. е. признак детерминируется чаще всего одним-единственным геном. Это облегчает возможность применения технологии рекомбинантной ДНК для передачи данного признака. Таким образом, гены, кодирующие те или иные ферменты деструкции и модификации гербицидов, могут быть с успехом использованы для создания гербицидоустойчивых растений методами генетической инженерии, поскольку традиционные методы селекции создания сортов, устойчивых к гербицидам, очень длительны и малорезультативны.
Наиболее широко применяемый за рубежом гербицид глифосат (коммерческое название – Roundup) подавляет синтез важнейших ароматических аминокислот (тирозина, фенилаланина и триптофана). Под действием гербицида у неустойчивых к нему растений наблюдаются симптомы азотного голодания (из-за недостатка названных аминокислот), и они погибают в течение двух недель.
Путем переноса гена ср4 (ген, кодирующий EPSPS и несущий точковую мутацию – «мутацию мишени») в геном растений было изменено сродство гербицида с его ферментоммишенью. В результате гербицид «не узнаёт» свою мишень, фермент сохраняет активность, а растение становится устойчивым к его действию. Таким способом в 1977 г. был получен сорт сои, устойчивый к Roundup. Причем в полученной трансгенетической сое отсутствуют селективные гены устойчивости к антибиотикам, поскольку сам ген устойчивости к глифосату можно использовать в качестве селективного.
К числу наиболее распространенных гербицидов, применяемых при обработке зерновых культур, относится атразин. Он подавляет фотосинтез, связываясь с одним из белков фотосистемы II и прекращая тем самым транспорт электронов. Устойчивость к гербициду возникает в результате точечных мутаций в пластохинон-связывающем белке (замена серина на глицин), вследствие чего он теряет способность взаимодействовать с гербицидом. Химерные растения проявляли значительную устойчивость к таким концентрациям атразина, которые вызывали гибель контрольных растений с геном белка дикого типа.
Ряд гербицидов (паракват, ацифлуофен) ингибирует фотосинтез путем повышения содержания активных форм (радикалов) кислорода. Известно, что нейтрализация супероксиданиона катализируется ферментом супероксиддисмутазой, кодируемой геном sod. С целью защиты от гербицидов была получена кДНК гена sod из табака и введена в геном люцерны, что резко повысило устойчивость растения к этим гербицидам.
Устойчивость к насекомым
Для борьбы с насекомыми-вредителями в растениеводстве используются химические средства – инсектициды. Однако они оказывают вредное воздействие на полезных насекомых, загрязняют окружающую среду; кроме того, насекомые довольно скоро приспосабливаются к ним. Известно свыше 400 видов насекомых, устойчивых к используемым инсектицидам. Поэтому все большее внимание привлекают биологические средства борьбы, обеспечивающие строгую избирательность действия и отсутствие адаптации насекомых-вредителей к применяемому инсектициду.
Давно известна бактерия Bacillus thuringiensis, продуцирующая белок, высокотоксичный для многих видов насекомых и в то же время безопасный для млекопитающих. Этот прототоксин (Cry-белок, гены которого локализованы на плазмидах) в кишечнике насекомых протеолитически расщепляется и превращается в токсин (δ-токсин, или дельта-токсин), убивая их. Активированный токсин специфично связывается с рецепторами в средней кишке насекомых, что приводит к лизису клеток кишечного эпителия. Взаимодействие токсина с рецепторами строго специфично, что усложняет подбор комбинации «токсин – насекомое».
В природе найдено большое количество штаммов В. thuringiensis, чьи эндотоксины действуют только на определенные виды насекомых. Препараты Б. thuringiensis в течение десятилетий использовали для контроля численности насекомых на полях. Безопасность токсина и его составных белков для человека и других млекопитающих полностью доказана.
Встраиванием гена эндотоксина в геном растений (табак, картофель, томаты, хлопчатник, кукуруза, рис, рапс, тополь и др.) были получены трансгенные растения (Bt-растения – от В. thuringiensis), не поедаемые насекомыми (например, картофель, устойчивый к колорадскому жуку), что позволило отказаться от применения инсектицидов (рис. 4.11).
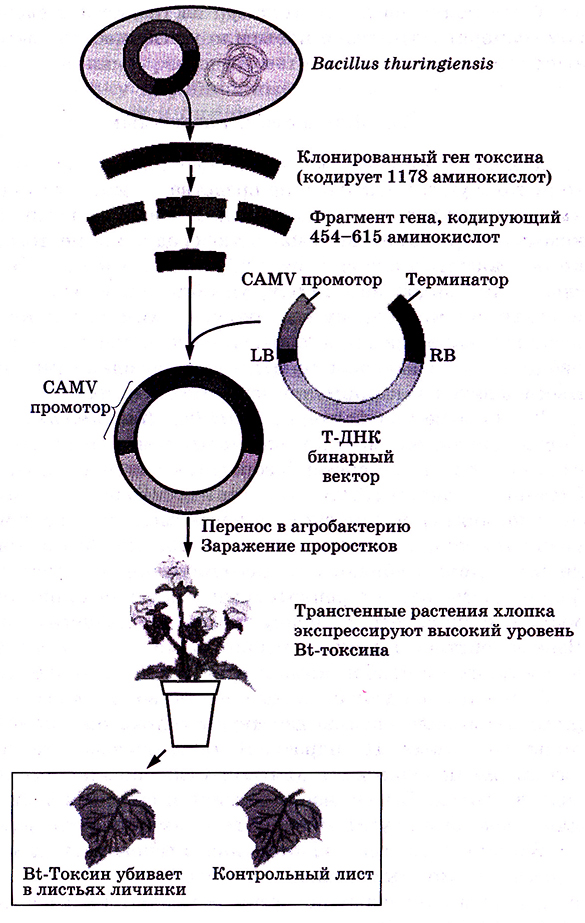
Рис. 4.11. Лолучение трансгенных растений хлопка с геном bt, несущим устойчивость к насекомым
В Северной Америке картофель со встроенным геном cry IIIA (с токсичными для колорадского жука свойствами) получил широкое распространение. В настоящее время полевые испытания трансгенного картофеля проводятся в России.
Получены трансгенные растения табака, способные синтезировать токсин. Такие растения устойчивы к поеданию гусеницами Manduca sexta: последние погибали в течение трех суток контакта с токсинпродуцирующими растениями. Токсинообразование и обусловленная им устойчивость к насекомым передавались по наследству как доминантный признак.
Трансформация генами эндотоксина, выделенными из генома В. thuringiensis, растений томата вызывает у них защитный эффект, сопоставимый с использованием инсектицидных препаратов.
В настоящее время Bt-растения хлопка и кукурузы занимают основную долю в общем объеме производства генетически модифицированных растений этих культур в США.
Повышение устойчивости растений к стрессовым условиям
Растения очень часто подвергаются воздействию различных неблагоприятных факторов окружающей среды: высокие и низкие температуры, недостаток влаги, засоление почв и т. д. Таких факторов множество, поэтому у растений выработались различные способы защиты от них – от физиологических изменений до структурных приспособлений, позволяющих преодолевать отрицательные воздействия.
Имеются определенные возможности для повышения устойчивости растений методами генетической инженерии. Это работа с отдельными генами, контролирующими метаболические ответы растений на стрессовые условия, например сверхпродукцию пролина в ответ на осмотический шок и действие засоления, синтез особых белков в ответ на тепловой шок и т. д.
Важным направлением генетической инженерии является селекция сортов, устойчивых к засухе, жаре, повышенному засолению почвы. Поскольку все эти стрессовые факторы относятся к разряду осмотических, то и подходы по этим направлениям общие. Чтобы приспособиться к таким условиям, растения синтезируют низкомолекулярные нетоксичные вещества – осмопротекторы. Эти вещества способствуют поглощению и удержанию воды, а также предотвращают разрушение макромолекул белков в стрессовых условиях. Идет работа над выявлением, клонированием и переносом в растения трансгенов, кодирующих образование различных осмопротекторов (Сахаров, аминокислот, многоатомных спиртов, полиаминов), веществ, регулирующих содержание ненасыщенных жирных кислот в мембранах клеток, и т. д. Исследования показали, что некоторые растения, в частности табак и томаты, не накапливают глицинбетаин (осмопротектор) и поэтому высокочувствительны к солевому шоку. Г. Джиа с соавторами в 2002 г. получил трансгенные томаты, экспрессирующие бетаинальгиддегидрогеназу (БАД, участвующий в биосинтезе глицинбетаина) лебеды Atriplex hortensis и проявляющие достаточно высокую устойчивость к солевому стрессу.
С развитием индустриальных технологий стала актуальной разработка методов, позволяющих вести хозяйство в условиях повышенных концентраций в почве тяжелых металлов. Один из подходов к решению этой проблемы – клонирование и встраивание в геном растений гена, кодирующего белок животного происхождения – металлотионеин, который способен связывать многие тяжелые металлы. Выделен ген, продукт которого связывает кадмий.
Можно отметить косвенный подход к получению морозоустойчивых растений, основанный на генно-инженерных методах работы с бактериями Pseudomonas syringae и Erwinia herbicola. Исследователи Колорадского университета (США) выявили, что повреждению растений при замерзании способствуют эти бактерии эпифитной (поверхностной) микрофлоры и что их белки служат центрами кристаллизации. Если обезвредить бактерии стрептомицином, то растения не замерзают при температуре –8 °С. Но стрептомицин дорог и вреден, поэтому выгоднее было изменить генетику данного штамма бактерий, вырезав из генома определенный ген. Растения, инфицированные мутантным штаммом Pseudomonas syringae, росли при отрицательной температуре. Однако оказалось, что бактерии мутантного штамма более живучи и способны вытеснить природный штамм, который, попадая в верхние слои атмосферы, способствует кристаллизации атмосферной влаги. Вероятно, что уничтожение природного штамма и замена его на мутантный могли бы привести к экологической катастрофе, поэтому научные разработки в этом направлении были вовремя приостановлены.
Дальнейшее изучение физиологической, биохимической и генетической основы ответной реакции растения на стрессовые условия среды позволит применять методы генетической инженерии для конструирования устойчивых растений.
Повышение эффективности биологической азотфиксации
Атмосферный азот фиксируется благодаря уникальному ферменту – нитрогеназе. Структура нитрогеназы одинакова у всех азотфиксирующих организмов. Это один из наиболее сложных ферментов, использующих простые субстраты. Непременное условие работы нитрогеназы – защита ее от кислорода, который ингибирует не только активность нитрогеназы, но и ее биосинтез. Кроме азота, нитрогеназа может восстанавливать ацетилен, цианистый водород, закись азота и некоторые другие соединения. Восстановление ацетилена в этилен позволило разработать надежный тест для обнаружения азотфиксирующей активности.
Лучше всех среди азотфиксаторов изучены ризобии, образующие симбиоз с бобовыми растениями, и свободноживущая бактерия Klebsiella pneumoniae. Установлено, что у этих бактерий за фиксацию азота ответственно 17 генов – так называемые nif-гены. Все они сцеплены друг с другом и расположены в хромосоме между генами, кодирующими биосинтез гистидина (his), и генами, ответственными за усвоение шикимовой кислоты (shiA).
Гены, кодирующие синтез белковых субъединиц компонентов нитрогеназы, образуют единый оперон HDKY. У быстрорастущей ризобии nif-гены существуют в форме мегаплазмиды, содержащей 200-300 т. п. н. В клетках симбиотических бактерий плазмиды, кроме структурных генов нитрогеназы, содержат гены, отвечающие за развитие корневых клубеньков у определенных видов бобовых.
Конструирование плазмид, несущих nif-гены, позволяет передавать способность к фиксации азота организмам, не обладающим этим свойством. Среди бактерий, кроме Е. coli, такой перенос осуществлен для бактерий Salmonella typhimurium, Erwinia herbicola и др. Однако подобные манипуляции могут приводить к нежелательным эффектам. Так, перенос генов в штамм Erwinia (бактерии, вызывающие гниение растений) может усилить его патогенное действие. Кроме того, существует вероятность случайного переноса вместе с nif-генами каких-то нежелательных генов.
В настоящее время внимание ученых привлекают проблемы введения генов азотфиксации в клетки небобовых растений, создания ризоценозов между этими растениями (особенно злаками) и азотфиксирующими организмами, повышения мощности корневой системы бобовых растений для увеличения на ней количества клубеньков. Кроме того, предполагается создание новых азотфиксирующих систем путем введения диазотрофных микроорганизмов в каллусные ткани растений с последующим образованием из них растений-регенерантов, а также повышение эффективности фиксации азота путем воздействия на гены, контролирующие этот процесс.
Таким образом, наиболее перспективными направлениями являются повышение эффективности фиксации азота в уже существующих природных системах за счет воздействия на гены, контролирующие этот процесс, а также увеличение мощности корневой системы бобовых растений и создание новых азотфиксирующих систем с помощью методов клеточной инженерии.
Повышение эффективности фотосинтеза
С4-растения характеризуются высокими темпами роста и высокой скоростью фотосинтеза, у них практически отсутствует видимое фотодыхание. У большинства сельскохозяйственных культур, относящихся к СЗ-растениям, высокая интенсивность фотодыхания, в результате чего теряется часть фотосинтетических продуктов. Фотосинтез и фотодыхание – тесно связанные процессы, в их основе лежит бифункциональная активность одного и того же ключевого фермента – рибулозобисфосфат-карбоксилазы-оксигеназы (РБФК/О). Низкое фотодыхание у С4-растений объясняется ограничением оксигеназной реакции РБФК/О. Перед генетической инженерией стоит задача исследовать возможности создания растений, у которых РБФК/О будет работать с преобладающей карбоксилазной активностью.
Один из возможных способов увеличения фотосинтеза и, следовательно, продуктивности растений состоит также в клонировании хлоропластных генов в клетках бактерий и их переносе в растения. Известно, что хлоропласты и прокариотические клетки сходны по ряду признаков.
Анализ области хлоропластных генов вблизи последовательности ДНК гена большой субъединицы основного фермента фотосинтеза РБФК/О кукурузы выявил значительные гомологии с известными промоторами и последовательностями ШД (последовательность Шайн – Дальгарно) клеток Е. coli. Все это привело к попытке клонирования генов хлоропластов в клетках Е. coli, наиболее часто используемой в генно-инженерных исследованиях.
В настоящее время уже клонировано несколько хлоропластных генов: гены синтеза субъединиц РБФК/О, белка хлорофилл-белкового комплекса, АТФ-синтетазы, цитохрома и др.
Изменение окраски цветков у декоративных растений
Цветоводы во все времена старались создавать растения, цветки которых имели бы более привлекательный внешний вид и лучше сохранялись после срезки. Однако скрещивание растений традиционными методами – это кропотливая работа, требующая много времени и сил и к тому же имеющая свои ограничения.
Так, например, никому не удавалось вывести синюю розу. Голландские ученые методами генетической инженерии создали сорт голубых (синих) роз, перенеся в них ген из дельфиниума, контролирующий синтез голубого пигмента.
Получены и испытываются трансгенные растения хлопка с окрашенным волокном. Предполагается, что в будущем натуральное хлопковое волокно станет крепче, не будет мяться и садиться и будет иметь различную окраску без использования химических красителей.
Растения как биореакторы
Растения дают большое количество биомассы, и их выращивание не составляет особого труда. Поэтому естественно было бы попытаться создать трансгенные растения, способные синтезировать новые соединения, используемые в медицине, химическом производстве и других отраслях. Такими соединениями могут быть, например, особые жирные кислоты, белки с высоким содержанием незаменимых аминокислот, съедобные вакцины и др. Уже созданы экспериментальные установки по получению с помощью растений моноклональных антител, функциональных фрагментов антител и полимера поли-β-гидроксибутирата, из которого можно изготавливать пластик, подверженный биодеградации.
Растения являются наиболее дешевыми продуцентами белков. К настоящему времени показано, что растения могут производить белки животного происхождения. Так, встраивание в геном арабидопсиса химерного гена, состоящего из части гена запасного белка арабидопсиса и кодирующей части для нейропептида – энкефалина, приводило к синтезу химерного белка в количестве до 200 нг на 1 г семян. Два структурных белковых домена были связаны последовательностью, узнаваемой трипсином, что давало возможность в дальнейшем изолировать чистый энкефалин, используемый в качестве болеутоляющего и успокаивающего средства.
Японские ученые получили растения картофеля и табака со встроенным геном человеческого α-интерферона, который применяют для лечения гепатита С и некоторых форм рака.
Созданы растения табака, нарабатывающие человеческий интерлейкин 10 (стимулятор иммунитета), а также растения арабидопсиса, синтезирующие витамин Е.
Разработаны также подходы, позволяющие получать бактериальные антигены в растениях и использовать их в качестве вакцин. Так, получен картофель, продуцирующий нетоксичные субъединицы В-токсина холеры. Такие растения могут быть использованы для получения дешевых съедобных вакцин против холеры. Иммунизация такой антихолерной вакциной вполне эффективно происходит путем преорального приема. Созданы бананы, вырабатывающие вакцину против полиомиелита.
Производство антител и их фрагментов с помощью трансгенных растений имеет ряд преимуществ перед их синтезом в клетках рекомбинантных микроорганизмов, так как трансформация растений носит стабильный характер. Кроме того, процессинг и укладка чужеродных белков в растениях сходны с таковыми в животных клетках. Также можно создавать условия, при которых чужеродные белки будут синтезироваться в семенах, где их целостность не нарушится длительное время.
Крупномасштабный бактериальный синтез поли-β-гидроксибутирата (полимера, из которого получают пластик, подверженный биодеградации) обходится довольно дорого. Поэтому получение этого полимера с помощью трансгенных растений – важный шаг для создания сельскохозяйственных культур, которые можно использовать для получения в больших количествах биодеградирующих пластиков.
Преимущества растений как «биофабрик» очевидны: можно производить очень редкие и дорогие вещества практически в неограниченных количествах; растения становятся продуцентами вакцин, фармакологических белков и антител, что позволяет значительно удешевить лечение различных заболеваний, в том числе и онкологических.
Регуляция сроков созревания и хранения плодов
Благодаря успехам генетической инженерии, можно не только вводить в организм новый чужеродный ген, но и заблокировать (провести адресное разрушение), ослабить (или, наоборот, усилить) действие природного гена.
Например, плоды томата во время созревания содержат значительное количество специального белка-фермента PG (полигалактуроназы), придающего плодам рыхлость. Этот фермент участвует в разрушении пектина – основного компонента межклеточного пространства растительных тканей. Продукт гена pg синтезируется в период созревания плодов томатов, а увеличение его количества приводит к тому, что плоды постепенно теряют упругость, становятся более мягкими и загнивают, что значительно сокращает срок их хранения. Для устранения этого белка (с целью увеличения сроков хранения томатов) проводят отключение гена pg путем встраивания в геном томатов антисмысловой конструкции (содержащей перевернутую копию гена) по отношению к этому гену. В результате транскрипции получается антисмысловая (перевернутая) мРНК (так называемая асРНК), которая комплементарно связывается с нормальной (смысловой) мРНК. Образуется молекула двухцепочечной РНК (дуплекс), которая уже не может служить матрицей для синтеза белка.
С применением этого подхода получены первые коммерческие растения томата Flavr Savr, отличающиеся пониженной деполимеризацией пектина клеточной стенки плодов, в результате чего они дольше хранились, сохраняя товарные и пищевые качества зрелых плодов, а сами растения были более устойчивы к грибковым заболеваниям.
Генно-инженерный подход применяют и для регулирования сроков созревания томатов. Известно, что этилен – это газообразный гормон, одна из функций которого – контроль над процессом созревания и старения плодов. В качестве мишени в этом случае используют ген efe (ethylene-forming enzyme), продуктом которого является фермент, участвующий в биосинтезе этилена. У трансгенных растений уровень этилена был гораздо ниже нормы, поэтому плоды имели более длительный срок хранения.
Данный подход представляет интерес и для обеспечения длительного хранения срезанных цветов.
Повышение урожайности, регуляция скорости роста
С помощью генетической инженерии можно повышать и урожайность сельскохозяйственных культур, несмотря на то что этот признак является полигенным. Тем не менее можно найти и применить отдельные гены, продукты которых позволяют существенно усилить процессы роста и в итоге повысить продуктивность растения. Так, встраивание в геном картофеля гена фитохрома В от арабидопсиса приводило к повышению интенсивности фотосинтеза и увеличению урожая клубней.
По данным ученых Иркутского университета (Р.К. Caляев и др.), перенос в геном картофеля гена, кодирующего образование фермента УДФГ трансферазы созревающего зерна кукурузы, сопровождался усилением биосинтеза ростовых фитогормонов. Это позволило повысить: урожай клубней – в два раза, уровень сухих веществ в клубнях – до 27 % (у обычных сортов – менее 20 %), аскорбиновой кислоты – до 9 %. Разрезанные клубни не темнели на воздухе. Этими же учеными были получены быстрорастущие трансгенные растения осины путем введения в них генов ugt – из кукурузы и acbp302 – из арабидопсиса. Продукты этих генов влияют на скорость роста растений через изменение их гормонального (ауксинового) статуса.
Методами генетической инженерии можно добиться повышения качественных и потребительских свойств сельскохозяйственной продукции. Ведутся работы и получены обнадеживающие результаты по созданию кофе без кофеина, табака без никотина (полагают, что курение сигарет из такого табака будет менее вредным для здоровья), арахиса, не содержащего характерных для него аллергенов.
В шлифованном рисе – основном источнике питания в ряде стран – отсутствует провитамин А (β-каротин), что приводит к дефициту витамина А в организме человека и способствует развитию различных заболеваний (например, к ухудшению зрения), особенно у детей. Швейцарским ученым удалось разработать генно-инженерный подход к созданию так называемого «золотого» риса. Они перенесли в геном риса генетическую конструкцию, содержащую сразу три гена от разных организмов, необходимых для биосинтеза β-каротина: гены фитоендесатуразы и ликопин β-циклазы – от нарцисса и ген каротиндесатуразы – от бактерии. Зерна трансгенного риса накапливали в эндосперме провитамин А в достаточном количестве и были окрашены в золотистый цвет.
Ведутся работы по созданию трансгенных растений лесных древесных пород с пониженным содержанием лигнина. В создании низколигниновых деревьев заинтересована целлюлозно-бумажная промышленность, так как лигнин, который составляет 15-35 % от сухого вещества в древесине, при производстве бумаги представляет собой «лишний» компонент, а его удаление – дорогостоящий и экологически опасный процесс.
4.5. Генетическая инженерия животных
Трансформация животного генома
Одними из носителей для введения чужеродной ДНК в животную клетку являются векторы на основе ДНК вирусов (например, SV40, вируса бычьей папилломы и т. д.) или на основе ретровирусов (например, на основе вируса лейкоза мышей) (рис. 4.12). Они легко проникают в клетку хозяина, встраиваются в ее ДНК путем обычной инфекции и обеспечивают высокоэффективный перенос генов. В основном трансформации животных клеток осуществляют либо с помощью ретровирусов (около 40 % от всех трансформаций), либо путем упаковки ДНК в липосомы (25 %), реже используют другие способы.
Рис. 4.12. Получение линии трансгенных мышей с использованием
ретровирусных векторов, Эмбрион, обычно находящийся на стадии
8 клеток, инфицируют рекомбинантным ретровирусом, несущим трансген.
Самки, которым был имплантирован эмбрион, производят на свет
трансгeннное потомство. Для идентификации мышат, несущих трансген
в клетках зародышевой линии, проводят ряд скрещиваний
Все генно-инженерные методы работы с клетками животных можно разделить на две группы: эксперименты с соматическими клетками и эксперименты по трансформации половых клеток. В последнем случае конечный результат – получение трансгенных организмов.
Генетическая трансформация соматических клеток животных
Культуры трансформированных клеток млекопитающих используют для получения различных веществ. Помимо создания клеток-продуцентов, трансформация соматических клеток млекопитающих позволяет изучать тонкие механизмы регуляции экспрессии генов и целенаправленно модифицировать генетический аппарат клетки животных, а при необходимости и человека, что имеет огромное значение для медицинской генетики.
Хотя культуры клеток животных при массовом выращивании гораздо менее экономичны, чем бактериальные и дрожжевые культуры, они обладают существенным преимуществом – способностью осуществлять мелкие, но весьма важные модификации белков – продуктов гена млекопитающих. Например, для эффективного функционирования ряда белков необходимо присоединение к ним цепочек из молекул углеводов или липидов. Образование и присоединение таких цепочек – обычный процесс для клеток млекопитающих, тогда как бактериальная клетка не способна производить подобные модификации.
Культуры клеток животных служат эффективным источником выделения некоторых вирусных антигенов с целью получения вакцин для животных и человека. Получение таких вакцинных культур клеток осуществимо с помощью техники рекомбинантных ДНК и эффективных векторов экспрессии для клеток млекопитающих и человека. При использовании ДНК-вакцин в организм вводится не антиген, а ген, кодирующий синтез этого антигена. Ген встраивается в плазмиду, плазмида вводится в организм путем обыкновенной инъекции, выработка вирусного белка провоцирует синтез специфических антител, т. е. вызывает иммунный ответ.
ДНК-вакцины имеют хорошие перспективы в животноводстве. Достоинством таких вакцин является маленький объем: для иммунизации одной мыши достаточно 10-50 мкг плазмиды, одной коровы – 200-300 мкг. Плазмида сохраняется в организме до одного года. В стадии клинических испытаний в настоящее время находятся ДНК-вакцины против микоплазм, возбудителя туберкулеза, сальмонеллеза, лейшманиоза.
Генетическая трансформация половых клеток животных
Если вводить ДНК в клетки многоклеточного организма, то результатом трансформации будет изменение свойств лишь небольшого числа клеток, которые приобрели новый ген. В этом случае животное будет химерным (т. е. клетки разных тканей будут иметь разный генотип).
Следовательно, для изменения свойств всего организма следует изменять геном половых клеток или зиготы, которые передадут новые свойства потомкам. Разработаны способы введения генов в эмбриональные клетки разных животных, в том числе млекопитающих и мух.
Существует две основные схемы создания трансгенных животных: микроинъекция чужеродной ДНК и введение генетической конструкции в эмбриональные стволовые клетки.
Микроинъекция чужеродной ДНК. Первая попытка была сделана американским ученым Дж. Гордоном в 1980 г. Методом микроинъекции он ввел в оплодотворенную яйцеклетку мыши рекомбинантную плазмиду pBR322, которая содержала ген тимидинкиназы вируса герпеса и фрагмент генома вируса SV40, вызывающего опухолевую трансформацию. В дальнейшем в геном мыши и других животных удалось ввести гены интерферонов, гормона роста человека и ряд других.
Микроинъекцию клонированных генов проводят в один или оба пронуклеуса только что оплодотворенной яйцеклетки мыши (рис. 4.13). Чаще выбирают мужской пронуклеус. После инъекции яйцеклетку немедленно имплантируют в яйцевод приемной (суррогатной) матери или дают ей возможность развиваться в культуре до стадии бластоцисты, после чего имплантируют в матку.
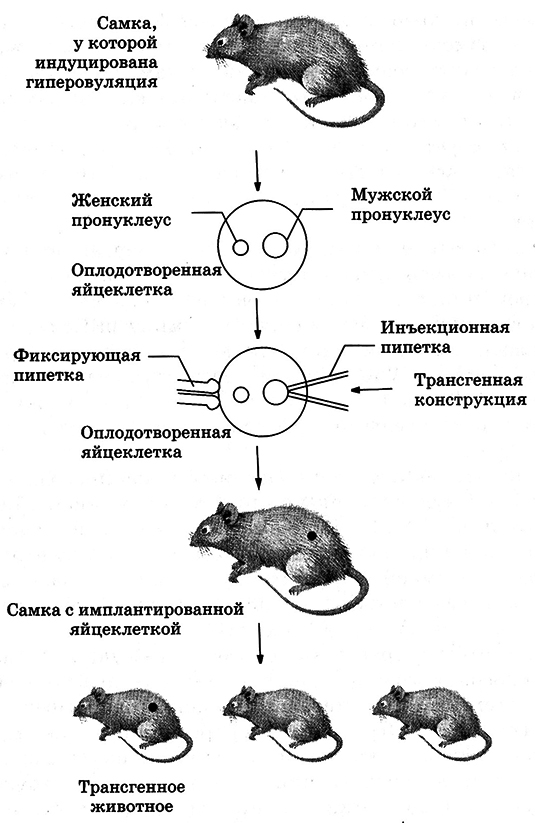
Рис. 4.13. Получение линий трансгенных мышей методом микроинъекций. Яйцеклетки выделяют из самок-доноров, у которых была индуцирована гиперовуляция и проведено спаривание с самцами. Трансгенную конструкцию инъекцируют в мужской пронуклеуе оплодотворенной яйцеклетки. Яйцеклетки имплантируют в суррогатную мать, которая производит на свет трансгенных мышат – основателей трансгетшых линий
Для отбора трансгенных особей (несущих введенный ген) проводят молекулярно-генетический анализ родившегося потомства. Скрещивая трансгенных животных, можно получить чистые (гомозиготные) трансгенные линии.
Недостатком технологии создания трансгенных животных путем микроинъекции генетических конструкций в пронуклеус яйцеклетки является ее трудоемкость и малоэффективность: полного развития достигает менее 1-5 % зигот.
Можно вводить ген в сперматозоиды и затем проводить ими оплодотворение. Таким образом были введены гены интерферона и инсулина человека, ген β-глобина кролика, ген тимидинкиназы вируса простого герпеса и кДНК вируса лейкемии мышей.
Введение генетической конструкции в эмбриональные стволовые клетки (ЭСК). Впервые культивируемые линии ЭСК из бластоцист мыши (рис. 4.14) были получены Эвансом, Кауфманом и Мартином в 1981 г. Позже аналогичные линии были получены из бластоцист других млекопитающих: золотистый хомячок (1988); свинья, овца (1990); корова, норка (1992); кролик (1993); крыса (1994); обезьяна (1995) и даже человек (1994).
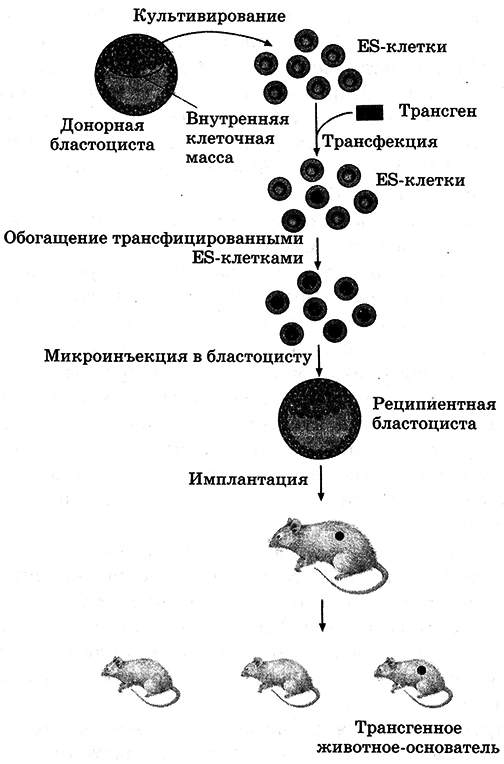
Рис. 4.14. Получение трансгенных мышей с помощью генетической модификации
эмбриональных стволовых клеток (ЭСК). ЭСК получают из внутренней клеточной массы
благтоцисты мыши. Их тратифицируют вектором, несущим трансген, культивируют
и идентифицируют трансформированные клетки методом позитивно-негативной селекции
или ПЦР. Популяцию трансформированных клеток вновь культивируют и вводят в бластоцисты,
которые затем имплантируют в матку суррогатных матерей. Скрещивая животных-основателей,
несущих трансген в клетках зародышевой линии, можно получить линии трансгепных мышей
Эмбриональные стволовые клетки (ЭСК) обычно получают из бластоцист. Когда число клеток (бластомер) эмбриона не превышает восьми, они являются недифференцированными, плюрипотентными (тотипотентными), т. е. способны дифференцироваться в любые типы клеток, включая клетки зародышевой линии, и каждая из них может дать начало новому организму. Эти клетки можно культивировать in vitro и после введения в них необходимого трансгена ввести в другой эмбрион на стадии бластоцисты, а затем имплантировать в матку суррогатной матери, производящей потомство. Скрещивая животных-основателей, несущих трансген в клетках зародышевой линии, можно получить линии трансгенных животных.
В отличие от предыдущего, этот метод позволяет проанализировать встраивание трансгена в геном клетки на стадии бластоцисты и проверить его экспрессию, что дает возможность выбрать линию ЭСК с наилучшими свойствами. Часть этих клеток можно заморозить в жидком азоте и хранить многие годы для последующего создания трансгенных животных.
Такой путь получения трансгенных животных выгоден еще и тем, что используются не зиготы, а бластоцисты. Их легко получить нехирургическим путем из половых путей самок крупных видов млекопитающих и трансплантировать суррогатным матерям для рождения трансгенных животных – основателей трансгенных линий.
Создание трансгенных животных – очень сложный и трудоемкий процесс. По статистике одно трансгенное животное удается получить на 40 инъецированных зигот мыши, на 100 зигот овцы или козы, на 1500 зигот коровы. К тому же это и неоднозначный процесс. Так как интеграция чужеродных генов носит случайный характер, могут быть повреждены соседние гены реципиента. Из трансгенных животных не более 50 % экспрессируют трансгенный белок, не у всех животных чужой ген попадает в половые клетки, т. е. способен передаваться потомству.
Клонирование животных
Клоном называется популяция клеток или организмов – потомков одной клетки или организма, полученных неполовым путем. Таким образом, все особи в клоне имеют идентичный набор генов и должны быть точной копией взятого для размножения экземпляра (соответствующего прототипа).
У животных можно получить подобные клоны в том случае, когда используемые объекты размножаются путем партеногенеза, т. е. бесполым путем, без предварительного оплодотворения. У нас в стране блестящие работы по клонированию выполнены на шелкопряде академиком В.А. Струнниковым. Выведенные им клоны шелкопряда (партеноклоны мужского пола, дающие на 20 % больше шелка, чем женские) известны на весь мир.
Высшие животные в природе размножаются только половым путем. Клетки животных, дифференцируясь, лишаются тотипотентности. Поэтому для их клонирования в основном используют недифференцированные делящиеся клетки.
Для клонирования животных ядро оплодотворенной яйцеклетки заменяют ядром, взятым от другой особи (с другой генетической информацией). Оказалось, что тотипотентность (возможность развиваться во взрослую особь) сохраняют ядра из клеток очень ранних эмбрионов. Это позволяет проводить искусственное разделение четырех – восьми клеточных эмбрионов на отдельные клетки, культивировать их in vitro до стадии бластоцисты и имплантировать в матку суррогатной матери, где они развиваются до рождения. Таким путем можно получать генотипически одинаковые особи (однояйцевых близнецов).
Сенсационность работы доктора Я. Вильмута и соавторов из Шотландии (1997) заключается в том, что впервыедля клонирования млекопитающих были использованы ядра соматических (дифференцированных) клеток взрослой овцы (клетки соединительной ткани – фибробласты) беломордой породы Финский дорсет, выделенные из вымени овцы (рис. 4.15).
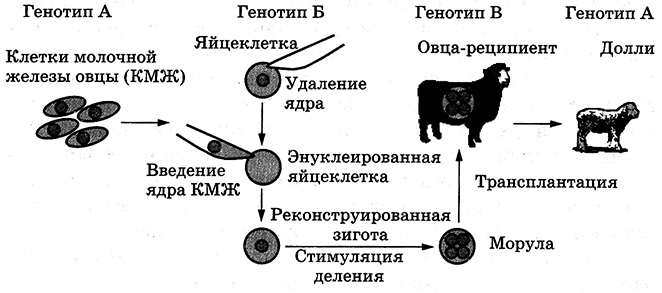
Рис. 4.15. Клонирование онцы методом переноса ядра
Клонирование овцы осуществлялось методом переноса ядра. Ядро яйцеклетки удаляли с помощью микропипетки. Затем культивировали эпителиальные клетки молочной железы взрослой особи, индуцировали их переход в фазу G0 и провели слияние клеток в G0 фазе и яйцеклеток, лишенных ядра овец шотландской черномордой породы. Выращивание восстановленных яйцеклеток осуществлялось в культуре или в яйцеводе до ранних стадий эмбриогенеза, а затем их имплантировали в матку суррогатной матери черномордых овец» где и происходило дальнейшее развитие. В результате появилась всемирно известная овца Долли, генотип и фенотип (беломордый ягненок) которой были полностью идентичны исходной матери. В эксперименте было проведено слияние 277 яйцеклеток с удаленными ядрами с клетками молочной железы в G0 фазе; из 29 эмбрионов только один развился до жизнеспособного плода.
Перенос ядра соматической клетки в энуклеироваиную зиготу (безъядерную) успешно проведен на мышах японскими учеными. Имеются сообщения о клонировании свиньи, коровы, кошки. Таким образом, была доказана сиособность ядер соматических клеток обеспечивать нормальное развитие млекопитающих.
Исследования по клонированию животных имеют фундаментальное значение. Полная схожесть организмов дает возможность сравнивать влияние на них различных препаратов и внешних условий (например, оценивать мутагенность различных химических соединений); выяснить механизмы дифференцировки клеток в процессе онтогенеза и возможность управления этими процессами. Это открывает путь к генотерапии и искусственному созданию органов для трансплантации. Появление клонов важно и для испытания новых лекарств.
Достижения генетической инженерии животных
Трансгенные животные являются удобной моделью для изучения болезней человека, их также планируют использовать для производства необходимых человеку биомедицинских препаратов.
Трансгенные животные как модели наследственных заболеваний человека
Трансгенные линии животных служат для моделирования различных генетических болезней человека, что имеет огромное значение для медицинской генетики. По данным секвенирования генома мыши, у человека содержится около 70-80 % гомологичных генов (генов-ортологов). На мышах можно получать мутации, осуществлять генно-инженерные манипуляции и изучать механизмы регуляции экспрессии генов, проводить скрещивание трансгенных животных и анализ наследования в потомстве.
На трансгенных животных можно изучать наследственные заболевания мозга и нервной системы. Гены болезни Альцгеймера (отложение белка β-амилоида приводит к образованию бляшек) и гены, отвечающие за развитие эпилепсии и болезней мозга, вводят в геном нормальных животных; при этом получают трансгенных животных-моделей, на которых можно испытывать различные терапевтические препараты.
Трансгенных животных стали использовать для исследования воспалительных и иммунологических заболеваний человека, например ревматоидного артрита. С их помощью моделируют болезни – атеросклероз, мышечную дистрофию (миодистрофия Дюшенна), образование опухолей, гипертонию, сердечно-сосудистые и прионные заболевания и др.
На основе изучения трансгенных животных разрабатывают методы генетической терапии (способы лечения различных наследственных заболеваний). При этом используют соматическую трансфекцию – метод, при котором генетические конструкции вводят в определенные клетки и ткани организма пациента.
Использование трансгенных животных в качестве биореакторов
Самая мощная белоксинтезирующая система находится в клетках молочной железы. Если поставить гены чужих белков под контроль казеинового промотора, то экспрессия этих генов будет мощной и стабильной, а белок будет накапливаться в молоке. Такие трансгенные животные, секретирующие в молоко гормоны, ферменты, антитела, факторы свертывания крови и роста и др., уже начинают использовать как биореакторы, т. е. продуценты биологически активных лекарственных белков человека. Традиционно такие белки выделяли из донорской крови, дефицит которой и низкая концентрация этих белков в ней не позволяют получать необходимое количество препаратов для фармакологии.
Первоначально необходимо получить трансгенное животное, у которого чужой ген экспрессируется в клетках молочной железы и его продукт выделяется в молоко. Для этого создают генетическую конструкцию, содержащую рекомбинантную ДНК трансгена и промотор гена β-казеина – белка, входящего в состав молока. Генетическую конструкцию вводят в зиготу. Причем генетическая конструкция должна работать только в клетках молочной железы и только во время лактации, не оказывая побочного действия на организм трансгенного животного.
В Англии в 1988 г. впервые удалось получить трансгенных овец, продуцирующих с молоком фактор свертывания крови, необходимый для лечения людей, больных гемофилией. В последующие годы в мире созданы трансгенные мыши, кролики, овцы, козы, свиньи, коровы, в молоке которых секретируются белки человека (ценнейшие фармацевтические вещества) – антитриисин, антитромбин, белок С, сывороточный альбумин (используемый при операциях), различные моноклональные антитела, эритропоэтин, инсулиноподобный фактор роста, интерлейкины и др.
Уже получены трансгенные коровы, в молоке которых содержится человеческий белок лактоферрин. Этот белок планируют применять для профилактики гастроэнтерологических заболеваний у людей с низкой иммунорезистентностью. Это больные СПИДом, недоношенные младенцы, больные раком, прошедшие радиотерапию.
В России в 1995 г. были предприняты попытки создать овец, продуцирующих химозин. Это ключевой фермент сыроделия, его традиционно выделяют из слизистой оболочки сычуга забитых молочных телят и ягнят.
Интересны и перспективны работы по созданию животных – продуцентов белка паутины пауков, поскольку прочность на разрыв нитей паутины в расчете на площадь поперечного сечения на порядок превосходит прочность стальных канатов. Так, перенеся в геном коз гены паука, отвечающие за выработку белков паутины, американские и канадские генетики получили трансгенных животных, продуцирующих «биосталь» – молоко, содержащее белок, по прочности превосходящий металл.
Использование трансгенных животных позволит снизить стоимость большинства дорогостоящих высокоэффективных препаратов в 10-20 раз и перевести, например, многие лекарства из разряда элитных в число общедоступных.
Трансгенные животные с выключенными генами (генный нокаут)
Генный нокаут (от англ. knock out – выбить) – это направленное разрушение (выключение) определенного гена с помощью гомологичной рекомбинации. Животные-нокауты – удобная модель для исследования функций различных генов. Сложность генома млекопитающих затрудняет проведение генетического анализа. Большинство исследований в этой области проводилось на мышах – классическом объекте генетики. Создание линий мышей, гомозиготных по направленно инактивированному гену, позволяет изучать детерминируемые данным геном свойства на уровне организма.
Большое значение имеют опыты по созданию животных, продуцирующих молоко, максимально приближающееся по составу к материнскому молоку человека. Для этого нужно выключить несколько генов коровы, т. е. получить животных-нокаутов, а затем ввести в ее геном несколько генов человека.
Трансгенные животные – источники органов для пересадки человеку
Трансгенных животных получают и для целей ксенотрансплантации, т. е. как источник органов для пересадки человеку.
Удобным донором органов являются свиньи, так как подходят человеку по строению, размерам и многим биохимическим показателям. Но пересаживать их органы без генетического изменения (трансформации) невозможно, так как они будут немедленно отторгнуты иммунной системой пациента. Чтобы этого не произошло, необходимо создать трансгенную свинью, у которой будут «нокаутированы» соответственные гены гистонесовместимости (тканенесовместимости), а вместо них введены гены гистосовместимости человека. Эти гены располагаются компактно в локусах гистосовместимости, и при проведении генного нокаута можно «выключить» сразу несколько генов. В январе 2002 г. было объявлено о рождении в США пометов трансгенных клонов свиньи с «отключенными» генами гистонесовместимости.
Создание трансгенных свиней, у которых продукты экспрессии генов ингибируют процесс отторжения органов при их пересадке, дает надежду на возможность успешной трансплантации органов животных в организм человека и позволит создать постоянный запас органов для пересадки людям.
Итак, получение трансгенных животных представляет интерес не только для фундаментальных исследований, но и для практического использования. Однако, несмотря на то что первые трансгенные животные были получены более 20 лет назад, до сих пор на рынке нет ни одного генетически модифицированного животного для использования в хозяйственной деятельности. Это связано с определенными техническими (сложность получения и размножения), финансовыми, а иногда и этическими проблемами. Тем не менее успехи генетической инженерии животных очевидны. Разработаны различные методы переноса генов в генетический материал животных и получены трансгенные особи млекопитающих, низших позвоночных и беспозвоночных животных. Ученые научились не только переносить в генетический материал животных отдельные гены, но и «выключать» или заменять некоторые конкретные гены.
4.6. Генодиагностика и генотерапия человека
Генодиагностика – совокупность методов по выявлению изменений в структуре генома. Это относительно новое, перспективное, быстро развивающееся направление диагностики. Диагностические методы обладают высокой специфичностью и чувствительностью, а также достаточно просты и достоверны. Успехи современной медицины во многом зависят от того, насколько рано и точно можно диагностировать наиболее распространенные генетические и инфекционные заболевания, а также новообразования.
Генетическая инженерия ввела в практику ДНК-диагностику. Известно, что участок ДНК, отвечающий за данный биологический признак, имеет определенную нуклеотидную последовательность, которая может служить диагностическим маркером. В основе методов ДНК-диагностики лежит выявление специфических нуклеотидных последовательностей в биологических образцах методом гибридизации (ДНК – ДНК, ДНК – РНК) или полимеразной цепной реакции (ПЦР).
Эти методы имеют несколько общих этапов:
- денатурация ДНК-мишени; фиксация полученной одяоцепочечной молекулы ДНК-мишени на мембранном фильтре;
- инкубация мембранного фильтра с одноцепочечной молекулой ДНК-зонда, которая при определенной температуре и ионной силе спаривается с ДНК-мишенью;
- промывание фильтра для удаления избытка не связавшихся меченых молекул ДНК-зонда;
- определение наличия гибридных молекул ДНК-мишень/ДНК-зонд с помощью радиоавтографического метода.
Гибридизация нуклеиновых кислот основана на использовании зондов, применяемых для выявления комплементарных последовательностей (искомого участка ДНК). Для обеспечения высокой точности диагностического теста гибридизационные ДНКи РНК-зонды должны быть высокоспецифичными. Специфичность зондов проявляется на разных уровнях: на видовом (различают два или более видов), на уровне отдельных штаммов в пределах одного вида, на генетическом уровне (различают разные гены).
Использование метода полимеразной цепной реакции ПЦР для мультипликации тестируемой ДНК обеспечивает также высокую чувствительность этих зондов.
В настоящее время получены и охарактеризованы более ста различных ДНК-зондов. Зонды применяют для:
- обнаружения генов или нуклеотидных последовательностей, специфичных для возбудителя инфекционного заболевания;
- обнаружения в тканях единичных клеток патогенных штаммов: хламидий, вируса гепатита С, возбудителей туберкулеза и др.;
- диагностики наследственных заболеваний путем нахождения специфических изменений в генах. Подобные зонды существуют для диагностирования более 1000 наследственных заболеваний, в том числе фенилкетонурии, серповидной анемии, дефицита α-антитрипсина, мышечной дистрофии, болезни Альцгеймера, мусковисцидоза, гемофилии и др.
Преимущества ДНК-диагностики – быстрота, надежность, высокая чувствительность и специфичность. Методы ДНК-диагностики имеют широкую перспективу развития, с их помощью в принципе можно выявлять на ранних стадиях заболевания практически любые патогенные микроорганизмы и определять многообразие наследственных заболеваний.
Генетическая терапия
Большие перспективы в лечении наследственных заболеваний человека открывает генетическая терапия (генотерапия). Она позволит устранить генетические дефекты (коррекция наследственных патологий) путем введения в соматические клетки полноценных (функционально активных) генов вместо (или помимо) поврежденного (мутантного) гена, а также лечить различные заболевания за счет введения в организм чужеродной генетической информации с целью получения терапевтического эффекта.
Принципиальный смысл генетической терапии заключается в замещении мутантного белка (с которым связано развитие болезни) клеток человека на соответствующий нормальный белок, который будет синтезироваться в клетках. То есть генотерапия направлена на компенсацию нарушенных функций клетки на генетическом уровне. Причем таким способом возможно лечение не только генетических, но и других (неинфекционных и инфекционных) заболеваний (рак, СПИД и т. п.), поэтому методы генетической терапии различны.
Существует два типа генотерапии: заместительная и корректирующая. Заместительная генотерапия заключается во вводе в клетку неповрежденного гена, когда болезнь связана с отсутствием или малым количеством белкового продукта. В клетку вводится неповрежденный ген, и создаются условия для его экспрессии (наряду с экспрессией мутантного гена) с целью получения достаточного количества нормального белка-продукта. Внесенная копия заменит по функциям сохранившийся в геноме больного дефектный ген. Все проводимые сегодня клинические испытания используют внесение в клетку дополнительных количеств ДНК.
При корректирующей генотерапии предполагается замена дефектного гена нормальным в результате рекомбинации. Пока этот метод проходит стадию лабораторных испытаний, и его эффективность еще очень низка.
В зависимости от способа введения экзогенных ДНК в геном пациента, существует два принципа лечении:
- генетическая терапия ex vivо (рис. 4.16). Так называемый «терапевтический» ген переносят в изолированные клетки больного с помощью ретровирусных векторов, трансдуцированные клетки культивируют in vitro и снова вводят в организм больного человека;
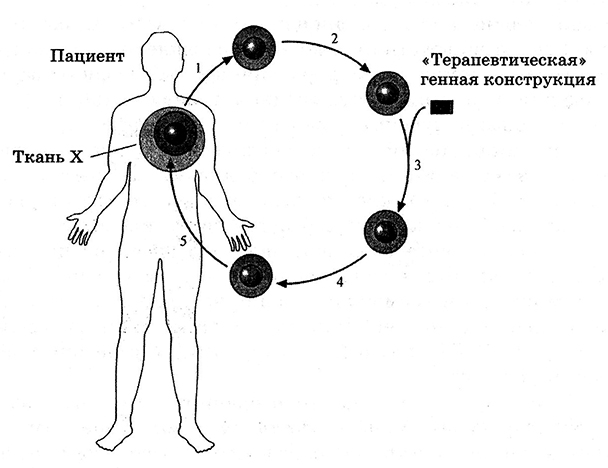
Рис. 4.16. Схематическое представление генной терапии ex vivo. Процедура включает:
1 – получение от пациента клеток с генным дефектом; 2 – культивирование изолированных клеток;
3 – трансфекщню «терапевтической» генной конструкции в изолированные клетки;
4 – отбор, выращивание и тестирование трапсфицированпых клеток;
5 – трансплантацию и трансфузию трансфицированных клеток пациенту
- генетическая терапия in vivo (рис. 4.17). Введение «терапевтического» гена непосредственно в клетки ткани-мишени пациента с помощью вирусных векторов или путем инъекций чистой ДНК, биобаллистики, введения липосом.
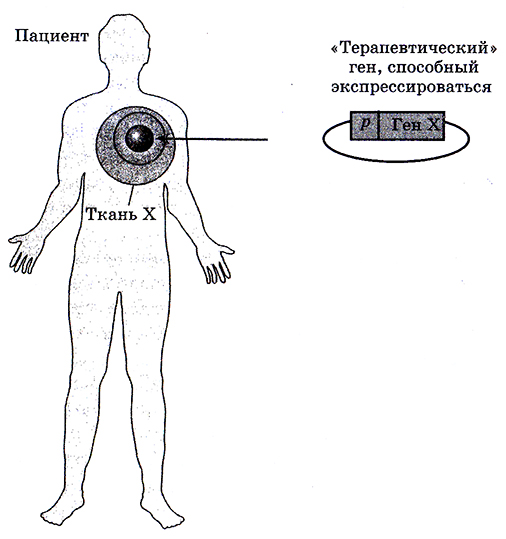
Рис. 4.17. Схематическое представление ген пой терапии in vivo.
Клонированный «терапевтический» ген (ген X) кодирует белок, корректирующий генетический дефект. Этот ген доставляется к клеткам определенной ткани пациента с наследственным заболеванием и экспресеируется в них. Промотор р, под контролем которого осуществляется транскрипция
Для переноса генов чаще всего испольаутот относительно легко доступные клетки: фибробласты, лимфоциты, клетки печени – гепатоциты, эндотслиальные и мышечные клетки, стволовые клетки костного моига, Такие клетки легко извлекаются из организма, затем в них можно включить необходимую генетическую конструкцию, провести отбор и культивирование in vitro трансформированных клеток, после чего вновь ввести их в организм больного. При этом у реципиента не развивается нежелательного иммунного ответа. Однако это сложная и дорогостоящая процедура.
В настоящее время в клиниках экспериментируют с Tлимфоцитами (острый комбинированный иммунодефицит, вызванный дефектом в гене ada) миобластами (мышечная дистрофия Дюшенна: дефект в гене дистрофина), фибробластами (гемофилия – дефекты в генах факторов IX или VIII), клетками эпителия бронхов (мусковисцидоз – дефект в гене cf-трансмембранного фактора) и гепатоцитами (семейная гиперхолестеринемия – дефект в гене рецептора липопротеинов низкой плотности).
В том случае, когда клетки с дефицитным геном нельзя извлекать и культивировать, проводят трансгеноз in vivo. Это очень перспективный подход, рассчитанный на массовое лечение широко распространенных заболеваний, однако пока он апробирован только для лечения мусковисцидоза.
Список наследственных заболеваний, которые пытаются или планируют лечить генами, велик. Это и ревматоидный артрит, и фенилкетонурия, и заболевания, связанные с недостатком гормонов (инсулина, эритропоэтина, гормона роста). Огромные перспективы открывает использование генотерапии для лечения онкологических заболеваний. По мере усовершенствования методов доставки генов и контроля их экспрессии список заболеваний, к которым можно применять генотерапию, будет безусловно расширяться.
Таким образом, в будущем генетическая терапия может стать одним из ведущих направлений в лечении наследственной патологии человека в связи с возможностью исправлять функции генетического аппарата больного, нормализуя его фенотип.

