Все живые организмы на нашей планете образуют различные соединения первичного метаболизма, такие, как углеводы, белки, липиды, витамины и другие вещества, необходимые для роста и развития. Их содержание и состав зависят от генетических характеристик объектов, стадии онтогенеза и условий произрастания.
Помимо первичных метаболитов, у некоторых организмов (преимущественно растений) осуществляется синтез так называемых вторичных метаболитов, к которым относятся алкалоиды, терпеноиды, стероиды, фенольные соединения, цианогенные гликозиды и др. (рис. 6.1). Эти низкомолекулярные вещества во многих случаях характерны для определенных видов растений, а их синтез в значительно большей степени видоспецифичен, чем синтез первичных метаболитов.
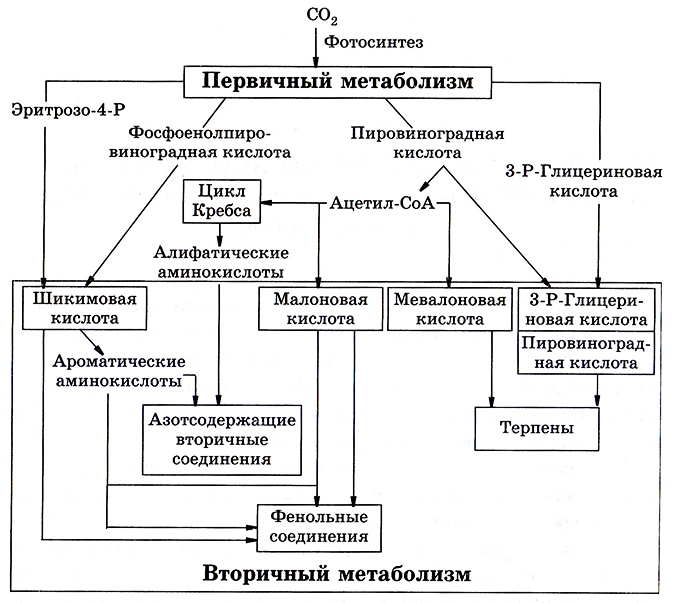
Рис. 6.1. Основные пути синтеза вторичных соединений и их связь с первичным обменом веществ
Все это свидетельствует о чрезвычайном разнообразии соединений, образуемых живыми организмами. Многие из них имеют важное народнохозяйственное значение и поэтому являются целевыми продуктами биотехнологических производств.
Обмен веществ клетки подчиняется сложнейшей системе регуляции. Задачей же биотехнолога является обеспечение сверхсинтеза необходимых для практических целей продуктов метаболизма, что достигается путем изменения как регуляторных систем метаболизма, так и генетических программ.
6.1. Основные методы и подходы, используемые
в промышленной биотехнологии
Как мы уже говорили, биотехнология – это целенаправленное получение ценных продуктов за счет использования биохимической деятельности микроорганизмов, изолированных клеток или их компонентов.
Преимущества биотехнологических производств:
- возможность получения специфичных и уникальных природных веществ, часть из которых (например, белки, ДНК) еще не удается получать другим путем (например, химическим синтезом);
- проведение 6иппмюлогически> процессов при m-im сительно невысоких температурах и дшшпшнх;
- высокие скорости jkh-tji 11 накоплении йипмяссы;
- использование в кнчгетие сырья дсмн-нмч отходов сельского хозяйства и промыш ленности;
- биотехнологические πρυυ,ιчтм обычно ЭК1 unmiчπ(>ι, дают меньше вредных отходов и блм.нш к протекающим " природе естественным процессам;
- технология и аппаратура биотех пол отческих производств просты, а также недороги.
Продукты биотехнологии получают по инд tint ι дуальным технологиям, используя для этого определенные биологические агенты, сырье, число стадий производства и их технологические режимы, которые могут сильно варьи ропать. В то же время для всех биотехнологических производств существует типовая схема.
К определяющим факторам биотехнологического процесса относят:
- вид используемого биотехнологического процесса;
- субстрат с его биохимическими и биофизическими характеристиками;
- аппаратуру, включая систему контроля управления;
- технологический режим и соответствие требованиям ГОСТа.
Промышленный биотехнологический процесс, в котором для производства коммерческих продуктов используют клеточные системы или микроорганизмы, обычно включает три ключевые стадии:
- подготовительную (обработка сырья, используемого в качестве источника питательных веществ, и приготовление, если это необходимо, питательных сред);
- биотехнологическую (рост микроорганизмов-мишеней в большом – обычно объемом более 100 л – биореакторе (ферментация) с последующим образованием нужного метаболита, например антибиотика, аминокислоты или белка (биотрансформация));
- получения готовой продукции (очистка целевого продукта от компонентов культуральной среды или от клеточной массы)·
Подготовительная стадия необходима для приготовления сырья, используемого в биотехнологическом процессе. В зависимости от целевого продукта, при этом предусматриваются:
- приготовление среды, включающей необходимые компоненты питания для организмов, и ее стерилизация (для асептических биотехнологических процессов, при которых нежелательно попадание посторонней микрофлоры);
- подготовка и стерилизация газов (обычно воздуха) путем очистки от пыли, влаги и присутствующих в воздухе микроорганизмов, включая споры;
- подготовка посевного материала, в том числе культивирование микроорганизмов, изолированных клеток растений или животных;
- подготовка биокатализатора – либо фермента в свободном или закрепленном на носителе виде, либо биомассы микроорганизмов, выращенных до состояния, в котором проявляется их ферментативная активность;
- предварительная обработка сырья, если оно поступает в непригодном для непосредственного использования в биотехнологическом процессе виде. Например, при получении спирта пшеницу сначала дробят, а затем подвергают ферментативному процессу «осахаривания». Другой пример – использование древесины для получения дрожжей: ее сначала измельчают, а затем подвергают нагреву до 200 °C в кислой среде. В результате кислотного гидролиза происходит превращение древесины в раствор глюкозы и лигнин. Раствор глюкозы (гидролизат) как раз и используют в биотехнологическом процессе для получения кормовых дрожжей.
Биотехнологическая стадия – основная в биотехнологическом производстве. Именно на этой стадии с использованием того или иного биологического агента (микроорганизмов, изолированных клеток, ферментов или клеточных органелл) происходит преобразование сырья в тот или иной целевой продукт.
Главной целью является получение определенного органического вещества. Однако биотехнологическая стадия, как правило, включает не только синтез новых органических соединений, но и ряд других биотехнологических процессов, таких, как:
- ферментация – процесс, осуществляеммй с помощью ферментов культивируемых микроорганизмов;
- биотрансформация – процесс изменения химической структуры вещества под действием ферментативной шстивности клеток или готовых ферментов;
- биокатализ – химические превращения вещества, протекающие с использованием биокатализаторов-ферментов;
- биоокисление – окисление загрязняющих веществ с помощью микроорганизмов или ассоциации микроорганизмов в аэробных условиях;
- метановое брожение – переработка органических отходов с помощью ассоциации метаногенных микроорганизмов в анаэробных условиях;
- биокомпостирование – снижение содержания вредных органических веществ в твердых отходах;
- биосорбция – сорбция вредных примесей из газов или жидкостей (обычно осуществляется закрепленными на специальных твердых носителях микроорганизмами);
- бактериальное выщелачивание – процесс перевода нерастворимых в воде соединений металлов в растворенное состояние под действием специальных микроорганизмов;
- биодеградация – разрушение вредных соединений, осуществляемая микроорганизмами-биодеструкторами.
Обычно биотехнологическая стадия завершается выходом одного жидкостного и одного газового потоков, иногда – только одного жидкостного или переработанного твердого продукта, например при созревании сыра или биокомпостировании отходов.
Получение готовой продукции – заключительная стадия технологического процесса биотехнологического производства. Чаще всего целевой продукт находится либо в самой биомассе, либо в жидкости. В зависимости от свойств биомассы и жидкости, для их разделения могут быть использованы различные методы:
- отстаивание – разделение под действием гравитационных сил (обычно при очистке сточных вод);
- фильтрация – пропускание суспензии через фильтрующий материал, на котором задерживаются частицы твердой фазы – биомасса. Такой способ применяют в производстве антибиотиков, особенно в тех случаях, когда микроорганизм-продуцент имеет мицелиальный характер;
- сепарация, центрифугирование – разделение под действием центробежных сил. Наиболее часто используют для отделения дрожжей или бактерий в производстве кормовой биомассы;
- микрофильтрация, улътрафилътрация – пропускание суспензии через мембраны с весьма малым размером пор, обеспечивающее удерживание клеток микроорганизмов на мембране и получение чистого раствора. При ультрафильтрации отделяются не только клетки, но и крупные молекулы растворенных веществ;
- коагуляция – добавление в суспензию реагентов, способствующих образованию и осаждению более крупных клеточных частиц, и отделению их от жидкости методом отстаивания;
- флотация – захват микроорганизмов пузырьками пены и выделение их из пенной фракции.
Целевые продукты биосинтеза могут быть внеклеточными и внутриклеточными.
Для внутриклеточных продуктов сначала необходимо разрушить оболочку клеток. Это можно осуществить дезинтеграцией клеток, разрушив клеточную оболочку физическими методами (с помощью мелющих тел, путем замораживания и продавливания, воздействием ультразвуком, методом декомпрессии – резкого сброса давления) или химическими и биотехнологическими методами. Используют также гидролиз (разрушение клеточных оболочек под действием химических реагентов и температуры), ферментолиз (разрушение клеточных оболочек под действием ферментов при повышенной температуре) или автолиз (разновидность ферментолиза, когда используют собственные ферменты клетки).
После проведения какой-либо из вышеперечисленных операций дальнейшее выделение целевого продукта осуществляют методами, общими для внеклеточных и внутриклеточных продуктов. Основными из них являются:
- экстракция – переход целевого продукта из водной фазы в не смешивающуюся с водой органическую жидкость (экстрагент). Наиболее известно выделение жироподобных веществ жидкими углеводородами (типа бензина). Применяют и многие другие виды экстрагентов (хлороформ, эфир, иутилацетат). Иногда экстракцию осуществляют непосредственно из биомассы микроорганизмов;
- осаждение – выделение целевого продукта путем добавления к жидкости реагента, взаимодействующего с растворенным продуктом и переводящего его в твердую фазу;
- адсорбция – перевод растворенного в жидкости продукта в твердую фазу путем его сорбции на специальных твердых носителях (сорбентах);
- ионный обмен – в твердую фазу переходят ионы (катионы или анионы), а не молекула целевого продукта или примеси;
- отгонка, ректификация – выделение растворенных и культуральной жидкости легкокипящих продуктов, например этилового спирта;
- ультрафилътрация, нанофилътрация и обратный осмос – выделение высокомолекулярных соединений (белков, полипептидов, полинуклеотидов). Обратный осмос и нанофильтрация позволяют отделять даже небольшие по размеру молекулы;
- центрифугирование, ультрацентрифугирование – иыделение вирусов, клеточных органелл, высокомолекулярных соединений.
Очистка необходима для получения биопродуктов высокой степени чистоты. Основной целью является удаление примесей, что достигается с помощью экстракции, адсорбции, ионного обмена, ультрафильтрации, обратного осмоса, ректификации и ферментолиза, которые были рассмотрены ранее. Кроме перечисленных, используют и другие процессы, такие, как:
- хроматография – процесс, напоминающий адсорбцию. На твердом сорбенте собираются растворенные вещества, часто близкие по структуре (например, смеси белков, нуклеотидов, Сахаров, антибиотиков). При адсорбции они десорбируются вместе, а вот при хроматографии они выделяются из сорбента как бы по очереди, что позволяет отделить их друг от друга;
- диализ – процесс, в котором через полупроницаемую пленку могут проходить низкомолекулярные вещества, а высокомолекулярные остаются. Путем диализа осуществляют очистку вакцин и ферментов от солей и низкомолекулярных растворимых примесей;
- кристаллизация – процесс, основанный на различной растворимости веществ при разных температурах. Медленное охлаждение позволяет формировать кристаллы из растворов целевых продуктов, причем чистота их обычно очень высока. Таким образом, например, получают кристаллы пенициллина. Можно даже получить еще более чистый продукт, если кристаллы растворить в воде или растворителе, а потом снова кристаллизовать (т. е. провести процесс перекристаллизации ).
Концентрирование продукта повышает его выход. Известно, что после биотехнологической стадии содержание продукта обычно составляет примерно 0,1-1 %, после стадии отделения биомассы – 0,1-2 %, после стадии выделения – 1-10 %, после стадии очистки – 50-80 % и, наконец, после стадии концентрирования – 90-100 %.
На стадии концентрирования применяют такие процессы, как выпаривание, сушка, осаждение, кристаллизация, фильтрация, ультрафильтрация, гиперфильтрация или нанофильтрация, обеспечивающие как бы отжим растворителя из раствора.
Получение готовой формы продукта завершает биотехнологическое производство. Продукт приобретает товарную форму за счет проведения процессов гранулирования (формирование гранул из порошка или прямо из раствора), дражирования, таблетирования (формирование драже, таблеток), розлива или фасовки, ампулирования (затаривания в ампулы).
6.2. Технологическое оборудование промышленного назначения
Для культивирования различных биологических объектов, в том числе микроорганизмов и культур клеток, в зависимости от поставленных задач используют различное технологическое оборудование. Это могут быть качалки и роллеры – при лабораторных исследованиях, биореакторы и ферментеры – при промышленных производствах.
В лабораторных условиях часто используют качалки и роллерные установки, вращение которых предотвращает седиментацию (осаждение) клеток и обеспечивает достаточную концентрацию растворенного кислорода. В большинстве случаев скорость вращения составляет 50-120 об/мин для круговых качалок и 1-20 об/мин – для роллерных установок. Несмотря на различные способы перемешивания клеточных культур, отличия в продуктивности и росте клеток незначительны.
Промышленное выращивание клеток растений осуществляют в биореакторах или ферментерах. Их подразделяют на две группы: по конструкции и по принципу перемешивания культуральной жидкости (рис, 6.2).
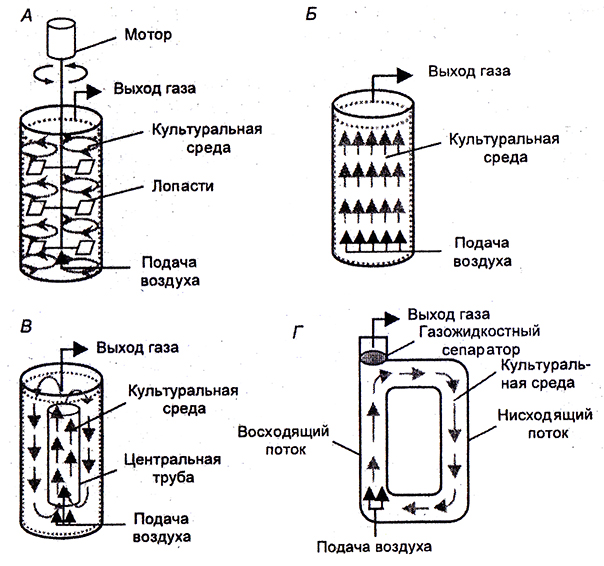
Рис. 6.2. Упрощенные схемы биореакторов различных типов:
А – реактор с механическим перемешиванием; Б – барботажная колонна; В – эрлифтный реактор с внутренней циркуляцией; Г – эрлифтный реактор с внешней циркуляцией. Стрелки указынпют направление потока культуральной среды
В биореакторах, относящихся к первой группе, перемешивание клеток происходит путем аэрирования воздухом. Это барботажный тип биореактора, при котором процесс перемешивания суспензии осуществляется поднимающимися пузырьками воздуха. В случае барботажных биореакторов обычно получают хорошие ростовые характеристики для большого числа клеточных культур. Однако сложность поддержания суспензии в гомогенном состоянии при высоких концентрациях биомассы клеток сужает сферу их применения.
Несколько больших значений максимальной концентрации клеточной биомассы можно достичь при применении эрлифтных биореакторов, в которых создаются направленные циркуляционные потоки. В эрлифтных биореакторах перемешивание суспензии осуществляется за счет применения специальной конструкции, создающей градиент плотности (как правило, это конструкция с внутренним цилиндром).
Вторая группа биореакторов представляет собой аппараты с применением механических перемешивающих устройств. Биореакторы этого типа позволяют изучать растительные клеточные популяции в очень широком диапазоне концентраций биомассы клеток. Вместе с тем стрессовое воздействие перемешивающего устройства на клеточную популяцию часто ограничивает их применение.
Выращивание растительных клеточных культур и микроорганизмов в биореакторах можно проводить в режимах периодического и проточного (непрерывного) культивирования.
Периодическое культивирование – это аналог выращивания клеточных культур в колбах на качалке. Периодическую культуру можно рассматривать как замкнутую систему, которая в своем развитии проходит четыре фазы – начальную, экспоненциальную, стационарную и отмирания. Условия существования культуры во всех этих фазах различны.
Проточное (непрерывное) культивирование характеризуется постоянным добавлением в биореактор свежей питательной среды и постоянным отбором либо суспензии (открытое проточное культивирование), либо отработанной среды (закрытое проточное культивирование). Непрерывная культура представляет собой открытую систему, стремнщуюся к установлению динамического равновесия. Для организмов создаются неизменные условия среды. Проточное культивирование конструктивно более сложно и поддается автоматическому регулированию, так как связано с ииедением в схему биореактора дополнительных устройств (перистальтических насосов, разделительных устройств и др.).
В периодической культуре условия все время меняются: плотность культуры возрастает, а концентрация субстрата уменьшается. Однако очень часто требуется, чтобы клетки могли долгое время находиться в фазе экспоненциального роста при постоянной концентрации субстрата в неизменных прочих условиях. Этого можно достичь, если в сосуд, содержащий культуру клеток, непрерывно вводить новый питательный раствор и одновременно удалять из него соотпетствующее количество клеточной суспензии.
Применение проточных сред при культивировании тканей обеспечивает динамичность и большее постоянство условий их питания. Преимущество проточной питательной среды над непроточными твердой и жидкой средами наблюдалось при выращивании незрелых зародышей. Сложность методического и технического обеспечения проточности питательных сред в процессе выращивания, очевидно, является причиной того, что эти среды еще не нашли широкого применения. Однако моделирование условий питания при проточности питательной среды стоит ближе к нативным условиям. Это преимущество, по-видимому, будет учитываться при дальнейшем совершенствовании условий питания в культуре ткани.
В практике микробиологических исследований широко применяют две разновидности открытого проточного культивирования: хемостатный и турбидостатный методы.
Хемостатный метод культивирования клеток базируется на использовании биореактора, в который с постоянной скоростью подается питательная среда и одновременно с той же скоростью (например, слив по уровню) отбирается клеточная суспензия. При этом объем выращиваемой суспензии остается постоянным. Хемостат состоит из сосуда-культиватора, в который из особого резервуара поступает с постоянной скоростью питательный раствор. Благодаря аэрации и механическому перемешиванию, в культиваторе создаются оптимальные условия для снабжения клеток кислородом и более быстрого и равномерного распределения питательных веществ, поступающих с новыми порциями раствора. Рост культуры в хемостате контролируется концентрацией субстратов. На таком ограничении скорости роста концентрацией одного из необходимых субстратов основана стабильность системы.
Турбидостатный метод предусматривает измерение концентрации клеточной биомассы в биореакторе и ее автоматическое поддержание на постоянном уровне путем изменения скорости протока. Работа турбидостата основана на поддержании постоянной плотности суспензии, или постоянной мутности. Датчик мутности регулирует через управляющую систему поступление питательного раствора. В сосуде для культивирования все питательные вещества содержатся в избытке, и скорость роста культуры приближается к максимальной. Турбидостат используют при скоростях протока, близких к максимальной удельной скорости роста, тогда как хемостат иногда становится неустойчивым и может произойти полное вымывание культуры из биореактора. Работа с турбидостатами технически сложнее, чем с хемостатами.
Хемостатный метод культивирования позволяет выделять фактор (чаще всего концентрацию ростлимитирующего компонента питательной среды), определяющий физиологобиохимическое состояние клеточной популяции. Так, было показано, что удельная скорость роста популяции клеток Acer pseudoplatanus L. может контролироваться концентрацией нитрата в питательной среде согласно соотношению, определенному Ж. JI. Моно для бактерий.
В то же время в условиях хемостатного выращивания не всегда удается поддерживать в течение продолжительного времени стационарное состояние культур растительных клеток. Например, культура клеток табака, выросшая в условиях хемостата на стандартной питательной среде для периодического выращивания, после одной-двух недель темнела и лизировалась. Только после увеличения концентрации всех компонентов в среде удалось получить (в условиях хемостата) стабильное состояние культуры клеток в течение 73 суток. (Следовательно, для поддержания стабильно пролиферпрующей культуры необходимо обеспечивать достаточно и ι «м'окую концентрацию компонентов питательной среды.
Наряду с лимитирующей концентрацией субстрата, на развитие суспензионной культуры растительных клеток, рлстутцей в условиях хемостата, значительное влияние окаимнает и скорость протока суспензии. Ее увеличение выше максимальной удельной скорости роста клеток приводит к иммыванию культуры из биореакторов. Поэтому данный мотод непригоден для изучения медленно растущих (медмшио делящихся) клеточных популяций.
Новые возможности изучения физиолого-биохимическоIO состояния клеточной популяции появляются при использовании «закрытого протока», когда не происходит удаления клеточной биомассы. При этом питательная среда добавляется в биореактор постоянно, и с той же скоростью мл него удаляется бесклеточная культуральная жидкость. Данный режим выращивания растительных клеток пранильнее было бы называть закрытым по биомассе протоком, однако обычно употребляют термин «закрытый проток», несмотря на его формальную нелогичность.
В заключение отметим преимущества и недостатки периодических и полупериодических процессов ферментации.
Преимущества:
- малая стоимость аппарата и системы управления;
- гибкость, т. е. возможность наработки в одном биореакторе разных продуктов;
- время культивирования можно произвольно менять;
- процесс менее подвержен инфицированию, мутациям клеток вследствие отсутствия протока и притока из-за относительно малого времени ферментации;
- процесс удобен для получения малых количеств продукта;
- условия культивирования можно поддерживать в оптимуме как в фазе роста биомассы, так и в фазе биосинтеза продукта, причем оптимальные условия для биомассы и продукта могут быть различны;
- процесс удобен для реализации биосинтеза вторичных метаболитов.
Недостатки:
- необходимость приготовления посевного материала;
- велико непродуктивное время ферментации;
- в связи с частой стерилизацией быстрее изнашиваются измерительные приборы, особенно датчики величины рН;
- производительность по биомассе и продукту часто ниже, чем при непрерывном процессе.
6.3. Продукты биотехнологии и блок-схемы их производств
Продукты, получаемые биотехнологическими способами, отличаются не только по цвету, вкусу, запаху или химическому составу, но и по тому, какое место в типовой технологической схеме они занимают.
Продуктами биотехнологического производства могут быть:
1. Газы – со стадии ферментации (диоксид углерода – при спиртовом производстве, биогаз – при переработке отходов путем метанового брожения, водород – при культивировании фототрофов).
2. Среда ферментации – культуральная жидкость вместе с микроорганизмами (например, кефир, йогурт) или твердый субстрат (например, сыр или ферментированная с заквасками колбаса).
3. Жидкость (осветленная, надосадочная, нативный раствор, фильтрат, угат, пермеат или супернатант), полученная после отделения биомассы, или ее концентрат. Готовые продукты на этой основе – пиво, вино, квас. Концентрат культуральной жидкости обычно получают выпариванием или высушиванием (например, кормовой лизин или кормовые антибиотики).
4. Биомасса инактивированная (например, кормовые дрожжи, которые на завершающих стадиях подвергают тепловой стерилизации).
5. Биопрепарат – жизнеспособная биомасса микроорганизмов в жидком или высушенном виде (пекарские дрожжи, бактериальные средства защиты растений, деструкторы нефтяных загрязнений, бактериальные удобрения, силосные закваски и т. п.).
6. Ослабленная биомасса микроорганизмов (например, живые вакцины, полученные при обработке клеток патоген пых микроорганизмов тепловыми воздействиями или химическими реагентами для снижения их патогенности).
7. Внеклеточные и внутриклеточные биопродукты. Чрезвычайно разнообразны по своей структуре, могут быть легкокипящей жидкостью (например, этанол, выделяемый из среды отгонкой или ректификацией) или твердым веществом (многие медицинские антибиотики, чистые пищевые или медицинские аминокислоты, лимонная кислота).
8. Переработанная биомасса микроорганизмов – гидролизаты и ферментолизаты, используемые как источники кормления для животных или как вкусовые добавки; клеточные оболочки, получаемые после разрушения микроорганизмов и применяемые как сорбент для очистки соков, иина, пищевых жидкостей.
9. Очищенная от загрязнений жидкость (например, при очистке сточных вод) или твердая среда (например, почва при микробиологической очистке ее от нефтяных загрязнений).
10. Жидкая среда (культуральная жидкость) с экстрагированными (выщелоченными) из твердой фазы компонентами (например, бактериальное выщелачивание металлов из руд, микробиологическое обессеривание угля и нефти).
Все эти продукты получают по технологическим схемам, или блок-схемам, содержащим несколько стадий. В каждом конкретном случае это определяется целевой задачей, а также свойствами микроорганизмов, сырья и самого готового продукта.
Блок-схема – это последовательность технологических стадий биотехнологического производства, необходимых для получения продукта. Рассмотрим несколько примеров блок-схем производства различных продуктов.
Блок-схема производства биогаза (рис. 6.3) значительно короче общей типовой схемы и включает подготовительные стадии, стадию метанового брожения и сушку как стадию концентрирования. Компримирование (сжатие) биогаза можно рассматривать как создание его готовой формы.
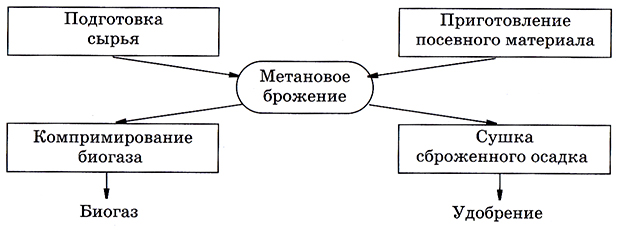
Рис. 6.3. Блок-схема производства биогаза
В производстве йогурта (рис. 6.4) предусмотрены две подготовительные стадии, одна биотехнологическая и стадия розлива, представляющая собой приведение продукта к готовой форме.
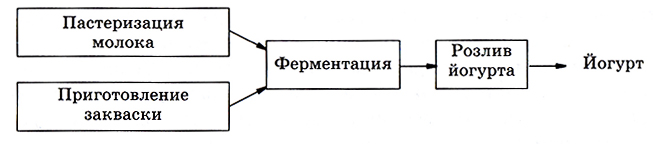
Рис. 6.4. Блок-схема производства йогурта
Процесс производства хлеба схематически представлен на рис. 6.5. Приготовление опары (суспензии муки в воде) аналогично приготовлению среды в биотехнологических производствах. В опару добавляют дрожжи для брожения, затем вновь муку (замес теста) и проводят анаэробный биологический процесс брожения. Далее тесто делят на заготовки, и они уже в третий раз подвергаются воздействию дрожжей в процессе расстойки. При этом диоксид углерода, образующийся при брожении, увеличивает объем хлеба и создает его пористость. Стадия выпечки закрепляет полученный результат и превращает, по существу, жидкий полупродукт в твердое тело – хлеб и хлебобулочные изделия.
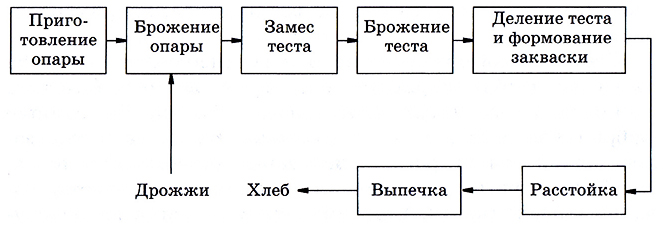
Рис. 6.5. Блок-схема производства хлеба
Приведенные примеры показывают, что биотехнологические производства включают в себя как специфические для биотехнологии стадии (ферментация, биоокисление, биотрансформация, брожение, бактериальное выщелачивание, биокомпостирование, ферментолиз, стерилизация среды и воздуха, дезинтеграция микроорганизмов), так и множество стадий, встречающихся в химической технологии (фильтрация, сепарация, отстаивание, экстракция, сушка, выпаривание, ультрафильтрация и обратный осмос, кристаллизация, ректификация, коагуляция и др.). Эти стадии, конечно, имеют свою специфику в биотехнологических производствах в связи с физическими и физико-химическими свойствами биологического объекта, его лабильностью и вариабельностью.
6.4. Белковые продукты
Биотехнологические методы применяют для получения разнообразных соединений, имеющих коммерческую ценность и являющихся продуктами жизнедеятельности микроорганизмов, а также клеточных культур растений и животных. В первую очередь это соединения первичного метаболизма, широко используемые в народном хозяйстве (белки, аминокислоты, витамины и другие соединения). Остановимся на некоторых из них.
Самыми важными веществами всех живых организмов являются белки – азотсодержащие вещества, различные по своему строению и молекулярной массе. В составе белков содержится примерно 16 % азота, а также углерод, водород, кислород и – часто – другие элементы, такие, как сера, фосфор, железо (молекула гемоглобина, например, содержит четыре атома железа) и медь.
Структурообразующие белки тела животных и человека называют фибриллярными или волокнистыми белками. Они имеют вытянутую нитеобразную форму. Важнейшие фибриллярные белки – это кератин (входит в состав волос, ногтей, мышц, рогов, игл и перьев животных) и коллаген (структурный компонент сухожилий, кожи, костей, соединительной ткани). При кипячении коллаген гидролизуется и образует растворимый в воде белок – желатин.
Белок животного происхождения – наиболее дефицитный компонент пищи. Мировая потребность в нем в настоящее время удовлетворяется лишь на 40 %. В связи с этим необходим поиск (в том числе и методами промышленной биотехнологии) ресурсов белка для пищевых целей.
Одним из современных способов получения белковых веществ является микробиологический синтез, поскольку по скорости роста микроорганизмы превосходят сельскохозяйственные культуры в сотни, а животных – в тысячи раз. Кроме того, для микробиологического синтеза не требуется больших земельных площадей, он не зависит от погодных и климатических условий и не загрязняет окружающую среду ядохимикатами.
Микробные белки близки по составу к белкам животного происхождения, и их применение в кормопроизводстве улучшает качество и усвояемость традиционных растительных кормов. Например, 1 т кормовых дрожжей обеспечивает экономию 5 т зерна и увеличивает продуктивность в животноводстве на 15-30 %. Современный средний завод по производству микробного белка мощностью 50 т/год, занимающий площадь 0,2 га, может обеспечить потребность в белке до 10 млн человек. Сельскохозяйственные технологии для таких масштабов производства требуют либо наличия до 16 тыс. га земельных угодий, засеянных пшеницей, либо содержания фермы, производящей 400 поросят в день.
В 1960-е гг. появился термин «белок одноклеточных организмов» (обычно употребляют его сокращенное название – аббревиатуру БОО, от single cell protein – SCP), которым обозначают целые неживые высушенные клетки водорос.лей, дрожжей, бактерий или грибов, используемые в качестве белкового продукта для кормовых и пищевых целей. И отечественной литературе этот белок называют белковокитаминным концентратом или БОО. Все эти названия несколько условны, так как в биомассах, помимо белков, существенную долю занимают другие компоненты – сахара, дипиды, нуклеиновые кислоты.
Белок одноклеточных организмов должен удовлетворять ряду специальных требований, главные из которых – питательность, перевариваемость, экономическая эффективность. Питательность этого белка, определяемая по химическому составу, близка питательности традиционных белковых продуктов.
Важнейшим условием при разработке новых технологий получения белка одноклеточных является доступность сырья. Это предполагает наличие различных резервных вариантов, позволяющих оперативно заменять и использовать различные источники сырья без существенного изменения качества получаемого продукта. В современных промышленных процессах используют как «чистое» сырье постоянного химического состава, так и комплексные соединения, включая отходы различных производств. Последнее наиболее выгодно экономически и имеет огромное значение для охраны окружающей среды.
Для синтеза белка микроорганизмы способны использовать различные углерод содержащие субстраты:
- углеводы;
- жидкие углеводороды;
- газообразные углеводороды;
- оксидаты углеводородов;
- углекислый газ, включая смеси с водородом.
Независимо от вида используемого сырья, типовая схема микробиологического производства белка включает получение и подготовку сырья, получение посевного материала, ферментацию, выделение, инактивацию, сгущение микробной биомассы, последующее высушивание и стандартизацию готового продукта.
Максимальные скорости синтеза белковых веществ микробными клетками реализуются при оптимальных условиях среды, когда удельная скорость роста близка к максимальной. Поэтому для получения белка одноклеточных биотехнологические процессы реализуют в проточном режиме, который позволяет стабилизировать практически все параметры стадии ферментации на уровнях, оптимальных для размножения клеток со скоростями роста, близкими к максимальной, т. е. в режиме белковой направленности биосинтеза.
Микробная биомасса питательна, если ее компоненты перевариваются ферментами пищеварительного тракта высших животных или человека. Препятствием этому могут быть клеточные стенки отдельных продуцентов, которые предварительно приходится разрушать, а также высокий уровень нуклеиновых кислот. Последние не опасны для высших животных, поскольку они метаболизируются в их организме и выводятся с уриной. Для человека же такой уровень нуклеиновых кислот неприемлем, так как в ходе их усвоения возможно нарушение обмена веществ и возникновение патологических состояний. Поэтому для пищевых целей микробную биомассу предварительно обрабатывают, используя различные методы разрушения и денуклеотизации.
Технология получения микробного белка является в настоящее время самой крупнотоннажной отраслью биотехнологии, производящей важнейшие кормовые препараты, белковые добавки для животноводства, звероводства, птицеводства, рыбоводства, а также белок пищевого назначения с использованием разнообразного сырья и субстратов.
Микроорганизмы, используемые в пищевой промышленности, часто входят в состав конечного продукта (хотя доля их там обычно невелика). Особенность белка одноклеточных организмов заключается в том, что он практически целиком состоит из микробной биомассы и в его производстве нередко принимают участие микробы, которые ранее в пище отсутствовали. По этой причине к белку одноклеточных организмов предъявляются повышенные требования (в том числе требование биобезопасности) учреждениями, контролирующими качество пищевых продуктов. Поэтому производство БОО направлено преимущественно на выработку кормов для животных, а не белков, непосредственно идущих в пищу. Корма для животных должны содержать некоторое количество белка (до 15-20 % – в зависимости от их вида и способа содержания). Для их производства можно использовать более широкий круг субстратов, в том числе и органические вещества отходов, что экономически выгодно.
К БОО-продуктам, производимым промышленностью на корм животным, относятся прутин (Pruteen) фирмы ICI (биомасса бактерий, выращенных на метаноле), топрина (Toprina) фирмы BP (дрожжи, выращенные на алканах) и грибная масса, получаемая по технологии фирмы Finnish Pekilo. При ее производстве в качестве субстрата используют сульфитный щелок – отход бумажной промышленности. Все эти БОО представляют собой слабоокрашенные порошки.
Число БОО-продуктов, используемых в пище, немногочисленно. Это дрожжевой экстракт (гидролизат пекарских дрожжей), применяемый в небольшом количестве как вкусовая и витаминная приправа. Во время Второй мировой войны в пищевых целях в Германии выращивали дрожжи Candida, но это производство не получило дальнейшего развития. Фирма Hoechst выпускает на основе бактерий, растущих на метаноле, продукт, содержащий 90 % белка. Этот продукт получают при фракционировании клеток выращенных бактерий, он обладает определенными функциональными свойствами и может использоваться в пищу. Единственный новый официально разрешенный вид белковой пищи микробного происхождения – это микопротеин, производство которого налажено в Англии фирмой Ranks Hovis Mc Dougal.
Грибной белок микопротеин – это пищевой продукт, состоящий в основном из мицелия гриба. Его производят методом непрерывного выращивания выделенного из почвы штамма Fusarium graminearum. Субстратом для него являются глюкоза и другие питательные вещества, а источниками азота – аммиак и аммонийные соли. После завершения стадии ферментации культуру подвергают термообработке (для уменьшения содержания рибонуклеиновой кислоты), а затем уже отделяют мицелий методом вакуумного фильтрования (рис. 6.6).
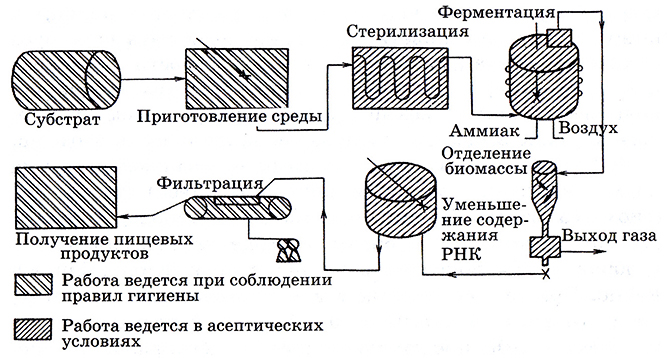
Рис. 6.6. Блок-схема производства микопротеипа
Текстура массы мицелия гриба близка к таковой естественных продуктов и имеет волокнистое строение, поэтому продукту можно придать текстуру мяса, а за счет добавок – мясной вкус и цвет· Для хранения грибной белок обычно замораживают, но иногда и высушивают путем распыления до порошкообразного состояния. Получение микопротеина имеет ряд преимуществ, по сравнению с процессом синтеза белка животными: высокая скорость роста (что характерно для производства всех BOO-продуктов) и более эффективное превращение субстрата в белок.
6.5. Аминокислоты
Аминокислоты являются основными структурными элементами, из которых построены белки и которые определяют многие важные их свойства. Первую аминокислоту глицин – выделил из желатина в 1820 г. А. Бракоино, последнюю – треонин – выделил из гидролилата фибрина в 1935 г. А. Роуз.
Аминокислоты находят широкое применение в качестве кормовых и пищевых добавок, приправ, сырья для фармацевтической и парфюмерной промышленности. При этом из 20 аминокислот, необходимых для построения белка, незаменимыми для человека являются восемь – лейцин, изолейцин, лизин, метионин, треонин, триптофан, валин, фенилаланин. Для сельскохозяйственных животных этот список дополняют гистидин и аргинин, а для молодняка птицы – еще и пролин. В связи с этим аминокислоты добавляют в корма, что сокращает расход дефицитных белков животного происхождения.
За последние годы количество аминокислот, используемых в кормопроизводстве, возросло в 15 раз, что составляет около 70 % от объема их производства. Около 30 % производимых аминокислот применяют в пищевой промышленности. Например, цистеин предотвращает пригорание пищи в процессе приготовления, улучшает качество хлеба при выпечке и усиливает запах пищи. Глицин, обладающий освежающим, сладковатым вкусом, используют при производстве напитков. Глутаминовая кислота способствует усилению вкуса и консервированию пищи. Некоторые аминокислоты (аргинин, метионин, цистеин, фенилаланин и др.) используют в медицине. Широко применяют аминокислоты в химической и фармацевтической промышленности в качестве предшественников при производстве детергентов, полиаминокислот, а также полиуретана и препаратов для сельского хозяйства.
Ежегодно в мире производится около 800 тыс. т аминокислот стоимостью свыше 5 млрд долларов. Более половины от общего объема производства приходится на долю L-глутаминовой кислоты, которую используют для получения глутамата натрия (натриевая соль глутаминовой кислоты) – широко известного усилителя вкуса и аромата.
Получение аминокислот возможно путем химического синтеза, гидролиза природного белкового сырья и биотехнологическим способом.
При химическом синтезе образуется продукт рацемат, содержащий как L-, так и D-формы аминокислот. D-изомеры этих соединений в большинстве случаев токсичны (за исключением глицина и метионина).
Получение оптически активных L-изомеров аминокислот из гидролизатов природных материалов растительного и животного происхождения связано с многоступенчатой и дорогостоящей очисткой.
Процесс биотехнологического производства аминокислот включает прямую микробную ферментацию, микробиологический или ферментативный синтез из предшественников. В настоящее время наиболее распространен микробиологический метод. Он основан на способности микроорганизмов синтезировать все L-аминокислоты, а в определенных условиях – осуществлять их сверхсинтез.
Образование каждой аминокислоты в микробных клетках строго определено и находится под четким генетическим контролем (рис, 6.7). Он осуществляется по мринцииу обратной связи на уровне генов, ответственных за синтез соответствующих ферментов (репрессия), и на уровне самих ферментов, которые в результате избытка образующихся аминокислот могут изменять свою активность (ретроингибирование). Данный механизм контроля исключает перепроизводство аминокислот, а также препятствует их выделению из клеток в окружающую среду.
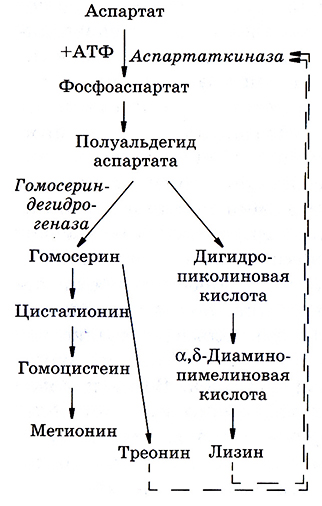
Рис. 6.7. Схема биосинтеза лизина, метионнна
и треонина в клетках микроорганизмов.
Стрелка указывает ингибирование но принципу обратной связи
Чтобы добиться сверхсинтеза отдельных аминокислот, нужно «обойти» или изменить механизм их синтеза. Для этого можно использовать природные («дикие») штаммы, оптимизировать условия ферментации, можно также добиться дисбаланса в метаболизме ами-покислот за счет изменения некоторых факторов среды (концентрации основного субстрата, рН, соотношения макрои микроэлементов и др.).
В промышленных масштабах аминокислоты получают либо экстракцией из белковых гидролизатов, либо очисткой продуктов метаболизма двух неспорулирующих грамположительных почвенных бактерий, например Corynebacterium или Brevibacterium spp. Обычно для повышения их продуктивности используют мутагенез с последующим отбором штаммов – сверхпродуцентов определенных аминокислот. Однако такой способ их получения требует много времени, а эффективность его невелика.
Альтернативным подходом является выделение и изменение специфических генов, кодирующих ключевые ферменты определенных биохимических реакций. Таков, например, генно-инженерный способ получения аминокислоты триптофана, синтезируемой Corynebacterium glutatamicum. Это достигается введением в клетки «дикого» типа копии гена, кодирующего антранилатсинтазу – фермент, лимитирующий синтез триптофана. Высокий уровень биосинтеза триптофана достигается также введением в клетки С. glutatamicum модифицированных генов трех ключевых ферментов его биосинтеза: З-дезокси-Д-арабиногептулозонат-7-фосфатсинтазы, антранилатсинтазы и антранилатфосфорибозилтрансферазы. В качестве альтернативы для синтеза аминокислот можно использовать E. coli.
Изменение синтеза аминокислот осуществимо генетическими методами, в том числе за счет использования мутантных организмов, таких, как ауксотрофные и регуляторные мутанты. Промышленные штаммы, как правило, несут несколько мутаций, затрагивающих механизмы регуляции целевой аминокислоты и ее предшественников.
Среди продуцентов аминокислот – различные микроорганизмы, представители родов Corynebacteriumf Brevibacterium9 Bacillus, Aerobacterf Microbacterium9 Escherichia. Для получения таких аминокислот, как L-глутамат, L-валин, L-аланин, L-глутамин и L-пролин, возможно применение природных штаммов и усиление у них продукции аминокислот условиями ферментации. Например, высокий выход глутамата (до 30 г/л) возможен при полном или частичном подавлении активности α-кетоглутаратдегидрогеназы, при добавлении в среду ПАВ и антибиотиков (пенициллина, цефалоспорина).
6.6. Гормоны
С давних времен среди людей нормального телосложения рождаются и лилипуты (примерно 10 человек на 1 млн населения). Доказано, что в период, когда тело растет, у лилипутов отсутствует специальный гормон – соматотропный, или гормон роста; такое нарушение физиологии имеется в генотипе этих людей. Но если в период роста в организм вводить этот гормон, то человек, казалось бы обреченный стать лилипутом, будет расти и достигнет нормального роста.
Соматотропный гормон (соматотропин, соматропин) является одним из гормонов передней доли гипофиза. По строению соматотропин является пептидным гормоном, состоит из 121 аминокислотного остатка, его молекулярная масса равна 20 кДа.
Влияние соматотропина на процессы метаболизма. Соматотропин играет существенную роль в постнатальном развитии организма, контролируя многие стороны углеводного, липидного и минерального обмена. Гормоном роста его называют потому, что у детей и подростков, а также у молодых людей с еще не закрывшимися зонами роста в костях он вызывает выраженное ускорение линейного (в длину) роста, в основном за счет длинных трубчатых костей конечностей. Дефицит гормона приводит к карликовости, лечение которой проводится посредством соматотропинотерапии. Секреция соматотропина максимальна у подростков в период интенсивного линейного роста и полового созревания. С возрастом она постепенно понижается и минимальна у пожилых людей.
Соматотропин оказывает мощное анаболическое и антикатаболическое действие, усиливает синтез белка и тормозит его распад, а также способствует снижению отложения подкожного жира, усилению его сгорания и увеличению соотношения мышечной массы к жировой. Кроме того, соматотропин принимает участие в регуляции углеводного обмена: он вызывает выраженное повышение уровня глюкозы в крови и является одним из гормонов-антагонистов инсулина по действию на углеводный обмен. При гипогликемии уровень соматотропина в крови резко повышается – это один из естественных физиологических механизмов быстрой коррекции гипогликемии.
Соматотропный гормон можно добывать дорогим и неприятным способом – из гипофиза мозга умерших людей.
Использование биотехнологических методов позволило «сконструировать» микроорганизм, способный синтезировать соматотропный гормон, и организовать его производство, которое может удовлетворить все потребности человечества.
Получение соматотропина с использованием генноинженерных методов проводилось с учетом того, что просоматотропин не подвергается процессингу в бактериальной клетке. Первоначально из клеток гипофиза выделили соответствующую мРНК (рис. 6.8). Фрагмент ДНК, кодирующий первых 23 аминокислотных остатка с N-конца, был получен методом химико-ферментативного синтеза, а олигопептид, кодирующий остальные аминокислотные остатки гормона, представлял собой кДНК, полученную посредством обратной транскриптазы на матрице мРНК. Затем оба фрагмента объединяли в одной плазмиде и переносили в E. coli. Такая трансформация и клонирование этого вектора в бактериальных клетках, где осуществляются интенсивная репликация, транскрипция и трансляция, позволили получить необходимое количество гормона. Он обладал биологической активностью, сопоставимой с гипофизарным соматотропином.
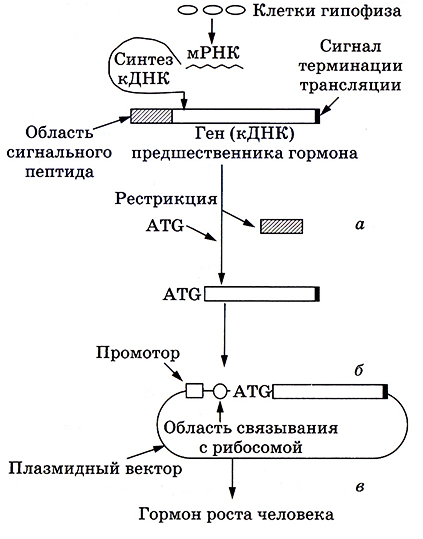
Рис. 6.8. Схема получения гормона роста человека:
α – выщепление рестриктазной области, кодирующей сигнальный пептид,
и присоединение триплета ATG, кодирующего метионин;
б – присоединение к гену промотора и области, необходимой
для связывания мРНК с рибосомой Е. coli, включение в вектор;
в – экспрессия гена в клетках бактерии
Получение генно-инженерного соматотропина явилось решением проблемы обеспечения медицины этим препаратом. Кроме того, он используется и в практическом животноводстве, повышая интенсивность роста животных.
Соматостатин – это один из гормонов гипоталамуса, а также гормон δ-клеток островков Лангерганса поджелудочной железы. По химическому строению это пептидный гормон, содержащий 14 аминокислот. Соматостатин существует в двух биологически активных формах, происходящих от одного предшественника и различающихся длиной N-конца (рис. 6.9).
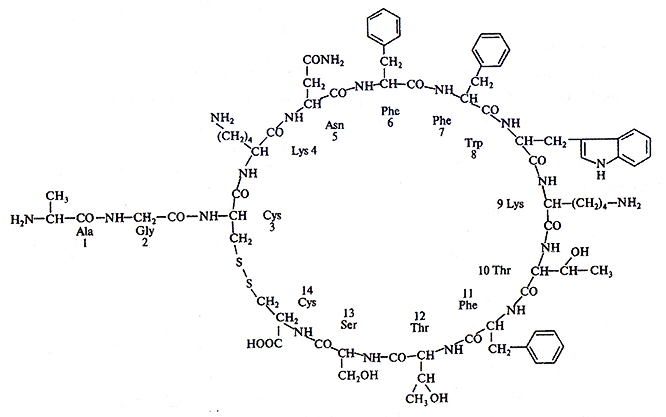
Рис. 6.9. Первичная структура молекулы соматостатина
Соматостатин подавляет секрецию гипоталамусом соматотропин-рилизинг-гормона и секрецию передней долей гипофиза соматотропного гормона, а также секрецию различных гормонально активных пептидов и серотонина, продуцируемых в желудке, кишечнике, печени и поджелудочной железе. Наиболее распространенное фармакологическое воздействие на соматостатинэргическую систему связано с ингибированием выброса гормона роста, что делает данную систему весьма перспективной при лечении опухолевых заболеваний.
Получение соматостатина с использованием генно-инженерных методов представляет собой интересный пример целенаправленного конструирования белков (рис. 6.10).
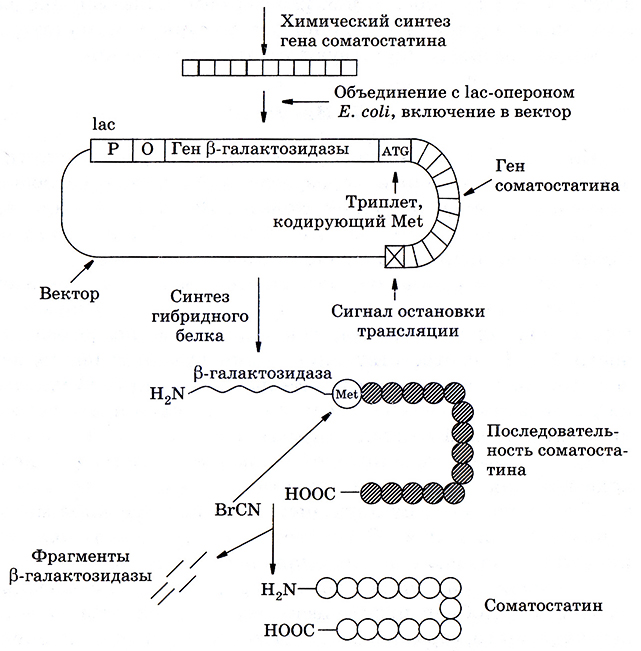
Рис. 6.10. Схема получения соматостатина с использованием генно-инженерных методов
Получить соматостатин в клетках бактерий в значительных количествах первое время не удавалось, так как он быстро разрушался протеолитическими ферментами. Чтобы «обмануть» внутриклеточные бактериальные протеазы, пришлось сконструировать химерный белок – искусственный предшественник соматостатина. В этом белке в качестве N-концевого участка использовали легко синтезируемый белок бактерии, а к нему через аминокислоту метионин присоединили сам соматостатин. Все это сделано на уровне генетического материала ДНК, который затем клонировали в соответствующем векторе. Успех работы обеспечивался предварительным анализом первичной структуры соматостатина, в составе которого отсутствуют остатки метионина.
6.7. Инсулин
Инсулин (от лат. insula – остров) – это гормон пептидной природы, который образуется в β-клегках островков Лангерганса поджелудочной железы. За открытие инсулина Дж. Маклауд и Ф. Бантинг в 1923 г. были удостоены Нобелевской премии по физиологии и медицине.
Синтез инсулина осуществляется через одноцепочечный белок-предшественник – препроинсулин, который содержит сигнальный пептид, аминокислотные последовательности А и В, соответствующие полипептидным цепям зрелого гормона, а также соединительный пептид С. В клетках поджелудочной железы после синтеза белка-предшественника сигнальный пептид отщепляется и образуется тгроинсулин – молекула, в которой сохраняется пептид С, необходимый для правильной ориентации Аи В-цепей гормона. После образования двух дисульфидных мостиков между цепями А и В пептид С удаляется, и образуется молекула инсулина, обладающая гормональными свойствами.
Значение инсулина обусловлено его разнообразным влиянием на обмен практически всех тканей. Основное же действие этого гормона заключается в снижении концентрации глюкозы в крови.
Инсулин увеличивает проницаемость плазматических мембран для глюкозы, активирует ключевые ферменты гликолиза, стимулирует образование в печени и мышцах из глюкозы гликогена, усиливает синтез жиров и белков. Кроме того, он подавляет активность ферментов, расщепляющих гликоген и жиры. То есть, помимо анаболического действия, инсулин обладает также и антикатаболическим эффектом.
Нарушение секреции инсулина вследствие деструкции β-клеток (абсолютная недостаточность инсулина) является ключевым звеном патогенеза сахарного диабета 1-го типа. Нарушение действия инсулина на ткани (относительная инсулиновая недостаточность) приводит к развитию сахарного диабета 2-го типа. В связи с этим инсулин выполняет основную роль в лечении диабета – болезни, по распространенности занимающей третье место в мире после сердечно-сосудистых заболеваний и рака. В Российской Федерации, как и во всем мире, количество больных сахарным диабетом постоянно увеличивается; в настоящее время оно достигает 2 млн человек, из которых более 750 тыс. нуждаются в ежедневном приеме инсулина. Мировая потребность в нем составляет несколько десятков килограммов в год.
Обычно инсулин получают из поджелудочных желез свиней и коров, но гормоны этих животных слегка отличаются от инсулина человека: инсулин свиней отличается одной аминокислотой, а инсулин коров – тремя. Отмечено, что инсулин животных часто вызывает побочные эффекты, в том числе аллергическую реакцию на такой препарат. Кроме того, сами возможности выделения и очистки гормона не беспредельны.
Существуют и другие методы получения инсулина:
- биосинтетический, или полусинтетический;
- генно-инженерный;
- модифицированный генно-инженерный;
- синтетический.
При производстве инсулина полусинтетическим методом используют природные источники сырья. В этом случае от очищенного инсулина свиньи отщепляют С-концевой октапептид В-цепи. Синтезируют С-концевой октапептид человеческого инсулина и присоединяют его химическим способом. Затем удаляют защитные группы и очищают полученный инсулин.
В настоящее время инсулин человека получают в основном двумя способами.
Первый связан с модификацией свиного инсулина синтетико-ферментативным методом. Он основан на том, что свиной инсулин отличается от инсулина человека одной заменой на С-конце В-цепи Ala30Thr. Замену аланина на треонин осуществляют путем катализируемого ферментом отщепления аланина и присоединения вместо него защищенного по карбоксильной группе остатка треонина, присутствующего в реакционной смеси в большом избытке. После отщепления защитной О-трет-бутильной группы получают инсулин человека.
Второй способ получения инсулина человека – генно-инженерный, т. е. биотехнологическое получение инсулина. Оно было осуществлено в 1980-е гг., что имело большое значение для практической медицины. В качестве компетентных клеток использовали E. coli, а гены обеих цепей молекулы человеческого инсулина были получены методом химического синтеза. Эти гены присоединяли к З'-концу гена, кодирующего белок β-галактозидазу, и вводили в векторную плазмиду. Трансформированные клетки Е. coli синтезировали химерные белки, состоящие из А или В-цепи инсулина, присоединенные через метионин к β-галактозидазе. С помощью бромцианина, специфически расщепляющего белки по остатку метионина, выделяли индивидуальную цепь инсулина. Однако образование дисульфидных цепей in vitro стало лимитирующей стадией всего процесса: выход биологически активного вещества был незначителен (вероятно, в связи с отсутствием С-пептида, без которого плохо проходило образование -S-S-мостиков между А и В-цепями инсулина).
Поэтому был разработан метод получения проинсулина человека с последующим созреванием его in tube (рис. 6.11). Были получены двухцепочечные фрагменты ДНК, соответствующие гену, кодирующему человеческий инсулин. Они были встроены в плазмиду и перенесены в Е. coli. Полученные рекомбинантные клетки синтезировали проинсулин, который затем in vitro превращали в зрелый инсулин.
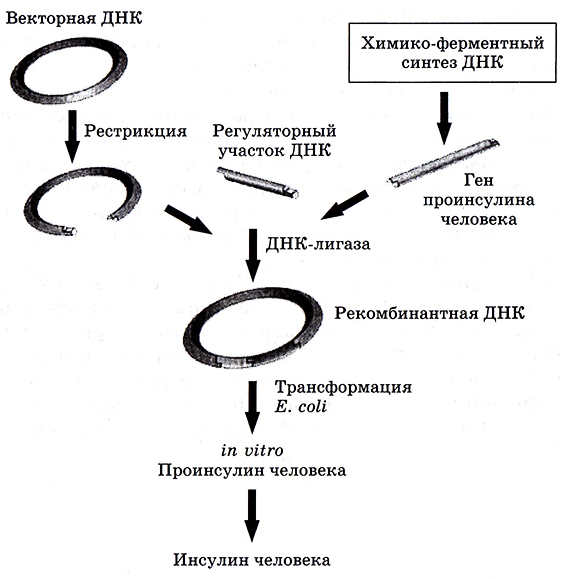
Рис. 6.11. Получение инсулина человека генно-инженерным методом
Инсулин стал первым препаратом, созданным с помощью технологии рекомбшшнтных ДНК. В настоящее время именно такой инсулин широко применяется в медицинской практике.
6.8. Витамины
Витамины – это низкомолекулярные органические вещества, способные в очень низких концентрациях оказывать сильное и разнообразное воздействие на живые организмы. Они принимают активное участие в метаболизме человека и высших животных, оказывая влияние на различные физиологические процессы {цикл трикарбоновыхкислот, распад и синтез жирных кислот, синтез аминокислот и др.). Природным источником многих витаминов являются растения и микроорганизмы.
В производстве многих витаминов ведущие позиции занимает химический синтез. Кроме того, для получения отдельных витаминов огромное значение имеет микробный синтез, например при производстве кормовых препаратов витаминов. Микробиологическим путем получают некоторые витамины группы В, а также эргостерин и каротин, являющиеся, соответственно, предшественниками витамина D2 и провитамина А.
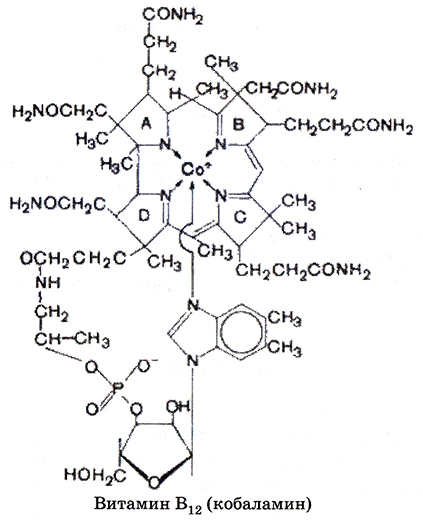
Рис. 6.12. Формула витамина В
Получение витамина B12. Витамин B12 (α-5,6-диметилбензимидазол (ДМБ)-цианокобаламин) необходим для роста и развития многих животных и микроорганизмов (рис. 6.12). Способность к его синтезу широко распространена среди прокариотических микроорганизмов. Активно продуцируют витамин B12 Propionibacterium, а Pseudomonas и смешанные культуры метанобразующих бактерий.
Микробиологический синтез – единственный способ получения витамина B12 – осуществляют в две стадии на основе пропионовокислых бактерий, способных к самостоятельному синтезу коэнзима B12 (аденозилкобаламина 5,6 ДМБ). Первую стадию культивирования проводят в течение 80 ч в анаэробных условиях и при слабом перемешивании (до полной утилизации сахара). Полученную биомассу центрифугируют и сгущенную суспензию инкубируют во втором аппарате еще в течение 88 ч, аэрируя культуру воздухом (2 м3/ч). Питательная среда содержит сахара (обычно глюкозу, 1-10 %), добавки солей железа, марганца, магния и кобальта (10-100 мг/л), кукурузный экстракт (3-7 %) и азот в виде (NH4)2SO4. Ферментацию проводят при 30 °C и рН 6,5-7,0. На второй стадии происходит образование ДМБ. После завершения ферментации витамин извлекают из клеток нагреванием в течение 10-30 мин при 80-120 °С. При последующей обработке горячей клеточной суспензии цианидом происходит образование CN-кобаламина. Продукт сорбируют, пропуская раствор через активированный уголь и окислы алюминия, а затем элюируют водным спиртом или хлороформом. После выпаривания растворителя получают кристаллический витамин B12, выход которого достигает 40 мг/л.
Разработаны эффективные технологии получения витамина B12 и на основе термофильных бацилл Bacillus circuIans, которые выращивают в нестерильных условиях в течение 18 ч при 65-75 °C на питательных средах, приготовленных из соевой и рыбной муки, мясного и кукурузного экстракта. Выход витамина составляет от 2,0 до 6,0 мг/л.
Для нужд животноводства витамин B12 получают на основе смешанной ассоциации, состоящей из четырех культур – углеводсбраживающих, аммонифицирующих, сульфатвосстанавливающих и собственно метанобразующих бактерий, которые взаимосвязанно расщепляют органический субстрат до CO2 и CH4. В качестве субстрата используют декантированную ацетоно-бутиловую барду, содержащую 2,0-2,5 % сухих веществ. Брожение проходит при 55-57 °C в нестерильной культуре в две фазы: на первой образуются жирные кислоты и метан, на второй – метан, углекислота и витамин B12. Длительность процесса в одном аппарате составляет 2,5-3,5 суток, в двух (последовательно) – 2-2,5 суток. Концентрация витамина в барде достигает 850 мкг/л. Параллельно в значительных количествах образуется газ (65 % метана и 30 % углекислоты). Барда имеет слабощелочную реакцию. Для стабилизации витамина ее подкисляют соляной или фосфорной кислотой, затем в выпарном аппарате сгущают до 20 % содержания сухих веществ и высушивают в распылительной сушилке. Содержание B12 в сухом препарате составляет до 100 мкг/г.
Получение витамина B2. Название витамина B2 – рибофлавин – происходит от сахара рибозы, входящего в состав молекулы витамина в виде многоатомного спирта D-рибита. Он широко распространен в природе и в значительных количествах синтезируется растениями, дрожжами, грибами, бактериями.
Животные, не синтезирующие этот витамин, должны получать его в составе комбикормов, поскольку при его дефиците в организме нарушаются процессы белкового обмена, замедляется рост. Препараты рибофлавина используют в медицине для лечения ряда заболеваний, а в животноводстве – в качестве добавки в корма. Микроорганизмы синтезируют рибофлавин и две его коферментные формы – ФАД и ФМН.
Продуцентами витамина B2 являются бактерии (Brevi bacterium ammoniagenes, Micrococcus glutamaticus), дрожжи (Candida guilliermondii, С. flaveri), микроскопические (Ashbya gossypii, Eremothecium ashbyii) и плесневые (Aspergillus niger) грибы.
Промышленное получение рибофлавина осуществляют химическим, микробиологическим и комбинированным синтезом. В последнем случае синтезированная микроорганизмами рибоза химически трансформируется в B2.
Для медицинских целей микробиологический рибофлавин получают на основе гриба Aspergillus. Для высоких выходов витамина (до 7 г/л) используют усовершенствованные штаммы и оптимизированные среды, содержащие (в %): кукурузный экстракт – 2,25; пептон – 3,5; соевое масло – 4,5 и стимуляторы (пептоны, глицин). Используют активный ииокулят, которым засевают стерильную среду. Ферментацию проводят в течение семи суток при 28 °C и хорошей аэрации. Исходный рН составляет около 7,0, в ходе ферментации в связи с выделением кислот среда подкисляется до рН 4,0-4,5. После использования углеродного субстрата продуцент начинает утилизировать кислоты, рН повышается, и затем начинается образование витамина B2. При этом кристаллы рибофлавина накапливаются в гифах и вне мицелия. На постферментационной стадии для выделения витамина мицелий нагревают в течение 1 ч при 120 °C.
В ряде стран для получения кормовых препаратов витамина B2 используют достаточно простой способ, основанный на выращивании микроскопического гриба Eremothecium ashbyii в глубинной культуре в течение 80-84 ч при 2830 °C на среде с глюкозой или мальтозой (2,5 %), источником азота в виде NH4NO3 и карбоксидом кальция (0,5 %). Выход рибофлавина составляет 1250 мкг/мл. Культуральная жидкость концентрируется в вакуумном испарителе до содержания сухих веществ 30-40 % и высушивается в распылительной сушилке. Товарная форма продукта – порошок с содержанием рибофлавина не менее 10 мг/г и 20 % сырого протеина. В препарате присутствуют также никотиновая кислота и витамины B1, B3, B6 и B12. При использовании штамма Bacillus subtilis, полученного генно-инженерным методом, выход рибофлавина составлял 4 г/л за 35 суток ферментации.
Получение эргостерина. Эргостерин (эргоста-5,7,22-триен-Зβ-ол) является исходным продуктом при производстве витамина D2 и кормовых препаратов дрожжей, обогащенных этим витамином. Витамин D2 (эргокальциферол) образуется при облучении ультрафиолетом эргостерина, который в значительных количествах синтезируют бурые водоросли, дрожжи, плесневые грибы. Наиболее активные продуценты эргостерина – Saccharomyces, Rhodotorylaf Candida.
В промышленных масштабах эргостерин образуется при культивировании дрожжей и мицелиальных грибов на средах, содержащих избыток Сахаров и недостаток азота, при высокой температуре и хорошей аэрации. Более интенсивно эргостерин образуют дрожжи рода Candida на средах с углеводородами. Кристаллический препарат витамина D2 получают при культивировании плесневых грибов (Penicilliumt Aspergillus).
Для получения кормовых препаратов проводят облучение суспензии или сухих дрожжей {Candida). Так, тонкий слой 5%-й суспензии дрожжей облучают ультрафиолетовыми лампами с длиной волны 280-300 нм.
Для получения кристаллического препарата витамина дрожжи или грибной мицелий подвергают кислотному гидролизу при 110°C. Витамин D2 экстрагируют спиртом, фильтруют, фильтрат упаривают и несколько раз промывают спиртом. Спиртовой экстракт сгущают до 50%-й концентрации сухих веществ, омыляют щелочью. Образовавшиеся кристаллы витамина очищают перекристаллизацией и сушат в эфире, отгоняя последний. Кристаллический осадок растворяют в масле. Препарат используют в медицинских целях. Эргостерин служит также исходным продуктом для получения ряда стероидных гормонов, пищевых и лекарственных препаратов.
6.9. Интерфероны
Интерфероны представляют собой особую группу белков, которые продуцируются клетками иммунной системы у большинства животных и человека. Впервые они были обнаружены как продукты метаболической активности инфицированных вирусами клеток. Следовательно, интерфероны являются «оружием», с помощью которого возможно противостоять болезнетворным бактериям, паразитам и даже раковым клеткам.
Интерфероны – это низкомолекулярные белки со сходными свойствами, состоящие из 146-166 аминокислотных остатков и выделяемые клетками организма в ответ на вторжение вируса. Общим их свойством является нарушение репликации вирусов, т. е. благодаря интерферонам клетки становятся устойчивыми к вирусной инфекции. За это они и получили свое название, происходящее от английского термина interfere with – мешать (вирусам осуществлять синтез своей РНК и белков).
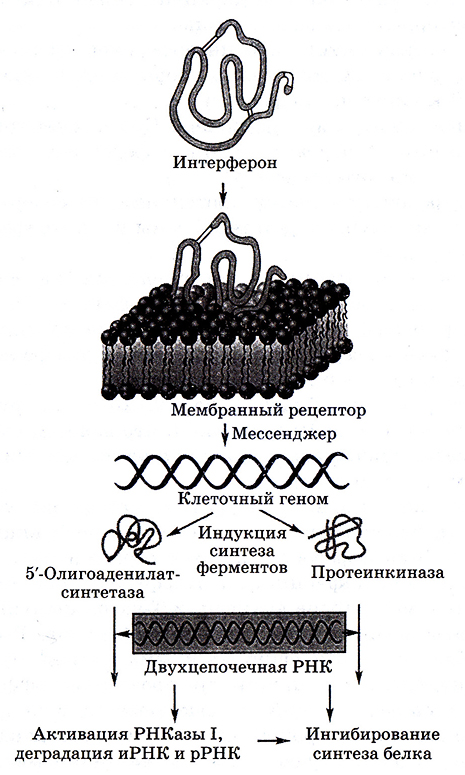
Рис. 6.13. Механизм действия интерферонов
При заражении клеток вирусом он начинает размножаться, и одновременно клетка-хозяин «запускает» синтез интерфероном. Они выходят из клетки, вступают в контакт с соседними клетками и делают их невосприимчивыми к вирусу. Интерфероны действуют, запуская цепь событий, приводящих к подавлению синтеза вирусных белков и – в некоторых случаях – сборки и выхода вирусных частиц (путем активации олигоаденилатсинтетазы) (рис. 6.13).
Таким образом, интерфероны не обладают прямым противовирусным действием, но вызывают такие изменения в клетке, которые препятствуют размножению вируса.
Образование интерферонов могут стимулировать не только интактные вирусы, но и различные другие агенты, например некоторые инактивированные вирусы, двухцепочечные РНК, синтетические двухцепочечные олигонуклеотиды и бактериальные эндотоксины.
Биологическая активность интерферонов очень высока: достаточно одной их молекулы, чтобы сделать клетку резистентной к вирусной инфекции.
Основные классы интерферонов. Существует три основных класса интерферонов: альфа-интерферон (а), бета-интерферон (β), гамма-интерферон (γ).
α-Интерфероны являются протеинами, не содержащими простетических групп, а β-интерфероны и γ-интерфероны – гликопротеинами.
Основными клетками – продуцентами интерферонов являются: для α-интерферона – макрофаги (лейкоциты T и В); для β-интерферона – эпителиальные клетки и фибробласты; γ-интерферон продуцируется Т-лимфоцитами и естественными киллерами (NK-клетками).
Все интерфероны обладают не только антивирусным и противоопухолевым действием, но и, что важнее, свойством активировать, понуждать к действию такие клетки иммунной системы, как макрофаги.
Помимо общих свойств, между различными типами интерферонов есть существенные отличия. Основные функции α-интерферона и β-интерферона связаны с ограничением и подавлением вирусной инфекции. γ-Интерферон является одним из ключевых медиаторов активации Т-звена иммунитета.
Основные эффекты действия интерферонов. Все интерфероны обладают противовирусным, иммуномодулирующим, противоопухолевым и антипролиферативным эффектами.
Противовирусный эффект заключается в индукции у обработанных интерфероном клеток «нечувствительности» к вирусам. В этом случае включаются такие механизмы, как подавление синтеза вирусной РНК и подавление синтеза белков оболочки вируса.
Иммуномодулируюгций эффект связан со способностью интерферонов регулировать взаимодействие клеток, участмующих в иммунном ответе. Эта функция осуществляется с помощью регуляции экспрессии на мембранах клеток молекул главного комплекса гистосовместимости I типа или путем непосредственной активации иммунокомпетентных клеток. Все эти факторы усиливают фагоцитарные и цитотоксические реакции в зоне воспалительного очага и способствуют эффективной элиминации инфекционного агента.
Противоопухолевый эффект связан со способностью интерферонов замедлять или подавлять рост культуры клеток и активировать противоопухолевые механизмы иммунной системы.
Все противоопухолевые эффекты интерферонов подразделяют на прямые и непрямые. Прямые эффекты связаны со способностью оказывать непосредственное воздействие на опухолевые клетки, их рост и дифференцировку, а непрямые – с усилением способности иммунокомпетентных клеток обнаруживать и уничтожать атипичные клетки организма.
Антипролиферативный эффект заключается в способности интерферонов проявлять свойства цитостатиков: подавлять рост клеток за счет ингибирования синтеза РНК, протеинов, а также ростовых факторов, стимулирующих пролиферацию клеток.
Помимо общих свойств, интерфероны обладают рядом отличий.
α-Интерферон и β-интерферон больше похожи друг на друга. Их гены локализуются в 9-й хромосоме. Для их выработки индуцирующим сигналом являются вирусы. Эти интерфероны обладают выраженным противовирусным и противоопухолевым действием, но в гораздо меньшей степени проявляют иммуномодулирующие свойства.
γ-Интерферон характеризуется выраженным иммуномодулирующим действием, регулирует иммунный ответ и выраженность воспалительных реакций. Противовирусные и противоопухолевые его свойства выражены слабее, чем у α-интерферона и β-интерферона. Тем не менее γ-интерферон существенно усиливает активность α-интерферона и β-интерферона. Ген γ-интерферона расположен в 12-й хромосоме.
Получение интерферонов. Интерфероны служат одним из самых эффективных средств лечения вирусных инфекций, но они видоспецифичны и могут быть получены только из клеток человека. Технология выделения и очистки интерферонов малоэффективна, прежде всего из-за крайне малого выхода конечного продукта. Поэтому получение генно-инженерного продукта является перспективной альтернативой традиционным методам выделения интерферонов.
Ген α-интерферона получили химико-ферментативным методом. Одной из трудностей, которую пришлось преодолеть, было то, что интерферон синтезируется в виде предшественника с дополнительной (сигнальной) последовательностью аминокислотных остатков. Бактериальные клетки не имеют протеиназ, превращающих предшественники в зрелые белки, поэтому надо было синтезировать ген, кодирующий только зрелый интерферон. Такой ген был получен и введен в клетку E. colL Физико-химические свойства гаинтерферона, выделенного из бактерий, оказались близки к свойствам интерферона, выделенного из крови доноров.
Значительным событием явилась удачная попытка введения генов интерферонов в дрожжевые клетки. Замена бактериальной клетки в качестве реципиента на дрожжевую сыграла огромную роль для всей генно-инженерной техники вообще и для получения интерферонов в частности. Дело в том, что β-интерферон и γ-интерферон представляют собой гликозилированиые белки, а процесс гликозилирования невозможен в E. Coli9 но вполне осуществим в дрожжевой клетке для точного воспроизведения структуры β-интерферона и γ-интерферона. Рекомбинантные штаммы дрожжей синтезировали в больших количествах интерфероны, обладающие выраженной биологической активностью.
Применение интерферонов. Разработка методов получения лейкоцитарного и рекомбинантного интерферонов в препаративных количествах, а также высокоэффективных методов их очистки открыла возможность применения этих препаратов для лечения вирусных и онкологических заболеваний.
Интерфероны представляют высокую ценность при лечении целого ряда заболеваний: вирусного и хронического гепатитов, герпетической инфекции, острых респираторных заболеваний, рассеянного склероза, миеломы, остеосаркомы. Есть данные о положительном эффекте применения интерферонов для лечения рака легких, мочевого пузыря, яичников, мозга и гортани.
Интерфероны выпускают в качестве лекарственных препаратов в виде каплей в нос, мазей или растворов для инъекций. Существуют натуральные интерфероны, полученные из лимфоцитов донорской крови, и искусственно синтезированные с применением генно-инженерных технологий (рекомбинантные). В настоящее время как у нас в стране, так и за рубежом выпускают коммерческие препараты – человеческий лейкоцитарный, лимфобластный (Велферон, Wellferon) и фибробластный (Ферон), а также интерфероны, полученные генно-инженерными методами: рекомбинантные α-интерферон (Роферон, Реальдерон и др.), β-интерферон и γ-интерферон (Гаммаферон).
6.10. Вакцины
Одно из важных направлений биотехнологии – создание и разработка вакцин, способствующих развитию иммунитета к патогенным вирусам и микроорганизмам.
Формированию у реципиента иммунитета к патогенным микроорганизмам способствует вакцинация. Эффект вакцинации был открыт более 200 лет назад, в 1796 г., врачом Э. Дженнером, доказавшим, что человек, перенесший коровью оспу (не очень тяжелую болезнь крупного рогатого скота), становится невосприимчив к оспе натуральной – очень опасному инфекционному заболеванию, с высокой смертностью. Даже если больной не погибает, у него нередко возникают различные уродства, психические расстройства и слепота.
Э. Дженнер публично провел прививку коровьей оспы восьмилетнему мальчику Джеймсу Фиппсу, использовав для этого экссудат из пустулы больной оспой коровы, а затем, через определенное время, дважды инфицировал ребенка гноем из пустулы больного натуральной оспой. Все проявления заболевания ограничились покраснением в месте прививки, исчезнувшим через несколько дней. Это связано с тем, что в ответ на введение вакцины организм запускает иммунный ответ – вырабатываются антитела, которые при последующей инфекции блокируют пролиферацию патогенного микроорганизма и не позволяют развиться заболеванию.
Начиная с первой вакцины, созданной Э. Дженнером, ведутся большие научные исследования в этом направлении. Большинство человеческих противовирусных вакцин создано на основе убитых (инакгивированных) патогенных микроорганизмов или живых, но не вирулентных (аттенуированных) штаммов. Такой подход достаточно эффективен и предотвращает распространение многих вирусных инфекций, однако его применение имеет ряд ограничений, связанных с:
- невозможностью культивирования всех патогенных микроорганизмов;
- потенциальной опасностью при работе с патогенными микроорганизмами и вирусами;
- возможностью ревертировать (возвращаться к исходному вирулентному штамму) аттенуированные штаммы (инактивация часто бывает неполной);
- высокой стоимостью производства традиционных вакцин (титр вирусов животных и человека в культуре и скорость их размножения, как правило, невысоки).
В последние годы все большее значение в получении вакцин приобретают биотехнологические подходы, в том числе технология рекомбинантных ДНК. Она позволяет создавать новые препараты, более безопасные и эффективные, менее дорогие и не имеющие ограничений в применении. Для этих целей используют следующие подходы:
1. Патогенный микроорганизм модифицируют, делетируя (убирая) гены, ответственные за вирулентность, при этом сохраняется способность штамма вызывать иммунный ответ. Получают живые вакцины, содержащие непатогенные микроорганизмы, которые не могут ревертировать и становиться патогенными.
2. Гены или их сегменты, кодирующие основные антигенные детерминанты (белки) патогенных микроорганизмов, экспрессируют в альтернативном хозяине, например Е. coli. Получают нужный продукт в большом количестве и используют его как вакцину. Такие вакцины, содержащие лишь отдельные компоненты патогенного микроорганизма, называют субъединичными вакцинами.
Достоинства субъединичных вакцин состоят в том, что препарат, содержащий очищенный иммуногенный белок, стабилен и безопасен. Его химические свойства известны, в нем отсутствуют дополнительные белки и нуклеиновые кислоты, которые могут быть причиной нежелательных побочных эффектов в организме-хозяине.
Недостатками субъединичных вакцин являются высокая стоимость очистки специфического белка и изменение его конформации после выделения, что может повлечь и изменение его антигенных свойств.
Клонированные гены, кодирующие основные антигенные детерминанты патогенного организма, встраивают в геном непатогенного носителя (обычно вируса) и получают живую безопасную вакцину, которая не содержит болезнетворных микроорганизмов. Живые вакцины, как правило, более эффективны, чем неживые или субъединичные.
В числе новых направлений создания рекомбинантных вакцин – разработка ДНК-вакцин (так называемых генных, полинуклеотидных вакцин, вакцин из нуклеиновых кислот). Принцип применения ДНК-вакцин заключается в том, что в организм пациента вводят молекулу ДНК, содержащую гены, кодирующие иммуногенные белки патогенного организма и генетические элементы, которые необходимы для экспрессии этого гена в клетках эукариот (человека). В качестве продуцентов таких генов используют бактериальные клетки, содержащие рекомбинантные плазмиды с соответствующими генами. После получения достаточной биомассы (количества копий) плазмидную ДНК выделяют из бактерий, очищают от других молекул ДНК и примесей. Полученную ДНК-вакцину вводят парентерально, при этом большая ее часть поступает в межклеточное пространство, после чего включается в клетки.
Противогерпетические вакцины. Вирус простого герпеса (HSV – Herpes simplex virus) вызывает инфекционное заболевание генерализованного или местного характера (преимущественно поражение кожи, глаз, слизистых оболочек, нервной системы, энцефалит и т. д.). Кроме того, он является онкогенным, поэтому вакцинация убитым или аттенуированным вирусом сопряжена с определенным риском развития рака. Для защиты от HSV-инфекции применяют неонкогенетическую субъединичную вакцину.
Для создания любой субъединичной вакцины прежде всего идентифицируют те компоненты патогенного микроорганизма, которые индуцируют выработку антител. В случае HSV-типа таким компонентом является гликопротеин Д-оболочки (gД). В ответ на введение этого гликопротеина мышам у них вырабатываются антитела, нейтрализующие интактный HSV. Ген gД HSV-1 был изолирован, клонирован в одном из экспрессирующих векторов в клетках млекопитающих и введен в яйцеклетки китайского хомячка, в которых, в отличие от E. Coli9 происходит гликолизирование чужеродных белков. Полноразмерный ген gД кодирует белок, в норме связывающийся с мембраной клетки млекопитающего. Затем модифицированным геном трансформировали яйцеклетки китайского хомячка, которые гликозилировали белковый продукт и секретировали его во внешнюю среду, так как он не мог встраиваться в клеточную мембрану. Антитела, вырабатываемые в ответ на введение модифицированного белка gД, эффективны в отношении вируса простого герпеса.
Противосалъмонеллезные вакцины. Разные штаммы Salmonella вызывают острые кишечные инфекции, постнатальную (послеродовую) инфекцию, брюшной тиф, пищевую токсикоинфекцию. Для профилактики всех этих заболеваний у овец, цыплят и человека эффективные пероральные вакцины созданы методом двойной делеции.
Такой способ получения непатогенных штаммов, пригодных для создания на их основе живых вакцин, состоит в удалении из генома патогенных бактерий участков хромосом, отвечающих за независимые жизненно важные функции. Лучше делетировать, по крайней мере, две такие области, так как вероятность их одновременного восстановления очень мала. Штамм с двойной делецией обладает ограниченной пролиферативной способностью и сниженной патогенностью, но обеспечивает выработку иммунного ответа. Штаммы Salmonella с двойной делецией вызывают легкую форму инфекции и обладают в 100 тыс. раз меньшей вирулентностью.
6.11. Антибиотики
Антибиотики (от anti – против, bios – жизнь) – самый большой класс фармацевтических соединений природного или полу синтетического происхождения, которые подавляют рост живых клеток, чаще всего прокариотических или простейших. К этому же классу относятся противогрибковые агенты, противоопухолевые лекарства и алкалоиды.
Современное определение термина «антибиотик» дано в 1961 г. М.М. Шемякиным и А.С. Хохловым, которые предложили считать антибиотическими веществами все продукты обмена любых организмов, способные избирательно убивать или подавлять рост и развитие микроорганизмов.
Антибиотики не просто вещества, действующие против болезнетворных микроорганизмов; это еще и вещества, получаемые с помощью микроорганизмов-продуцентов. Чаще всего они синтезируются актиномицетами, реже – бактериями. Среди актиномицетов наибольший вклад вносит род Streptomyces (в частности, только один вид Streptomyces griseus синтезирует более 50 антибиотиков).
Наиболее распространенными с коммерческой точки зрения антибиотиками оказались пенициллины, цефалоспорины и тетрациклины.
Пенициллин, исторически первый антибиотик, впервые выделил английский ученый А. Флеминг из плесневых грибов Penicillium notatum. В 1928 г. он обнаружил, что на агаре в одной из чашек Петри с бактериями Staphylococcus aureus выросла колония плесневых грибов. Колонии бактерий вокруг них стали прозрачными из-за разрушения клеток. Флемингу удалось выделить активное вещество – пенициллин, которое разрушало бактериальные клетки. Эта работа была опубликована в 1929 г. Флеминг недооценил свое открытие, считая, что получить лекарство будет очень трудно. Работу Флеминга продолжили Г. Флори и Э. Чейн, предложившие методы очистки пенициллина. Его массовое производство было налажено во время Второй мировой войны. В 1945 г. А. Флеминг, Г. Флори и Э. Чейн были удостоены Нобелевской премии в области физиологии и медицины.
Эффект от применения пенициллина превзошел все ожидания. По некоторым данным, только в 1940-1950-е гг. с его помощью было спасено от смерти более 15 млн человек. Действительно, часто раненый погибает не от самой раны, а от гнойного воспаления. Так, рана, полученная А.С. Пушкиным на дуэли, сама по себе не была опасна, но развилось воспаление – перитонит, что и привело к смертельному исходу. При нынешнем состоянии медицины Пушкина можно было бы вылечить с помощью антибиотиков.
Сразу же после открытия пенициллина начались поиски и других антибиотиков. Сейчас их существует уже более 3 тыс., но многие ученые в разных странах мира все время ищут более продуктивные микроорганизмы для их биосинтеза, достигая при этом поразительных успехов. Например, плесень Флеминга в военные годы давала активность по пенициллину не более 10 ед/мл. Современные штаммы микроорганизмов дают 50 тыс. ед/мл того же пенициллина.
Интересно, что в США в послевоенные годы поисками микроорганизмов занимались не только ученые. Институты давали объявления в газеты с просьбой приносить им разные образцы плесеней за вознаграждение. Рассказывают, что в одном из городов этим занималась некая пожилая женщина по имени Мэри. Она по всему городу искала плесень в гнилых фруктах, овощах, испорченном хлебе. Ей даже дали прозвище Заплесневелая Мэри. Так вот, именно она нашла родоначальника современных высокоактивных штаммов биосинтеза пенициллина в заплесневевшей гнилой дыне. Этот микроорганизм был назван Penicillum chrysogenum.
По оценкам ВОЗ, каждый год ученые обнаруживают от 100 до 200 новых антибиотиков, прежде всего в рамках обширных исследовательских программ по поиску среди тыгяч различных микроорганизмов таких, которые синтезировали бы уникальные антибиотики. Получение, лабораторные и клинические испытания новых лекарственных средств обходятся дорого, поэтому до применения доходят только те из них, которые имеют большую терапевтическую ценность и представляют экономический интерес. Это всего лишь 1-2 % от всех обнаруживаемых антибиотиков.
Обычно антибиотик действует не на все микроорганизмы подряд, да это и нежелательно: ведь наряду с болезнетворными будут уничтожаться полезные микробы, которые всегда есть в человеческом организме. Поэтому должен быть набор различных антибиотиков, пригодных для лечения разных болезней.
Но есть и другая сторона: болезнетворные микроорганизмы постепенно «привыкают» к действию антибиотиков. Возникают виды, которые вызывают заболевание, но они нечувствительны к «старому» антибиотику. Такое привыкание происходит не быстро, а в течение 10-15 лет. Но раз это все-таки происходит, ученым необходимо искать все новые и новые антибиотики и продуцирующие их микроорганизмы.
Образование антибиотиков – это наследственно закрепленная особенность метаболизма микроорганизмов, проявляющаяся в том, что каждый вид (или даже штамм) способен продуцировать один или несколько строго специфичных для него антибиотических веществ, что является результатом эволюции данного микроорганизма.
Специфичность действия антибиотиков объясняется:
- их высокой биологической активностью в отношении чувствительных к ним организмов, т. е. способностью проявлять эффект даже в очень низких концентрациях;
- избирательностью действия, т. е. способностью конкретного антибиотика проявлять свое действие лишь в отношении определенных организмов или групп организмов, не оказывая заметного эффекта на другие формы живых существ.
Величину биологической активности антибиотиков выражают в условных единицах, содержащихся в 1 мл (ед/мл) или в 1 мг (ед/мг) препарата. За единицу антибиотической активности принято минимальное количество антибиотика, способное подавить развитие или задержать рост определенного числа клеток стандартного штамма тест-микроба в единице объема питательной среды. Так, за единицу активности пенициллина принято минимальное количество препарата, способное задерживать рост золотистого стафилококка (штамм 209) в 50 мл питательного бульона; для стрептомицина единица активности – минимальное количество антибиотика, задерживающее рост E. coli в 1 мл питательного бульона.
Синтез микроорганизмами антибиотиков – одна из форм проявления антагонизма, который связан с определенным характером обмена веществ, возникшим и закрепленным в ходе эволюции. Воздействуя на постороннюю микробную клетку, это соединение вызывает нарушения в ее развитии. Антибиотики способны подавлять синтез оболочки бактериальной клетки в период размножения, изменять проницаемость цитоплазматической мембраны или ингибировать реакции обмена веществ.
Классификация антибиотиков может быть осуществлена:
- по принципу их биологического происхождения (предпочтительна для биологов, изучающих организмыпродуценты антибиотических веществ);
- по химическому строению (удобна для химиков, занимающихся изучением строения молекул антибиотиков и путей их синтеза);
- по типу и механизму биологического действия (принята в медицинской практике). В этом случае тип действия антибиотиков бывает щидным» (бактерицидным, фунгицид ным, вирицидным, протозоацидным), под которым понимают необратимое нарушение жизнедеятельности (гибель) инфекционного агента, и статическим (бактериостатическим, фунгистатическим, виристатическим, протозоостатическим), при котором прекращается или приостанавливается размножение возбудителя. Такая градация имеет основное практическое значение при лечении тяжелых инфекций, особенно у пациентов с нарушениями иммунитета, когда обязательно назначение «цидных» препаратов.
В зависимости от места приложения и механизма биологического действия, антибиотики подразделяют на:
- специфические ингибиторы биосинтеза клеточной стенки (пенициллины, цефалоспорины, цефамицины и др.);
- препараты, нарушающие молекулярную организацию и функции клеточных мембран (полимиксины, полиены);
- препараты, подавляющие синтез белка на уровне рибосом (макролиды, тетрациклины, левомицетин, фузидин);
- ингибиторы синтеза РНК на уровне РНК-полимеразы и ингибиторы, действующие на метаболизм фолиевой кислоты (рифампицины);
- ингибиторы синтеза РНК на уровне ДНК-матрицы (актиномицины и др.);
- ингибиторы синтеза ДНК на уровне ДНК-матрицы (антрациклины, митомицин С, нитрофураны, налидиксовая кислота).
При выделенном возбудителе назначают антибиотики с максимально узким спектром активности, так как «избыточная» широта спектра не дает преимуществ и опасна с точки зрения подавления нормальной микрофлоры.
В настоящее время установлена полная химическая структура только для трети антибиотиков, продуцируемых микроорганизмами, а химическим путем может быть получена лишь половина из них. В связи с возросшей сложностью выделения эффективных антибиотиков и распространением устойчивости к наиболее широко применяемым соединениям у большого числа патогенных бактерий существует потребность в новых соединениях. Для этого исследователи перешли от поиска новых антибиотиков к модификации структуры уже имеющихся. Они стремятся повысить эффективность антибиотиков, найти защиту от инактивации ферментами устойчивых бактерий и улучшить фармакологические свойства препаратов. В некоторых случаях природные микробные антибиотические продукты химическим или энзиматическим путем могут быть превращены в так называемые полусинтетические антибиотики, обладающие более высокими терапевтическими свойствами.
Современное промышленное получение антибиотиков – это сложная многоступенчатая биотехнологическая схема, состоящая из ряда последовательных стадий (рис. 6.14):
1. стадия биосинтеза (образования) антибиотика – основная биологическая стадия процесса получения антибиотика. Необходимо создание оптимальных условий для развития продуцента и максимально возможного биосинтеза антибиотика;
2. стадия предварительной обработки культуральной жидкости, клеток (мицелия) микроорганизма и фильтрации (отделение культуральной жидкости от биомассы продуцента). Определяется составом среды, характером роста продуцента, местом накопления биологически активного соединения (в культуральной жидкости или внутриклеточно);
3. стадия выделения и очистки антибиотика. В качестве основных методов применяют экстракцию, осаждение, сорбцию на ионообменных материалах, упаривание, сушку;
4. стадия получения готовой продукции, изготовления лекарственных форм, расфасовки.
Рис. 6.14. Схема производства антибиотике» в процессе микробного биосинтеза
Для максимального выхода антибиотика при культивировании продуцента необходим комплекс мер, включающий подбор питательных сред, высокопродуктивных штаммов микроорганизмов и режимов их культивирования.
Микроорганизмы, производящие различные метаболиты, в том числе и антибиотики, вначале проходят стадию быстрого роста (тропофазу), во время которой синтез этих веществ незначителен. По мере замедления роста из-за истощения одного или нескольких необходимых питательных веществ в культуральной среде микроорганизм переходит в идиофазу; именно в этот период синтезируются идио литы.
Эти особенности культурального роста необходимо учитывать в производственном процессе. Например, в случае антибиотиков большинство микроорганизмов в стадии тропофазы чувствительны к собственным антибиотикам, а во время идиофазы становятся устойчивыми к ним. Чтобы уберечь микроорганизмы, продуцирующие антибиотики, от самоуничтожения, важно быстро достичь идиофазы и затем культивировать микроорганизмы в этой фазе. Это достигается путем варьирования режимов культивирования и состава питательной среды на стадиях быстрого и медленного роста.
Новые антибиотики с уникальными свойствами и специфичностью можно получить путем генно-инженерных манипуляций с генами, участвующими в биосинтезе уже известных антибиотиков. Большой эффект здесь может дать технология рекомбинантных ДНК: с ее помощью можно создавать новые антибиотики с уникальной структурой, оказывающие более мощное действие на определенные микроорганизмы и обладающие минимальными побочными эффектами. Генно-инженерные подходы можно использовать для увеличения выхода антибиотиков и снижения стоимости их производства.
Большинство исследований было сосредоточено на пенициллинах и цефалоспоринах, структура которых включает четырехчленное β-лактамное кольцо. Добавление к β-лактамному кольцу метоксильной (СН30)-группы привело к появлению цефамицинов, близких к цефалоспоринам и эффективных как против грамотрицательных, так и против пенициллиноустойчивых микробов. Полусинтез состоит в замене химическим путем одной боковой цепи β-лактамного кольца на другую в полученной ферментацией молекуле. Устойчивость к пенициллинам и цефалоспоринам связана с наличием ферментов, так называемых β-лактамаз, которые широко распространены среди бактерий, актиномицетов, цианобактерий и дрожжей. Так как гены, кодирующие эти ферменты, находятся в составе плазмид, устойчивость может передаваться при переносе плазмид от одного бактериального штамма к другому.
Исследователи фирмы «Мерк, Шарп и Доум» открыли новый класс β-лактамных антибиотиков – тиенамицины, – продуцируемые Streptomyces cattleya. Тиенамицины чрезвычайно эффективны против грамположительных и грамотрицательных бактерий, а также способны ингибировать β-лактамазы, что значительно повышает возможности этих антибиотиков. К ингибиторам β-лактамаз относятся также клавулановая и оливановая кислоты, идентифицированные исследователями английской фармацевтической компании «Бичем». Компания выпустила новый антибиотик – аугментин, – который представляет собой комбинацию β-лактамного антибиотика амоксициллина и клавулановой кислоты.
Синтез антибиотика является результатом действия 10.40 генов, поэтому практически невозможно обнаружить отдельные спонтанные мутации, которые могли бы повысить его выход. В промышленных штаммах Penicillium chrysogeпит или Streptomyces auerofaclens выход пенициллина или тетрациклина удалось повысить с нескольких миллиграммов на литр (штамм дикого типа) до 20 г/л и более. Эти высокопродуктивные штаммы были получены в результате последовательных циклов мутагенеза и селекции.
В результате мутаций появились новые вторичные метаболиты, в том числе 6-диметилхлортетрациклин и 6-диметилтетрациклин. Определенные мутанты, так называемые идиотрофы, способны синтезировать только половину молекулы антибиотика, а среда должна быть обогащена другой ее половиной. Такая форма мутационного биосинтеза привела к открытию новых производных антибиотиков, в том числе принадлежащих к аминоциклитольной группе.
Создание новых и совершенствование существующих технологий получения антибиотиков, разработка экологически чистых безотходных технологий получения высококачественных препаратов – важнейшая задача современной биотехнологии. В основном антибиотики применяют для борьбы с болезнями человека, животных и растений, как стимуляторы роста животных, при консервировании продуктов, в научных исследованиях (в биохимии, молекулярной биологии, генетике, онкологии).
Традиционно антибактериальные препараты подразделяют на:
- природные (собственно антибиотики, например пенициллин);
- полусинтетические (продукты модификации природных молекул, например амоксициллин, цефазолин);
- синтетические (например, сульфаниламиды, нитрофураны).
Антибиотики используют для предотвращения и лечения воспалительных процессов, вызванных бактериальной микрофлорой. Они избирательно угнетают жизнедеятельность микроорганизмов. Под избирательным действием понимают активность только в отношении определенных родов и видов микроорганизмов при сохранении жизнеспособности клеток хозяина.
Антибиотики представляют собой самую многочисленную группу лекарственных средств. Так, в России в настоящее время используется 30 различных групп антибиотиков, а число препаратов приближается к 200. Ежегодно во всем мире производится 100 тыс. т антибиотиков на сумму примерно 5 млрд долларов, причем более 100 млрд долларов приходится на долю антибиотиков, добавляемых в корм скоту в качестве добавок или ускорителей роста.
Все антибиотики, несмотря на различия химической структуры и механизма действия, объединяет ряд уникальных качеств.
Во-первых, уникальность антибиотиков заключается в том, что, в отличие от большинства других лекарственных средств, их мишень-рецептор находится не в тканях человека, а в клетке микроорганизма.
Во-вторых, активность антибиотиков не является постоянной, а снижается со временем, что обусловлено формированием лекарственной устойчивости (резистентности). Антибиотикорезистентность – неизбежное биологическое явление, и предотвратить ее практически невозможно.
В-третьих, антибиотикорезистентные микроорганизмы представляют опасность не только для пациента, у которого они были выделены, но и для многих других людей, даже разделенных временем и пространством. Поэтому борьба с антибиотикорезистентностью в настоящее время приобрела глобальные масштабы.
В течение многих лет антибиотики используют как стимуляторы роста сельскохозяйственных животных и птиц, как средство борьбы с заболеваниями растений и посторонней микрофлорой в ряде бродильных производств, как консерванты пищевых продуктов. Механизм стимулирующего действия антибиотиков также не до конца выяснен. Предполагают, что стимулирующий эффект низких концентраций антибиотиков на организм животного связан с двумя факторами:
- воздействием на микрофлору кишечника;
- непосредственным влиянием на организм животного.
В первом случае антибиотики снижают число вредных и увеличивают количество полезных для организма микроорганизмов, во втором – снижают рН содержимого кишечника, уменьшают поверхностное натяжение клеток организма, что способствует ускорению их деления. Кроме того, антибиотики увеличивают количество ростовых гормонов, улучшают приспособляемость организма к неблагоприятным условиям и т. д.
Кормовые антибиотики применяют в виде неочищенных препаратов, представляющих собой высушенную массу продуцента, содержащую, помимо антибиотика, аминокислоты, ферменты, витамины группы В и другие биологически активные вещества. Все производимые кормовые антибиотики:
- не используются в терапевтических целях и не вызывают перекрестной резистентности бактерий к антибиотикам, применяемым в медицине;
- практически не всасываются в кровь из пищеварительного тракта;
- не меняют своей структуры в организме;
- не обладают антигенной природой, способствующей возникновению аллергии.
В настоящее время производится несколько видов кормовых антибиотиков: препараты на основе хлортетрациклина (биовит, кормовой биомицин), бацитрацин, гризин, гигромицин Б и др. Из этих препаратов только бацитрацин представляет собой высушенную культуральную жидкость, полученную в результате глубинного выращивания Bacillus lichenif or mis. Остальные антибиотики являются продуктами жизнедеятельности разных видов Actinomyces.
Антибиотики используют и как средство борьбы с различными фитопатогенами. Действие антибиотика сводится к замедлению роста и гибели фитопатогенных микроорганизмов, содержащихся в семенах и вегетативных органах растений. К таким антибиотикам относятся фитобактериомицин, трихотецин, полимицин.
Применение антибиотиков в пищевой промышленности позволяет снизить длительность термообработки продуктов питания при их консервировании. Используемые антибиотики воздействуют на клостридиальные и термофильные бактерии, устойчивые к нагреванию. Наиболее эффективным признан низин, который практически не токсичен для человека и позволяет вдвое снизить время термообработки.
6.12. Моноклональные антитела
Моноклональные антитела (MA) – это антитела, вырабатываемые иммунными клетками, принадлежащими к одному клеточному клону, т. е. произошедшими из одной клетки-предшественницы. Они могут быть выработаны почти на любое вещество, которое антитело будет специфически связывать. Их можно далее использовать для обнаружения этого вещества или его очистки.
Моноклональные антитела широко применяют в биохимии, молекулярной биологии и медицине. Если их используют в качестве лекарства, то название последнего оканчивается на -mab (от англ. monoclonal antibody).
Впервые методика получения моноклональных антител с помощью гибридомной технологии была опубликована в 1975 г. Ж. Келером и С. Милыптейном, которые в 1984 г. получили за ее создание Нобелевскую премию. Именно они, предварительно введя в организм антиген и вызвав таким образом иммунный ответ, извлекли лимфоидную клетку, продуцирующую соответствующие антитела, и объединили ее с клеткой опухоли (миеломы) (рис. 6.15). В результате получился непрерывно делящийся клеточный гибрид (гибридома), способный синтезировать антитела с заданной специфичностью. Гибридома унаследовала от нормальной клетки способность к синтезу антител, а от опухолевой – бессмертие и способность к неограниченному и бесконтрольному росту.
Рис. 6.15. Схема получения моноклоиалъных антител:
1 – иммунизация; 2 – выделехгие клеток селезенки;
3 – получение культуры м целом ных клеток;
4 – гибридизация (слияние); 5 – селекция гибридом;
6 – отбор положительных клопов; 7 – культивирование;
8 – производство моноклоиалъных тел in vitro в биореакторе;
9 – получение моноклоиалъных антител
В действительности продуцировать антитела способны только единичные гибридомные клетки. Их необходимо выделять и размножать клонированием. После тестирования клопов на способность образовывать антитела отбираютположительные культуры, которые снова клонируют и подвергают последующей селекции (рис. 6.16). В результате получают гибридому, продуцирующую моноклональные антитела. Производство моноклональных антител этими клетками осуществляют in vitro в биореакторе или in vivo в асцитной жидкости мыши. Таким способом получают моноклональные антитела к определенным антигенам бактерий или вирусов, опухолевых клеток, лимфоцитов, а также к гормонам, ферментам, медиаторам и т. д.
Рис. 6.16. Скрининг клеток, вырабатывающих моноклональные антитела
С появлением моноклональных антител в биологии и медицине началась эпоха современных исследований высочайшей точности. Специфичность антител делает их мощными диагностическими инструментами, которые позволяют определить наличие минимального количества искомых субстанций. В настоящее время моноклональные антитела используют для:
- обнаружения загрязнителей окружающей среды;
- проверки пищевых продуктов на наличие опасных микроорганизмов;
- распознавания злокачественных клеток среди нормальных;
- аналитических целей – как «иммунологический микроскоп» с чрезвычайно высоким разрешением;
- диагностики инфекционных заболеваний человека, животных и растений, а также в биотехнологии в качестве лигандов для аффинной хроматографии.
Уже сейчас препараты моноклональных антител широко применяют в лабораторной диагностике многих заболеваний как диагностические тест-системы.
Современная диагностика злокачественных новообразований крови немыслима без моноклональных антител. Их используют для определения иммунного статуса пациентов, диагностики и контроля эффективности лечения онкологических заболеваний, диагностики бактериальных и вирусных инфекций (гепатиты А и С, простой герпес, клещевой энцефалит, цитомегаловирусная инфекция, ВИЧ), для определения биологически активных веществ – белков крови, гормонов, ростовых факторов, клеточных рецепторов, медиаторов воспаления и др. Для исследования локализации злокачественного новообразования и степени метастазирования используют метод введения в организм специфичных к определенной опухолевой клеточной популяции моноклональных антител, связанных с радиоактивными изотопами.
Моноклональные антитела незаменимы при диагностике заболеваний, но могут быть использованы и в качестве высокоспецифичных терапевтических средств. Они могут осуществлять избирательную доставку химиотерапевтических агентов к клеткам опухоли, не затрагивая при этом здоровые клетки организма. В настоящее время уже создано и успешно применяется в клинической практике несколько лекарственных препаратов, содержащих моноклональные антитела.
Существуют также моноклональные антитела для лечения аутоиммунных заболеваний и реакций отторжения трансплантата. В этих случаях действие моноклональных антител направлено против клеток иммунной системы, участвующих в патологических процессах; другие иммунные механизмы при этом не страдают.
Предпринимаются попытки связать моноклональные антитела с противоопухолевыми препаратами, такими, как доксорубицин или рицины. Это обеспечит адресную доставку токсичного препарата к опухолевым клеткам, позволит прицельно (направленно) обнаруживать и уничтожать их, не повреждая здоровые ткани.
Таким образом, работы по получению новых моноклональных антител в целях создания на их основе лекарственных и диагностических средств очень перспективны. Они позволят вывести практическую медицину на качественно новый уровень. Терапия с помощью моноклональных антител эффективна, очень специфична, т. е. нацелена только на определенный патологический механизм, являющийся причиной заболевания, и, следовательно, сравнительно безопасна.
Одна из причин ограниченного применения этого метода терапии заключается в том, что мышиные антитела зачастую распознаются иммунной системой человека. Развивающийся при этом иммунный ответ не только выводит терапевтические антитела из организма, он может приводить к поражению ι точек. Для снижения проблемы возникновения человеческих антимышиных антител (HAMA) разработчики лекарственных средств используют химерные или гуманизированные антитела. Для создания химерного антитела антигенсвязывающие зоны (вариабельные домены) мышиного антитела объединяют с эффекторными зонами (константными доменами) человеческого антитела. Для создания человеческого антитела только аминокислоты, образующие зону, взаимодействующую с антигеном (гипервариабельные регионы), заменяют соответствующими аминокислотами мышиного антитела. К препаратам, синтезируемым описанным методом, относятся Zeiiapax, Vitaxin, Mylotarg, Herceptin и Xolair.
Тем не менее преимущества применения моноклональных антител очевидны, что обусловило производство их в промышленном масштабе.
На сегодняшний день 20 % биофармацевтических препаратов являются продуктами гибридомной технологии. Всего в мире на различных стадиях разработки находится свыше 350 лекарственных средств, содержащих моноклональные антитела, 70 % из них проходят клинические испытания. По прогнозам, к 2010 г. на рынке появится более 100 новых препаратов на основе моноклональных антител с общим объемом продаж около 50 млрд долларов.
Ряд фармацевтических фирм США, Европы и Японии производят диагностические наборы, моноклональные антитела для терапии заболеваний и лабораторной техники, а также для научных целей.
6.13. Вторичные соединения
Характерной особенностью клеток растений является способность к синтезу соединений так называемого вторичного метаболизма, к которым относятся терпеноиды, полифенолы, алкалоиды, стероиды и др. Они синтезируются, как правило, в меньших количествах, чем вещества основного (первичного) обмена, и, кроме того, не участвуют в нем.
Впервые термины «первичные соединения» и «вторичные соединения» ввел немецкий биолог А. Коссель (1891). В своей лекции «О химическом составе клеток», прочитанной для Берлинского общества физиологов, он говорил: «Предлагаю называть соединения, имеющие важность для каждой клетки, первичными, а соединения, не присутствующие в любой растительной клетке, – вторичными».
Долгое время считалось, что вторичные метаболиты отличаются от первичных тем, что они:
- распространены в ограниченном числе видов растений;
- являются «конечными» продуктами первичного обмена;
- не имеют значения для образующей их клетки, но могут быть необходимы для целого растения.
В настоящее время установлена важная роль вторичных метаболитов в жизни растений. Они обнаружены у 20-30 тыс. их видов, т. е. у 10-15 % всей флоры Земли. Установлена структура уже около 100 тыс. индивидуальных веществ. Выяснено участие 15-25 % генов растительных организмов в их вторичном метаболизме. Все это свидетельствует о том, что считать эти соединения синтезированными «случайно» – неправильно.
Ученые-биологи достаточно долго не уделяли должного внимания вторичным соединениям. Гораздо больше знали о них провизоры, фармацевты и криминалисты, поскольку лекарственные и ядовитые свойства растений чаще всего обусловлены этими соединениями.
Вторичные соединения придают также вкус и аромат растениям. От их присутствия зависят окраска цветков и многообразие «расцветки» окружающего нас мира. Многие из вторичных соединений используются в качестве лекарственных препаратов, вкусовых и ароматических добавок для пищевой и парфюмерной промышленности.
Все это свидетельствует о важном народнохозяйственном значении вторичных соединений, они могут найти широкое применение в биотехнологическом производстве. Рассмотрим основные классы вторичных соединений, синтезирующихся в клетках высших растений.
Терпены (старое название – изопреноиды) – одни из наиболее распространенных в растениях вторичных веществ. Свое название получили от немецкого слова terpentin (скипидар), означающего смесь этих веществ.
К настоящему времени известно более 30 тыс. соединений данной группы вторичных метаболитов. Основным их структурным элементом является пятиуглеродное соединение – изопрен. Общая формула всех терпенов выражается как (C5H8)n.
Все терпены подразделяют по единому структурному признаку – числу изопреновых единиц, входящих в состав их молекулы.
Среди терпенов встречаются также смешанные вещества, молекула которых состоит из терпеноидной и нетерпеноидной частей. Последняя может быть представлена тетрапирролом, как это характерно для хлорофилла и цитохрома, бензохиноном, что наблюдается в структуре убихинонов, а также аденином – в случае цитокининов. Такие соединения называют меротерпенами.
Большинство терпенов имеет название, отражающее тот растительный источник, откуда они были выделены впервые. Так, например, ментол впервые получили из растений мяты (Mehta), бетулапренолы – из листьев березы (Betula), авенастерин – из зерен овса (Avena).
Функции, выполняемые терпенами в клетках растений, чрезвычайно разнообразны. Так, важную физиологическую активность проявляют такие их представители, как цитокинины, гиббереллины и абсцизовая кислота. Монои сесквитерпеноидам часто приписывают аллелопатическую роль. Аллелопатия – это вредное действие одного растения (донора) на другое (реципиент). Стеролы, локализованные в клеточных мембранах растений, по-видимому, выполняют там такую же функцию, как холестерол в мембранах животных клеток. Существует предположение, что стеролы стабилизируют мембраны и контролируют их проницаемость. Каротиноиды защищают клетки от фотодинамического повреждения и, кроме того, участвуют в поглощении света при фотосинтезе. Смешанные терпеноиды также играют ключевую роль в обмене веществ у растений: хлорофилл, лишенный своей фитольной боковой цепи, не эффективен; пластохинон участвует в фотосинтетическом транспорте электронов, а убихинон – в митохондриальном транспорте электронов. Полипренилпирофосфаты участвуют в процессе гликозилирования при образовании клеточных стенок.
Фенольные соединения, или полифеполы, являются вторыми по распространенности в растительном мире представителями вторичных соединений. Эти вещества, так же как и терпены, обнаружены не только во всех растениях, но даже в каждой растительной клетке. В настоящее время число известных фенольных структур превышает девять тысяч.
Фенольные соединения содержат в своей молекуле бензольное ядро с одной или несколькими гидроксильными группами. Их классификация зависит от числа ароматических колец (одно или два), а также от количества присоединенных к ним атомов углерода.
Фенольные соединения с одним ароматическим кольцом подразделяют на следующие классы:
соединения C6-ряда – не содержат в своей структуре дополнительных атомов углерода. К ним относятся простые фенолы, представителями которых являются фенол (в малых количествах образующийся в хвое сосны), пирокатехин (найден в листьях тополя) и флороглюцин (чешуя лука);
соединения C6–C1-ряда – имеют в своей структуре один дополнительный атом углерода (рис. 6.17). К ним относятся оксибензойные кислоты и их производные, которые часто называют фенольными кислотами или фенолокислотами, а также лишайниковые кислоты – специфические фенольные соединения, синтезируемые лишайниками;
соединения C6–C2-ряда – соответствующие альдегиды и спирты оксибензойных кислот, в их структуре присутствует два дополнительных атома углерода;
соединения C6–C3-ряда – имеют три дополнительных атома углерода и составляют наиболее многочисленную и важную группу веществ, часто называемых фенилпропаноидами (рис. 6.18). К ним относятся оксикоричные (по международной номенклатуре – гидроксикоричные) кислоты, оксикоричные (гидроксикоричные) спирты, фенилпропены, а также кумарины, изокумарины и хромоны – соединения, у которых дополнительные атомы углерода замыкаются в конденсированное лактонное кольцо; некоторые фенилпропаноиды образуют димеры, т. е. соединения типа (C6-C3)2, которые называют лигнанами.
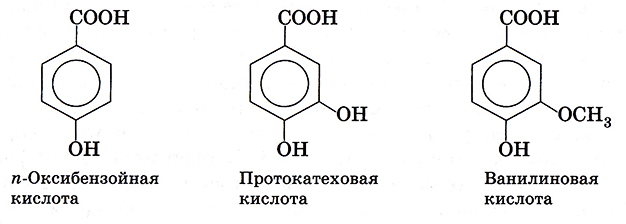
Рис. 6.17. Структурные формулы оксибензойных кислот
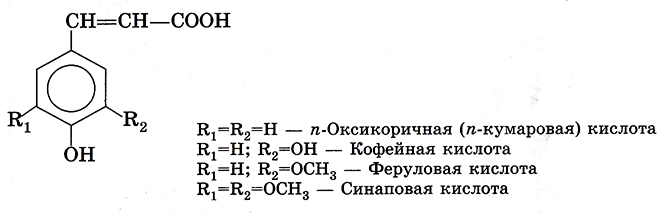
Рис. 6.18. Структурные формулы некоторых фенилпропаноидов
Фенолъные соединения с двумя ароматическими кольцами подразделяют на:
- соединения C6–C1–C6-рядa – имеют два ароматических кольца, соединенных мостиком из одного углеродного атома. К ним относятся бензофеноны и ксантоны;
- соединения С6–С2–С6-ряда – имеют два ароматических кольца, соединенных двумя атомами углерода. К ним относятся стильбены (два ароматических кольца соединяются цепочкой из двух атомов углерода) и антрахиноны (два ароматических кольца соединяются двумя атомами углерода с образованием центрального конденсированного третьего кольца);
- соединения С6–С3–С6-ряда – имеют два ароматических кольца, соединенных тремя атомами углерода. Наиболее многочисленная группа фенольных соединений, представленная прежде всего флавоноидами, которые, в свою очередь, включают целый ряд подгрупп, в зависимости от степени окисления треху г л сродного кислородсодержащего (пиранового) кольца (рис. 6.19). К ним относятся флавоны, антоцианы, флавононы, флавоналы, изофлавоноиды и неофлавоноиды.
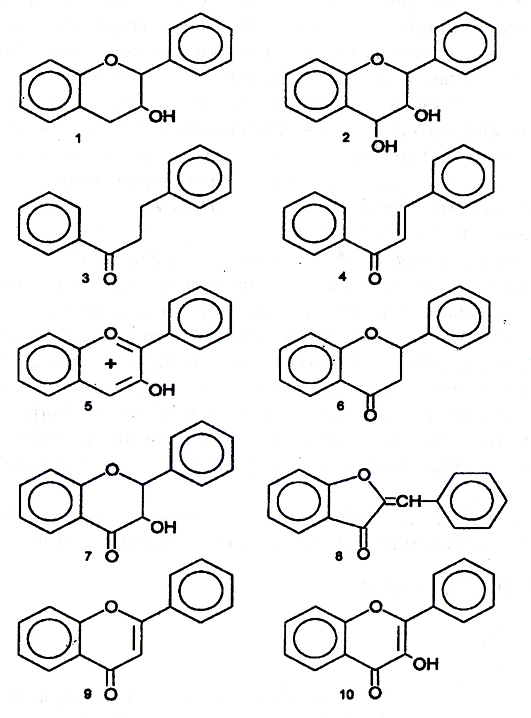
Рис. 6.19. Основные классы φ л авоноидов:
1 катехипы; 2 – лейкоцианидины; 3 – дигидрохалкины; 4 – хал коны;
5 – антоцианидины; 6 флавятютчы; 7 – флананонолы; 8 – ауроиы;
9 – флавоны; 10 – флавонолы
В особые группы выделяют димерные и полимерные фенольные соединения. Это дубильные вещества (таннины) и лигнин. Термин «таннины» был впервые использован для описания веществ, которые превращали сырые животные шкуры в кожу в процессе дубления (tannin). Связываясь с белками коллагена шкуры животных, таннины повышают устойчивость получаемой кожи к жаре, воде и микроорганизмам.
Наиболее распространенным полимером фенольных соединений в растениях является лигнин. В его образовании принимают участие три оксикоричных спирта: конифериловый, пара-кумаровый и синаповый. В результате биохимических превращений они и образуют лигнин, который представляет собой сильно разветвленный полимер.
Для фенольных соединений характерно формирование огромного числа соединений за счет модификаций молекулы и образования конъюгатов с разнообразными структурами. Это может происходить за счет различного замещения в бензольных кольцах (к которым в различных положениях могут присоединяться группы –ОН, –OCH3), способности образовывать гликозиды с широким набором монои дисахаридов, а также наличия асимметричных атомов углерода. Фенольные соединения могут также связываться с органическими кислотами, растительными аминами, алкалоидами. Помимо этого, растительные фенолы взаимодействуют с изопреноидами, образуя большую группу пренилированных фенолов. Такие свойства фенольных соединений обеспечивают огромное разнообразие структур, характерное для растительных фенолов.
Фенольные соединения играют важную роль в самых различных физиологических процессах – фотосинтезе, дыхании, росте и защитных реакциях растительного организма. Кроме того, они выполняют механические и структурные функции (лигнин), а также являются аттрактантами для насекомых-опылителей и животных – распространителей семян. Многие представители фенольных соединений обусловливают вкусовые качества растений. Особенно часто это отмечается для флавоноидов. Например, флавонон нарингенин придает горький вкус кожуре грейпфрута, тогда как другой флавонон – гесперидин, обнаруженный в кожуре апельсина и мандарина, таких свойств не проявлял. Во многих плодах (яблоки, груши, вишня, айва, персики, абрикосы) и ягодах (ежевика, земляника, брусника, смородина, малина, виноград) содержатся катехины, также относящиеся к соединениям флавоноидной природы. Наибольшее их содержание было отмечено в молодых побегах чайного растения (до 30 % на сухой вес). Катехины широко применяют в производстве какао, виноделии и особенно в чайной промышленности. Это связано с тем, что продукты окисления катехинов обладают характерной окраской и приятным слабовяжущим вкусом. Кроме того, они проявляют Р-витаминную активность. Часто в растениях встречается рамноглюкозид кверцетина – рутин, используемый в медицине как капилляроукрепляющее средство.
У 200 природных флавоноидных веществ выявлено 40 видов биологического действия. В основном оно связано с их антиоксидантным и мембраностабилизирующим действием, а также влиянием на ферментные системы. Благодаря такой разнообразной активности флавоноидсодержащие растения служат сырьем для производства препаратов желчегонного, противоязвенного, капилляроукрепляющего, гипотомического действия. Флавоноиды применяют как антимутагены, противоопухолевые и антиаллергические препараты. Так, препарат ревенол, получаемый из коры приморской сосны, виноградных зерен и куркумы, обладает антиоксидантной активностью, в 50 раз превышающей таковую у а-токоферола. Разработанный на основе экстракта виноградных косточек французский препарат эндотелон используют для лечения онкологических заболеваний.
Алкалоиды представляют собой большую группу азотсодержащих вторичных веществ, найденных у 20 % видов сосудистых растений.
Термин «алкалоид» введен в 1819 г. немецким фармакологом В. Майсснером. Чтобы особая группа азотсодержащих веществ с щелочными свойствами не была классифицирована как щелочи (alcali), он предложил назвать ее алкалоидами. Название происходит от арабского слова alcali – щелочь и греческого eidos – подобный.
Алкалоиды содержат азот, чаще всего в составе гетероциклического кольца. В настоящее время известно около 10 тыс. индивидуальных веществ.
Согласно химической классификации, алкалоиды – это соединения, содержащие один или несколько атомов азота в молекуле, что и придает им щелочные свойства. Обычно их подразделяют на две подгруппы: протоалкалоиды, которые содержат азот не в гетероцикле, и истинные алкалоиды, содержащие азот в гетероцикле.
Биохимическая классификация алкалоидов основана на их метаболизме. Гликоалкалоиды, а также ряд других алкалоидов (например, алкалоиды аконита) по типу синтеза и структуре фактически являются изопреноидами, поэтому было решено выделить их в особую группу – изопреноидных псевдоалкалоидов. В связи с этим сейчас принято подразделять алкалоиды на три подгруппы: протоалкалоиды (азот не в гетероцикле (рис. 6.20)); истинные алкалоиды (азот в составе гетероцикла (рис. 6.21)); псевдоалкалоиды (синтез не из аминокислот). Каждая подгруппа, в свою очередь, подразделяется на 3-10 классов.
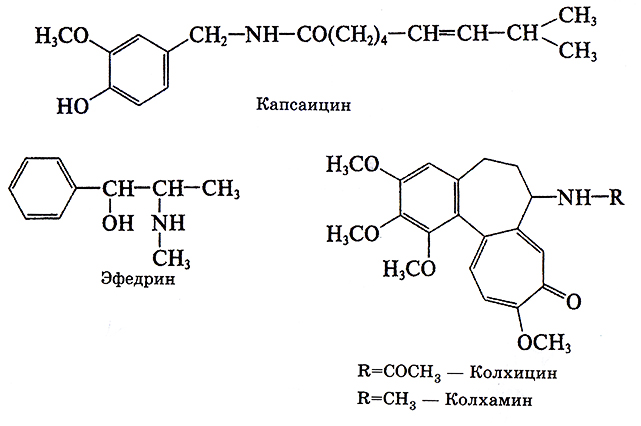
Рис. 6.20. Структура некоторых протоалкалоидов
Рис. 6.21. Основные группы истинных алкалоидов
Наиболее широко алкалоиды распространены среди покрытосеменных растений. Особенно богаты ими семейства маковых, пасленовых, бобовых, кутровых, мареновых, лютиковых. Во мхах, папоротниках и голосеменных алкалоиды встречаются относительно редко. Разные органы и ткани растения могут содержать разные алкалоиды. Обычно их концентрация невелика и составляет десятые и сотые доли процента. При содержании алкалоидов около 1-3 % растение считается богатым этими соединениями (алкалоидоносным). Только немногие растения, например культивируемые формы хинного дерева, могут накапливать до 1520 % алкалоидов.
Алкалоиды могут оказывать токсическое действие на человека. Однако их малые дозы используют в качестве эффективных фармакологических препаратов (морфин, кодеин, эфедрин, атропин). Некоторые алкалоиды (никотин, кофеин) применяют как стимуляторы или седативные средства.
Цианогенные гликозиды и глюкозинолаты также являются азотсодержащими веществами (рис. 6.22). Их иногда называют прототоксинами или фитоантисипинами. Они принимают непосредственное участие в защите растений от травоядных животных. При гидролизе цианогенных гликозидов специфичной гликозидазой выделяется синильная кислота.
Рис. 6.22. Цианогенные гликозиды высших растений
Цианогенные гликозиды широко распространены в растительном царстве и часто встречаются у представителей бобовых, розоцветных и некоторых злаков. Их много также в крахмалистых клубнях маниока Manihot esculenta. Это важный пищевой продукт в ряде тропических стран. Клубни и мука маниока – обычная пища для аборигенов, которые научились в процессе приготовления избавляться от токсичных соединений.
Вторая важная группа растительных прототоксинов – глюкозинолаты – впервые была выявлена у растений семейства крестоцветных Cruciferae. В растении глюкозинолаты, так же как и цианогенные гликозиды, пространственно отделены от гидролизующих их ферментов. При повреждении растительных тканей происходит смешивание глюкозинолатов с соответствующими ферментами и превращение их в летучие токсичные вещества с горчичным запахом – изотиоцианаты и нитрилы. Образующиеся вещества функционируют как токсины и репелленты для травоядных животных. Большинство исследований, посвященных глюкозинолатам, выполнено на рапсе Brassica napus, который служит важным источником для получения пищевого растительного масла в Северной Америке и Европе. Одна из основных задач селекционеров состоит в получении семян рапса с резко сниженным содержанием глюкозинолатов.
Таким образом, в растениях синтезируются различные соединения вторичного метаболизма. Их группы находятся в растении в динамическом состоянии, а содержание меняется от органа к органу в ходе онтогенеза. Поэтому, с одной стороны, при проведении скрининга желательно собрать как можно больше образцов разных частей растений на разных фазах развития, а с другой – при интерпретации полученных данных необходимо сравнивать данные о содержании изучаемого соединения в сходных частях растений, отобранных на одной и той же фазе развития. Очевидно, что данные о динамике содержания вторичных метаболитов представляют непосредственный интерес при проведении хемотаксономических исследований.
Поскольку многие из вторичных метаболитов обладают высокой биологической активностью, они находят широкое практическое применение. И в этом плане перспективным источником их получения могут быть каллусные и суспензионные культуры высших растений.
Культуры in vitro – продуценты вторичных соединений. Существующие методы культивирования изолированных клеток и тканей в условиях in vitro позволяют использовать их для практического применения. Особый интерес представляет способность изолированных клеток, тканей и органов синтезировать вещества вторичного метаболизма, которые широко применяют в медицине, ветеринарии, кормопроизводстве, пищевой промышленности, парфюмерии, для защиты растений и др.
Интерес исследователей к этому направлению работ не случаен. По сравнению с использованием традиционного растительного сырья, получение физиологически активных веществ методами клеточной биотехнологии имеет ряд преимуществ, так как:
- процесс получения биомассы клеток автоматизирован и не зависит от сезона, климатических и почвенных условий;
- можно оптимизировать условия культивирования суспензии клеток, позволяющих синтезировать в необходимом количестве нужные вещества.
Использование клеточных культур растений для получения вторичных метаболитов важно и в тех случаях, когда:
- невозможно выращивание растения в природе;
- имеются трудности в его сборе;
- содержание вторичных соединений в культурах in vitro высокое или высока его цена на мировом рынке;
- возможен хороший рост клеточных культур растений на сравнительно простых по составу питательных средах;
- вторичное соединение (соединения) выделяется клетками в питательную среду;
- можно получить высокопродуктивные растительные культуры.
Основным условием культивирования изолированных клеток и тканей в условиях in vitro является тот факт, что они, так же как и интактные растения, синтезируют вторичные метаболиты.
Первые данные, касающиеся синтеза вторичных соединений в клеточных культурах растений, появились в литературе в 1940 г., когда Дж. Боннер сообщил об образовании каучука клетками гваюлы. Первыми лекарственными растениями, исследованными в культуре ткани, были барвинок розовый и белена черная. Исследования В. Телле и Ф. Готре доказали способность культуры ткани белены к синтезу алкалоидов. Позднее появились и другие сообщения о получении культур тканей различных лекарственных растений, способных синтезировать многие уникальные соединения вторичного метаболизма. Это культуры ткани табака, накапливающие большие количества никотина (0,7 %), диоскореи – диосгенина (1,6 %) и др.
В отделе биологии клетки и биотехнологии Института физиологии растений РАН собрана большая коллекция используемых в промышленности клеточных культур растений, синтезирующих вторичные метаболиты. Это культуры женьшеня дальневосточного (источник алкалоида диосгенина), диоскореи дельтовидной (источник стероидных гликозидов), раувольфии змеиной (продуцент антиаритмического алкалоида аймалина), стевии (источник заменителя сахара – стевиозида) и др. В последние годы большое внимание в мире уделяется культивированию клеток тиса ягодного, синтезирующего уникальное вещество терпеноидной природы – таксол, который является противораковым препаратом.
Использование культур in vitro для получения вторичных соединений связано с их высокой продуктивностью. Экспериментально доказано, что прирост клеточной биомассы в условиях in vitro и in vivo проходит с разной скоростью. Например, за год прирост корня женьшеня в тайге составляет 1 г, на плантации – 3 г, а при выращивании клеток корневого происхождения на агаре (in vitro) можно получать 0,4 г сухой массы на литр среды в день. Биомасса клеток женьшеня в суспензии при выращивании в 50-литровом ферментере увеличивается до 2 г в литре среды за сутки, что в тысячу раз больше, чем при выращивании на плантации. Учитывая высокую стоимость женьшеня (килограмм плантационного корня стоит 100-150 долларов), цена дикорастущего корня может доходить до нескольких тысяч долларов. Поэтому с экономической точки зрения биотехнологический способ получения биомассы культуры клеток женьшеня весьма перспективен.
Вещества вторичного синтеза, как правило, получают из суспензионной культуры, которую выращивают в биореакторах или ферментерах. Важной характеристикой клеток иопуляции является ее стабильность в отношении синтеза метаболитов. Она может сохраняться в течение всего времени существования популяции, постепенно снижаться за счет медленного увеличения числа клеток с низким синтезом метаболитов или быть нестабильной в случае быстрой потери способности клеток синтезировать вторичные метаболиты.
Технология выращивания культур клеток в биореакторах представляет собой масштабный процесс. Специалисты немецкой фирмы DIVERSA (ныне – FYTON) осуществили выращивание ряда культур в биореакторах объемом до 75 тыс. л. В России на Омутнинском биохимическом заводе в биореакторах объемом до 2,5 м3 в промышленном масштабе получили биомассу женьшеня. В ТОО «Тэмбр» (г. Ярославль) осуществлено проточное культивирование клеток женьшеня в промышленных биореакторах объемом 7,5 м3. В Институте физиологии растений РАН оптимизированы режимы культивирования целого ряда различных культур клеток высших растений (женьшеня настоящего, полисциаса и других аралиевых, диоскореи дельтовидной, маральего корня и др.) в биореакторах объемом 630 л.
Российские ученые разработали технологию, жизненно важную для десятков тысяч пациентов. Она позволяет получать практически любое требуемое количество паклитаксела – основы одного из самых эффективных, но и самых дорогих препаратов для лечения некоторых видов онкологических заболеваний, в том числе рака легкого, яичников и молочной железы. Субстанция, полученная по новой технологии, по структуре ничем не отличается от обычной, но стоить будет, по мнению авторов, существенно дешевле. Дело в том, что высокая цена паклитаксела – это не прихоть фармацевтов, а следствие огромных затрат на его производство. В природе он есть только в коре очень редкого и очень медленно растущего дерева – тихоокеанского тиса. Чтобы выделить количество, необходимое для лечения только одного пациента, нужно собрать кору с 10-12 взрослых деревьев. Понятно, что такое лекарство дешевым просто не может быть. Разумеется, что, обнаружив удивительные свойства паклитаксела, ученые искали способы более дешевого его получения. Были разработаны и методы химического синтеза, и способ получения полупродукта из хвои тиса с последующей его переработкой в паклитаксел. Но оказалось, что синтетический аналог существенно дороже вещества, выделенного из природного сырья.
Метод же, который предлагают использовать специалисты ОАО «Биохиммаш», относится к области биотехнологии. Это ценное лекарство ученые научились выделять из природного сырья. Но не из деревьев, а из культуры клеток тиса, выращенных в ферментере и способных эффективнее прочих вырабатывать искомую субстанцию.
Продуктивность клеточных культур высших растений в отношении синтеза вторичных веществ зависит также от состава питательной среды, используемой для их выращивания.
Обязательными компонентами питательных сред являются углеводы. Клеточные культуры могут расти на различных углеводах (испытано более 30 различных соединений), но в большинстве случаев их лучший рост отмечается при добавлении в питательную среду двух Сахаров – глюкозы или сахарозы. В то же время высокий уровень синтеза свойствен культурам, растущим на сахарозе, а на питательных средах с глюкозой синтез часто сильно ослаблен. Причины этого явления пока не ясны. Повышенные концентрации сахарозы (5 %) в среде эффективны для роста культуры диоскореи, а пониженные (1,5 %) – для продуктивности диосгенина.
Минеральный состав питательных сред также оказывает большое влияние на синтез вторичных соединений; при этом наиболее важно содержание фосфора, калия и различных форм азота. Высокие концентрации фосфора в большинстве случаев приводят к улучшению роста культуры и ослаблению синтеза вторичных метаболитов. Это отмечено для синтеза никотина в культуре клеток табака, антоцианов – в культивируемых клетках моркови, катехинов – в каллусах чая. Накопление вторичных веществ в культурах in vitro обычно начинается после исчерпания фосфора из среды.
Имеются данные о том, что повышение концентрации фосфора в питательной среде увеличивало содержание алкалоидов в культуре барвинка розового и антрахинонов в культуре клеток Galium sp.
Показано, что как для роста, так и для синтеза вторичных соединений необходимы минеральные формы азота. При этом органические формы (пептон, дрожжевой экстракт и др.) тормозят и рост, и синтез. Очень важно соотношение аммонийного и нитратного азота. Можно проследить определенную тенденцию: повышение доли нитратного азота способствует увеличению синтеза вторичных веществ, в частности диосгенина, в культуре клеток диоскореи.
Фитогормоны как компоненты питательных сред привлекают наибольшее внимание исследователей. Однако влияние гормонов на синтез вторичных соединений в культуре клеток неоднозначно и может меняться, в зависимости от класса вторичных соединений, физиологического состояния культуры, условий культивирования и др.
Наиболее интенсивно изучались ауксины и цитокинины поскольку они являются необходимыми компонентами питательных сред. Имеется множество примеров, когда ауксины стимулировали или подавляли синтез вторичных соединений. Ауксины стимулировали синтез антоцианов в культурах моркови и тополя, антрахинонов – в Cassia fistula и Cassia torra, сапогенинов – в тригонелле; уменьшали и исключали синтез антрахинонов и шиконина в воробейнике, скополамина – в гиосциамусе, хлорогеновой кислоты – в табаке.
Достаточно часто влияние ауксинов на синтез вторичных метаболитов зависит от их природы. Так, синтез никотина в табаке стимулируется НУК и ИУК, но тормозится 2,4-Д; синтез антоцианов и нафтахинонов в клетках культуры Plumbago zeylanica, наоборот, стимулируется повышенными концентрациями 2,4-Д и тормозится ИУК и НУК. В целом 2,4-Д чаще, чем ИУК и НУК, отрицательно влияет на синтез вторичных соединений.
Результатов по влиянию цитокининов на синтез вторичных соединений существенно меньше, что не позволяет выявить какие-либо закономерности. Например, бензиламинопурин стимулировал синтез стероидных сапогенинов в культуре паслена, а кинетин также стимулировал синтез алкалоидов в клетках скополии, но полностью ингибировал синтез никотина в культуре клеток табака.
Результаты по другим классам фитогормонов весьма фрагментарны и противоречивы.
Изучению влияния предшественников синтеза вторичных метаболитов на продуктивность клеточных культур посвящено значительное число работ. В большинстве случаев добавление их к питательной среде не приводило к существенному увеличению продуктивности клеток. По всей видимости, концентрация предшественников не является определяющим фактором для синтеза вторичных соединений в культуре.
Все это свидетельствует о том, что, используя различные комбинации питательных сред, можно повысить продуктивность клеточных культур высших растений и эффективность синтеза вторичных веществ.

