УТВЕРЖДАЮ.
Заместитель главного
государственного санитарного
врача СССР
26 сентября 1975 г.
№ 1351—75
Методические указания распространяются на лаборатории санэпидстанций, лаборатории предприятий Министерства пищевой промышленности, общественного питания и Центросоюза.
Настоящие указания содержат методику исследования кремовых изделий по ходу технологического процесса (сырья, полуфабрикатов, готовой продукции) и смывов, взятых с рук, инвентаря и оборудования.
На производстве кондитерских изделий с кремом, в отличие от других предприятий, санитарно-показательными микроорганизмами являются не только бактерии группы кишечных палочек, но и коагулазоположительные стафилококки.
Это обусловлено тем, что в кремовых кондитерских изделиях, несмотря на значительное содержание в них сахара, стафилококки, благодаря особым биологическим свойствам, могут выживать и размножаться. Они продолжают свою деятельность, при концентрации сахара в водной фазе продукта до 60%, тогда как большинство микроорганизмов прекращают размножение при 47%.
Стафилококки не требовательны к питательным средам, практически любой вид пищевого продукта служит средой для их размножения. Они устойчивы к действию физических и химических факторов; хорошо выдерживают высушивание и действие солнечного света; переносят нагревание при 70° С в течение часа, а при 80°— 10 минут.
Источником стафилококков в природе является человек, а также молочный скот, особенно больной маститом. Основным местом обитания стафилококков у человека являются его кожные и слизистые покровы и носоглотка.
В связи с этим стафилококки широко распространены во внешней среде.
При простудных заболеваниях (ангина, катары верхних дыхательных путей и т. д.) и гнойных поражениях кожи (гнойнички, фурункулы,, нагноившиеся порезы, ожоги и т. п.) количество людей-носителей стафилококков значительно увеличивается. Не последнее место в распространении стафилококков занимают люди с кариесом зубов.
Стафилококки попадают в продукт с пораженной поверхности кожи рук и открытых частей тела работников, а также при кашле и чихании.
При благоприятных условиях среды и температуры стафилококки размножаются и могут образовать токсические вещества в продукте, не изменяя его вкуса и внешнего вида, что особенно опасно для возникновения пищевого отравления.
Стафилококковые интоксикации, связанные с употреблением кремовых изделий, нередко возникают из-за грубых нарушений санитарного режима производства или личной гигиены лиц, занятых изготовлением этих изделий, в связи с этим обнаружение коагулазоположительных стафилококков в креме, в смыве с рук и инвентаря одних или в сочетании с бактериями группы кишечных палочек является показателем санитарного содержания производства кондитерских кремовых изделий.
Одним из важнейших средств профилактики стафилококковых пищевых отравлений является создание максимальных гигиенических условий изготовления, хранения и реализации тортов и пирожных с кремом, исключающих возможность заражения стафилококком сырья, полуфабрикатов и готовых изделий, а также размножения и образования энтеротоксина в них.
Для предотвращения образования энтеротоксинов в готовых кондитерских кремовых изделиях, как показали, экспериментальные данные, •существенное значение имеет концентрация сахарного сиропа для мочки (50%). Вследствие чего необходим строгий контроль за содержанием указанного процента сахара в сиропе для мочки.
Систематический организованный лабораторный контроль за качеством сырья, кремовых изделий, а также чистотой оборудования, инвентаря и соблюдением правил личной гигиены позволяет установить объективные показатели санитарного содержания обследуемых производств и обязывает проводить ряд гигиенических мероприятий.
ОБЪЕКТЫ, ПОДЛЕЖАЩИЕ ИССЛЕДОВАНИЮ
При текущем санитарном надзоре за предприятиями кондитерских кремовых изделий бактериологическому контролю подлежат:
- Яичная масса (содержимое выпущенных яиц), меланж. Исследование меланжа проводят согласно МРТУ 49/39—67.
- Масло сливочное после зачистки, сахарный сироп для мочки бисквита и сироп «Шарлотт».
- Крем на различных этапах его приготовления.
- Крем готовых изделий: пирожные и торты.
- Смывы с рук персонала, специальной одежды, инвентаря и оборудования.
ОТБОР ПРОБ И ТЕХНИКА ВЗЯТИЯ СМЫВОВ
Отбор проб
Пробы сливочного масла, яичной массы, меланжа, крема, сахарного сиропа для мочки бисквита, процеженного и охлажденного сиропа «Шарлотт» в количестве 50 м/мл отбирают стерильными ложками в стерильные банки, закрывают двумя слоями бумаги и обвязывают бечевкой- Торты и пирожные в количестве не менее 2-х штук отбирают из холодильных камер цеха и экспедиции.
Взятие смывов
Смывы с оборудования и инвентаря производят перед началом работы, либо после санитарной обработки в санитарные дни.
Смывы с рук следует производить перед началом работы, после пользования туалетом.
Взятие смывов с рук персонала, спецодежды, инвентаря и оборудования производят с помощью стерильных ватных тампонов на стеклянных (лучше металлических) палочках или марлевых салфеточек размером 5X5.см, завернутых в бумажные пакеты.
Непосредственно перед взятием смыва увлажняют тампон или салфетку стерильной 0,1%-ной пептонной водой или физиологическим раствором, предварительно разлитым по 2 мл в стерильные пробирки. Салфетки при этом захватывают прокаленным пинцетом. После взятия смыва тампон или салфетку помещают в ту же пробирку, из которой проводили увлажнение. При контроле жирных поверхностей пользуются сухими тампонами или салфетками.
Смывы с крупного оборудования и инвентаря берут с поверхности в 100 см2 в разных местах исследуемого предмета. Для ограничения поверхности используют шаблон (трафарет) площадью 25 см2.
При взятии смывов с мелких предметов обтирают всю рабочую поверхность предмета, причем одним тампоном протирают три одноименных объекта (например, три ложки); у ножей протирают рабочую часть их и нижнюю часть ручки (примерно наполовину).
При взятии смывов с рук протирают тампоном ладони обеих рук, проводя не менее 5 раз по одной ладони и пальцам, затем протирают участки между пальцами, ногти и под ногтями.
При взятии смывов с санитарной одежды протирают 4 площадки по 25 см2: нижнюю часть каждого рукава и 2 площадки с верхней и передней части спецовки.
МЕТОДИКА ИССЛЕДОВАНИЯ ПРОДУКТОВ
Подготовка проб к исследованию
Масло сливочное и крем в количестве 50 г помещают в колбу и ставят в термостат на 43° или водяную баню при температуре не выше 45°.
Для посева используют нижний слой растопленного масла или крема. Меланж перед посевом дефростируют и тщательно перемешивают.
Для анализа крема тортов или пирожных используют крем художественной отделки и из прослойки с прилегающей частью мучнистой основы. Различные сиропы исследуют без предварительной подготовки.
Определение титра бактерий группы кишечных палочек
- Для определения титра бактерий группы кишечных палочек в масле сливочном, яичной массе, в сиропах, креме и в креме с пирожных и тортов с прилегающей частью мучнистой основы, готовят разведения от 1 : 10 до 1:1000. Для разведения используют 0,1%-ную пептонную воду или физиологический раствор, разлитый в пробирки по 9 мл и подогретый до 45°. Из нижнего слоя растопленного масла; крема и крема с мучнистой основой берут 1 мл и вносят в пробирку с 9 мл пептонной воды, получают разведение 1 : 10 и из него готовят последующие разведения. Для десятикратного разведения сиропов к 10 мл добавляют 90 мл пептонной воды и далее готовят разведения 1 : 100 и 1 : 1000 как обычно.
В среду Кесслер, разлитую в пробирки по 5 мл, засевают следующие объемы: 1,0 мл и далее из разведений по 1,0 мл, что соответствует 0,1, 0,01 и 0,001 мл продукта. Посев 1 мл сиропа производят путем высева 10 мл из разведений 1:10 в колбу с 50 мл среды Кесслер, все’ остальные разведения, как указано выше. Посев инкубируют при 43° в течение 18—24 часов.
- Из всех пробирок со средой Кесслер, независимо от наличия роста (т. е. помутнение среды), производят высевы на сектора чашек со средой Эндо. Инкубируют при 37°— 18—24 часа.
- Чашки с посевами просматривают, при отсутствии характерных колоний на всех секторах чашки дают отрицательный ответ. При наличии темно-красных колоний с металлическим блеском или без блеска, розово-красных или бледно-розовых типичных для бактерий группы кишечных палочек производят их изучение, т. е. готовят препараты, красят по Граму, микроскопируют. Наличие грамотрицательных палочек в препарате указывает на присутствие бактерий группы кишечных палочек.
Вычисление титра производят согласно указаний ГОСТ 9225—68, таблица 9.
Определение количества коагулазоположительных
стафилококков в 1 г/мл
- Для количественного учета стафилококков 0,1 мл нижнего слоя растопленного крема и крема с пирожных и тортов с прилегающей мучнистой основой и сливочного масла засевают на поверхность молочносолевого агара. Сиропы засевают без предварительной обработки. Посевной материал тщательно втирают шпателем в поверхность питательной среды. Посевы на молочносолевом агаре инкубируют 18—24 часа при 37° и до 48 часов при комнатной температуре.
- Одновременно с посевами на плотные среды производят посевы в среды накопления — солевые бульоны — с содержанием хлористого натрия 6,5% и 10%, разлитые в пробирки по 5 мл. В каждую пробирку вносят по 0,5 мл исследуемой пробы. Посевы помещают в термостат при 37° на 18—24 часа.
- Через 24—48 часов инкубации на молочносолевом агаре стафилококки образуют золотистые, кремовые или эмалево-белые колонии. Подозрительные колонии (не менее 2—3) микроскопируют при окраске препарата по Граму. При наличии грамположительных кокков производят пересев отдельных колоний на сектора чашек питательного агара с молоком или кровью и на бульон с 1% глюкозы для постановки реакции плазмокоагуляции общепринятым или ускоренным методами.
Для количественного учета стафилококков в 1 г/мл исследуемого материала, все выросшие на плотной среде колонии, аналогичные подвергнутым изучению, подлежат подсчету и пересчету на 1 г/мл исследуемой пробы по общепринятой методике.
- При отсутствии роста колоний стафилококков на чашках с молочносолевым агаром при прямом посеве изучают культуры со сред накопления.
- Со сред накопления через 18—24 часа производят пересевы на чашки питательного агара с молоком или кровью. При отсутствии роста колоний стафилококков на плотных питательных средах при пересевах со сред накопления высевы с последних производят повторно через 48 часов. При повторном отсутствии роста стафилококков при высеве со сред накопления выдается заключение об отсутствии стафилококков. При наличии колоний стафилококков при высеве из сред накопления они изучаются как описано выше.
МЕТОДИКА ПОСТАНОВКИ РЕАКЦИИ КОАГУЛЯЦИИ
ПЛАЗМЫ
А. Приготовление цитратной плазмы
В настоящее время используют сухую кроличью плазму, выпускаемую Белорусским Институтом эпидемиологии и микробиологии *.
Сухую плазму разводят по прилагаемому к ней наставлению.
При отсутствии сухой плазмы, используют цитратную плазму крови кроликов или человека, которую готовят следующим образом: к 8 мл свежевзятой крови добавляют 2 мл стерильного 5%-ного лимоннокислого натрия. После осаждения эритроцитов на холоду. +6°---1-8° или при центрифугировании (3 тыс. об/мин.) плазму отсасывают и разводят физиологическим раствором из расчета 1 часть плазмы и 4 части физиологического раствора. Разведенную плазму разливают в стерильные пробирки с пробками по 0,5 мл. Необходим контроль с заведомо коагулазоположительной культурой стафилококков.
Б. Постановка реакции плазмокоагуляции
В пробирку с 0,5 мл цитратной разведенной плазмы вносят петлю чистой суточной культуры стафилококков с плотной питательной среды, тщательно смешивают и ставят в термостат при 37°. Пробирки осторожно, избегая встряхивания сгустка, просматривают каждые 1—3— 6 часов в течение рабочего дня, после чего оставляют до утра при комнатной температуре, для окончательного учета. Необходимо иметь в виду, что при длительной инкубации более 18 часов, может наступить разжижение образовавшегося сгустка за счет действия фибринолизина.
Для сокращения сроков исследования можно рекомендовать ставить реакцию плазмокоагуляции с молодой культурой, выращенной при 37° в течение 1—2 часов в 1,0 мл бульона с 1% глюкозы, предварительно подогретого в термостате. Реакцию плазмокоагуляции ставят путем добавления 2 капель молодой бульонной культуры и 0,5 мл разведенной плазмы. Помещают в термостат при 37°. Реакция коагуляции наступает в пределах 2—3 часов.
Реакция коагуляции плазмы считается положительной независимо от степени свертывания плазмы (от небольшого сгустка, взвешенного в плазме, до плотного сгустка, остающегося неподвижным при перевертывании пробирки).
МЕТОДИКА ИССЛЕДОВАНИЯ СМЫВОВ
Материалом посева при исследовании смывов является смывная жидкость, используемая для увлажнения тампона или марлевой салфетки.
- а) Для выявления наличия коагулазоположительных стафилококков производят посев непосредственно тампоном на чашки с молочносолевым агаром. Если смывы производят марлевыми салфетками, то посев на плотные питательные среды удобнее осуществлять нанесением на noверхность среды в количестве 0,1 мл смывной жидкости, которую затем тщательно растирают шпателем по всей поверхности агара.
В качестве среды накопления для стафилококков применяют питательный бульон с 6,5% хлористого натрия, разлитым по 5 мл в пробирки, куда помещают оставшуюся смывную жидкость.
- б) Для выявления наличия бактерий группы кишечных палочек посев производят в среду накопления, для чего тампон, которым производили ранее посев на мол очно солевой агар (или марлевую салфетку), погружают в среду Кесслер, разлитую в пробирки по 5—10 мл.
Дальнейший ход исследования на обнаружение стафилококков и бактерий группы кишечных палочек производят как указано в разделе «Определение титра БГКП» и «Определение количества коагулазоположительных стафилококков в 1 г/мл».
ОФОРМЛЕНИЕ РЕЗУЛЬТАТОВ
БАКТЕРИОЛОГИЧЕСКИХ ИССЛЕДОВАНИИ
ЯИЧНОЙ МАССЫ, МАСЛА СЛИВОЧНОГО, СИРОПОВ,
КРЕМОВ И СМЫВОВ
В протоколе исследований необходимо указывать:
- а) титр бактерий группы кишечных палочек;
- б) степень обсеменения коагулазоположительными стафилококками в пересчете на 1 г/мл;
- в) в смывах указывать наличие или отсутствие бактерий группы кишечных палочек и стафилококков.
Примечания:
а) фаготипирование коагулазоположительных стафилококков проводят в лабораториях санэпидстанций по специальным показателям.
б) Исследования на наличие бактерий рода сальмонелла в меланже, яичной массе, масле сливочном, сиропах и кремовых изделиях производят в лабораториях санэпидстанций.
САНИТАРНО-БАКТЕРИОЛОГИЧЕСКИЕ ПОКАЗАТЕЛИ
ОЦЕНКИ КРЕМА ГОТОВЫХ КРЕМОВЫХ ИЗДЕЛИЙ
И СМЫВОВ КОНТРОЛИРУЕМЫХ ОБЪЕКТОВ
- Титр бактерий группы кишечных палочек не ниже 0,01 г.
- Содержание коагулазоположительных стафилококков не более 500 в 1 г/мл.
- Бактерии группы кишечных палочек и коагулазоположительных стафилококков должны отсутствовать в смывах с контролируемых объектов.
Примечание. Неоднократное обнаружение коагулазоположительных стафилококков со сред обогащения (продукты, смывы) указывает на нарушение санитарного режима производства и требует проведения внепланового санитарного дня.
Приложение
Питательные среды
- Молочно-солевой агар: к 100,0 мл 2%-ного стерильного агара, содержащего 6,5% поваренной соли, добавляют 10,0 мл, снятого стерильного молока. РН 7,4.
- Молочный агар: к 100,0 мл стерильного мясопептонного агара, добавляют 10,0 мл снятого стерильного молока. pH 7,4.
- Снятое молоко: молоко центрифугируют, удаляют сливки, разливают в пробирки по 5,0 и 10,0 мл и стерилизуют при 121°— 10 минут.
- Солевые бульоны: к 100,0 мл, мясопептонного бульона pH-7,4—7, добавляют 6% или 9,5% поваренной соли. Разливают в пробирки по 5,0 мл. Стерилизуют при 12 Г — 20 минут.
- Кровяной агар: к 100,0 мл 2%-кого стерильного мясопептонного агара pH 7,4 растопленного и остуженного до 45° добавляют 4,0—5,0 мл дефибринированной или цитратной крови кролика или человека.
- Среда Кесслер (модифицированная); к 1 литру воды добавляют 10 г пептона и 50 мл бычьей желчи, или других сельскохозяйственных животных. Кипятят при помешивании 20—30 минут, фильтруют через вату, прибавляют 2,5 г глюкозы, объем доводят до 1 литра, устанавливают pH 7,4—7,6, добавляют 2 мл 1%-ного водного раствора кристаллического фиолетового, разливают по 5—10 мл в пробирки с поплавками. Стерилизуют при 121°—15—20 минут. Готовая среда должна иметь темно-фиолетовый цвет.
Схема санитарно-бактериологического контроля на производстве кремовых кондитерских изделий *

* Схема санитарно-бактериологического контроля производства кремовых и кондитерских изделий должна быть единой для всех указанных предприятий.
Требует уточнения и согласования с государственным санитарным надзором лишь периодичность санитарно-бактериологического контроля и количество анализов в зависимости от мощности предприятия, сменности работы и штатности единиц бактериологов.

Результаты бактериологических исследований сырья, полуфабрикатов и готовых изделий
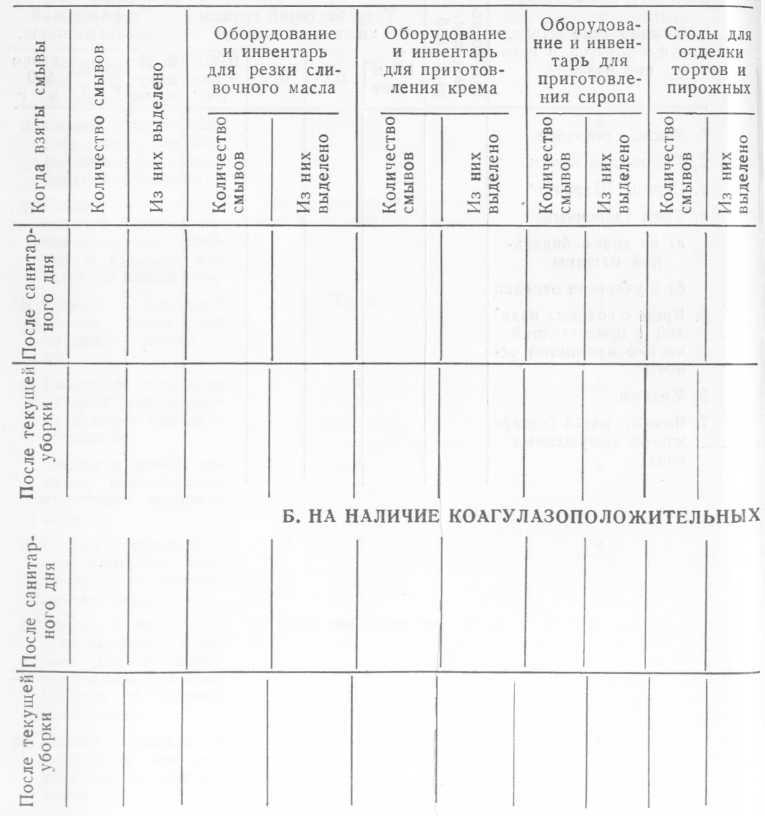
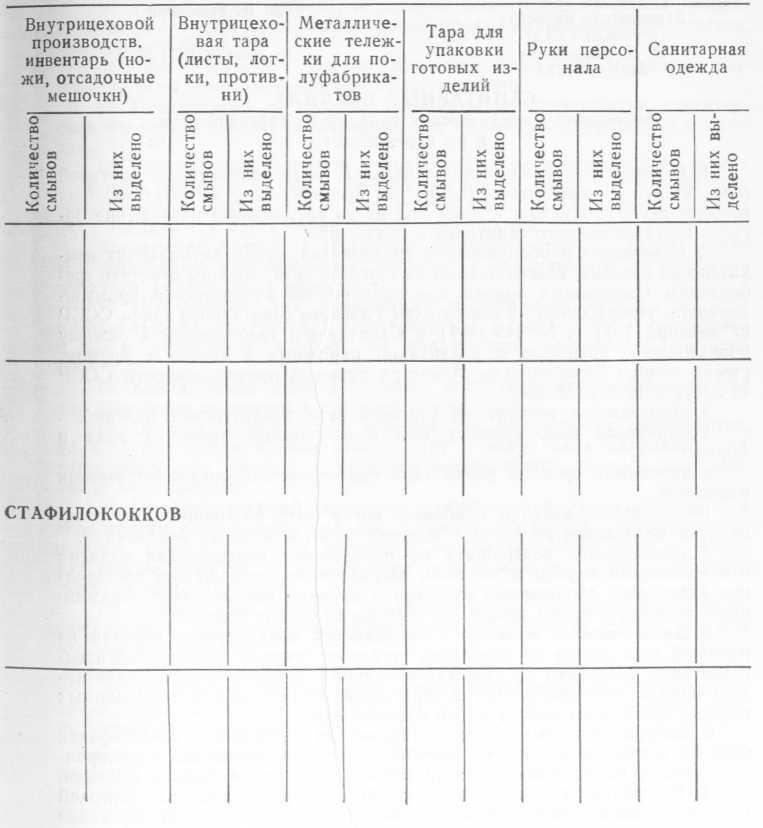
РЕЗУЛЬТАТЫ БАКТЕРИОЛОГИЧЕСКИХ ИССЛЕДОВАНИЙ СМЫВОВ С ИНВЕНТАРЯ, ОБОРУДОВАНИЯ И РУК
А. НА НАЛИЧИЕ ГРУППЫ КИШЕЧНЫХ ПАЛОЧЕК