I. Отбор образцов и подготовка проб для анализа
Консервы перед стерилизацией подвергают микробиологическому исследованию немедленно после закатки банок.
В бактериологическом кабинете банки тщательно промывают чистой теплой водой, пользуясь щетками, и вытирают.
Крышку банки фламбируют смоченной в спирте и зажженной ватой,, открывают банки стерильным консервным ножом. Пробы для анализа содержимого банок в зависимости от вида и консистенции продукта подготавливают одним из двух следующих способов.
Первый способ. При анализе консервов с большим количеством заливки, пюреобразных, для детского питания и диетического, а также томатопродуктов отбирают для посева пробы продуктов — 0,5 или 1,0 см3:
- а) из консервов с большим количеством заливки — из жидкой фазы;
- б) из пюреобразных консервов для детского и диетического питания — непосредственно от содержимого банок;
- в) из томатопродуктов, расфасованных в мелкую тару, — непосредственно от содержимого банок;
расфасованных в крупную тару — во время расфасовки асептически в стерильную тару (банку)—не менее 10,0 см3, затем на посев берут 0,5 см3.
Отобранную пробу высевают непосредственно в чашки Петри и после термостатирования проводят подсчет общей обсемененности по формуле (1) или приготавливают из отобранной пробы серию последовательных разведений, высевают их в чашки Петри и после термостатирования ведут подсчет общей обсемененности по формуле (3).
Второй способ. При анализе консервов, не содержащих жидкой фазы или содержащих ее в незначительном количестве, в продукт добавляют воду в соотношении приблизительно 1 : 1 и высевают смыв с продукта без дальнейшего разведения или из последовательно приготовленных разведений 0,5 см3 или 1,0 см3 в чашки Петри. Для приготовления смывов из консервируемых продуктов:
- г) расфасованных в тару емкостью до 0,5 л, содержимое банки перекладывают в стерильную банку с таким же содержанием воды, закрывают крышкой и встряхивают в течение 3 мин;
- д) расфасованных в тару емкостью более 0,5 л, от содержимого отбирают часть продукта, помещают в предварительно простерилизован- ную банку с определенным количеством (не более 0,5 л) воды.
По разности воды в банке до прибавления продукта и после его внесения определяют объем внесенного продукта.
Подсчет общей бактериальной обсемененности проводят по формулам (2) или (3).
II. Определение общей бактериальной обсемененности
Общее количество бактерий в исследуемых консервах перед стерилизацией определяют в 1 см3 продукта путем посева непосредственно самого продукта или его последовательных разведений в чашки Петри с питательным агаром.
Выбор степени разведения зависит от предполагаемой бактериальной загрязненности консервов перед стерилизацией. Разведение подбирают с таким расчетом, чтобы после посева на чашках Петри выросло не более 300 колоний (для большинства консервов наиболее приемлемым является разведение 1 : 100); пюреобразные консервы для детского и диетического питания при хорошем санитарном состоянии производства высевают без разведения.
Для приготовления разведения 1 см3 исследуемого продукта переносят последовательно в пробирки с 9 см3 стерильной воды. Исследуемый продукт или его разведение в количестве 1 см3 высевают на чашку Петри и заливают 20 см3 расплавленного и охлажденного до 45° С питательного агара.
Можно применять мясопептонный агар, рыбопептонный или питательный агар, приготовленный из сухой среды ВИЭМ.
На дне чашки записывают наименование анализируемого продукта, разведение, взятое для посева, и дату анализа.
После застывания агара чашки перевертывают крышками вниз и ставят в таком виде в термостат с температурой 37±0,5°С на 24 ч для учета активно развивающейся микрофлоры.
Для обеспечения подсчета количества выросших колоний чашку помещают вверх дном (без крышки) на темном фоне; можно пользоваться лупой с увеличением в 8—10 раз.
Подсчет бактериальной обсемененности консервов перед стерилизацией проводится по формулам:
при посеве непосредственно продукта:
![]() (1)
(1)
при анализе продуктов, не смешивающихся с водой при разведении (смыв с продукта):
![]() (2)
(2)
при посеве продуктов, смешивающихся с водой при разведении:
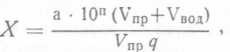 (3)
(3)
где х — число колоний в 1 см3 продукта;
а — число колоний, выросших на чашках; п — степень разведения продукта;
Увод— объем воды в банке;
Упр—объем продукта в банке;
<7 — объем посевного материала, внесенного на чашку.
При анализе основного сырья, зелени, пряностей и других вспомогательных материалов (смыв с продукта), отобранных на технологической линии, число микроорганизмов учитывается в 1 г анализируемого продукта по формуле:
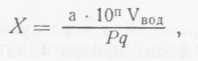 (4),
(4),
где Р — масса продукта.
III. Подготовка образцов для определения
в них бактериальных спор
Число спор в сырье, полуфабрикатах и в консервируемом продукте до стерилизации определяется при посеве прогретого образца продукта.
Из подготовленного для анализа образца стерильной трубкой или пипеткой отбирают примерно 10 см3 продукта и вносят в стерильную пробирку.
Пробирку с отобранным продуктом помещают в водяную баню с температурой 50° С. Воду в бане доводят до нужной температуры и пробирку с продуктом выдерживают в водяной бане с установившейся температурой определенное время.
Температуру внутри пробирки с продуктом определяют в контрольной параллельной пробирке по термометру с соответствующей шкалой.
Для выявления спор термофильных (аэробных и анаэробных) бактерий пробирку с продуктом прогревают в кипящей водяной бане после достижения 94—96° С внутри пробирки с продуктом в течение 20 мин. Для выявления спор аэробных и анаэробных мезофильных бактерий в продуктах, стерилизуемых при температуре выше 100° С, пробирку с продуктом прогревают при температуре 80° С (внутри пробирки с продуктом) в течение 20 мин.
IV. Определение присутствия спор
облигатных мезофильных
и термофильных анаэробов
Присутствие спор облигатных мезофильных анаэробов в исследуемых консервах до стерилизации определяют путем посева 0,5 см3 прогретого, как указано выше, продукта в пробирки со средой Китта—Тароцци с добавлением 0,15%-ного агара.
Присутствие спор облигатных термофильных анаэробов в исследуемых консервах до стерилизации определяют посевом 0,5 см3 прогретого, как указано выше, продукта в пробирки со средой Тароцци с добавлением 0,5% стерильного мела, 3% дрожжевого автолизата и 100 мкг аскорбиновой кислоты.
Посевы для выявления спор мезофилов термостатируют при 37± ±0,5°С, для выявления спор термофилов — при 55±0,5°С. Спустя 48 ч после посева в среде отмечают газообразование и анаэробный рост.
При наличии в пробирках анаэробного роста из накопительных культур 1—2 капли высевают в чашку Петри. Чашку с посевом заливают 30 см3 уплотненной питательной среды, содержащей 2% агара и 1% глюкозы. Питательный агар до добавления к нему глюкозы должен иметь- pH 7,0—7,2.
Сразу же после застывания агара на его поверхность пинцетом кладут стерильное предметное стекло так, чтобы под ним не было пузырьков воздуха. После наложения стекла чашку перевертывают крышкой вниз и ставят в таком виде в термостат с температурой 37±0,5°С или 55±0,5°С для выявления мезофильных или термофильных анаэробных бактерий соответственно.
Облигатные анаэробы выявляются на чашке под стеклом в центральной его части в виде отдельных колоний или сплошного роста, они отступают от края стекла на 3—4 мм, образуя иногда под стеклом пузырьки газа.
Факультативные анаэробы растут не только под стеклом в виду сплошной зоны, но и по всей поверхности чашки.
V. Определение числа спор термофильных бацилл
Из подготовленного для анализа материала после прогрева берут 1 см3 продукта и переносят его на чашку Петри с картофельно-пептонным агаром.
Посевы термостатируют при 55±0,5°С 24 ч при 80%-ной влажности воздуха в термостате. Влажность обеспечивают, помещая в термостат открытый сосуд с большой поверхностью испарения воды.
VI. Метод бактериологического контроля воды
на присутствие спор облигатных анаэробов
Споры облигатных анаэробных микроорганизмов присутствуют в питьевой воде в небольшом количестве. Если число спор облигатных анаэробов в 100 см3 воды больше 1, то такая вода является при производстве консервов дополнительным источником инфицирования продуктов клостридиальными микроорганизмами. Воду, содержащую в 100 см3, споры клостридий, перед употреблением необходимо хлорировать.
Методика обнаружения спор облигатных анаэробов в воде включает следующее: 1) концентрирование присутствующих в воде микроорганизмов на мембранном ультрафильтре или с помощью центрифугирования; 2) инактивацию вегетативных микробных клеток, осевших на фильтре или при центрифугировании; 3) проращивание бактериальных спор, осевших на фильтре или при центрифугировании, в жидкой питательной среде для анаэробов.
Подготовка к анализу. Вся бактериологическая посуда (пробирки, мензурки, склянки, воронки, колбы, пастеровские пипетки) должна быть тщательно вымыта и простерилизована сухим жаром или в автоклаве. Дистиллированную воду разливают в колбы и стерилизуют в автоклаве.
Бумажные фильтры, пинцеты и воронки Зейтца завертывают в бумагу и стерилизуют сухим жаром или в автоклаве.
Мембранные ультрафильтры № 3 проверяют на присутствие явных пороков (отверстий, трещин и т. д.), после чего их помещают в выпаривательную чашку или в химический стакан с теплой стерильной дистиллированной водой и дважды кипятят. Воду каждый раз сменяют для удаления из ультрафильтров воздуха и остатков растворителей, применявшихся при их изготовлении.
Отбор, хранение и транспортировка проб. Эти операции производятся в соответствии с требованию ГОСТ 5215—60.
Пробы воды отбирают согласно плану и объему лабораторно-производственного контроля качества воды. Пробы отбирают в стерильные •склянки с притертыми пробками или без них в часы наибольшего рас-хода воды. Из кранов водопроводных сооружений выемка проб воды производится после предварительной их стерилизации (обжиганием в пламени горелки или ватным тампоном, смоченным спиртом) и последующего спуска воды в течение 10 мин при полном открытии крана.
Проба воды должна быть исследована тотчас же после ее отбора с глубины 10—15 см от поверхности.
Для определения спор облигатных анаэробов отбирают 100 см3 воды. »
Проба воды должна быть исследована тотчас же после ее отбора или не позднее чем через 2 ч после взятия пробы. При невозможности выполнения этого условия анализ должен быть произведен не позднее чем через 6 ч после отбора пробы при условии хранения ее при температуре в пределах от 1 до 5° С.
Транспортировка проб допускается при соблюдении следующих условий:
1) посуду с пробами упаковывают в ящики или корзины, желательно с теплоизолирующей прокладкой;
2) температура в ящике (корзине) с пробами при транспортировке должна поддерживаться в пределах от 1 до 5° С с помощью резиновых мешков, наполненных летом льдом, зимой —теплой водой;
3) пробы воды должны быть предохранены от резких толчков, опрокидывания и замачивания ватных пробок;
4) пробы воды должны быть доставлены в лабораторию для анализа не позднее, чем через 6 ч с момента отбора.
Проведение анализа. При наличии в отобранной для анализа воде мути, медленно выпадающей в осадок, воду предварительно фильтруют через стерильный бумажный фильтр в стерильную колбу. Полученный первичный фильтр используют для дальнейшей работы.
а) Проведение анализа с использованием мембранного ультрафильтра. Прокипяченный мембранный ультрафильтр № 3 перед началом работы вставляют в стерильную воронку Зейтца между двумя стерильными бумажными фильтрами, равными по диаметру мембранному ультрафильтру. Фильтры помещают на металлическую сетку воронки Зейтца и закрепляют их болтами. Воронку вставляют в резиновую пробку, резиновую пробку с воронкой Зейтца в свою очередь вставляют в колбу Бунзена. Пробка должна плотно прилегать к горлышку колбы.
Подготовленную таким образом колбу Бунзена подсоединяют к вакуумному насосу. Анализируемую воду или первичный фильтрат наливают в воронку Зейтца. По мере фильтрования воду доливают в воронку до тех пор, пока через мембранный ультрафильтр не пройдет 100 см3 воды. Фильтрование прерывают в тот момент, когда в воронке Зейтца еще остается фильтрующая жидкость, покрывающая фильтр слоем 2— 3 мм. Мембранный ультрафильтр с концентрированным на нем посевным материалом переносят стерильным пинцетом из воронки на дно пробирки с регенерированной средой для анаэробов. Пробирку с фильтром прогревают при 80° С в течение 20 мин. и термостатируют при 37±0,5°С.
б) Проведение анализа с помощью центрифугирования. При осаждении микроорганизмов центрифугированием анализируемую воду или первичный фильтрат в объеме 100 см3 наливают в стерильные центрифужные стаканы и центрифугируют 30 мин при 3000 об/мин. Немедленно после центрифугирования надосадочную жидкость осторожно декантируют с помощью пастеровской пипетки, оставляя на дне центрифужной пробирки 1—2 см3 воды. Всю оставшуюся после декантирования воду с осевшими микроорганизмами с помощью пастеровской пипетки переносят на дно пробирки с регенерированной питательной средой для анаэробов.
Далее поступают так же, как при посеве микроорганизмов, уловленных с помощью мембранного ультрафильтра.
Все операции проводят с соблюдением правил асептики.
Учет результатов. Посевы термостатируют в течение 48 ч. Спустя 48 ч после посева отмечают характер развития. Признаками развития анаэробов является появление мути и образование газа в среде. Посевы микроскопируют, отбирая жидкость для мазков со дна пробирки. Если в посевах обнаружены палочки, то для окончательного вывода о присутствии облигатных анаэробов делают высев на агаризованную питательную среду для анаэробов под стекло.
Сразу же после застывания агара на его поверхность пинцетом накладывают стерильное предметное стекло. Стекло должно быть положено так, чтобы под ним не было пузырьков воздуха.
После наложения стекла чашки Петри переворачивают крышкой вниз и помещают в таком виде в термостат с температурой 37±0,5°С на 48 ч.
Облигатные анаэробы выявляются на чашке под стеклом в центральной его части в виде отдельных колоний или сплошной зоны роста, отступающей от края стекла на 3—4 мм, иногда под стеклом образуются пузырьки газа. Факультативные анаэробы растут не только под стеклом в виде сплошной зоны, но и по всей чашке.
При наличии под стеклом характерного для облигатных анаэробов роста делают вывод о присутствии в 100 см3 воды спор облигатных анаэробных микроорганизмов.
Главное управление эпидемиологии и гигиены Минздрава РСФСР доводит до сведения, что Минрыбхозом СССР и Минздравом СССР 2 марта 1988 года утверждено «Временное положение о порядке отбора проб .и периодичности определения токсичных веществ (токсичных химических элементов — ТХЭ и хлорорганических пестицидов —ХОП) в гидробионтах и продуктах, вырабатываемых из них». Указанным документом определены периодичность выборочного контроля рыбы внутренних водоемов, консервов (в том числе детского питания), баночных пресервов и рыбной гастрономии (рыбы холодного и горячего копчения, пряного посола, маринованной, вяленой, соленой и т. д.) в центральных бассейновых лабораториях Всесоюзного рыбопромышленного объединения и территориальных лабораториях производственно-территориальных управлений Минрыбхоза РСФСР.
Определение содержания токсических веществ в гидробионтах и продуктах, вырабатываемых из них, проводится в пробах, отобранных для определения их состава и качественных показателей в соответствии со стандартами: ГОСТ 7631—85 «Рыба, морские млекопитающие, морские беспозвоночные и продукты их переработки. Правила приемки, методы органолептической оценки качества, методы отбора проб для лабораторных испытаний»; ГОСТ 8756-0—70 «Продукты пищевые консервированные. Отбор проб и подготовка их к исследованию»; ГОСТ 20438—75 «Водоросли, травы морские и продукты их переработки. Правила приемки. Методы органолептической оценки качества. Методы отбора проб для лабораторных испытаний». При проведении внеплановых исследований (по указанию санэпидслужбы) только по определению ХОП отбор проб продукции производится в соответствии с Унифицированными правилами отбора проб сельхозпродукции, продуктов питания и объектов окружающей среды для определения микроколичеств пестицидов, утвержденными Минздравом СССР № 2051—79 от 21.08. 79 г.
Оценка качества рыбопродуктов по содержанию токсичных химических элементов проводится в соответствии с ПДК тяжелых металлов и мышьяка в продовольственном сырье и пищевых продуктах (СанПиН 42-123-4689—86), по содержанию пестицидов — в соответствии с санитарно-гигиеническими нормами «Максимально допустимые уровни содержания пестицидов в пищевых продуктах и методы их определения» (СанПиН 42-123-4540—87). Обязательному определению подлежат химические элементы— ртуть, свинец, кадмий, а в консервах в сборной жестяной таре — и олово.
В случае установления в исследуемых объектах токсичных веществ (ХОП или какой-либо химический элемент) выше норм, утвержденных Минздравом СССР, вопрос об использовании сырья или готовой продукции решается по согласованию с территориальной санэпидслужбой; при этом вводится усиленный контроль за выполнением рекомендаций, а также по ГОСТ 20736—75 «Качество продукции. Статистический приемочный контроль по количественному признаку при нормальном распределения контролируемого параметра».
Методическое руководство работой по определению содержания токсических веществ, анализ и обобщение полученных результатов возложено на Всесоюзный НИИ морского рыбного хозяйства и океанографии (ВНИРО), куда ежегодно в соответствии с указанием Минрыбхоза СССР (письмо № 541 от 14.05.87.) направляются данные ведомственных лабораторий о загрязненности продукции.
С введением настоящего Положения отменен ранее действующий порядок контроля химических элементов в рыбных консервах, изложенный в Инструкции по порядку санитарно-технического контроля консервов на производственных предприятиях, оптовых базах, в розничной торговле и на предприятиях общественного питания (утв. Минздравом СССР 18.09.73 г. № 1121, раздел IV, п. 46—52).
Прошу принять указанный документ к руководству.
Е. Н. Беляев

