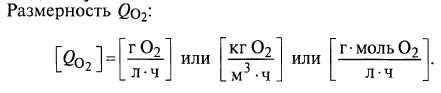Основные предпосылки. Поскольку ход процесса определяется микроорганизмами, различия в ходе ферментации в аппаратах разного масштаба и конструкции следует искать в микроокружении микробных клеток. Концентрации питательных веществ, продуктов метаболизма, температура и рН вряд ли зависят от масштаба. Более естественным выглядит предположение о различии в концентрациях растворенного кислорода С.
Аэробные микроорганизмы не могут развиваться в отсутствие кислорода. Однако растворимость кислорода воздуха в воде очень невелика – 7 мг/л при 20 °С. Если жидкость (или среду) полностью насытить кислородом воздуха, а затем прекратить аэрацию, то многие промышленные культуры микроорганизмов «съедают» этот запас за 5–10 с. Поэтому требуется непрерывная подача воздуха в аппарат.
Надо заметить, что растворимость кислорода зависит еще и от давления воздуха, а вернее, от парциального давления кислорода в газовой фазе. Если, например, повысить давление воздуха в 2 раза, то и концентрация растворенного кислорода при насыщении жидкости воздухом также повысится в 2 раза. Если вместо воздуха для насыщения среды использовать чистый кислород, то концентрация растворенного кислорода возрастет почти в 5 раз – пропорционально парциальному давлению кислорода в воздухе и газообразном кислороде: (100 %) / (21 %) ≈ 4,8. Этот показатель – концентрацию растворенного кислорода – можно измерять с помощью специального датчика растворенного кислорода. Это очень важный прибор для процессов ферментации, хотя в обычных системах контроля и автоматизации химических производств он используется довольно редко.
Профили изменения концентрации растворенного кислорода во времени. Концентрации растворенного кислорода, которые мы указывали ранее, – это концентрации в равновесном состоянии, при насыщении. В реальном процессе происходит непрерывное потребление растворенного кислорода из жидкости и одновременно его непрерывное растворение – массопередача из пузырей воздуха.
Надо иметь в виду важную особенность микробиологических процессов. Микроорганизмы не способны потреблять кислород напрямую из газовых пузырей. Они потребляют лишь растворенный кислород, т. е. кислород переходит в клетку микроорганизма через две ступени: массопередача из газа в жидкость и затем потребление уже растворенного кислорода из жидкости.
Чтобы повлиять на концентрацию растворенного кислорода в жидкости, необходимо изменить либо скорость продувания воздуха через аппарат, либо частоту вращения мешалки в аппарате; либо давление в нем.
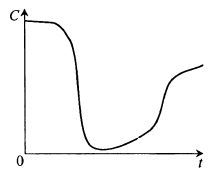
Мы можем наблюдать за ходом изменения концентрации растворенного кислорода непрерывно в течение всей ферментации. Обычный ход кривой C(t) представлен на рис. 11.1.
Рис. 11.1. Типичный профиль изменения концентрации
растворенного кислорода во времени в ходе периодической ферментации
Эта кривая (профиль во времени) отражает разные потребности кислорода в разные периоды ферментации и, соответственно, баланс между подводом кислорода и его потреблением.
Можно, конечно, меняя скорость подачи воздуха и частоту вращения мешалки, поддерживать профиль во времени, например, в большом аппарате таким же, как в малом.
А можно вспомнить о том, что кислород, как и другие субстраты, влияет на процесс обычно по кривой с насыщением (рис. 11.2).
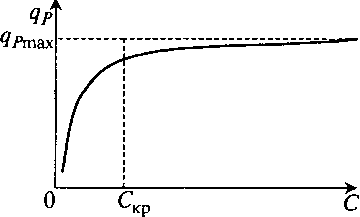
Рис. 11.2. Влияние концентрации растворенного кислорода на удельную скорость биосинтеза целевого продукта
Тогда в ходе процесса достаточно поддерживать величину С > CKP.
Обычно зависимость выхода за весь процесс ферментации (P или X) от поддерживаемой концентрации растворенного кислорода имеет вид графика, представленного на рис. 11.3.
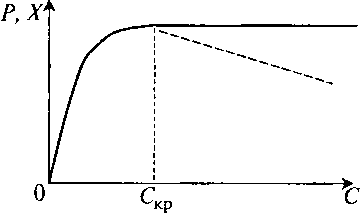
Рис. 11.3. Влияние концентрации растворенного кислорода на выход продукта или биомассы микроорганизмов
Повышение концентрации растворенного кислорода выше некоторой величины CKP не ухудшает процесс, но из экономических соображений удобно держать концентрацию поменьше. При высоких концентрациях в аппарат подается больше воздуха, больше скорость вращения мешалки, иногда приходится увеличивать давление и даже добавлять в воздух кислород.
Есть процессы, хотя их и немного, в которых повышение концентрации растворенного кислорода хуже не просто из-за перерасхода воздуха и энергии, но также и из-за снижения выхода (показано пунктиром на рис. 11.3).
Так в общем выглядит способ масштабирования процесса путем поддержания профиля растворенного кислорода во времени.
Проблема в том, что обслуживание датчика и прибора для измерения растворенного кислорода – довольно хлопотное дело, и часто на заводах их либо нет, либо отказываются от их регулярной эксплуатации.
Связь концентрации растворенного кислорода с условиями массопередачи. Как бы сделать так, чтобы этот профиль в аппарате- большего масштаба выдерживался сам собой? Какую характеристику нужно поддерживать одинаковой в сравниваемых аппаратах, чтобы одинаковым был и кислородный профиль?
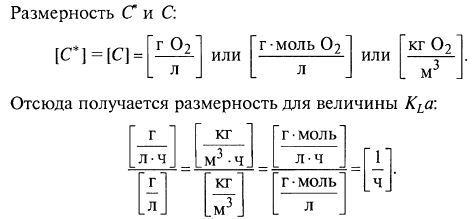
Для ответа на этот вопрос рассмотрим основное уравнение массопередачи кислорода в ферментере
QO2=KLα(С*–C), (11.1)
где QO2– скорость потребления кислорода единицей объема среды (кинетический параметр, аналогичный QS для не газообразного субстрата); KLα – объемный коэффициент массопередачи по кислороду; С* – концентрация растворенного кислорода при насыщении; С – текущая концентрация растворенного кислорода.
Уравнение показывает, что в текущий момент времени скорость потребления кислорода равна его скорости растворения в жидкости из газового потока.
Интересно, что коэффициент KLα включает в себя площадь межфазной поверхности, поэтому его размерность включает в себя единицу объема.
Из уравнения (11.1) легко получить выражение для текущей концентрации растворенного кислорода С: (11.2)
Если в ходе процесса скорость потребления кислорода QO2, изменяется во времени, то изменяется и концентрация растворенного кислорода, что и дает наблюдаемый профиль во времени.
Если мы имеем два разных аппарата, в которые загружена одна и та же культуральная жидкость, имеющая одну и ту же скорость потребления кислорода на единицу объема, то концентрация растворенного кислорода в таких аппаратах зависит только от коэффициента массопередачи KLa.
Отсюда вытекает второй способ масштабирования – по величине KLa.
Если обеспечить равенство значений KLa в сравниваемых аппаратах, то можно ожидать, что при этом автоматически обеспечивается и равенство профилей концентраций растворенного кислорода во времени.
Кроме того, если KLa, например, недостаточен (мал), то мы не сможем поддержать требуемое значение Сопт в течение всего процесса (рис. 11.4).
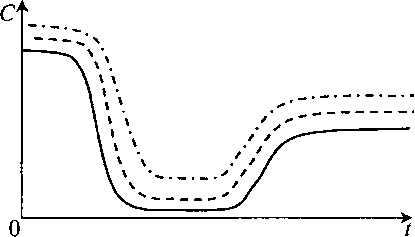
Рис. 11.4. Влияние коэффициента массопере- дачи KLa на профиль по времени растворенного кислорода в процессе ферментации:
1 – для процесса с минимальным значением KLа;
2– для процесса с промежуточным значением KLa;
3 – для процесса с максимальным значением KLa
Профили растворенного кислорода при различных значениях KLa (которые можно задать разной частотой вращения мешалки, разными ее размерами и конструкцией, разной скоростью аэрации) должны различаться.
Можно по результатам таких ферментаций построить зависимость выхода от величины KLa (рис. 11.5).
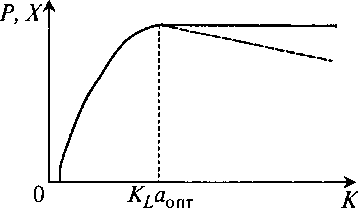
Рис. 11.5. Зависимость выхода продукта от величины KLα:
КLαопт – значение KLα, оптимальное для реализации процесса
Хотя здесь за KLα скрывается профиль C(t) в ходе ферментации, выход продукта в зависимости от KLα аналогичен зависимости от С: либо с насыщением (с плато в области высоких KLα), либо с экстремумом (оптимальным диапазоном KLα) – в зависимости от процесса. В обоих случаях можно выбрать значение или диапазон значений KLa, которые должны поддерживаться в аппаратах любой конструкции и размера, чтобы получить желаемый результат.
Методы определения KLα в аппаратах различного масштаба. Далее при масштабировании возникает проблема реализации необходимого значения KLa в аппаратах любого типа и размера.
Для этого и нужны формулы, связывающие величину KLα с размерами мешалки, аппарата, числом ярусов, частотой вращения, скоростью подачи воздуха на аэрацию. Подобные формулы для различного вида аппаратов можно найти в специальной литературе.
Например, для аппаратов с мешалкой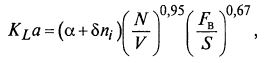
где α и δ – коэффициенты; ni – число ярусов мешалки; N – мощность, расходуемая на перемешивание жидкости; FB – расход воздуха; S – поперечное сечение аппарата (равное πD2/4).
В курсе «Биореакторы» приводятся такие формулы для аппаратов разной конструкции.
Как определить влияние величины KLα на результат процесса при проведении опытов в колбах?
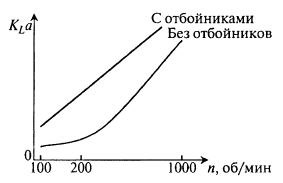
Прежде всего, можно менять частоту встряхиваний качалки (устройства для встряхивания колб). На рис. 11.6 представлена зависимость величины KLα от частоты качаний для двух типов колб – обычных полых колб и колб с отбойниками.
Рис. 11.6. Влияние частоты качаний качалки на величину KLα при проведении опытов в колбах
Отбойники различной конструкции вставляются в колбы для создания сопротивления движению потока и улучшения условий перемешивания и массопередачи. Колбы с отбойниками позволяют моделировать аппараты высокой интенсивности.
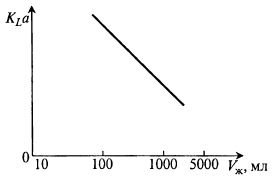
Довольно часто устройства для встряхивания колб (качалки) не имеют приспособлений для регулирования скорости. В этом случае можно использовать для создания различных значений KLα прием, заключающийся в проведении экспериментов с различными объемами жидкости в колбе. На рис. 11.7 представлена зависимость коэффициента KLα от объема жидкости в колбе.
Рис. 11.7. Влияние объема жидкости в колбе V на величину KLa
В микробиологической практике используют колбы разного объема и разной конструкции. Даже при их постоянной степени заполнения величина KLα зависит от объема сосуда.
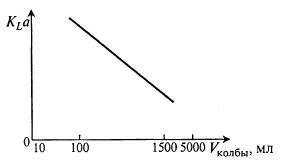
На рис. 11.8 представлен характер изменения величины KLα в колбах разной вместимости при их заполнении на 1/10 объема.
Рис. 11.8. Влияние объема колбы на величину KLa
Графики позволяют приблизительно оценить величину KLα для колб разного объема с разной степенью заполнения и с разной частотой качаний.
Практически же при решении реальных задач масштабирования с использованием колб целесообразно провести соответствующие эксперименты по сульфитной методике, в которой скорость массопередачи кислорода определяют по скорости реакции окисления сульфита в сульфат.