Энергетический и конструктивный обмен веществ
Многообразные проявления жизнедеятельности дрожжей можно наиболее полно и целенаправленно использовать при знании физиологии обмена веществ, особенностей биохимических процессов, характерных для них в естественных условиях. Основной функцией обменных процессов является накопление энергии и ее целесообразное расходование для поддержания жизнеспособности клеток, т. е. синтез и обмен элементов биологических структур.
Обмен веществ в клетке (превращение веществ, метаболизм) складывается из двух процессов – катаболизма и анаболизма. Схема процессов изображена на рис. 23.
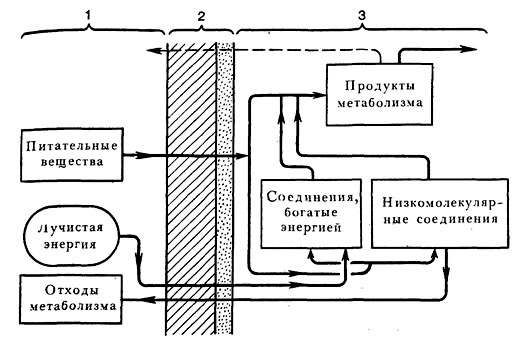
Рис. 23. Схема обмена веществ у микроорганизмов [165]:
1 – окружающая среда; 2 – клеточная оболочка и цитоплазматическая мембрана; 3 – цитоплазма.
Катаболизм (диссимиляция) – это ферментативное расщепление крупных молекул питательных веществ (углеводов, жиров, белков) для получения энергии.
Диссимиляция органического вещества дрожжами в процессе брожения или дыхания является основным источником получения соединений, из которых одни представляют собой ненужные продукты обмена и выделяются из клетки, а другие используются для биосинтетических реакций и таким образом включаются в анаболический процесс.
Извлекаемая энергия запасается в форме фосфатных связей аденозинтрифосфата (АТФ) или некоторых других богатых энергией соединений, которые используются на многочисленные реакции обмена веществ, обеспечивающие рост, развитие и размножение. Такой диссимиляционный процесс называют энергетическим обменом [65, 112, 165].
Анаболизм (ассимиляция) –это использование питательных веществ для биосинтеза сложных соединений, в частности, высокомолекулярных (полисахаридов, нуклеиновых кислот, белков, жиров), необходимых для роста и самовоспроизведения клетки из простых предшественников (аминокислот, пуриновых и пиримидиновых оснований, органических кислот, фосфатов сахаров). Синтез связан с потреблением свободной энергии, высвобождаемой при дефосфорилировании АТФ. Такой биосинтетический процесс часто называют конструктивным (строительным) обменом веществ.
Анаболический и катаболический процессы часто локализуются в разных структурных единицах клетки, однако протекают они одновременно, что обусловливается специфическими особенностями ферментов [165]. Скорость катаболизма в клетке регулируется не концентрацией тех или иных питательных веществ в окружающей среде, а потребностью клетки в энергии в каждый определенный момент. Используя энергию в форме АТФ, клетка для получения ее перерабатывает такое количество исходного материала, которое может удовлетворить потребность в энергии, 40 необходимой для выполнения жизненных функций.
Таким образом, в результате обмена веществ дрожжи из питательной среды берут все необходимые элементы для накопления энергии, синтеза структурных элементов клетки, многочисленных ферментов и в нее возвращают промежуточные отработанные продукты.
В настоящее время установлено, что в природе существует единый универсальный способ энергетического и конструктивного метаболизма у живых организмов – анаэробная диссимиляция углеводов [66, 165, 166].
Процессы брожения и дыхания, или анаэробный и аэробный распад углеводов, играют основную роль в метаболизме дрожжевой клетки.
Дрожжи относятся к факультативным анаэробам. Микроорганизмы, принадлежащие к группе факультативно-анаэробных, в условиях анаэробиоза получают энергию в результате внутренних окислительно-восстановительных процессов. Попадая в аэробные условия, они обычно также используют свое «топливо» анаэробным способом, после чего продукты анаэробного расщепления окисляются молекулярным кислородом. Следовательно, анаэробное превращение глюкозы у дрожжей есть обязательная первая стадия, за которой может следовать аэробная фаза – дыхание, интенсивность которого находится в прямой зависимости от условий культивирования [66]:
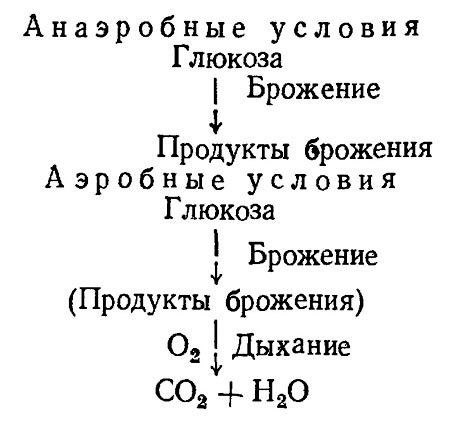
Главным источником энергии у дрожжей бродящего типа является анаэробный распад шестиуглеродных сахаров, в первую очередь D-глюкозы. При этом потребленная глюкоза практически полностью расщепляется до этанола и СО2 с одновременным накоплением высших спиртов и других продуктов обмена. Разные сахара сбраживаются с различной скоростью. Легко сбраживаются глюкоза и фруктоза, медленнее – манноза и еще медленнее– галактоза. Дисахариды (сахароза и мальтоза) хорошо сбраживаются дрожжами. Пентозы дрожжами не сбраживаются.
Различают три биохимические фазы энергетического обмена [77].
В первой фазе, сопровождающейся выделением ничтожного количества энергии, происходит в основном гидролиз сложных питательных веществ.
Во второй фазе характер процессов энергетического обмена веществ определяется доступностью кислорода для клеток. В анаэробных условиях происходит выделение энергии в результате брожения углеводов с образованием этанола, что характерно для дрожжей бродящего типа; в аэробных – в результате окислительного (апотомического) превращения гексозомонофосфата, обычно характерного для дышащих дрожжевых клеток.
Третья фаза – цикл трикарбоновых кислот – основная фаза не только энергетического, но и конструктивного обмена веществ дрожжей в аэробных условиях.
Реакции обмена веществ в клетке катализируются ферментами.
(Ферменты – самый крупный и наиболее высокоспециализированный класс белковых молекул.
В живой дрожжевой клетке, как и в других микроорганизмах, непрерывно протекает синтез ферментов, причем только тех, для которых имеются соответствующие гены. Количество различных ферментов в клетке фиксировано не строго и изменяется в соответствии с изменением химических и физических свойств среды. Синтезируются ферменты так же, как и неактивные белки – из свободных аминокислот. Активность одних ферментов зависит только от структуры белка, тогда как других ферментов – и от присутствия групп небелковой природы, так называемых кофакторов. Кофакторами могут быть или ионы металлов (магний, медь, кобальт, цинк, железо), или сложные органические соединения, называемые коферментами. или те и другие. Многие коферменты, например, содержат в качестве активных компонентов витамины. Так, в состав ферментов аминотрансфераз входит фосфопиридоксаль – производное витамина Be; в состав дегидрогеназ входит рибофлавин (витамин Вг) в соединении с фосфорной кислотой (флавинмононуклеотид); фосфорный эфир тиамина (витамина Вх), соединяясь с белком, образует пируватдекарбоксилазу, расщепляющую пировиноградную кислоту на уксусный альдегид и СО2, и т. д.
Ферменты подразделяются на б основных классов, каждый из которых в свою очередь делится на подклассы, а эти последние – на группы [88].
1. Оксидоредуктазы – это ферменты, катализирующие реакции биологического окисления и восстановления и, следовательно, связанные с процессами брожения и дыхания. К этому классу относятся дегидрогеназы: алкогольдегидрогеназа (алкоголь: НАД-оксидоредуктаза), лактатдегидрогеназа (L-лактат: НАД-оксидоредуктаза), глицеральдегидфосфатдегидрогеназа (D-глицеральдегид-3-фосфат: НАД-оксидоредуктаза), малатдегидрогеназа (L-малат: НАД-оксидоредуктаза), цитохромоксидаза (цитохром с: О2-оксидоредуктаза) и др. В качестве коферментов дегидрогеназы содержат НАД+ или НАДФ+, ФМН или ФАД.
Считают, что дегидрогеназы расположены в цитоплазме и в митохондриях [85].
Показано, что у дрожжей имеются три различные алкогольдегидрогеназы, зависимые от НАД. Из них АД I и АД II локализованы в цитоплазме, а АД III – в митохондриях.
2. Трансферазы – катализируют перенос целых атомных групп (остатков фосфорной кислоты, моносахаридов и аминокислот и т. д.) с одной молекулы на другую. В зависимости от того, какую химическую группировку переносит данный фермент, природа кофермента различна.
Особенно активна в дрожжах транскетолаза (седогептулозо-L-фосфат: D-глицеральдегид-З-фосфат-гликольальдегидтрансфераза). Коферментом транскетолазы является тиаминпирофосфат-гексокиназа (АТФ: D-гексоза-6-фосфотрансфераза), который катализирует реакцию фосфорилирования – перенос остатка фосфорной кислоты от АТФ на глюкозу, пентозу и др.
Аминотрансферазы осуществляют перенос аминогруппы с аминокислот на кетокислоты, например, тирозин-аминотрансфераза (L-тирозин: 2-оксоглутарат-аминотрансфераза).
3. Гидролазы – катализируют реакции расщепления более сложных соединений на более простые с присоединением воды. К этому классу относятся эстеразы, расщепляющие и синтезирующие сложные эфиры (липазы, таназы, пектинэстеразы, фосфатазы, сульфатазы). Гидролазы эфиров карбоновых кислот найдены в столовых винах, шампанском, хересе.
Инвертаза (Р-О-фруктофуранозид-фруктогидролаза, 3-фруктофуранозидаза) катализирует гидролиз сахарозы. Незначительная активность инвертазы в сусле некоторых сортов винограда значительно повышается после сбраживания его вследствие перехода этого фермента из дрожжей [7].
Протеолитические ферменты (протеазы) также относятся к классу гидролаз. Они катализируют гидролиз пептидов и белков и в связи с этим имеют большое значение в практике применения ферментных препаратов.
4. Лиазы катализируют реакции негидролитического отщепления каких-либо групп от субстрата. К ферментам этого класса относятся: пируватдекар-боксилаза, декарбоксилазы аминокислот, альдолаза.
Пируватдекарбоксилаза (карбоксилиаза 2-оксокислот) в качестве кофермента содержит тиаминпирофосфат, играет важную роль у дрожжей – катализирует образование спирта
Декарбоксилазы аминокислот содержат в качестве кофярмента пири-Доксальфосфат.
Альдолаза (кетозо-l-фосфат-альдегидлиаза) играет важную роль в углеводном обмене. В процессе брожения молекула фруктозы с присоединенными остатками фосфорной кислоты под действием альдолазы разрывается с образованием двух молекул фосфотриоз, которые впоследствии образуют спирт.
Активность дрожжевой альдолазы специфически усиливают ионы калия, поэтому введение хлористого калия ускоряет процесс спиртового брожения.
5. Изомеразы – это ферменты, катализирующие превращения органических соединений в их изомеры (аминокислот, оксикислот и углеводов или их производных). Например, УДФ глюкозо-эпимераза превращает галактозу в глюкозу. С наличием или отсутствием у дрожжей данного фермента связана способность или неспособность сбраживать галактозу (Sacch. oviformis галактозу не сбраживают).
6. Лигазы (синтетазы) катализируют процесс соединения двух молекул, протекающий одновременно с расщеплением АТФ. К этому классу принадлежат карбоксилазы, содержащие биотин, которые катализируют при участии АТФ реакции карбоксилирования различных органических кислот. Пируват-карбоксилаза [пируват: СО2– лигаза (АДФ)] катализирует синтез щавелевоуксусной кислоты из пировиноградной кислоты и СО2. К классу лигаз относится ацетил-КоА синтетаза [ацетат: КоА-лигаза (АМФ)], которая катализирует важную реакцию синтеза самых разнообразных соединений, в том числе и стероидов. К лигазам относятся аспарагинсинтетаза и глютаминсинтетаза, катализирующие при участии АТФ синтез аспарагина и глютамина из соответствующих дикарбоновых аминокислот.
Различные ферменты и ферментные системы локализуются обычно в органеллах или просто растворены в цитоплазме. Все детали клетки, на которых размещены ферменты, построены из мембран, содержащих белковые и липидные компоненты. Ферменты гликолиза локализуются в растворимой фракции цитоплазмы. Инвертаза и пермеазы, обеспечивающие транспорт питательных веществ в клетку, так же как и гексокиназа – важнейший фермент фосфорилирования,– находятся в оболочке дрожжевой клетки. Ферменты, участвующие в окислении пировиноградной кислоты, жирных кислот и некоторых аминокислот, находятся в митохондриях. В рибосомах находятся ферменты, обеспечивающие синтез белков.)
Спиртовое брожение
Анаэробный распад углеводов, происходящий в результате жизнедеятельности дрожжей (процесс спиртового брожения), завершается образованием в основном этилового спирта и СО2.
Механизм спиртового брожения определен многолетними исследованиями. Л. Пастер впервые простыми и убедительными опытами доказал, что сбраживание сахаров происходит только в присутствии клеток дрожжей. В 1897 г. Э. Бухнер и Т. Бухнер обнаружили, что дрожжевой сок, полученный растиранием дрожжей с песком, способен сбраживать глюкозу до спирта. Этим был доказан ферментативный характер спиртового брожения, в выяснении сущности реакций которого большую роль сыграли исследования советского биохимика А. Н. Лебедева. Однако М. М. Монассеина задолго до опытов Бухнеров указывала на ферментативный характер спиртового брожения и в 1871 г. опубликовала работу «К учению об алкогольном брожении».
Предложенная Нейбергом схема спиртового брожения (первая форма брожения Нейберга) представляла собой попытку объяснить процесс при помощи ряда гипотетических промежуточных ступеней.
Следующим этапом в расшифровке процесса спиртового брожения было открытие, сделанное в 1905 г. Л. А. Ивановым, а также А. Гарденом и У. Ионгом. Они обнаружили, что для спиртового брожения, индуцируемого дрожжевым экстрактом, необходим фосфат и что гексозодифосфат (фруктозо-1,6-дифосфат) и другие идентифицированные вещества играют роль промежуточных продуктов в суммарном процессе брожения.
Г. Эмбден, О. Мейергоф и Я. О. Парнас детально раскрыли последовательность реакций и энергетику гликолиза. Поэтому гликолиз часто называют путем Эмбдена – Мейергофа – Парнаса.
Спиртовое брожение – это один из путей анаэробного превращения углеводов. Он состоит из ряда последовательно протекающих реакций.
Установлено, что процесс анаэробного расщепления сахаров дрожжами осуществляется с тем же запасом энергии в форме АТФ и тем же ферментативным путем, что и гликолиз, вплоть до образования пировиноградной кислоты. Поэтому в настоящее время термин «гликолиз», характеризующий основной путь превращения глюкозы в пировиноградную кислоту без участия свободного кислорода, применяют к начальной стадии спиртового и других видов брожения и к анаэробной, подготовительной стадии дыхания в растениях [166].
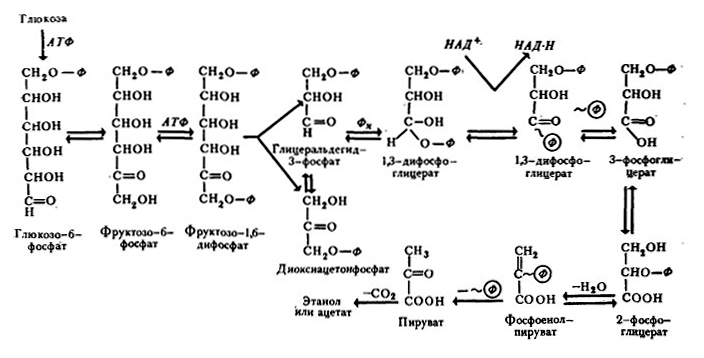
Схема сбраживания глюкозы (молекула глюкозы для простоты изображена па схеме в виде цепи) [66].
1. Фосфорилирование D-глюкозы за счет АТФ с образованием глюкозо-6-фосфата. Эта первая реакция гликолиза катализируется ферментом гекрокиназой. В клетке количество свободной D-глюкозы сравнительно невелико; большая часть ее находится в фосфорилированной форме
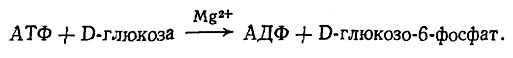
2. Превращение D-глюкозо-6-фосфата во фруктозо-6-фосфат в результате реакции изомеризации, катализируемой ферментом фосфогексоизомеразой
![]()
3. Фосфорилирование D-фруктозо-6-фосфата путем присоединения еще одного остатка фосфорной кислоты с образованием фруктозо-1,6-дифосфата. В этой второй «пусковой» реакции используется еще одна молекула АТФ при участии фермента фосфофруктокиназы. Считается доказанным, что суммарная скорость гликолиза лимитируется именно этой реакцией, катализируемой фосфофруктокиназой
![]()
4. Расщепление фруктозо-1,6-дифосфата на две фосфотриозы: глицеральдегид-3-фосфат и диоксиацетонфосфат. Эта реакция катализируется ферментом альдолазой
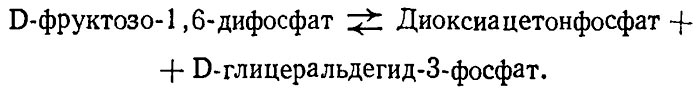
5. В последующие реакции гликолиза может непосредственно включаться только одна из двух образующихся фосфотриоз, а именно глицеральдегид-3-фосфат. Однако и диоксиацетонфосфат благодаря присутствию в клетке специфического фермента триозофосфатизомеразы полностью преобразуется в глицеральдегид-3-фосфат. В результате этой реакции обеспечивается полное использование глюкозы в энергетическом обмене клетки
![]()
6. Окисление глицеральдегид-3-фосфата до 1,3-дифосфоглицерата. Эта реакция катализируется специфической дегидрогеназой триозофосфата (глицеральдегид-3-фосфат-дегидрогеназой). Она называется реакцией гликолитического окисления – восстановления.
Окисление глицеральдегид-3-фосфата, катализируемого дегидрогеназой, является единственным окислительным этапом на всем протяжении гликолитического пути. Однако кислород в этой реакции не участвует. Требуется лишь присутствие окислителя НАД+, который при этом восстанавливается до НАД-Н (символом НАД обозначается окислительно-восстановительный кофермент – никотинамид-адениндинуклеотид: НАД+ – окисленная форма и НАД-Н – восстановленная)
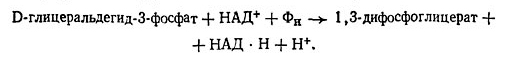
7. Перенос фосфатной группы от 1,3-дифосфоглицерата на АДФ. Благодаря действию двух ферментов (глицеральдегид-3-фосфат-дегидрогеназы и фосфоглицераткиназы) энергия, высвобождающаяся при окислении альдегидной группы до карбоксильной, запасается в форме энергии фосфатных связей АТФ
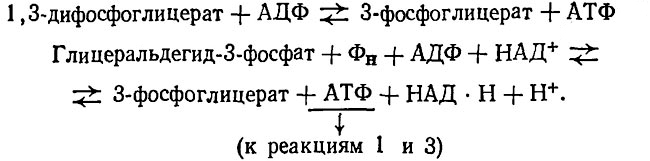
8. Превращение 3-фосфоглицерата в 2-фосфоглицерат катализируется ферментом фосфоглицеромутазой
![]()
9. Дегидратация 2-фосфоглицерата с образованием фосфо-енолпирувата катализируется енолазой
![]()
10. Перенос фосфатной группы от фосфоенолпирувата на АДФ с образованием пирувата и АТФ катализируется пируваткнназой (АТФ: пируват-фосфотрансферазой)
![]()
Образование пировиноградной кислоты рассматривается как поворотный этап анаэробного расщепления сахара, являющийся общим для дыхания, гликолиза и брожения всех видов.
Основное значение гликолиза состоит в перестройке структуры молекулы глюкозы в высокоактивный и лабильный в химическом отношении пируват, что облегчает биохимические превращения исходного субстрата на последующих этапах окислительно-восстановительных процессов.
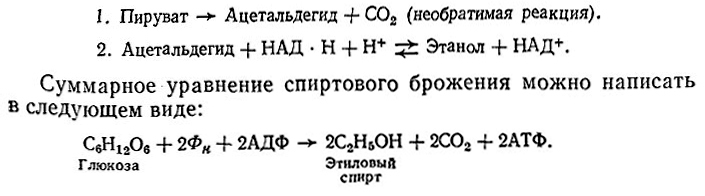
11. Если О2 отсутствует, то дальнейшие превращения пировиноградной кислоты происходят анаэробным путем, в процессе брожения (молочнокислого, спиртового и др.).
При спиртовом брожении последний этап гликолиза, катализируемого лактатдегидрогеназой, заменен двумя другими ферментативными реакциями при участии соответственно пируват-декарбоксилазы и алкогольдегидрогеназы. В результате этих реакций образуется этанол – конечный продукт спиртового брожения
При введении специфических ингибиторов формы спиртового брожения изменяются:
а) вторая форма брожения Нейберга. Для получения глицерина в сбраживаемую среду вводят бисульфит натрия, который связывает ацетальдегид и предотвращает этим реакцию восстановления его до спирта. Водород восстановленного НАД-Нз в этом случае используется на восстановление фосфоглицеринового альдегида до глицерина (реакции 4 и 5). Таким образом, при брожении сульфитированного виноградного сусла происходит накопление в виноматериалах глицерина и уксусного альдегида в виде бисульфитного производного;
б) третья форма брожения Нейберга. При щелочной реакции среды ход брожения изменяется: половина молекул ацетальдегида окисляется до уксусной кислоты, другая – восстанавливается до этилового спирта. В этом процессе происходит подкисление субстрата.
Иногда в клетках дрожжей возникает необходимость в использовании запасного полисахарида – гликогена. В результате реакции, катализируемой ферментом фосфоглюкомутазой, гликоген вовлекается в гликолиз в виде глюкозо-6-фосфата. Продукты брожения, которые в анаэробных условиях уже не могут быть использованы клеткой и поэтому выводятся из нее, все еще содержат значительную часть нереализованной химической энергии. Поэтому клеткам, находящимся в анаэробных условиях, для получения энергии приходится расходовать гораздо больше глюкозы, чем тем же самым клеткам в условиях аэробиоза [66].
Дыхание
В присутствии кислорода воздуха дрожжи получают энергию за счет дыхания. Процессы гликолиза, протекающие при этом, поставляют относительно малое количество восстановленных соединений, которые могут быть переданы затем в дыхательную цепь. Обеспечение дыхательной цепи должно идти из каких-то других источников. Доказано, что цикл трикарбоновых кислот (цикл Кребса) является тем основным общим руслом, по которому осуществляется окончательное окисление не только продуктов обмена углеводов, но также белков, предварительно преобразованных молекул жиров.
Исходным продуктом превращений, состоящих из ряда последовательных ферментативных реакций, замкнутых в цикл, является пировиноградная кислота. Первое звено в цепи реакций– окислительное декарбоксилирование пировиноградной кислоты с образованием исходного метаболита цикла – ацетил-КоА. При каждом обороте цикла молекула уксусной кислоты в форме ацетил-КоА вступает во взаимодействие с щавелевоуксусной кислотой, образуя лимонную кислоту. Затем лимонная кислота превращается в изолимонную и затем – в а-кетоглутаровую кислоту, из которой в результате окислительного декарбоксйлирования образуется янтарная кислота. Последняя, как наиболее быстро превращающееся соединение цикла Кребса, окисляется далее до щавелевоуксусной кислоты, которая может снова включаться в цикл.
На уровне а-кетоглутаровой кислоты от цикла Кребса имеется ответвление, ведущее к системе глутамин-глутамат. Эта система является узлом, от которого отходят метаболические пути, ведущие к образованию аминокислот аргинина и пролина.
Суммарная реакция цикла трикарбоновых кислот описывается уравнением
![]()
Из этого уравнения видно, что в цикл не вовлекается ни молекулярный кислород, ни неорганический фосфат, ни АТФ. Окисление происходит за счет кислорода воды и отщепления атомов водорода. Затем водород переносится на дыхательную цепь.
Дыхательная цепь дрожжей в принципе сходна с таковой высших организмов. Она включает ряд дегидрогеназ, связанных с НАД-Н (пируват-, изоцитрат-, α-кетоглутарат, лактат- и малатдегидрогеназы), флавопротеиды, кофермент Q (убихинон) и штохромы в, с1 с, α, α3. Особенностью ее является наличие миохондриальной НАД-зависимой алкогольдегидрогеназы, катализирующей окисление этанола помимо алкогольдегидрогеназы I и II, локализованной в цитоплазме [85, 88].
Механизм аэробного извлечения энергии из питательных веществ основан на реакции окислительного фосфор ил ирования АДФ.
Таким образом осуществляется акт дыхания, состоящий из ряда последовательных окислительно-восстановительных реакций между водородом, который отщепляется от карбоновых кислот в цикле Кребса, и молекулярным кислородом [77].
Следует отметить, что все ферменты, катализирующие индивидуальные реакции цикла, локализованы в дрожжевых митохондриях. Для непрерывной работы цикла обязательно требуются акцепторы водорода, и поскольку наиболее эффективным акцептором является кислород, то максимальная скорость цикла наблюдается только в условиях достаточного снабжения кислородом.
В условиях анаэробиоза происходит полная редукция основной энергетической функции митохондрий. Отсутствие дыхания компенсируется усилением гликолиза, который становится главным механизмом энергообеспечения клетки. Функционирует лишь модифицированный цикл Кребса, который приводит к накоплению в клетке пировиноградной и уксусной кислот, что в свою очередь способствует накоплению в среде этилового спирта [66, 85].
Для аэробных дрожжевых организмов основным механизмом конечного окисления метаболитов является цикл трикарбоновых кислот. Следовательно, условия культивирования, тип обмена дрожжей (аэробный, анаэробный) могут изменять относи тельную значимость цикла Кребса в обмене веществ.
Дрожжи рода Saccharomyces будучи полностью лишены источников питания часто сохраняют жизнеспособность и даже обнаруживают признаки активного эндогенного метаболизме. В этом случае они используют для получения энергии эндоген ный субстрат – осуществляют брожение и дыхание в первуь очередь за счет гликогена, а затем – трегалозы.
Таким образом, метаболизм углеводов является одним и центральных путей обмена, выполняя функцию не только основного поставщика энергии, но и главного источника углерод содержащих фрагментов, которые необходимы для синтеза всех других компонентов клетки [66, 166].
Важную роль в биосинтетических процессах играют коферменты, обладающие макроэргическими связями: АТФ, УТФ, KоА и др. Процесс синтеза белка в рибосоме схематически протекает так [88]: активированные аминокислоты, соединенные мРНК, переходят в рибосомы клетки, где и происходит их связывание в белки.
Биосинтетический путь образования полисахаридов (основных компонентов клеточной оболочки), сахаров и запасных полимеров (гликогена) из неуглеводных предшественников начинается от пировиноградной кислоты. Это обратный процесс гликолиза [165].
Строительным материалом для высших жирных кислот, стероидов и других соединений протоплазмы служит уксусная кислота в форме ацетил-КоА [65].
Витамины группы В в обмене веществ выполняют роль ко ферментов или компонентов коферментов. Синтезируются они в очень небольших количествах. Исходным сырьем для биосинтеза большинства витаминов служат низкомолекулярные соединения, используемые также и в синтезе других клеточных компонентов.
Итак, в результате основного обмена питательные вещества поглощенные клеткой, ассимилируются и перерабатываются в компоненты цитоплазмы, обеспечивая этим прирост биомассы и ресинтез веществ клетки, и разлагаются, окисляются, освобождая нужную для жизни энергию. Продукты энергетического обмена выделяются из клетки вместе с продуктами диссимиляции компонентов клетки. Часть усвоенных веществ откладывается в виде запасных (жиров, гликогена, волютина), которые могут быть использованы наравне с поступающими питательными веществами [65] (см. рис. 23). В итоге сложных биохимических превращений происходит прирост биомассы и образуются продукты обмена. По этим конечным показателям судят об интенсивности энергетического и конструктивного обмена веществ.
Физиолого-биохимические изменения дрожжей
в аэробных и анаэробных условиях
В процессе спиртового брожения в отсутствие молекул кислорода воздуха высвобождается лишь незначительная часть энергии (117 кДж), потенциально заложенной в одном моле глюкозы (2817 кДж), тогда как при дыхании – полном окислении глюкозы до СО2 и Н2О – значительно больше– 1504 кДж. Такое огромное различие в количестве высвобождаемой энергии определяет высокую чувствительность клеток дрожжей ко всяким изменениям окислительного метаболизма, вызывая в них различные функциональные изменения.
Принято считать, что в производственных условиях при ведении процесса брожения дрожжи получают необходимую для них энергию не только за счет анаэробного превращения углеводов, но и за счет дыхания [77]. Именно в начальной фазе анаэробного роста клеток энергия поступает и от аэробного окисления сахара (сбраживаемое виноградное сусло содержит до 7 мг/л растворенного кислорода) с возможным использованием метаболитов цикла Кребса.
Доступ кислорода, обеспечивающий более эффективное в энергетическом отношении аэробное дыхание, предохраняет клетки от излишних трат веществ, происходящих в процессе анаэробного дыхания. Подобное действие кислорода, выражающееся в угнетении брожения дыханием и в значительном снижении потребления элементов субстрата – глюкозы, названо эффектом Пастера. Эффект Пастера наиболее существенен при аэробном сбраживании малосахаристых сред. И наоборот, аэрация высокосахаристых сред вызывает противоположный сдвиг энергетического обмена у дрожжей – тормозит дыхание и активизирует брожение [85]. Этот эффект получил название эффекта Крэбтри. В настоящее время считают, что подавление дыхания в присутствии высоких концентраций глюкозы имеет генетическую природу и обусловлено подавлением синтеза цитохромов.
Аэробные условия
А. А. Мартаковым [41, 105] при аэробном сбраживании высокосахаристых сред виноградного сусла установлен альдегидный эффект. По механизму действия он отличается от эффекта Пастера и эффекта Крэбтри тем, что вызывает одновременное торможение брожения и дыхания в результате неполного окисления этанола до ацетальдегида. В этом случае сахар сначала разлагается дрожжами в спирт, а последний окисляется далее в ацетальдегид, который и накапливается в бродящем сусле в качестве вторичного продукта аэробного брожения. Следовательно, протекает одновременно процесс разложения сахара в спирт и окисление спирта в ацетальдегид. Возможность альдегидного эффекта обусловлена наличием у дрожжей пространственно разобщенных ферментов гликолиза (в цитоплазме) и окислительного комплекса (в митохондриях). Эта особенность винных дрожжей использована для ускорения процесса созревания вин на этапе брожения сусла путем его аэрации для технологии хереса глубинным способом; интенсификации процесса созревания крепких вин типа портвейна [105, 106]. Кроме того, аэробно-анаэробный способ сбраживания сусла обеспечивает не только ускорение процесса созревания вина, но и желаемую степень снижения его кислотности при переработке высококислотного винограда.
Непрерывным брожением сусла при повышенном содержании спирта (8–10% об.) достигается снижение степени окисленности столовых вин [106].
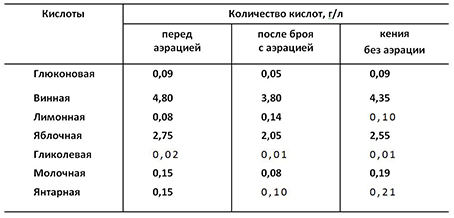
Способность дрожжей к интенсивному окислению и использованию в аэробных условиях брожения винной, молочной, яблочной, уксусной и других органических кислот послужила основой для создания способа снижения кислотности крепких вин. Изменение содержания кислот при брожении высококислотного сусла показано в табл. 2. Аэробное брожение рекомендуется для снижения содержания летучих кислот в вине [106].
Таблица 2
Известно, что снижение кислотности сусла при получении вина общепринятым способом происходит главным образом за счет винной и яблочной кислот; при этом степень накопления молочной, янтарной и лимонной кислот меньшая, чем степень усвоения винной и яблочной [106, 156]. При аэробном же брожении содержание всех указанных кислот уменьшается.
Таким образом, в аэробных условиях дрожжи склонны к преимущественному окислению этилового спирта в присутствии сахара и без сахара.
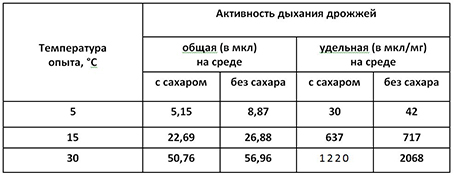
В ходе аэробного роста дрожжей в зависимости от исходной концентрации глюкозы и количества инокулята наблюдается подавление их дыхательной активности [85]. Исчезновение глюкозы приводит к быстрому восстановлению дыхательной активности, клетки начинают снова расти, используя в качестве источника углерода и энергии этанол и продукты метаболизма глюкозы. Такая трактовка подтверждена экспериментально в работах Н. Г. Саришвили и нашла применение в виноделии [181]. Проведенные исследования достаточно убедительно показали, что потребление кислорода дрожжами на среде без сахара значительно повышается, при этом наиболее интенсивно при температуре 30°С. Влияние содержания сахара в субстрате (г/100 мл) на активность дыхания дрожжей характеризуется данными, приведенными в табл. 3.
Таблица 3
С увеличением в субстрате концентрации клеток дрожжей с 5–6 до 500–600 млн./мл возрастает скорость потребления кислорода (рис. 24) [122]. На основе этих неоспоримых фактов для совершенствования подготовки бродильной смеси к шампанизации предложен способ биологического обескислороживания купажа виноматериалов в потоке с последующей выдержкой вин для обогащения их биологически активными веществами [180]. Шампанские виноматериалы, прошедшие технологическую обработку и обычно содержащие кислорода в количестве 4,5–5,0 мг/л, непрерывно подают в вертикально расположенный аппарат с наполнителями (в нижнюю часть) и одновременно вводят дрожжевую разводку в количестве 2–3 млн/мл. В купаже, прошедшем биологическое обескислороживание, кислород не содержится.
Анаэробные условия
При развитии клеток дрожжей в условиях анаэробиоза происходит резкая перестройка энергетического обмена. Дрожжи обладают окислительным механизмом синтеза стеринов, порфиринов и ненасыщенных жирных кислот, являющихся существенными компонентами мембран [85]. Поэтому в условиях глубокого анаэробиоза при отсутствии этих компонентов наступает дегенерация клеток. При введении стеринов и ненасыщенных жирных кислот в среду с сахарами факультативные анаэробы (способные к брожению) могут расти практически неограниченно долго и по характеру обмена напоминают типичные анаэробные организмы. Они характеризуются резко сниженным содержанием фосфолипидов, эргостерина и ненасыщенных жирных кислот, полным отсутствием цитохромов дыхательной цепи, уменьшенным содержанием ферментов Цикла Кребса и первичных дегидрогеназ [85]. В соответствии с этими изменениями наблюдается почти полная редукция дыхательной активности.
Таким образом, в условиях анаэробиоза митохондрии превращаются в недифференцированные структуры, называемые промитохондриями, происходит полная редукция основной энергетической функции их. Отсутствие дыхания компенсируется усилением гликолиза, который становится основным источником энергии клетки. Бродильная функция клеток дрожжей при этом достигает максимума. В связи с этим интересно привести данные по брожению виноградного сусла под давлением СО2 и отметить некоторые особенности энергетического обмена дрожжей в анаэробных условиях.
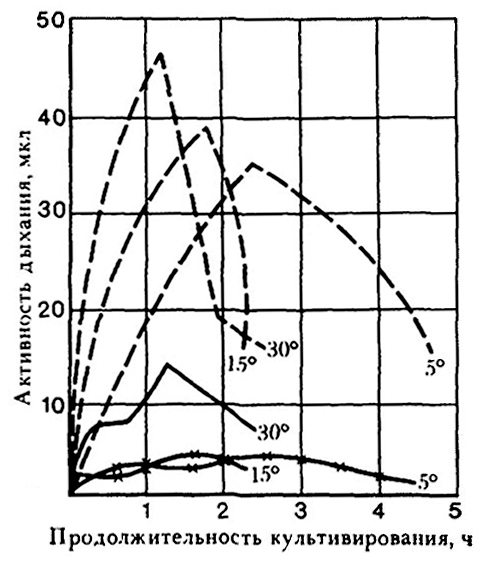
Рис. 24. Скорость потребления кислорода дрожжами при различной температуре в °С [181].
(Сплошные линии— 5—6 млн./мл, прерывистые — 500—600 млн./мл клеток).
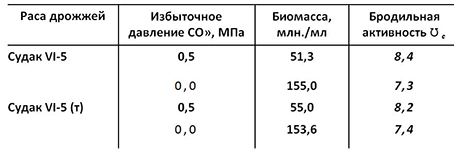
Н. И. Бурьян и сотр. [41] установлено, что винные дрожжи, выросшие в условиях избыточного давления СО2, используют при брожении сахар значительно интенсивнее, чем те же дрожжи, развившиеся в аэробных условиях. Расчет количества Рис. 24. Скорость потребления кисло-сброженного сахара на 1 г воздушно-сухих дрожжей показывает, что
бродильная способность определенной массы (1 г) клеток, развивающихся в условиях избыточного давления СО2 до 0,5 МПа, выше на 25% по сравнению с бродильной способностью клеток, развивавшихся при брожении со свободным доступом воздуха. Влияние избыточного давления СО2 на скорость размножения дрожжей и процессы брожения характеризуется данными, приведенными в табл. 4.
Таблица 4
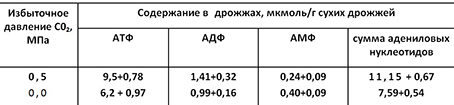
Размножение дрожжей тесно связано с запасом в клетках АТФ, АДФ и АМФ, характеризующих их энергетическое состояние [29]. Избыточное давление СО2 приводит у дрожжей расы Судак VI-5 (т) к увеличению суммы адениловых нуклеотидов в основном за счет прироста АТФ (табл. 5).
Таблица 5
Пр имечание. Ʊ с– скорость утилизации сахаров к концу брожения (в мкг на 1 млн. клеток дрожжей за 1 ч).
Основным поставщиком энергии у факультативных анаэробов в условиях недостатка кислорода, как известно, становится брожение. В связи с этим найденный высокий уровень АТФ в дрожжах, бродивших под давлением СО2, коррелирует с отмеченным ранее для этих условий усилением утилизации из среды энергетического субстрата глюкозы и повышенной активностью гексокиназы, так называемого пускового фермента брожения. Активность гексокиназы в дрожжах (количество восстановленного НАДФ-Н2 в миллимикромолях/1 мин-1 мг белка) при избыточном давлении СО2 (МПа) по сравнению с обычными условиями брожения (при атмосферном давлении) характеризуется следующими данными:
Давление СО2 0,5 0,0
Активность гексокиназы 472±14,5 371 ±12,5
Однако, несмотря на высокоэнергетическое состояние, скорость размножения дрожжей в этих условиях была низкой, что свидетельствует о специфическом действии высоких концентраций углекислого газа на функцию почкования дрожжей.
Проведенные исследования по выявлению влияния избыточного давления СО2 на физиолого-биохимические свойства дрожжей позволяют сделать вывод о том, что у дрожжей в этих условиях наблюдается нарушение корреляции между скоростью размножения и скоростью утилизации сахаров из среды. Такое несоответствие, как известно, ведет к обогащению среды культивирования вторичными продуктами, а также к повышенному содержанию в ней восстановленных веществ [29].
Функциональная перестройка клеток наступает и при выращивании дрожжей на неполноценной питательной среде или в среде с несбалансированным содержанием витаминов, микроэлементов и других питательных веществ. Так, избыточное обеспечение дрожжей витамином Bi приводит к перестройке их Даже в аэробных условиях культивирования на бродильный тип; недостаток пантотеновой кислоты в среде резко снижает дыхательную активность, при этом такое изменение передается по наследству [85]. Добавление в среду эргостерина и ненасыщенных жирных кислот (в форме твин-80) способствует росту дрожжей, что позволяет считать эти вещества необходимыми факторами роста в анаэробных условиях [232, 239, 242].
Таблица 6
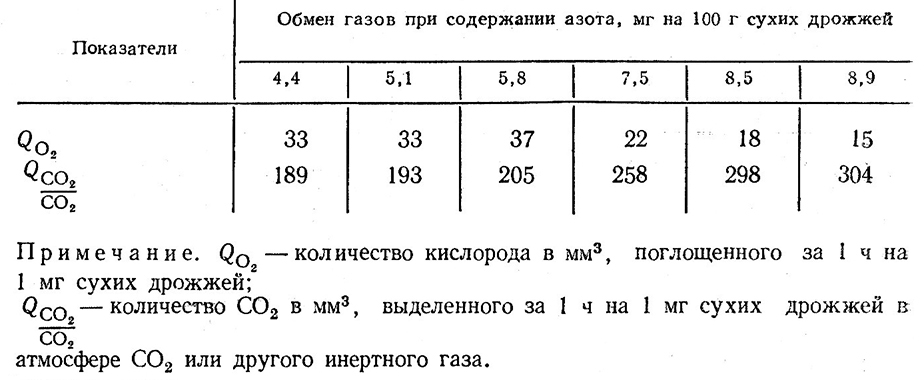
Запас азотистых веществ в клетках дрожжей связан с энергетическим обменом: чем богаче дрожжи азотом, тем ниже интенсивность дыхания и, наоборот, выше интенсивность брожения [109, 154]. Зависимость между содержанием азота и обменом газов показана в табл. 6 [154].
Бродильные свойства производственных рас дрожжей
Как уже отмечалось, дрожжи для полного обеспечения энергией всех жизненно важных функций свои энергетические потребности восполняют за счет спиртового брожения и аэробного дыхания.
Дрожжи различаются по интенсивности брожения и дыхания. Одни значительно богаче дыхательными ферментами, другие имеют бродильный метаболизм [154]. Для характеристики истинных бродильных свойств различных рас производственных дрожжей Е. Н. Одинцова рекомендует использовать коэффициент Qco2 / Qo3 (отношение интенсивности брожения к интенсивности дыхания) [128]. Определение этого коэффициента у многих рас винных дрожжей позволило отобрать лучшие для брожения виноградного сусла под давлением СО2 и поточного процесса брожения [17, 228].
При сравнительном исследовании бродильных свойств рас винных (Sacch. vini), спиртовых (Sacch. cerevisiae) и пивоваренных (Sacch. carlsbergensis) дрожжей установлено, что винные дрожжи наряду с большей спиртоустойчивостью и способностью сбраживать более высокие концентрации сахаров, чем дрожжи спиртового и пивоваренного производств, нуждаются в относительно большем доступе воздуха, обладают меньшей степенью анаэробиоза (табл. 7) [128].
Таблица 7

Дрожжи вида Sacch. vini чаще имеют повышенную интенсивность брожения и более высокую степень анаэробиоза, чем дрожжи других видов, используемые в виноделии, тогда как среди культур вида Sacch. oviformis чаще обнаруживаются расы с большей спиртообразующей способностью (табл. 8) [154].
Таблица 8
Примечание. Обозначения по табл. 6 и 7.
Питание
Питательные вещества либо входят в состав клетки, либо снабжают ее необходимой для жизни энергией.
Перенос питательных веществ через цитоплазматическую мембрану, которая обладает способностью регулировать проникновение различных веществ в клетку и выход из нее, осуществляется в результате переноса двух типов: диффузии и стерео-химического специфичного переноса. Каждый тип переноса имеет активную и пассивную формы (рис. 25).
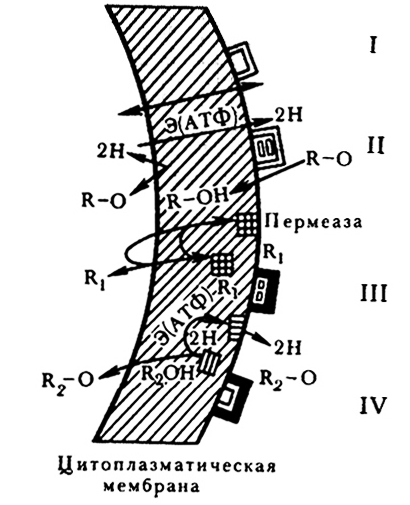
Рис. 25. Схема механизмов переноса веществ
через цитоплазматическую мембрану:
I – пассивная диффузия; II –активная диффузия; III – пассивный стерео-химический специфичный перенос;
IV – активный стереохимический специфичный перенос [112].
Процесс пассивной диффузии происходит без затрат энергии клеткой, и вещества проникают через цитоплазматическую мембрану при растворении в ней, а процесс активной диффузии с затратой энергии (обычно АТФ) в процессе дыхания. Так, для проникновения вещества R–О в клетку потребуется затрата энергии на восстановление его водородом до R – ОН, растворимого в цитоплааматической мембране, с последующим окислением до R–О в клетке и освобождением водорода для восстановления новой молекулы R–О.
Перенос же в клетку большинства веществ, нерастворимых в цитоплазматической мембране, осуществляется находящимися на мембранах особыми белками-переносчиками – пермеазами. Таким образом, проницаемость цитоплазматической мембраны связана с наличием веществ, роль которых заключается в транспорте ряда веществ в клетку микроорганизма. При пассивном стереохимическом специфичном переносе питательных веществ комплекс вещество – пермеаза растворяется в цитоплазматической мембране, диффундирует в клетку и пермеаза возвращается за новым веществом.
Активный стереохимйческий специфичный перенос питательных веществ требует затраты энергии клеткой микроорганизма на превращение вещества в форму, способную соединиться с белком-носителем и пройти через мембрану. Например, вещество R2–О должно быть превращено в R2–ОН, которое и объединяется со специфической пермеазой [112].
Следует отметить, что эффект переноса растворенных веществ обеспечивает определенная стереохимическая структура пермеазы и транспортируемого вещества. Так, перенос определенного углевода протекает только при участии одной пермеазы. Установлена зависимость поступления в клетки дрожжей сахаров от их циклического строения. Потеря циклического строения у сорбита, маннита и других шестиатомных спиртов приводит к четкому изменению проницаемости. Обнаружена видовая специфичность проникновения сахаров. Клетки Sacch. cerevisiae используют трегалозу, тогда как Sacch. fragilis – нет. Проницаемость клеток в смесях сахаров обусловлена конкуренцией, например, между глюкозой и галактозой, галактозой и мальтозой. Таким образом, физиологическую разнокачественность микроорганизмов определяет не только комплекс ферментов, но и обладание специфической проницаемостью или транспортным механизмом.
На процессы переноса растворенных веществ у микроорганизмов влияют факторы окружающей среды Активность пермеаз обычно ингибируется ионами тяжелых металлов, величиной pH, температурой и др. Изменяется проницаемость мембран дрожжей и от условий культивирования. Так, на среде с большим недостатком биотина проницаемость мембран увеличивается [77].
Как и во всех живых организмах, основную часть дрожжевой клетки составляет вода – в пределах 75% от общей массы. Состав сухой массы дрожжей следующий [154], %:
Неорганические вещества 5–10
Углеводы 25–50
Азот 4,8–12
Белки (N X 6,25) 30–75
Липиды 2–5
Неорганические вещества дрожжевой клетки в основном состоят из фосфорной кислоты (около 50%) и калия (около 25%). Остальные элементы (сера, кальций, железо, хлор, марганец, цинк, молибден, бор и др.) содержатся в ней в незначительных количествах. Углеводы дрожжей составляют полисахариды, гликоген.
Содержание свободных аминокислот в дрожжах к концу брожения составляет (в мг/г лиофильно-высушенных дрожжей) [135]:
лизин – 7,5;
аргинин–1,3;
гистидин–11,0;
аспарагиновая кислота – 2,9;
серии – 2,7;
глицин– 1,5;
глутаминовая кислота – 3,9;
аланин – 8,7;
пролин – 2,0;
тирозин – 2,8;
метионин – 2,9;
лейцин (изолейцин) – 5,4;
цистеин – следы.
Нуклеиновые кислоты дрожжей – пуриновые и пиримидиновые основания – составляют соответственно 8 и 4% от общего количества азота [154].
Витамины, содержание в 1 г сухих дрожжей, мкг:
Инозит 6000– 15000
Биотин 0,6–2,7
Пантотеновая кислота 2,0–19,0
Тиамин 24–50
Пирйдоксин 14–39
Никотинамид 370–750
Рибофлавин 30–60
Химический состав дрожжей может изменяться в зависимости от состава питательной среды, возраста культуры и условий культивирования. Отношение дрожжей к веществам, входящим в состав среды, зависит главным образом от ферментов, вырабатываемых данным видом или расой дрожжей.
Среды для культивирования дрожжей должны содержать все необходимые им химические элементы и в достаточно легко усвояемой форме,
Углеродное питание
Источниками углерода для дрожжей могут быть самые разнообразные органические соединения углеводы (сахара и их производные), спирты, органические кислоты, аминокислоты, белки, углеводороды и многие другие. Однако в отношении сахаров существует видовая специфичность. На этом построена диагностика видов дрожжей. Так, при общности химизма углеводного обмена большая часть видов рода Saccharomyces различается между собой прежде всего по отношению к сахарам. Что касается других источников углерода – спиртов и органических кислот,– то отношение к ним одинаково у всех видов данного рода [90].
Однако большинство видов винных дрожжей сбраживают глюкозу, фруктозу, мальтозу, сахарозу и галактозу; рафинозу используют частично, а лактозу, мелибиозу, пентозы, декстрины и крахмал совсем не сбраживают. В виноградном сусле примерно в равных количествах содержатся глюкоза и фруктоза. Фруктоза значительно слаще глюкозы, поэтому для приготовления вин с остаточным сахаром лучше использовать дрожжи, обладающие способностью в первую очередь сбраживать глюкозу.
По интенсивности утилизации глюкозы или фруктозы (к моменту, когда сброжено около 50% фруктозы) дрожжи разделяют на 3 группы [154]:
1) глюкозофильные – сбраживают к этому моменту от 80 до 85% глюкозы (большая часть видов рода Saccharomyces, а также виды родов Saccharomycodes и Brettanomyces);
2) фруктозофильные – в этот период используют только от 5 до 10% глюкозы (Sacch. bailli, Sacch. rouxii, T. stellata);
3) дрожжи, использующие оба сахара почти с одинаковой скоростью: к моменту, когда они утилизируют половину фруктозы, исчезает 40–60% глюкозы (Sacch. rosei, Pichia membranaefaciens).
Органические кислоты занимают важное место в обмене веществ у дрожжей: они могут стимулировать или ингибировать их рост, служить единственным источником углерода и энергии [26,126,178].
Все промежуточные продукты цикла Кребса (пировиноградную, уксусную, янтарную, фумаровую и яблочную кислоты) дрожжи в состоянии использовать в качестве единственного источника углерода. Однако скорость роста на средах с этими кислотами ниже, чем на средах с глюкозой. При выдержке вина под хересной пленкой показано образование щавелевой, гликолевой, фумаровой и глутаровой кислот, которых в исходном вине не было [178]. Специальные опыты подтвердили синтез хересными дрожжами из яблочной кислоты фумаровой, янтарной, гликолевой; из пировиноградной – лимонной, яблочной, молочной, янтарной кислот.
Ненасыщенные жирные кислоты, особенно олеиновая, линолевая, линоленовая, пальмитолеиновая, арахидииовая, являются важными ростовыми факторами дрожжей в анаэробных условиях. А. Андреазен и Т. Стийер [232] установили, что винные дрожжи могут свободно размножаться в анаэробных условиях, если в среду для культивирования ввести два вещества: какую-либо ненасыщенную жирную кислоту (олеиновую, линолевую, линоленовую) и стерины (эргостерин или холестерин). П. Брешо с соавторами [239, 242] изучали дрожжи в процессе приготовления вин углекислотной мацерацией. Ими установлено присутствие стимуляторов роста дрожжей в виноградном сусле (пруин винограда), необходимых для развития в анаэробных условиях.
Использование дрожжами углеводородов как единственного источника углерода широко применяется для получения кормового белка. Парафины могут активно потребляться углеводо-родокисляющими дрожжами рода Candida при технологическом процессе производства дрожжевой массы.
В настоящее время существует подкрепленное экспериментальными данными мнение об участии СО2 в обмене веществ дрожжей [35]. А. К. Родопуло [161] была доказана способность дрожжей синтезировать из пировиноградной кислоты и углекислоты ряд органических кислот: лимонную, яблочную, янтарную, молочную и др.
При производстве шампанских вин дрожжи оказываются в среде с повышенным содержанием СО2. Л. В. Дубинчук, Н. Н. Глонина, Е. С. Дрбоглав исследовали фиксацию С1402 дрожжами при шампанизации и установили активное использование СО2 для синтеза белковых веществ, кислот [54, 56].
Таким образом, среди всех разнообразных органических источников углерода углекислый газ является биологически активным веществом, связанные формы которого являются необходимым продуктом для дрожжей [50].
Азотное питание
Источники азота, необходимые для синтеза азотсодержащих компонентов клетки (аминокислот, белков, пуриновых и пиримидиновых нуклеотидов и некоторых витаминов), должны содержаться в среде в виде органических или неорганических соединений. Большинство дрожжей не усваивают нитраты. Однако род Hansenula характеризуется способностью использовать их, чем и отличается от рода Pichia. Некоторые виды рода Brettanomyces также усваивают нитраты. В качестве неорганических источников азота дрожжи хорошо используют: сернокислый и фосфорнокислый аммоний, аммиачные соли уксусной, молочной, яблочной и янтарной кислот [76].
В этом случае ближайшим предшественником органического азота является аммиак, который дрожжи рода Saccharomyces усваивают в первую очередь и только потом – органические азотистые вещества – аминокислоты. Дрожжи могут использовать в качестве источника азота мочевину и пептон. Для получения большой биомассы Sacch. cerevisiae в аэробных условиях в среде должен содержаться азот как в органической, так и неорганической форме. Один миллиард клеток усваивает около 4–7 мг азота [78].
Аммиачный азот, содержащийся в виноградном сусле (от 25 до 100 мг/л), быстро усваивается дрожжами в первые часы (сутки) размножения клеток. Иногда, при недостатке аммиачного азота в сусле (в годы сильного вызревания винограда или поражения ягод грибом Botrytis cinerea), для усиления роста культуры дрожжей вводят соли аммония. Но делать это можно только перед забраживанием, так как в процессе брожения дрожжи усваивают аммонийные соли не полностью [154]. Следует также обратить внимание на то, что добавки солей аммония повышают в вине титруемую кислотность и снижают величину pH.
Н. Ф. Саенко и другие исследователи установили, что хересные дрожжи лучше развиваются при внесении дополнительных источников азотистого питания (0,5% дрожжевого автолизата или лебедевского мацерационного сока или водного раствора аммиака в количестве 80–120 мг/л). Наиболее быстрому развитию хересной пленки способствует одновременное внесение 0,5% автолизата и 80 мг/л аммиачного азота [178].
Хорошо усваиваются дрожжами аминокислоты, хуже – пептиды и совсем не усваивается нативный белок. Однако при наличии усвояемого азота в среде дрожжи способны расщеплять белок, выделяя протеолитические ферменты [229].
По питательной ценности для вийных дрожжей Э. Пейно и С. Лафон-Лафуркад [292] аминокислоты разделили на хорошо усваиваемые – изолейцин, триптофан, аргинин, валин, гистидин, аспарагиновая кислота и плохо усвояемые – треонин, фенилаланин, тирозин, метионин, серин, лизин, глицин, глутаминовая кислота, лейцин. Совершенно не усваивается пролин.
Примечательным фактом является то, что дрожжи используют только природные формы аминокислот (L-формы).
Дрожжи в процессе брожения виноградного сусла, с одной стороны, потребляют азотистые вещества, с другой – выделяют их в среду. При этом поступление аминокислот и других азотистых веществ значительно увеличивается к концу брожения, когда возрастает число мертвых клеток дрожжей и соответственно – автолитические процессы усиливаются. Однако надо учесть и то, что аминокислоты могут выделяться в среду и живыми клетками.
Н. М. Сисакян и Э. Н. Безингер [188] исследовали изменение состава аминокислот в процессе брожения виноградного сусла и формирования вина и показали, что в процессе сбраживания сусла дрожжи интенсивно ассимилируют большинство аминокислот, не затрагивая пролин, и по окончании брожения отдают в вино аспарагиновую, глутаминовую и ץ-аминомасляную кислоты, аланин, валин, гликокол, серин, треонин. Таким образом, при культивировании дрожжевых клеток на среде, содержащей полную смесь аминокислот, возможна прямая их ассимиляция в таком количестве, которое соответствует их содержанию в белке дрожжей [76]. Это свидетельствует о том, что для построения белков при размножении и росте клеток необходим не только азот, но и углеродистый остаток аминокислоты. Установлено, что дезаминированный остаток аминокислоты является фактором, определяющим его питательную ценность, позволяет рассматривать аминокислоты не только как источник азота, но одновременно и как источник углерода. Этим можно объяснить принципиальную разницу в ценности различных аминокислот.
Основой метаболизма аминокислот являются реакции трех главных типов: дезаминирование, переаминирование, декарбок-силирование.
В процессе распада и образования «вторичных» аминокислот исключительная роль принадлежит реакциям переаминирования при участии аминотрансфераз. Наличие систем переаминирования у винных дрожжей Sacch. vini и Sacch. oviformis показано В. К. Липатовой [41]. Дрожжи, выращенные в аэробных условиях (виноградное сусло-агар), имели незначительную активность L-аспартат- и L-аланин-аминотрансфераз. У них отсутствовала L-тирозин-аминотрансфераза по сравнению с этими же дрожжами, выращенными в анаэробных условиях (виноградное сусло), хотя выход клеточного экстракта из 1 г сухих дрожжей оставался в тех же пределах. Активность аминотрансфераз дрожжей, выращенных на виноградном сусле, характеризуется данными, приведенными в табл. 9.
Таблица 9
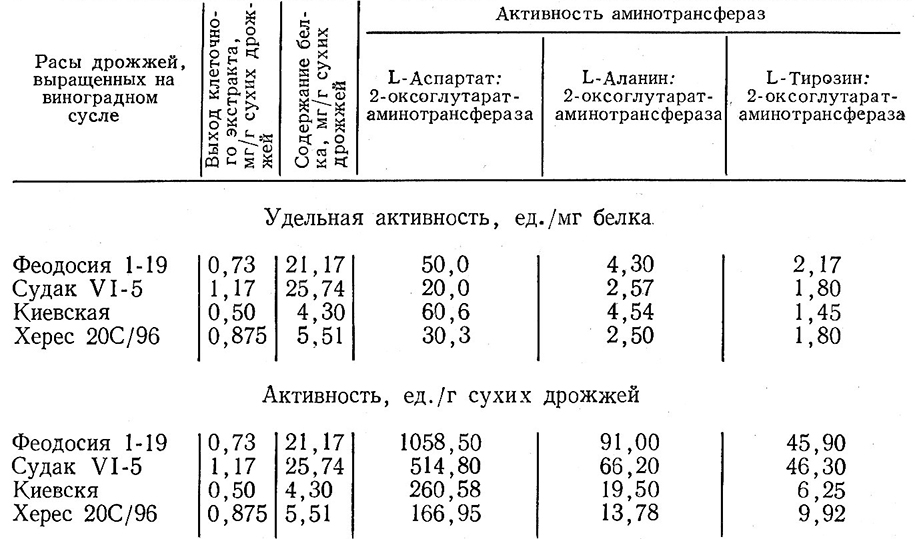
Несмотря на то что содержание белка в дрожжах рас Киевская и Херес 20 С/96 в аэробных условиях было выше, чем в анаэробных, активность аминотрансфераз была незначительной. Это указывает на связь реакций переаминирования с функциональной деятельностью дрожжей – брожением. Наряду с влиянием условий культивирования на активность аминотрансферазных систем дрожжей оказывал влияние также и азотистый состав среды, применяемой для культивирования (табл. 10).
Таблица 10
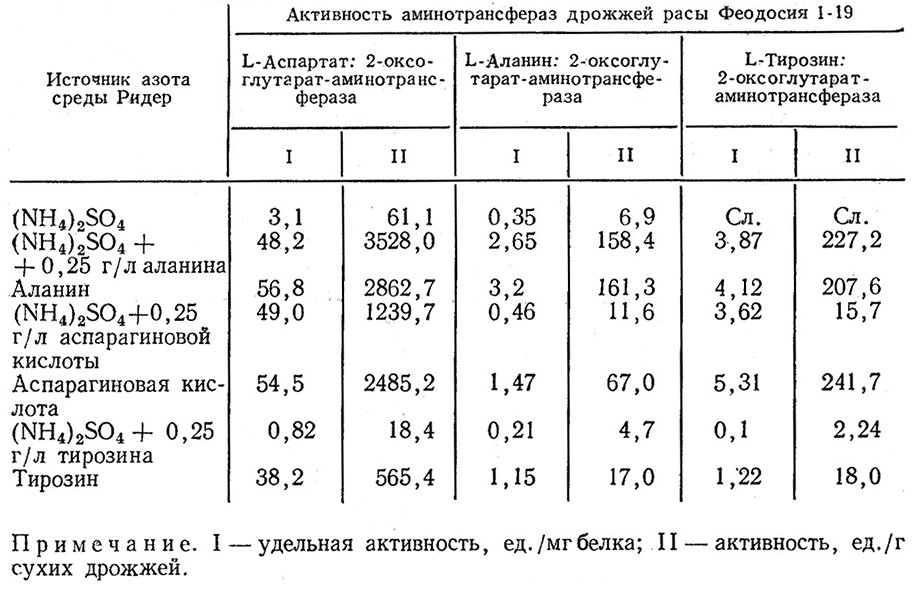
Добавки аминокислот к сернокислому аммонию и полная замена сернокислого аммония аминокислотами значительно увеличивали активность изучаемых ферментов.
Аминокислоты оказывали влияние не только на соответствующие аминотрансферазы, но и на другие, для которых они не являлись субстратами. Аланин, добавленный в среду, оказывал заметное воздействие на активность всех исследуемых ферментов. При добавке тирозина увеличивалась активность только тирозин-аминотрансферазы, и лишь при полной замене сернокислого аммония тирозином повышалась активность аминотрансфераз.
Вполне очевиден факт проявления аминотрансферазной активности при наличии в среде аминокислот. Об этом же свидетельствуют данные увеличения активности ферментов на синтетической среде с сернокислым аммонием к концу брожения, когда в ней появляются аминокислоты, как в результате обмена веществ дрожжей, так и частичного автолиза дрожжевых клеток. Активность аспартат-аминотрансферазы с 3,1 ед./мг белка в середине брожения возросла до 47,7 ед./мг белка к концу брожения; активность аланин-аминотрансферазы увеличилась с 0,35 до 0,92 ед./мг белка. В конце брожения активность тирозин-амино-трансферазы составляла 2,64 ед./мг, в то время как в середине 64 брожения обнаружены только следы этого фермента. Таким образом, наличие в среде аминокислот служит условием для проявления аминотрансферазной активности, что позволяет предполагать их индуцируемость.
Экстремальное воздействие на дрожжи как избытка кислорода, так и избытка СО2 значительно изменяет азотистый обмен. Так, наличие кислорода сдвигает обмен в сторону накопления больших количеств биомассы и способствует усиленному потреблению азотистых веществ, в том числе и аминокислот из среды. Поэтому в ней уже к середине брожения остается только 25% аминокислот и 9% общего азота. Наоборот, избыточное давление СО2 тормозит размножение дрожжей, но единицей биомассы расходуется больше и аминокислот, и общего азота.
Влияние условий брожения на содержание азотистых веществ в дрожжах и в виноматериале к концу брожения виноградного сусла видно из данных, приведенных в табл. 11.
Таблица 11
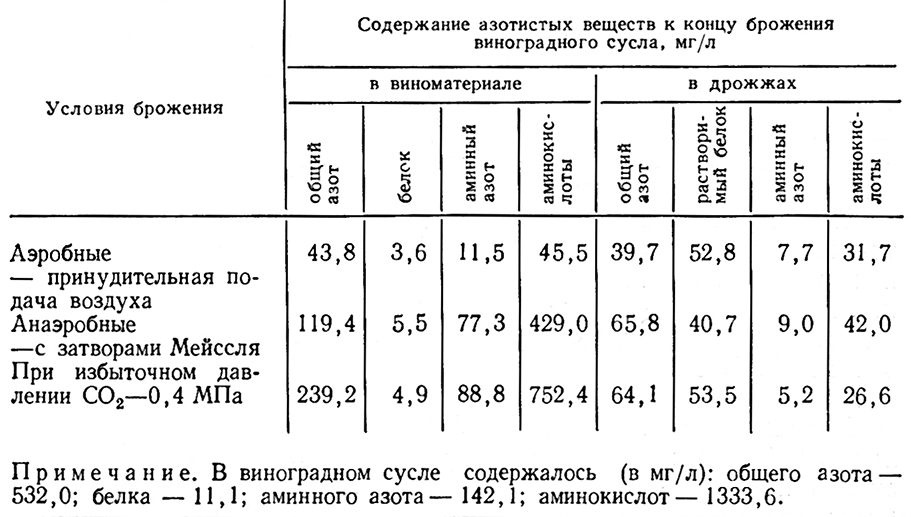
Условия брожения оказывают существенное влияние на протеиназную активность. Максимальной удельной активностью обладают дрожжи в аэробных условиях брожения–100% и минимальной– 66% при брожении в атмосфере СО2 при давлении 0,4 МПа. Пептидазная активность во много раз ниже протеиназной. Это обусловлено тем, что гидролиз белка в живой клетке идет главным образом до полипептидов и в очень незначительной степени до аминокислот [135].
В целом при выдержке вина на осадке дрожжи могут возвратить 75% аминокислот, потребленных ими во время брожения [252].
Динамика аминокислот в процессе сбраживания виноградного сусла различными расами дрожжей описана В. К. Липатовой [41, 96] и Н. И. Бурьян с сотр. Выдержка вина на дрожжах показала, что расы дрожжей Судак VI-5 и Херес 20 С/96 сильнее обогащают вино аминокислотами, чем расы Феодосия 1-19 и Киевская.
Описаны случаи усвоения атмосферного азота хересными дрожжами при недостаточном содержании азотистых веществ в виноматериале [178].
Азотистый обмен наряду с углеводным является основным в процессе брожения. На грани этих двух обменов синтезируются компоненты, влияющие на органолептические показатели вина [145]. Избыток азотистых веществ в винах при наличии доступа кислорода воздуха приводит к переокисленности и появлению в вине мадерных тонов. Г. Г. Валуйко для регулирования содержания азотистых веществ в виноматериалах рекомендует проводить брожение при температуре 16–18°С, что обеспечивает получение легких шампанских и столовых виноматериалов [32, 40].
Для снижения содержания азотистых веществ в винах рекомендуется биологическое азотопонижение (многократное брожение и фильтрация), используемое в технологии приготовления мускатных игристых вин, описанной Е. П. Шольцем [41], и столовых полусладких,– Л. Т. Ермачковой [41].
Неорганические элементы питания
Для питания дрожжей также необходимы неорганические элементы: фосфор, сера, калий, кальций и др.
Фосфор входит в состав важнейших соединений клетки: нуклеопротеидов, нуклеиновых кислот, полифосфатов, фосфолипидов. Соединения фосфора играют определенную роль в различных химических превращениях и в особенности в углеводном обмене и в переносе энергии. Дрожжи хорошо используют в качестве источников фосфора неорганические ортофосфаты, которые превращаются в полифосфаты и после активирования используются для синтетических процессов. Недостаток фосфора в среде приводит к резкому изменению у дрожжей обмена веществ, связанного с нарушением потребления и усвоения углеводов и азота. Для физиологических потребностей расходуется около 10–13 мг фосфора на 10 млрд. клеток [77].
При изучении влияния фосфорного питания на процесс спиртового брожения винных дрожжей (Sacch. vini и Sacch. oviformis) установлено активирование размножения клеток и повышение интенсивности брожения при дополнительном введении фосфорного питания в виде двузамещенного фосфата натрия (100– 500 мг/л). В вине снижается количество общих и летучих кислот, повышаются вкусовые достоинства [75].
В дрожжевых клетках полифосфаты обнаружены в двух различных формах: кислоторастворимые (в холодной трихлоруксусной кислоте) – меньшая часть и кислотонерастворимые – большая часть. Наибольшее количество фосфора полифосфатов (0,12–0,07% на сухую биомассу) содержат молодые, интенсивно почкующиеся клетки. Такой факт свидетельствует о том, что полифосфаты определяют начало и скорость процесса почкования клеток. При этом в период активного роста и размножения, когда интенсивно синтезируются белок и нуклеиновые кислоты, расходуются в первую очередь кислотонерастворимые полифосфаты как более физиологически активная фракция, а затем – полифосфаты кислоторастворимой фракции.
С прекращением почкования клеток отмечается почти полное использование полифосфатов. При выдержке вина на дрожжевом осадке содержание общего фосфора в дрожжах уменьшается, а в вине соответственно увеличивается, т. е. кислоторастворимые фосфорные соединения переходят из дрожжевых клеток в вино [6].
Сера входит в состав белка и простетических групп (–SH) некоторых ферментов и коэнзима А, поэтому без наличия серы в среде нарушаются обменные процессы и синтез полноценного белка. Существенную роль в жизнедеятельности дрожжей играют такие серусодержащие вещества, как аминокислоты (цистенн, цистин, метионин), витамины (тиамин и биотин) и другие соединения. В виноградном соке естественным источником серы являются сульфаты [223]. В анаэробных условиях в процессе брожения элементарная сера в клетках восстанавливается в сероводород, а в аэробных – растворяется в жироподобных веществах клеток и накапливается в них.
Малые количества серы усиливают почкование дрожжей. Но уже 1 мг/л значительно задерживает этот процесс, поэтому особенно опасно содержание элементарной серы в виноматериалах, используемых для вторичного брожения.
В присутствии ионов металлов (железа, меди) сера в клетках образует сульфиды металлов, которые и окрашивают дрожжевой осадок в коричнево-красный или серо-черный цвет. Отложение элементарной серы в клетках дрожжей приводит к образованию инволюционных форм.
Кальций и калий необходимы для активирования некоторых ферментов. Вместе с тем кальций может выступать и в роли ингибитора многих ферментов.
Микроэлементы оказывают влияние на размножение дрожжей и на брожение. Мп в количестве 1 мг/л повышает энергию дыхания, большие количества (45–90 мг/л) активируют брожение, повышают биосинтез эстераз дрожжей. Молибден активирует размножение, бор – сбраживающую способность дрожжей.
Смесь микроэлементов Li, Rb, Ni, Со способствует увеличению прироста массы дрожжей [218].
Факторы роста – это стимуляторы роста, к которым относятся витамины, аминокислоты, пуриновые и пиримидиновые основания. Основными факторами роста беспигментных (бесцветных) форм дрожжевых организмов являются шесть витаминов группы В: инозит (витамин В8), биотин (витамин В7), пантотеновая кислота (витамин В3), тиамин (витамин B1), пиридоксин (витамин В6), никотиновая кислота (витамин В5; РР).
Для витаминов не найдено до сих пор никакого другого механизма действия, кроме прямого участия в той или иной ферментативной реакции. Этим определяется их значение для живых организмов. Следовательно, витамины, входящие в состав винограда и вина, важны не только с пищевой точки зрения, но они могут играть ведущую роль в процессе формирования молодого вина, входя в состав ферментов, катализирующих окислительно-восстановительные процессы, обмен углеводов и азотистых веществ [40, 41].
Минимальные количества их для развития дрожжевых организмов на синтетической среде составляют (в мкг на 1 мл): инозита– 5; биотина – 0,0001; пантотеновой кислоты – 0,25; тиамина – 1,0; пиридоксина – 0,25; никотиновой кислоты – 0,5 [129].
Необходимым фактором роста красных дрожжей Rhodotorula помимо тиамина служит парааминобензойная кислота.
Витамины группы В относятся к наиболее активной по физиологическому действию группе биокатализаторов. Среди дрожжей встречаются формы полностью не способные к синтезу одного, двух, а в некоторых случаях и нескольких витаминов данной группы. У таких тест-культур совершенно отсутствует рост, если требуемого витамина нет в питательной среде [65]. Уменьшение дозы требуемого витамина – от полной до предельно малой – вызывает адекватную реакцию ростом: урожай культуры будет предельно большим при наличии в среде достаточной дозы этого витамина и постепенно сниженным при постепенном уменьшении количества требуемого витамина в опытных образцах. На этом принципе Е. Н. Одинцовой [129] разработаны количественные методы микробиологического определения витаминов группы В.
Для нормальной жизнедеятельности и размножения определенных групп дрожжевых организмов и отдельных рас требуются микроаминокислоты. Некоторые аминокислоты, добавленные к синтетической среде совместно с необходимыми витаминами, оказывали стимулирующее действие на размножение отдельных штаммов дрожжей. Однако этот вопрос почти не изучался.