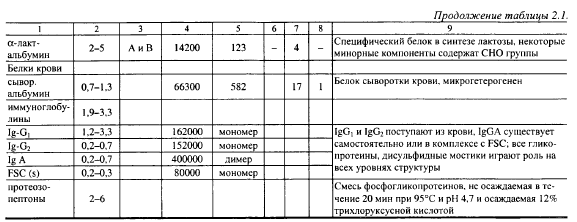
Состав и отличительные свойства белков молока показаны в табл. 2.1. Около 90% белков молока синтезируются молочной железой, остальные проникают в него через стенки кровеносных сосудов из крови.
Белки молока делят на казенны и сывороточные белки. Казенны нерастворимы при pH 4,6 и 20° С (изоэлектрическая точка), коагулируют под действием кислых протеаз (химозина, пепсинов и др.). К сывороточным относят белки, которые не коагулируют под действием химозина и других молокосвертывающих энзимов и остаются при выработке сычужных сыров в сыворотке. Коагуляция молока под действием энзимов, образующихся в организме новорожденных млекопитающих (в основном химозина), является начальным этапом переваривания ими казеина. Несвертываемость сывороточных белков под действием химозина свидетельствует о возможности их усвоения в нативном виде, необходимость которой связана с характером выполняемых сывороточными белками специфических функций. К таким функциям относятся защита новорожденных от инфекций, участие в формировании у них собственных защитных систем.
Содержание сывороточных белков и иммуноглобулинов выше всего в молозиве (до 90% белков молозива), поскольку новорожденные особенно нуждаются в защите от инфекций. Интересно, что в начальный период жизни (до 14 суток) в желудке у новорожденных образуется химозин и практически не вырабатываются пепсины, способные расщеплять иммуноглобулины. При переходе с молочного на обычное кормление, наоборот, начинают образовываться пепсины, а выделение химозина практически прекращается. Таким образом, функции, выполняемые белками в организме, зависят от возраста животного. Содержание сывороточных белков возрастает в стародойном молоке и при заболевании коров маститами, когда проницаемость стенок кровеносных сосудов увеличивается.
Сывороточные белки являются глобулярными белками и представляют собой гидрофильные коллоиды. Благодаря прочной гидратной оболочке и высокой дисперсности они находятся в молоке в состоянии устойчивого коллоидного раствора. В отличие от казеинов они начинают денатурироваться при сравнительно невысоких температурах (выше 65° С) с последующей агрегацией и осаждением на казеине.

В коровьем молоке присутствуют казенны четырех основных групп: asl-, as2-, β- и æ-казеины. Кроме этого, в молоке имеется несколько минорных казеинов, большинство которых образовано в результате действия на основные казенны природной щелочной протеазы молока - плазмина. Они включают уг, у2- и у3-казеины, протеозо-пептоны, образующиеся из β-казеина, λказеин, образующийся из asl-казеина, и 20-30 неидентифицированных пептидов.
Казенны фосфорилированы (в основном, фосфаты соединены с гидроксильными группами серина), что обусловливает наличие у них отрицательного заряда. Отрицательный заряд β-, asl- и аз2-казеинов равняется соответственно минус 12, 15 и 21 мВ. Из-за высокого содержания фосфора α- и βказенны активно связывают Са и осаждаются при концентрации СаС12 больше 6 мМ (больше 66,6 г/100 кг молока).
æ-Казеин имеет одну фосфатную группу, не связывает кальций и растворим при высоких его концентрациях. Он гидрофобно взаимодействует с другими казеинами и может предотвращать осаждение чувствительных к кальцию казеинов, масса которых в 10 раз выше его собственной.
Большое количество анионных групп в казеинах обусловливает высокую чувствительность их к pH, а наличие в полипептидных цепочках казеинов, в частности β-казеина, определяет наличие заряженных гидрофильных участков. В противовес им в цепочках имеются гидрофобные участки. Особенно сильной гидрофобностью отличается сегмент β-казеина от 30 до 209 остатка, благодаря наличию которогоβ-казеин в водных растворах легко образует зависимые от температуры ассоциации со степенью полимеризации до 40 мономеров.
Наличие SH-групп в составе as2- и æ-казеинов повышает их реакционную способность, в частности создает возможность связываться с β-лактоглобулином после тепловой обработки молока. В цепочках казеинов относительно часто встречаются остатки пролина, которые повышают подвижность их молекул.
æ-Казеины содержат до 5 остатков углеводов. Их С-терминальный сегмент (гликомакропептид, или просто макропептид - МП) имеет заряд минус 12 мВ и обладает сильными гидрофильными свойствами, обусловленными высоким содержанием оксиаминокислот и аминокислот кислого характера; N-терминальный сегмент гидрофобен.

