В будущем влияние биотехнологии на развитие химической промышленности будет определяться возможностью объединения принципов микробиологии, биохимии и химической технологии. Основной предпосылкой использования биологического катализа в химии является способность ферментов катализировать энантиомерно однозначные, стереохимически определенные реакции синтеза. Сегодня многие биологические процессы имеют такие характеристики, что с экономической точки зрения они не могут конкурировать с альтернативными химическими процессами. Принято считать, что для успешного осуществления крупномасштабного биологического процесса, направленного на получение некоего химического соединения, необходимо, чтобы прибавочная стоимость продукта составляла 500—1000 долл, за тонну сверх стоимости сырья. Впрочем, все же существуют области, в которых применение биотехнологии обещает быть перспективным.
- Тип реакции: прямые реакции окисления — восстановления; использование обычных ферментов для проведения нетривиальных реакций; белковая инженерия, нацеленная на изменение свойств катализатора; использование биокатализа в неводных средах.
- Конфигурация реактора: оптимизация биокатализаторов методами генной инженерии; выбор термостабильных систем или использование иммобилизованных конфигураций; разработка дешевых, эффективных и общеудобных методов повторного использования кофактора; химическая инженерия в связи с проблемами крупномасштабных биокаталитических систем (см. гл. 10).
- 4.4.1. Тип реакции
Реакции прямого окисления и оксигенации
Для преобразования сложных молекул в ходе органического синтеза используются оксидоредуктазы со строгой структурной, сайт- и стереоспецифичностью. В случае более широкой субстратной специфичности эти ферменты могут использоваться как катализаторы типовых реакций. В реакциях превращения спиртов в карбонилы находят применение нуклеотид-зависимые дегидрогеназы. Так, хорошо изучена алкогольдегидрогеназа из печени лошади: известны ее субстратная специфичность и стереохимия катализируемых реакций. Она атакует моно-, ди- и тетрациклические структуры. Построена модель ее активного центра, что позволяет прогнозировать активность этого фермента в отношении новых субстратов (см. разд. 4.1.1). Отметим, что ациклические вторичные спирты — плохой субстрат для этого фермента, и если ставится задача осуществления синтеза на их основе, то целесообразно попытаться использовать другие дегидрогеназы (возможно, термофильные). Особенность оксигеназ состоит в их способности с высокой эффективностью и специфичностью включать кислород прямо в органические субстраты; проведение такого прямого окисления неактивированных органических субстратов — вечный камень преткновения в работе химика-синтетика. Реакции этого типа весьма разнообразны: они лежат в основе превращения алканов в спирты,, олефинов — в эпоксиды, сульфидов — в сульфоксиды; это реакции гидроксилирования ароматического кольца и его раскрытия, а также окислительного деметилирования. Вполне возможно, что результаты глубокого изучения механизма активации а присоединение кислорода ферментами найдут применение для создания новых химических каталитических систем. В последнее время большое внимание уделялось использованию различных микробных оксигеназных систем в стереоспецифическом эпоксиокислении олефинов, в результате которого образуются «строительные блоки» для синтеза полимеров. В микроорганизмах, окисляющих алканы и алкены, функционируют соответствующие монооксигеназы, но если исходить из нынешнего уровня технологии, то вряд ли хоть один процесс такого типа целесообразен с экономической точки зрения. Поскольку оксигеназы нестабильны, принято считать, что эти процессы основаны на. биокаталитической активности целостных организмов. Предложен интересный альтернативный путь таких превращений: трехступенчатый ферментативный процесс с участием оксидаз (рис. 4.14). На первом этапе пиранозо-2-оксидаза из гриба-ба- зидиомицета катализирует образование перекиси водорода, используя в качестве субстрата и источника энергии глюкозу. Далее галопероксидаза осуществляет реакцию перекиси водорода с алкеном и ионом какого-либо галогена с образованием алкенгалогидрина, от которого затем отщепляются атомы водорода и галогена и образуется соответствующий алкеноксид. Побочными продуктами процесса являются фруктоза и глюконовая кислота. Стереоспецифичность окислительного катализа может использоваться в процессе синтеза диэпоксимономеров Для производства стереорегулярных полимеров. Мономерные единицы могут быть получены и путем превращений бензола под действием оксигеназ (гл. 5) или в результате двойного моноокисления дифенила с образованием 4,4-дигидроксидифенила.
Использование обычных ферментов в нетривиальных
химических реакциях
В органическом синтезе ферменты применяются пока не очень широко в основном потому, что большинство интересующих исследователей веществ не являются их природными субстратами. Приходится специально изучать субстратную специфичность ферментов и условия протекания реакций, катализируемых наиболее освоенными промышленностью ферментами, с тем чтобы выяснить возможность вовлечения этих ферментов в каталитические процессы, интересующие химика-синтетика.
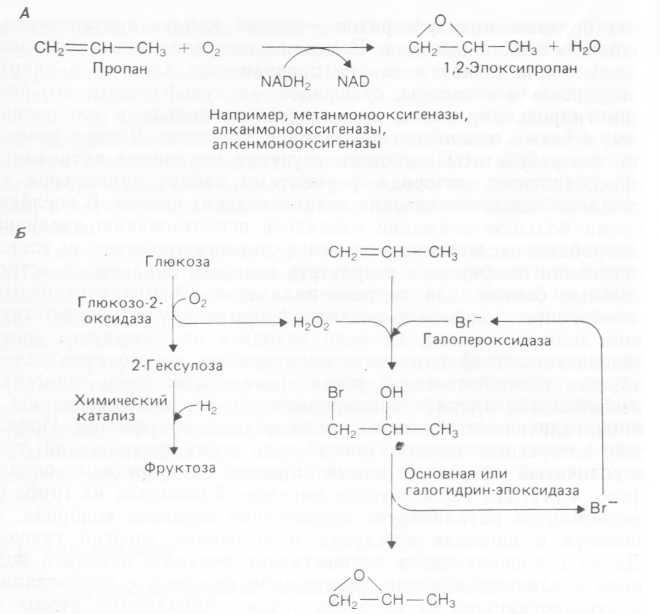
Рис. 4.14. Осуществляемое при участии микроорганизмов образование мономеров эпоксидов. А — прямое окисление с помощью монооксигеназ с широким спектром действия; Б — многоступенчатый процесс.
Так, промышленностью производится фермент глюкозооксидаза, проявляющий высокую специфичность к донору электронов D-глюкозе. C другой стороны, специфичность его к акцепторам электронов гораздо шире, и природный акцептор, кислород, может быть заменен некоторыми синтетическими красителями. Это послужило основой для использования фермента в реакции восстановления бензохинона в гидрохинон (рис. 4.15), причем реакция шла в три раза быстрее, чем в присутствии кислорода. Фермент может восстанавливать и другие хиноны (некоторые из них применяются в биологии и медицине), а также ряд ароматических нитросоединений. Было показано, что галактозооксидаза катализирует реакцию стереоспецифического превращения алифатических спиртов (не сахаров) в альдегиды; так, глицерол превращается в S-(—)-глицеральдегид. Для разделения З-арил-акролеинов может быть использована ксантиноксидаза, так как она окисляет транс-изомер в сто раз быстрее, чем цис.
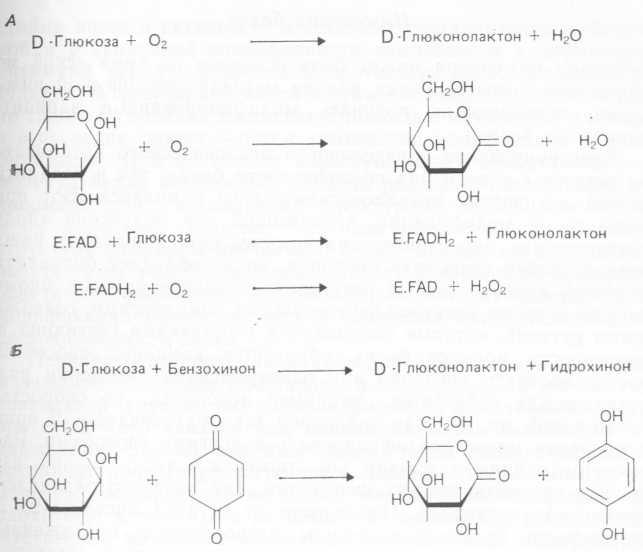
Рис. 4.15. Использование глюкозооксидазы и неприродных акцепторов электронов при химическом синтезе органических веществ. А — обычная реакция; Б — реакция с неприродным акцептором электронов.
Изменяя условия, в которых действует фермент, мы также можем существенно повлиять на химические особенности катализируемой реакции. Так, пероксидаза из хрена гидроксилирует ароматические соединения с небольшой специфичностью и малым выходом. Понижение температуры с 25 до OoC подавляет побочные реакции, в результате чего в основном гидроксилируются пара-замещенные ароматические соединения по мета-поло- жению и vice versa. Карбоксиэстераза из печени свиньи способна осуществлять как реакцию трансэтерификации, так и гидролиз эфиров, причем последняя реакция доминирует, поскольку плохо растворимые спирты не могут эффективно конкурировать с молекулами воды. Фермент можно заставить работать по первому механизму, применив двухфазные системы, в которых фермент растворен в минимальном объеме воды, а основная органическая среда образована спиртом и эфиром.
Инженерия белка
Белковая инженерия может быть основана на химической модификации готового белка или на методах генетической инженерии, позволяющих получать модифицированные варианты природных белков.
Конструирование определенного биологического катализатора ведется с учетом как специфичности белка, так и каталитической активности металлоорганического комплекса. Вот примеры такой модификации, проведенной для получения «полусинтетических биоорганических комплексов». Миоглобин кашалота способен связывать кислород, но не обладает биокаталитической активностью. В результате объединения этой биомолекулы с тремя электрон-переносящими комплексами, содержащими рутений, которые связываются с остатками гистидина на поверхности молекул белка, образуется комплекс, способный восстанавливать кислород при одновременном окислении ряда органических субстратов, например аскорбата, со скоростью почти такой же, как для природной аскорбатоксидазы. В принципе белки можно модифицировать и другими способами. Рассмотрим, например, папаин. Он относится к числу хорошо изученных протеолитических ферментов, для которого определена трехмерная структура. Поблизости от остатка цистеина-25 на поверхности белковой молекулы располагается протяженный желобок, в котором протекает реакция протеолиза. Этот участок может быть алкилирован производным флавина без изменения доступности участка связывания потенциальных субстратов. Такие модифицированные флавопапаины использовались для окисления Ы-алкил-1,4-дигидроникотинамидов, и каталитическая активность некоторых из этих модифицированных белков была существенно выше, чем у природных флавопротеин-NADH- дегидрогеназ. Таким образом удалось создать очень эффективный полусинтетический фермент. Использование флавинов с высокоактивными, находящимися в определенном положении элек- трон-оттягивающими заместителями, возможно, позволит разработать эффективные катализаторы для восстановления никотинамида.
Крупные успехи, достигнутые за последнее время в химическом синтезе ДНК, открыли перед белковой инженерией принципиально новые возможности: конструирование уникальных, не встречающихся в природе белков. Для этого необходимо и дальнейшее развитие технологии, так чтобы изменение генов методами генетической инженерии приводило к предсказуемым изменениям белков, к улучшению вполне определенных функциональных их характеристик: числа оборотов, Km для конкретного субстрата, термостабильности, температурного оптимума» стабильности и активности в неводных растворителях, субстратной и реакционной специфичности, потребности в кофакторах, оптимуме pH, устойчивости к протеазам, аллостерической регуляции, молекулярной массы и субъединичного строения. Обычно такого улучшения достигали с помощью мутагенеза и отбора, а в последнее время — путем химической модификации и иммобилизации. Для успешного конструирования конкретного типа молекул белка необходимо выявить ряд основополагающих закономерностей, связывающих структурные особенности белков и их желаемые свойства. Так, зная точную кристаллическую структуру молекулы изучаемого белка, мы можем идентифицировать те ее участки, которые следует направленно модифицировать для увеличения его каталитической активности. Такая модификация может состоять в изменении аминокислотной последовательности белка.
Первая контролируемая модификация белка была проведена в середине 60-х годов Кошландом и Бендером. Для замены гидроксильной группы на сульфгидрильную в активном центре протеазы — субтилизина они применили метод химической модификации. Однако, как выяснилось, такой тиолсубтилизин не сохраняет протеазную активность. Вообще говоря, методы химической модификации не только жестки и неспецифичны; они плохи еще и тем, что с их помощью невозможно вызвать множественные желаемые изменения, особенно если модифицируемые аминокислотные остатки погружены в глубь третичной структуры белка. Для этого нужна белковая инженерия, основанная на генетической инженерии. Сегодня она осуществляется при помощи двух хорошо освоенных методов (гл. 7). Так, сайт-специфический мутагенез осуществляется следующим образом. Клонируют ген того белка, который интересует исследователя, и встраивают его в подходящий генетический носитель. Затем синтезируют олигонуклеотидную затравку с желаемой мутацией, последовательность которой из десяти — пятнадцати нуклеотидов в достаточной степени гомологична определенному участку природного гена и поэтому способна образовывать с ним гибридную структуру. Эта синтетическая затравка используется полимеразами для начала синтеза комплементарной копии вектора, которую затем отделяют от оригинала и используют для контролируемого синтеза мутантного белка. Альтернативный подход основан на расщеплении цепи, удалении подлежащего изменению сайта и замещении его синтетическим аналогом с желаемой последовательностью нуклеотидов.
Тирозил-тРНК—синтетаза катализирует реакцию аминоацилирования тирозиновой тРНК, которая включает активирование тирозина с помощью ATP с образованием тирозиладенилата. Ген этого фермента, выделенный из Bacillus Stearothermophilus, был встроен в бактериофаг Ml3. Затем каталитические свойства фермента, особенно его способность связывать субстрат, были изменены путем сайт-специфической модификации. Так, треонин-51 был заменен на аланин. Это привело к двукратному увеличению связывания субстрата, видимо, из-за невозможности1 образования водородной связи между этим остатком и тирозил- аденилатом. При замене аланина пролином нарушается конфигурация молекулы фермента, но способность к связыванию субстрата увеличивается в сто раз, так как облегчается его взаимодействие с гистидином-48. Сходные сайт-специфичные изменения были получены в З-лактамазе, и обычно они сопровождались инактивацией фермента. Замена серина-70 на цистеин приводи! к образованию р-тиоллактамазы, константа связывания у которой не отличается от таковой для природного фермента, но активность по отношению к пенициллину составляет всего 1-—2%. Тем не менее активность этого мутантного фермента в отношении некоторых активированных цефалоспоринов не меньше исходной активности или даже превышает ее; эти белки также более устойчивы к действию протеаз.
Мутации, вызываемые путем сайт-специфичного воздействия, используют сегодня для проверки адекватности результатов структурных исследований. В некоторых случаях с их помощью удалось показать, что структурная стабильность белка и его каталитическая активность могут быть разобщены. Накопив достаточное количество информации о взаимосвязи между стабильностью структуры белка и его функцией, мы, возможно, сумеем осуществлять тонкую регуляцию активности биологических катализаторов и создавать полностью синтетические их, аналоги. Недавно появилась работа, в которой сообщалось о клонировании первого синтетического гена фермента, кодирующего активный фрагмент молекулы рибонуклеазы.
Биологический катализ в неводных средах
Известно, что биологический катализ осуществляется в природе в водной среде, но сфера применения ферментов в биотехнологии не может ограничиваться только этими условиями. Нередко нужно подвергнуть изменению структуры липофильных или водонерастворимых веществ, например стероидов или углеводородов. Применение органических растворителей может не только увеличить каталитическую активность определенного фермента путем повышения доступности субстрата, но и сместить равновесие соответствующей химической реакции.
Главным фактором здесь является стабильность биокатализатора в органическом растворителе. Активность ферментов во многих не смешивающихся с водой органических растворителях нередко сильно падает. Так, в качестве катализаторов реакции дегидрирования стероидов в среде бензола и гептана использовали разные виды Nocardia. Для увеличения их стабильности применяли иммобилизацию; при этом нужно было учитывать гидрофобность носителя. Бактерии, заключенные в гидрофобные гели, обладали большей каталитической активностью, чем находящиеся в гидрофильном окружении, что определялось характером распределения субстрата между гелем и окружающим его растворителем. Сегодня мы умеем конструировать носители с нужной степенью гидрофобности: для этого используются фо- тосшиваемые преполимеры смол и уретановые преполимеры. Иммобилизация фермента на поверхности или внутри твердого носителя повышает его устойчивость к действию органических растворителей, препятствуя разрушению третичной структуры белка в таких средах. Многие ферменты, катализирующие реакции превращения липофильных субстратов in vivo, локализуются в мембранах, и иммобилизация как бы имитирует их стабилизированное связанное состояние в мембранах. Так, для синтеза этилового эфира N-ацетил-Б-триптофана из этанола и N-ацетил-Б-триптофана использовали химотрипсин в хлороформе. Липаза, иммобилизованная на гидрофобном полимере, катализирует в н-гексане реакцию переэтерификации. Таким путем из оливкового масла и насыщенных высших жирных кислот получают заменитель кокосового масла.
Комбинируя разные описанные в этой главе способы, мы сможем существенно расширить границы применения биологических катализаторов в производстве и анализе химических веществ, применяемых в промышленности.
- 4.4.2. Конфигурация реактора
Оптимизация биокатализатора
Особенности конфигурации биореактора, используемого в биотехнологическом процессе, определяются биохимическими и биофизическими свойствами избранного биокатализатора. От его природы зависит также и способ дальнейшей переработки полученного продукта. В этой связи при разработке процесса особое значение приобретает улучшение свойств катализатора методами генетической инженерии, например изменения тех физических параметров, которые определяют его способность работать в определенной среде, специфичность и производительность, а также локализацию синтезируемого продукта (вспомним о внеклеточном образовании некоторых веществ клетками растений). Более подробно роль генетических методов в решении •задач биотехнологии разбирается в гл. 7.
Регулировать особенности протекания процесса можно также путем разумного выбора катализатора. Сегодня большие усилия затрачиваются на выделение, изучение свойств и способов использования термофильных микроорганизмов и их ферментов во многих уже применяющихся в промышленности био- катализируемых реакциях. Получаемые при этом преимущества определяются увеличением стабильности белков и их более высокой каталитической активностью. Модернизировать процессы можно и путем применения организмов, обитающих в экстремальных условиях (например, при низких pH или высоких концентрациях солей). Так, для производства органических кислот имеет смысл попытаться использовать ацидофильные галофилы; галофильные виды уже сейчас применяются при выработке полиолов (образование глицерола при участии Duniella).
Применение иммобилизованных биокатализаторов как в составе целых организмов, так и в виде изолированных ферментов будет играть все большую роль в разработке и проведении биотехнологических процессов, поскольку это облегчает работу с ними, повторное их использование и отделение продукта реакции. Сама иммобилизация тоже может благоприятно сказываться на стабильности и рабочих характеристиках катализатора, что в конечном счете может создать основу для кардинального пересмотра экономической конкурентоспособности определенного типа биопроизводства.
Повторное использование кофактора
Для проявления каталитической активности 30% известных ферментов нужен один из пяти кофакторов (NAD, NADP, ATP, FAD либо CoA). Само применение этих ферментов в биокатализе будет определяться тем, удастся ли повторно использовать эти дорогие вещества либо вообще обойтись без них. Существует три подхода к решению этой проблемы: ферментативный, химический и электрохимический.
Ферментативную регенерацию кофакторов, например, можно осуществить при участии ряда имеющихся в продаже ферментов, которые в качестве восстановителя используют дешевые субстраты. В этом направлении была проведена большая работа по использованию формиатдегидрогеназы — фермента, который катализирует восстановление NADH при превращении формиата в углекислый газ. Так как продукт реакции является газом, он легко удаляется из реакционной смеси и не мешает выделению из нее продукта реакции. Основная трудность здесь — потеря самого кофактора из реакционной смеси. Предпринимались попытки повторного использования регенерированного кофактора в такой системе путем присоединения его к более крупным молекулам с сохранением его каталитической активности. Такой комплекс можно удерживать в реакторе при помощи ультрафильтрующей или гидрофобной жидкой мембраны. NAD включали в полиэтиленгликоль (с мол. массой 10 000—40000) и использовали в мембранном реакторе. К сожалению, каталитическая активность таких иммобилизованных кофакторов обычно сильно падает и составляет всего несколько процентов от их активности в свободной форме. Коферменты и соответствующие регенерирующие ферменты стабилизировали также путем иммобилизации в структуре гелей.
Химическое окисление NADH можно осуществить в реакции присоединения к нему кислорода с использованием акцепторов электронов вроде PMS/DCPIP или FMN.
Несомненный интерес представляет и электрохимическое окисление NAD(P)H и восстановление NAD(P)+. Для окисления восстановленных коферментов был предложен ряд электродов. Осуществить стереоспецифическое электрохимическое восстановление оказалось гораздо сложнее. Недавно были разработаны соответствующие процессы с применением электродов с ферментами, которые участвуют в реакции стереоспецифического восстановления за счет электрохимического восстановления редокс-центров ферментов. Это удалось осуществить благодаря разработке методов переноса электронов между электродами и этими редокс-центрами. В результате в некоторых случаях каталитический процесс протекает в отсутствие кофактора. Такое замещение кофактора модифицированным электродом, видимо, легче осуществить для реакций восстановления, чем окисления.
- 4.4.3. Будущий вклад биотехнологии в химическую промышленность
Источником сырья для различных отраслей химической промышленности в обозримом будущем будут нефть и ее производные. Получаемые из них с малыми затратами продукты вряд ли потребуется производить при помощи какой-то другой технологии. Факторами, которые могут оказать сильное влияние на внедрение биотехнологии в эту область, являются истощение источников сырья, повышение стоимости энергии и постоянная необходимость эффективной переработки отходов. Уменьшение доступных источников горючего приведет к тому, что все более широко будут использоваться ресурсы биомассы. Бродильные производства и технологии на основе ферментов будут и далее дополнять спектр обычных химических технологий. Что же касается применения биотехнологии в крупномасштабных производствах химических веществ или полимеров, то перспективы здесь весьма ограничены. C экономической точки зрения наиболее целесообразным представляется использование специфических преимуществ биокаталитических процессов в малообъемных производствах редких химических веществ с высокой прибавочной стоимостью.
ЛИТЕРАТУРА
Современная химическая биотехнология
Atkinson B., Mavituna F. (1983). Biochemical and Bioengineering Handbook, Nature Press, UK.
Cain R. B. (1980). Transformation of aromatic hydrocarbons. In: Hydrocarbons in Biotechnology (eds. Harrison D. E. F., Higgins I. J. and Watkinson R.), pp. 99—133, Heyden1 London.
Dellweg H. (ed.) (1983). Biotechnology, Vol. 3: Biomass, Microorganisms for Special Applications, Microbial Products 1, Energy from Renewable Sources, Verlag Chemie, Weinheim.
Evelegh D. E. (1981). The microbiological production of industrial chemicals, Scient. Am., 245, 154—178.
Godfrey T., Reichelt J. (1983). Industrial Enzymology: The Application of Enzymes in Industry, The Nature Press, Macmillan, UK.
Kieslich K., Sebek O. K. (1979). Microbial transformation of steroids. In: Annual Reports on Fermentation Processes, Vol. 3 (ed. Perlman D.), pp. 267—297, Academic Press, New York.
Peppier H. J., Perlman D. (eds.) (1979). Microbial Technology, Vol. 1 and 2: Microbial Processes, Academic Press, London.
Rose A. H. (ed.) (1978—1980). Economic Microbiology Series, Vol. 2: Primary Products of Metabolism, Vol. 3: Secondary Products of Metabolism, Vol. 5: Microbial Enzymes and Bioconversions, Academic Press, London.
Schindler J., Schmid R. D. (1982). Fragrance or aroma chemicals: microbial synthesis and enzymatic transformation — a review, Process Biochem., 17(5), 2—8.
Scott C. D. (ed.) (1983). Fifth Symposium on Biotechnology for Fuels and Chemicals, Biotechnology and Bioengineering Symposium Number 13, John Wiley and Sons, New York.
Sebek O. K., Kieslich K. (1977). Microbial transformation of organic compounds: alkanes, alicyclics, terpenes and alkaloids. In: Annual Reports on Fermentation Processes, Vol. I (ed. PerIman D.), pp. 267—297, Academic Press, New York.
Smith J. E., Berry D. R., Kristiansen B. (eds.) (1983). The Filamentous Fumgir Volume IV, Fungal Technology, Edward Arnold, London.
Получение химических веществ из биомассы
Curtin M. Е. (1983). Harvesting profitable products from plant tissue culture. Biotechnology, 1(8), 649—657.
Eveleigh D. E. (1983). Biological routes for cellulose utilisation. In: Biotech’83, Proceedings of the International Conference on the Commercial Applications and Implications of Biotechnology, pp. 539—548, Online Conferences Ltd., Midlesex1 UK.
Flinn J. E., Lipinsky E. S. (1983). Production of chemicals via advanced biotechnological processes. In: Biotech’83, Proceedings of the International Conference on the Commercial Applications and Implications of Biotechnology pp. 523—538, Online Conferences Ltd., Middlesex, UK.
Fowler M. W. (1981). Plant cell biotechnology to produce desirable substances Chern. Ind., 7, 229—233.
Jones L. Н. (1983). Plant cell cloning and culture products. In: Biotechnology (eds. Phelps C. F. and Clarke P. H.), pp. 221—232, Biochemical Society Symposium Number 48, Biochemical Society, London.
Staba E. J. (ed.) (1980). Plant Tissue Culture as a Source of Biochemicals, CRG Press, Boca Raton, Florida.
Перспективы развития
Brown G. B., Manecke G., Wingard L. B. {eds.) (1978). Enzyme Engineering, Vol. 4, Plenum Press, New York.
Klibanov A. M. (1983). Unconventional catalytic properties of conventional enzymes: applications in organic chemistry, Basic Life Sci., 25, 497—518.
Maugh T. H. (1984). Semisynthetic enzymes are new catalysts, Science, 223, 154—156.
Maugh T. H. (1984). Need a catalist? Design an enzyme, Science, 223, 269— 271.
Neidleman S. L., Geigert J. (1983). Biological galogenation and epoxidation. In: Biotechnology (eds. Phelps C. F. and Clarke P. H.), pp. 39—52, Biochemical Society Symposium Number 48, Biochemical Society, London.
Omata T., Iida T., Tanaka A., Fukui S. (1979). Transformation of steroids by gelentrapped Nocardia rhodochrous cells in organic solvents, Eur. J. appl. Microbiol. Biotechnol., 8, 143—155.
Pye E. K., Weetall H. H. (eds.) (1978). Enzyme Engineering, Vol. 3, Plenum Press, New York.
Ulmer K. M. (1983). Protein engineering, Science, 219, 666—671.
Wingard L. B., Berezin I. V., Klyosov A. A. (eds.) (1980). Enzyme Engineering, Future Directions, Plenum Press, New York.
Wiseman A. (ed.) (1977—1983). Topics in Enzyme and Fermentation Biotechnology, Vols. 1—7, Fillis Horwood, Chichester.

