ФЕРМЕНТЫ, РАСЩЕПЛЯЮЩИЕ КЛЕТОЧНЫЕ СТЕНКИ ЭНДОСПЕРМА ЯЧМЕНЯ
Солодбращению сопутствуют изменения в структуре эндосперма, в практике обычно называемые общим (цитолитическим) растворением зерна. Они возникают в ходе постепенного разрыхления первоначальной структуры зерна и катализируются ферментами, разрушающими материал клеточных стенок.
Браун и Моррис первыми установили, что растворение эндосперма происходит в результате ферментативных реакций. Так как действие этих ферментов в основном направлено на стенки клеток, то они были отнесены к группе. цито-гидролитических ферментов. Позднее это название было сокращено до «цитаз», а процесс разрыхления структуры зерна назван цитолизом.
Цитазы играют важную роль, хотя они образуют малоизученную группу ферментов. Сравнительно мало известен также и механизм прорастания семян, а также синтез целлюлозы, гемицеллюлоз и пектина в растениях, которые, несомненно, являются тоже ферментативными процессами.
Фермент, растворяющий стенки растительных клеток (цитаза), является комплексом ферментов, из которого до сих пор были более детально изучены лишь некоторые отдельные ферменты. Согласно Вейденхагену, многие из этих ферментов близки к гликозидазам, но все же различия между ними достаточно велики, чтобы отнести их к самостоятельной группе. Это ферменты экзоцеллюлярного типа. Их фосфорилирующая деятельность не выявлена.
СУБСТРАТЫ
Материал клеточных стенок эндосперма ячменя пока еще не удалось определить химически однозначно. Исследование растительных клеточных оболочек показало, что основу их. составляет скелет из микрофибрилл, окруженный инкрустирующими веществами.
Скелет образуют клетчатка (целлюлоза), полиглюкуроновые кислоты, связанные в целлюлозе либо в видесложных эфиров, либо через глюкозидную связь, и гёмйцеллюлозы, тоже химически связанные. Взаимное соотношение всех этих компонентов можно выразить целыми числами.
Инкрустирующим веществом j клеточных оболочек является древесная масса (лигнин) и гемицеллюлоза, нерастворимая в воде и имеющая иной состав, чем гемицеллюлозы, содержащиеся в скелете клетки.
Целлюлоза (клетчатка) – это нерастворимый полисахарид, образующий основную составную часть клеточных оболочек растительных клеток и главную составную часть опорных тканей растений.
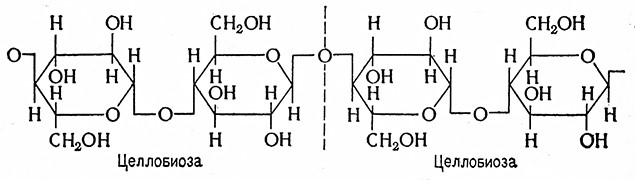
Молекулы целлюлозы образуют линейные цепи, в которых глюкозные остатки соединены в целлобиозные димеры. Отдельные крупные молекулы (макромолекулы) соединены водородными мостиками и образуют в определенном -геометрическом порядке прочные пучки микрокристаллической структуры, называемые мицеллами. Мицеллярная структура обусловливает механическую и химическую стойкость целлюлозы. Кристаллическая решетка бывает еще усилена неуглеводным компонентом, лигнином.
В результате ферментативного (частичного) гидролиза целлюлозы образуется смесь олигосахаридов, трисахаридов и тетрасахаридов, остальные-50% составляет целлобиоза. При полном гидролизе минеральными кислотами целлюлоза расщепляется до глюкозы.
У целлюлоз различного происхождения молекулярный вес колеблется от 250 000 до 2 000 000. Таким образом, молекула целлюлозы содержит от 1 400 до 10 000 глюкозных единиц. Мицеллы могут соединять до 60 молекул целлюлозы. В воде целлюлоза нерастворима.
Пo данным Прингсхайма, ячмень содержит кроме настоящей целлюлозы еще и запасную целлюлозу – лихенин, которая по химическому составу близка к целлюлозе. От настоящей целлюлозы лихенин отличается тем, что растворяется в горячей воде.
В природе целлюлозе сопутствуют гемицеллюлозы, которые значительно отличаются по химическому составу от целлюлозы. При гидролизе гемицеллюлоз образуются различные сахара: D-галактоза, L-арабиноза, D-глюкоза, D-ксилоза и уроновые кислоты, чаще всего D-галактуроновая или же D-глюкуроновая.
Ячмень содержит нерастворимые в воде гемицеллюлозы и растворимые слизеобразные вещества – гумми. Это полисахариды, содержащие гексозы и пентозы. Прис различает две группы гемицеллюлоз, растворимых в 4%-ном едком натре – гемицеллюлозы из оболочек ячменя и гемицеллюлозы из эндосперма.
Гемицеллюлозы из оболочек ячменя содержат некоторое количество уроновых кислот, много пентозанов и отличаются низкой удельной вязкостью. При переработке ячменя и солода в пивоваренном производстве эти гемицеллюлозы не растворяются и поэтому не влияют на технологию пивоварения. Главным компонентом клеточных стенок внутри эндосперма является гемицеллюлоза. Они не содержат уроновых кислот, состоят в основном из глюйозанов и характеризуются высокой удельной вязкостью, Прис выделил гумми осаждением 20%-ным раствором сульфата аммония. Он получил чистый β-глюкозан без пентоз, растворимый в воде. По Мередиту, гумми солода содержат больше пентоз, чем гумми ячменя. Люшингер с сотрудниками установил, что гумми, которые гидролизуются при солодоращении, состоят исключительно из глюканов. В ячмене они нашли от 6,2 до 6,7% гумми, осаждаемых ацетоном, а в солоде – от 2 до 2,3%.
Ксилан – полисахарид, содержащий преимущественно ксилозу (D-ксилопиранозу). Отдельные ксилозные единицы связаны друг с другом между атомами углерода 1 и 4, а иногда между атомами углерода 1 и 3. При гидролизе ксилана образуется D-ксилоза.
Mаннан – полисахарид, содержащий преимущественно маннозу.
Галактаны содержат очень много галактозы.
Пектиновые вещества – это полисахариды, состоящие из соединенных между собой остатков полиуроновых кислот, иногда с карбоксилами, этерифициг рованными или связанными с другими компонентами.
В растениях пектиновые вещества присутствуют в виде нерастворимых пектоцеллюлоз и протопектинов. Это комплексные соединения пектина с целлюлозой или же другими полисахаридами, связанные друг с другом мостиками фосфорной кислоты и ионами Ca+2 и Mg+2. Под действием разбавленных кислот образуется пектин, растворимый в воде и нерастворимый в этаноле и ацетоне. Разбавленные основания омыляют эфирные связи; отщепляется метанол и образуются пектиновые кислоты.
Пектин – метилированный сложный эфир галактуроновой кислоты – образуется из протопектина при действии разбавленными кислотами или же в результате ферментативного гидролиза. Остатки галактуроновой кислоты связаны α-глюкозидными 1,4-связями. Молекулярная масса пектина в зависимости от его происхождения колеблется от 20 000 до 150 000.
Ферментативное расщепление указанных субстратов в значительной степени зависит от их химического состава и физического строения, от структуры клетки, а иногда и отмакроструктуры. В клеточных стенках, содержащих лигнин, эти вещества, как правило, взаимосвязаны. Так, например, у целлюлозы аморфные фракции под воздействием ферментов быстрее расщепляются, чем кристаллические. У кристаллических ксиланов были выявлены большие различия, тогда как лихенин, хотя он хорошо диспергируется, ведет себя аналогично целлюлозе. В одеревеневших субстратах лигнин может физически связывать часть сахаридов.
Гидролиз глюкозидных связей указанных субстратов катализируют гидролазы глюкозидов и сахаридазы (3.2.1); гидролиз эфирных связей катализируют гидролазы эфиров карбоновых кислот (3.1.1).
ЦЕЛЛЮЛАЗА
Ферменты, катализирующие расщепление клетчатки (целлюлозы), широко распространены в природе в растительных материалах, особенно в семенах. О наличии целлюлазы (β-1,4-глюкан-глюкогидролазы, 3.2.1.4), в ячменном солоде, катализирующей расщепление природной целлюлозы, свидетельствуют данные, приведенные в различных источниках.
Результаты исследований дают основание предположить, что в комплексе солодовой цитазы отсутствует целлюлаза, способная катализировать расщепление природной целлюлозы. К такому выводу пришли первые исследователи в этой области Браун и Моррис (1895), которым не удалось расщепить инкрустированную целлюлозу ферментами солодового экстракта. Грюсс (1795) установил, что структура клеточных стенок в основном сохраняется при прорастании ячменя, но они становятся проницаемыми. Эти выводы были проверены Люерсом и Лойблом (1923). По их данным, содержание целлюлозы в ячмене при его прорастании не уменьшалось, а наоборот, несколько повышалось в конце прорастания, что связано с относительным увеличением нерастворимых веществ за счет использованного крахмала. Они установили, что целлюлаза в солоде отсутствует.
В отличие от них Прингсхайм и Бауэр (1928), а затем Цис (1931) и Отто (1929) обнаружили целлюлазу в ячменном солоде. Из продуктов гидролиза они выделили D-глюкозу. Пο данным Прингсхайма, полупродуктом ферментативного гидролиза является целлобиоза. Однако эти ученые для исследований использовали гидрат-целлюлозу, коллоидные растворы которой следует считать химически и физически измененными и поэтому более доступными для цитолиза, чем природная целлюлоза.
Эти положения, подтвержденные также микроскопическими исследованиями, дают основание сделать вывод, что изменения клеточных стенок при прорастании ячменя вызываются не целлюлазой, а другими ферментами, высвобождающими полиуроновые кислоты и расщепляющими гемицеллюлозы, тогда как целлюлозный скелет остается нетронутым.
ГЕМИЦЕЛЛЮЛАЗЫ (ЦИТАЗЫ)
Ферменты, катализирующие гидролиз клеточных стенок, довольно широко распространены в растениях, особенно в прорастающих семенах. Можно предполагать, что расщепление различных гемицеллюлоз катализируют разные гёМицеллюлазы, большинство которых пока ещё не изучено.
Один из ферментов – ксиланазу (ксилан-4-ксиланогидролазу, 3.2.1.8) – обнаружили в солоде Люерс и Фолькамер. Этот фермент расщепляет ксилан, выделенный из эндосперма ячменя или из сердцевины бузины до ксилозы. Оптимальная температура действия ксиланазы 45°С, оптимальная величина рН 5,0. При нагреве до 60°С фермент полностью разрушается в течение 15 мин. В результате ферментативного гидролиза ксилана образуется 75% ксилозы; образование ее замедляет дальнейшее расщепление. Это влияние продуктов расщепления не проявляется при прорастании ячменя, так как зародыш непрерывно использует образующуюся ксилозу. Ксиланазу можно отделить от амилазы повторной адсорбцией в слабокислой среде (рН 5) и элюированием фосфатным буфером (рН 8,3).
По данным Люерса и Малыпа, при прорастании ячмемя существенный рост активности ксиланазы наблюдгется только на четвертый день, т. е. в период, когда начинает сказываться растворение зерна.
Прис и Энсворт установили, что расщепление гемицеллюлоз и гумми катализируют при солодоращении:
- ферменты цитолитические, содержащиеся уже в ячмене, которые понижают вязкость в результате разрыва крупных молекул;
- ферменты цитолитические, образующиеся только при прорастании, которые проводят более глубокое расщепление молекул (до свободных пентоз).
Сандегрен и сотрудники установили, что в процессе участвует также трансглюкозидаза, катализирующая перенос остатков Сахаров, отщепленных от цепей других сахаридов.
Мак Леод и Миллар цитолитическую активность зерна объясняют деятельностью ферментов эндо-р-глюканазы и эндопентозаназы.
β-ГЛЮКОЗАНАЗЫ
Ферменты, катализирующие гидролиз β-глюкозанов, изучал Прис с сотрудниками. Они различают эндо-β-глюкозаназу, понижающую вязкость, и экзо-β-глюкозаназу, отщепляющую глюкозу и часть целлобиозы. Экзофермент при сушке разрушается. Затем было установлено, что активность глюкозаназы при солодоращении значительно возрастает, тогда как деятельность ферментов, катализирующих расщепление арабанов и ксиланов, усиливается незначительно.
ПОЛИГАЛАКТУРОНАЗА (ПЕКТИНАЗА)
Присутствие пектиназы (полигалактуронид-гликаногидролазы, 3.2.1.15) в ячмене пока что спорно. На основании работ Буржело и Герирсеу (1898), Kappe (1922) и Эрлиха (1927) считали, что срединные пластинки клеточных стенок эндосперма ячменя содержат также пектиновые вещества. Однако Финн и Юст (1937) доказали, что пектиновых веществ в ячмене и в солоде нет. Только в оболочках имеется небольшое количество галактуроновой кислоты, которая является составной частью полигалактуроновых кислот или же связана с гумми-веществами ячменя.
ОЛИГОСАХАРИДАЗЫ
Из ферментов этой группы в ячмене и солоде в основном содержится β-глюкозидаза (β-Б-глюкозид-глюкогидролаза, 3.2.1.21). Этот фермент гидролизует β-глюкозидные связи олигосахаридов и глюкозидов. Он гидролизует большое количество субстратов и поэтому имеет различные названия (целлобиаза,·генциобиаза). Возможно, что его взаимодействие с остальными ферментами, участвующими в расщеплении клеточных стенок эндосперма ячменя, обусловлено тем, что β-глюкозидаза катализирует гидролиз целлобиозы, образующейся в результате действия целлюлазы на клетчатку (целлюлозу). Оптимальное значение рН для деятельности этого фермента находится в пределах 4,0–4,5. При солодоращении содержание этого фермента возрастает по сравнению с его первоначальным количеством в ячмене в 3,5 раза.
ФЕРМЕНТЫ, РАСЩЕПЛЯЮЩИЕ КРАХМАЛ
Расщепление крахмала катализируют ферменты из группы глюкозидаз (3.2) при участии ферментов из группы трансглюкозидаз (2.4).
К ферментам первой группы относятся амилазы и амилоглюкозидазы, которые разрывают молекулу крахмала гидролизом α-глюкозидных связей. Равновесие этих реакций сильно сдвинуто в сторону расщепления, а потому они практически необратимы.
К ферментам второй группы относятся гексозилтрансферазы, в частности α-глюканфосфорилаза, и некоторые нефосфорилирующие ферменты, такие, как циклодекстриназа, амиломальтаза, амилосахараза. При катализируемых ими реакциях фосфорные и гликозильные группы переносятся с одной молекулы на другую. Большинство этих реакций необратимы.
СУБСТРАТЫ
Естественным и имеющим большое значение в технологии субстратом ячменной и солодовой амилазы является крахмал. Природный крахмал – это не химически индивидуальное, а гетерогенное вещество, содержащее в зависимости от его происхождения от 20 до 25% амилозы и от 75 до 80% амилопектина (фракции А и В, по Шоху, или же амилозы и изоамилозы, по Самцу).
Амилоза состоит из длинных, неразветвленных цепочек молекул α-глюкозы (α-глюкопиранозы), соединенных друг с другом глюкозидными связями в положении α-1,4.
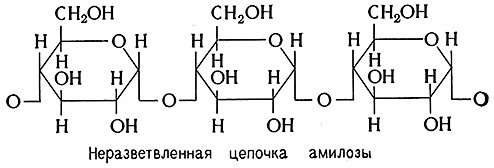
Количество молекул глюкозы, образующих цепочку, неодинаково, оно колеблется в пределах от 60 до 600 единиц. Этому соответствуют молекулярные массы от 10 000до 100 000. Таким образом, амилоза является смесью полимериых гомологов с цепочками различной длины. Предполагают, что неразветвленные цепочки амилозы не прямые, а спиралеобразные.
Амилоза растворима в воде, с йодом окрашивается в синий цвет. По Мейеру (1940), амилоза под действием β-амилазы полностью гидролизуется до мальтозы.
Амилопектин образует короткие разветвленные цепочки. Поэтому кроме связи в положении а-1,4 встречаются также связиа-1,6; амилопектин имеет следующую разветвленную структуру по (Лернеру и Кори):
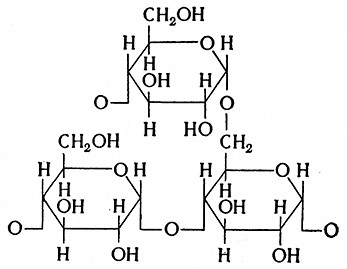
Суммарное количество глюкозных остатков в молекуле колеблется; в среднем оно составляет 3 000. Разветвление цепочки наступает примерно при наличии более 30 глюкозных единиц, так что в молекуле амилопектина имеется около 90 связей α-1,6. По Мак Леоду, ячменный амилопектин содержит в молекуле от 24 до 26 глюкозных единиц, а солодовый амилопектин – только от 17 до 18 глюкозных единиц. Молекулярная масса этого амилопектина высокая и может колебаться от 10 000 до 1 000 000.
Амилопектин содержит Небольшое количество фосфорной кислоты (0,175% P2O5), образующей соединения типа сложных эфиров.
Крахмальный клейстер образуется при нагревании взвеси крахмала в воде. При медленном нагревании зерна крахмала в воде сначала набухают и при определенной температуре образуется вязкий гель (крахмальный клейстер).
Температура клейстеризации зависит от происхождения крахмала. Лe Корвойзе указывает следующие температуры (в °C) клейстеризации:

Температура клейстеризации непостоянна. Она колеблется и у крахмала одного и того же происхождения в зависимости от структуры его зерен, которые являются сферокристаллами, состоящими из множества мицелл, а также от некоторых физических и физико-химических факторов. Чем медленнее нагревается суспензия крахмала, тем лучше набухают отдельные зерна и тем при более низкой температуре наступает клейстеризация. На поглощение воды влияет также характер суспензии крахмала. По Нейману, мелкие зерна труднее клейстеризуются, чем крупные.
Наличие электролитов (ионов) в среде влияет на температуру клейстеризации крахмала и сказывается либо положительно, либо отрицательно. Низкие концентрации кислот затрудняют клейстеризацию, высокие же концентрации ускоряют ее, однако здесь Н-ионы оказывают уже и химическое действие. Как правило, щелочи способствуют клейстеризации.
Важное технологическое значение имеет температура клейстеризации солодового крахмала, который является основным субстратом амилаз при производстве пива.
Гейнтц указывает-, что температура клейстеризации солодового крахмала зависит от климатических условий созревания пивоваренного ячменя. Солодовый крахмал из ячменей, выращенных в холодных районах, начинает клейстеризоваться при 50–52°С, выросших в умеренно теплых районах – при 52–53°С, а в теплых районах – при 54-57°С.
Растворимый крахмал – это продукты, полученные из природного крахмала, например, под действием разбавленных кислот (Линтнер), щелочей (Вроблевский), окисляющих веществ (Синивский) или же частичным ферментативным гидролизом. Препараты, полученные таким образом, не отличаются по форме своих зерен от исходного крахмала. При нагревании с водой растворимый крахмал дает раствор, не образующий клейстера после остывания. В некоторых случаях происходит растворение крахмала и в холодной воде. Растворимый крахмал служит стандартным субстратом для определения диастатической силы.
Субстратом амилаз являются также некоторые продукты неполного гидролиза крахмала, называемые декстринами. Это аморфные вещества, растворимые в воде. В зависимости от длины их цепочки они дают с раствором йода различные цветные реакции. Декстрины, состоящие из 4–6 остатков глюкозы, не окрашиваются йодом (ахродекстрины), содержащие 8–12 глюкозных остатков, окрашиваются йодом в красный цвет (эритродекстрины), а декстрины, образующие цепи из 30-35 остатков глюкозы, окрашиваются йодом уже в синий цвет (амилодекстрины).
Субстратом амилаз является также гликоген, представляющий собой физиологически важное резервное вещество животного происхождения, по структуре подобное крахмалу. Гликоген состоит, как и амилопектин, из разветвленных глюкозных цепочек. Разветвления более многочисленны в среднем после трех глюкозных остатков; цепочки гликогена короче и содержат на конце от 6 до 7 глюкозных остатков. Молекулярная масса гликогена от 1 000 000 до 4 000 000.
АМИЛАЗЫ
Амилазы – ферменты, расщепляющие крахмал. Из ферментов прорастающего ячменя амилазы имеют наибольшее промышленное и биологическое значение. Амилазы более изучены по сравнению с другими ферментами растительного происхождения. Однако их способ действия еще и до сих пор не изучен окончательно.
Пайен и Персоз (1833) обнаружили амилазу в прорастающем ячмене и называли ее «диастаза». В зернах непроросшего ячменя амилазу обнаружили Линтнер и Экхард (1899). Она отличалась от амилазы прорастающих зерен тем, что иначе расщепляла крахмальный клейстер.
Наличие обоих этих ферментов доказал Олссон. Coгласно его первоначальной теории эти ферменты взаимодействуют при осахаривании крахмала – первый из них (амилаза) расщепляет крахмал до декстринов, а второй (декстриназа) расщепляет декстрины до мальтозы. В дальнейшем Олссон и Нортроп показали, что оба эти фермента действуют одновременно; это две различные амилазы, расщепляющие крахмал до мальтозы и декстринов. Одна из них катализирует реакцию, при которой быстро исчезает синяя окраска с раствором йода, но мальтозы образуется сравнительно мало. Эту амилазу Олссон назвал декстринирующей амилазой (декстриногенной). Другая амилаза катализирует реакцию, при которой синяя окраска с йодом исчезает только тогда, когда образуется большое количество мальтозы. Эту амилазу Олссон назвал осахаривающей (сахарогенной). По терминологии, введенной Кюном, декстринирующая амилаза называется α-амилазой, а осахаривающая амилаза – β-амилазой, причем различают эти амилазы по оптической форме образующегося сахара (α-мальтоза илр β-мальтоза). Позднее было доказано, что β-амилаза содержится в непроросшем ячмене и что при солодоращении ее содержание возрастает. α-Амилаза же является типичным компонентом солода и активируется только при прорастании; в ячмене Следы α-амилазы были обнаружены только недавно.
ИЗМЕНЕНИЯ СУБСТРАТА ПРИ РАСЩЕПЛЕНИИ, КАТАЛИЗИРУЕМОМ АМИЛАЗАМИ
Гидролитическое расщепление крахмала, катализируемое амилазами (амилолиз), включает в себя процессы разжижения, декстринизации и осахаривания. До сих пор еще не удалось установить, катализирует ли разжижение крахмала какой-либо другой фермент.
Предполагают, что деятельность двух амилаз дополняется деятельностью α-глюкозидазы (мальтазы) и трансглюкоз идаз.
Гидролитическое расщепление, катализируемое амилазами, происходящее в растворах амилозы, амилопектина, крахмального клейстера и гликогена, можно наблюдать по характерным изменениям свойств субстрата, а именно:
- увеличению восстанавливающей способности, вызываемому освобождением глюкозидных гидроксилов;
- изменению цветной реакции с раствором йода: первоначальная синяя окраска переходит постепенно в фиолетовую, красную и бурую; одновременно с изменением цвета уменьшается интенсивность окраски, которая затем совершенно исчезает; этот фактор объясняют декстринизацией крахмала;
- понижению вязкости; быстрое относительное понижение вязкости крахмального клейстера связано с разжижением крахмала;
- изменению удельного вращения; первоначальное высокое правое вращение раствора амилопектина (растворимого крахмала) [α]D = + 200° уменьшается до конечного значения [α]D = + 130°С. Одновременнос понижением удельного вращения растворы после введения в них карбоната натрия проявляют мутаротацию;
- осветлению мутного раствора гликогена, поддающемуся наблюдению нефелометрическим методом.
Характеристика α-амилазы и β-амилазы
Эти амилазы можно различить между собой путем количественного определения изменений свойств субстрата при катализируемом ими гидролизе (рис. 1).
- α-Амилаза – вызывает исключительно быстрое понижение вязкости крахмального раствора, но его восстанавливающая способность возрастает очень медленно;
- окраска, возникающая в результате реакции растворов амилопектина с йодом, очень быстро изменяется от фиолетовой через красную и бурую до полного обесцвечивания (ахроматическая точка), причем еще при низкой восстанавливающей способности раствора;
- удельное вращение раствора равномерно падает; после введения карбоната натрия раствор дает мутаротацию, значение которой ниже непосредственно измеряемых значений удельного вращения;
- мутность раствора гликогена быстро исчезает.
- β-Амилаза – вязкость крахмального клейстера понижается медленно и также медленно исчезает мутность раствора гликогена, а восстанавливающая способность равномерно повышается;
- окраска в результате реакции с йодом переходит довольно медленно в фиолетовую и, наконец, в красную, но не доходит до бесцветной реакции (ахроматической точки);
- удельное вращение сначала резко падает, затем лишь незначительно понижается; в присутствии карбоната натрия происходит мутаротация.
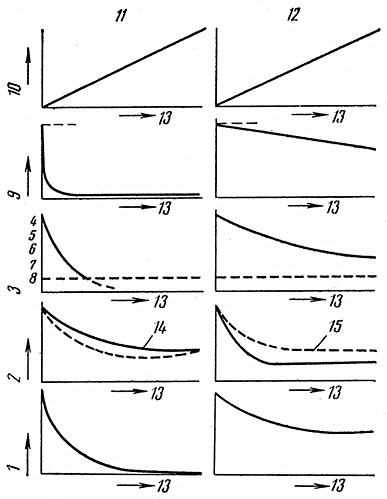
Рис. 1. Характеристика амилаз (П. Бирнфилд):
1 – мутность раствора гликогена; 2–оптическое вращение; 3–йодная реакция; 4– синяя; 5 – фиолетовая; 6 – красная; 7 – бурая (коричневая); 8 – бесцветная; 9 – относительная вязкость; 10 –восстанавливающая способность; 11– α -амилаза (декстринарующая); 12 – β-амилаза (осахаривающая); 13–время; 14,15 – мутаротация.
СОЛОДОВАЯ α-АМИЛАЗА
Чистую, кристаллическую солодовую а-амилазу (рис. 2) (α-1,4-глюкан-4-глюканогидролазу, 3.2.1.1) получили Швиммер и Боллс из коммерческого солодового экстракта шестидесятипятикратной очисткой путем абсорбции на крахмале из раствора, содержащего 40% этанола, и последующего элюирования насыщенным водным раствором сульфата кальция (по Гольмбергу). После четырехкратной перекристаллизации выход был равен 29%.
Чистая солодовая α-амилаза содержит 13,4% азота и 0,01 % фосфора. Она активируется в присутствии ионов кальция, которые заметно повышают ее стабильность. Вещества, коагулирующие ионы кальция (0,01 M тетрафосфат или же 0,01 M гексаметафосфат), инактивируют а-амилазу. Этим чистая солодовая α-амилаза отличается от β-амилазы. Чистая α-амилаза чувствительна к повышенной кислотности (она кислотонеустойчива) и инактивируется подкислением солодового экстракта до рН 3,3 при 0°С или до рН 4,2–4,3 при 20°С. Фермент стабилен при рН от 5 до 9 с оптимумом активности при рН от 5 до 6.
а-Амилаза, содержащаяся в солодовых экстрактах, выдерживает нагревание до 70°С в течение 20 мин. Этим она отличается от β-амилазы, которая в этих условиях необратимо инактивируется. Стабильность чистых препаратов α-амилазы при высоких температурах намного ниже стабильности неочищенных растворов. Различия в таких случаях объясняются не свойствами самого фермента, а наличием стабилизаторов в естественной среде.
Рис. 2. Кристаллическая солодовая α-амилаза (Швиммер и Боллс).
Солодовая α-амилаза активируется, освобождается или образуется при прорастании ячменя. По Люерсу, а-амилаза появляется примерно на четвертый день проращивания, а ее максимальное количество в зеленом солоде образуется примерно на восьмой день.
Декстринирующая солодовая α-амилаза, как и амилаза плесеней (такадиастаз), бактерий (суперластаза, биолаза) и амилазы животного происхождения (панкреатическая, птиалин), катализирует гидролитическое расщепление α-1,4-глюкозидных связей. При этом разрываются молекулы обоих компонентов крахмала, т. е. амилозы и амилопектина; происходит разжижение и декстринизадия, сопровождающиеся быстрым уменьшением вязкости.
Молекула амилозы с длинными неразветвленными цепями разрывается при гидролитическом расщеплении. В первой фазе реакция протекает быстро и в результате образуются α-декстрины с короткими цепями и низким молекулярным весом. В зависимости от длины цепей эти декстрины дают с раствором йода окраску, переходящую от фиолетовой через красную до бурой. α-Декстрины постепенно продолжают расщепляться до полисахаридов с еще более низкой молекулярной массой, которые не дают цветной йодной реакции.
Глюкозидные связи амилозы разрушаются внутри цепей беспорядочно, и только их концевые связи не гидролизуются. Некоторые ученые полагают, что четыре связи на конце каждой цепочки разрушаются с меньшей скоростью, чем остальные связи.
Во второй фазе реакции, протекающей значительно медленнее, образуется смесь мальтозы и мальтотриозы, или же мальтотриоза медленно продолжает расщепляться до мальтозы и глюкозы. После окончания реакций раствор содержит около 87% мальтозы и ,13% глюкозы. Восстанавливающие сахара и декстрины образуются в оптической α-форме и проявляют мутаротацию. Образующаяся при этом мальтоза действует как неспецифический ингибитор.
Действие -амилаз на амилозу показано на рис. 3.
Рис. 3. Действие амилаз на амилозу (Мейер):
а – действие α-амилазы; б-действие β-амилазы.
На основании исследований было установлено, что α-декстрины, образовавшиеся при действии а-амилазы на амилозу, соответствуют в большинстве случаев по величине молекуле гексаозы, т. е. полисахарида, содержащего 6 молекул глюкозы. Быстрое образование этих декстринов объясняется тем, что α-амилаза разрывает амилозную цепь по частям, соответствующим шести молекулам глюкозы. Такому же числу молекул глюкозы соответствует также один виток спирально свернутой молекулы амилозы.
Нормальный ход расщепления амилозы а-амилазой иногда нарушается образованием в растворе частиц, устойчивых к действию фермента. Чем ниже концентрация раствора, тем меньше образуется комплексных соединений фермента с субстратом и тем большая часть амилозы остается устойчивой к действию фермента. Таким образом, расщепление амилозы α-амилазой зависит от концентрации фермента.
Аналогично α-амилаза на коротких разветвленных цепочках амилопектина разрывает α-1,4-глюкозидные связи. При этом образуются сначала декстрины со средней молекулярной массой, дающие с раствором йода от красной до бурой окраску, и небольшое количество мальтозы. Восстанавливающая способность раствора после исчезновения йодной реакции зависит от степени разветвления и от степени полимеризации исходного субстрата, поэтому она различается у амилопектинов из разных видов крахмала. Если образуются декстрины с низкой молекулярной массой, то окраска от цветной реакции с растворомйода исчезает быстрее, а мальтозы затем образуется больше и одновременно появляется немного глюкозы. Далее можно обнаружить разветвленные и неразветвленные конечные декстрины, т. е. гепта-, гекса-, пента-, тетраи трисахариды, а также мальтозу, изомальтозу и глюкозу.
Конечный продукт расщепления амилопектина а-амилазой представляет собой смесь, состоящую примерно из 19% глюкозы, 73% мальтозы и 8% изомальтозы (рис. 4).
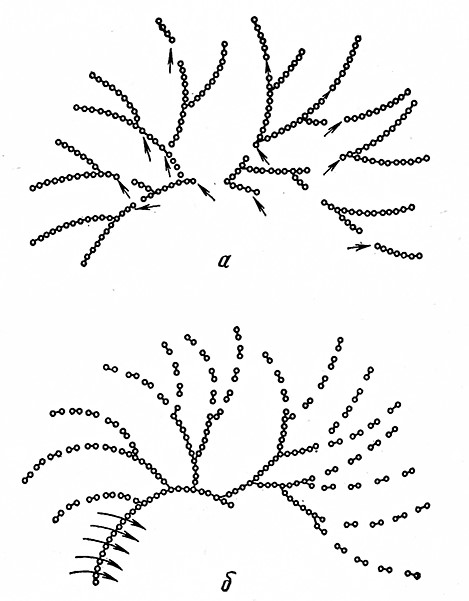
Рис. 4. Действие амилаз на амилопектин (Мейер):
α – действие α-амилазы: б – действие β-амилазы.
Крахмальный клейстер содержит как амилозу, так и амилопектин в кристаллическом состоянии, образующий исключительно большие частицы. Под действием солодовой α-амилазы на крахмальный клейстер происходит одновременно гидролиз α-1,4-глюкозидных связей амилозы и амилопектина. Разрыв некоторых глюкозидных связей понижает число крупных единиц, что значительно уменьшает вязкость крахмального клейстера. По Бирнфилду, содержание зерен, образующих крахмал, уменьшается до 0,01 своего первоначального значения уже при расщеплении 0,1% глюкозидных связей. Существенное уменьшение вязкости наступает тогда, когда гидролизуется столько глюкозидных связей, что восстанавливающая способность начинает увеличиваться быстро и ее приращение уже не поддается измерению. Это обстоятельство привело Бирнфилда к неправильному выводу, что будто бы разжижение и осахаривание вызываются двумя различными ферментами.
ЯЧМЕННАЯ И СОЛОДОВАЯ β-АМИЛАЗА
Кристаллическая β-амилаза (α-1,4-глюкан-мальтогидролаза, 3.2.1.2) выделяется из водного раствора ячменной муки путем вымораживания и последующего высушивания в вакууме. Если β-амилазу получают из солода, то сначала необходимо инактивировать α-амилазу подкислением экстракта до рН 3,3 при 20°С в течение 15 мин, а затем изменить рН буфером до 6,0. В последнее время кристаллическая β-амилаза была выделена из солода; после 15-кратной очистки выход был 10%.
Чистая β-амилаза (рис. 5) – это белковое вещество, очень хорошо растворимое в воде. Она содержит 14,1% азота. β-Амилаза не активируется ионами Ca2+ (в отличие от α-амилазы), и ее деятельность не усиливается в присутствии Cl-ионов. Ионы тяжелых металлов (меди, серебра и ртути) инактивируют β-амилазу необратимо.
Рис. 5. Кристаллическая β-амилаза из финского сорта ячменя Пиркка (Реиндела Белоглавек).
По Вейлю и Кадуэллу, активность β-амилазы существенно зависит от наличия SH-групп и тирозина. В первом случае инактивирующее действие оказывает окисление SH-групп в S – S-связи. Это инактивирование обратимо и его можно снять восстановлением сероводородом.
Диапазон стабильности фермента при рН от 4 до 8, оптимум активности при рН от 4,5 до 5.
Осахаривающая ячменная и солодовая β-амилаза обладает большой способностью катализировать расщепление растворимого крахмала в мальтозу. Нерастворимый природный крахмал и крахмальный клейстер не разжижаются.
Расщепление амилозы, катализируемое β-амилазой, является самым простым случаем ферментативного гидролиза амилозы. В длинных неразветвленных цепочках амилозы β-амилаза расщепляет а-1,4-глюкозидные связи от восстанавливающих (неальдегидных) концов цепочек. Одновременно α-глюкозидная конфигурация около атома углерода альдегидной группы, возникшей в результате гидролиза, превращается в β-глюкозидную. Мальтоза постепенно по одной молекуле отщепляется от отдельных цепочек, которые соответственно укорачиваются. Синяя окраска при реакции с йодом не меняется даже при высокой концентрации мальтозы. Это объясняется тем, что остатки цепочек долго сохраняют характер амилозы. Когда остатки цепочек становятся очень короткими, синяя окраска через фиолетовую и красную совершенно исчезает (раствор обесцвечивается).
Амилоза гидролизуется β-амилазой до мальтозы полностью.
Мальтоза образуется в оптической β-форме. Однако в обычных экспериментальных условиях образование мальтозы замедляется вследствие возникновения крупных частиц амилозы, устойчивых к воздействию фермента. Это связано со старением раствора амилозы, в котором происходит ретрограда дня. Поэтому для полного осахаривания необходимо в раствор β-амилазы добавить по каплям щелочной раствор, содержащий амилозу в сильно диспергированном состоянии. В этих условиях образование комплекса фермента с субстратом происходит значительно легче, чем тогда, когда реагируют частицы амилозы различной величины. Комплекс амилоза-β-амилаза не подвержен ретроградации, так что он не препятствует полному превращению амилозы в мальтозу.
Расщепление амилопектина, β-катализируемое β-амилазой, протекает аналогично расщеплению амилозы. Однако у разветвленной молекулы амилопектина фермент атакует одновременно многие боковые цепочки. Поэтому начальная скорость реакции в данном случае значительно выше, чем при гидролизе амилозы. От отдельных цепочек постепенно отщепляются молекулы мальтозы с невосстанавливающих концов вплоть до мест разветвления, где имеются связи α-1,6, перед которыми гидролиз прекращается. Всего образуется около 42% теоретического количества мальтозы (Самец, 1935), т. е. около 60% амилопектина при этом расщепляется до мальтозы и высокомолекулярных (конечных) декстринов (Бирнфилд, 1951). Эти декстрины дают с раствором йода красную окраску, не сбраживаются и не обладают восстанавливающей способностью. Мальтоза и декстрины образуются в оптической β-форме.
Предел расщепления амилопектина зависит от степени его разветвления и от происхождения. На молекулярную массу конечного декстрина влияют молекулярная масса исходного субстрата и степень его разветвления.
Вязкость крахмального клейстера уменьшается под действием β-амилазы лишь незначительно. Это объясняется тем, что β-амилаза действует только на глюкозидные связи и не может действовать на огромные частицы крахмального клейстера.
ОДНОВРЕМЕННОЕ ДЕЙСТВИЕ α-АМИЛАЗЫ И Β-АМИЛАЗЫ
Амилаза (диастаза), содержащаяся в обычном и в специальном диастатическом солоде, является естественной смесью α-амилазы и β-амилазы. Осахаривающая β-амилаза активна уже в непроросшем ячмене и ее содержание возрастает при солодоращении. В солоде эта амилаза колиичественно преобладаёт над декстринирующей α-амилазой, почти все количество которой активируется только при прорастании ячменя.
При одновременном действии обеих амилаз гидролиз крахмала проходит значительно глубже, чем при воздействии каждого из этих двух ферментов в отдельности. Предельный выход мальтозы – 75–80%. В присутствии дрожжей, содержащих а-1,4-глюкан-глюкогидролазу (3.2.1.33), крахмал расщепляется полностью (Гопкинс, 1933).
Осахаривание амилозы и концевых групп боковых цепей амилопектина начинает β-амилаза с невосстанавливающего конца, α-амилаза же атакует молекулы субстрата внутри цепочек беспорядочно.
Низкомолекулярные и высокомолекулярные (конечные) декстрины образуются как и мальтоза, в результате действия α-амилазы на амилозу и на амилопектин. Высокомолекулярные декстрины образуются и под действием β-амилазы на амилопектин. Это – декстрины типа эритрогранулозы, и α-амилаза гидролизует их вплоть до связей α-1,6, что образует новый субстрат для действия β-амилазы. Таким образом, α-амилаза повышает эффективность действия β-амилазы. Кроме того, β-амилаза атакует декстрины типа гексаозы, образующиеся при гидролизе амилозы α-амилазой.
Схема амилозных и амилопектиновых компонентов крахмала и продуктов их ферментативного расщепления представлена на рис. 6.

Рис. 6. Схема амилозных и амилопектиновых компонентов крахмала и продуктов их ферментативного расщепления (Гаррис):
1 – амилоза; 2– амилопектин; 3 – β-амилаза; 4– α-амилаза; 5– декстрины с линейной цепью; 6 – мальтоза; 7 – мальтотриоза; 8 – конечые β-декстрины; 9 – декстрины с разветвленной цепью; 10– глюкоза; 11–конечная декст). наза; 12 – полная a-+-β-амила а; 13 – кислота; 14 – изомальтоза; 15 – конечные декстрины; 16 – глюкозидная α-1,6-связь; 17 – глюкозидная α-1,4 связь.
Декстрины с линейными цепями осахариваются обеими амилазами. При этом β-амилаза образует мальтозу и немного мальтотриозы, а α-амилаза – мальтозу, глюкозу и мальтотриозу, которая затем расщепляется до мальтозы и глюкозы. Декстрины с разветвленными цепями разрываются вплоть до мест разветвления. При этом возникают низкомолекулярные декстрины или же олигосахариды, главным образом трисахариды и изомальтоза. Разветвленные остаточные продукты, которые уже больше не гидролизуются ферментами, называются конечными декстринами; они составляют 25–30%.
ГИДРОЛАЗЫ ГЛИКОЗИДОВ (САХАРИДАЗЫ)
К этой группе относятся несколько гидролизующих ферментов ячменя и солода, имеющих второстепенное значение. В отличие от амилаз сахаридазы катализируют не гидролиз крахмала, амилозы, амилопектина и гликогена, а гидролиз некоторых-продуктов их расщепления. Их реакции аналогичны реакциям амилаз и они практически необратимы. Сахаридазы действуют как на α-1,4-цепи, так и на α-1,6-цепи, тогда как амилазы специфичны только в отношении а-1,4цепей. Ни одна из сахаридаз не была получена в чистом виде.
В ячмене и солоде из сахаридаз были обнаружены, в частности, α-глюкозидаза или мальтаза (Линг и Наньи, 1923 и Прингсхайм и Лейбович, 1926), β-глюкозидаза или целлобиаза (ван Лаер, 1931) и β-фруктозидаза, т. е. сахараза или инвертаза.
а-Глюкозидаза (a-D-глюкозид-глюкогидролаза, 3.2.1.20) катализирует гидролиз α-глюкозидных связей. Она содержится вместе с амилазами во всех растительных клетках и клетках животного происхождения, в которых образуется или расщепляется крахмал или гликоген. При прорастании ячменя ее содержание возрастает и зеленый солод содержит уже примерно в два раза больше α-глюкозидазы, чем исходный ячмень. Эта глюкозидаза содержится также в пивоваренных дрожжах. Она гидролизует мальтозу, образовавшуюся в процессе амилолиза, до глюкозы. Этот фермент чувствителен к изменениям кислотности среды. β-Глюкозидаза (β-D-глюкозид-глюкогидролаза, 3.2.1.21) гидролизует β-глюкозидные связи олигосахаридоd и глюкозидов. Характерными субстратами являются амигдалин и салицин. В качестве компонента солода она значения не имеет.
β-Фруктофуранозидаза (β-D-фруктофуранозид-фруктогидролаза, 3.2.1.26) гидролизует сахарозу до глюкозы и фруктозы. Из производных сахарозы она гидролизует также другие β-фруктозиды, например рафинозу, генцианозу, стахиозу и др. В ячмене и солоде она имеет большее значение, чем β-глюкозидаза. Под ее воздействием образуется, по всей вероятности, сахароза, которая в небольших количествах содержится в солоде.
ТРАНСГЛЮКОЗИЛАЗЫ
К группе трансглюкозилаз (гликозилтрансфераз, 2.4) относятся негидролизующие ферменты, катализирующие реакции, механизм которых аналогичен гидролазам. Глюкозидные цепи полисахаридов (А – О – В), однако, при этих реакциях разрываются не при участии H2O, а при реакции с ROH, происходит перенос глюкозильных групп с одного остатка (В) на другой (R):
А–О–В + ROH ⇄ А–О–R + В–ОН.
При реакциях этого -типа энергия не выделяется вовне, либо потому что она мала, либо потому что не превращается в тепловую энергию. В связи с этим эти реакции обратимы.
Название «трансглюкозилазы» предложили Дудоров с сотрудниками (1947). Обычно различаются трансглюкозилазы фосфорилирующие, т. е. фосфорилазы, и трансглюкозилазы не фосфорилирующие.
Реакции синтеза и расщепления крахмала и подобных полисахаридов, катализируемые трансглюкозил азами, можно вывести из общего уравнения (Бирнфилд) подстановкой вместо R, X и Y.
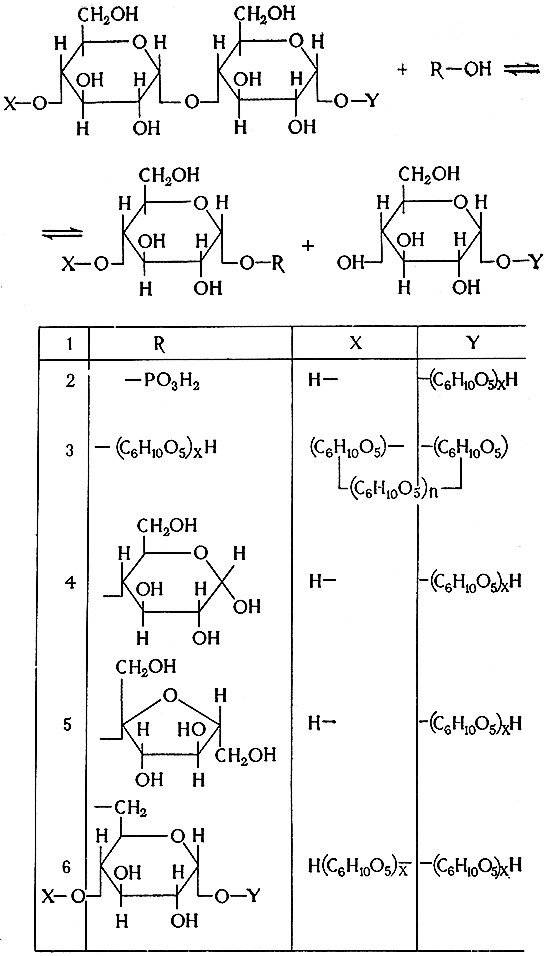
1 – фермент» 2 – α-глюканфосфорилаза (а-1,4-глюкан: ортофосфат-глюкозил-трансфераза, 2.4.1);
3 – циклодекстриназа (декстрин: α-1,6-глюкан-6-глюкозил-трансфераза, 2.4.1.2);
4 – амиломальтоза (α-1,4-глюкан: D-глюкоза-4-глюкозилтрансфераза, 2.4.1.3);
5 – амилосахараза (α-1,4-глюкан-D-фруктоза-2-глюкозилтрансфераза, 2.4,1.4);
6 – Q-фермент (α-1,4-глюкан: α-1,4 глюкан-6-глюкозилтрансфераза, 2.4.1.18).
α-Глюканфосфорилаза катализирует реакцию менаду крахмалом (гликогеном) или некоторыми продуктами их расщепления и фосфатом, включая фосфаты гексозы. Это – обратимые реакции, протекающие при расщеплениях и синтезах в метаболизме полисахаридов. Они имеют большое физиологическое значение.
α-Глюканфосфорилаза специфична в отношении α-1,4-глюкозидных связей. Однако она, как правило, сопутствует другим ферментам и в смеси с ними может расщеплять и синтезировать α-1,6-глюкозидные связи. Глюканфосфорилаза, специфичная в отношении α-1,6-глюкозидных связей, найдена также в дрожжах.
Нефосфорилирующие трансглюкозилазы катализируют, в частности, следующие обратимые реакции:
- циклодекстриназа: циклогексаамилоза + мальтоза ⇄ нециклический полиглюкозан;
- амиломальтазаг n мальтоза ⇄ полисахарид + n глюкоза;
- амилосахараза: n сахароза ⇄ амилопектиноподобный полисахарид + n фруктоза;
- Q-фермент: амилоза ⇄ амилопектин (трансгликозилирование).
ФЕРМЕНТЫ, РАСЩЕПЛЯЮЩИЕ БЕЛКОВЫЕ ВЕЩЕСТВА ЯЧМЕНЯ И СОЛОДА
Расщепление белков (протеолиз) катализируют протеолитические ферменты или протеазы (пептид-гидролазы, 3.4), способные гидролизовать пептидные связи (– СО – NH –). Они относятся к двум группам, включающим эндопептидазы, т. е. протеиназы (пептид-пептидогидролазы, 3.4.4), и экзопептидазы, т. е. пептидазы (дипептидгидролазы, 3.4.3). Эндопептидазы катализируют расщепление пептидных связей внутри молекул белков, а экзопептидазы расщепляют преимущественно концевые связи.
Протеазы обычно подразделяют на три группы по условиям их активирования. Первая группа включает в основном протеазы, участвующие в пищеварении, такие, как пепсин, трипсин и т. д. Эти ферменты образуются в виде проферментов (зимогенов) и нуждаются в активаторах. Протеазы второй группы активируются цианидами, аскорбиновой кислотой, цистеином и глютатионом; к ним относятся папаин, фицин и другие растительныеферменты (в том числе протеазы ячменя и солода) и некоторые животные ферменты внутриклетЬчного происхождения, например катепсин. Третью группу образуют протеазы, являющиеся металлопротеидами. Их активность зависит от присутствия ионов металла, например Mn2+, Mg2+, Zn2+, Co2+, и понижается при связывании этих металлов.
Ячмень и солод содержат одну протеазу из группы эндопептидаз (протеиназ) и не менее двух экзопептидаз (пептидаз). Они дополняют друг друга вследствие различного характера их гидролизующего действия. Естественными субстратами этих ферментов являются белковые вещества ячменя и продукты их расщепления.
СУБСТРАТЫ
Белковые вещества или протеины являются сложными продуктами конденсации α-аминокислот, связанных друг с другом пептидными связями. Они имеют очень высокую молекулярную массу, например для ячменного глобулина (эдестина) она равна 208 000.
Некоторые белковые вещества образуют линейные цепи связанных пептидными связями аминокислот со свободными концевыми аминными (– NH2) и карбоксильными группами (–СООН), например
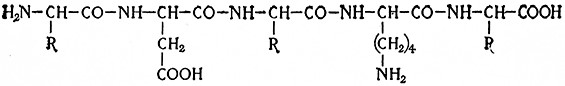
Кроме того, в молекуле белков могут находиться также свободные аминогруппы и карбоксильные группы, не являющиеся концевыми группами аминокислот; это могут быть аминогруппы диаминокарбоновых кислот и карбоксильные группы дикарбоновых кислот. И, наконец, некоторые белковые вещества имеют пептидные цепи, замкнутые в кольцо, так что они не имеют концевых аминных или карбоксильных групп.
Белки имеют исключительно важное физиологическое значение. Они являются главной составной частью многих живых клеток, так что и сама жизнь тесно связана с метаболизмом белковых веществ. В микроорганизмах и высших растениях аминокислоты образуются из простых неорганических веществ. Многие микроорганизмы используют для их синтеза даже азот воздуха. В отличие от этого животные организмы образуют свои белковые вещества из аминокислот.
Белки имеют следующий химический состав (в %):·

Основной составной частью белковых веществ различного происхождения является азот, содержание которого обычно определяют методом Кьельдаля. Умножением содержания азота в процентах на коэффициент 6,25 получают содержание белковых веществ.
Для качественного определения содержания белковых веществ пользуются цветными реакциями и реакциями осаждения, самыми распространенными из которых являются следующие.
Биуретовая реакция (тест Бюре) – это реакция на присутствие пептидных групп; в растворе белкового вещества появляется фиолетовое окрашивание после прибавления нескольких капель разбавленного раствора сернокислой меди, подщелоченного едким натром.
Миллонова реакция (тест Миллона) – это реакция на фенольные группы тирозина, входящего в состав многих белков. При нагревании с азотнокислой ртутью и свободной азотной кислотой (реактивом Миллона) в растворе, содержащем белковые вещества, образуется красный осадок, который при последующем нагревании чернеет.
Тест Гопкинса-Коло – это реакция на триптофан. Если в раствор белковых веществ, в который уже внесена глиоксиловая кислота, добавить концентрированную серную кислоту, то в присутствии триптофана на границе обеих жидкостей образуется фиолетовое кольцо. Ксантопротеиновая реакция (тест Геллера) – в прозрачном растворе белкового вещества после введения концентрированной азотной кислоты появляется белый осадок, который при кипячении желтеет, а затем при подщелачивании становится оранжевым. Тест положителен в присутствии аминокислот с бензольным ядром, т. е. тирозина и триптофана.
Многие белковые вещества, нерастворимые в воде, растворяются в растворах солей, в разбавленных кислотах или основаниях.
Некоторые белковые вещества растворимы в 70%-ном спирте (этаноле). Растворы белков стойки и имеют типичные свойства гидрофильных коллоидов. Они вязки и имеют сравнительно низкое поверхностное натяжение. Обычно они непрозрачны, а при встряхивании образуют стойкую пену. Стойкость пены обусловлена частичным коагулированием, наступающим при достаточно высокой концентрации белковых веществ в поверхностных слоях.
Растворы белков весьма чувствительны ко всем физико-химическим воздействиям, меняющим их коллоидное равновесие. Интересно в технологическом отношении поведение растворов белковых веществ при их нагревании.
Белковые вещества нерастворимы в концентрированных растворах электролитов. Это их свойство используется для осаждения (высаливания) белков из водных растворов путем добавления к ним солей, чаще всего сернокислого аммония. Концентрация соли, необходимая для высаливания белковых веществ при определенной температуре, различна; поэтому можно постепенным повышением концентрации солей получить различные фракции белковых веществ. На этом основана также проверка белковой устойчивости разных сортов пива.
Белковые вещества в зерне ячменя распределены неравномерно. Больше всего их в алейроновом" слое. Эти белковые вещества нерастворимы в воде и при технологическом процессе получения пива переходят в дробину. В периферийном слое эндосперма находятся запасные белковые вещества. Часть их заполняет клетки эндосперма в виде гистологического белка и объединяет зерна крахмала. Различия в содержании запасных белковых веществ оказывают непосредственное влияние на все содержание белковых веществ в ячмене. Много исследований посвящено вопросу о количественном содержании белковых веществ в ячмене. По осборну, ячмень содержит следующие белки
Лейкозин – ячменный альбумин, растворим в воде, в разбавленных растворах солей, в кислотах и основаниях. Из слегка подкисленного раствора лейкозин можно высолить путем введения в него сернокислого аммония до насыщения. Изоэлектрическая точка при рН 4,6. Результаты электрофоретических, хроматографических и иммунологических испытаний показали, что лейкозин – это гетерогенный белок, содержащий β-амилазу. Электрофйретически можно разложить лейкозин на семь компонентов с большей или меньшей активностью β-амилазы.
Эдестин – ячменный глобулин, нерастворим в воде, но -растворяется в разбавленных растворах солей. Растворимые соли ячменя, солода и производственной воды способны перевести в раствор существенную часть эдестина из исходных материалов. В таком растворе эдестин коагулирует при рН затора и сусла неполностью. Сернокислым аммонием он высаливается при полунасыщении. Изоэлектрическая точка при рН 7. В растворах с рН 5,2 и более кислых эдестин денатурируется. В пиве он может вызывать появление мутей. Глобулин можно фракционировать хроматографическим путем на декстрановом геле, а также осаждением сернокислым аммонием. Результаты ультрацентрифугирования и электрофоретических испытаний показали, что эдестин содержит четыре компонента.
По Сандегрену, эти компоненты, обозначенные а, β, γ и δ, за исключением глобулина δ, содержатся и в. солоде. Глобулин β типичен для ячменя. От остальных белковых компонентов он отличается большей устойчивостью к повышенной температуре (70°С) и к действию протеаз солода. Установлено, что холодная муть пива содержит от 60 до 65% белков, являющихся продуктами расщепления глобулина с высокой молекулярной массой. Эти же белки являются причиной стойкого помутнения пива.
Гордеин – ячменный проламин, растворим в 70%ном --этаноле, кислотах и основаниях, нерастворим в воде и растворах солей. Из раствора его можно выделить добавлением нейтральных солей; из спиртового раствора он осаждается ацетоном или же разбавлением водой. От лейкозина и эдестина гордеин отличается высоким содержанием глютаминовой кислоты и пролина и содержанием антоцианогенов. Химически он неоднороден, и его можно электрофоретически разделить на семь компонентов.
Глютелин – белок, нерастворимый в воде, растворах солей и спирта, но растворимый в разбавленных щелочах. От остальных белков ячменя он отличается растворимостью в присутствии редуцирующих веществ. По расположению аминокислот и по содержанию глютаминовой кислоты и пролина он близок к гордеину. Ячменный глотелин пока еще полностью не изучен. Сравнительно много глютелина содержится в алейроновом слое ячменя. В ходе технологического процесса он почти не изменяется.
Наряду с нативными белками субстратами ячменных и солодовых протеаз являются также измененные белки. К ним относятся главным образом коагулированные белки, метапротеины, альбумозы, пептоны и полипептиды.
Коагулированные белки образуются под действием тепла. Нативные белки хорошо растворимы в воде, при кипячении нерастворимы и выпадают из раствора (коагулируют). Этот процесс протекает в две стадии. Сначала происходит денатурация белка – химическое изменение, вызванное внутренней перегруппировкой в молекуле, и, во всей вероятности, сопровождаемое потерей воды. Денатурированный белок содержит большее количество аминогрупп или сульфгидрильных групп, чем пер. воначальный белок, но его пептидная цепь остается ненарушенной. В дальнейшем денатурированный белок в результате коллоидно-химических изменений свертывается (коагулирует). Первичные частицы соединяются с вторичными, и образуется грубая суспензия, которая выпадает из раствора.
Глобулярная теория предполагает, что при этих процессах происходит частичное или полное развертывание белковой глобулы. Удлинение спиралей пептидной цепи вначале обратимо, но при превышении определенного значения развертывание идет быстро и необратимо. Это активирует гидрофобные группы, и белок становится нерастворимым в воде. Развертыванием значительной части пептидной цепи объясняется также то, что денатурированные белки легче расщепляются протеазами.
Метапротеины (гидролизованные протеины) – это частично гидролизованные белки. Они образуются при температуре от 30 до 60°С под действием либо слабых кислот (кислый альбумин), либо слабых оснований (щелочной альбумин).
Пептоны (альбумозы, протеозы и т. п.) – это высокомолекулярные продукты расщепления белков эндопептидазами, коллоидные вещества, сохранившие еще большинство типичных свойств белков. Они осаждаются в кислой среде танином, но при биуретовой реакции они дают розовую окраску вместо фиолетовой. При кипячении пептоны из растворов не осаждаются (не коагулируют) даже при изоэлектрической точке. Их коллоидные свойства аналогичны коллоидным свойствам белков. Растворы имеют активную поверхность, они вязки и при встряхивании легко образуют пену.
Полипептиды представляют собой последнюю ступень расщепления белков эндопептидазой. Это – продукты конденсации аминокислот, их строение хорошо известно и большое количество различных полипептидов искусственно синтезировано. Чаще всего это высокомолекулярные вещества с коллоидными свойствами, однако нормально они образуют молекулярные растворы, которые легко диффундируют. Биуретовая реакция и реакция Миллона положительны лишь тогда, когда полипептиды содержат в молекуле достаточное количество реакционноспособных групп. Однако, как правило, они не реагируют, как белки, и не коагулируются танином. Полипептиды являются субстратами экзопептидаз, дополняющих деятельность эндопептидаз.
ЭНДОПЕПТИДАЗЫ
Ячменная и солодовая эндопептидазы (подподкласс пептидпептидогидролаз, 3.4.4) гидролизуют внутренние пептидные связи (– СО – NH –) протеинов, т. е. связи, удаленные от диссоциирующих групп молекул субстрата. Белковые макромолекулы при этом расщепляются на относительно небольшие молекулы, представляющие собой полипептиды с малой молекулярной массой. Основной реакцией является гидролиз:
NH2-R1-CO-NH-R2-COOH + H2O → NH2-R1-COOH + NH2-R2-COOH.
Как и все эндопептидазы, ячменная и солодовая эндопептидазы тоже активнее действуют на измененные белки, например денатурированные, чем на нативные.
По своим свойствам ячменная эндопептидаза относится к ферментам типа папаина (3.4.4.10), весьма распространенным в растениях. Она активируется синильной кислотой примерно на 50%, сероводородом и некоторыми соединениями, содержащими сульфгидрильную группу, например глютатионом и глютамилцистеином. Оптимум ее активности лежит в пределах рН от 4,6 до 4,9 И колеблется в зависимости от субстрата. Для эдестина самый низкий рН стабильности фермента равен 4,3. Оптимальная температура 50–60°С. Ячменнаяэндопептидаза лучше всего действует на белки, изоэлектрическая точка которых лежит в указанном диапазоне рН, оптимальном для деятельности фермента.
Ячменная и солодовая эндопептидазы сравнительно устойчивы при высоких температурах и этим они отличаются от экзопептидаз. Более устойчивы они при значении рН от 4,4 до 4;6, т. е. в диапазоне изоэлектрических точек солодовых белков. В этом диапазоне рН они активны еще некоторое время при температуре 60–70°С, тогда как при рН 6 эти эндопептидазы теряют уже 80–85% своей активности при температуре 62°С за 10 мин. По Кольбаху, заметное ослабление активности этого фермента в водном растворе при температуре 30°С наступает уже через час, а при 70°С этот фермент за час разрушается полностью.
ЭКЗОПЕПТИДАЗЫ
Комплекс пептидаз (экзопептидазы), содержащийся в зеленом солоде, включает не менее двух ферментов, но предполагается наличие в нем и других ферментов.
Экзопептидазы (дипептидгидролазы, 3.4.3) катализируют отщепление концевых (терминальных) аминокислот пептидов; при этом образуются сначала дипептиды, а затем – аминокислоты. При гидролизе в данном случае постепенно разрываются те пептидные связи, которые находятся вблизи поддающихся диссоциации аминогрупп (–NH2) или карбоксильных групп (–СООН); величина молекулы субстрата имеет второстепенное значение.
Экзопептидазы характеризуются субстратной специфичностью. Среди них имеются дипептидазы, гидролизующие только дипептиды, и полипептидазы, гидролизующие высокомолекулярные пептиды, содержащие в молекуле не менее трех аминокислот. В группу полипептидаз входят аминопептидазы (α-аминоацилпептид-гидролазы, 3.4.1), их активность обусловливается наличием в молекуле субстрата свободной аминогруппы, и карбоксипептидазы (пептидил-аминокислотные гидролазы, 3.4.2), требующие присутствия в молекуле субстрата свободной карбоксильной группы.
Все экзопептидазы имеют оптимальную активность при значении рН 7–8 и температуре около 40°С. В водных растворах активность экзопептидаз ослабляется при повышении температуры до 50°С, а при 60°С наступает быстрая инактивация.
Присутствие в прорастающем ячмене нескольких экзопептидаз подтверждается в основном тем, что солодовый экстракт расщепляет разные пептиды с различной скоростью.
Экзопептидазы находятся в прорастающем ячмене только в местах роста, главным образом в зародышевом листке, ростке, щитке и окружающей ткани, но не в эндосперме и алейроновом слое.
ФЕРМЕНТЫ, РАСЩЕПЛЯЮЩИЕ ЯЧМЕННЫЙ ЖИР
Ферменты, катализирующие гидролиз жиров (липидов) и жироподобных веществ (липоидов), до сих пор мало изучены. Количественное содержание их в ячмене незначительно. В последние годы было установлено некоторое технологическое значение жиров и родственных им веществ. Продукты расщепления жиров в какой-то степени влияют на вкус и биологическую стойкость пива. Так как жиры и жироподобные вещества являются запасными веществами ячменного зерна, то представляют интерес ферменты, катализирующие химические изменения этих веществ.
СУБСТРАТЫ
Жир, экстрагированный из ячменя, представляет собой желто-бурое масло, из которого при длительном отстаивании выделяется твердая кристаллическая фаза. Общее содержание жира в ячмене колеблется от 2,0 до 2,5%.
Жиры (липиды) являются сложными эфирами глицерина (глицеридами) и высших жирных кислот (насыщенных и ненасыщенных). Содержание (в %) отдельных жирных кислот в ячменном жире, по Ринке; приведено ниже.

Эти данные показывают, что в поддающейся омылению фракции ячменного жира преобладает наряду с ненасыщенной олеиновой кислотой (с одной двойной связью) еще менее насыщенная линолевая кислота (с двумя двойными связями), которая при окислении кислородом воздуха постепенно осмаливается и твердеет.
Кроме свободных жиров, в ячмене содержатся жиры, связанные с белками или с углеводами. На липопротеиды, содержащие белки, растворимые в растворах соли, приходится примерно 2,5–5,0% всего ячменного жира. Фракции жира, связанного с углеводами в ячмене, пока еще не выделены, но об их наличии можно судить потому, что такие жиры определены в кукурузе, ржи и пшенице.
Из жироподобных веществ (липоидов) наибольшее значение имеют фосфатиды. В их молекуле, по структуре подобной молекуле жира, одна гидроксильная группа глицерина образует сложный эфир с фосфорной кислотой, которая соединена также сложной эфирной связью с аминоспиртом, коламином или холином.
Основными фосфатидами ячменного жира являются лецитин и кефалин.
Лецитины имеют в молекуле насыщенную и ненасыщенную жирные кислоты, глицерин, фосфорную кислоту и холин. Часть лецитина связана с белками. Лецитины– это β-фосфатиды; кефалины – α-фосфатиды. Кефалины отличаются от лецитинов также тем, что в их молекуле глицеринфосфорная кислота связана с коламином и они содержат аминокислоту серин.
Установлено, что из общего содержания жиров от 3,1 до 4,2% приходятся на фосфатиды, преимущественно лецитин. Вакаизуми обнаружил в ячмене и солоде кроме лецитина еще β-лизолецитин, который при гидролизе отщеплял пальмитиновую и глицеринфосфорную кислоты и холин. Он приписывает β-лизолецитину способность усиливать пенообразование. Наличие кефалина в ячмене пока еще не доказано. О количественном содержании отдельных жирных кислот в фосфатидах имеется мало данных. Качественно наличие их доказано, так же как и глицеридов, но фосфатиды содержат, по всей вероятности, больше насыщенных кислот, главным образом пальмитиновую кислоту, количество которой превышает, по Эйльварду (1956), 20%.
Другим компонентом ячменного жира являются воска, которые представляют собой сложные эфиры высших одноосновных жирных кислот и высокомолекулярных одноатомных спиртов. Они содержат свободную кислоту, свободные спирты, а также часто и углеводороды.
Воска являются существенным компонентом жира, находящегося в оболочках. По Гейсу (1910), воск выделяется из охлажденного спиртового раствора в кристаллической форме и имеет чисто-белый цвет. Его влияние на послеуборочное дозревание ячменя заключается в том, что он понижает проницаемость слоев оболочки зерна для кислорода.
ЛИПАЗЫ
Расщепление растительных жиров катализируют фитолипазы. Это – эстеразы, гидролизующие эфирные связи глицеридов; при этом выделяются жирные кислоты. Впервые наличие липаз в ячмене обнаружил Маэстрини (1921). Если метаболизм жиров является источником энергии в начале прорастания, то липаза (гидролаза эфиров глицерина, 3.1.1.3) является ферментом, важным в технологическом отношении. Этому ферменту до сих пор уделялось мало внимания вследствие того, что он слабо растворим в воде. Только при применении подходящих эмульгаторов стало возможным его изучение. Мак Леод и Уайт показали, что для растворимой фракции ячменной липазы оптимум рН 6,8, в то время как в прежних работах (Маэстрини) указывался рН 7,5. Температурный оптимум нерастворимой фракции липазы находится в пределах 45–48 0C. Стойкость фермента при повышенных температурах сильно зависит от влажности. При осторожной предварительной сушке зеленого солода активность липазы снижается незначительно. Самая высокая ее активность выявлена в среде с 40% воды (Мак Леод). В связи с этим обсуждался вопрос о возможной взаимосвязи между чувствительностью ячменей к воде и активностью липазы.
Ячменная липаза растворима в воде лишь примерно на 15%, и при прорастании количество растворимой липазы не увеличивается. Четкого различия между растворимой и нерастворимой фракциями липазы не установлено. Хотя при исследованиях липаза расщепляла трибутирин быстрее, чем триолеин, авторы считают существование двух различных липаз маловероятным.
В зернах ячменя около 55% липазы сосредоточено в поверхностных слоях. По другим данным, около 2/3 всей липазы содержится в зародыше. При замачивании ячменя активность липазы снижается, но при прорастании она постепенно повышается и в конце солодоращения она выше, чем в ячмене. Ухудшение качества ячменя, хранящегося в неудовлетворительных условиях (высокие влажность и температура), сопровождается повышением кислотности вследствие увеличения количества свободных жирных кислот, образующихся в результате ферментативного гидролиза жиров, а также в незначительной степени благодаря кислым фосфатам и белкам. По Балингу, жизнеспособность зерна характеризуется количеством жирных кислот, что подтверждается исследованиями состояния ячменя по его кислотности, прорастаемости, всхожести и запахуг
ЛИПОКСИГЕНАЗА
Липоксигеназа, 1.13.1.13 (прежнее название–липоксидаза) катализирует равновесие самоокисления жирных кислот. Она высвобождает ион водорода из а-метиленовой группы, активированной соседством изолированной двойной связи; при этом благодаря цепной реакции образуются переходные перекиси ненасыщенных жирных кислот, которые расщепляются до карбонильных соединений (альдегидов, кетонов) или жирных кислот с короткими цепочками. Липоксигеназа атакует главным образом ненасыщенные жирные кислоты с несколькими двойными связями (цис) – линолевую кислоту (с двумя двойными связями), линоленовую (с тремя двойными связями) и арахиновую (с четырьмя двойными связями).
Однако самоокисление может протекать и без воздействия липоксигеназы: в результате действия высокой температуры, света, тяжелых металлов и перекисей. Противоположное явление наблюдается без доступа света и воздуха и наличия антиоксидантов, к числу которых относятся и токоферолы.
Липоксигеназа повреждает в основном хранящийся ячмень. Прогорклый вкус зеленого солода, образующийся при неправильнбм температурном режиме во время предварительной сушки и обнаруживаемый еще в заторе, объясняют действием липоксигеназы (Виндиш, 1893).
ФОСФОЛИПАЗЫ
Фосфолипазы – этоэстеразы, катализирующие расщепление фосфатидов, лецитина и кефалина. По характеру действия различают четыре фосфолипазы.
Фосфолипаза А, или лецитиназа (фосфатид-ацилгидролаза, 3.1.1.4), отщепляет одну молекулу жирной кислоты от лецитина или кефалина; остается лизолецитин или лизокефалин. Фосфолипаза В, или лизофосфолипаза (лизолецитин-ацилгидролаза, 3.1.1.5), отщепляет две молекулы жирной кислоты; остается глицерофосфорный сложный эфир холина. Фосфолипаза С (фосфатидилхолин-холинфосфогидролаза, 3.1.4.3) расщепляет лецитин до диглицерида и холинфосфата. Фосфолипаза D (фосфатидилхолин-фосфатидогидролаза, 3.1.4.4) расщепляет фосфатиды до холина или же коламина и фосфатидов.
По данным Акера, ячмень содержит фосфолипазы B и D. Фосфолипаза В имеет оптимальную активность между рН 6,0 и 6,3 и температуре 25°С; она связана в клетках. Растворимая фосфолипаза D имеет оптимальную активность в диапазоне рН от 5,8 до 6,2 и температуре 25– 30°С. Фосфолипаза В активируется только при прорастании, тогда как активность фосфолипазы D при солодоращении не изменяется.
Предполагается наличие в ячмене ацетилэстеразы (3.1.1.6). Пшеничная ацетилэстераза при высокой температуре более устойчива, чем ячменная липаза, а при прорастании ее активность не повышается. Очевидно, она распределена в зерне равномерно. Глицериды уксусной кислоты расщепляются очень быстро. С увеличением длины их цепочки активность фермента падает, особенно начиная с C9. При расщеплении жиров не исключена возможность взаимодействия липазы с ацетилэстеразой.
ТРАНСАМИНАЗЫ ЯЧМЕНЯ И СОЛОДА
Трансаминазы (аминотрансферазы) впервые изучил Гутенберг (1961). Он установил [160], что ячмень и солод содержат две трансаминазы:
аспартат-аминотрансферазу, прежнее название которой глютаматоксалацетаттрансфераза (L-аспартат: , 2-оксоглютарат-аминотрансфераза, 2.6.1.1), катализирующую реакцию
L-аспартат + 2-оксоглютарат оксалацетат + L-глютамат;
аланина минотрансферазу, прежнее название которой пируват-глютамат-трансаминаза (L-аланин: 2-оксоглютарат-аминотрансфераза, 2.6.1.2), катализирующую реакцию
L-аланин + 2-оксоглютарат пируват + L-глютамат. В обеих реакциях образуется L-глютаминовая кислота, являющаяся соединительным звеном в цитратном цикле, через который протекает дыхание клеток. Активной группой (коферментом) трансаминаз являются производные витамина B6 (пиридоксин, пиридоксаль, пиродоксамин).
Глютамат-оксалацетат-трансаминаза содержится в значительном количестве в зародыше и щитке, тогда как пируват-глютамат-трансаминаза локализуется в основном в алейроновом слое и в зародыше. Это распределение позволяет по активности обоих ферментов судить о ходе сушки и хранениц ячменя, так как зародыш и алейроновый слой весьма чувствительны к действию тепла.
По Линко и Мильнеру, активность трансаминаз при солодоращении быстро возрастает с увеличением содержания воды в ячмене. Как и у протеаз, активность трансаминаз повышается при холодном способе солодоращения.
Некоторые технологические приемы также в какой-то степени активируют трансаминазы. Так, например, активность глютамат-оксалацетат-трансаминазы стимулирует гиббереллин, который одновременно влияет и на метаболизм азотистых веществ. Опрыскивание прорастающего ячменя раствором глюкозы стимулирует активность пируват-глютамат-трансаминазы.
Для выбора режима сушки солода и для правильного хранения ячменя необходимо учитывать особенности действия этих ферментов.
ФЕРМЕНТЫ, РАСЩЕПЛЯЮЩИЕ СЛОЖНЫЕ ФОСФОРНЫЕ ЭФИРЫ
Фосфорная кислота имеет большое биологическое значение в метаболизме. Она преобладает над остальными минеральными составными частями ячменя, непосредственно влияет на кислотность, а также на систему буферов полупродуктов пивоваренного производства.
Гидролитическое расщепление сложных эфиров фосфорной кислоты катализируют фосфозстеразы, которое протекает по уравнению
R • OPO (OH)2 + H2O → ROH + H3PO4.
СУБСТРАТЫ
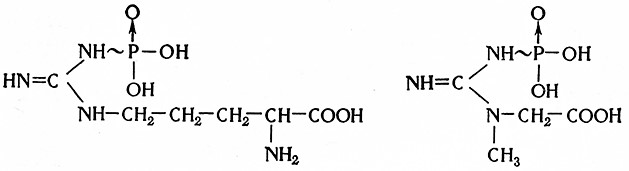
Субстратом фосфоэстераз является фосфор, содержание которого в ячмене в среднем составляет 1 % P2O5 на сухое вещество. Наибольшая часть (от 65 до 80%) фосфора содержится в виде фосфорных сложных зфиров. Среди них количественно преобладает фитин [86], представляющий собой смесь кальциевых и магниевых солей фитиновой кислоты, являющейся гексафосфорным сложным эфиром инозита.
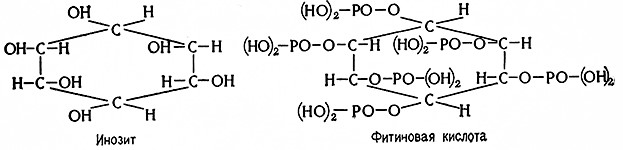
Физиологически важны также фосфатиды, в которых фосфор связан в виде сложного эфира с глицерином и, наконец, нуклеотиды, содержащие фосфорный сложный эфир рибозы, связанный с пиримидиновым или пуриновым основанием.
ФИТАЗА
Фитаза (жезо-инозит-гексофосфат-фосфогидролазаД 1.3.8) катализирует гидролиз фитина по уравнению
![]()
Оптимальная активность ячменной фитазы наблюдается при температуре 48°С и рН 5,2 – 5,3 (Люерс, 1927). Скорость реакции пропорциональна количеству фермента лишь при низких концентрациях. Гидролиз фитина сильно замедляют неорганические фосфаты.
Солодовая фитаза обладает значительной активностью. Из фитина она отщепляет фосфорную кислоту постепенно; временно возникают различные фосфорные сложные эфиры инозита, которые в конечном итоге дают инозит и неорганический фосфат. Оба продукта ферментативного гидролиза фитина имеют большое технологическое значение. Неорганические фосфаты проявляют свое действие при брожении, а инозит способствует росту дрожжевых клеток.
По Люерсу, содержание фитазы при солодоращении возрастает. Зеленый солод содержит в конце прорастания приблизительно в 9 раз больше фитазы, чем исходный ячмень. Сандегрен установил, что фитаза расщепляет при солодоращении от 20 до 30% фитина, содержащегося в ячмене.
При лабораторных экспериментах по затиранию расщеплялось примерно 50% фитина, так что в дробине оставалось около 50% нерасщепленного фитина. Однако производственная дробина содержала. только от 35 до 40% фитина. Кислотность заторов и сусла (рН 5,9) не была оптимальной для действия фитазы. При подкислении заторов молочной кислотой (2,6 кг на 1 кг солода) рН изменялся до 5,3. В этих условиях расщеплялось 90% фитина, а выход повышался на 2,5%.
САХАРОЗОФОСФОРИЛАЗА
Сахарозо-глюкозилтрансфераза (дисахарид-глюкозилтрансфераза, 2.4.1.7), отщепляет неорганический фосфат. Для определения скорости реакции необходимо иметь концентрированные растворы ферментов, приготовляемые из зеленого солода в прессе Бухнера. Оптимальная активность фермента наблюдается при температуре 41,5°С и рН 6,0.
При солодоращении содержание фермента возрастает уже в замочном чане, а максимальный прирост его достигается на пятый день прорастания. На этой стадии зеленый солод содержит в 8,5–9 раз больше сахарозо-глюкозилтрансферазы, чем исходный ячмень.
ГЛИЦЕРО-2-ФОСФАТАЗА
Солод содержит очень активную глицеро-2-фосфатазу (2-фосфоглицеро-фосфогидролазу, 3.1.3.19), которая отщепляет от глицерофосфата неорганический фосфат (Люерс, 1929). Оптимальная активность фермента наблюдается при температуре 36°С и рН 5,2.
Глицеро-2-фосфатаза ячменя относится к типу, катализирующему расщепление α-глицерофосфата и β-глицерофосфата с одинаковой скоростью реакций.
При замачивании ячменя содержание глицеро-2-фосфатазы сначала уменьшается, а с начала прорастания ячменя происходит быстрое увеличение ее содержания, продолжающееся до пятого дня. За весь период содержание фермента по сравнению с его количеством в исходном ячмене увеличивается в 11 раз.
НУКЛЕОТИДПИРОФОСФАТАЗА
Присутствие нуклеотидпирофосфатазы (динуклеотиднуклеотидгидролазы, 3.6.1.9) установлено в ячмене и солоде при использовании дрожжевой нуклеиновой кислоты в качестве субстрата (Люерс, 1929). Оптимальная активность фермента при температуре 49°С и рН 5,6.
После значительного уменьшения содержания фермента при замачивании количество фермента при прорастании начинает быстро увеличиваться (до шестого – седьмого дня). К этому времени содержание нуклеотидпирофосфатазы увеличивается в 8 раз по сравнению с ее первоначальным количеством в ячмене.
ПИРОФОСФАТАЗА НЕОРГАНИЧЕСКАЯ
Этот фермент (пирофосфат-фосфогидролаза, 3.6.1.1) был обнаружен в ячмене, солоде и солодовых ростках (Люерс, Г931). Пирофосфатаза катализирует гидролиз сложных эфиров пирофосфорной кислоты и пирофосфатов в ортофосфорные соединения:
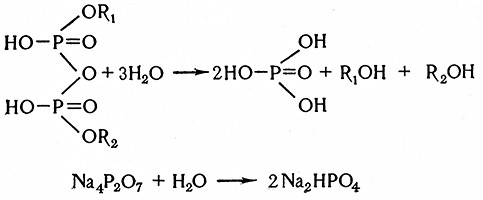
Оптимальная температура действия солодовой пирофосфатазы находится в пределах от 37 до 42°С, оптимальное значение рН равно 5,5. Образующийся ортофосфат замедляет реакцию.
Солодовые ростки содержат в 5–6 раз больше пирофосфатазы, чем такое же количество солода.
МЕТАФОСФАТАЗА
Метафосфатаза была обнаружена в низовых производственных дрожжах. Она катализирует гидролиз органических и неорганических полиметафосфатов в ортофосфаты:
(NaPO3)n + nH2O → nNaH2PO4.
Препарат, приготовленный из мацерационного сока низовых дрожжей, термоустойчив и имеет оптимальный рН 8.
ФОСФОМОНОЭСТЕРАЗА
Этот фермент содержится в пивоваренных дрожжах. Он гидролизует а-глицерофосфат значительно быстрее, чем β-глицерофосфат. Оптимум рН находится в пределах от 5,2 до 6,2. Фермент активируется ионами Mg2+ и Mn2+.
АДЕНОЗИНТРИФОСФАТАЗА, ИЛИ АТФ-АЗА
Фермент (АТФ-фосфогидролаза, 3.6.1.3, миозин) катализирует гидролиз аденозинтрифосфорной кислоты, от которой он отщепляет одну ортофосфорную группу, связанную пирофосфатной связью. Превращение аденозинтрифосфорной (АТФ) кислоты в аденозиндифосфорную (АДФ) кислоту обогащает систему свободной энергией, содержащейся в макроэргической пирофосфатной связи.
ФЕРМЕНТЫ ПРОЦЕССОВ ФОСФОРИЛИРОВАНИЯ
Сложные эфиры фосфорной кислоты являются важными в биологическом отношении промежуточными продуктами метаболизма каждой клетки. Их возникновение и превращение в живых организмах являются результатом действия ферментов, катализирующих перенос фосфатных остатков (фосфорного радикала). Это ферменты из группы трансфераз, которые относятся к гликозилтрансферазам (2.4) и фосфотрансферазам (2.7).
Гликозилтрансферазы, переносящие фосфорный радикал, раньше назывались фосфорилазами (трансфосфорилазами), или же фосфокиназами; перенос фосфорного радикала обеспечивается в системе АТФ/АДФ; в классификации они составляли самостоятельную группу. Новое положение их в классификации обусловлено тем, что при реакциях фосфорилирования происходит перенос гликозильного остатка от донора, которым является глюкозо-1-фосфат, на различные акцепторы.
Большинство этих глинозилтрансфераз стали известны лишь в последнее время. Они имеют большое биологическое значение потому, что катализируют важные процессы синтеза различных полисахаридов, таких, как крахмал, гликоген, декстран и леван, синтез сахарозы и т. д. Реакции, катализируемые гликозилтрансферазами, сопровождаются сравнитёйьно небольшими изменениями термодинамического потенциала, поэтому они обратимы. Это позволяет организму быстро синтезировать и расщеплять резервные вещества при небольших затратах свободной энергии.
Фосфотрансферазы переносят бедные или богатые энергией (макроэргические) фосфатные остатки, они имеют кардинальное значение в энергетической системе живых организмов. Перенос фосфатных остатков, бедных энергией, могут в определенных условиях катализировать также фосфоэстеразы. Перенос макроэргических же остатков, наоборот, осуществляется только в присутствии аденозинтрифосфата (АТФ) в качестве донора и аденозиндифосфата (АДФ) или аденозинмонофосфата (АМФ) в качестве акцептора (система адениловой кислоты). Макроэргическими связями ( ~ ) являются:
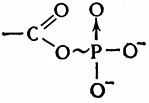
1. Ангидридные связи в нормальных и смешанных ангидридах органических и неорганических кислот, включающие полифосфатные, фосфосульфатные и ацилфосфатные связи:

ОO-в неорганических полифосфатах й полифосфатах нуклеозидов. Основными веществами этого типа являются аденозиндифосфат (АДФ) и аденозинтрифосфат (АТФ):
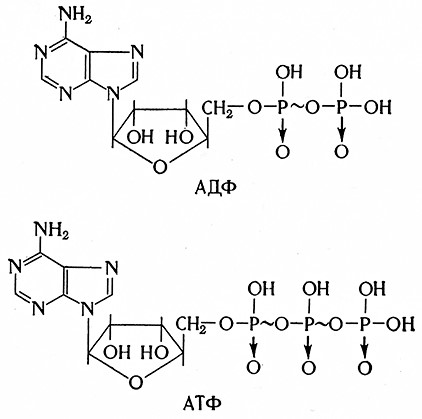
В организме оба вещества являются источником «активного фосфата». Из двух макроэргических связей АТФ используется только одна, т. е. концевая. Другие же могут использоваться косвенно после перевода в концевую макроэргическую связь АТФ согласно уравнению
АДФ + АДФ ⇄ АМФ + АТФ.
АМФ (аденозинмонофосфат-5'-адениловая кислота) имеет уже. только нормальную эфирную связь:

находится в смешанном ангидриде 3-фосфоаденозин-фосфосульфата (ФАФС). Вещество является источником «активного сульфата» для биосинтеза сложных эфиров серной кислоты.
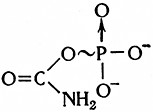
в) Ацетилфосфатная связь
встречается в карбамилфосфате, являющемся важным промежуточным продуктом азотного метаболизма:
2. Фосфамидные связи
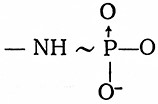
встречаются в аминофосфате и креатинфосфате (так называемых фосфогенах):
Креатинфосфат имеет свободную энтальпию (теплосодержание) при гидролизе макроэргических связей AG' еще несколько большую, чем АТФ, который реагирует с ним по уравнению Ломанна
креатин + АТФ ⇄ креатинфосфат + АДФ
(AG' = 12,57 • 103 Дж/моль).
Реакция выполняет функцию регулятора концентрации АТФ в тканях.
3. Энолсульфатные связи
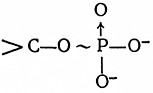
имеют высокие AG'. Предполагают, что эфирная связь препятствует возникновению кетоформы, которая беднее энергией, а потому более устойчива.
4. Тиоэфирные связи
чаще всего имеются в ацетилированных производных кофермента А. Высокие AG' тиоэфиров по сравнению с нормальными сложными эфирами объясняются неспособностью серы образовывать двойные связи.
Изменения свободной энтальпии при гидролизе макроэргических связей (по А. Шипалю с сотрудниками) приведены в табл. 7.
Таблица 7

α-ГЛЮКАНФОСФОРИЛАЗА
(α-1,4-ГЛЮКАН: ОРТОФОСФАТ-ГЛЮКОЗИЛТРАНСФЕРАЗА, 2.4.1.1)
Этот фермент катализирует перенос глюкозного остатка от глюкозо-1-фосфата на цепочку с большим числом 1,2глюкозидных связей по уравнению
(C6H10O5)n + H3PO4 ⇄ C6H10O5–OPO (OH)2 + (C6H10O5)n–1
Глюкозо-1-фосфат идентифицировал Кори (1936), который одновременно установил, что реакция «фосфоролитического» расщепления крахмала обратима.
Чистые препараты фермента не действуют на глюкозо-1-фосфат. Предполагается, что при синтезе полисахарида присутствует затравочная молекула, невосстанавливающие цепочки которой могут удлиняться за счетглюкозо-1-фосфата. В этом отношении наиболее выгодны гликоген и амилопектин, имеющие много нередуцирующих концевых цепей, но эффективны также и декстрины, главным образом для растительных ферментов. Глюкоза, мальтоза и β-декстрины с одним или двумя глюкозными остатками в концевых цепочках неэффективны. По-видимому, требуется не менее трех глюкозных остатков.
Равновесие реакции синтеза и расщепления (фосфоролиза) зависит от рН. При рН 7 равновесие сдвинуто в сторону синтеза, при этом около 75% H3PO4 свободны. Если из системы удаляется глюкозо-1-фосфат, то равновесие стойко смещается вправо. Амилоза (полисахарид только с 1,4-связями) при этом расщепляется без остатка, тогда как амилопектин и гликоген расщепляются не полностью, а конечные декстрины (с 1,6-связями) не расщепляются; эти ферменты расщепляют или синтезируют 1,4-глюкозидные связи.
Очщценные ферменты (фосфорилазы) животного и растительного происхождения катализируют синтез полисахаридов только с линейными неразветвленными цепочками, которые, за исключением длины цепочек, аналогичны амилозе.
Кристаллические препараты фермента из картофеля получили Фишер и Гилперт, а также Браун и Гилперт.
ФАКТОР РАЗВЕТВЛЕНИЯ (Q-ΦΕΡΜΕΗТ)
α-Глюкан-ветвящая гликозилтрансфераза (а-1,4-глюкан: а-1,4-глюкан-6-гликозилтрансфераза, 2.4.1.18) катализирует только синтез амилозоподобных полисахаридов с а-1,4-связями. При синтезе амилопектина или гликогена, в которых имеется также небольшое количество 1,6-связей, участвует фактор разветвления. Из растительных ферментов этого типа лучше всех изучен Q-фермент из картофеля. В результате взаимодействия обоих ферментов образуется полисахарид, аналогичный амилопектину.
Q-фермент превращает амилозу в амилопектин, разрывая 1,4-связи амилозной цепочки; отщепленная часть, по-видимому, остается связанной с ферментом, благодаря чему сохраняется энергия высвобожденной связи в соединении субстрата с ферментом, и эта энергия может, быть перенесена на молекулу амилозы с образованием 1,6-связи; при этом молекула разветвляется. Q-фермент действует только на амилозные цепочки не менее чем с 25 глюкозными единицами. Для быстрого воздействия необходимо, чтобы цепочки имели среднюю длину, т. е. примерно 40 глюкозных единиц.
Первое сообщение о факторе разветвления было сделано Кори (1943). Кристаллический препарат Q-фермента получили Джильберт и Патрик.
САХАРОЗА-ГЛЮКОЗИЛТРАНСФЕРАЗА
(ДИСАХАРИД-ГЛЮКОЗИЛТРАНСФЕРАЗА, 2.4.1.7)
Фермент катализирует реакции
Caxaposa-+-H3PO4 ⇄ α-глюкозо-1-фосфат + фруктоза.
Этот фермент обнаружил у Leuconostoc mesenteroides Каган с сотрудниками, а у Pseudomonas – Дудоровс сотрудниками.
Эти ферменты строго специфичны в отношении глюкозной группы переносимого ими субстрата. При реакции фосфат может быть заменен мышьяковокислой солью; предполагается первичное возникновение глюкозо-1-apceната, который самопроизвольно (спонтанно) гидролизуется, так что реакция является кажущимся гидролизом сахарозы.
Кроме фосфата, акцепторами гликозильного остатка могут быть и некоторые сахара, например:
сахароза + L-сорбоза ⇄ D-глюкозидо-L-сорбозид + фруктоза.
Фермент катализирует также следующий синтез сахарозы:
D-глюкозо-1-кетоксилозид + фруктоза ⇄ сахароза + ксилокетоза.
Таким образом, этот фермент является типичной трансглюкозилазой.
МАЛЬТОЗОФОСФОРИЛАЗА
(МАЛЬТОЗА: ОРТОФОСФАТ-ГЛЮКОЗИЛ-ТРАНСФЕРАЗА, 2.4.1.8)
По Фиттингу и Шерпу, фермент катализирует (из Neisseria meningitidis) реакцию
мальтоза + H3PO4 → β-D-глюкозо-1-фосфат + D-глюкоза.
Реакция аналогична реакций при фосфоролизё сахарозы, но из α-глюкозидного дисахарида мальтозы образуется β-глюкозо-1-фосфат. Далее установлено, что в отсутствие глюкозы не происходит обмена между β-глюкозо-1-фосфатом и неорганическим фосфатом или между мальтозой и глюкозой.
УДФ-ГЛЮКОЗА: D-ФРУКТОЗА-2-ГЛЮКОЗИЛ-ТРАНСФЕРАЗА, 2.4.1.13
Этот фермент катализирует образование сахарозы из уридиндифосфата (УДФ) глюкозы и фруктозы:
УДФ глюкоза + D-фруктоза ⇄ сахароза + УДФ.
Он был выделен Лелуа и Кардини из зародыша пшеницы. Предполагают, что ферменты этого типа катализируют последнюю ступень биологического синтеза сахарозы в высших растениях.
УДФ-ГЛЮКОЗА: D-ГЛЮКОЗА-6-ФОСФАТ-1-ГЛЮКОЗИЛТРАНСФЕРАЗА, 2.4.1.15
По Лелуа и Кабилю, этот фермент катализирует образование трегалозо-фосфата по уравнению
УДФ глюкоза -JD-глкжозо-б-фосфат трегалозо-6-фосфат УДФ.
ГЕКСОКИНАЗА (АТФ: D-ГЕКСОЗА-6-ФОСФОТРАНСФЕРАЗА, 2.7.1.1)
Фермент катализирует перенос молекулы фосфата от АТФ на глюкозу, фруктозу или маннозу:
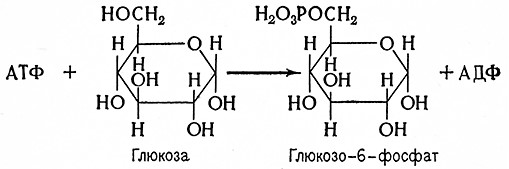
Наряду с ферментами животного происхождения были выявлены АТФ: гексозофосфотрансферазы в дрожжах и высших растениях. Фермент из дрожжей в кристаллической форме получили Кунитц и Мак Дональд, также Кори с сотрудниками.
Дрожжевой фермент катализирует начальную стадию спиртового брожения.
ФОСФОФРУКТОКИНАЗА (АТФ: D-ФРУКТОЗА-бФОСФАТ-1-ФОСФОТРАНСФЕРАЗА, 2.7.1.11)
Образование фруктозо-1,6-дифосфата при брожении было установлено в 1909 г. Гарденом и Янгом. Значительно позже (1936) Остер с сотрудниками установил, что фруктозо-1,6-дифосфат образуется вследствие переноса фосфата от АТФ на фруктозо-6-фосфат:
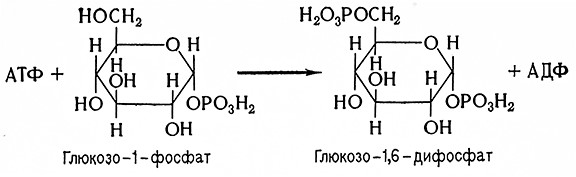
Очищенные препараты этого фермента строго специфичны в отношении донора; они действуют только на АТФ и не действуют на АДФ. Кори с сотрудниками установил, что фермент кроме фруктозо-6-фосфата фосфорилирует также фруктозо-1-фосфат. Однако неизвестно, фосфорилирует ли фруктозо-1 -фосфат тот же фермент или же специфическая АТФ фруктозо-1-фосфат-фосфотрансфераза.
Фосфофруктокиназа имеется во всех организмах и клетках, в которых происходит гликолитическое расщепление. Дрожжевой фермент не активен в отсутствие Mg2+. Оптимальное значение рН – около 7.
ФОСФОГЛКЮКОКИНАЗА (АТФ: D-ГЛЮКОЗА-1-ФОСФАТ-6-ФОСФОТРАНСФЕРАЗА, 2.7.1.10)
Карбини с сотрудниками установил, что глюкозо-1-фосфат является коферментом фосфоглюкокиназ. Одновременно они доказали, что в дрожжах и в мышцах имеются АТФ: глюкозо-1 -фосфат-фосфотрансферазы, катализирующие следующую реакцию:

Фермент этого типа не катализирует фосфор ил ирование глюкозы. Очищенный препарат фосфоглюкокиназы не катализирует также перенос фосфата на глюкозо-1-фосфат. В данном случае, следовательно, имеются два различных фермента.
Эти ферменты активны только в присутствии ионов Mg2+ или Mn2+. Оптимальное значение рН для дрожжевого фермента составляет 6,8.

