Контроль санитарно-гигиенического состояния питьевой воды проводят в соответствии с СанПиН 2.1.4.1074; ГОСТ Р 51232, ГОСТ 18963; МУК 4.2.1018 по следующим микробиологическим показателям:
- термотолерантные колиформные бактерии (ТКБ);
- общие колиформные бактерии (ОКБ);
- КМАФАнМ (ОМЧ).
Упрощенная схема контроля качества воды в условиях производственных лабораторий представлена на рисунке 1.
Полная схема контроля качества воды в условиях производственных лабораторий представлена на рисунке 2.

Примечание 1
Результаты посева фильтров на среде Эндо:
- на фильтрах нет роста колоний или рост пленчатых, губчатых, плесневых колоний - результат «отсутствие ОКБ и ТКБ в 100 см3 воды». Анализ закончен через 24 ч;
- на фильтрах рост изолированных типичных лактозоположительных колоний - подсчитывают число колоний каждого типа отдельно, подтверждают их принадлежность к ОКБ и ТКБ (исследуют не менее 3-4 колоний каждого типа) по признакам:
- оксидазный тест;
- принадлежность к Г раму;
- ферментация лактозы на лактозной среде при (37±1) °С 48 ч для ОКБ и при (44±0,5) °С 24 ч для ТКБ.
Примечание 2
Результаты посева воды на среду накопления:
- отсутствие помутнения и образования кислоты и газа в засеянных объемах воды - результат «отсутствие ОКБ и ТКБ в 100 см3 воды». Анализ закончен через 24 ч;
- из флаконов, где отмечено помутнение и образование кислоты и газа, а также помутнение и кислота при использовании ГПС или помутнение при использовании ЛПС, делают высев на среду Эндо. При отсутствии роста колоний или росте пленчатых, губчатых, плесневых колоний - результат «отсутствие ОКБ и ТКБ в 100 см3 воды». Анализ закончен через 24 ч. Рост изолированных типичных лактозоположительных колоний - подсчитывают число колоний каждого типа отдельно, подтверждают их принадлежность к ОКБ и ТКБ по признакам:
- оксидазный тест;
- принадлежность к Г раму;
- ферментация лактозы на лактозной среде при (37±1) °С 48 ч для ОКБ и при (44±0,5) °С 24 ч для ТКБ.
7.3.1 Отбор проб для контроля воды
Для отбора проб воды используют специально предназначенную для этих целей одноразовую посуду или емкости многократного применения, изготовленные из материалов, не влияющих на жизнедеятельность микроорганизмов.
Емкости должны быть оснащены плотно закрывающимися пробками (силиконовыми, резиновыми или из других материалов) и защитным колпачком (из алюминиевой фольги, плотной бумаги). Многоразовая посуда, в т.ч. пробки, должна выдерживать стерилизацию сухим жаром или автоклавированием.
При отборе проб в одной и той же точке для различных целей первыми отбирают пробы для микробиологических исследований. Если отбирают воду после обеззараживания химическими реагентами, то для нейтрализации остаточного количества дезинфектанта в емкость, предназначенную для отбора проб, вносят до стерилизации натрий серноватисто-кислый в виде кристаллов из расчета 0,01 г на 500 см3 воды.
Пробу отбирают в стерильные емкости. Емкость открывают непосредственно перед отбором, удаляя пробку вместе со стерильным колпачком. Во время отбора пробка и края емкости не должны чего-либо касаться. Ополаскивать посуду запрещается.
При исследовании воды из распределительных сетей отбор проб из крана проводят после предварительной его стерилизации обжиганием и последующего спуска воды не менее 10 мин при полностью открытом кране. При отборе проб напор воды может быть уменьшен. Пробу отбирают непосредственно из крана без резиновых шлангов, водораспределительных сеток и других насадок. Если через пробоотборный кран происходит постоянный излив воды, отбор проб проводят без предварительного обжига, не изменяя напора воды и существующей конструкции (при наличии силиконовых или резиновых шлангов).
При заполнении емкостей должно оставаться пространство между пробкой и поверхностью воды, чтобы пробка не смачивалась при транспортировании.
После наполнения емкость закрывают стерильной пробкой и колпачком.
Отобранную пробу маркируют и сопровождают документом отбора проб воды с указанием места, даты, времени забора, фамилии специалиста, отбирающего пробу, и другой информации.
Пробы воды можно хранить при температуре 4-10 °С не более 6 ч. Если пробы нельзя охладить, их анализ следует провести в течение 2 ч после забора.
7.3.2 Проведение анализов
7.3.2.1 Определение общего числа микроорганизмов (ОМЧ)
Сущность метода
Метод основан на определении общего числа мезофильных аэробных и факультативно-анаэробных микроорганизмов (ОМЧ), способных образовывать колонии на питательном агаре или агаре для определения КМАФАнМ при температуре 37 °С в течение 24 ч, видимых с увеличением в два раза.
Проведение анализа
Пробу воды тщательно перемешивают, вносят в чашки Петри по 1 см3 и проводят посев в соответствии с 5.6.1. При этом из каждой пробы делают посев не менее двух объемов по 1 см3.
Обработка результатов
Подсчитывают все выросшие на чашке колонии, наблюдаемые при увеличении в два раза. Количество колоний на обеих чашках суммируют и делят на два. Результат выражают числом колоний образующих единиц (КОЕ) в 1 см3 исследуемой пробы воды.
Если подсчет отдельных колоний на чашках невозможен, то в протоколе отмечают сплошной рост.
Общее число микроорганизмов (ОМЧ) должно составлять не более 50 КОЕ/см3. При получении неудовлетворительных результатов проводится усиленная обработка воды и повторный анализ.
7.3.2.2 Определение общих и термотолерантных колиформных бактерий методом мембранной фильтрации (основной метод)
Сущность метода
Метод основан на концентрировании бактерий из определенного объема анализируемой воды на мембранном фильтре, выращивании их при (37+1) °С на дифференциальной питательной среде с лактозой и последующей идентификации колоний по культуральным и биохимическим свойствам.
Проведение анализа
Подготовка мембранных фильтров
Мембранные фильтры № 2 или № 3, а также планктонные фильтры № 6, проверенные на отсутствие трещин, отверстий и т.п., помещают по одному на поверхность дистиллированной воды, нагретой до 80 °С в стакане (в чашке для выпаривания, эмалированной кастрюле и др.) и медленно доводят до кипения на слабом огне, после чего воду заменяют и кипятят 10 мин. Смену воды и последующее кипячение повторяют 3-5 раз до полного удаления остатков растворителей из фильтров, после чего они готовы к работе. Подготовленные фильтры хранят сухими или в широкогорлой банке с дистиллированной водой. Перед употреблением фильтры стерилизуют кипячением в дистиллированной воде.
Фильтрующие мембраны «Владипор» марки МФА-МА №№ 5, 6, 7, 8 и 10, визуально проверенные на отсутствие трещин, отверстий, пузырей и т.п., стерилизуют кипячением. При этом во избежание скручивания мембран необходимо соблюдать следующие правила. На дно стакана или другой емкости, в котором проводят кипячение, помещают «сторож для молока» или нержавеющую сетку для ограничения бурного кипения. Дистиллированную воду заливают в стакан или емкость в небольшом объеме, ограничивающем свободное вращение в ней фильтрующих мембран. Однако вода должна покрывать предназначенные для стерилизации фильтрующие мембраны. Дистиллированную воду доводят в сосуде до 80-90 °С, после чего, убавив нагрев, на поверхность воды по одной помещают фильтрующие мембраны. Воду с помещенными в нее мембранами медленно доводят до кипения и кипятят на слабом огне в течение 10-15 мин. Затем воду сливают и заменяют небольшим количеством (чтобы покрыть фильтрующие мембраны) стерильной дистиллированной воды. После чего фильтрующие мембраны готовы к употреблению. При необходимости проводят повторное кипячение фильтрующих мембран.
Подготовка фильтровального аппарата к анализу
Перед посевом воды фильтровальный аппарат стерилизуют фламбированием после обтирания ватным тампоном, смоченным спиртом. После охлаждения на нижнюю часть фильтровального аппарата (столик) кладут фламбированным пинцетом стерильный мембранный фильтр, прижимают его верхней частью прибора (стаканом, воронкой) и закрепляют устройством, предусмотренным конструкцией прибора.
Выполнение анализа
При исследовании питьевой воды анализируют 3 объема по 100 см3.
При получении стабильных отрицательных результатов допустима фильтрация 300 см3 через один фильтр.
При фильтрации воды неизвестного качества целесообразно увеличение количества фильтруемых объемов для получения изолированных колоний на фильтре (например, 10, 40, 100, 150 см3 воды).
Отмеренный объем воды фильтруют через мембранные фильтры.
Фильтры помещают на среду Эндо. Чашки с фильтрами ставят в термостат дном вверх и инкубируют посевы при температуре (37±1) °С в течение (24±2) ч.
Если на фильтрах нет роста или выросли пленчатые, губчатые, плесневые, прозрачные, расплывчатые колонии, выдают отрицательный ответ: отсутствие ОКБ И ТКБ в 100 см3 исследуемой воды.
Анализ заканчивают через 24 ч.
Если на фильтрах обнаружен рост изолированных типичных лактозоположительных колоний: темно-красных, красных с металлическим блеском или без него или других подобного типа колоний с отпечатком на обратной стороне фильтра, подсчитывают число колоний каждого типа отдельно и приступают к подтверждению их возможной принадлежности к ОКБ и ТКБ.
Для подтверждения наличия ОКБ исследуют:
- все колонии, если на фильтрах выросло менее 5 колоний;
- не менее 3-4 колоний каждого типа.
Для подтверждения наличия ТКБ исследуют все типичные колонии, но не более 10.
Каждую выбранную изолированную колонию исследуют на:
- наличие оксидазной активности;
- окраску по Г раму по 6.4.1;
- ферментацию лактозы до кислоты и газа.
Постановка оксидазного теста проводится по 6.3.2.
При контроле качества воды оксидазный тест предназначается для дифференциации бактерий семейства Enterobacteriaceae от бактерий семейства Pseudomonadaceae и других водных сапрофитных бактерий.
При положительном результате колонию из дальнейшего исследования исключают.
Если при исследовании колоний, окрашенных в темно-красный цвет, получают недостаточно четкий результат, необходимо пересеять культуру со среды Эндо на питательный агар. После инкубации тест повторяют.
Определение ферментации лактозы
Оставшуюся часть оксидазоотрицательной грамотрицательной изолированной колонии засевают параллельно в две пробирки с лактозной средой (лактозопептон- ной или полужидкой средой с лактозой) по 4.6.2.4:
- для подтверждения наличия ОКБ посев инкубируют при температуре (37±1) °С в течение 48 ч;
- для подтверждения наличия ТКБ посев осуществляют в среду, предварительно подогретую до температуры 43-44 °С, и инкубируют при температуре (44,0±0,5) °С в течение 24 ч.
Первичный учет образования кислоты и газа на подтверждающих полужидких средах возможен через 4-6 ч.
При обнаружении кислоты и газа дают положительный ответ.
При отсутствии кислоты и газа или при наличии только кислоты пробирки с посевами для окончательного учета ТКБ продолжают инкубировать до 24 ч.
Пробирки с посевами для подтверждения наличия ОКБ после просмотра через 24 ч и получения отрицательного результата продолжают инкубировать до 48 ч для окончательного учета.
Если колония, подлежащая исследованию, незначительных размеров, ее пересевают на скошенный питательный агар и после инкубации в течение 18-24 ч выполняют все необходимые подтверждающие тесты.
Грамотрицательные колонии учитываются как ОКБ при отрицательном окси- дазном тесте и ферментации лактозы при температуре 37 °С с образованием кислоты и газа.
Грамотрицательные колонии учитываются как ТКБ при отрицательном окси- дазном тесте и ферментации лактозы при температуре 44 °С с образованием кислоты и газа.
Если проведенные тесты дают положительный результат о принадлежности исследованных колоний к ОКБ (оксидазоотрицательные, грамотрицательные, ферментирующие лактозу с образованием кислоты и газа), то мы говорим о присутствии ОКБ в исследованном объеме.
Обработка результатов
При отсутствии общих и термотолерантных колиформных бактерий на всех фильтрах результат записывают «не обнаружено КОЕ ОКБ в 100 см3» и «не обнаружено КОЕ ТКБ в 100 см3».
После идентификации всех выросших подозрительных колоний число колониеобразующих единиц ОКБ и ТКБ подсчитывают на всех фильтрах и выражают числом КОЕ в 100см3 воды.
7.3.2.3 Определение общих и термотолерантных колиформных бактерий титрационным методом
Титрационный метод может быть использован:
- при отсутствии материалов и оборудования, необходимых для выполнения анализа методом мембранной фильтрации;
- при анализе воды с большим содержанием взвешенных веществ;
- в случае преобладания в воде посторонней микрофлоры. препятствующей получению на фильтрах изолированных колоний общих колиформных бактерий.
Сущность метода
Метод основан но накоплении бактерий поело посева установленного объема роды в жидкую питательную сроду с последующим пересевом на дифференциальную плотную питательную среду с лактозой и последующей идентификации колоний по культуральным и биохимическим тестам.
Проведение анализа
При исследовании питьевой воды качественным методом (текущий саиэпи- демнадзор, производственный контроль) засевают 3 объема по 100 см3 исследуемой воды.
При исследованиях воды с целью количественного определения ОКБ и ТКБ при повторном анализе проводят посев: 3 объемов по 100 см3, 3 объемов по 10 см3 и 3 объемов по 1 см3.
Каждый объем исследуемой воды засевают в лактозо-пептонную или глюкозо- пептонную среду, приготовленные по 4.6.2.4. Посев 100 см3 и 10 см3 воды проводят в 10 см3 и 1 см3 концентрированной среды, посев 1 см3 пробы проводят в 10 см3 среды обычной концентрации.
Посевы инкубируют при (37±1) °С в течение 24 ч при проведении анализа на среде ГПС и 48 ч при проведении анализа на среде ЛПС. Не ранее 24 ч инкубации проводят предварительную оценку посева. Из емкостей, где отмечено помутнение, изменение окраски (кислотообразование) и образование газа, а также помутнение и кислотообразование при использовании ГПС или помутнение при использовании ЛПС, проводят посев бактериологической петлей на сектора среды Эндо (4.6.2.6), разделенной на 3-4 сектора (5.6.2.2), для получения изолированных колоний. При получении сплошного роста необходимо рассеивать посевной материал на чашку со средой Эндо для выделения изолированных колоний.
Емкости без признаков роста на среде ЛПС оставляют в термостате и окончательно просматривают через 48 ч. Посевы без признаков роста считают отрицательными и дальнейшие исследования с ними не проводят. Из посевов, где отмечено помутнение и образование газа или только помутнение, делают высев на сектора среды Эндо.
Посевы на среде Эндо инкубируют при температуре (37±1) °С в течение 18-20 ч.
При отсутствии роста колоний на секторах среды Эндо, а также при наличии пленчатых, губчатых, с неровными краями и поверхностью, плесневых и других не характерных для кишечных палочек колоний получают отрицательный результат.
При образовании помутнения, газа и изменения цвета в среде накопления и росте на среде Эндо колоний, типичных для лактозоположительных бактерий: темно-красных или красных, с металлическим блеском или без него, выпуклых с красным центром и отпечатком на питательной среде (изменение цвета среды под колонией), дают положительный ответ на присутствие общих колиформных бактерий в данном объеме пробы.
Наличие ОКБ требуется подтвердить:
- если в среде накопления отмечено только помутнение;
- если принадлежность к лактозоположительным колониям вызывает сомнение у исследователя.
В этих случаях:
- проверяют наличие отпечатка на среде Эндо после снятия петлей подозрительной колонии;
- выполняют оксидазный тест;
- подтверждают принадлежность к Граму по 4.1;
- подтверждают способность к газообразованию при посеве изолированных 1-2 колоний каждого типа с каждого сектора на среду с лактозой по 4.6.2.4 с последующей инкубацией посевов при температуре (37±1) °С в течение 24-48 ч.
При отсутствии изолированных колоний проводят рассев на среду Эндо общепринятыми методами.
Отрицательный ответ дают, если:
- в среде накопления нет признаков роста;
- на секторах среды Эндо нет роста;
- на секторах среды Эндо выросли не характерные для колиформных бактерий колонии (прозрачные с неровными краями, расплывчатые и т.п.);
- все колонии оказались оксидазоположительными;
- все колонии оказались грамположительными;
- если в подтверждающем тесте на среде с углеводом не отмечено газообразования.
Для определения термотолерантных колиформных бактерий работают с секторами среды Эндо, где выросли типичные лактозоположительные колонии. Делают посев 2-3 изолированных колоний каждого типа с каждого сектора в пробирки с любой из лактозных сред.
Среду перед посевом нагревают на водяной бане или в термостате до 44 °С. Немедленно после посева пробирки помещают в термостат и инкубируют при температуре (44±1) °С в течение 24 ч. Допускается просмотр посевов через 4-6 ч.
При образовании газа в среде накопления, росте на среде Эндо лактозоположительных бактерий и выявлении способности этих бактерий ферментировать лактозу до кислоты и газа в течение 24 ч при температуре 44 °С дают положительный результат на наличие в этом объеме пробы воды ТКБ. Во всех остальных случаях дают отрицательный ответ.
Допускается для ускорения выдачи ответа на присутствие ТКБ проводить посев 1 см3 из объемов среды накопления, где отмечено помутнение и газообразование в пробирки с лактозо-пептонной средой с поплавком по 4.6.2.4 и предварительно прогретые до температуры 44 °С. Посевы выдерживают в термостате при температуре (44±1) °С в течение 24 ч. При обнаружении изменения окраски индикатора и образования газа дают положительный ответ.
Обработка результатов
При исследовании 3 объемов по 100 см3 результаты оцениваются качественно и при обнаружении ОКБ и ТКБ хотя бы в одном из 3 объемов, делается запись в журнале: «обнаружены в 100 см3».
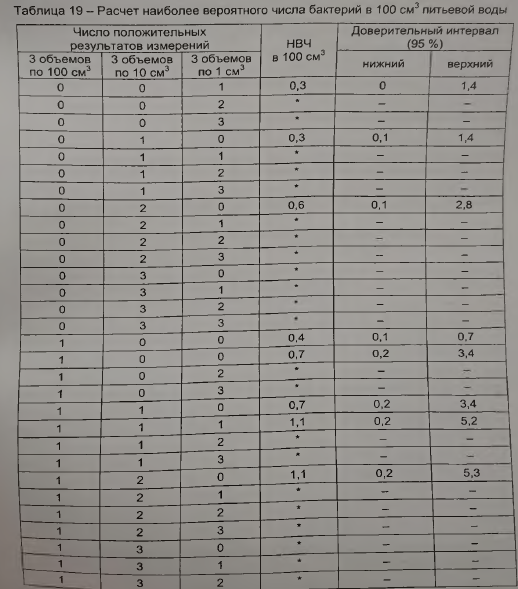
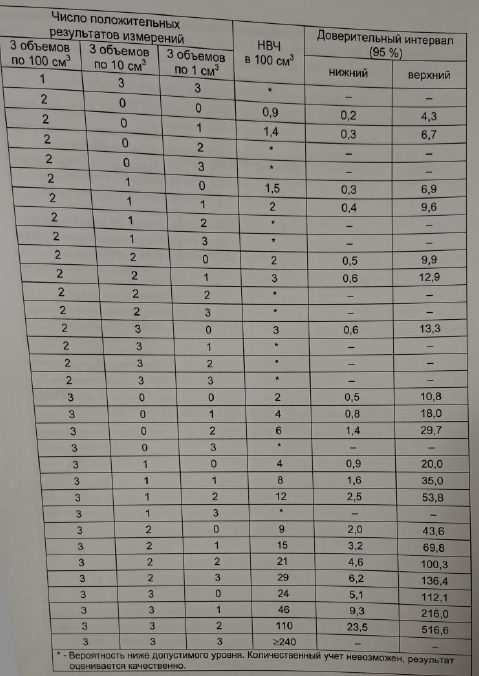
При исследовании количественным методом определяют наиболее вероятное число (НВЧ) ОКБ и ТКБ по таблице 19.
Результат представляют без доверительного интервала.
При отрицательном результате на наличие ОКБ и ТКБ во всех исследованных объемах выдают заключение в протоколе «не обнаружены в 100 см3».
Микробиологические показатели безопасности питьевой воды при контроле в условиях производственной лаборатории представлены в таблице 20.

Периодичность контроля:
- зависит от вида водоснабжения (централизованное или собственное) и вида выпускаемой продукции (непосредственное использование воды в ходе технологического процесса или для технических целей) и проводится 4-12 раз в год,
- усиленный контроль показателей проводят при появлении тех или иных характерных органолептических пороков продуктов или при снижении их хранимоспо- собности.
Картина роста БГКП на средах ГПС и ЛПС приведена в приложении Г.

