ОБЩИЕ СВЕДЕНИЯ
Термин «сальмонеллез» в настоящее время объединяет большую группу клинически полиморфно протекающих заболеваний, вызываемых разнообразными серотипами (более 1800) бактерий рода Salmonellae. Следовательно, сальмонеллез – это полиэтиологическая острая инфекционная болезнь. Ряд сальмонелл, адаптированных к паразитированию в организме человека, приобрел существенные отличия в биологических свойствах. Это послужило основанием к выделению в качестве самостоятельных болезней брюшного тифа, паратифов А и В.
Изучение этиологии сальмонеллеза началось с наблюдений Боллингера (1876, 1880), обратившего внимание на связь между септикопиемическими заболеваниями домашних животных и возникновением после употребления их мяса пищевых отравлений у людей. Позднее были разработаны первые рекомендации по профилактике пищевых отравлений. Дальнейшие успехи в изучении природы пищевых отравлений были связаны с развитием микробиологии.
Первые научные исследования этиологии пищевых отравлений связаны с именем немецкого ученого Гертнера, который в 1888 г. бо время вспышек пищевых отравлений и Тюрингии выделил одного и того же микроба из мяса коровы и селезенки погибшего человека. Выделенный микроб был назван Bact. enteritidis. В 1892 г. Лефлером был установлен возбудитель эпизоотии мышей – Bact. typhimurium. Через год Флюге и Кенще обнаружили сальмонелл у больных во время эпидемического подъема пищевых отравлений в Бреславле (ныне Вроцлав), назвав его Unci, enteritidis Breslau. Американские ветеринарные врачи Сальмон и Смит (1885) (выделили из органов свиней, погибших от чумы, микроб, названный позже Bact. suipestifer. Предполагалось, что этот микроб вызывал холеру у свиней в США и Германии. Однако впоследствии оказалось, что указанные заболевания вызывает специфический вирус, a Bact. suipestifer является лишь спутником истинного возбудителя заболевания. В связи с тем, что один и тот же микроб высевался у людей с пищевыми отравлениями в честь заслуг Сальмона по предложению Линьера его назвали сальмонеллой, а пищевое отравление, им вызываемое, – сальмонеллезом. Брюс и Уайт (1926) предложили распространить название «сальмонеллы» на всю группу паратифозных бактерий, а в 1934 г. Международная номенклатурная комиссия узаконила его название.
КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА ВОЗБУДИТЕЛЕЙ САЛЬМОНЕЛЛЕЗА
В настоящее время число выявленных представителей рода Salmonella приближается к 2000. Принимая во внимание практическую необходимость и многочисленность сероваров сальмонелл, предпринимались попытки их классификации.
В 1959 г. Е. Kauffmann предложил отдельные серотипы рода Salmonella рассматривать как бактериальные виды. Позднее (1961, 1963) он же дал определение рода Salmonella как «группы сероферментативных фаготипов», не изменяя при этом обычной номенклатуры серотипов.
На основании ферментативных характеристик F. Kauffmann (1966) разделил сальмонелл на 4 подрода (I, II, III, IV). При этом в качестве III подрода в род Salmonella была включена группа бактерий рода Arisona, ранее рассматривавшаяся как самостоятельный род.
Наиболее приемлемой и практически удобной классификацией рода сальмонелл является предложенная L. Le Minor, В. Rohde и J. Tayler (1970) и основанная на биохимических различиях членов рода, согласно которой подроды (по Kauffmann) рассматривались как виды, которым были даны следующие названия:
I подрод:
S. kauffmanii (в честь датского ученого F. Kauffmann) по предложению Е. Borman и соавт. (1944);
II подрод:
S. salame – по предложению L. Le Minor и соавт. (1970). Название происходит от первого описанного серотипа этого подрода (S. dares-salaame);
III подрод:
S. arisone– поредложено F. Kauffmann (1941).
IV подрод:
S. houtenae– по предложению L. Le Minor и соавт. (1970) название происходит от первого описанного серотипа (S. houten).
Авторы классификации указали, что в соответствии с договоренностью, принятой на IX Международном конгрессе по микробиологии (Москва, 1966), вновь выделяемые серотипы сальмонелл, принадлежащие к подродам II, III и IV, не получают названий, а с целью их систематики указываются их антигенные формулы. Серотипы из I подрода по-прежнему будут получать названия, основанные па географическом принципе, т. е. включать название страны, города, штата, района, в которых они были впервые выделены.
Следует отметить, что проблема классификации и номенклатуры сальмонелл обсуждается до сих пор. В частности, P.R. Edwards и W. Н. Ewing (1972) подразделили род сальмонелл на 3 вида – S. choleraesuis, S. typhi и S. enteritidis. Согласно этому предложению в названии отражены антигенные особенности – серотип (Ser) и биохимические свойства – биосеротип (biocer). Причем два первые вида на серотипы не делятся. Эта классификация принята подкомитетом по энтеробактериям американского' общества микробиологов и встречается в научной литературе.
Ряд устоявшихся названий серотипов сальмонелл в последнее время изменен. В частности, S. paratyphi С именуется теперь S. hirschfeldii, a S. paratyphi В – S. Schottmnelleri. Как было отмечено выше, III подрод сальмонелл представлен ранее самостоятельным родом Arizona. Впервые штамм бактерий, отнесенный к этому роду, был выделен от больных рептилий в 1939 г. М. Coldwell и D. Ryerson. Изучив этот штамм и обнаружив тесное родство его Н-антигенов с сальмонеллами, F. Kauffmann (1941) включил его в род сальмонелл.
Значение этого подрода сальмонелл в развитии отдельных вспышек сальмонеллеза не вызывает сомнений, несмотря па малочисленные сведения о его микробиологической характеристике и эпидемиологической роли [Murphy W., Morris J., 1950; Sechter L. et al., 1970].
В ряде случаев сальмонеллы убиквитарны (S. typhimnrltmi), хотя некоторые их представители свойственны только отдельным регионам. Так, в Северной Америке чаще обнаруживается S. berta, а в Южной – S. altona. П странах Дальнего Востока причиной сальмонеллеза чаще лпллотся S. sendai, а в Африке – S. wangata.
Ложное значение имеет полипатогенность сальмонелл. Польшипство сальмонелл патогенны как для человека, так к дли различных животных и птиц. Лишь S. typhi и S. paratyphi А и С являются исключением из этого правила. S. paratyphi В патогенна как для молодняка крупного рогатого скота и цыплят, так и для человека.
БИОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА САЛЬМОНЕЛЛ
Сальмонеллы – это мелкие бактерии вытянутой формы с закругленными концами длиной от 1 до 3 и диаметром от 0,5 до 0,8 нм. Большинство из них благодаря перитрихиально расположенным жгутикам подвижны. Некоторые мутанты сероваров сальмонелл неподвижны, и лишь S. gallinarium и S. pullorum всегда неподвижны.
Сальмонеллы долго сохраняют жизнеспособность во внешней среде. Так, в воде открытых водоемов и питьевой воде они живут от 11 до 120 дней, в морской воде – от 15 до 27 дней, в почве – от 1 до 9 мес, в комнатной пыли – от 80 до 547 дней, в колбасных изделиях – от 60 до 130 дней, в замороженном мясе – от 6 до 13 мес, в яйцах – до 13 мес, в яичном порошке – до 9 мес, на замороженных овощах и фруктах – от 2 нед до 2,5 мес [Килессо В. А., 1985]. Наиболее устойчивой является S. typhimurium, которая может оставаться жизнеспособной на тканях и на бумаге от 7 до 12 мес [Облапенко Г. П., 1980].
Оптимальной температурой для размножения сальмонелл является 35-37 °С. При температуре 5°С рост сальмонелл полностью прекращается. Размножение сальмонелл лимитируется и рН среды. Они могут расти при значении рН не ниже 4,1 и не выше 9. Рост сальмонелл могут подавлять или ограничивать высокие концентрации соли и сахара. Кипячение убивает сальмонелл мгновенно, хотя накопление в воде белковых веществ повышает термоустойчивость сальмонелл [Попович Г. Г., Вондаренко В. И., 1981]. При замораживании, наоборот, они могут оставаться жизнеспособными длительное время.
Наиболее эффективным дезинфицирующим средством р отношении сальмонелл является осветленный раствор хлорной извести, который в концентрации 0,3% при 30 мин экспозиции убивает сальмонелл через 1 ч. По данным С. Н. Черкинского (1975), хлорирование сточных вод в 6 раз снижает их обсемененность сальмонеллами.
На питательных средах большинство сальмонелл образует небольшие, диаметром 2-4 мм, колонии. Ряд сероваров (S. abortus equi, S. abortus ovis, S. typhi suis) образует более мелкие колонии, диаметром около 1 мм. Колонии сальмонелл на питательном агаре прозрачны, голубоватого цвета. При посеве на среду Эндо они слегка розоватые, прозрачные; иа среде Плоскирева – бесцветные, выглядят более плотными и мутноваты. На висмутсульфит агаре колонии всегда черного цвета, с металлическим блеском. Питательная среда под колонией окрашена в черный цвет. Ряд сероваров, в частности S. paratyphi С, образует на этой среде светлые, зеленоватые колонии.
Ферментативные свойства сальмонелл, послужившие одним из критериев выделения подродов, различаются даже в пределах одного серовара. Большинство сальмонелл аэрогенны, за исключением S. typhi, которая никогда не продуцирует газа. Однако анаэрогенные варианты описаны и у других сальмонелл. Так, это явление описано у S. paratyphi В [Красюк Л.С. и др., 1970], S. typhimurium [Арбузова В.А., 1960].
Образование сероводорода и отсутствие продукции индола, как и аэрогенность, – характерные свойства сальмонелл. Однако, по данным F. Kauffmann (1966), имеется не менее 30 сероваров, образующих индол. За исключением представителей III подрода, все сальмонеллы не способны ферментировать лактазу и салицин (кроме сальмонелл IV подрода). Основные биохимические признаки сальмонелл представлены в табл. 1, а основные биохимические признаки подродов сальмонелл – в табл. 2.
Таблица 1.
Основные биохимические признаки бактерий рода Salmonella
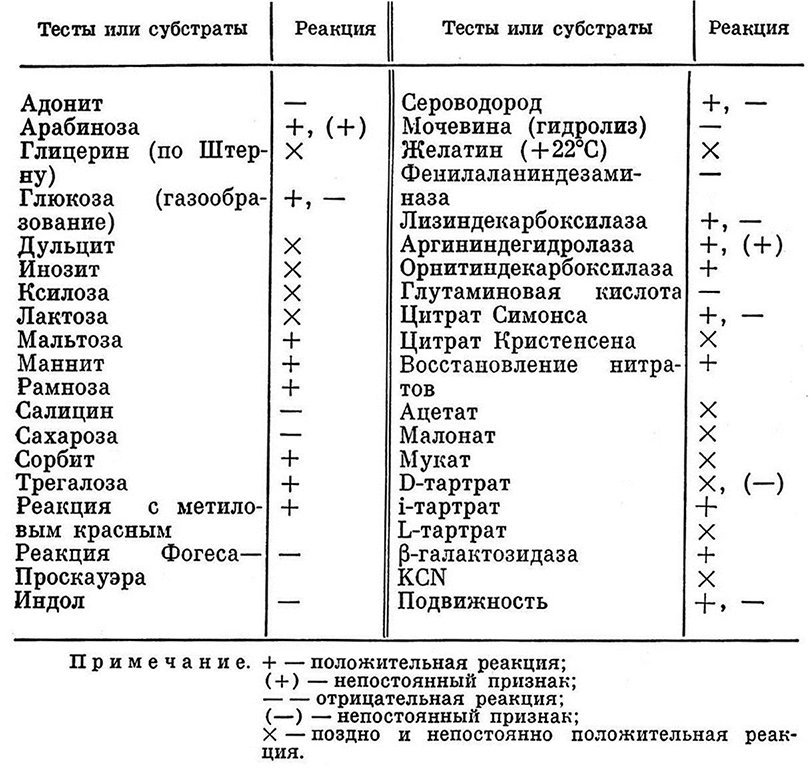
Таблица 2.
Основные биохимические признаки подродов сальмонелл

Подрод I включает в себя практически все известные ныне серовары сальмонелл. Представители подрода II – это редко встречающиеся серовары. В отличие от подрода I они разжижают желатин и дают положительную реакцию в тесте с малонатом натрия. Сальмонеллы IV подрода способны ферментировать салицин и расти в присутствии KCN.
АНТИГЕННАЯ СТРУКТУРА И СЕРОЛОГИЧЕСКАЯ ИДЕНТИФИКАЦИЯ САЛЬМОНЕЛЛ
Каждый серотип сальмонелл имеет характерный только для ного набор определенных антигенных факторов. Этот набор, составляющий антигенную структуру серотипа, складывается из сочетания О- и Н-антигенов микроба. О-аптиген расположен на поверхности микробной клеткк и представляет собой фосфолипидо-полисахаридный комплекс, включающий 60% полисахарида, 20–30% липида я 8,5–4,5% гексозамина. Этот комплекс термостабилен, не разрушается при кипячении в течение 2 ч. Наличие у сальмонелл Н-антигена определяется жгутиками.
В соответствии с предложением Кауфмана и Уайта (1934) все подроды сальмонелл по О-антигену делят на серологические группы, а по Н-антигену – на серотипы. Фенол и формалин разрушают О-антигенную детерминанту, что препятствует агглютинации штамма 0-антисывороткой. При этом Н-антиген разрушается. Спирты не разрушают О-антиген, но инактивируют Н-антигены. Указанные свойства Н- и О-антигенов используются для установления групповой (по О-антигену) и типовой (по Н-антигену) принадлежности сальмонелл.
Деление сальмонелл на серологические группы производят в соответствии с содержанием тех или иных О-антигенов, при этом отдельные антигенные факторы обозначают арабскими цифрами.
Специфичность О-антигена в серологических реакциях обусловлена дидезоксигексозами, расположенными на концах полисахаридных цепочек. Например, иммунный комплекс О-антигена 12 определяется двумя цепями, одна из которых оканчивается рамнозой, а другая – глюкозой. Антиген 9 (группа D) обусловлен полиозидом тивелозой (З-6-дидезокси-Д-манноза); антиген 2 (группа А) – паратозой.
Как было указано выше, выделение серологических типов обусловлено Н-антигенами. Последние у сальмонелл могут встречаться в двух серологических фазах: первой («специфическая») и второй («неспецифическая»). Антигены 1-й фазы обозначают прописными буквами латинского алфавита, 2-й фазы – арабскими цифрами или прописными латинскими буквами с арабскими цифрами. Сальмонеллы, в которых Н-антигены представлены двумя фазами, называют двухфазными в отличие от монофазных, имеющих только антигенные факторы 1-й фазы.
Состав антигенов, определяющий антигенную формулу сальмонелл, не является стабильным. Это представляется! том, что благодаря развитию различных вариаций Н- и О-антигенов у сальмонелл могут возникать закономерные иамо пения этих антигенов. Различают несколько видов антигенных вариаций: S-R-вариации – переход от гладкой формы (S-форма) к шероховатой (R-форма), влияющий па качественное и количественное изменение О-антигена. Трудпость идентификации колоний по их виду (гладкая, шероховатая) состоит в том, что в ряде случаев колонии по виду являются шероховатыми, а по серологическим свойствам содержат антигены гладких колоний и наоборот. Возникновение S-R-вариации О-антигена можно доказать по поведению штаммов в изотоническом растворе хлорида натрия – культуры из R-форм колоний выпадают в виде нестойкого агглютината, а из S-форм – остаются во взвешенном состоянии. При кипячении изотонического раствора NaCl культуры в R-форме образуют осадок на дне пробирки, в то же время культуры в S-форме находятся во взвешенном состоянии. Во избежание S-R-вариации среда для хранения штаммов сальмонелл не должна содержать углеводов, а пересевы необходимо производить как можно реже. Оптимальной для сохранения культур в S-форме является яичная среда (среда Дорсе) или высушивание в вакууме.
Н-О-вариации состоят в переходе из жгутиковой (НО-формы) в безжгутиковую О-форму. Неподвижные серовары (S. gallinarum, S. pullorum) существуют только в О-форме.
Vi-вариации определяются только Vi-антигеном, который является одним из компонентов О-антигена. Присутствие его на поверхности тела бактерий препятствует агглютинации последних О-сывороткой. Вопреки мнению A. Felix и R. М. Pitt (1934) доказано, что Vi-антиген не является носителем вирулентности микроба и может быть обнаружен у сальмонелл и у некоторых бактерий семейства кишечных (Escherichia, Citrobacter). Vi-вариации описаны только в отношении S. typhi:
а) V-форма – штамм содержит большое количество Vi-антигена и является О-инагглютинатальным;
б) W-форма – не содержит Vi-антиген, агглютинируется О-сывороткой;
в) VW-форма – содержит Vi-антиген, но агглютинируется О-сывороткой.
Имеются О-вариации, заключающиеся в количественном изменении О-антигена. Чаще всего это происходит с О-антигенами 1, 6 и 12. Наличие или отсутствие О-антигена 1 определяется конвертирующим фагом, ответственным за лизогенизацию [Stocker В., 1959]. Эта вариация возможна в серологических группах А, В и D, которым присущ О-антиген 1. При этом утрата лизогенности ведет к исчезновению этого антигена. Утрата или приобретение антигена за счет конвертирующего фага не влияет на название серовара.
В ряде случаев лизогенизация может сопровождаться полной заменой серовара. С помощью конвертирующего фага Ei 5, характерного для всех сальмонелл группы Ег, осуществлена замена О-антигена группы Ei (3, 10) на Ег (3, 15): S. anatum была превращена в S. newington [Isek J., Sakai Т., 1953, 1954]. Феномен фаговой конверсии обусловливает изменения и О-антигена 6 (группа С). N. Escobar и P. Edwards (1964) показали, что сальмонеллы, имевшие О-антигены 6 и 7, обладали фагом, способным конвертировать факторы 62 и 7 в 61 и 7.
Помимо количественного и качественного изменения О-антигенов, вариации могут затрагивать и Н-антигены. Качественные изменения жгутиковых антигенов состоят в наличии или отсутствии антигенных комплексов в 1-й и 2-й фазах. В зависимости от структуры Н-антигена различают монофазные и дифазные серовары. У последних одновременно присутствуют обе фазы Н-антигена. Указанные вариации Н- и О-антигенов в естественных условиях встречаются редко и не могут существенно осложнить работу бактериолога.
Помимо указанных выше антигенов, у сальмонелл установлены поверхностные К-антигены [Степанова Л.К., 1980]. Они представляют собой белково-полисахаридный комплекс с выраженными антигенными свойствами. F. Kauffmann обнаружил М-антиген (1935, 1936) и Т-антиген (1956, 1957) сальмонелл. Несмотря на многочисленность и вариабельность антигенов при серологической идентификации сальмонелл, принимают во внимание три основных антигена – О, Н, Vi. Во всех лабораториях мира используется диагностическая схема Кауфмана – Уайта, построенная на анализе этих трех антигенов. В соответствии с особенностями структуры О-антигенов в этой схеме выделены 50 О-групп. Каждая группа объединяет большее или меньшее количество сероваров, расположенных в альфавитном порядке по обозначению 1-й фазы их Н-антигепа (табл. 3).
Таблица 3.
Сокращенная схема антигенной структуры сальмонелл
по Кауфману-Уайту

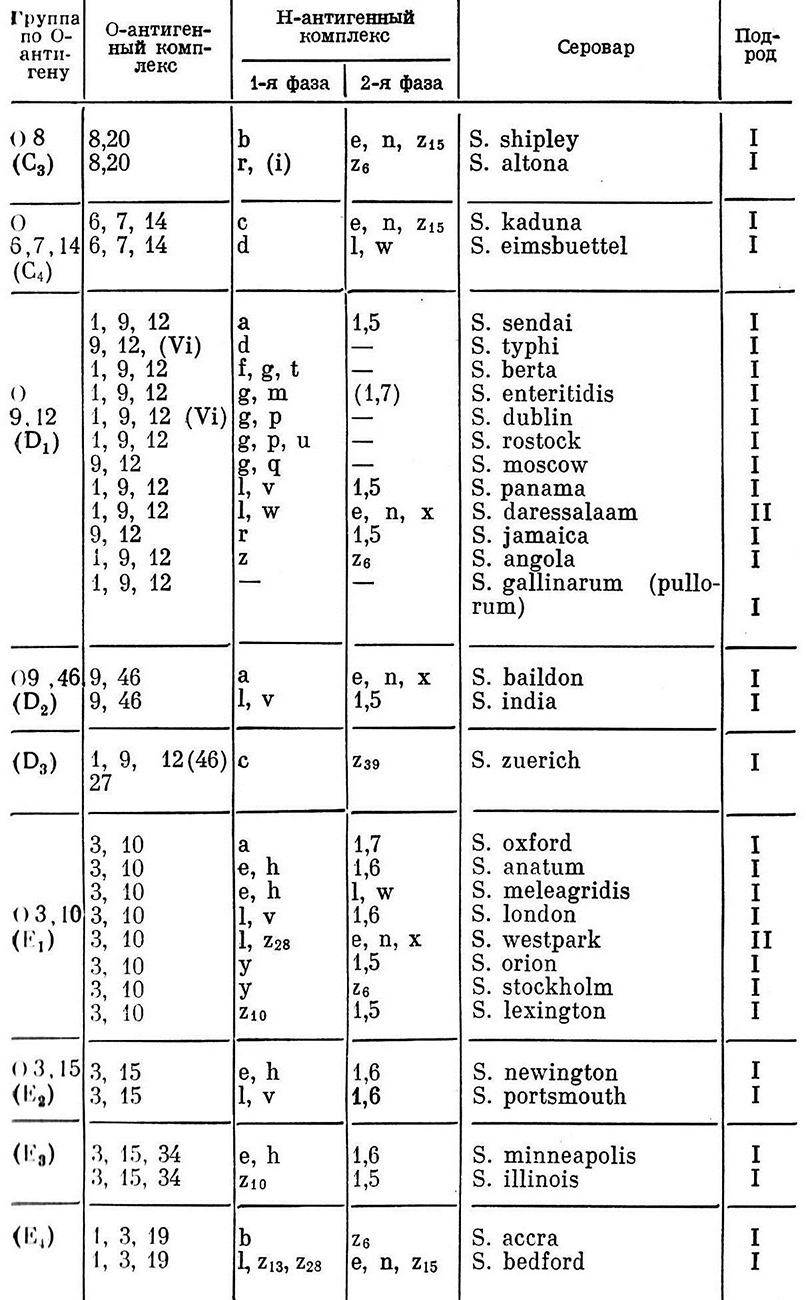
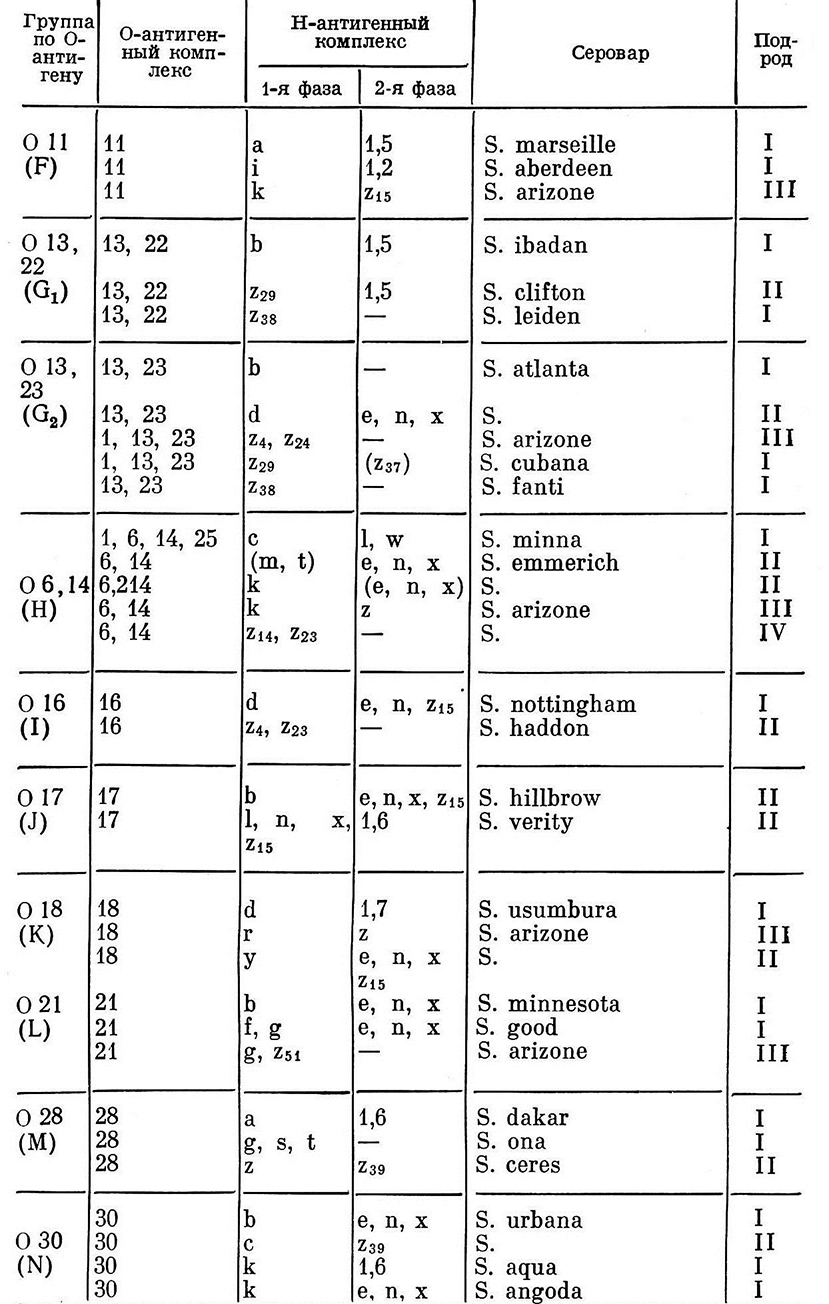
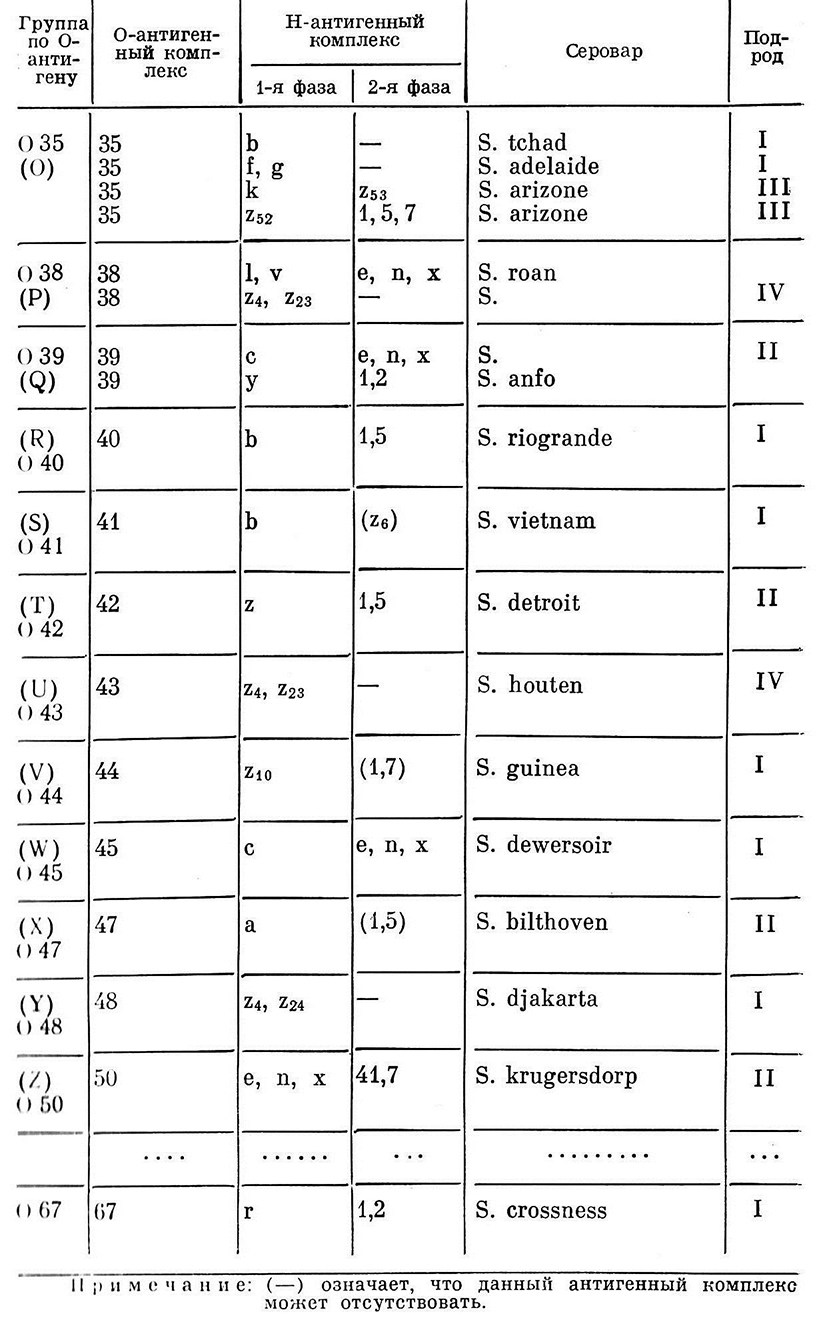
Определение серовара сальмонелл начинается с изучения выделенной культуры в реакции агглютинации на стекле с поливалентной (ABCDE) адсорбированной О-сывороткой. При наличии агглютинации культуру испытывают с отдельной групповой сывороткой и далее с монорецепторнммн Н-сыворотками. После определения антигенов 1-й фазы анализируют антигены 2-й, что позволяет установить антигенную формулу серовара. При отсутствии агглютинации с поливалентной ABCDE 0-сывороткой и положительной реакции с поливалентной сывороткой редких групп проводят дополнительные биохимические тесты c целью определения принадлежности к подродам сальмонелл. При положительном решении далее исследуют штамм с помощью моновалентных О-сывороток редких групп и Н-сывороток.
Важное значение для идентификации имеет определение чувствительности штамма к сальмонеллезному О-бактериофагу. Он лизирует 97,5% штаммов сальмонелл [Килессо В. А., 1963; Felix A., Callow В., 1943]. Вместе с тем ряд часто встречающихся сероваров устойчив к этому фагу (S. derby, S. tennessee, S. anatum, S. london).
Для установления источников инфекции, эпидемиологических связей между отдельными заболеваниями, дифференциации привозных случаев от местных определение антигенной формулы распространенных штаммов сальмонелл дополняется внутрисероваровым разделением. С этой целью определяют биовары и фаговары. Известно, что в пределах одного серовара встречается большее или меньшее число стабильных биохимических вариантов бактерий Выделение биоваров основано на ферментативной активности штамма по отношению к углеводам. В частности, у S. typhimurium имеется 25 стабильных биоваров, а биовары S. enteritidis и S. dublin имеют даже отдельные названия (denysz, chaco, essen, acara, coeln).
В качестве эпидемиологических маркеров используют и фаготип сальмонелл. В настоящее время существуют схемы для фаготипирования, основанные на специфичности бактериофага по отношению к микробу-хозяину. Известны типовые фаги к S. typhimurium, S. enteritidis, S. dublin и др. В настоящее время у S. typhimurium различают 90 фаготипов, причем ряд типов имеет ограниченное распространение. Особый интерес у специалистов вызывает фаготип 29 S. typhimurium. Полагают, что он ответствен за внутрибольничные вспышки сальмонеллеза. Этот фаготип распространяется только среди людей (контактно-бытовой путь), вызывает тяжелые формы сальмонеллеза, устойчив к антибиотикам. По мнению Р. А. Агаева (1978), внутрибольничные вспышки могут вызывать и другие фаготипы этой сальмонеллы. Существует обоснованное мнение, что «госпитальный» штамм S. typhimurium представляет собой особую биологическую разновидность, резистентную к большинству антибиотиков, нечувствительную к типовым фагам, обладающую повышенной термоустойчивостью и повышенным содержанием фермента лизиндекарбоксилазы [Покровский В. И. и др., 1981; Hrabar A., Tiljak-Misicz Z., 1977]. Предполагают, что «госпитализация» может отмечаться у S. wien, S. agona, S. infantis и S. isangi [Арбузова В. A., 1978; Канев Э. Ф., 1980].
Помимо исключительной роли антигенных комплексов сальмонелл для идентификации, необходимо иметь в виду и их значение в развитии заболевания. Известно, что очищенные К-антигены нетоксичны, но обладают выраженными антигенными свойствами. По мнению JI. К. Степановой (1978), К-антигены ответственны за способность сальмонелл к пенетрации в макрофаги с последующим размножением в них. У штаммов, имеющих только О-антиген, выражено исключительно цитопатичеекое действие. Поэтому антитела против К-антигена препятствуют внутриклеточному размножению сальмонелл, а О-антитела обеспечивают антитоксический иммунитет.
РОЛЬ АНТИГЕННЫХ КОМПЛЕКСОВ САЛЬМОНЕЛЛ В ПАТОГЕНЕЗЕ САЛЬМОНЕЛЛЕЗА
По данным многах исследователей, в возникновении сальмонеллеза ведущую роль играют живые бактерии, гибель которых в организме больного сопровождается развитием эндотоксинемии [Будягян Ф. Е., 1941; Werder, Sutton, 1933]. Такого же мнения придерживается и большинство современных клиницистов [Билибин А. Ф., 1964; Блюгер А. Ф. и др., 1975; Бунин К. В., 1975, 1978; Покровский В. П., 1979, 1983].
Принято выделять 2 вида токсичных продуктов жизнедеятельности микробов – экзотоксин и эндотоксин. К экзотоксинам отнесены токсичные продукты жизнедеятельности бактерий, активно (при жизни) секретируемые в окружающую среду, а к эндотоксинам – те ядовитые для макроорганизма продукты жизнедеятельности, которые освобождаются только при лизисе микробной клетки [Мельников В. И. и др., 1969].
По мнению большинства исследователей, основным фактором, ответственным за развитие заболевания, является эндотоксиновый комплекс сальмонелл. Вместе с тем в последние годы появились данные, свидетельствующие о способности этих микробов к продукции экзотоксина.
Роли эндотоксинов в патогенезе заболеваний, вызванных грамотрицательными микробами, посвящено огромное количество исследований, ведущих начало от работ И. И. Мечникова (1889).
Благодаря цитохимическим, иммунохимическим исследованиям получены важные сведения о молекулярной структур! эндотоксина грамотрицательных бактерий, установлена близость их архитектоники, химического состава и биологических свойств.
Электронно-микроскопическими методами установлено, что клеточная стенка грамотрицательных бактерий имеет 6-слойную структуру [Авакян А. А. и др., 1972]. Наружный слой клеточной стенки толщиной 2-4 нм содержит в основном лицопротеиды и рыхло связан с подлежащим слоем. Далее расположен пластичный слой, представленный 3-слойной мембраной, имеющей асимметричное строение: ее наружный слой толще (4,5-5,5 нм) внутреннего (2,5 нм) электроннснплотного слоя. Между ними расположен менее плотный средний слой. Пластичный слой образован комплексам липополисахаридов (ЛПС) и белков. Липоиротеидцый комплекс образует 5-й слой, названный глобулярным. Этот слой ковалентно связан с 6-м слоем – пептидогликаном [Тимаков В. Д. и др., 1980].
Изучение химической структуры клеточной стенки энтеробактерий позволило выделить 2 комплекса соединений, относящихся к внешней мембране (первым 5 слоям) и пептидогликану. Внешняя мембрана содержит 7x105 молекул липида, 1,3x106 молекул белка и 0,7X105 единиц ЛПС на одну клетку. Полагают, что фосфолипиды и белки, входящие в состав различных энтеробактерий, сходны по структуре и составу [Захарова И. Я., 1980; Соловьева Т. Ф., Овидов Ю. С., 1980].
Липиды внешней мембраны представлены в основном «фосфолипидами: фосфатидилзтаноламином (85%), фосфазидилглицерином и дифосфатидилглицерином. В состав липидов входят насыщенные и ненасыщенные жирные кислоты с разветвленной цепью из 16–18 атомов углерода, что является характерным признаком для грамотрицательных микробов и используется для их таксономии [Salton М. R., Owen Р., 1976].
Белки внешней мембраны состоят из основных (4-5) л минорных (8-19) компонентов с различной молекулярной массой. Эти белки наиболее полно изучены у Е. coli и S. typhimurium [Di Rienzo J. M. et al., 1978]. В основном они являются рецепторами для фагов и колицинов. Эти белки пронизывают клеточную стенку микробов и служат порами для диффузии химических соединений через мембрану в клетку, что и дало основание назвать их белками-поринами. В клетке обнаружено 1,1x10s молекул матрикелых белков и 7,2 x105 молекул белка липопротепда.
Липопротеид считается основным компонентом внешней мембраны. В клеточной стенке он находится в 2 формах: свободной (2,4x105 молекул на клетку) и связанной с пептидогликаном (4,8x105 молекул). Липопротеид состоит из 58 аминокислотных остатков. С помощью Е-аминогруппы С-терминального лизина полипептид связан с карбоксильной группой каждого 10-12-го остатка диамино-пимелиновой кислоты пептидогликана, а с N-конца через цистеин к полипептиду присоединен диглицеридный остаток, который имеет фосфолипидное происхождение. N-терминальный конец липопротеида представлен глицерилцистеином с двумя эфиро- и одной амидосвязатшой жирной кислотой. Последние являются мононенасыщенными и на 65 % состоят из пальмитата [Di Rienzo J. М. et al., 1978].
Пептидная часть липопротеида представляет конформационно а-сшграль. Полагают, что 6 молекул таких спиралей формируют суперспираль, которая в комплексе с матриксными белками формирует каналы-поры для пассивной диффузии химических соединений через мембрану [Di Rienzo J. М., 1978].
В формировании клеточной стенки энтеробактерий большую роль играет комплекс ЛПС, определяющий в отличие от белков антигенную специфичность клетки. Большая часть ЛПС локализована во внешней мембране и лишь незначительная ее часть обнаруживается за пределами последней в виде О-специфических боковых цепей полисахарида, ЛПС содержит липиды и карбогидрат, к которому присоединены детерминантные группы Сахаров. Во внешней мембране молекулы ЛПС через двухвалентные катионы связаны друг с другом, а через гидрофобные и иопные взаимодействия – с фосфатными группами фосфолипидов и основными аминокислотами белков. Это обеспечивает большую подвижность липидов и ЛПС в мембране [Leive L., 1974].
Последний, 6-й, слой микробной клетки – пептидогликан (муреиновый или мукопептидный слой). Муреин, составляющий гликановый остов пептидогликана, представлен повторяющимися единицами N-ацетилглюкамина и N-ацетилмурановой кислоты, связанной Д-аланином. Его поптидная часть кроме Д-аланина содержит тетрапептиды, состоящие из L-аланина, D-изоглутаминовой кислоты. L-лизипа или диаминопимелиновой кислоты. Формы связывания, структура и состав пептидов у разных энтеробактерий различны [Salton М. R., Owen В, 1976]. Кроме того, с помощью химического анализа установлено, что муреиновый слой энтеробактерий содержит липопротоидпые молекулы [Braun V., 1973].
Цитоплазматическая мембрана состоит из гидрофобной зоны фосфолипидов, которую пронизывают белковые тяжи. Структурные белки мембраны встроены в двойной фосфолипидный слой. Остальные белковые компоненты соединяются гидрофобными связями либо с внешней, либо с внутренней стороной мембраны [Salton М. R., Owen Р., 1976]. Между пептидогликаном внешней мембраны и цитоплазматической мембраной располагается периплазматическое пространство, в котором аккумулируются периплазматичеекие белки. Большая часть их представлена гидролазами (щелочная и кислая фосфатазы, фосфодиэстераза циклического аденозинмонофосфата, пенициллиназа и др.). Другую часть представляют белки, включенные в активный транспорт (связывающие белки). Часть из них расположена свободно (связывающие лейцин, аргинин, сульфат, галактозу), а часть соединена с внешней стороной цитоплазматической мембраны (белки, транспортирующие лактозу, пролин, фосфотрансферазу II).
На внутренней стороне мембраны синтезируются основные химические единицы муреина, липополисахарида, фосфолипиды, белки. Всего в Цитоплазматической мембране обнаружено около 120 белков. На мембране фиксируются шгазмиды, а также бактериальные хромосомы в период роста и деления микробной клетки. Цитоплазматическая мембрана ответственна за перенос электронов, активный транспорт химических соединений, синтез и перенос предшественников липидов, необходимых для построения клеточной стенки, синтез и перенос белков в периплазматическое пространство [Salton М. R., Owen Р., 1976].
При сальмонеллезе стенка кишечной бактерии становится мишенью для бактериоцинов, различных классов антител (агглютинины, бактериолизины, опсонины, комплементсвязывающие антитела и др.). В результате этих воздействий клетка подвергается лизису и в окружающую среду попадают различные компоненты клеточной стенки и ее цитоплазмы. Эти компоненты чрезвычайно близки по составу к тканям организма, что, с одной стороны, подчеркивает единство различных биологических видов, а с другой – объясняет их высокую физиологическую активность по отношению к макроорганизму.
Выделение эндотоксинов из энтеробактерий основано на разрыве связей, в основном ковалентных (гидрофобных, ионных и др.), которыми они связаны с другими компонентами клеточной стенки. Уже первые опыты выделения эндотоксинов показали, что они являются сложными молекулярными комплексами, состоящими из белка, полисахарида и липида и локализованными в клеточной стенке [Boivin A. et al., 1933; Morgan Т. J., 1936].
Для извлечения из микробной стенки антигенов (эндотоксинов) используют три группы методов:
а) обработку клеточной стенки растворителями кислотного и нейтрального характера, диэтиленгликолем, мочевиной, формамидом и водным пиридином, фенолом, смесью фенол/вода;
б) ферментативное расщепление микробной массы с последующим извлечением антигенов (эндотоксинов);
в) физическое воздействие на микробную клетку (замораживание и оттаивание, ультразвук и др.).
Кратко характеризуя методические подходы к выделению эндотоксинов, следует отметить, что метод Буавена обеспечивает выделение относительно неповрежденного эндотоксинового комплекса, состоящего из трех компонентов клеточной стенки, наиболее полно отражающих О-серологические свойства и токсичность целой микробной клетки. В связи с этим представляет интерес и цикл работ группы авторов, изучавших мутанты Е. соН, у которых отсутствовал фермент, декарбоксилирующий диаминопимелиновую кислоту в лизин [Meadow Р. М., 1957; Municio А. М. et al., 1963; Knox К. W. et al., 1966 и др.]. В отсутствие лизина в среде эти микробы выделяли в окружающую среду большое количество ЛПС – основного компонента эндотоксина (около 700 мг/мл). Этот ЛПС содержал 24-28% липида, 9-12% белка и около 60% полисахарида. При сравнении этого внеклеточного ЛПС и ЛПС, выделенного из клеток, выросших в присутствии лизина, т. е. «нормальных» клеток, было установлено, что они полностью идентичны по химическому составу. Комплексы такого типа очень близки к полному антигену Буавена. В этой связи необходимо отметить, что в литературе нередко термин «эндотоксин» приравнивают к термину «липополисахарид». Однако эти понятия неравнозначны. ЛПС является основным компонентом эндотоксина, но только его компонентом, поэтому он не может характеризовать биологические свойства всего комплекса эндотоксина.
Химический состав эндотоксинового комплекса, выделенного методом Буавена, очень близок к составу клеточной стенки, установленному цитохимическими методами. При воздействии формамидом на эндотоксиновый комплекс Буавена от него отщепляется липид В. При этом не изменяются ни О-антигенная специфичность, ни биологические свойства эндотоксина. Липид В включает в себя фосфатидилэтаноламин, являющийся основным фосфолипидом клеточной стенки бактерий рода Enterobacteriacae [Rothfield R. et al„ 1969].
Белки эндотоксинового комплекса недостаточно изучены. Полагают, что их удаление снижает иммуногенность комплекса, но не влияет на серологические и токсические характеристики [Westphal О. et al., 1952]. Вместе с тем в работах ряда авторов установлено обратное. Было высказано предположение о том, что схожие проявления токсичности различных энтеробактерий обусловлены идентичным, составом белков грамотрицательных микробов. Причем токсичные свойства целого эндотоксинового комплекса зависят либо от комплекса липидов с углеводами, либо от комплекса липидов с белками. Продукты кислотного (и щелочного) гидролиза комплексного антигена Буавена обладали вдвое меньшей токсичностью, чем сам комплексный антиген.
Общепризнано, что токсическое действие второй части эндотоксинового комплекса – липополисахарида – сильнее [Westphal О. et al., 1952]. В зависимости от способа выделения он может находиться либо в свободной форме, либо в нативиой, т. е. в связи с белками и фосфолипидом. Метод Буавена обеспечивает выделение нативной формы молекулы ЛПС. Благодаря применению этого и других методов выделения строение ЛПС достаточно хорошо изучено [Езепчук Ю. П., 1977; Luderitz О. et al., 1981].
Молекула ЛПС состоит из 2 компонентов: полисахарида и липида А. Полиеахаридная часть молекулы представлена олигосахаридом кора и О-специфическими углеводными цепями, которые присоединены к коре в виде боковых цепей. Структура цепей определяет серологическую специфичность ЛПС, в то время как олигосахарид кора (сердцевина) в ЛПС бактерий одного вида постоянен.
Липидный фрагмент ЛПС – липид А – присоединен к кору кислотолабильной связью. По своей структуре липид А является фосфорилированным дисахаридом, гидроксильные и аминогруппы которого этерифицированы длинноцепочечньтми жирными кислотами. Многочисленными исследованиями установлено, что структуры молекул липида А в ЛПС различных энтеробактерий очень похожи.
Жирные кислоты являются главным компонентом липида А. Именно они ответственны за гидрофобность липида А и, вероятно, за его токсичность. У энтеробактерий преобладают насыщенные незамещенные жирные кислоты и 3-оксижирные кислоты. Наибольший вклад в изучение структуры липида А сальмонелл сделан при изучении гептозонегативного штамма S. typhimurium [Westphal О. et al., 1969].
Установлено также, что составная часть ЛПС – липид А – является центром токсичности всей молекулы ЛПС [Климанова Г. В. и др., 1978; Luderitz О. et al., 1973]. Однако существует обоснованное мнение, что токсичность эндотоксинового комплекса определяется всеми компонентами молекулы эндотоксина (белок, ЛПС и даже полисахаридный компонент) [Kessel R. W. J. et al., 1966].
Роль белков в токсичности эндотоксинового комплекса заслуживает внимания [Петровская В. Г., 1977; Peterson J. W. et al., 1979]. Среди бактерий кишечной группы обнаружены отдельные штаммы, эндотоксины которых содержали белковые компоненты, обладающие высокой биологической активностью. Это прежде всего колицины. Было установлено, что колицины выделяются в составе эндотоксинового комплекса Е. coli [Mesrobeanu I. et al., 1964]. Этот белок обладал бактерицидной активностью, в то время как О-антиген (эндотоксин) таким свойством не обладал. Высказано предположение, что присоединение к такому белку полисахарида и фосфолипида угнетает это свойство белка. Колициногения передается штаммам через фаги или эписомы инфекционным путем. В результате формируется новое свойство, ранее не характерное для этого вида микробов. Ю. Е. Полоцкий и Т. А. Авдеева (1981) утверждают, что энтеротоксигенность, а не эндотоксиновый комплекс сальмонелл, эшерихий, шигелл обеспечивает решающее влияние на патогенез этих заболеваний, прежде всего вызывает усиление секреции электролитов и жидкости в кишечнике.
Для решения вопроса о значении энтеротоксинов сальмонелл в патогенезе заболеваний используется метод аналогии. Известно, что система токоигенности строится на генах, не сцепленных с теми, которые детерминируют синтез биополимеров и структур, необходимых для течения коренных процессов, обеспечивающих существование данного вида микроорганизмов [Далин М. В., Фиш Н. Г., 1980]. Свойство энтеротоксигенности с этих позиций является качеством, присущим виду сальмонелл, no реализуемое не во всех ситуациях. Вариабельность этого признака у сальмонелл отнюдь не фенотипическая, поскольку токс+гены, ответственные за синтез энтеротоксина в такой популяции, отсутствуют. В этой связи эндотоксиновый комплекс, выделяемый методом Буавена, отражает присущие виду сальмонелл, генетически определенные структуры и компоненты, которые, за исключением мутантов, всегда присутствуют в этих микробах и, следовательно, при шбели микробов могут проявить свою биологическую активность.
Гипотеза об обособленности генов, Кодирующих синтеа белковых токсинов, в том числе и энтеротоксинов, была подтверждена при использовании химических соединений, избирательно действующих на маркеры, содержащиеся во внехромосомном аппарате – ллазмидах. Так, Smith Н. (1968) сообщил о плазмидной локализации токс+генов Е. coli, ответственных за энтеротоксигенность, одновременно показав, что имеется возможность межродовой и межвидовой передачи плазмиды, содержащей этот ген. В частности, было установлено, что эта плазмида может быть передана от Е. coli к S. typhimurium и S. enteritidis. Хорошо известно, что плазмиды могут передаваться от клетки к клетке инфекционным путем и могут существовать как автономно (внехромосомно), так и в виде эписом, т.е. будучи интегрированными или объединенными с бактериальной хромосомой.
В свете приведенных данных становится понятным, что передача признака энтеротоксигенности от одного вида бактерий к другому реализуется именно эписомным путем. В этой связи мы не можем согласиться с мнением Ю. Е. Полоцкого и соавт. (1978-1981) о том, что только энтеротоксигенность может быть ответственной за развитие патогенеза сальмонеллеза. Скорее всего, наоборот, этот признак является достаточно редким, определяемым эписомой свойством бактериальной клетки. Вероятно, так называемые госпитальные штаммы сальмонелл, характеризующиеся повышенной вирулентностью и патогенностью, как раз обладают этим дополнительным, заново приобретенным признаком энтеротоксигенности, который наслаивается на токсигенность классического эндотоксинового комплекса сальмонелл. Вероятность такого предположения основана на фактах утери токс+гена, ответственного за энтеротоксигенность. Ш. Д. Мошковский (1972) полагает, что утеря или приобретение токс+гена не отражается на общем морфологическом или биохимическом строении клетки.
Таким образом, эндотоксиновый комплекс сальмонелл, выделяемый методом Буавена, является максимально приближенным к нативному эндотоксиновому комплексу, локализованному в стенке микроба. Что же касается роли энтеротоксинов в генезисе токсических проявлений при сальмонеллезе, то, видимо, она достаточно велика, так как химический состав эндо- и энтеротоксинов сальмонелл близок [Bywater R. J., 1972]; они отличаются только по количеству белков.
БИОЛОГИЧЕСКИЕ СВОЙСТВА ЭНДОТОКСИНА САЛЬМОНЕЛЛ
Биологическая характеристика эндотоксина, ЛПС и липида А сложна и во многом противоречива. Биологическая активность ЛПС и липида А в значительной степени зависит, с одной стороны, от метода их выделения, а с другой– от физического состояния их молекул. В частности, установлена связь между конформацией и биологической активностью молекул ЛПС [Galanos С., 1975]. Что же касается токсичности, то она в большой степени зависела от субструктур и конформационных характеристик липида А [Luderitz О. et al., 1978]. По мнению О. Luderitz и соавт. (1981), токсичность липида А обеспечивается его субструктурным компонентом – глюкозамином. Липид А не обладал токсичностью в случаях его выделения из мутантных штаммов, не содержащих глюкозамин, или же из обычных штаммов, где он был химически замещен.
Помимо токсичности, ЛПС и липид А обладают еще более чем 30 видами биологической активности [Захарова Н. Я., 1980; Luderitz О. et al., 1981; Rietschel Е. Т. et al., 1982].
Внутривенно введенный эндотоксин прежде всего обнаруживался в печени. Вначале эндотоксин аккумулируется главным образом в купферовских клетках, а через 2-3 дня обнаруживался в гепатоцитах. Почки были свободны от эндотоксина. Через несколько часов после внутривенной инъекции эндотоксин появлялся в легких. При этом, по мнению М. Freudenberg и соавт. (1980), эндотоксинсодержащие клетки имели печеночное либо селезеночное происхождение. Установлено также, что после внутривенного введения эндотоксина последний, то крайней мере у крыс, в течение уже нескольких минут связывается с особым лшгопротеином плазмы. Полагают, что обнаружение эндотоксина в легких и связь его с липопротеинами плазмы отражает клиренс эндотоксина. Макрофаги после взаимодействия с эндотоксином выделяют в соответствии со спецификой ткани особые медиаторы, опосредующие действие эндотоксина на организм человека и высших животных. После инкубации макрофагов с эндотоксином обнаруженособый «эндогенный нироген», являющийся, по мнению С. Galanos и соавт. (1972) и Е. Т. Rietschel и соавт. (1973), причиной лихорадки при всех грамотрицательных инфекциях. Из макрофагов выделены также факторы: «стимулирующий колонизацию энтеробактерий» [Urbaschek D. et al., 1980] и «некротизирующий опухоли» [Mannell D. N. et al., 1980]. При инкубации эндотоксина с макрофагами последние способны выделять активаторы плазминогена, гормональной и ферментной систем. После контакта с эндотоксином макрофаги начинают секретировать интерферон, шстамин и серотонин, антагонисты глюкокортикоидов. Вместе с тем эндотоксивиндуцированная активация комплемента не имеет отношения к эндотоксичности ЛПС. Способность к активации системы комплемента присуща эндотоксинам практически всех энтеробактерий [Rietschell Е. Т. et al., 1982].
При анализе влияния эндотоксина энтеробактерий на системы органов и тканей показано, что воздействие ЛПС наиболее выражено по отношению к системе свертывания крови. Установлена способность эндотоксинов вызывать агрегацию тромбоцитов.
Установлена также ведущая роль эндотоксинов в усилении секреции электролитов и жидкостей на модели изолированной петли кишечника экспериментальных животных [Авцын А. П. и др., 1975; Ткаченко В. В., 1982]. Этой способностью обладают эндотоксины всех грамотрицательных бактерий. Именно с этим свойством эндотоксинов связывают водно-электролитные потери при сальмонеллезе [Giannella R. A. et al., 1979].
Установлена способность эндотоксинов вызывать резкие изменения гемодинамики организма человека и высших животных, а в ряде случаев при больших дозах осложнять циклическое течение заболевания развитием эндотоксинового шока [Киселев П. Н., 1971; Лыткин М. И. и др., 1980]. Хорошо изучен и феномен Санарелли – Шварцмана, вызываемый эндотоксином любых грамотрицательных бактерий и, как правило, заканчивающийся смертью экспериментального животного [Каныпина Н. Ф., 1979].
Приведенный анализ не охватывает всей совокупности биологических свойств эндотоксинов, но и он вполне достаточен для постановки вопроса о механизмах, ответственных за реализацию их биологических свойств. Вместе с тем полное понимание природы явлений, обусловленных эндотоксинами, не может быть достигнуто до тех пор, пока мы не сможем объяснить действие эндотоксина на молекулярном уровне. Сложность проблемы усугубляется химической сложностью и гетерогенностью липополисахаридов. Эндотоксины, принадлежащие даже одному и тому жештамму, при различных методах выделения могут иметь различный состав. С другой стороны, многообразный характер физиологических нарушений, вызываемых этими эндотоксинами, служит дополнительным препятствием на пути изучения механизмов их действия.
Анализ литературных данных позволяет выделить два подхода к объяснению биологических явлений, вызываемых эндотоксином. С одной стороны, имеется тенденция1 все биологические эффекты приписывать липиду А молекулы ЛПС [Luderitz О. et al., 1981]. По мнению других: исследователей, вирулентность и патогенность определяются качествами двух взаимодействующих систем – микроба (и его токсичных субстанций) и макроорганизма [Войно-Ясенецкий М. В., 1981]. D. W. Watson, J. Kim (1963) пришли к выводу, что эндотоксичность молекулы ЛПС имеет двоякую природу: первичную, обусловленную действием самой молекулы ЛПС, и вторичную, являющуюся результатом возникновения шперчувствительности замедленного типа (ГЗТ). Однако следует подчеркнуть, что эта гипотеза объясняет преимущественно одно биологическое свойство – местную реакцию Шварцмана. Все же иммунологическим механизмам придается важное значение в объяснении сути биологических проявлений действия эндотоксина.
По мнению С. A. Stetson (1961), об иммунологической природе биологической активности эндотоксина (лихорадка, шок, феномен Шварцмана) свидетельствует близость проявлений анафилаксии и эндотоксинемии. Однако не все свойства эндотоксинов можно объяснить развитием ГЗТ. В частности, трудно объяснить происхождение таких свойств эндотоксинов, как противоопухолевое действие [Балицкий К. П., Векслер И. Г., 1975, Ермольева 3. В., Вайсберг Г. Е., 1976]. Общеизвестное цитотоксическое действие эндотоксина также не укладывается в проявления ГЗТ.
Разнообразие свойств, вероятно, связано и с тем, что макроорганизм обладает набором специфических рецепторов. При взаимодействии с этими рецепторами эндотоксин вызывает секрецию специфических медиаторов, которые и ответственны за тот или иной биологический эффект. Таким образом, согласно этой гипотезе, многообразие биологических эффектов определяется не сложной структурой молекулы ЛПС и не влиянием ее отдельных компонентов, а наличием различных специфических рецепторов у макроорганизма.
Предполагают существование особых клеток, ответственных за взаимодействие с эндотоксином. Видимо, они относятся ж иммунной системе и представлены макрофагами. После контакта с эндотоксином происходят пролиферация и дифференцировка В-лимфоцитов и фибробластов. Следствием такого взаимодействия является секреция иммунокомпетентными клетками антител. Поэтому не исключено, что моноциты и макрофаш, в том числе купферовские клетки печени, являются первыми мишенями для эндотоксина.
В опытах с изолированной петлей кишечника эндотоксин и энтеротоксин энтеробактерий, в том числе сальмонелл, наряду с усилением секреции жидкости и воды вызывают резкое увеличение активности ряда ферментов, в частности фермента аденилатарсклазы [Юркив В. А., 1978]. Активация аденилатциклазной ферментной системы сопровождается резким повышением уровня циклического аденозинмонофосфата [Ющук Н. Д. и др., 1980].
Циклические нуклеотиды определяют самые разнообразные проявления биологической активности макроорганизма: опосредуют действие гормонов на клеточном уровне, участвуют в регуляции обмена веществ, активации энзимов, влияющих на проницаемость мембран и ряд других жизненно важных процессов. Все это послужило основанием считать циклические нуклеотиды универсальными внутриклеточными регуляторами [Федоров П. А., 1975].
Определяющее влияние на синтез циклических нуклеотидов оказывают простагландины, которые способны активировать аденилатциклазную систему клетки [Ажгихин И. С., 1978]. Синтез циклических нуклеотидов и простагландинов тесно связаны [Некрасова А. А. и др. 1982]. Не случайно эндо- и экзотоксины энтеробактерий, вызывая усиление секреции электролитов и жидкости, одновременно стимулируют синтез простаглаидинов и циклических нуклеотидов [Юркив В. А., 1978; Girannella R. A. et al., 1975].
Ряд биологических эффектов, вызываемых эндотоксинами (лихорадочная реакция, диарея, гипотензия, эндотоксиновый шок и др.), резко угнетаются при введении ингибиторов биосинтеза простагландинов [Giannella R. А. et al., 1973; Fletcher J. R., Rumwell P. W., 1978]. С другой стороны, введение экспериментальным животным простагландинов вызывало эффекты, чрезвычайно близкие к проявлениям действия эндотоксина энтеробактерий на микроорганизм [Ажгихин И. С., 1978].
По мнению R. A. Giannella (1979), повышение уровня простагландинов при экспериментальной сальмонеллезной лндотоксинемии объясняется сопутствующей воспалительной реакцией. J. A. Splavinsky (1978) полагает, что увеличение нростагландинов при введении животным эндотоксина Е. coli связано с ингибированием ферментов, ответственных за катаболизм простагландинов. Ранее A. G. Herman и J. R. Vane (1975) выдвинули гипотезу о том, что эндотоксины в различных тканях усиливают синтез эндогенных простагландинов. По мнению Е. Т. Rietschel и соавт. (1982), такими тканями могут быть только макрофаги.
Таким образом, анализ данных литературы свидетельствует о том, что имеется единодушие исследователей в признании определяющей роли токсинов энтеробактерий в патогенезе острых кишечных инфекций. Еместе с тем развитие клинической картины большинство авторов связывают с токсическим действием компонентов клеточной стенки энтеробактерий на макроорганизм. Об этом свидетельствуют и употребляемые до сих пор термины «эндотоксин», «экзотоксин», «энтеротоксин».
В большинстве исследований имеется существенная недооценка роли адаптационно-приспособительных механизмов макроорганизма в патогенезе заболевания. В этой связи вызывает закономерный интерес тот факт, что практически любой эндотоксин энтеробактерий в экспериментальных условиях вызывает значительное повышение уровней циклических нуклеотидов и простагландинов. Однако в большинстве случаев исследователи трактуют эти данные в свете традиционных представлений о токсической природе воздействия компонентов клеточной стенки энтеробактерий на макроорганизм. Мы полагаем, что именно но этой причине имеется противоречивость суждений о причинах повышения уровней простагландинов при экспериментальных эндотоксинемиях.

