ОБЩИЕ СВЕДЕНИЯ
Усиление биосинтеза простагландинов при сальмонеллезе оказывает влияние на обмен и других активных веществ, участвующих в регуляции гомеостаза. Постоянство внутренней среды организма человека обеспечивается, с одной стороны, многократным дублированием регуляции функций, а с другой – наличием определенной соподчиненности различных уровней регуляции.
При этом соподчиненность (иерархия) обязательно предполагает саморегуляцию и самоарганизованность целостного организма. Высший уровень саморегуляции обеспечивает изменение вететативных функций и поведения организма по сигналам внешнего мира. Средний – осуществляет приспособительные реакции в связи с изменениями внутренней среды организма. Низший уровень обеспечивает постоянство физиологических констант и обладает большой автономностью Горизонтов П. Д., 1981.
Включение различных уровней саморегуляции зависит от многих факторов, в том числе и от степени отклонения физиологических параметров. При этом саморегуляция внутренней жизнедеятельности, процессов тканевого и клеточного уровней относится к наиболее древним и генетически закрепленным функциям живых организмов Горизонтов П. Д., 1981. Саморегуляция функций предполагает, что на уровне клеток, тканей, ортанов, систем она является результатом взаимоотношения противоположных влияний – возбуждающих или ослабляющих факторов.
Известно, что на уровне систем, органов, тканей, отдельных клеток ретуляция функций осуществляется особой системой биохимических факторов, получившей название системы нейротуморальной регуляции. Ее гуморальные субстанции – физиологически активные вещества, непосредствевно участвуя в регуляции соматических функций, одновременно играют важную роль и в, процессах синаптической передачи. Таким образом, многообразие выполняемых функций является характерной чертой физиологически активных веществ. В условиях патологического процесса возникшие нарушения нейрогуморальной регуляции становятся факторами патогенеза заболевания.
К физиолотически активным веществам наряду с некоторыми гормонами относят медиаторы вегетативной нервной системы (ацетилхолин, норадреналин, адреналин), серотонин, гистамин, брадикинин, ангиотензин II, циклические нуклеотиды, простагландины, олигопептиды мозга (эндорфин, энкефалин), субстанцию Р [Гомозков О. В., 1981]. Важное значение имеет то, что спектр физиологической активности этих веществ может во многом совпадать. Это касается веществ с разной химической структурой и разной локализацией в тканях. Более того, одно и тоже вещество в зависимости от вида ткани (рецепторов) может вызывать противоположные по направленности эффекты. Свое регуляторное воздействие физиологически активные вещества могут оказывать как в месте своего синтеза, так и дистантно. Эти особенности определяются количеством синтезированных веществ или же состоянием инактивирующих их ферментов, величиной кровотока и др.
Какова же роль простагландинов в системе нейрогуморальной регуляции? Прежде всего следует остановиться на основных постулатах теории саиорегуляции регуляция не может быть обеспечена влиянием одного активирующего механизма. Это всегда единство противоположных влияний. Второе – саморегуляция обязательно предполагает обратную связь. Вместе с тем в патологии известно понятие о порочном круге. Его возникновение возможно только при реализации, положительной обратной связи в регуляции. При этом следствие активизирует причину, его (следствие) вызвавшую. Возникшее изменение является стимулом к увеличению воздействия на систему регуляции факторов, возбуждающих или угнетающих ее. Вэтом смысле важное значение имеет тот факт, что в физиологических условиях реализация регулирующего воздействия практически всех гуморальных субстанций сопряжена с активацией местного синтеза простагландинов. В многочисленных клинических и экспериментальных исследованиях получены убедительные доказательства высвобождения простагландинов из легких, сердца, почек, кишечника и других органов под влиянием катехоламинов, кининов, вазопрессина, ангиотензина [Гомозков О. В., 1981].
В свете этих, данных можно предполагать, что избыточный синтез простагландинов, развившийся под влиянием эндотоксина, вызывает функциональные отклонения самых различных органов и систем. Измепение функционального состояния в свою очередь вызывает изменения в уровнях других физиологически активных веществ, эффект, действия которых на конечном этапе вновь активизирует синтез простагландинов. Возникает классический порочный круг, в основе которого лежит мощный регуляторный эффект простагландинов на функцию систем, органов, тканей, клеток. Поддержанию этого порочного круга способствует и то, что, с одной стороны, большие количества разных простагландинов, особенно групп Е2 и F2, могут медиировать эффекты физиологически активных веществ. С другой стороны, доказано, что простагландины вызывают высвобождение ряда физиологически активных субстанций. В частности, было показано, что РGЕ2 и РGF2 вызывают дегрануляцию тучных клеток желудочнокишечного тракта и легких с последующим высвобождением гистамина. Результат действия высоких доз гистамина и серотонина в свою очередь опосредуется через активацию синтеза простагландинов.
Длительность патологического процесса, по нашему мнению, в значительной степени зависит от дозы эндогоксина. Его выделение с биологическими жидкостями, нейтрализующие эффекты факторов неспецифической и специфической иммунореактивности в конечном итоге создают подпороговые значения, которые уже не способны активизировать ферментную систему простагландинсинтетазы. Вероятно, имеет значение и состояние рецепторов к эндотоксину в этой ферментной системе. Естественное снижение активности ферментной системы биосинтеза простагландинов, вызванное указанными факторами, или фармакологический эффект индометацина в конечном итоге нормализуют уровни простагландинов и всей системы нейрогуморальной регуляции. В противном случае нарушения этого вида регуляции могут вызвать истощение адаптационных возможностей, что, видимо, ответственно за развитие токсикоинфекционного шока.
Проблема динамики изменений концентрации физиологически активных веществ в патотенезе сальмонеллеза до последнего времени остается неясной. Вместе с тем решение задачи повышения эффективности терапии немыслимо без четкого определения ведущих факторов нейрогуморальной регуляции. Только воздействие на ведущие факторы регуляции способно привести к быстрому восстановлению функционального состояния различных органов и систем.
В настоящее время не вызывает сомнений, что при среднетяжелом и тяжелом течении сальмонеллеза и других токсикоинфекций основным патофизиологическим фактором является потеря жидкостей и электролитов. Состояние обезвоженности саломо по себе является фактором, воздействующим на многие регуляторные механизмы, прежде всего на тканевом уровне или среднем уровне саморегуляции. В этой связи значительный интерес вызывает исследование функционального состояния систем ре« гуляции водноэлектролитного баланса.
РЕНИНАНГИОТЕНЗИНАЛЬДОСТЕРОНОНАЯ СИСТЕМА
Ренинангиотензинальдостероновая система является одним из важнейших факторов нейрогуморальной регуляции, ответственных за состояние водноэлектролитного обмена. В остром периоде заболевания нами установлено, что активность этой системы достоверно повышена по сравнению со здоровыми лицами. С нашей точки зрения, аналнз динамики уровней компонентов этой системы на фоне проводимого лечения должен дать ответ на вопрос об эффективности воздействия лечебных факторов на регуляторные процессы. Иначе говоря, если лечение патогенетически обосновано, то оно э первую очередь должно влиять на механизмы саморегуляции на тканевом уровне. Если исходить из представлений о порочном круге в системе регуляции, ответственном за развитие патологического процесса, то чрезвычайно важно уяснить, каким образом метод лечения воздействует на прерывания этого порочного круга.
Для уточнения роли ренинангиотензинальдостерононой системы, а также катехоламинов, кннинов, гистамина и серотонина в развитии нарушений регуляции различных органов и систем нами проведено изучение, динамики изменений их концентрации.
Анализ функционального оостояния ренинангиотензинальдостероновой системы выявил, что в сопоставимых по тяжести и степени дегидратации группах больных юрием индометацина (опытная группа) уже через 1012 ч приводил к достоверному снижению активности ренина, в плазме крови. У больных,,получавших лишь регидратационную терапию (контрольная группа), в этот период обследования отмечено некоторое повышение активности ренина в плазме (рис. 15).
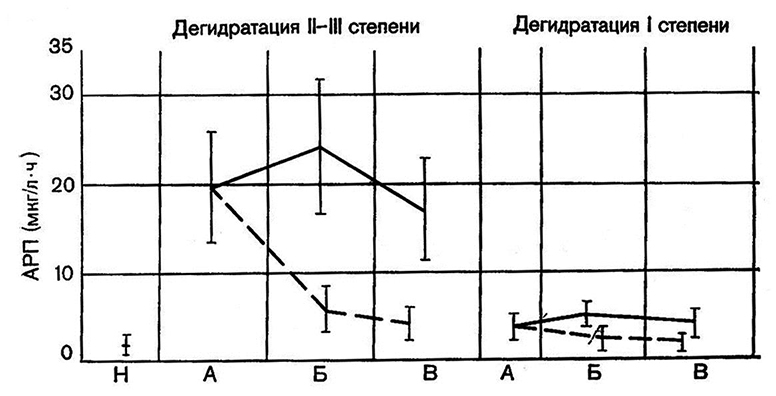
Рис. 15. Изменения активности ренина плазмы (АРП) крови при лечении сальмонеллеза.
Н – контроль; А – разгар болезни; Б – через 1012 ч после начала лечения; В – реконвалесценция.
Сплошная линия – лечение раствором «Квартасоль»; пунктирная – лечение индометацином.
Напротив, изменения концентрации альдостерона в плазме в обеих группах имели одинаковую направленность. Она восстанавливалась до нормы через 1012 ч после начала лечения (рис. 16).
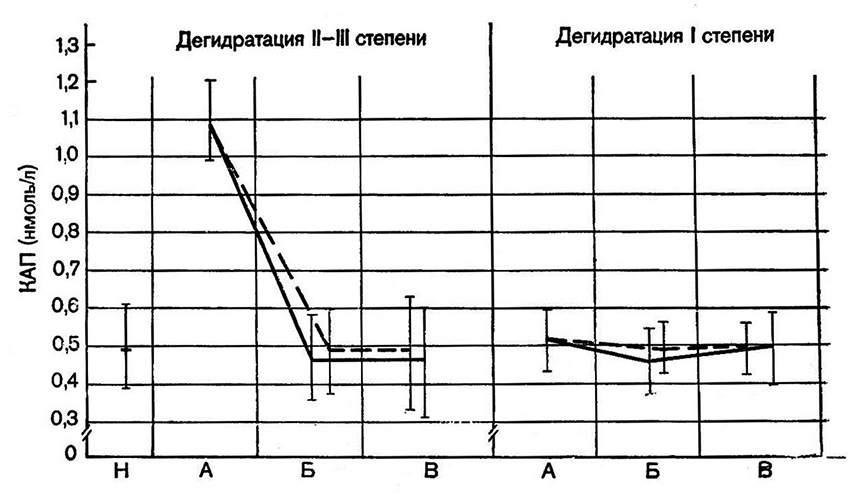
Рис. 16. Изменения показателей концентрации альдостерона
в плазме (КАП) крови при лечении сальмонеллеза.
Условные обозначения те же, что и на рис. 16.
Водноэлектролитный обмен через 1012 ч после приема индометацина у абсолютного большинства больных восстанавливался, в то время как у больных контрольной группы отмечалась гипонатриемия, а при IIIII степени дегидратации – гипоосмия, гипокалиемия и повышенный индекс гематокрита. Следует отметить, что при сравнении показателей водноэлектролитного обмена с группой больных, леченных только раствором («Квартасоль», выявлены статистически достоверные отличия по показателям концентрации натрия в плазме крови, не зависимые от исходной степени дегидратации. Показатели осмолярности плазмы крови и индекса гематокрита имели достоверные отличия лишь у больных с исходной дегидратацией IIIII степени.
В периоде реконвалесценции показатели активности ренина в плазме характеризовались дальнейшим снижением. У больных с девидратацией IIIII степени она составила 4,38±0,79 миг/л(ч, однако отличалась от контроля (р<0,01). Активность ренина плазмы у больных с исходной дегидратацией I степени достоверных отличий от контроля не имела, Уровень концентрации альдостерона плазмы в шериоде репонвалесценции динамических изменений не претерпевал. Показатели водноэлектролитного обмена в периоде реконвалесценции также не изменялись. Следует отметить, что у больных контрольной группы в этот период были отмечены повышенные значения активности ренина плазмы и явления гипонатриемии.
Эти данные свидетельствуют о том, что шрименение в комплексном лечении больных сальмонеллезом ингибитора биосинтеза простаглавдинов – индометацина – приводит к прекращевию водноэлектролитных потерь, восстановлению водноэлектролитного обмена и тем самым к уменьшению активности ренинангиотензинальдостероповой системы.
Таким образом, тастроинтестинальная форма сальмонеллеза среднетяжелого течения в остром периоде болезни характеризуется активацией ренинангиотензинальдоатероновой системы, причем лучше всего она выражена у больных с дегидратацией IIIII степени. Одной из возможных причин этого явления может быть повышенный синтез шростатландинов, активирующий в условиях сальмонеллезной интокоикации деятельность юкстагломерулярного аппарата почек. Повышенная активность ренина плазмы вызывает усиленное образование ангиотензина II, а тот в свою очередь стимулирует синтез альдостерона. При сальмонеллезной интоксикации имеется и другой путь стимуляции ренинангиотензинальдостероновой системы. Простагландины, образовавшиеся под влиянием эндотоксина, активируют аденилциклазу, последняя приводит к усилению синтеза цАМФ. Этот нуклеотид в свою очередь вызывает резкое усиление секреции электролитов и связанной с ними жидкости, тем самым способствуя водноэлектролитныи потерям. Водноэлектролитный дисбаланс, как известо, является мощным стимулятором ренинангиотензинальдостероновой системы. С точки зрения наличия двух взаимосвязанных механизмов активации этой биорегуляторной свстемы становится понятным, что внутривенная инфузия раствора «Квартасоль» не в аостоянии полностью решить поставленных задач по борьбе с сальмонеллезной интоксвкацией и развившимся водноэлектролитным дисбалансом. Основная причина этого в том, что инфузионная терапия подавляет лишь один механизм активации ренинангиотензинальдостероновой системы – восполнение жидкостных объемов и частичное восстановление водноэлектролитного равновесия. Однако это, как известно, является следствием развившегося процесса, а не его причиной. В результате удается лишь частично купировать симптомы интоксикации, частично восстановить водноэлектролитный обмен. Остающиеся симптомы интоксикации, водноэлектролитный дисбаланс, повидимому, поддерживаются за счет простагландинемии. Все это в свою очередь создает условия для активации ренина плазмы, что и было нами отмечено через 1012 ч после инфузии раствора «Квартасоль».
Напротив, применение ингпбитора биосинтеза простагландинов – индометацина – в комплексе с регидратацией способствует решению поставленных задач, так как такая терапия воздействует на оба механизма активации ренинангиотензинальдостероновой системы. Ипгибирование биосинтеза простагландинов позволяет в сжатые сроки купировать симптомы интоксикации, прекратить водноэлектролитные потери, восстановить водноэлектролитный баланс, что и приводит к нормализации показателей ренинангиотензинальдостероновой системы.
Таким образом, анализ влияния ингибитора биосинтеза простагландинов на функциональное состояние ренинангиотензинальдостероновой системы дает основание высказать предположение о том, что активация этой системы возникает как в связи с водноэлектролитными шотерями, так и стимулирующвм действием простагландинов. В соответствии с нашей концепцией шатогенеза синдрома интоксикации генезис гиперсекреторной диареи, а также избыточная функциональная активность ренинавхиотензинальдостероновой системы связаны с влиянием простагландинов. Это вполне логично с позиции теории саморегулирующейся системы. В кишечнике простагландины участвуют в развитии защитной реакции по удалению токсина, а в системе, обеспечивающей постоянство водноэлектролитного состава, активизируют процессы задержки электролитов и жидкости. На основании шолученных результатов можно считать, что на фоне приема больными индометацина происходит, с одной стороны, более шолное восстановление водноэлектролитного состава, что снижает рефлекторное влияние на активацию ренинангиотензинальдостероновой системы. С другой стороны, более быстрое снижение активности ренина и концентрации альдостерона в плазме может происходить за счет прекращения стимулирующего влияния избыточных уровней простагландинов.
КОРТИКОСТЕРОИДЫ И ВОДНО-ЭЛЕКТРОЛИТНЫЙ ОБМЕН
Кора надпочечников активно влияет на водноэлектролитный обмен не только через альдостерон. Привлекают внимание и сообщения о частом развитии гипокортицизма у больных сальмонеллезом. Некоторые полагают, что гипокортицизм оказывает неблагоприятное влияние на течение инфекционного процесса, что требует соответствующей заместительной терапии [Ребенок Ж. А., 1972; Блюгер А. Ф. и др., 1975].
В связи с тем что снижение экскреции 17оксикорти костероидов у обследованных больных совпадало с уменьшением диуреза, возникло предположение о возможной взаимосвязи указанных явлений, несмотря на то что, как известно, у здоровых людей экскреция 17 оксикортикостероидов от объема диуреза не зависит [Меньшиков В. В., 1969]. Сопоставление величины экскреции 17 оксикортикостероидов (общих и свобадных) и диуреза у обследуемых позволило убедиться в полном отсутствии зависимости между ними [Ребенок Ж. А., 1985]. По мнению этого автора, основной причиной снижения экскреции 17оксикортикостероидов у больных пищевыми токсикоинфекциями сальмонеллезной этиологии в остром периоде болезни следует считать транзиторную гипофункцию коры надпочечников, которая развивается вследствие специфического воздействия 'бактериальных эндотоксинов на энзиматические системы секреторных клеток. Этот вывод следовал из анализа резервов надпочечников, выявляемых пробой на АКТГ [Меньшиков В. В., 1969]. После внутримышечного введения АКТГ имело место не только значительное увеличение экскреции 17оксикортикостероидов, но и выраженная зависимость степени увеличения экскреции как от дозы адренокортикотропина, так и от тяжести течения заболевания. Следовательно, резервы коры надпочечников у больных пищевыми токсикоинфекциями сохранены.
Нами изучено функциональное состояние коры надпочечников, по содержанию суммарных 11оксикортикостероидов (гидрокортиэона и кортикостерона) в периферической крови с помощью метода конкурентного связывания на основе транскортина человека. Состояние водноэлектролитного обмена оценивалось по концентрации ионов калия и натрия в плазме крови методом пламенной фотометрии, объему внеклеточной жидкости тиосульфатным методом и индексу гематокрита, который определяли на центрифуге Адамса.
Под нашим наблюдением находилось 57 больных пищевыми токсикоинфекциями неуточненной этиологии и 39 больных гастроинтестинальной формой сальмонеллеза среднетяжелого течения. Обследование проводилось в динамике при поступлении, через 24 ч после начала лечения и в период рвконвалесценции.
В зависимости от вида терапии было сформировано 4 группы больных: больные пищевыми токсикоинфекциями, леченные с применением регидратации (1я группа), больные пищевыми токсикоинфекциями, которым на фоне регидратации, назначали индометацин (2я группа), больные сальмонеллезом, леченные регидратацией (3я группа), и больные сальмонеллезом, которым на фоне регидратации назначали индометацин (4я группа). Контрольная группа состояла из 20 практически здоровых лиц.
На высоте интоксикации и водноэлектролитных потерь у больных пищевой токсикоинфекцией наблюдалось достоверное повышение концентрации 11оксикортикостероидов по сравнению с контролем (131,7±17,5 мкг/л и 138,0±16,7 мкг/л соответственно) (р<0,05). У этих же больных установлены достоверное понижение концентрации ионов калия и натрия в плазме крови, уменьшение объема внеклеточной жидкости и увеличение индекса гематокрита.
Уже через 24 ч после начала лечения концентрация 11оксикортикостероидов в первой и второй группах снижалась и достигала физиологических значений – 92,1 13,3 мкг/л и 765±5,6 мкг/л соответственно (р<0,05), так же как и показатели объема внеклеточной жидкости и индекса гематокрита. Однако в первой группе сохранялось сниженное содержание калия и натрия в плазме крови, в то время как во второй группе их концентрация значительно возрастала и уже не отличалась от нормальных величин.
В, период реконвалесценции все показатели нормализовались, за исключением концентрации ионов натрия в 1й группе, где сохранялась гипонатриемия (127,4±1,1 ммоль/л, р<0,01). Динамика показателей 11оксикортикостероидов, содержания ионов натрия и калия в плазме крови, а также объем внеклеточной жидкости и индекс гематокрита у больных сальмонеллезом полностью повторяли изменения у больных пищевыми токсикоинфекциями. Таким образом, вы вправе, предположить общность адаптационных механизмов как при пищевой токсикоинфекции невыясненной этиологии, так и при сальмонеллезе, возникающих в процессе развития патологического процесса.
Полученные данные не позволили установить различия в динамике изучаемых показателей при сравнении двух методов лечения, хотя клинические наблюдения говорят о том, что при применении индометацина у больных пищевой токсикоинфекцией и сальмонеллеэам происходят исчезновение интоксикационного синдрома и восстановление водноэлектролитных потерь в более сжатые сроки, чем при традиционном методе лечения с помощью полиионных растворов.
Мы обратили внимание на тот факт, что на высоте интоксикации у больных определялся различный уровень содержания 11оксикортикостероидов: у одних он был значительно повышен, у других – снижен. При индивидуальной оценке уровней 11оксикортикостероидов оказалось, что повышение их концентрации чаще наблюдалось у больных, госпитализированных на 12й дни болезни, и реже – при более поздней гоопитализацяи. Так, у 52 больных, гоашитализированных в, первые 2 дня болезни, уровни 11оксикортикостероидов были выше физиологических значений в 42 случаях. В то же время у 44 больных, госпитализированных в более поздние сроки, высокие уровни 11оксикортикостероидов установлены лишь у 12 человек, а низкие – у 27.
В зависимости от исходного уровня 11 оисикортикостероидов в плазме крови мы разделили больных на 2 подгруппы: в подгруппу А вошли 54 больных с исходными результатами содержания кортикостероидов, которые превышали 150 мкт/л (верхняя граница нормы). Подгруппу Б составляли 37 больных с показателями уровня кортикостероидов ниже 50 мкг/л (нижняя граница нормы). В каждой группе выделяли больных пищезььми токсикоинфекциями и сальмонеллезом, леченных традиционными методами и с применением индометацина.
Исходные уровни 11оксикортикостероидов плазмы крови у больных пищевыми токсикоинфекциями, впоследствии получавшими ретидратационную терапию, составили 261,1±32,8 мкг/л, а в группе с комбинированной терапией – 260,4±26,8 мкг/л. У этих же больных содержание калия и натрия в плазме крови было снижено, уменьшен объем внеклеточной жидкости и увеличен индекс гематокрита.
Через 24 ч после начала лечения концентрация 11оксикортикостероидов в плазме крови больных имела тенденцию к снижению. Однако при лечении только регидратацией концентрация гормонов продолжала оставаться повышенной (154,5±28,1 мкг/л, р<0,05), в то время как при лечении индометацином уже через сутки показатели 11оксикортикостероидов достигали физиологических значений (87,2±15,9 мкг/л, р<0,05). Одновременно в первой группе сохранялась гипокалиемия и тип1онатриемия, тогда как во второй группе концентрация калия и натрия нормализовалась.
В период реконвалесценции лишь в первой группе наблюдалась гипонатриемия, остальные показатели достоверных отличий от контроля не имели.
Анализ данных об изменениях 11оксикортикостероидов в плазме крови больных сальмонеллезом показал, что они полностью повторяют аналогичную динамику при пищевой токсикоинфекции.
Следует подчеркнуть, что восстановление концентрации кортикостероида происходит, в более сжатые сроки в тех случаях, когда больные получают индометацин. Что касается восстановления показателей объема внеклеточной жидкости, индекса гематокрита и электролитов плазмы крови, то их более быстрая нормализация также наблюдается у тех больных, которым был назначен индометацин.
Таким образом, повышение содержания 11оксикортикостероидов в плазме крови больных пищевыми токсикоинфекциями и сальмоиеллезом является адаптационным ответом этой системы на водноэлектролитные потери и другие нарушения в организме больных, наступившие вследствие интоксикации. В то же время появление синдрома интоксикации отражает повышенный синтез простагландинов под влиянием тоисинов и активации аденилциклазной системы. При применении индометацина ингибитора биосинтеза простагландинов – происходят стабилизация объема водных пространств организма в результате прекращения диареи и как следствие этого снижение уровня кортикостероидов.
У 22 больных пищевой токсикоинфекцией и у 7 больных сальмонеллезом (труппа Б) на высоте интоксикации обнаружено снижение уровня кортикостероидов в плазме крови шри одновременном уменьшении концентрации натрия и калия плазмы крови, объема внеклеточной жидкости и повышении индекса гематокрита. Следует отметить, что восстановление таких параметров, как концентрация оксикортикостероцдов, натрия и калия в крови, а также объема внеклеточной жидкости и индекса гематокрита, имело одинаковую динамику как при лечении больных с помощью инфузионных растворов, так и при применении индометацина. Однако, несмотря на одинаковую динамику, имелись некоторые различия в скорости восстановления изученных показателей. У больных пищевой токсикоинфекцией, леченных без применения индометацина, через 24 ч после начала лечения сохранялись гипокалиемия и гипонатриемия, а в период реконвалесценции были достоверно снижены концентрации гормонов и натрия в плазме крови, тогда как в группе больных, леченных с применением ивдометацина, происходила нормализация этих показателей. В группе больных сальмонеллезом, леченных регидратационной терапией, через 24 ч сохранялась гипокалиемия. У больных же сальмонеллеэом, леченных с применением индометацина, через 24 ч концентрация калия в плазме крови нормализовалась.
Анализ этого материала позволяет высказать мнение о том, что механизмы интоксикации и нарушения водноэлектролитного обмена сходны при сальмонеллезе и пищевой токсикоинфекции невыясненной этиологии. Можно предположить, что усиленный синтез простагландинов ведет к развитию симптомов интоксикации, диареи и потере жидкости и электролитов. Вследствие водноэлектролитных расстройств происходит активация секреции кортикостероидов, которые включаются в механизмы удержания жидкости в организме, что можно расценивать как проявление синдрома адаптации. Не исключено и непосредственное влияние простагландинов на секреторную функцию коры надпочечников [Морозова М. С., 1985].
МЕДИАТОРЫ ВЕГЕТАТИВНОЙ НЕРВНОЙ СИСТЕМЫ
В настоящее время в патолотии, в том числе и инфекционной, большое внимание уделяется состоянию системы циклических нуклеотидов [Федоров Н. А., 1979; Sutherkand Е. W., 1976]. Они являются «вторым посредником» между мембраной клетки и находящимися внутри нее ферментами. Роль «первых посредников» могут выполнять простаглацдины, медиаторы вегетативной нервной системы (ацетилхолин и катехоламины) и другие физиологически активные вещества. Катехоламины, являясь мембранными регуляторами клетки, приспосабливают организм к действию различных патогенных агентов [Меньшиков В. В., 1970; Селье Г., 1977]. Соотношение выделяемых с мочой катехоламинов (адреналина и норадреналина) характеризует состояние симпатикоадреналовой системы и преобладание в организме адреналового (гормонального) или симпатического (медиаторного) звена, а также его компенсаторные и адаптационные возможности [Большакова Т. Д., 1973; Броер Б. А., 1980]. Динамика коэффициента цАМФ/цГМФ крови определяет переход организма из адренвргической в холинергическую фазу адаптации [Кожемякин Л. А., Коростовцев Д. С., 1977; Кожемякин Л. А. и др., 1979], а по мнению некоторых авторов [Федоров Н. А., 1979], имеет прогностическое значение при инфекциях. При освобождении биологически активных веществ (катехоламинов и циклических нуклеотидов) в количествах, значительно отличающихся от физиолотических, они из факторов адаптации превращаются в факторы патогенеза [Бетайдарова Р. Х., 1982; Первухина Н. К., 1983; Меерсон Ф. 3. и др., 1984].
По данным Н. К. Первухиной (19731983), нарушение баланса медиаторов вегетативной нервной системы является важным фактором патогенеза острых кишечных инфекций с диареей. При этом гиперкатехоламинурия, а не гиперацетилхолинемия определяет патогенез нарушений функций почек и кровообращения, диарею. В случаях рецидива сальмонеллеза и холеры автору удалось наблюдать именно гиперкатехоламинурию, B то время как уровни ацетилхолина в крови не были высокими. В результате этих исследований было отмечено, что высокие уровни ацетилхолина выявлялись лишь в первые 2 дня болезни, в то же время выделение повышенных уровней катехоламинов с мочой продолжалось долго (37 сут), а интенсивность катехоламинурии находилась в очевидной зависимости от степени обезвоженности. И напротив, особенности клинического течения диарейных заболеваний не отражались на уровнях ацетилхолина в крови.
В соответствии с установленным в клинических и экспериментальных условиях преобладанием адренергических процессов над холинергическими Н. К. Первухина (1983) рекомендует использование тканевых адреноблокаторов с целью купирования основных проявлений заболевания. В соответствии с данными автора активация адренергических процессов направлена на включение компенсаторных механизмов, однако их усиление по мере нарастания патологических изменений уже становится фактором, снижающим резистентность организма. Для повышения резистентности и приспособления организма к новым условиям существования, необходима смена адренергической фазы на холинергическую. В экспериментах на животных автором было показано, что αадреноблокаторы полностью предотвращали летальный исход при экспериментальной токсинемии как в случаях их предварительного введения, так и на фоне токсинемии. Обзидан также предотвращал гибель животных при предварительном введении, однако, в условиях развившейся интоксикации он ускорял их гибель. Автор делает вывод о том, что аадреноблокаторы обладают корригирующим свойством, а βблокаторы только профилактическим. Следовательно, переключение адренергических процессов на холинергические определяется αадренорецепторами и блокада последних положительно влияет на течение бактериальных инфекций. Эти данные служат теоретической предпосылкой для разработки дополнительных принципов лечения, направленных на повышение его эффективности.
В литературе имеются единичные указания о функциональной взаимосвязи простагландинов с катехоламинами [Hedqvist Р., 1977; 1979]. Можно предположить, что повышенный уровень простагландинов определенным образом изменяет адаптационную роль катехоламинов, что имеет значение для прогноза заболевания.
При поступлении в стационар при тяжелом и среднетяжелом течении сальмонеллеза отмечено достоверное снижение выделения адреналина с мочой (5,34±0,08 мкг/сут; 6,24±0,07 мкг/сут). Легкое течение заболевания характеризовалось повышенной экскрецией адреналина (до 8,96±0,07 миг/сут). Анализ экокреции норадреналина показал, что во всех группах больных происходило ее достоверное повышение: при легком течении– 16,20±0,30 мкг/сут; среднетяжелом течении – 19,40±0,23 мкг/сут; тяжелом течении – 22,26±10,25 мкг/сут.
На следующий день на фоне общепринятой регидратационной терапии при среднетяжелом и тяжелом течении сальмонеллеза экскреция адреналина оставалась достоверно сниженной, а уровень норадреналина был повышен.
Полученные данные свидетельствуют о том, что у больных легкой формой сальмонеллеза в период разгара заболевания отмечается активация обоих отделов симпатикоадреналовой системы, а при среднетяжелом и тяжелом течении – выраженная активация симпатического звена и истощение адреналового. Это можно объяснить тем, что адреналин как более лабильное вещество активнее расходуется организмом либо, что более вероятно, в условиях сосудистой гипотензии потребность организма в норадреналине выше, так как он оказывает только аадренергическое действие на сосуды, которое у него в 1,51,7 раза выше, чем у адреналина.
Возможно и опосредованное блокирование выхода катехоламинов из нервных окончаний простагландинами серии Е [Hedqvist Р., 1977, 1979]. В результате проведенной регидратационной терапии к моменту выписки больных со среднетяжелым течением не происходило полного восстановления активности симпатикоадреналовой системы. Так, уровень экскреции адреналина, оставался достоверно сниженным, а норадреналина – повышенным. Очевидно, это результат следовой реакции организма на внешнее воздействие.
К моменту выписки больных, перенесших тяжелое течение заболевания, происходило полное восстановление суточной экскреции катехоламинов, что, на наш взгляд, является следствием применения глюкокортикоидов в сочетании с регидратационной терапией у 22 больных. Известно, что глюкокортикоиды являются активаторами симпатикоадреналовой системы.
На фоне, дополнительного приема ицдометацина обмен катехоламинов изучен у 31 больного со среднетяжелым и у 6 больных – с тяжелым течением сальмонеллеза. Индометацин оказывал стабилизирующее влияние на экскрецию адреналина и норадреналина с мочой у больных со среднетяжелым течением, сальмонеллеза, что проявлялось в увеличении экскреции адреналина и уменьшении норадреналина в группе больных, леченных индометацином (адреналин – 7,13±0,13 мкг/сут, р<0,05; норадреналин– 19,53±0,35 мкг/сут, p<0,05).
При тяжелом течении сальмонеллеза достоверных отличий в сравниваемых группах больных не выявлено.
Таким образом, наши данные не дают оснований полагать, что адренергическая первиан система является активатором гиперсекреторной диареи. На фоне приема больными индометацина отмечено, что экскреция адреналина увеличивалась, а понос прекращался.
По данным D. А. Terragno и соавт. (1975), простагландины, синтезируемые в стенке сосудов, оказывают выраженное вазоконстрикторное и вазодилататорное действие. На высоте интоксикации у больных сальмонеллезом нами выявлено снижение экскреции катехоламинов, которое устранялось назначением индометацина. В свою очередь Р. Hedqvist (1970) показал, что высокие уровни простагландинов блокируют выход катехоламинов из нервных окончаний.
Принимая во внимание вышеизложенное, можно предположить, что индометацин блокирует активный синтез простагландинов в сосудистой стенке, освобождает катехоламины из нервных окончаний и на фоне адекватной регидратационной терапии опоообствует восстановлению геиодинамики в системе микроциркуляции.
КАЛЛИКРЕИНКИНИНОВАИ СИСТЕМА
Деятельность калликреинкининовой системы направлена на регуляцию водноэлектролитнoгo равновесия и тесно связана с работой простагландиновой системы и свертывающей системой крови.
Калликреины представляют собой ферменты протеиназы, которые высвобождают из кининогенов пептиды и кинины. Различают два основных класса калликреинов: плазменные и железистые. Калликреинкининовая система плазмы отличаемся от железистой калликреинкининовой системы не олько биохимическими и иммунологичесними характеристиками, но и функционально. Калликреины плазмы имеют большую молекулярную массу. Под их влиянием высвобождается брадикинин, а под влиянием железистых калликреинов – лизилбрадикинин, у них разные ингибиторы. Калликреины плазмы крови участвуют в ее свертывании, фибринолизе, являются медиаторами воспаления, активируют комплемент, участвуют в регуляции артериального давления. Железистые калликреины главным образом регулируют органный кровоток, влияют на экскрецию воды и электролитов и, наконец, участвуют в регуляции артериального давления [Carretero О. А., Seileli А. G., 1980]. Неактивная форма каллижреина плазмы – прекалликреин – активируется фактором Хагемана. Механизм активации действует по принципу обратной связи.
Фактор Хагемана является мощным активатором прекалликреина плазмы и, так же как и последний, действует на кининоген. Фактор Хагемана является важной составной частью системы свертывания крови. Дефицит прекалликреина вызывает увеличение времени свертывания крови. Калликреин плазмы вызывает также хемотаксис полиморфноядерных лейкоцитов.
Регуляция синтеза калликреина и кининов сложна и мало изучена. Однако точно установлено, что физиологическая активность кининов тесно связана с простагландинами, синтез которых отчасти контролируется кининами [ColinaChourio J. et al., 1976]. Вопервых, под влиянием кининов усиливается синтез простагландинов. Вовторых, простагландины, образованные под влиянием кининов, выполняют функции медиаторов, опосредующих действие кининов, связанное с увеличением выделения натрия с мочой, а также со снижением чувствительности сосудов почки к арессорным воздействиям ангиотензина II и адренергических стимулов.
Хотя действие кининов, основных продуктов деятельности калликреинкининовой системы, и ангиотензинов, образующихся в результате работы ренинангиотензиновой системы, на кровообращение антагонистично, их объединяет способность вызывать синтез простагландинов и влиять на их метаболизм [McGiff J. C., Itskovits Н. О., 1973]. Кроме тово, выброс ренина, основного фермента ренинангиотензиновой системы, вызывающего образование ангиотензина и калликреина, под действием которого образуется первый из кипинюв – лизилбрадикинин, частично контролируется простагландинным механизмом [Olson U. В., 1977; Data J. L. et al., 1978]. На оба декапептида (ангиотензин I и лизилбрадикинин) действует один и тот же фермент – диспептидилкарбоксипептидаза, или кининаза II, который превращает ангиотензин I в более активный гормон – ангиотензин II и разрушает кинины. Блокада этого фермента вызывает повышение активности калликреинкининовой системы [Nasjletti А. et, al., 1975] и подавляет ренинантиотензиновую систему [Davalos М. et al., 1978]. Еще одним важным фактором, связьгвающим две системы, является способность калликреина переводить неактивный ренин, так называемый проренин, в активный [Sealey J. Е., 1978].
Таким образом, ренинавгиотензиновая, простагландиновая и калликреинкининовая системы, обеспечивающие поддержание водносолевого равновесия, тесно связаны между собой.
Нами было изучено влияние подавления биосинтеза простагландинов индометацином на функциональное состояние калликреинкининовой системы, свертывающей и фйбринолитической систем крови у 65 больных сальмоаеллезом среднетяжелого течения. Контрольную труппу составили 75 больных этой же степени тяжести. В большинстве случаев больные были госпитализированы в 1е сутки от начала заболевания (61%). На 2е сутки болезни в стационар поступило 27%, а на 3и сутки лишь 12% больных.
О состоянии калликреинкининовой системы крови судили на основании определения спонтанной эстеразной активности, прекалликреина, ингибитора калликреина флюорометрическим микрометопом [Кузнецов В. А., Беляков Н. В., 1980].
Для определения компонентов фибринолитической системы – плазмина и плазминогена – использовалась методика Friherger и соавт. (1978) с применением хроиогенного субстрата «Хромозим ПЛ» фирмы «Boehringer mannheim»,
Оценку свертывающей системы проводили тромбоэластографическим методом, который позволяет автоматически регистрировать механические свойства фибринтромбоцитарной структуры при ее формировании и стабилизации [Hartert, 1948].
Определение состояния кининовой, свертывающей и фибринолитической систем нами шроводилось троекратно: на высоте интоксикации, через сутки после начала терапии и в периоде ренонвалесценции (56й день пребывания больных в стационаре).
Повышение спонтанной эстеразной активности, снижение уровня прекалликреина, ингибитора калликреина, выявленные у большинства больных (74%), можно расценивать как признаки активации плазменного калликреиногенеза, повышение синтеза кининов крови в остром периоде сальмонеллезной интоксикации.
Изменения тромбоэластотраммы на высоте интоксикации свидетельствовали о гипокоагуляционных сдвигах в свертывающей системе крови. Нарушения затрагивали все три фазы свертывания крови. Необходимо отметить, что показатель синереза, константа использования тромбина не претерпевали существенных изменений, хотя, по данным других исследователей, эти показатели увеличивались. Расхождение в прочтении результатов можно объяснить разными объектами исследования – цитратная кровь и цитратная плазма. Мы использовали цитратную кровь, в результате чего на тромбоэластотрамме зафиксировано влияние не только плазменных факторов коагуляции, но и форменных элементов крови на процесс стабилизации и формирования фибринтромбоцитарной структуры.
Со стороны фибринолитичеокой системы у больных сальмонеллезом на высоте интоксикации отмечалось угнетение ее активности, что выражалось в значительном повышении уровня плазминогена, предшественника плазмина по сравнению с нормой. Уровень плазмина был ниже, чем у здоровых лиц (р<0,05). Эти данные показывают, что у большинства больных (65% ) в периоде выраженной интоксикации отмечается снижение фибринолитической активности крови.
Анализируя состояние свертывающей и фибринолитической систем крови в остром периоде сальмонеллеза, мы предполагаем, что эти изменения связаны с наличием у больных гипокоагуляционной фазы синдрома диссеминированного внутриоосудистого свертывания Крови.
Данные, полученные при исследовании гемостаза в остром периоде сальмонеллеза, у большинства больных свидетельствуют о типокоагуляционных сдвигах (67%), т. е. 2й фазе синдрома диосеминированного внутрисосудистого свертывания. Гиперкоагуляционную направленность свертывающей системы удалось уловить лишь в 13% случаев. Угнетение фибриналитической активности в гипокоагуляционной фазе этого синдрома можно объяснить своеобразным истощением ферментных систем, которые принимают участие в формировании данной реакции организма, что, согласно современным представлениям, можно расценивать как, своеобразный «протеолитический взрыв» [Балуда В. П, 1981].
Учитывая взаимосвязь кининовой и фибринолитической систем, низкий уровень плазмина иожно объяснить тем, что прекалликреиновый активатор, будучи продуктом гидролиза фактора Хагемана, проявляет повышенную активность по отношению к кининообразованию и меньшую – к процессам фибринолиза. Поэтому низкий уровень плазмина связан с недостатком активаторов плазминогена, обеспечивающих его, переход в плазмин. С другой стороны, повышенный уровень плазминогена отражает потенциальную активность фибринолитической системы против возможных тромботических осложнений.
Повышенный уровень кининов крови в данной ситуации носит приспособительный характер, возникает в ответ на изменение реологических свойств крови. Кинины выполняют роль посредника в поддержании динамического равновесия между тонусом, сосудистой проницаемостью и жидкостной характеристикой, протекающей по сосудам крови [Гомазков О. А., 1976]. Изменяя тонус, сосудистую проницаемость, влияя на скорость регионарного кровотока, кинины тем самым улучшают микроциркуляцию и поддерживают таким образом обмен веществ в органах и тканях на должном уровне.
Между калликреиновой, свертывающей и фибринолитической системами существует тесная взаимосвязь. Нами определена корреляционная зависимость между прекалликреином и суммарным показателем тромбоэластограммы. Эти показатели выбраны в связи с их большой информативностью. Уровень прекалликреина косвенно отражает содержание кининов в, плазме крови. Суммарный показатель дает возможность быстрого определения направленности процесса коагуляции. В остром периоде сальмонеллеза между прекалликреином и суммарным показателем тромбоэластограммы определяется обратная корреляционная взаимосвязь (r = –0,59±0,02, р<0,05) .
Действительно, на высоте интоксикации снижение уровня прекалликреина косвенно указывает на повышенное содержание кининов в крови. Суммарный показатель тромбоэластограммы увеличен и свидетельствует о гипокоагуляционных сдвигах гемостаза. Таким образом, гипокоагуляция сопровождается повышенным синтезом кининов крови. Обнаруженная корреляционная зависимость подтверждает не только адаптационную роль кининовой системы в данной ситуации, но и служит доказательством ее взаимосвязи оо свертывающей системой крови, тем более что эта корреляционная зависимость сохранялась и к периоду клинического выздоровления, т. е. у реконвалесцентов (r = – 0,99±0,04, р<0,01).
На высоте сальмонеллеэной интоксикации определен коэффициент линейной корреляции между прекалликреином и плазмином – главным представителем фибринолитической системы. В период интоксикации между прекалликреином и плазмином определяется, прямая корреляционная зависимость (г= 0,55±0,25, р<0,05), сохраняющаяся в период реконвалесценции (r = 0,79 ±0,19, р<0,01).
Эта связь отражает сложные взаимоотношения между кининовой и плазминовой системами. Ее можно объяснить с позиции единой системы фактора Хагемана. Высокий уровень кининов крови соответствует низкому содержанию плазмина, что связано с неодинаковой активностью прекалликреинового активатора по отношению к калликреиновой и фибринолитической системам. Наши исследования еще раз подтверждают роль кининовой системы как посредника в восстановлении и поддержании равновесия между тонусом сосудов, их проницаемостью и реологическими свойствами протекающей по сосудам крови. Через сутки после проведения регидратационной терапии обследован 41 больной сальмонеллезом с целью выяснения состояния калликреинкининовой, фибринолитической и свертывающей систем крови с последующим сравнением с контрольной группой здоровых лиц.
Результаты исследований свидетельствовали о явной тенденции к нормализации калликреинкининовой системы: спонтанная эстеразная активность снизилась до 0,92±0,17 ммоль/л/ч и не отличалась от нормы (р>0,05), уровень прекалликреина повысился до 50,82±1,1 ммоль/л/ч и достиг величин, определяемых у здоровых лиц (р>0,05), одяаке ингибитор калликреина оставался ниже нормы.
Потенциал свертывающей системы крови, по данным тромбоэластограммы, у больных сальмонеллезом в период ранней реконвалесценции оставался направленным в сторону гипокоагуляции, о чем свидетельствовали изменения параметров тромбоэластограммы, достоверно не отличавшихся от ее показателей в острый период сальмонеллеза.
В период ранней реконвалесценции отмечалась нормализация показателей фпбринолитической системы. Уровень плазминогена достиг, показателей группы сравнения (р>0,05), содержание плазмина повысилось и не отличалось от нормы (р>0,05).
Все это говорит о том, что развившаяся в период выраженной интоксикации гипокоагуляционная фаза синдрома диссеминированного внутрисосудистого свертывания сохраняется и через сутки после проведения регидратационной терапии, хотя и отмечается нормализация части показателей кининовой и фибринолитической систем.
Возможно, наблюдаемая гипокоагуляция в какойто мере отражает недостаточное дезинтоксикационное действие регидратационной терапии, которая не в состоянии полностью купировать симптомы интоксикации и изменения со стороны свертывающей и калликреинкининовой систем крови.
У реконвалесцентов (48 человек) не отмечалось никаких клинических проявлений перенесенного заболевания. Однако специальные методы обследования, применяемые нами, показали, что изменения со стороны кининовой системы и гемостаза наблюдаются у большинства больных.
Со стороны кининовой системы отмечалось: нормальный уровень спонтанной эстеразной активности (0,88±0,15 ммоль/л/ч, р>0,05) и прекалликреина (50,16±1,95 ммоль/л/ч, р>0,05). У большинства больных (70,3%) содержание ингибитора калликреина составило 0,98±0,048 усл. ед., не достигая при этом показателей здоровых лиц (p<0,05), лишь в 6% случаев ингибитор калликреина,достиг показателей нормы.
Изменения показателей тромбоэластограммы свидетельствовали о гипокоагуляционных сдвигах у большинства больных (78%). Наблюдения за изменениями фибринолитической системы показали, что у большинства больных (67%) уровень плазмииогена был увеличен (р<0,02), а содержание плаэмина не отличалось от показателей здоровых лиц (р>0,05).
Таким образом, перед выпиской из стационара у реконвалесцентов на фоне клинического выздоровления в большинстве случаев (78%) со стороны свертывающей системы отмечались гипокоагуляционные сдвиги. Со стороны фибринолитической системы отмечено повышение уровня плазминогена у 67% больных. Эти изменения можно объяснить сохранявшейся гипокоагуляционной фазой синдрома диссеминированного внутрисосудистого свертывания. Среди показателей, характеризующих калликреинкининовую систему, у 70,3% реконвалесцентов пе возвращалась к норме концентрация ингибитора калликреина.
Таким образом, восстановление параметров свертырающей, фибринолитической и кининовой систем у больных сальмонеллезом, леченных регидратационной терапией, не наступает при клиническом выздоровлении.
Обследовано 65 больных после проведения комплексной терапии (регидратационная терапия + индометацин). Практически у всех больных, получавших индометацин, уже в течение первых суток лечения исчезли основные проявления интоксикации.
Через сутки после комплексной терапии у больных сальмонеллезом (47 человек) отмечалась нормализация основных показателей калликреинкининовой системы. Спонтанная эстеразная активность и уровень прекалликреина не отличались от нормы (р>0,05). Ингибитор калликреина составил 0,92±0,026 усл. ед. и не достиг нормальных величин (р>0,01). Тенденция к нормализации содержания ингибитора калликреина в группе больных, леченных с применением индометацина, была выражена более четко по сравнению с больными, получавшими только инфузионную терапию (р<0,05) (рис. 17).
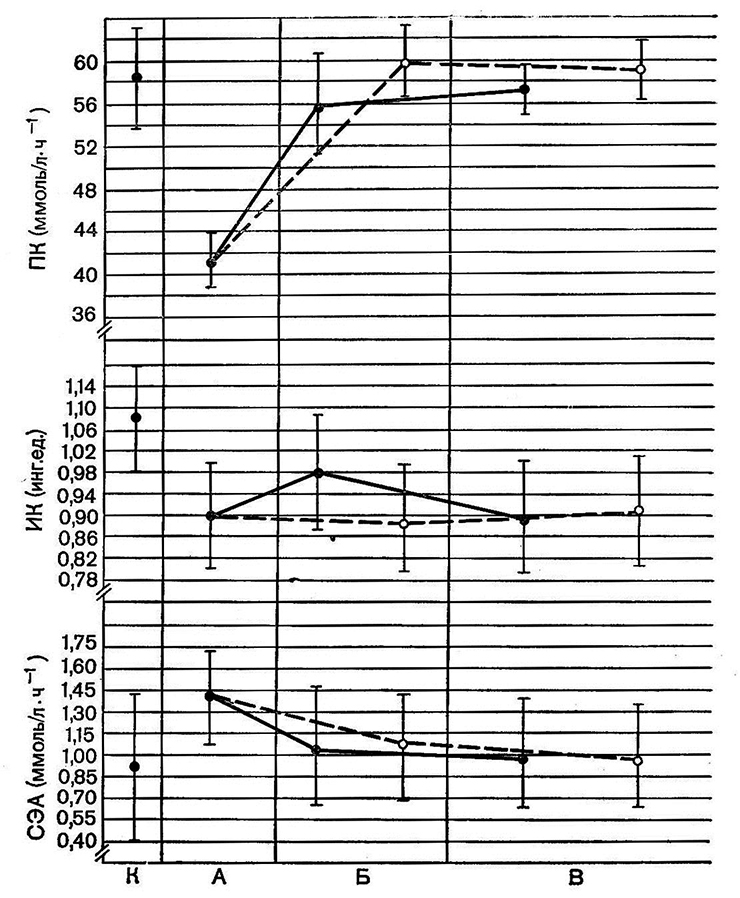
Рис. 17. Изменения концентрации компонентов калликреинкининовой системы при лечении сальмонеллеза.
ПК – прекалликреин; ИК – ингибитор калликреина; СЭА – спонтапная эстеразная активйость.
К – норма; А – при поступлении. Б – через 1 сутки после начала лечения; В – при выписке.
Сплошная линия – регидратационная терапия; пунктирная – лечение иядометацином.
Со стороны свертывающей системы крови отмечены гипокоагуляционные сдвиги и через сутки после проведения терапии, что объясняется развитием 2й фазы синдрома диссеминированного внутрисосудистого свертывания в остром периоде сальмонеллезной интоксикации. Однако следует отметить, что у больных, получавших дополнительно индометацин, несмотря на сохранившуюся гипокоагуляцию, тенденция к нормализации основных параметров тромбоэластограммы была достоверно выражена по сравнению с данными тромбоэластограммы больных, леченных только инфузионной терапией. Фибринолитическая активность крови (по уровню плазминогена и плазмина) у большинства больных не отличались от показателей у здоровых лиц (р>0,05).
Нами сделана попытка объяснить купирующий эффект терапии на проявление синдрома интоксикации с точки зрения условно выделенных В. А. Кузнецовым (1981) типов реагирования калликреинкининовой системы.
К I типу реагирования калликреинкининовой системы отнесены показатели тех больных, у которых в остром периоде сальмонеллеза обнаружены типичные признаки активации кининовой системы. К периоду реконвалесценции происходила нормализации ее активности. Этот тип реагирования был наиболее распространенным как в 1й группе больных (78%), так и во 2й группе (80%).
Ко II типу реагирования мы отнесли больных с признаками нарушения «реактивности» кининовой системы. Этот тип реагирования по распространенности занимал второе место и встречался среди больных 1й группы в 15,6%, а во 2й группе – в 13% случаев.
III тип реагирования объединил больных с показателями, которые мы расценивали как снижение реактивности кининовой системы. Этот тип реагирования встречался редко среди больных обеих групп: в 5,2 и 7% случаев для 1й и 2й групп соответственно.
Таким образом, включение в схему лечения больных сальмонеллезом индометацина оказывало положительный эффект уже через сутки после начала терапии, что выражалось полным купированием проявлений интоксикации, более четкой направленностью в нормализации параметров свертывающей и калликреинкининовой систем. Эффект комбинированной терапии можно объяснить с точки зрния блокирования избыточного синтеза простагландинов, которое наблюдалось в остром периоде сальмонеллеза под действием бактериального эндотоксина.
Полученные данные позволяют предполагать, что при одинаковом клиническом проявлении интоксикации степень ее купирования зависит от индивидуальной реактивности организма, в частности от типа реагирования калликреинкининовой системы. Возможно, снижение реактивности кининовой системы крови, как при III типе и в малой степени при II типе реагирования калликреинкининовой системы, объясняет отсутствие положительного эффекта от лечения в ряде случаев как 1м, так и 2м методами лечения.
В период поздней реконвалесценции активность калликреинкининовой системы у больных нормализовалась, за исключением ингибитора калликреина, который оставался ниже уровня нормальных показателей (р<0,01).
Изменения калликреиновой системы у больных, леченных регидратационной терапией, совпадали с показателями группы больных, получавших, помимо инфузионной терапии, индометацин. Следует отметить, что число реконвалесцентов с нормальными показателями ингнбитора калликреина в последней группе превышало количество реконвалесцентов, леченных только инфузионной терапией.
Тромбоэластографические показатели в период поздней реконвалесценции свидетельствовали о гипокоагуляционных изменениях. На фоне имеющейся гипокоагуляции необходимо отметить нормализацию угловой константы, а также превалирующее число реконвалесцентов с нормальными показателями в группе, получавшими дополнительно индометацин по сравнению с группой больных, леченных традиционным методом регидратационной терапии.
Следует отметить, что в обеих группах больных к моменту выписки из стационара оставались в пределах нормы показатели синереза и константы тотального свертывания крови. У большинства больных уровень плазмина и плазминогена был в норме, в то время как у реконвалесцентов, леченных без применения индометацина, уровень плазминогена превышал норму.
Применение индометацина ингибирует избыточный синтез эндогенных простагландинов, оказывающих значительное влияние на свертывающую систему крови. Видимо, этим объясняются нормализация фибринолитической активности крови и более выраженная тенденция к нормализации тромбоэластографических показателей в период ранней и поздней реконвалесценции у больного сальмонеллезом.
Роль простагландинов в регуляции системы гемостаза и калликреинкининовой системы послужила основанием для проведения анализа показателей, характеризующих одновременно с показателями гемодинамики и кардиодинамики состояние 120 больных сальмонеллезом среднетяжелого течения. Для исследования кардио и гемодинамики были применены реографические методы. Выявленные нарушения в фазовой структуре систолы левого желудочка сводились к следующему: удлинялись период напряжения и индекс напряжения миокарда, укорачивались механический коэффициент и внутрисистолический показатель. Такие показатели, как длительность периода изгнания и механическая систола, соответствовали контрольным значениям.
Оценку гемодинамики малого круга кровообращения производили традиционным реографическим методом, а также по величине давления в системе легочной артерии, определяемого методом реопульмоногр афин с выполнением пробы Вальсальвы [Сивков И. И. и др., 1977]. С этой целью использовали электрический датчик перепада давлений (ЭДПД1). Определение параметров калликреинкининовой системы проводили с помощью общепринятых методов.
Перечисленный комплекс измененных показателей фазовой структуры систолы левого желудочка не укладывался ни в один из выделенных В. Л. Карпманом (1965) фазовых синдромов. Поэтому мы не нашли возможным выделить у наших больных в остром периоде заболевания фазовый синдром гиподинамии, как это сделали М. А. Досабаева и соавт. (1977), Ж. А. Ребенок и Л. Э. Полонецкий (1977) и другие, по ряду причин. Вопервых, сопоставление с контрольными некоторых показателей фазовой структуры систолы левого желудочка выявило их полное соответствие. Вовторых, в работах В. Л. Карпмана (1965) и Б. М. Когана и соавт. (1982) подчеркивается, что выделение фазовых синдромов возможно только при неизмененных экстракардиальных условиях. Так, при пищевых токсикоинфекциях последние закономерно изменяются. Нельзя согласиться с мнением, что у больных с пищевыми токсикоинфекциями, в том числе сальмонеллезной этиологии, развивается фазовый синдром гиподинамии, свидетельствующий о снижении сократительной функции миокарда левого желудочка.
Изучение фазовой структуры систолы правого желудочка, проведенное в остром периоде заболевания, выявило сходные изменения.
Комплексное изучение показателей сократительной функции миокарда левого желудочка и системной гемодинамики в разные периоды болезни показало, что метод лечения не влиял на сроки восстановления показателей кардиодинамики. Из этого следует, что изменения в фазовой структуре систолы левого желудочка обусловлены изменениями центральной гемодинамики, а не влиянием повышенного биосинтеза простагландинов и других метаболитов арахидоновой кислоты. Нормализация фазовой структуры систолы правого желудочка происходит в более поздние сроки реконвалесценции (56й дни болезни).
Изучение показателей центральной гемодинамики выявило увеличение сердечного индекса и снижение общего периферического сопротивления (р<0,01). В результате такого перекрестного изменения показателей центральной гемодинамики (возрастания сердечного индекса и снижения общего периферического сопротивления) уровень системного артериального давления имел тенденцию только к снижению, хотя достоверно и не отличался от величин в контрольной группе.
Поскольку на левый желудочек падала дополнительная нагрузка по выбросу увеличенного объема крови, производимая левым желудочком работа возрастала в 1,4 раза (р<0,001), а мощность сокращения левого желудочка увеличивалась в 1,3 раза (р<0,001).
Перестройка центральной гемодинамики по гиперкинетическому типу расценивалась нами как компенсаторная реакция, направленная на поддержание достаточного уровня системного артериального давления при значительно сниженной сосудистой резистентности. Этот компенсаторный механизм срабатывает ввиду того, что водноэлектролитные потери происходят в первую очередь за счет интерстициальной жидкости, а объем циркулирующей крови при среднетяжелом течении пищевой токсикоинфекции остается неизменным [Трясучев И. О., 1978; Бродов Л. Е. и др., 1963].
Восстановление показателей центральной гемодинамики в большой степени зависело от используемого метода лечения.
Сердечный индекс, хотя и оставался увеличенным в обеих группах больных, но имел более выраженную тенденцию к нормализации во второй группе– 3,25±0,10 л/мин м, р<0,05 (в первой группе – 3,52±0,14 л/мин м, р<0,01). Общее периферическое сопротивление снижалось во второй группе больных до 1,88±0,11 см/с (в контроле – 2,24±0,08 см/с; p<0,06), а средняя скорость в фазе медленного кровенаполнения (Уср) – до 0,50±0,04 см/с (в контроле – 0,63±0,034 см/с; р<0,05).
Таким образом, данные реопульмонографии свидетельствуют о значительном нарушении кровотока в системе легочной артерии. Использованная в наших исследованиях методика реопульмонограммы с выполнением пробы Вальсальвы [Сивков И. И. и др., 1977] не только подтвердила наши предположения о развитии гипертензии в малом круге кровообращения, но и позволила установить ее количественный уровень.
Так, минимальное давление в остром периоде заболевания возрастало в 2,4 раза, составляя 17,9±0,27 мм рт. ст. (в контроле – 7,6±0,22 мм рт. ст.; р<0,001), а уровень среднединамического давления увеличивался в 1,7 раза, достигая у больных 25,7±0,21 мм рт. ст. (в контроле– 15,0±0,25 мм рт. ст.; р<0,001).
Механизм развития легочной гипертензии при острых кишечных инфекциях сложен и окончательно не изучен. Видимо, он связан с изменениями гемодинамики в остром периоде заболевания и биохимическими расстройствами. Определенную роль играет и то обстоятельство, что легкие, помимо своей основной газообменной, выполняют и «нереспираторную» функцию, т. е. участвуют в метаболизме большинства биологически активных веществ, в том числе и производных арахидоновой кислоты. Описанные некоторыми авторами микротромбоз и нарушение целостности эндотелия капилляров при грамотрицательных инфекциях приводят к уменьшению количества функционирующих капилляров [Luscher Е. F., 1982; Bisio 3. М. et а1., 1983], а также повышению концентрации в крови некоторых биологически активных веществ [Frolich Х С. et al., 1980; Berry L. J., 1982], вызывающих спазм артериол, что создает дополнительные препятствия кровотоку в этом отделе сосудистого русла. Одновременно наблюдаются нарушения и газообменной функции легких, что сопровождается нарушением насыщения крови кислородом [Жильцов Ю. Д., 1978].
Одним из компенсаторных механизмов, направленных на разгрузку малого круга кровообращения и выравнивание сосудистого гомеостаза, является «включение» шунтового механизма кровообращения, что тем не менее приводит к ухудшению гемодинамики, которая уже сама по себе способна служить причиной поддержания легочной гипертензии [Хомазюк А. И., 1975].
Изучение гемодинамики малого круга кровообращения, проведенное через 1 сут после начала лечения, показало, что, несмотря на снижение давления в системе легочной артерии в обеих группах больных, оно оставалось более высоким, чем в контрольной группе (р<0,001), независимо от проводимой терапии. К периоду полного клинического выздоровления давление в малом круге кровообращения снижалось по сравнению с исходным уровнем, но еще не достигло значений контрольной группы.
Выявленные нарушения центральной гемодинамики в остром периоде сальмонеллеза совпадали с основными фармакологическими эффектами кининов, что дает основание предполагать их участие в развитии указанных нарушений гемодинамики.
Активность калликреинкининовой системы плазмы крови изучена нами у 83 больных. Уровень прекалликреина в остром периоде сальмонеллеза равнялся 39,5±1,27 ммоль/л/ч и был ниже соответствующего показателя в контрольной группе (56,4±2,31 ммоль/л/ч; р<0,001) . Этот показатель, по мнению В. А. Кузнецова (1981), играет исключительно важную роль в определении функциональной активности калликреинкининовой системы в целом, поскольку является предшественником ведущего кининообразующего фермента – калликреина. Снижение уровня прекалликреина свидетельствует об усиленном образовании калликреина. Аналогичные данные получены при изучении ингибитора калликреина, уровень которого в остром периоде болезни составил 0,900,05 усл. ед. (в контроле – 1,08±0,05 усл. ед.; р<0,05). Спонтанная эстеразная активность у большинства больных не претерпевала существенных изменений и не имела достоверных различий с контрольной группой (у больных – 1,39±0,17 ммоль/л/ч; в контроле – 0,89: 0,26 ммоль/л/ч; р>0,05). Отсутствие изменений со стороны показателей спонтанной эстеразной активности объясняется тем, что она отражает суммарную активность целой группы протеиназ трипсиназного типа, таких, как трипсин, плазмин, калликреин и другие, часть из которых, как известно, имея эстеразную активность, не оказывает кининогеназного действия.
Таким образом, комплексная оценка компонентов калликреинкининовой системы плазмы крови позволила выявить в остром периоде заболевания активацию плазменного кининогенеза.
Поскольку ведущим из определяемых компонентов калликреинкининовой системы был прекалликреин, мы провели анализ корреляций его значений и ряда показателей центральнои гемодинамики в остром периоде сальмонеллеза. Выявлена отрицательная корреляционная связь (r = – 0,46, р<0,001) между уровнем прекалликреина и величиной сердечного индекса. При сопоставлении прекалликреина с общим периферическим сопротивлением обнаружена положительная корреляционная связь (r = 0,61) . Эти данные свидетельствуют об участии компонентов калликреинкининовой системы в перестройке гемодинамики в остром периоде заболевания.
Механизм активации калликреинкининовой системы при бактериальных инфекциях и интоксикациях сложен и окончательно не выяснен. Об этом свидетельствует тот факт, что даже в последнее время появляются работы, раскрывающие новые пути активации плазменного кининогенеза [Kalter Е. S. et al., 1983]. Представляется более вероятной активация плазменного кининогенеза через непосредственное взаимодействие эндотоксина с фактором Хагемана, впервые показанное D. С. Morrison, С. G. Chochrane (1974), поскольку ранее нами было установлено, что в остром периоде сальмонеллеза происходит этапная активация свертывающей и противосвертывающей систеМ. А как известно, фактор Хагемана является ключевым ферментом, связывающим воедино свертывающую, противосвертывающую и калликреинкининовую систему [Чернух А. М., Гомазков О. А., 1976].
Активное состояние калликреинкининовой системы плазмы крови могут поддерживать также ацидоз и гипоксия [Жильцов Ю. Д., 1978], ряд систем гуморальной регуляции [Berry L. 3., 1982; Scicli А. G., 1983]. Активность калликреинкининовой системы крови может быть высокой и в результате значительного нарушения гемодинамики в малом круге кровообращения (гипертензия, ацидоз, гипоксия), вследствие чего снижается активность кининазы II, ведущего кининразрушающего фермента [О'Brodovich Н. М., 1981].
Таким образом, проведенные нами исследования роли калликреинкининовой системы в нарушениях гемостаза и гемодинамики не оставляют никаких сомнений в том, что пусковым механизмом развития патофизиологических и патобиохимических нарушений при сальмонеллезе является эндотоксин сальмонелл. Согласно многочисленным исследованиям, эндотоксин реализует свое действие через различные медиаторные системы и прежде всего через простагландины [Berry L. J., 1982], которым отводится исключительно важная роль в функционировании практически всех органов и систем [Sullivan J. М., 1981]. Кроме того, нами показано, что эндотоксин сальмонелл обладает способностью резко активизировать биосинтез простагландинов из полиненасыщенных жирных кислот.
Кинины и простагландины относятся к ведущим гуморальным системам, ответственным за поддержание сосудистого гомеостаза [Дзизинский А. А., Гомазков О. А., 1976; McGiff J. С., Quilley J., 1980]. Они, как известно, находятся в тесной функциональной взаимосвязи [Nasjletti А., Malki К. U., 1979]. Помимо накопления в крови вазоактивных субстанций, важное место в развитии гемодинамических расстройств в остром периоде сальмонеллеза занимают и выраженные водноэлектролитные потери, которые на более поздних стадиях приобретают уже самостоятельное патогенетическое значение.
Использование исключительно одной регидратационной терапии полиионными растворами корригирует прежде всего водносолевой баланс организма и в меньшей степени оказывает влияние на степень эндотоксинемии. Поэтому цепь патогенетических реакций при этом виде: терапии не прерывается, и у больных наблюдается более. выраженная по длительности клиническая картина заболевания. В случае добавления в комплексное лечение больных сальмонеллезом индометацина, который оказывает мощное тормозное действие на биосинтез простагландинов, мы не только восполняем водносоленые потери, но и предупреждаем действие эндотоксина на системы физиологически активных веществ, влияние которых на системы тканевой регуляции опосредуется простагландинами [Гомозков О. В., 1981].
ЦИКЛИЧЕСКИЕ НУКЛЕОТИДЫ
Анализу циклических нуклеотидов в последние годы посвящено большое количество исследований. Установлено, что активность секреторного процесса в кишечнике кор; релирует с уровнем синтеза циклического аденозинмонофосфата. В ряде работ отмечено прогностическое значение определения уровней цАМФ. По данным Ф. А. Туманова (1983), высокие уровни этого нуклеотида в плазме крови наблюдались в случаях медленного выздоровления. Отмечена прямая сильная корреляционная связь высоких уровней цАМФ в плазме крови с обнаружением сывороточных иммуноглобулинов в копрофильтратах у больных с затяжным течением. Важное значение придается системе цАМФ/цГМФ в развитии иммунных реакций. Показано, что активация синтеза цАМФ вызывает пролиферацию иммунокомпетентных клеток федоров Н. А., 1979; Бунин К. В. и др., 1979]. Вместе с тем многие вопросы, касающиеся динамики циклических нуклеотидов в крови и тканях больных сальмонеллезом, плохо изучены.
В своих исследованиях мы исходили из общепринятого положения о том, что циклические нуклеотиды опосредуют разного рода сигналы, воспринимаемые клеткой. При этом мы допускали, что значительное усиление синтеза простагландинов должно определенным образом влиять на активность синтеза этих внутриклеточных регуляторов. Более того, имеется большое количество клинических и экспериментальных данных, свидетельствующих о том, что именно простагландины регулируют синтез циклических нукле=тидов.
Циклические нуклеотиды определяли общепринятыми методами. Анализ влияния различных схем лечения проводился в сопоставлении с основными клиническими проявлениями по группам больных. Лечение подбиралось методом случайной выборки.
Уровни циклических нуклеотидов (цАМФ и цГМФ) определены у 123 больных гастроинтестинальной формой сальмонеллеза при поступлении в стационар, а также через сутки, считая от начала лечения, и в период реконвалесценции. Среднее значение исходного уровня цАМФ в плазме крови у всех 123 больных было ниже физиологического – 17,6±1,08 ммоль/л. В группе лиц, леченных с помощью общепринятой методики регидратации, он составил 14,8±1,48 ммоль/л, а в группе лиц, получавших дополнительно к регидратации индометацин, – 14,68±0,7 ммоль/л. К концу первых суток после начала лечения у больных, получавших лишь регидратационную терапию, отмечено снижение уровня цАМФ в плазме крови (9,05±0,38 ммоль/л, р<0,05). В то же время у лиц, получавших комплексную терапию, показатели цАМФ практически сохранялись на цифрах исходного уровня (13,84±0,75 ммоль/л; р>0,05), т. е. снижения уровня цАМФ не происходило.
При первом обследовании больных уровни цГМФ в плазме крови в обеих группах были практически одинаковыми (6,9±0,38 нмоль/л и 7,760,44 нмоль/л соответственно) m не отличались от физиологических значений (7,15±0,88 нмоль/л; р>0,05) . В дальнейшем уровни зГМФ в плазме крови больных оставались низкими (5,74±0,25 нмоль/л) и не зависели от методов лечения. Несущественные изменения показателей цГМФ в плазме крови больных сальмонеллезом подчеркивали Н. Д. Ищук (1980) и В. И. Рябов (1983).
При анализе содержания циклических нуклеотидов у больных сальмонеллезом мы обратили внимание на то, что при поступлении больных в стационар у части из них наблюдалось повышение уровня цАМФ в плазме крови (22,61,2 нмоль/л; р<0,05), а у других – он был ниже физиологических значений (10,9±0,39 нмоль/л; р<0,05). Причем больных с высокими уровнями цАМФ в плазме крови было больше, чем больных с низкими значениями цАМФ.
Низкие показатели исходного уровня цАМФ в плазме крови при первичном обследовании всех 123 больных явились следствием того факта, что у 51 из обследованных больных снижение уровней цАМФ в плазме крови было более значительным, чем увеличение цАМФ в плазме крови у остальных 72 больных.
66 из 72 больных, у которых при первичном обследовании обнаружено повышение показателей цАМФ в плазме крови, были госпитализированы в стационар на 12й день болезни. В то же время больные, у которых наблюдался низкий уровень цАМФ в плазме крови, были госпитализированы в более поздние сроки, в частности 45 из 51 больных были обследованы на 34й день болезни.
Таким образом, повышение уровня цАМФ в плазме крови больных сальмонеллезом происходит в начальной стадии заболевания, а далее наступает снижение его показателей, что и было нами отмечено у больных, поступивших в более поздние сроки болезни.
Аналогичную динамику мы наблюдали у больных сальмонеллезом при определении циклического гуанозинмонофосфата. Исходные уровни циклического гуанозинмонофосфата в группе больных, получавших общепринятую регидратационную терапию, составили 9,04±1,1 нмоль/л, а в группе больных, получавших также индометацин, – 10,6 1,4 нмоль/л.
Как известно, восстановление жидкостей и электролитов, которого мы добивалпсь в обеих группах больных, не оказывает быстрого влияния на концентрацию циклических нуклеотидов. По данным большинства исследователей, только в период реконвалесценции происходит восстановление физиологических значений. содержания циклических нуклеотидов.
У больных с высоким исходным уровнем цАМФ в плазме крови (22,6±1,2 нмоль/л), получавших общепринятое регидратационное лечение, уже через 24 ч наблюдалось достоверное снижение (ниже физиологических значений) содержания этого нуклеотида до 11,94±0,81; р<0,001, в период реконвалесценции оно составляло 12,2±0,82 нмоль/л. В то же время у больных с высоким исходным уровнем цАМФ в плазме крови, леченых комбинацией индометацина с регидратацией через сутки, не отмечено снижения уровня цАМФ в плазме крови (17,7±1,3 нмоль/л). В период реконвалесценции уровни цАМФ в плазме крови больных продолжали снижаться. Их среднее значение (15,7±1,5 нмоль/л) было ниже физиологических показателей. Следует отметить, что наиболее выраженный клинический эффект от применения индометацина наблюдался у больных сальмонеллезом с высоким исходным уровнем цАМФ в плазме крови.
В группе больных с низким исходным уровнем цАМФ в плазме крови (10,9±0,39 нмоль/л) проводимое в обоих вариантах лечение не оказывало существенного влияния на уровни цАМФ во все периоды заболевания. В период реконвалесценции значения плазменных уровней нуклеотида составили соответственно 11,9±0,81 нмоль/л и 10,7±0,74 нмоль/л (р)0,05).
У больных с высокой концентрацией циклического аденозинмонофосфата в плазме крови, а также у тех, кому :проводилась регидратационная терапия, мы не выявили изменений показателей циклического гуанозинмонофосфата в период реконвалесценции по сравнению с исходным уровнем. Аналогичные результаты получены у больных с низким содержанием цАМФ, которым проводилась лишь регидратационная терапия. В группе больных с высоким уровнем цАМФ, которым проводилось лечение индометацином, отмечено достоверное снижение уровня цГМФ до 6,69±0,39 нмоль/л спустя сутки после начала лечения, а в период реконвалесценции – до 6,684±0,64 нмоль/л по сравнению с исходным уровнем (10,6±1,4 нмоль/л.
В группе больных с низким уровнем цАМФ, леченных индометацином, не было изменений содержания цГМФ к концу лечения. Однако уровень цГМФ в этой группе больных в период реконвалесценции был достоверно выше (7,81±1,2 нмоль/л), чем в группе больных с низким уровнем цАМФ (5,4±0,73 нмоль/л), получавших только регидратационную терапию.
Требует уточнения вопрос о том, почему назначение ингибитора биосинтеза простагландинов ведет к стабилизации уровня цАМФ в плазме крови, в то время как на фоне регидратационной терапии этот показатель имеет тенденцию к резкому снижению.
Мы провели эксперименты на животных для сопоставления изменения содержания циклических нуклеотидов в крови и в тканях (тонкая кишка). На экспериментальных животных (кролики породы Шиншилла) была воспроизведена сальмонеллезная интоксикация путем внутривенного введения эндотоксина S. typhimurium в дозе 1,0 мг/кг массы тела. В первой серии опытов прослежена концентрация цАМФ и цГМФ в плазме крови животных на протяжении 3часовой сальмонеллезной интоксикации. Установлено, что уже через 30 мин после введения эндотоксина сальмонелл уровни циклического аденозинмонофосфата и циклического гуанозинмонофосфата резко возрастали. Так, уже через 30 мин после внутривенного введения эндотоксина с фоновых значений 59,7±9,2 нмоль/л концентрация циклического аденозинмонофосфата увеличилась до 173,6±22,7 нмоль/л (р<0,001). В то же время уровень циклического гуанозинмонофосфата возрос с 17,6±3,0 нмоль/л до 42,9 нмоль/л (р<0,001) .
Через 60 мин после введения эндотоксина выявлено дальнейшее увеличение содержания обоих нуклеотидов в плазме крови: циклического аденозинмонофосфата – до 243,1±33,6 нмоль/л, а гуанозинмонофосфата – до 58,5±6,6 нмоль/л.
Эти наблюдения свидетельствуют о резкой активации синтеза обоих циклических нуклеотидов под действием эндотоксина сальмонелл (рис. 18).
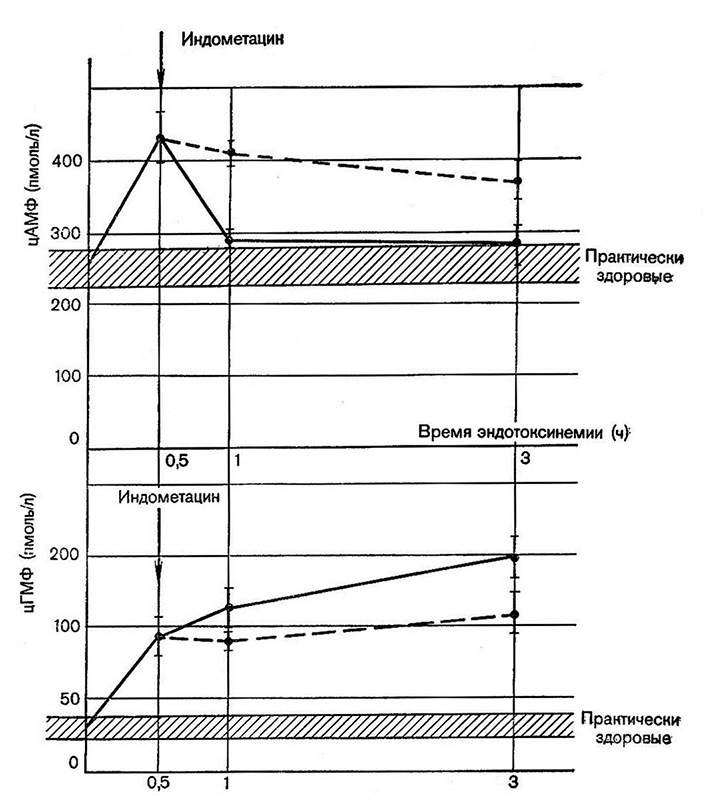
Рис. 18. Циклические нуклеотиды в плазме крови кроликов
при сальмонеллезной интоксикации после введения индометацина.
Сплошная линия – контроль; пунктирная – введение индометацина.
Высокие уровни циклических нуклеотидов отражают общее действие эндотоксина, но на основании этих данных невозможно судить о функциональном состоянии какихлибо определенных органов и систем. В условиях сальмонеллезной интоксикации наибольший интерес вызывает функциональное состояние стенки тонкой кишки. Поэтому было проведено исследование содержания циклических нуклеотидов в слизистой оболочке тонкой кишки в эксперименте.
При экспериментальной сальмонеллезной интоксикации через 30 мин после начала эксперимента отмечено резкое повышение содержания цАМФ в слизистой оболочке тонкой кишки (430,2±38,6 пмоль/г). Однако уже спустя 60 мин после начала интоксикации содержание циклического аденозинмонофосфата снижалось до его физиологических значений (286,5±16,1 пмоль/г). К 180й минуте эксперимента уровни цАМФ в слизистой тонкой кишки не отличались от физиологических значений (279,0±25,4 пмоль/г).
Совершенно иной была динамика содержания в слизистой кишки циклического гуанозинмонофосфата. Через 30 мин после начала опыта его концентрация составила 88,1 9,0 пмоль/г; через 60 мин она возросла до 122,0±19,0; а на 180й минуте опыта достигла максимума – 156,0±16,5 пмоль/г (рис. 19).
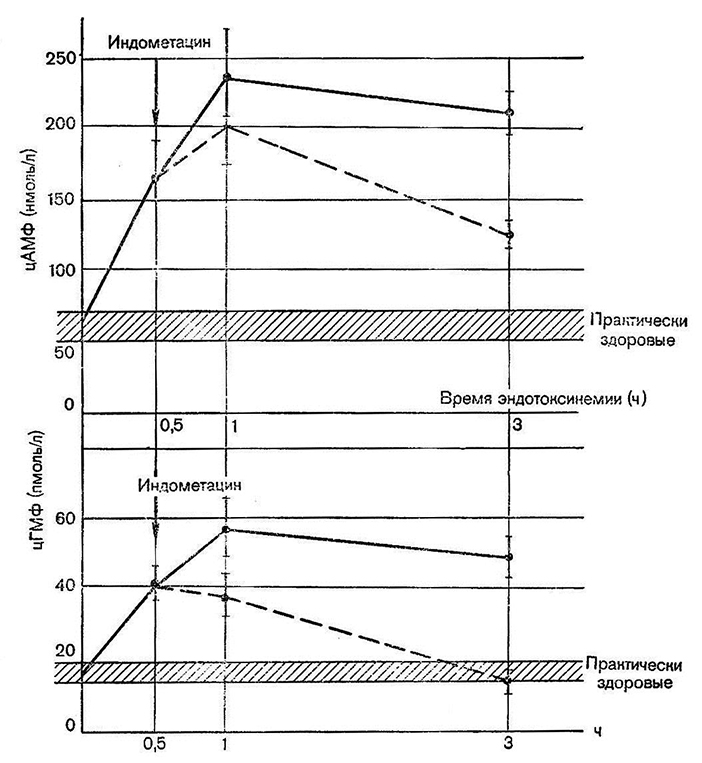
Рис. 19. Циклические нуклеотиды в слизистой оболочке тонкой кишки кроликов
при сальмонеллезной интоксикации после введения индометацина.
Сплошная линия – контроль; пунктирная – введение индометацина.
Указанная динамика содержания обоих циклических нуклеотидов происходила на фоне адинамии, повышения ректальной температуры и прогрессирующей диареи у животных.
Активация синтеза этих универсальных внутриклеточных регуляторов в условиях сальмонеллезной интоксикации остается очевидным, но недостаточно расшифрованным явлением. Сторонники традиционного подхода объясняют повышение уровней любых физиологически активных веществ повреждающим действием эндотоксина. Именно такой довод используют для объяснения причин повышения или понижения уровня катехоламинов, кортикостероидов, кининов и ряда других веществ в плазме крови у больных сальмонеллезом или в эксперименте.
Для уточнения возможных причин изменения содержания циклических нуклеотидов проведена вторая серия опытов на животных. В этой серии опытов животным на фоне развившейся сальмонелле зной интоксикации (через 1 ч) с помощью зонда в желудок вводили индометацин в дозе 10 мг/кг массы тела. При исследовании динамики содержания цАМФ и цГМФ в плазме крови животных было установлено, что через 30 мин после введения индометацина уровни обоих нуклеотидов не претерпели существенных изменений и не были выше физиологических значений. При исследовании концентрации циклических нуклеотидов через 180 мин после развития интоксикации выявлено достоверное снижение показателей цАМФ (130,312,7 пмоль/л) и цГМФ в плазме крови. Уровень цГМФ при этом не отличался от показателей у интактных животных. Концентрация цАМФ в слизистой тонкой кишки на фоне введения индометацина сохранялась на высоком уровне в течение всего эксперимента.
Концентрация цГМФ в слизистой кишки прогрессивно снижалась и к 180й минуте опыта уменьшилась до 115,3±18,5 пмоль/л. Эти показатели достоверно отличались от данных, полученных у животных в первой серии опытов (156,016,5 пмоль/г; р<0,02).
Таким образом, клинические и экспериментальные данные дают основание считать, что концентрация циклических нуклеотидов в плазме крови резко повышена на ранних стадиях развития интоксикации. У больных сальмонеллезом в более поздние сроки болезни наблюдается снижение уровней циклических нуклеотидов в периферической крови.
Вместе с тем из результатов эксперимента следует, что на протяжении всего периода наблюдений имело место постоянное нарастание концентрации цГМФ в тканях слизистой тонкой кишки, что сопровождалось усилением диареи. Это позволяет предположить, что потерю жидкости и электролитов невозможно объяснить только с позиций активации синтеза циклического аденозинмонофосфата. Обнаружение высоких концентраций циклического гуанозинмонофосфата в слизистой тонкой кишки в течение 180 мин наблюдения, отмеченное в первой серии опытов, и достоверное снижение его значений на фоне введения животным индометацина оставляют открытым вопрос о патогенетической роли этого нуклеотида в усилении секреции электролитов и жидкости.
Результаты сравнительной оценки влияния двух схем лечения на динамику циклических нуклеотидов дают основание полагать, что резкие изменения содержания нуклеотидов в определенной степени связаны с регуляторным влиянием простагландинов. В этой связи особо показательны экспериментальные данные, Введение животным ингибитора биосинтеза простагландинов сопровождалось, с одной стороны, купированием диареи, а с другой – достоверным снижением концентрации циклического гуанозинмонофосфата в слизистой тонкой кишки. Эти данные соответствуют известным представлениям о регулирующем влиянии простагландинов на синтез циклических нуклеотидов [Ажгихин И. С., 1978; Варфоломеев С. Д., Мевх А. Т., 1985]. В свою очередь результаты изучения динамики уровней циклических нуклеотидов в клинических и экспериментальных условиях сальмонеллезной интоксикации подтверждают наши представления о патологической роли простагландинов.
ГИСТАИИН И СЕРОТОНИН
Пристальный интерес исследователей к патогенетической роли гистамина и серотонина объясняется как локализацией этих физиологически активных веществ в слизистой оболочке тонкой кишки, так m их активацией при самых различных физиологических и патологических состояниях макроорганизма [Гомазков О. В., 1981]. Основное депо гистамина – тучные клетки в слизистой оболочке желудочнокишечного тракта. Как и у большинства нейрогуморальных регуляторов, воздействие гистамина на тканевом уровне определяется характером тканей. Гистамин воспринимают H1 и Н2рецепторы. Мышечные ткани, обладающие Н1рецептором (мышечная оболочка крупных сосудов, бронхов, кишечника), под действием экзогенного гистамина сокращаются. Противоположный указанному эффект вызывает тот же гистамин в тканях, обладающих Н2рецептором. Связывание гистамина с этим рецептором сопровождается снижением тонуса и последующим расширением мелких сосудов, увеличением их проницаемости, активацией секреции хлористоводородной кислоты в желудке.
Имеется еще одна группа фактов, привлекающая внимание исследователей к роли гистамина и серотонина в патогенезе острых кишечных инфекций. В многочисленных экспериментах были получены доказательства близости проявлений эндотоксинемии и экзогениого введения животным гистамина и серотонина. Эти наблюдения позволили выдвинуть предположение о медиаторной роли этих биологических аминов в реализации эффектов эндотоксина грамотрицательных бактерий [Шенкман Б. 3., 1984; Urbashek В. et al., 1976].
Анализ данных литературы выявил два подхода к объяснению значения гистамина и серотонина в патогенезе пищевой токсикоинфекции, сальмонеллеза и дизентерии. Часть исследований указывает на участие этих физиологически активных веществ в развитии воспалительных и аллергических реакций при острых кишечных пнфекциях [Карева И. Я., 1977; Резникова О. Т. и др., 1977; Вершеня М. И. и др., 1983].
В соответствии с представлениями других авторов гистамин и серотонин причастны к развитию диареи при пищевых токсикоинфекциях, полиэнтеритах и сальмонеллезе [Ребенок Ж. А., 1977; Ющук Н. Д. и др., 1977; Сидаков Б. М. и др., 1983; Рязанова Н. Я. и др., 1983; Donowitz М. et al., 1979; Linaker В. D. et а1., 1981].
Мы полагаем, что оба биогенных амина играют важную роль в перестройке нейрогуморальной регуляции в условиях патологического процесса. Важно определить инициирующие факторы, вызывающие синтез этих физиологически активных веществ из предшественников. Только в этом случае можно разработать подходы к совершенствованию методов лечения больных.
По данным Б. М. Сидорова и соавт, (1983), имеется определенная функциональная взаимосвязь между гистамином и циклическими нуклеотидами в регуляции метаболизма на тканевом уровне. При обследовании 60 больных пищевыми токсикоинфекциями наряду с высокими концентрациями циклических нуклеотидов в биоптатах слизистой толстой кишки выявлены и повышенные уровни гистамина. По мнению авторов, это может свидетельствовать об их взаимосвязи в генезисе диареи.
Установлено, что дегрануляция тучных клеток и высвобождение гистамина могут происходить под влиянием протеаз, бактериальных токсинов и двух групп простагландинов – Е1 и F2 [Muller – Berghaus G., 1970; Klein W. W., 1971; Maslinsky L., 1977]. Более того, как показали J. R. Parrat и R. М. Sturgess (1977), вызываемый эндотоксином Е. coli спазм сосудов легких не снимался после блокады рецепторов гистамина и серотонина. Купирование сосудистого эффекта эндотоксина обеспечивал лишь ингибитор биосинтеза простагландинов – индометацин.
По мнению Ж. А. Ребенка (19771983), повышение концентрации серотонина в крови больных, о которой свидетельствовало и снижение экскреции 5оксииндолуксусной кислоты, объясняется ингибирующим влиянием эндотоксина на активность моноаминоксидазы. Известно, что этот фермент катализирует окислительное дезаминирование серотонина до 5оксииндолуксусной кислоты. Обнаружение высоких концентраций гистамина в первые дни болезни, по данным этого автора, может определять его патогенетическое значение в развитии диареи и других характерных проявлений сальмонеллеза. Этот вывод сделан на основании обнаружения меньших количеств гистамина при легком течении пищевых токсикоинфекций. Автор допускает, что в развитии гипергистаминемии может иметь значение гиповолемия, но основной причиной повышения содержания гистамина является способность эндотоксина вызывать дегрануляцию тучных клеток.
Избыточное накопление серотонина, гистамина и ацетилхолина на фоне меньшего высвобождения кортикостероидов и катехоламинов, по мнению Ж. А. Ребенка (19771983), приводит к изменениям процессов регуляции гомеостаза. Терапевтическая тактика в соответствии с данными автора должна быть направлена на восстановление механизмов регуляции. Решение этих задач, особенно при тяжелом течении пищевых токсикоинфекций, возможно при назначении больным кортикостероидов и антигистаминных препаратов.
Для выяснения роли гистамина и серотонина нами проведены наблюдения над 63 больными пищевыми токсикоинфекциями среднетяжелого течения. Возраст больных – от 21 до 46 лет. Все были госпитализированы в первые 2 дня от начала заболевания. У всех больных проанализировано влияние регидратационной терапии раствором «Квартасоль» (28 человек) и предложенной нами схемы лечения с назначением индометацина (35 человек) на динамику клинических проявлений, обмен гистамина и серотонина. С этой целью были изучены концентрации гистамина и гистидина, триптофана, серотонина и конечного продукта его распада – 5оксииндолуксусной кислоты. Объем инфузии в обеих группах больных был идентичным и не превышал 12 л в сутки. Исследование обмена гистамина и серотонина проводили по методу С. А. Мещеряковой (1974) в цельной крови. Пробы крови анализировали до начала лечения, через 24 ч и перед выпиской реконвалесцентов.
До начала лечения на фоне выраженных клинических проявлений пищевой токсикоинфекции концентрация гистидина в крови (95,33±15,2 ммоль/л) была более чем в 2 раза выше по сравнению с здоровыми людьми (39,61±4,5 ммоль/л). Концентрация предшественника серотонина – триптофана (113,8±18,7 ммоль/л) более чем в 3 раза превышала показатель у здоровых лиц (29,3±5,03 ммоль/л).
Значительное повышение уровней предшественников гистамина и серотонина невозможно объяснить преимущественным влиянием какойто одной группы факторов. Можно высказать предположение о нарушении под влиянием интоксикации дезаминазного пути распада гистидина в печени и подавлении окисления триптофана под действием триптофанпирролазы в печени и крови.
Несмотря на высокие концентрации предшественников, уровни серотонина (1,034±0,15 ммоль/л) и гистамина (2,1±0,2 ммоль/л) были увеличены, но не соответствовали кратности прироста концентраций гистидина и триптофана. Возможно, концентрация этих биогенных аминов в крови не соответствует их уровню в стенке кишечника. Обнаружение значительного содержания 5оксииндолуксусной кислоты в крови свидетельствует о резком усилении синтеза серотонина.
Через сутки от начала лечения в контрольной группе больных (регидратационная терапия) отмечено некоторое увеличение концентрации триптофана (113,8±18,7 ммоль/л) и гистидина (124,2±19,3 ммоль/л), но в обоих случаях оно не было статистически значимым. В этот период не выявлено существенных колебаний уровней гистамина (2,13±0,3 ммоль/л) и серотонина (1,3±0,2 ммоль/л). Однако очень высокая концентрация 5оксииндолуксусной кислоты (0,82±0,1 ммоль/л) свидетельствовала об интенсивном синтезе серотонина.
Таким образом, общепринятая регидратационная терапия не оказывала существенного влияния на обмен гистидина и триптофана. В группе больных, получивших регидратационную терапию в сочетании с индометацином, концентрация гистидина в крови (86,5±14,4 ммоль/л) продолжала оставаться резко повышенной по сравнению с нормой, но была достоверно ниже, чем у больных в контрольной группе (р<0,05). Уровни триптофана на фоне приема индометацина снизились до 66,8±8,3 ммоль/л, но в 2 с лишним раза превышали показатели у здоровых лиц (р<0,001). Вместе с тем снижение концентрации предшественников в крови не оказало какоголибо значимого влияния на концентрацию серотонина и гистамина в крови. Они не отличались от уровней этих биогенных аминов: в контрольной группе. К исходу первых суток в контрольной группе диарея купировалась у 50% больных, а в основной (прием индометацина) – у всех 35 человек. Следовательно, высокие уровни серотонина и гистамина в крови не отражались на клинических проявлениях пищевой токсикоинфекции.
Период реконвалесценции в обеих группах больных характеризовался некоторым снижением концентраций триптофана и гистидина и их метаболитов, однако это снижение не было статистически значимым по сравнению с предшествующим обследованием.
Таким образом, проведение исследования свидетельствуют о существенных изменениях обмена серотонина и гистамина при пищевой токсикоинфекции, однако нами не установлена связь между уровнями гистамина и серотонина в крови и синдромом интоксикации.
Вместе с тем данные литературы о высокой концентрации этих биогенных аминов и особенно гистамина в слизистых оболочках тонкой и толстой кишки в период разгара заболевания характеризуют их участие в развитии патологического процесса при острых кишечных инфекциях. Развитие синдрома интоксикации при гастроинтестинальной форме сальмонеллеза характеризуется существенной перестройкой нейрогуморальной регуляции на тканевом уровне. В период разгара заболевания наблюдается нарушение метаболизма гистамина и серотонина, существенно изменяется обмен катехоламинов, циклических нуклеотидов, альдостерона, ренина, кортикостероидов, изменяется функциональное состояние калликреиикининовой системы, нарушается водноэлектролитный и кислотнощелочной баланс. Изменение параметров регуляции сопровождается развитием синдрома интоксикации.
По данным многих экспериментальных исследований, инициирующим фактором в изменении параметров нейрогуморальной регуляции являются токсические субстанции возбудителей заболевания. Об этом же свидетельствует и опыт клинических наблюдений. Как показывает врачебная практика, удаление токсинов из организма путем промывания желудка, адсорбции, выведения токсинов при внутривениом и энтеральном введении коллоидных растворов сопровождается ослаблением интоксикации. В конечном итоге диарея и рвота выполняют ту же выделительную защитную функцию.
В свою очередь признание определяющей роли токсических субстанций возбудителя заболевания в развитии нарушений нейрогуморальной регуляции ставит вопрос о механизме этих нарушений. Патогенное влияние токсических субстанций на макроорганизм реализуется на молекулярном уровне. Существует множество фактических данных об активации синтеза универсальных тканевых гормонов – простагландинов при экспериментальном воспроизведении практически всех грамотрицательных инфекций. Мы пришли к выводу о том, что инициирующим фактором развития изменений нейрогуморальной регуляции на тканевом уровне является обусловленная эндотоксином активация биосинтеза простагландинов. Безусловно, сложный комплекс изменений нейрогуморальной регуляции на последующих этапах развития заболевания реализуется по принципу «порочного круга» в результате возникших водноэлектролитных потерь, нарушений кислотнощелочного состояния, нарушений микроциркуляции и гем оста за, развития иммуно патологических реакций и др.
Разрыв «порочного круга» в нейрогуморальной регуляции возможен лишь при удалении токсина, его нейтрализации иммунными факторами. Опыт применения индометацина, являющегося мощным ингибитором биосинтеза простагландинов, убедительно доказывает патогенетическую роль этого феномена в развитии синдрома интоксикации. Естественно, наше предположение не исчерпывает возможностей влияния на молекулярные основы патогенеза синдрома интоксикации. Оно является лишь первой попыткой в новом направлении по совершенствованию методов дезинтоксикационной терапии больных инфекционными заболеваниями.
ВЛИЯНИЕ ЛЕЧЕНИЯ НА ИММУННУЮ СИСТЕМУ
Одной из актуальнейших задач лечения инфекционного больного является профилактика бактерионосительства. Его патогенез до последнего времени остается малоизученным, но ясно одно – в формировании носительства важное значение имеют неполноценность иммунных реакций макроорганизма и особенности возбудителей заболевания. Неблагоприятное влияние антибиотикотерапии на течение инфекционного процесса у больных гастроинтестинальной формой сальмонеллеза общеизвестно. По многочисленным наблюдениям, антибиотикотерапия оказывает и иммунодепрессивное воздействие.
По данным И. К. Мусабаева и соавт. (1979), у больных сальмонеллезом (30 человек) на фоне приема антибиотиков отмечается снижение бласттрансформации лимфоцитои (в среднем 36,40) и повышение концентрации иммуноглобулинов всех классов, особенно IgG и IgA.
В период реконвалесценции у обследованных больных обнаружена тенденция к повышению количества Тлимфоцитов и снижению концентрации иммуноглобулинов, однако полной нормализации анализируемых показателей не наступало.
С нашей точки зрения, снижение показателей клеточного иммунитета определяется и проводимой этиотропной терапией. При комплексном изучении цитохимическими методами ферментативной активности лейкоцитов, а также их фагоцитарной активности у 42 больных сальмонеллезом Б. С. Нагоевым (1979) показано, что в динамике заболевания изученные показатели нарастали. Эти данные требуют особого внимания. Высокая ферментативная активность нейтрофилов в период реконвалесценции, вероятно, свидетельствует не об их защитных функциях, а в большей степени о продолжающемся активном инфекционном процессе. И. И. Корниловой (1979) показано, что при манифестной форме сальмонеллеза в остром периоде преобладает повышение щелочной фосфатазы нейтрофилов с последующим нарастанием активности кислой фосфатазы. Иная картина наблюдалась при формировании носительства. При остром носительстве повышалась активность. кислой фосфатазы, а при хроническом – обеих фосфатаз.
Нами проведено комплексное исследование специфических и неспецифических факторов иммунитета на фоне приема больными индометацина. Известно, что индометацин при длительном применении способен оказывать иммунодепрессивное действие [Сигидин Я. А., Денисов Л. Н., 1972]. Сотрудниками нашей кафедры Данилкиным Б. К. и соавт. (1983) проведен анализ показателей полных и неполных антител в сыворотке крови больных сальмонеллезом, получавших в острой стадии заболевания комплексную терапию с использованием индометацина.
Обследовано 64 больных гастроинтестинальной формой сальмонеллеза средней тяжести (30 мужчин и 34 женщины) в возрасте от 16 до 60 лет. 44 человека получали индометацин при поступлении в стационар в виде однодневного курса по 50 мг 3 раза в день. 20 остальных больных, составивших контрольную группу, лечились теми же методами комплексной патогенетической терапии, но без применения препарата.
Определение содержания полных и неполных антител в сыворотке крови произведено в динамике на 2й и 7й дни болезни с помощью реакции непрямой гемагглютинации с комплексным сальмонеллезным Одиагностикумом производства Московского НИИЭМ им. Гамалеи и гемагглютинационного варианта пробы Кумбса. Для определения неполных антител IgG, IgA и IgMклассов применяли моноспецифические сыворотки против иммуноглобулинов человека производства НИИЭМ им. Гамалеи.
Результаты исследования свидетельствуют о достоверном увеличении к 7му дню болезни титров полных антител в сыворотке крови больных, как получавших, так и не получавших индометацин. Средние показатели титров антител на 2й день болезни у лиц, получавших и не получавших индометацин, составили соответственно 1,4х:039 и 1,24 х:0 17, к 7му дню болезни – 2,79 х:0,5 и 2,17 х:0,30. Темпы увеличения содержания полных антител были приблизительно одинаковыми в обеих группах больных (р>0,05) .
К 7му дню болезни сывороточные Оантитела в диагностических титрах (1: 2000 и выше) были выявлены лишь у 18 из 64 больных (в 28,1% случаев), что согласуется с наблюдениями других авторов, отмечавших появление диагностических титров Оантител на 1й неделе заболевания лишь в 2530% случаев [Малинина Н. П., 1973; Шуба Л. И и Сулейманов А. К., 1978, Газатуллина Д. К., 1979].
Н олные антитела при сальмонеллезе уже на 2й день болезни определялись в высоких титрах (1:6401:12 800) и принадлежали главным образом к иммуноглобулинам IgG и IgMклассов. Эти результаты соответствуют данным других ученых: Ю. Л. Субботиной (1972), Л. И. Шуба, А. К. Сулейманов (1978), М. Р. Коротковой и Т. Г. Старковой (1978). Не отмечено также различий в скорости нарастания титров неполных антител к моменту выписки больных из стационара. Так, у больных, получавших индометацин, средние показатели неполных 1 С и 1дМантител к 7му дню болезни достигли уровней 8,76 : 0,16 и 5,65: 0,18, а у лиц контрольной группы– 8 61:0,17 и 5 58:0,22 соответственно. Различия между показателями у лиц контрольной и опытнои групп статистически недостоверны.
Титры неполных IgAантител были значительно ниже, чем антител других классов и варьировали от 1:100 до 1:400 у лиц обеих групп. Уровни неполных IgAантител у больных, не получавших индометацин, оставались практически, без изменений со 2го по 7й дни болезни: 427х:0,44 и 425 х:0,39. Средний показатель этих антител у больных, получавших индометацин, к концу 1й недели был равен 2,79 х:0,33 и демонстрировал тенденцию к их снижению по сравнению с аналогичным показателем у лиц контрольной группы (4,24 х:0,39 и 2,79 х:0,33).
Таким образом, результаты наблюдений свидетельствуют о том, что использование индометацина при лечении больных сальмонеллезом в виде короткого однодневного курса не приводило к существенным изменениям показателей образования полных и неполных сывороточных Оантител.
Принимая во внимание важную роль фагоцитоза в санации организма больных, а также способность сальмонелл подавлять фагоцитарную реакцию, было решено оценить влияние индометацина на фагоцитарную активность нейтрофилов у больных сальмонеллезом [Данилкин Б. К. и др., 1985]. Фагоцитарную активность нейтрофилов периферической крови определяли с помощью визуального метода. Исследования проведены у 64 больных гастроинтестинальной формой сальмонеллеза среднетяжелого течения.
Фагоцитарный индекс, фагоцитарное число и коэффициент фагоцитарного числа на 2й день заболевания у больных основной группы были равны 58,8±0,2, 3,28±0,3 и 0,8±0,1, а у лиц контрольной группы – 59,1±0,1, 3,12±0,6 и 0,7±0,2. Значения тех же показателей к 7му дню болезни у лиц, получавших и не получавших индометацин, составили в основной группе 73,6±1,3, 11,1±0,4, 1,2±0,2 и в контрольной – 75,8±0,8, 11,6±0,4, 1,5±0,2 соответственно. Как в начальном периоде болезни, так и в стадии реконвалесценции не установлено достоверных различий показателей фагоцитарной активности нейтрофилов в обеих группах больных.
Таким образом, результаты этих наблюдений свидетельствуют о том, что применение индометацина в виде короткого курса (первые 12 ч от начала регидратации) не оказывает влияния на процессы образования сывороточных антител и фагоцитарную активность нейтрофилов периферической крови при сальмонеллезной токсикоинфекции.
В последние годы пристальное внимание уделяется изучению участия клеточных факторов иммунитета в патогенезе различных инфекционных заболеваний, в том числе сальмонеллеза. Данные экспериментальных исследований убедительно доказали, что тимус играет ведущую роль в формировании иммунокомпетентной системы организма и связанном с ней образовании антител и клеточных популяций. Одним из наиболее доступных методов определения показателей клеточного иммунитета является выявление содержания Тлимфоцитов в периферической крови. Определение содержания этих клеток при различных инфекционных заболеваниях проводилось Е. С. Белозеровым (1976), E. Н. Бейсембаевым (1978), М. Н. Назармухамедовой (1980), Э. Ш. Боцвадзе (1981) и др. В результате длительных клиникоэкспериментальных исследований отечественных и зарубежных ученых была установлена общая закономерность развития иммунных реакций, выражающаяся в снижении функциональной активности Тсистемы иммунитета в острой фазе инфекционного процесса. В этой связи уместно отметить явную недостаточность работ по анализу влияния различных методов лечения на содержание сывороточных Тлимфоцитов у больных сальмонеллезом [Блюгер А. Ф., 1980; Рашидова Р. А., 1980].
Нами проведено исследование влияния индометацина на содержание Тлимфоцитов в периферической крови у 27 больных гастроинтестинальной формой сальмонеллеза. Группу сравнения составили 10 практически здоровых лиц в возрасте от 20 до 30 лет, не имевших в анамнезе заболеваний сальмонеллезом. Определение содержания Тлимфоцитов в обеих группах проводилось методом спонтанного розеткообразования. Изучение показателей содержания Тлимфоцитов осуществлено в динамике заболевания: при поступлении больных в стационар (13й день от начала болезни) и перед выпиской (67й день от начала заболевания). Все больные получали комплексную терапию с использованием инфузионных растворов, которая была дополнена у 14 больных из числа обследованных лиц назначением индометацина в виде короткого однодневного курса в суточной дозе 150 мг.
В результате проведенных исследований установлено, что в остром периоде болезни (до назначения лечения) происходило снижение содержания Тлимфоцитов у всех наблюдавшихся больных (40,6±2,6%) по сравнению со здоровыми людьми (53,2±4,4%, р<0,05).
В период реконвалесценции (67й день от начала болезни) у всех больных установлено нарастание содержания Тлимфоцитов. У больных, получавших и не получавших индометацин, оно было практически одинаковым и составило соответственно 47,1±6,0% и 45,1±5,6%, приближаясь к величине данного показателя у лиц контрольной группы (55,2±4,4; р>0,05).
Полученные результаты совпадают с данными литературы, свидетельствующими о снижении активности Тсистемы иммунитета в остром периоде заболевания. Кроме того, есть основания полагать, что индометацин не оказывает существенного влияния на динамику активности Тлимфоцитов. Мы считаем, что индометацин в предложенной нами курсовой дозе не влияет на иммуногенез, а также на частоту формирования бактерионосительства.

