Кроме стандартного метода (ГОСТ 20264-2—74), требующего применения сложных реактивов, протеолитическую активность можно определить описанными ниже методами.
Интерферометрический метод. Этот метод разработан во ВНИИФСП (Всесоюзном научно-исследовательском институте ферментной и спиртовой промышленности). В нем степень гидролиза белка под действием протеолитических ферментов исследуемых препаратов определяется с помощью интерферометра ИТР-2 по разности показателей преломления светового луча, проходящего через испытуемый и контрольный раствор.
За единицу протеолитической активности принимают такое количество ферментного препарата, которое катализирует расщепление 1 г белка в строго определенных условиях: при температуре 30° С, pH среды 7,0, продолжительности протеолиза 30 мин, постоянном соотношении субстрат — фермент, обеспечивающем гидролиз белка за 30 мин на 50% с образованием продуктов, неосаждаемых трихлоруксусной кислотой.
Активность ферментных препаратов определяют по специально выведенному уравнению, в котором количество расщепленного белка характеризуется показателем интерферометра. Полученную величину пересчитывают на 1 г исследуемого препарата и выражают его активность в условных единицах. В качестве субстрата используют 1%-ный раствор казеина.
Техника определения следующая. В пробирку диаметром 20 мм и высотой 180 мм вносят 10мл 1 %-ного раствора казеина и прогревают в ультратермостате при температуре 30 ±0,2° С в течение 10 мин. Затем, не вынимая пробирки из термостата, добавляют в нее 5 мл ферментного раствора, перемешивают и оставляют на 30 мин для протеолиза. Протеолиз прекращают добавлением при перемешивании 10 мл 4%-ного раствора трихлоруксусной кислоты (ТХУ), при этом также осаждаются нерасщепленные белки и высокомолекулярные продукты протеолиза. Осаждение производится в том же термостате на протяжении 15 мин.
Для контрольного опыта используют те же реактивы, но в другом порядке. В аналогичную пробирку вносят 10 мл 4%-ного раствора ТХУ, добавляют 5 мл ферментного раствора, перемешивают и выдерживают 5 мин для инактивации фермента. Затем в смесь вносят 10 мл субстрата и выдерживают 15 мин в ультратермостате при температуре 30° С для осаждения белка. По окончании, осаждения обе пробирки охлаждают до комнатной температуры и содержимое их фильтруют через бумажный складчатый фильтр.
Прозрачные фильтраты (рабочий и контрольный) вносят в камеры кюветы интерферометра ИТР-2 и измеряют разность показателей преломления рабочего и контрольного растворов m по барабану интерферометра. Для этого используют кювету с длиной рабочей грани 2 см, в правую ее камеру наливают контрольный раствор, в левую — рабочий.
Для точности определения необходимо, чтобы показание прибора не превышало 500, что соответствует переходу в вещества, не осаждаемые ТХУ кислотой (аминокислоты и пептиды), не более 75% взятого для определения белка. Нельзя также, чтобы количество превращенного белка было слишком малым —меньше 20%.
Протеолитическую активность ПС, ед/г, ферментного препарата рассчитывают по уравнению
ПС = (0,1702 m— 10,213)/(n • 1000),
где m — показание барабана интерферометра; 0,1702 и 10,213 — коэффициенты, найденные экспериментально; n — количество ферментного препарата во взятом для определения количестве ферментного раствора, мг.
Реактивы. 1. 1 %-иый раствор казеина. Готовят растворением в воде. 2. 4%-пый раствор ТХУ.
Унифицированный интерферометрический метод (Модификация по А. П. Рухлядевой и Г. В. Полыгалиной). Этот метод дает возможность анализировать протеолитические ферменты в любой зоне pH с использованием в качестве субстрата 1%-ного раствора казеината натрия. За единицу активности принимают такое количество фермента, которое катализирует расщепление 1 г белка до веществ, не осаждаемых ТХУ кислотой при строго определенных условиях: температура протеолиза 30° С, продолжительность 30 мин, соотношение фермент — субстрат 1 : 2, продолжительность осаждения высокомолекулярных веществ, образующихся при гидролизе белка,— 15 мин. При данном соотношении фермент — субстрат обеспечивается гидролиз белка на 50%.
Техника определения аналогична основному интерферометрическому методу. В методику внесены следующие изменения: субстрат — 1%-ный раствор казеината натрия. Соотношение количества субстрата и раствора фермента 2:1. Субстрат готовят растворением в воде (для нейтральных и щелочных протеаз) или в 0,1 н. растворе НСl (для кислых протеаз) при подогреве и перемешивании магнитной мешалкой. После растворения субстрат охлаждают и доводят pH до нужной величины 0,1 н. раствором NaOH.
После фильтрации определяют разность показателей преломления по сравнению с контролем на интерферометре ИТР-2.
Расчет протеолитической активности ведут по уравнениям, учитывающим зависимость количества прогидролизованного белка от количества единиц активности фермента, введенного в реакцию с препаратом.
Протеолитическую активность препаратов ПС, ед/г, определяют по приведенным ниже уравнениям.
Для нейтральных и щелочных протеаз грибного происхождения
ПС = (0,22m — 21,6)/(n • 1000);
для кислых протеаз грибного происхождения
ПС = (0,58/m — 128,9)/(n • 1000);
для протеаз бактериального происхождения
ПС = (0,35/m — 59,8)/(n • 1000).
Здесь m — показание интерферометра; n — количество ферментного препарата, взятого на анализ, мг.
Погрешность данного метода не превышает ± 5,0% относительных.
Метод Лейлян — Фольгарда в модификации УкрНИИПП. Особенностью данного метода является то, что субстратом в ферментной реакции служит казеин, предварительно растворенный при помощи гидроксида натрия.
Для прерывания ферментной реакции используют титрованный раствор соляной кислоты, а для осаждения нерасщепленного белка — сульфат натрия. О количестве расщепленного белка судят по соляной кислоте, оставшейся в фильтрате, так как казеин связывает и увлекает в осадок всегда определенное, пропорциональное его массе количество соляной кислоты. Оставшуюся в растворе соляную кислоту определяют титрованием гидроксидом натрия при индикаторе крезоловом красном.
Рассчитывают протеолитическую активность по разности между расходом на титрование 0,1 н. раствора гидроксида натрия в рабочем и контрольном опыте. За единицу протеолитической активности принято такое количество фермента, которое за 1 ч при температуре 30° С расщепляет 1 г казеина. ПС выражают числом указанных единиц в 1 г сухого препарата.
Определение проводят в двух параллельных пробах. Для этого в две конические колбы вместимостью 100 мл вносят пипеткой по 20 мл раствора казеина и прогревают в термостате или водяной бане при 30° С в течение 10 мин. Затем при помешивании в колбы добавляют по 10 мл ферментного раствора. Общий объем реакционной смеси должен быть 30 мл. Если ферментного раствора берут меньше, то недостающий объем дополняют дистиллированной водой непосредственно перед введением ферментного раствора. Продолжительность ферментной реакции — 1 ч при температуре 30 ± 0,2° С. Действие фермента прерывают добавлением при перемешивании 20 мл 0,1 н. раствора HCI в 7,5%-ном растворе сульфата натрия и немедленно фильтруют, возвращая первые порции на фильтр до полной прозрачности раствора.
Параллельно ставят два контрольных опыта, в которых раствор НС1 в сульфате натрия вводят перед добавлением ферментного раствора. В этом случае отпадает также необходимость выдерживания пробы в термостате.
После получения прозрачных фильтратов в опытах и контрольных пробах из каждой отбирают по 20 мл фильтрата, добавляют 2 капли индикатора крезолового красного и оттитровывают НС1 0,1 н. раствором NaOH до появления красного окрашивания.
Разность между расходом щелочи на титрование в рабочих и контрольных пробах, отнесенная к 10 мл фильтрата, должна находиться в пределах 0,4—2,5 мм. При других значениях опыт повторяют с большим или меньшим количеством ферментного раствора.
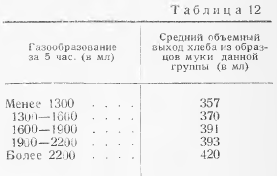
По разности расхода 0,1 н. раствора NaOH на титрование в рабочей и контрольной пробе, пользуясь табл. 12, определяют протеолитическую активность ферментного препарата. Таблица составлена при условии, что для определения взято 10 мл ферментного раствора в разведении 1 : 100. При других дозировках протеолитическую активность ПС, ед/г, пересчитывают по формуле
ПС = е/n,
где е — количество единиц ПС, найденное по табл. 12; n — количество ферментного препарата или культуры, соответствующее 10 мл фильтрата (1/5 от количества, внесенного в реакционную смесь), г или мл.
Полученный результат пересчитывают на сухое вещество. Например, для определения ПС ферментного препарата приготовили 0,1 %-ный ферментный раствор. Для определения взяли 10 мл его. На титрование опытной пробы израсходовали 2,7 мл 0,1 н. раствора, а контрольной — 1,5 мл. Влажность ферментного препарата 10%. Разность в пересчете на 10 мл (2,7—1,5)/2 = 0,6 мл. По таблице она соответствует 0,0360 ед. ПС- п = 0,1 • 10/(100 • 5) = 0,002 г. В расчете на 1 г сухого вещества препарата
ПС = (0,0360/0,002) • [100/(100— 10)] = 20 ед/г.
Реактивы.
- 5%-ный щелочный раствор казеина. 50 г (по сухому веществу) технически измельченного казеина помещают в химический стакан вместимостью 1 л, добавляют 50 мл дистиллированной воды и оставляют на 30 мин. Затем стакан помещают в водяную баню с температурой 65—70° С. При тщательном перемешивании стеклянной палочкой постепенно добавляют 50 мл 1 н. раствора NaOH. В процессе растворения жазеина небольшими порциями (по 50—80 мл) добавляют воду (5—6 раз), нагретую до 65—70° С и выдерживают на водяной бане до полного исчезновения комочков. После полного растворения и охлаждения раствор переносят в мерную колбу вместимостью 1 л, доводят до. метки и, перемешав, фильтруют через четыре слоя марли.
- 0,1 н. раствор НСl в 7,5%-ном растворе Na2S04. В мерной колбе вместимостью 1 л растворяют дистиллированной водой фиксанал 0,1 н. НС1 и 75 г безводного сульфата натрия (Na2S04).
- 0,5%-ный спиртовой раствор крезолового красного. 0,5 г этого индикатора растворяют в 100 мл 96%-ного спирта-ректификата и фильтруют.
- 1 н. раствор 0,1 н. раствор NaOH.

