Амперометрическое титрование представляет собой объемный метод анализа, в котором для индикации конечной точки титрования используют диффузионный ток, наблюдаемый на ртутно-каломельном или вращающемся платиновом электроде.
Для амперометрического титрования SH-групп применяют прибор ПАТ (рис. 21). На его штативе закреплены электродвигатель 5 с редуктором, столик 1 для электролизера 2 с исследуемым раствором, каломельный электрод 3 и микробюретка 6 для рабочего раствора. Штатив имеет устройство для подъема и опускания вручную электролизера на определенную высоту (для погружения электродов).
Электродвигатель приводит во вращение мешалку 4, служащую электродом, с частотой вращения 800 мин-1. Она представляет собой стеклянную трубку, через которую пропущен провод, соединенный внизу с впаянной платиновой проволокой диаметром 0,5 мм. Наружный рабочий конец проволоки имеет длину 4—5 мм. Раствор перемешивается двумя небольшими симметрическими стеклянными «крылышками», расположенными на трубке.
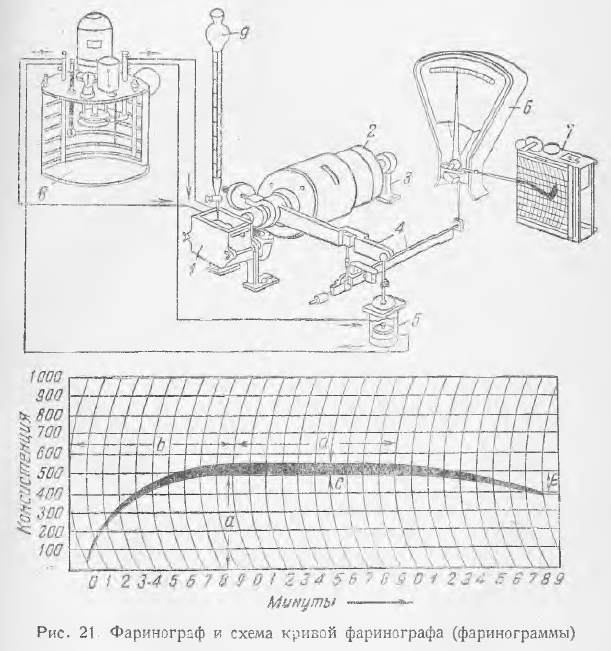
В качестве электрода сравнения служит каломельный электрод, соединенный с анализируемым раствором мостиком, заполненным насыщенным раствором хлорида калия.
Прибор снабжен блоком питания, работающим от батарейки на 4,3 В. Возникающий диффузионный ток регистрируется микроамперметром типа М 198/2. При амперометрическом титровании на приборе ПАТ испытуемый раствор помещают в электролизер, опускают в него электроды и титруют раствором нитрата серебра.
При приложении ЭДС в цепи устанавливается слабый ток — остаточный. От начала титрования испытуемого раствора до момента нейтрализации SH-групп ток — постоянный, так как ионы AgN03 связываются с испытуемым веществом. После нейтрализации, когда в растворе появится избыток ионов AgN03, сила тока резко возрастет пропорционально количеству добавляемого электролита. Титрование оканчивается при достижении линейной зависимости силы тока от количества прибавляемого AgN03.
Техника определения следующая. Навееску теста в количестве 1 г для определения SH-групп тщательно растирают в фарфоровой ступке в течение 2—3 мин до получения гомогенной суспензии с 30 мл модифицированной смеси Бенеша — Ларди — Бенеша следующего состава, мл: 1 М трис-буфер — 4; 1 М HN03 — 3,4; 1М КС1 — 0,3; 1 мг/мл ЭДТА — 0,3; салицилат натрия — 3,78 г; вода бидистиллят до общего объема — 30.
Приготовленную таким образом суспензию помещают в стаканчик вместимостью 50 мл и опускают в него вращающийся платиновый электрод, а также электрод сравнения. Электроды оставляют на 5 мин для установления равновесия в системе, после чего смесь титруют 0,001 М водным раствором AgN03, который добавляют-по 0,1 мл через каждую минуту. Диффузионный ток, возникающий при этом, фиксируют по показаниям микроамперметра, так как 1 мин необходима для реагирования AgN03 с SH-rpyn- пами и установления постоянной силы тока раствора. Титрование прекращают при достижении линейной зависимости между силой тока и прибавляемым количеством AgN03.
По результатам титрования на миллиметровой бумаге строят график, на котором наносят значение силы тока, как функцию добавляемого объема реактива, и определяют точку эквивалентности. Содержание SH-групп выражают в микроэквивалентах на 1 г белка исследуемого образца, исходя из расчета, что 1 мл 0,001 М AgN03 соответствует 1 мкэкв SH-групп. Содержание белка в пробе определяют по Кьельдалю.
Правильность количественного определения SH-rpynn в реакционной смеси этим методом проверяют титрованием раствора восстановленного глютатиона известной концентрации. Для этой цели используют водный раствор глютатиона, содержащий 1 мкэкв SH-групп в 1 мл раствора.
Приготовленную смесь титруют раствором 0,001 М AgN03. 1 мл раствора AgN03, пошедшего на титрование, соответствует 1 мкэкв SH-rpynn.
Дисульфидные связи определяют после их восстановления в SH-группы. Для этого в реакционную смесь Бенеша — Ларди — Бенеша дополнительно вводят 0,2 мл раствора сульфита натрия, насыщенного на холоду.
При необходимости определять все дисульфидные связи, включая «скрытые», недоступные для непосредственного восстановления сульфитом натрия, в смёсь вместо 3,78 г салицилата натрия вносят 12,6 г. мочевины. Под ее действием белковые молекулы «развертываются» и «скрытые» SS-связи поддаются восстановлению до SH- групп.
Для определения SS-связей 0,5 г теста растирают с 30 мл буферной смеси, содержащей сульфит натрия, и переносят в стаканчик прибора. Суспензию титруют, как при определении SH-групп в тесте.
Так как сульфит натрия восстанавливает дисульфидные связи по схеме
R-SS-R’ + SO3--→RSH- + R'-SSO3- ,
то 1 моль R—SS—R’ образует 1 моль RSH-.
Содержание дисульфидных связей рассчитывают как разность между содержанием SH-групп, оттитрованных после добавления сульфита натрия к буферной среде и до его добавления.
Для определения SH-групп и SS-связей в клейковине навеску сырой клейковины, отмытой по стандартной методике, встряхивают на холоду в течение суток с 50-кратным 12%-ным водным раствором салицилата натрия, затем дважды центрифугируют при частоте вращения 7000 мин-1. На определение SH-групп берут 5 мл полученного центри- фугата, а на определение SS-связей— 1 мл. При подготовке реакционной смеси учитывают содержание салицилата натрия, содержащееся в пробе салицилатного центрифу- гата клейковины, взятой на определение. Для определения SH-групп в клейковине в реакционную смесь добавляют 2,83 г салицилата натрия, а для определения SS-связей — 3,58 г. Дальнейшее определение производится аналогично тому, как это делается для теста.
Реактивы. 1. 1 М раствор триса (триоксиметиламино- метан). 2. Раствор ЭДТА 1 мг/мл (этилендиаминтетраацетат), трилон Б. 3. 12%-ный раствор салицилата натрия. 4. 1 Мраствор HN03. 5. 1 М раствор КС1. 6. 0,001 н. раст-вор глютатиона. 7. Насыщенный на холоду раствор сульфата натрия.
Все реактивы должны быть химически чистыми и свежеприготовленными.

