С помощью современных методов анализа (хромато-, спектро-, полярография и др.) установлено, что в создании специфического вкуса и аромата хлеба наиболее важная роль принадлежит летучим карбонильным соединениям (альдегидам, кетонам и др.).
Основными этапами анализа являются: выделение их из исследуемого продукта, разделение на составляющие компоненты с помощью химического или физико-химического метода, идентификация и количественное определение.
Описанные ниже методы выделения летучих карбонильных соединений из исследуемого продукта и определения их при помощи спектрофотометра модифицированы применительно к анализу продуктов хлебопекарного производства в КТИПП Л. М. Маркиановой, которой также проведено специальное редактирование настоящего раздела.
Выделение летучих карбонильных соединений из исследуемого продукта. Альдегиды и кетоны являются легколетучими активными соединениями, поэтому наиболее часто для их отделения от основной массы продукта применяют перегонку в вакууме, в токе инертного газа, центрифугирование или многократную экстракцию- системой растворителей. Иногда их отгоняют в глубоком вакууме при помощи испарителя.
Для их определения используются специфические реагенты на карбонильную группу, такие, как бисульфит натрия, 2,4-динитрофенилгидразин (2,4-ДНФГ), 2,4-динитрофенилсемикарбазид и др.
Для низкотемпературной дистилляции под вакуумом гомогенизируют 200 г теста, густой опары или закваски, мякиша или 100 г корки с 500 мл бидистиллированной воды при 3—4° С и взбалтывают 10 мин. Затем все переносят в колбу 1 вместимостью 3 л (рис. 29). При анализе жидких полуфабрикатов гомогенная смесь готовится из 500 г исследуемого продукта и 300 мл воды.
После загрузки колбу закрывают насадкой Клайзена 2 и ведут отгонку 1 ч при температуре водяной бани 40° С в грушевидные колбы, 3, содержащие по 10 мл предварительно отфильтрованного, насыщенного раствора 2,4-ДНФГ в 2 н. растворе соляной кислоты. Приемные колбы охлаждают льдом. Для конденсации паров имеется холодильник 4. Разрежение создается при помощи вакуум-насоса 5.
Для отгонки летучих карбонильных соединений в токе инертного газа пользуются установкой, показанной на рис. 30.
Подготовка полуфабрикатов и хлеба для анализа ведется так же, как и при использовании вакуумной дистилляции. Гомогенизированную массу помещают в колбу 1 и ведут отгонку в токе аргона 1,5 ч в реакционные склянки Дрекселя 2 и 3, содержащие по 25 мл насыщенного раствора 2,4-ДНФГ в 2 н. растворе соляной кислоты, который охлаждается льдом. Температуру водяной бани поддерживают в пределах 40—45° С, вакуум создают водоструйным насосом.
При любом способе выделения 2,4-ДНФГ избирательно извлекает альдегиды и кетоны из общей смеси отгоняемых летучих веществ и превращает их в гидразоны, которые являются устойчивыми, легко кристаллизирующимися соединениями, трудно растворимыми в воде. Собранные отгоны оставляют в холодильнике на 12—15 ч для полного связывания альдегидов и кетонов в гидразоны.
Спектрофотометрический метод определения суммы летучих карбонильных соединений в хлебе. Для определения общей суммы летучих карбонильных соединений спектрофотометрическим методом образовавшиеся гидразоны фильтруют через предварительно высушенный и взвешенный фильтр, тщательно промывают раствором 2 н. соляной кислоты, затем водой до нейтральной среды, сушат в электрошкафу при температуре 50° С до постоянной массы и взвешиванием находят массу образовавшихся гидразонов.
Количество 2,4-ДНФГ, пошедшего на реакцию с карбонильными соединениями, определяют на спектрофотометре по оптической плотности насыщенного солянокислого раствора 2,4-ДНФГи фильтрата после отделения гидразонов. Спектрофотометрирование ведут при длине волны 320 нм (максимум поглощения солянокислого раствора 2,4-ДНФГ).
Зная оптическую плотность растворов, количество гидразонов находят по калибровочной кривой, и по разности содержания гидразонов в насыщенном растворе и фильтра- теопределяют количество 2,4-ДНФГ, в гаммах, пошедшего на реакцию с карбонильными соединениями.
Содержание карбонильных соединений X, мг на 100 г СВ продуктов, вычисляют по формуле
Х=(А — В) 100•100/[1000Р(100— W)],
где А и В — масса соответственно образовавшихся гидразонов и 2,4-ДНФГ, пошедшего на реакцию, в гаммах; 1000 — пересчет гаммов в миллиграммы; Р — масса вещества, взятого на отгонку, мг; W — влажность исследуемого вещества, %.
Для построения калибровочной кривой готовят растворы 2,4-ДНФГ различной концентрации в 2 н. соляной кислоте, мкг на 25 мл раствора. Учитывая чувствительность спектрофотометрического метода, берут 0,2 мл исследуемого раствора, разбавляют его до 10 мл 2 н. соляной кислотой, а затем — до 25 мл водой и фотометрируют. По оси абсцисс откладывают концентрацию 2,4-ДНФГ, в гаммах, по оси ординат — оптическую плотность Е.
По данным Л. А. Боровиковой, ошибка определения суммы летучих карбонильных соединений спектрофотометрическим методом составляет 0,2—0,3%.
Разделение гидразонов на группы. Навеску гидразонов (40—50 мг) обрабатывают бензолом и десятикратным объемом изооктана, нагретого до 70° С. Смесь помещают на сутки в холодильник, после чего фильтруют. Гидразоны ароматических соединений и фурфурол выпадают в осадок красно-коричневого цвета. В растворе остаются гидразоны алифатических карбонильных соединений.
Для более полного разделения гидразонов надосадочную жидкость сливают на фильтр. Осадок четыре-пять раз заливают растворителями до тех пор, тока стекающий фильтрат не станет бесцветным, и переносят его на высушенный и взвешенный фильтр. Фильтрат упаривают под вытяжкой. После испарения бензола и изооктана остается осадок гидразонов алифатических карбонильных соединений желтого цвета.
Разделение, идентификация и количественное определение алифатических карбонильных соединений регенерационной газожидкостной хроматографией (методика Л. А. Боровиковой). Сущность этого метода заключается в разделении свободных карбонильных соединений на газовом хроматографе.
Ход определения следующий. На аналитических весах отвешивают 1—2 мг гидразонов. К навеске добавляют 5—6 мг α-кетоглутаровой кислоты, 5 мг целита-545 (для увеличения сыпучести смеси) и 5 мг бикарбоната натрия (при нагревании бикарбоната образуется углекислый газ, который способствует улетучиванию регенерированных карбонильных соединений).
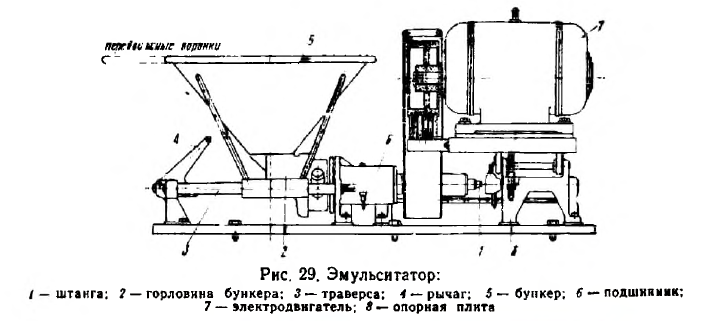
Смесь тщательно перемешивают в тигле и переносят в реакционный сосуд с удлиненной трубкой 11 специального устройства для регенерации (рис. 31), которое снабжено уплотнительным корпусом 2.
Реакционный сосуд представляет собой круглодонную стеклянную колбочку из тугоплавкого стекла (диаметром 12— 14 мм) с отводом в виде трубки (длиной 70-80 и наружным диаметром 5—6мм). Трубка изогнута под углом 100—110°, конец ее открыт.
Корпус устройства 2 изготовлен из стали или латуни в виде цилиндра, внутренние стенки которого покрыты тефлоновой прокладкой 6. С одной стороны к корпусу крепится игла 9 шайбой 8 и накидной гайкой 7. Игла — съемная, любого размера, легко заменяется в случае ее загрязнения. С другой стороны к корпусу присоединяется реакционная трубка 5, которая вставляется через отверстие ff гайке 1 и туго затягивается этой гайкой. Герметичность достигается шайбой 5 и толстой у плотните ль ной резин кой 4 (кусочек вакуумного шланга).
Выход из трубки реакционного сосуда закрывают стекловатой с целью улавливания твердых частиц сгорания и предохранения иглы от засорения. Реакционный сосуд открытым концом вставляют в корпус устройства для регенерации,а расширенную часть его опускают в предварительно нагретый до 250° С сплав Вуда 10. Регенерацию ведут 30 с. Регенерированные карбонильные соединения поступают в хроматограф ЛХМ-7А с пламенно-ионизационным детектором.
В хроматографе используют колонку из нержавеющей стали длиной 2 м и внутренним диаметром 4 мм. Твердым носителем служит хромосорб W, жидкой фазой —ββ1- оксидипропионитрил в количестве 15% к массе носителя. Газ-носитель — азот, скорость движения которого 20 мл/мин.
Разделение карбонильных соединений алифатического ряда проводят при следующих температурах: термостата колонок — 50, термостата детектора — 100, испарителя —150°С.
Идентифицируют карбонильные соединения по времени удерживания в сравнении со свидетелями. Время удерживания отдельных соединений обычно берут по отношению к времени удерживания уксусного альдегида, которое составляет 4,5 мин. Относительное время удерживания карбонильных соединений по сравнению с уксусным альдегидом, полученное Л. А. Боровиковой на хроматографе ЛХМ-7А, приведено ниже.

Количественное содержание отдельных компонентов определяют методом нормализации, который основан на том, что сумма площадей всех пиков на хроматограмме принимается за 100%, а площадь каждого пика составляет определенную часть суммы всех площадей. Зная суммарное количество алифатических карбонильных соеди. нений, вычисляют содержание отдельных компонентов смеси.
Разделение, идентификация и количественное определение ароматических карбонильных соединений методом восходящей хроматографии на бумаге. Ароматические карбонильные соединения нельзя разделить методом газожидкостной хроматографии, так как не решен вопрос регенерации их из 2,4-динитрофенилгидразонсв. Поэтому разделение и идентификация этих соединений проводится методом хроматографии на бумаге.
Ход определения следующий. Красно-коричневый осадок гидразонов взвешивают и растворяют в 3 мл этилацетата. В микропипетку набирают 200—300 мкл раствора и наносят его на хроматографическую бумагу «быстрая FN-12» или «быстрая Л-4» в виде штриха длиной 1—1,5 и шириной 0,3—0,5 см. Промежутки между штрихами должны быть 3—4 см.
Для идентификации веществ параллельно с исследуемым раствором наносят модельную смесь гидразонов-свидетелей. Для этого используют 2,4-ДНФГ ацетона, фурфурола, уксусного, пропионового, изомасляного и изовалерианового альдегидов, которые получают в результате взаимодействия химически чистых альдегидов и кетонов с насыщенным раствором 2,4-ДНФГ в2н. соляной кислоте.
Во время нанесения пятна подсушивают теплым воздухом.
Учитывая гидрофобные свойства гидразонов, хроматографическую бумагу обрабатывают по методу В. Л. Пикаевой уксусным ангидридом, затем подсушивают 30—40мин. после чего обрабатывают 5%-ным раствором н-октилового спирта в метаноле и снова сушат при комнатной температуре 10—12 ч для полного удаления метанола. При обработке бумаги линию старта оставляют сухой.
В качестве подвижной фазы служит смесь растворителей — гексан : толуол : уксусная кислота в соотношении 0:1:3, которую помещают в хроматографическую колонку в количестве 300 мл.
Разделение гидразонов производят 9—10 ч при 20-22° С. С целью получения компактных пятен разгонку повторяют 4-6 раз. При разгонке гидразоны разделяются в виде желтых пятен в следующей последовательности вверх от линии старта: оксибензальдегид, фенилуксусный альдегид, бензальдегид, фурфурол.
Для количественного определения веществ, разделенных хроматографией, полученные на бумаге пятна вырезают, измельчают, помещают в пробирку и заливают 5 мл 80%-ного этанола для элюирования содержащихся на них веществ. Пробирку закрывают пробкой и оставляют на 4— 5 ч. Через каждые 30 мин ее встряхивают. По окончании элюирования содержимое пробирок фильтруют через стеклянный фильтр с применением вакуума.
Окрашенную жидкость вливают в кювету и измеряют оптическую плотность раствора фотоэлектроколориметром ФЭК-М со светофильтром № 3 (длина волны для максимума светопропускания 500 нм).
Для гидразонов-свидетелей строят калибровочные кривые. С этой целью готовят растворы разной точной концентрации. Хроматографируют их при тех же условиях, что и исследуемый раствор и определяют их оптическую плотность. На оси абсцисс откладывают концентрацию, миллиграмм на 5 мл, по оси ординат — оптическую плотность.
С помощью этих кривых устанавливают концентрацию веществ в элюате.
Определение ароматного числа хлеба. Для сравнения интенсивности аромата различных веществ, содержащихся в продукте, И. Г. Мохначевым и М. П. Кузьминым' предложен показатель «ароматное число» Он представляет собой отношение концентрации пахучего вещества к его порогу чувствительности. Это безразмерное число и выражается в тысячах единиц.
Порог чувствительности разных веществ определяется экспериментально методом дегустации. Для этого готовят водные растворы чистых карбонильных соединений с возрастающей от нуля концентрацией. Максимальная концентрация должна значительно превышать порог чувствительности. Образцы для дегустации разливают в одинаковые емкости с притертой пробкой.
Методом треугольника из большого числа дегустаторов выбирают несколько, обладающих наибольшей чувствительностью. Они и определяют, при какой наименьшей концентрации ощущается запах того или иного вещества. Порогом чувствительности считают концентрацию, которую ощутили 2/3 дегустаторов из общего количества.
Ароматное число А, тыс. ед., вычисляют по формуле
А = К/(П •1000),
где К — концентрация данного вещества в продукте, мг на 100 г СВ; П — порог чувствительности, %.
Например, в мякише исследуемого хлеба содержание масляного альдегида составляет 0,08, а уксусного альдегида— 0,30 мг на 100 г СВ. Порог чувствительности масляного альдегида Ам.а составляет 1·10 9%, уксусного Ау.а 6 • 10-7%. Тогда
Ам.а = 0,08/(1 • 10-9· 1000) = 80000;
Ау.а = 0,31/(6 · 10-7 · 1000) = 500.
Следовательно, несмотря на значительно большее содержание уксусного альдегида, влияние его на аромат хлеба значительно ниже, чем масляного.
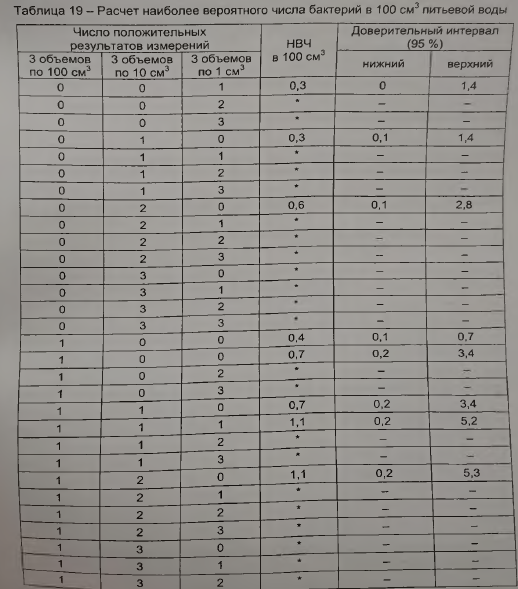
Порог чувствительности и ароматное число карбонильных соединений в хлебе из пшеничной муки II сорта, по данным Л. А. Боровиковой, приведены в табл. 19.