При экспрессии чужеродных генов в геноме растений возникает ряд проблем.
Первые гены, которые использовались для трансформации растений, были выделены из бактерий, и их нельзя было напрямую использовать для трансформации растительных клеток. Для того чтобы бактериальные гены транскрибировались в эукариотической клетке, необходимо заменить их исходные бактериальные промоторные последовательности либо на промоторы растительных генов, либо на другие, которые могут инициировать транскрипцию в растительной клетке. Кроме того, необходимо присоединить к З'-последовательности бактериального гена фрагмент, содержащий сигнал полиаденилирования. Такие модификации необходимы для того, чтобы эукариотическая РНК-полимераза могла транскрибировать бактериальную последовательность и затем мРНК транслировала бактериальный белок в растительной клетке.
В качестве промотора для экспрессии бактериальных генов наиболее часто используют промотор 35S-PHK вируса мозаики цветной капусты (CaMV). Такой выбор решает сразу две проблемы: во-первых, промоторы двудольных могут в ряде случаев не работать в геноме однодольных, и наоборот, а промотор 35S CaMV обеспечивает транскрипцию в любых геномах растений. Во-вторых, большинство эукариотических промоторов являются довольно слабыми, a 35S-промотор CaMV обеспечивает очень высокий уровень экспрессии гена, находящегося под его контролем. В ряде случаев при трансформации растительной клетки растительным геном все равно заменяют его собственный промотор на промотор 35S CaMV как более сильный, чтобы повысить выход белкового продукта.
Промотор 35S CaMV является конститутивным, что обеспечивает постоянную, сильную экспрессию гена, который находится под его регуляцией, во всех тканях трансгенного растения. Именно поэтому промотор 35S CaMV является самым используемым в векторных конструкциях для трансформации растений. В последнее время иногда используют искусственно полученный МАС-промотор, который представляет собой удвоенную последовательность 35S CaMV.
В последнее время все большее значение приобретают тканеспецифичные промоторы растительных генов. Их преимущество перед промотором 35S CaMV состоит в том, что гены под их контролем экспрессируются только в определенных тканях. Так, любой ген, контролируемый пататиновым промотором, будет экспрессироваться только в клубнях, так как белок пататин – это запасной белок клубней картофеля, и его гены экспрессируются только в клубнях. Тканеспецифичные промоторы используют в случае, когда чужеродный белок необходим в определенных органах растения. Например, в случае защиты от каких-либо почвенных патогенов удобно использовать корнеспецифичные промоторы, что приводило бы к синтезу защитного белка только в подземных частях растений в местах контакта с патогенами. Использование таких промоторов для растения является более приемлемым.
Также используют так называемые индуцибельные промоторы. В отличие от конститутивного промотора 35S CaMV гены под такими промоторами экспрессируются не постоянно, а только в определенных условиях. Например, промоторы, которые индуцируются поранением, металл-индуцибельные – в присутствии ионов металлов (меди, железа и т. п.). Таким образом, «включение – выключение» гена под контролем таких промоторов легко регулируется. Индуцибельные промоторы все чаще используются в генетической инженерии, и не только растений. Недостатком многих тканеспецифичных и индуцибельных промоторов является их слабая активность.
Помимо промотора на экспрессию трансгена влияет также место интеграции в растительный геном. И хотя считается, что последовательность Т-Д НК может встраиваться в геном в любом месте, однако в ряде работ показано, что это происходит не случайным образом. Очень часто Т-ДНК встраивается в гетерохроматиновые участки, где экспрессии гена не происходит, и трансген под любым даже сильным промотором транскрибироваться не будет. Ситуацию можно преодолеть только повторными трансформациями.
Для выявления экспрессии чужеродных генов на ранних стадиях получения трансгенных растений используют маркеры экспрессии – репортерные гены. Продукты генов-репортеров обычно легко детектируются с помощью простых методов. Наиболее широко используемый репортерный ген GUS кодирует фермент β-глюкуронидазу и при добавлении субстрата расщепляет его с получением соединения, окрашенного в ярко-голубой цвет. Другой репортерный ген gfp при экспрессии образует флуоресцирующий белок, который также легко детектируется. Обычно экспрессия репортерного гена коррелирует с уровнем экспрессии функционального гена в трансгенном растении.
2.8. ПОВЫШЕНИЕ ПРОДУКТИВНОСТИ РАСТЕНИЙ
И УЛУЧШЕНИЕ ИХ КАЧЕСТВА МЕТОДАМИ ГЕННОЙ ИНЖЕНЕРИИ
Одной из основных задач улучшения растений является повышение качества синтезируемых продуктов: белков, жиров, полисахаридов и других веществ, определяющих их питательную и техническую ценность.
У злаков наибольший интерес представляют запасные белки эндосперма. Запасные белки в основном кодируются несколькими, сходными по своей структуре и по нуклеотидному составу, генами, объединяемыми в мультигенные семейства. Обычно экспрессия этих генов строго тканеспецифична и происходит на определенной стадии развития семени. В большинстве случаев запасные белки растений имеют несбалансированный для питания человека и животных аминокислотный состав. Так, запасные белки бобовых – легумины – характеризуются низким уровнем аминокислоты метионина, а запасные белки злаков – проламины – бедны лизином, триптофаном и треонином. Дефицит этих аминокислот снижает питательную и кормовую ценность семян.
Улучшение аминокислотного состава белка методами традиционной селекции довольно затруднительно в связи с тем, что гены, определяющие эти важные сельскохозяйственные признаки, часто бывают сцеплены и наследуются вместе с генами, вызывающими нежелательные признаки. Так, использование в селекции кукурузы и ячменя мутантов типа опак-2, хайпроли, имеющих относительно высокое содержание лизина в зерне, не привело к значительному улучшению качества, так как у мутантных форм повышенное содержание лизина коррелировало с уменьшением синтеза основных запасных белков зеина и гордеина и, в конечном итоге, с уменьшением продуктивности растений и урожайности посевов.
В связи с этим наиболее перспективным является использование генно-инженерных методов при создании новых сортов, что позволяет ввести в геном только полезный признак, без сцепления с отрицательными свойствами. Так, например, введение дополнительных кодонов лизина в гены проламинов может привести к синтезу белков, обогащенных лизином, и улучшению кормовой и питательной ценности белка.
Технология генно-инженерного улучшения качества растений и получаемой из них продукции включает ряд этапов:
1) клонирование генов запасных белков;
2) изучение механизмов тканеспецифичной и временной экспрессии белков и определение последовательностей ДНК, определяющих и регулирующих такую специфическую экспрессию;
3) целенаправленное изменение последовательности генов запасных белков с целью улучшения аминокислотного состава;
4) создание векторов, содержащих измененный ген;
5) введение модифицированных генов в растения;
6) тестирование экспрессии генов и качества продукции.
Получение трансгенных растений с улучшенными качествами зерна невозможно без подготовительного этапа, включающего детальное изучение как последовательности самого гена, так и его элементов, участвующих в регуляции синтеза белка.
Учеными уже охарактеризованы десятки генов запасных белков злаков, бобовых и ряда других растений, изучены структура и регуляция экспрессии генов. Исследователи уже клонировали 10 генов гордеинов ячменя, гены α - и β-глиадинов и глютенина пшеницы, зеинов кукурузы, легуминов бобовых, пататина картофеля и др. Для некоторых генов определена их нуклеотидная последовательность.
Общий план изолирования генов запасных белков включает следующие этапы: 1) получение и частичная очистка соответствующей мРНК; 2) синтез и клонирование кДНК; 3) выделение из геномных библиотек последовательности гена запасного белка.
Синтез запасных белков имеет жесткую регуляцию: гены экспрессируются только в единственной ткани (проламины злаков только в эндосперме зерна) и в течение короткого периода развития зерна. Исследование генов запасных белков показало общность их строения, что представляется логичным, так как они выполняют одинаковую функцию. Так, общим для подавляющего большинства генов запасных белков является отсутствие интронов. Кроме этого, у них на расстоянии 300 н. п. отточки начала транскрипции расположена специфическая последовательность в 25 н. п., названная эндосперм-боксом. Была определена функция эндосперм-бокса и показано, что именно от присутствия этой 25-нуклеотидной последовательности зависит тканеспецифичная экспрессия генов запасных белков в эндосперме зерна. Более того, продукт любого гена, перед которым находится последовательность эндосперм-бокса, синтезируется только в семенах или зернах, и представлялось логичным включение ее в состав векторов, содержащих модифицированную последовательность генов проламиновых белков с целью их последующего депонирования в семенах или зернах.
Следующий этап в получении трансгенных растений с улучшенным аминокислотным составом белка можно представить на примере модифицированного α-зеина. Белок α-зеина кукурузы характеризуется низким содержанием лизина, что значительно снижает его питательную ценность. В последовательность гена α-зеина при помощи олигонуклеотид-направленного мутагенеза вводили дополнительные кодоны лизина. Полученный модифицированный ген α-зеина экспрессировал белок, содержащий лизин. Впервые такая работа была проведена по введению новых кодонов в последовательность α-зеина. Теперь такое введение новых триплетов для изменения (улучшения) аминокислотного состава белков является обычным.
Модифицированный ген α-зеина был клонирован в область Т-ДНК вектора для трансформации. В состав конструкции также входила последовательность эндосперм-бокса, что приводило к тканеспецифичной экспрессии α-зеина в семенах. Были получены растения кукурузы, трансформированные геном модифицированного α-зеина, обогащенного лизином (рис. 2.5). Модифицированный белок активно синтезировался в семенах трансгенных растений кукурузы. В результате получены линии кукурузы с улучшенным качеством зерна. В дальнейшем такие трансгенные линии могут использоваться для выведения новых гибридов и сортов методами классической селекции.
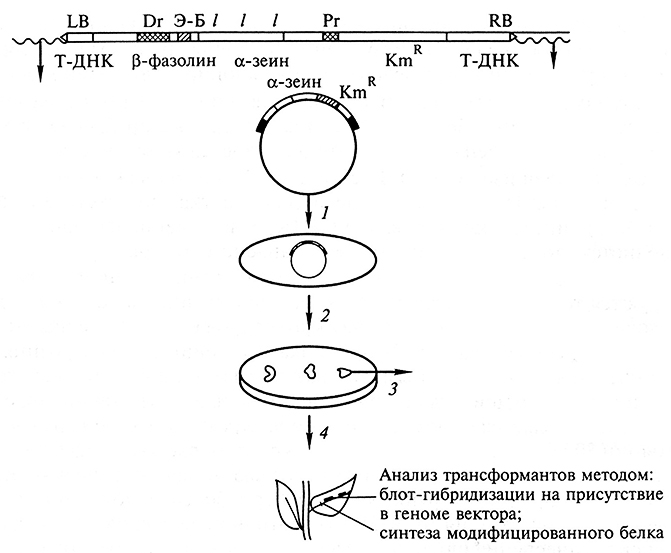
Рис. 2.5. Схема получения трансгенного растения табака
с интегрированным геном α -зеина, обогащенного лизиновыми кодонами:
1 – трансформация агробакгерии; 2 – трансформация растительных клеток;
3 – селекция на среде с антибиотиком канамицином; 4 – регенерация
Аналогично были получены трансгенные растения пшеницы. Введение в геном растения модифицированного гена высокомолекулярной субъединицы белка глютенина с измененной последовательностью приводит к активному синтезу модифицированного белка и влияет на состав и уровень соответствующих запасных белков, что приводит к улучшению хлебопекарного качества пшеничной муки.
Одним из новых подходов к улучшению состава белков является конструирование химерных генов на основе известной последовательности генов запасных белков одно- и двудольных. В качестве исходных были использованы гены гордеина В1 ячменя и легумина В4 бобов. Конструкцией, содержащей такой химерный ген, были трансформированы растения табака и получены трансгенные линии растений.
Таким образом, реальной становится возможность манипулирования белковым составом эндосперма зерновых методами генетической инженерии.
Помимо получения растений с измененными запасными белками было показано, что трансгенные растения могут быть использованы в качестве производителей «съедобных» вакцин. Так, получены растения табака и картофеля, синтезирующие иммуноглобулин А – G, энтеротоксин, В-токсин холеры, белок поверхностного антигена гепатита В. Белок, полученный из трансгенных растений, обладал такими же антигенными и физиологическими свойствами, как и белок, полученный из животных клеток. В настоящее время проводятся испытания по вакцинированию человека против гепатита В при помощи трансгенных растений. Из этого следует, что использование трансгенных растений может привести в будущем к получению дешевых и биологически высокоактивных вакцин.
Помимо получения трансгенных растений с модифицированными запасными белками зерновых и бобовых проводятся работы по улучшению состава жирных кислот ряда масличных культур, и в первую очередь рапса. Семена рапса характеризуются высоким содержанием масла, однако из-за большого количества в нем специфической длинноцепочечной эруковой кислоты, а также глюкозинолатов вкусовые и питательные качества рапсового масла резко снижаются. С помощью генетической инженерии и последующей селекции были получены сорта рапса, содержащие гены, контролирующие длину молекулы жирных кислот, что привело к снижению доли эруковой кислоты и улучшению качества рапсового масла. Аналогичные работы ведутся по получению модифицированных жирных кислот с повышенным содержанием ненасыщенных связей, что позволит получать растения, синтезирующие новые ценные жирные кислоты. Кроме того, в последнее время было показано, что изменение состава жирных кислот может приводить к повышению устойчивости растений кряду насекомых, а также к действию пониженных температур.
К 2001 г. уже прошли полевые испытания сорта трансгенных растений сои, рапса и кукурузы с модифицированным составом жирных кислот.
Одним из приоритетных направлений в селекции является повышение урожайности новых сортов. Генно-инженерные разработки активно ведутся в следующих направлениях: увеличение фотосинтетической активности и увеличение синтеза отдельных веществ.
Работы по увеличению фотосинтетической активности проводятся в направлении введения генов С4 фотосинтеза в С3-растения. Ген фосфоенолпируваткарбоксилазы (РЕРС) фотосинтетической системы кукурузы С4, кодирующий основной фермент, участвующий в фиксации атмосферного СО2 в клетках мезофилла листа, был клонирован и перенесен методом агробактериальной трансформации в С3-растения риса. Анализ полученных трансгенных растений показал, что активность фермента в клетках риса в 2–3 раза выше, чем у кукурузы, что привело к увеличению фотосинтетической активности и урожайности.
Кроме клонирования и использования генов, непосредственно участвующих в процессах фотосинтеза, были идентифицированы гены, контролирующие количество хлоропластов в клетке. Использование таких генов также приводит к изменению уровня фотосинтеза. Другой подход основан на увеличении содержания хлорофилла в каждом хлоропласте. Были получены модифицированные белки, специфически связывающие хлорофилл а/Ь, и было показано, что повышенная экспрессия таких белков в трансгенных растениях приводит к значительному увеличению биомассы.
Другое направление проводимых работ касается возможностей изменения метаболизма у трансгенных растений. Введение гена сахарозофосфатсинтетазы кукурузы (SPS-гена), являющегося ключевым ферментом в регуляции углеводного метаболизма, в геном других растений приводило к изменению углеводного обмена и повышению продуктивности растений. В настоящее время получены такие трансгенные растения томата, картофеля, рапса, хлопчатника.
В 1999–2000 гг. в США, Канаде и ряде других стран, где разрешено использование трансгенных растений, уже прошли полевые испытания и используются в сельскохозяйственном производстве семь трансгенных сортов кукурузы и один сорт пшеницы, трансформированные различными генами, повышающими урожайность и качество полученной продукции.
Помимо трансформации генами, приводящими к улучшению качества и повышенной продуктивности растений, в 1998–2001 гг. были получены первые четыре коммерческих сорта трансгенных цветов: сорт гвоздики с геном АСС-синтетазы, вызывающим ускоренное цветение, и три сорта (две – гвоздики и один – хризантемы) – с измененными генами биосинтеза антоциана, что привело к нетрадиционной окраске лепестков венчика. Также получены сорта петуньи и львиного зева, трансформированные конструкциями, содержащими мобильные элементы.
2.9. ПОЛУЧЕНИЕ ТРАНСГЕННЫХ РАСТЕНИЙ,
УСТОЙЧИВЫХ К СТРЕССОВЫМ ВОЗДЕЙСТВИЯМ
Экстремальное влияние окружающей среды, такое как засуха, избыточное увлажнение, воздействие высоких или низких температур, засоление и кислотность почв приводит к значительным потерям сельскохозяйственной продукции. Поэтому использование сортов растений, толерантных к стрессовым воздействиям, имеет большое экономическое значение.
Многие из адаптивных реакций растений на стресс обусловливаются синхронным взаимодействием множества генов. Поэтому более доступными для генно-инженерных исследований оказываются биохимические процессы, непосредственно индуцировавшиеся фактором стресса. Так, известно, что в растениях, подвергающихся длительному водному стрессу, накапливается ряд органических низкомолекулярных соединений, таких, как пролин, глицинбетаин, и ряд других, которые служат осморегуляторами или осмопротекторами.
Было показано сходство стрессового ответа у бактерий и высших растений: в обоих случаях в клетках происходит синтез молекул осмопротекторов, механизмом действия которых является установление осмотического баланса между цитоплазмой и окружающей средой и, кроме того, частичная стабилизация белков при стрессовых условиях. Сходные биохимические пути синтеза молекул осмопротекторов позволили использовать гены бактериального происхождения для получения трансгенных растений, устойчивых к стрессам.
Из генома Е. coli были выделены два гена proBosm и proА, кодирующие ферменты пути биосинтеза пролина, аккумулирование которого в клетке происходит в ответ на осмотический стресс. Экспрессия этих бактериальных генов в геноме растений приводила к повышенному синтезу пролина. Полученные трансгенные растения табака осуществляли повышенный синтез и накопление пролина по сравнению с контрольными растениями. Трансгенные побеги укоренялись и могли расти при концентрации соли в среде 20 г/л (350 мМ).
Был выделен ген бетаинальдегиддегидрогеназы (BADH), который катализирует синтез глицинбетаина. Трансгенные растения табака, экспрессирующие этот ген, обладали повышенной солеустойчивостью.
Было показано, что устойчивость к высоким температурам связана с геном Fad7, белок которого влияет на метаболизм жирных кислот. Инактивация такого гена в трансгенных растениях риса привела к тому, что растения могли расти при повышенных температурах и выдерживать до двух часов при + 47 °С.
Полевые испытания сорта трансгенных газонных трав на засухоустойчивость и устойчивость к засолению проходят с тем, чтобы в дальнейшем их можно было использовать в больших городах с характерным абиотическим фоном.
2.10. ПОЛУЧЕНИЕ ТРАНСГЕННЫХ РАСТЕНИЙ,
УСТОЙЧИВЫХ К НАСЕКОМЫМ
Используя генно-инженерные методы, возможно конструирование растений с повышенной резистентностью к атаке насекомыми. Так, было показано, что бактерии Bacillus thuringiensis экспрессируют инсектицидный белок-прототоксин, который, попадая в кишечник насекомых, расщепляется под действием протеаздо активного токсина, приводящего к гибели вредителей.
Препараты на основе этого токсина использовались для обработки растений в поле. Полученные препараты были нестойкими и довольно быстро разлагались, что не позволяло развить у вредителей устойчивость к инсектициду, в то время как продукция таких белков в растительных клетках могла обеспечивать устойчивую резистентность растений к насекомым.
Из генома В. thuringiensis был выделен ген токсина bt2 и поставлен под контроль промотора 35S CaMV. bt-ген был интегрирован в геном растений табака методом агробактериальной трансформации. Экспрессия бактериального bt2-гена в растительных клетках была подтверждена как на уровне транскрипции, по присутствию соответствующей мРНК, так и на уровне трансляции, по синтезу белка-токсина. Полученные трансгенные растения табака были устойчивы к вредителям. Эффективность защиты сельскохозяйственных культур от вредителей была показана и на трансгенных растениях томата, трансформированных генами эндотоксина, при этом бактериальный белок, синтезированный в тканях растений, обеспечивал защитный эффект, сравнимый с использованием инсектицидных препаратов.
Помимо табака и томата бактериальный bt2-ген был введен в геном многих сельскохозяйственных растений, в том числе в картофель, кукурузу, хлопчатник, рис, сою, брокколи и др. Для ряда культур получены сорта трансгенных растений, экспрессирующих в своем геноме bt2-ген. Так, в 1994–1995 гг. были получены и прошли полевые испытания сорта томата, картофеля и хлопчатника (фирма «Monsanto»), кукурузы как кормовой, так и пищевой сахарной (фирма «Novartis»), а в 1998 г. был получен сорт картофеля с тройной устойчивостью, который помимо bt2-гена, содержал ген устойчивости к вирусу скручивания листьев и ген устойчивости к гербициду глифосату. В 2000 г. в странах с разрешенным использованием генетически модифицированных продуктов сортами трансгенных растений, устойчивых к насекомым, были засеяны около 380 тыс. га, из них: 230 тыс. га – трансгенным хлопчатником, 144 тыс. га – трансгенной кукурузой, 5 тыс. га – трансгенным картофелем.
Использование трансгенных растений привело к резкому сокращению применения инсектицидов и повышению урожайности.
2.11. ПОЛУЧЕНИЕ ТРАНСГЕННЫХ РАСТЕНИЙ,
УСТОЙЧИВЫХ К ГРИБНОЙ, БАКТЕРИАЛЬНОЙ
И ВИРУСНОЙ ИНФЕКЦИИ
При действии фитопатогенов в растениях включается каскад механизмов защитных реакций. При этом активные ответные реакции в растениях могут проходить по двум основным направлениям: во-первых, в ответ на инфекцию начинается синтез соединений, являющихся токсичными и ограничивающих жизнедеятельность патогенов, что в конечном итоге приводит к их гибели. Во-вторых, в качестве защитного ответа могут создаваться структурные барьеры, которые предотвращают повреждение растений и распространение патогенов, что достигается лигнификацией клеточных стенок растений либо укреплением клеточных стенок за счет гликопротеидов, богатых гидроксипролином, и других соединений, так называемых экстенсинов, что приводит к защите тканей от повреждения фитопатогенами.
В ответ на инфицирование вирусами, бактериями и грибами индуцируются специфические PR-белки (pathogenesis related proteins), в том числе и наиболее изученные хитиназы и β-1,3-глюканазы. Эти ферменты ингибируют рост грибов, а также некоторых видов бактерий.
Экспериментально был доказан фунгицидный эффект белков хитиназ и глюканаз, а также их кодирование одиночными генами. Поэтому гены хитиназы и глюканазы были использованы в генно-инженерных работах по получению трансгенных растений, устойчивых к фитопатогенам. Были получены трансгенные растения табака, хлопка, кукурузы, рапса, томата, риса, картофеля, люцерны, турнепса и других, экспрессирующих ген хитиназы под контролем промотора 35S CaMV. У этих растений наблюдалась устойчивость к грибной инфекции. В настоящее время получены трансгенные сорта табака, рапса, томатов, картофеля с повышенной устойчивостью к Rhizoctonia, растения табака – к Cercospora nicotiana.
Другую группу соединений, также обладающих фунгицидным эффектом, представляют низкомолекулярные белки (40–50 кДа), к которым относятся цистеиновые белки растений, ингибиторы галактуроназ, растительные дефензины, группа MF-белков. Все эти белки обычно неспецифически повышают устойчивость растений к различным грибным и бактериальным инфекциям. Трансгенные растения, экспрессирующие этот белок, обладают устойчивостью как к грибной, так и к вирусной инфекции.
В процессе изучения взаимоотношений вирус – растение было вовлечено большое число различных методов. Только их комбинирование могло принести результаты по получению растений, устойчивых к вирусной инфекции. За последние годы в этом направлении был сделан заметный рывок, что напрямую связано с более детальным пониманием организации генома и функционирования вирусных генов. В настоящее время для получения растений, устойчивых к вирусной инфекции, с помощью генно-инженерных технологий существует ряд подходов, позволяющих получить трансгенные растения, трансформированные геном белка оболочки вируса, что приводит к уменьшению инфицированности и ингибированию размножения вируса. Таким методом были получены растения табака и картофеля, трансформированные геном белка оболочки вируса табачной мозаики, что привело к появлению стойкого антивирусного эффекта у трансгенных растений.
В настоящее время получены линии табака, которые, помимо устойчивости к ВТМ, резистентны к вирусу тыквенной мозаики. Были также получены растения картофеля и кукурузы, устойчивые к вирусам скручивания листьев, и растения ячменя, резистентные к вирусу карликовости. Также получен и выращивается сорт тыквы, обладающий устойчивостью сразу к трем вирусам.
Еще одним подходом к получению устойчивых к патогенам растений является трансформация растительных клеток генами, кодирующими ферменты пути биосинтеза фитоалексинов, проявляющих фунгицидное и антимикробное действие. Трансформация этими генами растений томата и картофеля значительно повысила устойчивость к фитофторозу и фузариозу, а табака – к серой гнили.
В настоящее время получены четыре трансгенных коммерческих сорта картофеля, устойчивые к Y вирусу (PVY) и вирусам скручивания листьев (PLRV), сорт тыквы, устойчивый одновременно к трем различным вирусам, сорт папайи, устойчивый к круговому вирусу папайи (PRV).
2.12. ПОЛУЧЕНИЕ ТРАНСГЕННЫХ РАСТЕНИЙ,
УСТОЙЧИВЫХ К ГЕРБИЦИДАМ
Одним из основных направлений биотехнологии растений является получение культурных растений, устойчивых к воздействию гербицидов. Гербициды широкого спектра действия, уничтожая сорные травы, оказывают угнетающее действие и на посевы. Получение устойчивых к гербицидам растений ведется в двух направлениях: во-первых, прямая селекция устойчивых к гербицидам форм растений (в основном, путем скрещивания с дикими видами растений, устойчивых к гербицидам), во-вторых, получение трансгенных растений путем введения генов, экпрессия которых приводит к гербицид-резистентности. Теоретической основой получения трансгенных растений, устойчивых к гербицидам, являются данные о молекулярных механизмах возникновения устойчивости к гербицидам и выделения генов как бактериального, так и растительного происхождения, определяющих этот признак. Действие гербицидов проявляется в подавлении метаболизма растительных клеток: ингибировании биохимических процессов прежде всего фотосинтеза (атразин, симазин, диурон) и синтеза аминокислот (глифосат, сульфонилмочевина, биалафос). Устойчивость к гербициду возникает либо в результате изменения сродства гербицида с его ферментом-мишенью, либо непосредственно ингибированием молекулы гербицида.
Получение растений, устойчивых к гербицидам, методами генной инженерии прежде всего основывается на изучении молекулярных механизмов толерантности и включает следующие этапы: выявление мишеней действия гербицидов в клетке растений, отбор растений/бактерий, устойчивых к данному гербициду (в качестве источника генов резистентности), идентификация и клонирование этих генов, изучение их экспрессии для использования в трансгенных конструкциях.
Действие гербицида атразина основано на его связывании с хлоропластным мембранным белком (Qb), который кодируется геном pbcA. Ген pbcA был выделен из генома некоторых сорняков. Было показано, что устойчивость к гербициду связана с возникновением точечной мутации в гене pbcA, что приводит к замене в белке аминокислотного остатка серина на глицин. Такие замены в белке Qb приводят к резкому уменьшению связывания гербицида с ферментом-мишенью. В результате возникает устойчивость к гербициду. Мутантный ген pbcA был встроен в векторные конструкции для трансформации растений. Полученные трансгенные растения были устойчивы к атразину.
Аналогично было показано, что замена аланина на аргинин в белке EPSP-синтетазы, который кодируется геном aroA Е. coli, приводит к возникновению устойчивости к действию гербицида глифосата. Это было использовано для трансформации клеток табака, томатов, сахарной свеклы и картофеля мутантным геном аrоА и получения трансгенных растений, устойчивых к гербициду.
Введение в геном растений бактериального гена bar приводит к появлению устойчивости к гербициду BASTA. Было показано, что белок, кодируемый bar-геном, – фосфинотрицинацетилтрансфераза – ацетилирует активный компонент гербицида фосфинотрицин, что приводит к его инактивации. Получены сорта трансгенного риса (1995), сорго (1995), пшеницы (1994) и ряда других растений. В последнее время bar-ген стал использоваться и в качестве селективного маркера в генно-инженерных векторах.
Введение в геном риса гена, кодирующего фермент протопорфириногенсинтетазу (Protox), выделенного из бактерий В. subtilis, привело к повышению устойчивости трансгенных растений к гербицидам дифенил-эфирового ряда. При этом был показан механизм антигербицидного действия: повышенная экспрессия этого белка Protox нейтрализует действие гербицида, чем и обусловлено повышение устойчивости к нему. При этом была показана прямая зависимость между числом встроенных копий гена и уровнем устойчивости.
В настоящее время в странах Северной Америки и Европе разрешены к применению более 20 сортов трансгенных растений, устойчивых к гербицидам, таких важных сельскохозяйственных культур, как кукуруза, хлопок, рис, соя, пшеница, картофель, томаты, лен. Проходят полевые испытания трансгенные сорта клубники, сахарной свеклы и некоторых цветочных культур. Всего в мире трансгенными сортами и гибридами, устойчивыми к гербицидам, засеяно около 34 млн гектаров, или 80 % всех посевов трансгенных сортов.
В целом можно говорить о том, что получение трансгенных растений является одним из наиболее бурно развивающихся направлений биотехнологии. К февралю 2001 г. в странах с разрешенным использованием генетически модифицированных растений были проведены испытания и разрешены к коммерческому использованию 78 сортов трансгенных растений 18 возделываемых культур.
Быстрые темпы развития генной инженерии растений приводят к стремительному росту возделываемых площадей, занятых трансгенными растениями, с 1,6 млн га в 1996 г., когда началось их возделывание в коммерческих масштабах, до более 80 мл н га в 2005 г., что составило около 5 % всех пахотных площадей в мире. Интересно отметить, что 99 % всех этих площадей занимают четыре основные трансгенные культуры: соя, кукуруза, рапс и хлопок. В 2004 г. трансгенными были в США около 75 % хлопка и сои, в Китае – 53 % хлопка, в Аргентине – 99 % сои, в Канаде – 63 % рапса. В 2003 г. 75 % всех выращиваемых трансгенных растений содержали ген устойчивости к гербицидам, 21 % – ген устойчивости к вредителям и почти 8 % – более одного гена устойчивости.
2.13. ТРАНСГЕННЫЕ РАСТЕНИЯ –
ПРОДУЦЕНТЫ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
В последние десятилетия началась разработка векторных конструкций для получения трансгенных растений, активно экспрессирующих белки для медицинских целей, которые могли бы потребляться непосредственно в пищу либо для выделения из них белкового продукта с последующей его очисткой. Получение рекомбинантных белков в растениях имеет ряд значительных преимуществ:
- экспрессия терапевтически важных белков в растениях гораздо дешевле, чем в биореакторах с использованием культуры клеток млекопитающих;
- большая безопасность рекомбинантных белков, синтезированных в растениях, по сравнению с получением их в трансгенных животных, так как в растениях не развиваются патогенные для человека вирусы и бактерии и возможность заражения конечных продуктов минимальна;
- посттрансляционные изменения белков в растительных и животных клетках происходят одинаково, что приводит к образованию правильной третичной структуры, в то время как именно правильная упаковка эукариотической белковой молекулы является главной проблемой при синтезе ее в прокариотических бактериях;
- наработка терапевтически важных рекомбинантных белков в съедобных частях растения резко снижает конечную цену продукта из-за отсутствия проблем с очисткой.
Первые данные о возможности использования растений в качестве «фабрик» для производства лекарственных белков были получены в 1989 г., когда были созданы трансгенные растения табака, экспрессирующие иммуноглобулины IgG1. В настоящее время получены растения, синтезирующие различные белки для терапевтических целей, в том числе соматотропин (табак), который применяется в ветеринарии, антитела против вируса герпеса (табак, кукуруза, соя), интерфероны для лечения гепатита В и С (рис, турнепс), лактоферин (картофель), обладающий антимикробным действием, гирудин (рапс) и протеин С (табак), использующиеся для лечения тромбозов, и ряд других белков.
Отдельный интерес представляет получение трансгенных растений, продуцирующих иммунизирующие антигены с тем, чтобы получить съедобные вакцины. Впервые данные о съедобной вакцине были опубликованы в 1992 г., и это была вакцина против гепатита В, полученная в растениях сначала табака, а затем и картофеля. У мышей, в пищу которых добавлялся такой картофель, наблюдали развитие иммунного ответа против вируса гепатита. В 1999 г. была получена вакцина против вируса гепатита в результате трансформации растений люпина и салата-латука. В настоящее время уже созданы и прошли клинические испытания ряд вакцин на основе трансгенных растений, в том числе вакцина против гастроэнтерита (табак, картофель), вируса кори (латук), холерного вибриона (картофель), цитомелаговируса (картофель, табак), вируса папилломы (картофель). В подавляющем большинстве случаев при поедании съедобных трансгенных растений, экспрессирующих эти белки, развивался специфический иммунный ответ. Получение новых съедобных растительных вакцин является одним из наиболее перспективных направлений генной инженерии.
2.14. ТРАНСФОРМАЦИЯ ПЛАСТОМНОГО ГЕНОМА РАСТЕНИЙ
Пластиды представляют собой цитоплазматические органеллы и присутствуют в каждой растительной клетке. Эволюционно пластиды произошли из цианобактерий в результате их захвата эукариотической клеткой и до настоящего времени сохранили многие характерные черты прокариотического организма, такие как прокариотический тип промотора, объединение генов в опероны, специфический генетический код, прокариотический тип механизмов транскрипции и трансляции. Функционально и морфологически пластиды могут различаться. В целом можно выявить несколько основных типов пластид, присутствующих в различных органах и тканях растения: хлоропласты (фотосинтезирующие пластиды листьев и других зеленых тканей растения), хромопласты (окрашенные пластиды цветков и зрелых плодов) и амилопласты (пластиды запасающих органов растения).
Геном пластид представлен кольцевой молекулой ДНК длиной 120–180т. н. п. При этом геном всех пластид одного растения одинаков и межвидовые отличия незначительны. Пластидные гены в молекуле ДНК расположены очень компактно и функционально разделяются на два основных класса: гены, связанные с фотосинтетическим аппаратом, и гены генетических систем, включающие гены рибосомных РНК и белков, тРНК, РНК полимеразы и т. д. Большинство пластидных генов организованы вопероны и экспрессируются совместно с образованием гигантской полицистройной мРНК.
Каждая клетка мезофилла листа содержит до 100 пластид. Каждая пластида полиплоидна и содержит 10–100 копий кольцевой ДНК. Таким образом, каждая клетка может содержать до 10 тыс. копий каждого гена пластидного генома.
В последнее время интерес к пластидам резко возрос в связи с возможностью использования их для генной инженерии. Это прежде всего связано с высоким уровнем белкового синтеза в пластоме, материнским типом наследования и отсутствием эпигенетических процессов, таких как эффект положения и замолкание гена, значительно осложняющих экспрессию трансгенов в ядерном геноме. Однако активное использование пластид в генной инженерии сдерживалось рядом факторов и, прежде всего, трудностью доставки чужеродной ДНК через двойную мембрану пластид, а также полиплоидностью пластидного генома, так как для получения генетически стабильных трансформантов необходимо, чтобы трансген присутствовал в каждой копии пластидного генома.
Впервые стабильная интеграция чужеродного гена в геном хлоропластов растений была получена в лаборатории П. Малиги в 1990 г. При помощи метода биобаллистики в геном хлоропластов табака был введен ген ααdA, определяющий устойчивость к антибиотику стрептомицину, и получено первое транспластомное растение.
В настоящее время хлоропластная трансформация начинает составлять конкуренцию и является серьезной альтернативой трансформации ядерного генома растений. Причиной этого является то, что транспластомные растения имеют значительные преимущества над трансгенными растениями с трансформированным ядерном геномом с позиций более высокой эффективности продуцирования белков и большей биобезопасности для окружающей среды.
В качестве основных преимуществ хлоропластной трансформации можно указать следующие:
- 10–50-кратное увеличение уровней экспрессии встроенного пластомного трансгена, при котором количество полученного чужеродного белка может достигать 46 % от всего количество растворимых белков клетки. Причиной такой величины экспрессии является высокая полиплоидность каждой из пластид и большое их количество в клетке, и, таким образом, при введении трансгена в хлоропластный геном число его копий в цитоплазме одной клетки может составлять 5000–10000. В то время как ядро в клетке только одно при обычной 1–4 копийности встроенного в ядерный геном трансгена;
- экспрессия трансгена в хлоропластах более стабильная, чем в случае ядерных трансформантов. Как указывалось выше, интеграция трансгенов в ядерный геном происходит случайно и в непредсказуемые места на хромосомах. Это часто приводит к значительным различиям в уровнях экспрессии, изменениям в уровне синтеза трансгенного белка в течение времени до полного его прекращения. В случае хлоропластной трансформации встраивание трансгена идет по конкретным и выбранным экспериментатором местам хлоропластного генома. Это исключает возможность влияния на экспрессию трансгена окружающих фрагментов хлоропластной ДНК и уменьшения синтеза трансгенного белка;
- все транспластомные растения, полученные при трансформации одной векторной конструкцией, всегда будут генетически и фенотипически идентичны. Это также связано с тем, что интеграция трансгена в хлоропластную ДНК может проходить только по определенным последовательностям, присутствующим как в векторной конструкции, так и хлоропластном геноме путем гомологичной рекомбинации между ними. В случае же трансформации ядерного генома трансген встраивается в состав векторной конструкции в хромосомы ядра случайным образом и получить две независимые трансформации в один и тот же участок ядерной ДНК практически невозможно из-за огромного количества (сотни тысяч и более) потенциальных мест интеграции;
- возможности мультигенной экспрессии трансгенов в хлоропластах с одного полицистронного транскрипта мРНК. Это связано с особенностями хлоропластных генов, которые сходны с оперонной структурой бактериальных генов, когда несколько генов транскрибируются совместно с одного промотора в виде одной мРНК. Возможность создания вектора с таким искусственным мультигенным опероном увеличивает количество генов, которые могут экспрессироваться в растениях в результате одного акта трансформации. Кроме того, значительно повышается биобезопасность таких трансгенных растений, в связи с тем, что такие мультигенные векторные конструкции не могут работать в эукариотических геномах, в том числе и у насекомых, которые могут потенциально быть вовлеченными в горизонтальный перенос;
- рекомбинантные белки, и прежде всего белки человека, могут нормально процессироваться в хлоропластах, образуя вторичные структуры. В случае ядерных трансгенов чужеродные белки должны вовлекаться во вторичные метаболистические пути для правильного процессинга. При этом рекомбинантные токсичные белки при экспрессии в больших количествах в цитозоле растительной клетки часто бывают нетоксичны при аккумуляции их в хлоропластах;
- риск распространения трансгенов в случае транспластомных растений минимален. Это связано с тем, что зрелая пыльца не содержит пластид, которые могут передаваться только от яйца к эмбриону. Таким образом, значительно повышается биобезопасность таких растений в связи с невозможностью переноса трансгена на другие растения при переопылении.
Векторы для хлоропластной трансформации
Векторные конструкции построены на основе плазмиды Е. соli (см. рис. 1.7) и содержат гены селективного маркера, а также целевой ген(ы). Кроме того, так как в основе трансформации пластома лежит тот факт, что интефация в хлоропластный геном проходит по механизмам гомологичной рекомбинации, участок векторной плазмиды, несущий ген(ы), который необходимо встроить в хлоропластный геном, фланкирован (окружен) последовательностями, гомологичными двум фрагментам хлоропластной ДНК. Длина таких фланкирующих последовательностей может достигать 400–2000 н. п. Такая протяженность гомологии значительно увеличивает частоту рекомбинации между векторной конструкцией и гомологичными участками хлоропластного генома и, соответственно, увеличивается вероятность интеграции части вектора в хлоропластный геном и получения транспластомных растений. Для встраивания трансгенов выбираются межгенные районы пластома.
В качестве селективных маркеров в конструкциях для хлоропластной трансформации обычно использовался бактериальный ген ααdA, определяющий устойчивость растения к антибиотику стрептомицину, под контролем промотора рибосомного оперона пластид и теминаторной последовательностью также пластидного гена psbA (см. рис. 2.5). В присутствии стрептомицина в среде для регенерации растения с трансформированными хпоропластами, несущими ген устойчивости ααdA, остаются зелеными, в то время как нетрансформированные – белые. В последние годы в связи с возможным риском переноса антибиотической устойчивости от трансгенов к почвенным микроорганизмам в качестве селективного маркера эффективно используется выделенный из шпината растительный ген бетаин альдегиддегидрогеназы (BADH), который переводиттоксичный глицинальдегид (селективный агент) в нетоксичный для растений глицинбетаин.
В качестве функциональных используются гены различного, как бактериального (cry, аrо, bаr гены), так и животного, и растительного (гены GH1, gvgvp) происхождения, что определяется целями получения транспластомных растений. В ряде случаев д ля получения активного белкового продукта несколько генов объединяются в один оперон под контроль сильных пластидных промоторов, как это было сделано при введении кодирующего bt-токсин трехгенного оперона сrу2Аα2 в геном хлоропластов табака.
Методы трансформации пластндного генома
В настоящее время для трансформации хлоропластов используются три метода: биобаллистики, трансформация с помощью полиэтиленгликоля (ПЭГа) и с помощью микроинъекций с использованием жидкого металла галистана.
Наиболее широко применяемым и наиболее эффективным методом трансформации хлоропластов является метод биобалпистики. Методика проведения биобаллистической трансформации пластид аналогична проводимой при трансформации ядерного генома. Высокая эффективность, скорость регенерации трансформированных тканей и возможность использования для различных типов эксплантов и д ля разных видов растений, как однодольных, так и двудольных, сделала этот метод приоритетным для получения транспластомных растений. Выход трансформированных этим методом растений табака может достигать до 5–8 на один обстрелянный эксплант. Единственным ограничением применения этого метода является наличие дорогостоящей биобаллистической пушки.
Для ПЭГ-опосредованной трансформации необходимо получить протопласты. Протопласты в присутствии ПЭГа могут всасывать векторную ДНК, и изменения в мембране протопласта позволяют ДНК проникать внутрь цитоплазмы. Векторная ДНК транспортируется из цитоплазмы в хлоропласт, где и встраивается в геном последнего. Эффективность этого метода при трансформации хлоропластов не очень высока. Кроме того, не все растения могут регенерировать из протопластов, что довольно сильно сужает возможности применения этого метода.
Трансформация с помощью микроинъекций с использованием жидкого металла галистана является новейшей разработкой, однако пока не очень распространенной. Этот метод основан на микроинъекциях векторной ДНК непосредственно в хлоропласты с помощью стеклянной иглы диаметром 0,1 мм. Введение векторной конструкции происходит в результате теплового расширения жидкого металла галистана в шприце.
Дальнейшие этапы отбора транспластомных растений аналогичны таковым у ядерных трансгенов и проводятся в присутствии высоких концентраций селективного агента. Существенным отличием является то, что при пластидиой трансформации проводят несколько дополнительных раундов (до 4) селекции и регенерации. Это связано с плоидностью генома и мультикопийностью пластид в клетке. Так как интеграция векторной конструкции происходит лишь в несколько хлоропластов, проведение нескольких последовательных 3–4 этапов регенерации при очень жесткой селекции приводит к тому, что размножаются лишь трансформированные хлоропласты и в результате все хлоропласты в клетке и растении будут нести фрагмент векторной конструкции (рис. 2.6).
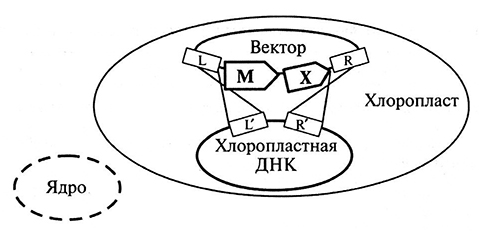
Рис. 2.6. Трансформация хлоропластов
В состав векторной конструкции для трансформации входят маркерный ген (M) и функциональный ген (X), окруженные последовательностями L и R, гомологичными хлоропластной ДНК. Трансформация хлоропластов основана на гомологичной рекомбинации между последовательностями L и R векторной конструкции и соответствующими последовательностями L' и R' хлоропластной ДНК.
В настоящее время хлоропласты все шире используются в качестве биореакторов и публикуется все больше работ, показывающих перспективность использования пластид для наработки белковых продуктов. Введение в пластидный геном гена cry1Ас и экспрессия bt-токсина в несколько раз повысила устойчивость таких транспластомных растений табака и картофеля к насекомым по сравнению с трансгенными, трансформированными аналогичным геном, но находящимся в ядерном геноме. Дальнейший анализ показал, что в листьях транспластомных растений bt-токсин может составлять до 5 % суммарного растворимого белка. Введение же в хлоропластную ДНК трехгенного оперона сrу2Аа2, включающего также два белка-помощника, достигало максимального количества 46 % от всех белков листа.
В настоящее время получены транспластомные растения табака, картофеля, томатов устойчивые к различным биотическим и абиотическим факторам (табл. 2.1).
Таблица 2.1. Экспрессия чужеродных генов в хлоропластах растений

Отдельным направлением является использование транспластомных растений для производства лекарственных препаратов и съедобных вакцин. Так, введенный в хлоропластнй геном растения табака ген GH1 приводит к синтезу белка соматотропина (гормон роста), количество которого в листьях составляет до 7 % всех растворимых белков. При этом была показана высокая биологическая активность полученного белка соматотропина. Другой пример – это синтез бета-субъединицы холерного токсина в хлоропластах табака, который может быть использован в качестве вакцины. Было показано, что полученный белок был антигенно идентичен природному СТВ токсину. При этом в листьях синтезированный белок мог составлять более 4 % от всех белков, в то время как экспрессия аналогичной конструкции у ядерных трансгенов в лучшем случае достигала 0,1 %. Аналогично были получены транспластомные растения табака, экспрессирующие вакцину против сибирской язвы.
Рядом исследователей было показана возможность экспрессии белка помимо листьев в хромопластах плодов томата и амилопластах клубней картофеля, хотя нужно отметить, что количество ожидаемого продукта было значительно ниже. Однако возможность экспрессии целевых генов в съедобных частях транспластомных растений открывает перспективы новому направлению–получению съедобных вакцин.

