Мы рассматривали различные способы хемостатного непрерывного культивирования, в котором регулировался только поток свежей питательной среды, а стабилизация параметров процесса осуществлялась за счет саморегулирования. Такой способ регулирования имеет определенные пределы и при колебаниях концентрации субстрата на входе, характеристик культуры и самого подаваемого потока может приводить либо к новому установившемуся состоянию, либо даже к полному вымыванию культуры из аппарата. Как альтернатива хемостату предложены различные варианты непрерывного процесса ферментации с внешним контуром регулирования процесса. Рассмотрим варианты таких процессов.
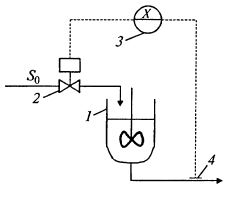
Турбидостат. Скорость разбавления в аппарате не поддерживается на постоянном уровне, а регулируется в зависимости от концентрации биомассы (рис. 9.19). Если концентрация биомассы начинает уменьшаться, скорость разбавления снижается, и наоборот. Один из способов измерения концентрации биомассы – определение степени поглощения светового потока суспензией. Такой способ называется турбидиметрическим. Отсюда и название «турбидостат». Правда, турбидиметрический способ измерения для высоких концентраций биомассы, для сред окрашенных или с включениями твердых частиц типа муки работает плохо. Но турбидостатом называют процесс, где регулируется концентрация биомассы, каким бы образом она ни измерялась.
Рис. 9.19. Схема процесса непрерывного культивирования микроорганизмов с внешним контуром регулирования подачи субстрата по концентрации биомассы:
1 – ферментер; 2 – регулирующий клаТган или насос-дозатор; 3 – регулятор; 4 – датчик концентрации биомассы
Респиростат. Уже говорилось о том, что с помощью газоанализаторов кислорода или углекислого газа можно измерять интенсивность дыхания культуры. Эта величина, следуя уравнению материального баланса, пропорциональна росту, образованию продукта и поддержанию жизнедеятельности:
(9.93)
Из этого соотношения видно, что QCO2 пропорциональна концентрации биомассы. Поэтому, регулируя интенсивность дыхания, можно регулировать и концентрацию биомассы, а следовательно, скорость подачи субстрата.
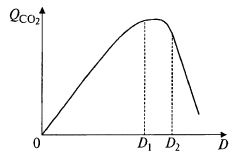
На рис. 9.20 представлена зависимость QCO2 от скорости разбавления. Анализируя ее, можно предложить способ управления. Задается определенная величина интенсивности дыхания, близкая к максимальной, на левой или правой ветви кривой. В зависимости от этого и закон регулирования будет различен: при снижении интенсивности дыхания в точке D1 величину D надо повышать, а в точке D2 – понижать, чтобы сохранить QCO2 на заданном уровне. Поскольку «дыхание» по-английски – respiration, такой способ называют респиростатом.
Рис. 9.20. Зависимость интенсивности дыхания в процессе непрерывного культивирования от скорости разбавления
Еще лучше не поддерживать дыхание на постоянном уровне, а все время искать скорость разбавления, обеспечивающую его максимум. Этот алгоритм управления легко реализуется с помощью современных систем автоматизации.
Оксистат. В этом способе регулирования подачу питательной среды в аппарат (скорость разбавления) осуществляют таким образом, чтобы поддерживать постоянное, относительно малое значение концентрации растворенного кислорода в среде.
Скорость потребления кислорода QO2 пропорциональна сумме его затрат на рост биомассы, образование продукта и поддержание жизнедеятельности культуры: (9.94)
Поддерживая QO2 на максимально возможном уровне, максимизируем производительность процесса.
Величина QO2 связана с концентрацией растворенного кислорода соотношением:
QO2 = KLα(C* – С), (9.95)
где KLα – коэффициент массопередачи между газом и жидкостью, определяемый характеристиками аппарата; С* – концентрация растворенного кислорода при полном насыщении жидкости кислородом (она зависит от концентрации кислорода в воздухе, давления и свойств среды, определяющих растворимость кислорода).
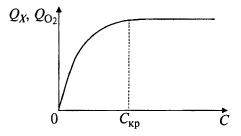
Согласно этому уравнению максимальная величина QO2 имеет место при минимальной концентрации растворенного кислорода С. Однако не следует забывать, что, как всякий субстрат, растворенный кислород влияет на скорость роста биомассы и через него – на QO2, часто по зависимости Моно (рис. 9.21).
Рис. 9.21. Зависимость скорости роста и/или интенсивности
дыхания от концентрации растворенного кислорода
Форма этой зависимости такова, что при возрастании С скорость роста биомассы сначала увеличивается очень быстро, но выше некоторого значения Скр, обозначаемого как «критическая» концентрация растворенного кислорода, скорость роста (и как следствие – скорость потребления кислорода) уже практически не зависит от величины С. Поэтому в таком способе и поддерживают концентрацию растворенного кислорода на уровне, близком к Скр.
Из уравнения (9.95) можно выразить величину Cb явном виде:
C = С* – QO2/KLα. (9.96)
Концентрация С* для обычных условий может считаться постоянной. Величиной KLα управляют, изменяя режимные параметры аэрации и перемешивания – расход воздуха, скорость вращения мешалки. Однако в случае оксистата этот способ воздействия на концентрацию кислорода не применяется. Коэффициент массо- передачи уже должен быть выведен на максимально возможный для данного аппарата уровень. Воздействие же на С осуществляется опосредованно – путем воздействия на скорость потребления кислорода QO2 за счет изменения скорости подачи свежей среды в аппарат. При этом изменяется и концентрация негазообразного субстрата S, соответствующим образом изменяя величины QX и QO2.
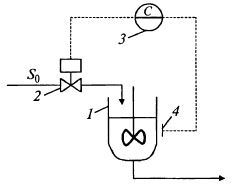
На рис. 9.22 представлена схема такого способа ведения непрерывного процесса ферментации, известного также как способ Господки (по фамилии ученого, предложившего его в начале 60-х годов XX в.). Называют его и оксистат, при этом в названии отражена его основная характеристика. Этот способ позволяет наилучшим образом использовать массообменные характеристики аппарата по кислороду.
Рис. 9.22. Схема процесса непрерывного культивирования
микроорганизмов с внешним контуром регулирования подачи
субстрата по концентрации растворенного кислорода в аппарате:
1 – ферментер; 2 – регулирующий клапан или насос-дозатор;
3 – регулятор; 4 – датчик растворенного кислорода
рН-стат. Рост микроорганизмов зачастую сопровождается выделением в среду некоторых кислот (закислением). Замедление же роста при недостатке субстрата вызывает, наоборот, защелачивание культуры, выражающееся в повышении рН. В некоторых процессах величина рН используется как параметр, в зависимости от которого в аппарат подается питательная среда. Скорость подачи при этом регулируется таким образом, чтобы величина рН поддерживалась на некотором постоянном уровне. Этот способ называют рН-стат. При этом, конечно, исключают регулирование рН другими способами – подачей в аппарат щелочи или кислоты.
Нутристат. В этом способе подача питательной среды в аппарат осуществляется так, чтобы поддерживать заданное значение концентрации субстрата S. Мы уже видели, что в хемостате специально следить за концентрацией субстрата не нужно – она устанавливается сама собой в зависимости от скорости разбавления:
(9.97)
Другая ситуация возникает, когда удельная скорость роста μ зависит от концентрации субстрата S не по уравнению Моно, а, например, по уравнению Андрюса, т. е. когда функция μ(S) проходит через экстремум (рис. 9.23).
Рис.·9·23·Экстремальные зависимости роста микроорганизмов (μ) или биосинтеза продукта (qp) от концентрации субстрата
Для обеспечения максимальной скорости роста в этом случае концентрацию субстрата необходимо поддерживать на некотором оптимальном уровне Sopt (SX или Sp – в зависимости от цели культивирования) в неустойчивом диапазоне. На этом уровне самопроизвольно концентрация субстрата не установится – при колебаниях она «скатится» в меньшую или большую сторону. Точно так же трудно поддерживать необходимую концентрацию в зоне ингибирования роста, если эта повышенная концентрация способствует оптимальной скорости биосинтеза продукта метаболизма. Вот тут и помогает нутристат, из самого названия которого (nutrition по-английски – питание) понятно, что речь идет о поддержании концентрации питательного субстрата в аппарате на постоянном уровне. Этот способ имеет неудобство: необходимо непрерывно измерять концентрацию субстрата в аппарате, что не всегда просто осуществить.
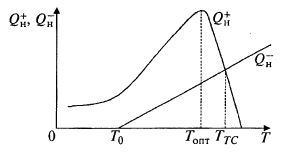
Теплостат. Обычно в ходе процесса температура поддерживается на некотором постоянном уровне путем регулирования подачи охлаждающей воды в рубашку или змеевик аппарата. При увеличении теплового потока Q+H повышается температура, регулятор увеличивает скорость подачи охлаждающей воды, увеличивается при этом также и скорость теплоотвода Q–H, что позволяет сохранить равновесие, т. е. равенство Q+H и Q–H.
Скорость тепловыделения Q+H обычно связана с ростом микроорганизмов. Зависимость Q+H от температуры (рис. 9.24) подобна зависимости роста от температуры.
Рис. 9.24. Зависимость скорости тепловыделения Q+ и скорости отвода тепла Q–H в аппарате без внешнего контура регулирования температуры
Эта зависимость имеет пологий участок подъема, довольно острый экстремум и крутой ниспадающий участок при увеличении температуры выше оптимального уровня Tопт. В обычном процессе температуру поддерживают на уровне Топт. В теплостате же она самопроизвольно устанавливается на уровне T = ТТС, при котором скорость биологического тепловыделения равна скорости отвода тепла в окружающую среду.
При отсутствии внешнего контура регулирования температуры отвод тепла обеспечивается лишь самопроизвольными теплопотерями в окружающую среду:
Q–H = KF(T – T0), (9.98)
где К– коэффициент теплопередачи; F- поверхность теплопередачи; T и T0 – температура в аппарате и в окружающей среде соответственно.
На рис. 9.24 это уравнение представлено прямой, которая пересекается с кривой Q+H(T) при T= TТС.
Из рисунка видно, что TТС > Топт. Хотя при этом процесс ферментации как-то идет (правда, медленно, с фактически постоянной скоростью роста), вряд ли стоит рекомендовать такой способ для использования. Гораздо проще (и точнее) регулировать обычным способом температуру на данном более высоком уровне, если вдруг по каким-то причинам при повышенных температурах выделяется некоторый ценный продукт.