Для описания кинетики этих сложных химических превращений примем, что каждая из входящих в систему реакций является простой химической реакцией, описываемой уравнением кинетики, в котором скорость протекания реакции пропорциональна произведению концентраций реагирующих веществ на соответствующую константу скорости реакции.
Из структуры уравнений видно, что фермент-субстратный комплекс EС может образовываться и вновь распадаться, т. е. это процесс обратимый. Обозначим константу скорости прямой реакции K1 а обратной – K–1 константу скорости образования продукта из фермент-субстратного комплекса обозначим K2: (12.3)
Запишем материальный баланс для образования фермент-субстратного комплекса (ES)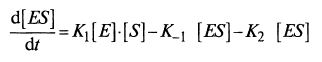
и материальный баланс для образования продукта P (12.5)
Особенность ферментативной кинетики состоит в том, что реакции образования и распада комплекса ES протекают гораздо быстрее, чем процесс образования конечного продукта реакции Р.
В связи с этим концентрация комплекса [ES] быстро устанавливается на некотором постоянном уровне, а сама реакция имеет стационарный характер по [ES], или квазистационарную кинетику.
Иначе говоря, можно принять (12.6)
Отсюда можем получить выражение для [jES]: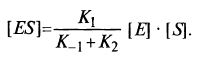
Интересно отметить, что фермент в процессе реакции не расходуется. Его начальная концентрация [E]0 просто раскладывается на свободный фермент и фермент-субстратный комплекс:
[Е]0=[Е] + [ES]. (12.8)
Если подставить сюда выражение для [ES], то можно получить зависимость для концентрации свободного фермента [E]: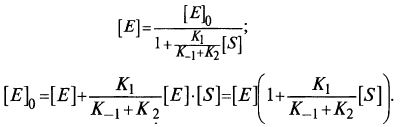
Подставим теперь это выражение в формулу (12.7) для концентрации фермент-субстратного комплекса [ЕS]: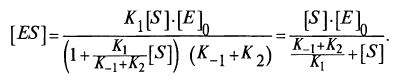
Найдем окончательное выражение для скорости образования продукта реакции: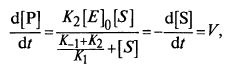
где V – скорость ферментативной реакции.
Это уравнение, предложенное в начале XX в. двумя авторами – Михаэлисом и Ментен (женщина-ученый), называют уравнением Михаэлиса–Ментен. Если ввести обозначение
KM = (K–1 + K2)/K1 (12.12)
где KM – константа Михаэлиса, и опустить квадратные скобки в обозначении концентраций Е, S и Р, то уравнение (12.11) преобразуется к виду (12.13)
Обратите внимание на сходство этого уравнения с уравнением Моно. Здесь dP/dt или V подобно QX или dX/dt; E0 подобно концентрации биомассы в уравнении Моно, а константа Михаэлиса Ku аналогична субстратной константе Моно KS.
Это сходство не случайно. Именно имея в виду ферментативный характер превращений субстрата микроорганизмами, Моно предложил форму уравнения, подобную уравнению Михаэлиса–Ментен.
Как определить количество фермента в исходной среде E0 или в системе после протекания реакции?
Для всех других участников ферментативной реакции – субстрата или продукта – существуют количественные методы, позволяющие точно определить массу вещества.
Для ферментов же часто даже неизвестна молекулярная масса – она обычно весьма велика, а ферменты представляют собой не чистое вещество, а смесь с белками и другими ферментами.
Фермент «взвешивают» не в граммах, а в единицах активности.
Единица активности – это такое количество фермента, которое при 30 °C за 1 минуту превращает 1 микромоль субстрата в продукт. Скорость реакции зависит еще и от концентрации субстрата и величины рН. Для каждого фермента эти стандартные условия его «взвешивания» заранее определены. Таким образом, количество фермента определяется по кинетике модельной реакции, и точное определение приходящейся на единицу активности массы фермента обычно неизвестно. Можно лишь определить концентрацию фермента в единице массы или объема вещества, проявляющего ферментную активность, но в ед/г или ед/мл (здесь «ед» – единица активности фермента).
В уравнении Михаэлиса–Ментен произведение K2E0 можно заменить на Vmax, а скорость образования продукта обозначить через V.
В результате получается принятый в ферментативной кинетике вид уравнения: (12.14)
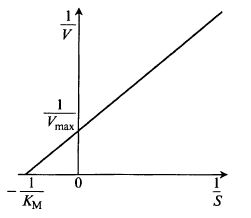
Как и в любом кинетическом уравнении, возникает проблема определения констант Vmax и КM по экспериментальным данным. Для этого, аналогично уравнению Моно, используют координаты Лайнуивера и Бэрка (рис. 12.2):
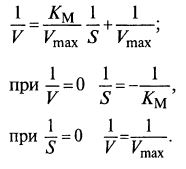
Рис. 12.2. Определение коэффициентов уравнения
методом Лайнуивера и Бэрка (двойных обратных координат)
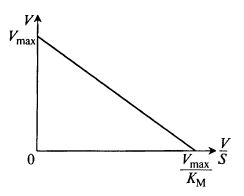
Другой вариант – координаты Корниш-Боудэна (V и V/S):
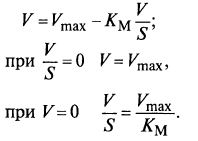
На рис. 12.3 показано, как выглядит уравнение (12.8) в этих координатах.
Рис. 12.3. Определение коэффициентов
уравнения методом Корниш-Боудэна
Все эти способы были предложены специалистами по ферментативной кинетике.