Методы иммобилизации. Существуют различные способы закрепления ферментов на носителе, основные из которых перечислены ниже.
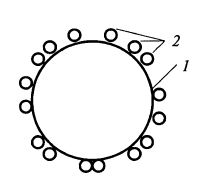
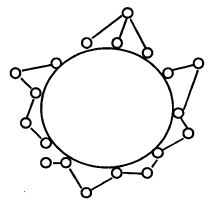
1. Адсорбция на носителе (рис. 12.5). Носителями могут быть неорганические материалы (стекло, силикагель, бентонит, оксид алюминия, диоксид титана и др.), природные полимеры (целлюлоза, коллаген) и синтетические полимеры (нейлон, полиэтилен, полипропилен).
Рис. 12.5. Иммобилизация фермента
методом адсорбции на носителе:
1 – гранула носителя; 2– молекулы фермента
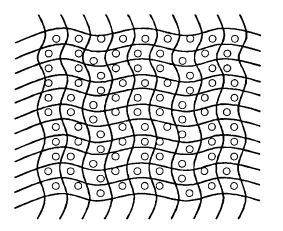
2. Включение в гель агар-агара, альгинатов, карагина- на (типа желе) (рис. 12.6).
Рис. 12.6. Иммобилизация фермента методом включения в гель
Молекулы фермента сидят в порах геля. Гель проницаем для молекул субстрата и продуктов реакции за счет молекулярной диффузии.
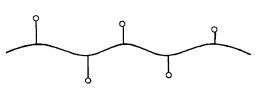
3 Ковалентное связывание с носителем. Носителем в этом случае является полимерный материал, длинные молекулы которого в разных местах связаны химическими кова- лентными связями с молекулами фермента (рис. 12.7).
Рис. 12.7. Иммобилизация фермента методом
ковалентного связывания с носителем
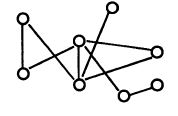
4. Поперечная «сшивка» молекул фермента при помощи бифункциональных реагентов. Молекулы фермента, свободно перемещающиеся в растворе, соединяются между собой различными своими участками с помощью определенных реагентов (рис. 12.8).
Рис. 12.8. Иммобилизация фермента
методом поперечной «сшивки»
Получается некое пространственное образование, включающее активные молекулы фермента и довольно большие пространства между ними, удобные для диффузии молекул субстрата и продукта реакции.
5. Адсорбция на носителе с последующей поперечной «сшивкой». Этот способ сочетает в себе способы 1 и 4.
По сравнению с обычной адсорбцией на носителе получается более глубокий слой молекул фермента, доступных для субстрата и продукта, а по сравнению с обычной «сшивкой» – более прочная гранула, имеющая жесткий остов в центре (рис. 12.9).
Рис. 12.9. Иммобилизация фермента методом адсорбции
на носителе с последующей поперечной «сшивкой»
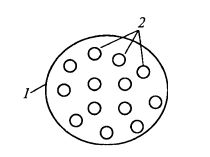
6. Включение в полупроницаемые капсулы. Внутри капсулы (рис. 12.10) как бы существует коллоидный раствор фермента. Внешняя оболочка капсулы довольно прочная, непроницаема для фермента, но проницаема для продукта и субстрата.
Рис. 12.10. Иммобилизация фермента
методом включения в полупроницаемые капсулы:
1 – капсула с полупроницаемой стенкой;
2 – молекулы фермента, взвешенные в растворе внутри капсулы
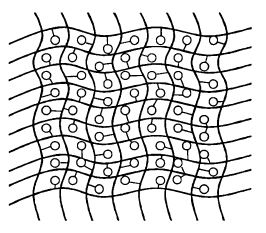
7. Сополимеризация фермента и полимера-носителя. Напоминает включение в гель, но матрица создается путем сополимеризации полифункционального реагента и фермента (т. е. фермент не просто находится в «клетке» геля, но и сцеплен с ней). Этот способ является сочетанием способов 2 и 4 (рис. 12.11).
Рис. 12.11. Иммобилизация фермента
методом сополимеризации с полимером-носителем
Примером является широко распространенный полиакрил-амидный гель, в котором в качестве реагента используется глута- ровый альдегид.
8. Физическое смешение – перемешивание фермента и порошка носителя. Метод довольно прост, но не очень надежен. Фермент может отслаиваться от носителя и переходить в раствор.
Оценка качества иммобилизованных ферментов и метода иммобилизации. Разработка иммобилизованного фермента (биокатализатора) – это целое искусство. Здесь и рецептура входящих в биокатализатор компонентов, и режим температуры, рН, перемешивания, при котором осуществляется иммобилизация, и методы отмывки свободного фермента и остатков непрореагировавшего мономера или реагентов.
Эта процедура – а ее смело можно называть технологией – часто является надежно охраняемым секретом фирм.
При оценке метода иммобилизации обычно учитывают 3 характеристики получаемого биокатализатора:
1) потеря активности при иммобилизации. Надо отдавать себе отчет в том, что иммобилизация – это всегда некоторое насилие над ферментом. Это особенно справедливо в методах, где в процессе иммобилизации используют химические реагенты, экстремальные для фермента значения рН и температуры. Поэтому сразу после иммобилизации суммарная активность фермента ниже, чем до нее;
2) стабильность биокатализатора. Это его способность противостоять деградации молекул фермента в процессе последующей его работы и хранения. Наиболее надежно, конечно, проверить образцы биокатализаторов при длительной работе, хотя в практике часто используют ускоренные методы старения и оценки стабильности;
3) активность биокатализатора. Она зависит не только от первого показателя – потери активности, но также и от того, насколько активен был исходный фермент, т. е. насколько хорошо и много удалось «затолкать» фермента в биокатализатор.
Разные оценки качества биокатализатора часто бывают противоречивыми. Выбирать приходится на основе экономического сравнения – сколько продукта и с какой производительностью может дать тот или иной биокатализатор и какова при этом получается его цена.