Ионообменный метод основан на способности специальных сорбентов – ионообменных смол – сорбировать биологически активные вещества, имеющие ионную природу (т. е. являющиеся кислотой, основанием или солью), благодаря эквивалентному обмену между ионами вещества, находящегося в растворе, и ионами сорбента.
Ионообменные смолы, или иониты, представляют собой синтетические высокомолекулярные органические вещества, практически нерастворимые в воде. Они содержат обменные ионы, один из которых связан с твердым носителем и называется фиксированным, или анкерным ионом. С ним электростатически связан противоположно заряженный ион, называемый подвижным ионом, или противоионом.
По этому подвижному иону ионообменные смолы подразделяются на катионообменники и анионообменники:
Tв. – H+ (катионообменник);
Tв. – OH– или Tв. – С1– (анионообменник).
Кроме того, существуют и амфотерные иониты, которые содержат и катионо-, и анионообменные группы, обладая, таким образом, двойственными свойствами: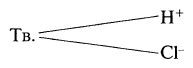
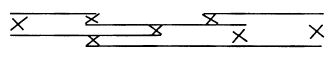
При введении ионита в жидкость он немного набухает, так как в его поры проникает вода. Но структура ионита построена не из линейных, а из пространственных трехмерных полимеров, что ограничивает способность к набуханию. Это связано с тем, что при полимеризации матрица вещества образует длинные продольные цепи, соединенные между собой поперечными мостиками – «химическими узлами» (рис. 16.1). Увеличение или уменьшение числа таких узлов влияет на размер микропор ионитов, а значит, и на их проницаемость.
Рис. 16.1. Схема химической структуры ионита
Набухшая структура ионита подобна пространственной сетке (губке), внутри которой передвигаются обменивающиеся ионы.
Сам процесс ионного обмена имеет обратимый характер и протекает следующим образом:
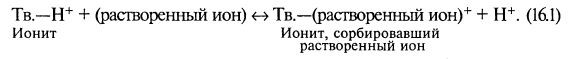
Высвобождающийся противоион диффундирует далее через поры ионита в жидкость. Движение ионов растворенного вещества внутрь гранулы ионита и, наоборот, вывод противоионов в окружающую жидкость происходят за счет диффузии.
Как и в любом массообменном процессе, в какой-то момент наступает равновесие между скоростями сорбции и десорбции (раз это обратимый процесс). Для жидкофазной экстракции связь между концентрациями растворенного вещества в условиях равновесия в разных фазах определяется коэффициентом распределения.
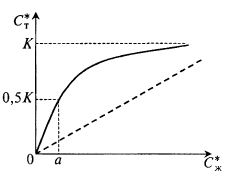
Для твердой фазы в условиях сорбции существует определенная особенность. Количество активных центров ионообменника ограничено (числом анкерных ионов), в связи с этим максимальное количество ионов растворенного вещества, связанных ионитом (т. е. сорбированных), не может быть больше определенного предела. Поэтому связь между равновесными концентрациями растворенного вещества в жидкости и в ионообменной смоле определяется соотношением, называемым изотермой Ленгмюра: (16.2)
где C*т и С*ж – соответственно равновесные концентрации растворенного иона в твердой фазе (сорбенте) и в жидкости (рафинате); К и α – константы, зависящие от свойств продукта и от свойств ионита соответственно.
Графическое выражение зависимости дано на рис. 16.2.
Рис. 16.2. Зависимость между равновесными концентрациями
растворенного вещества в жидкости и в твердом сорбенте
Из рисунка видно, что при С*ж → ∞ величина С*т → К, причем эта величина после какого-то значения С*ж уже мало отличается от К и практически не изменяется. Если
то
С*ж<< α, (16.3)
Величина α – характерный параметр изотермы Ленгмюра.
Если
С*ж<< α,
то
α + С*ж = α ,
и тогда (16.4)
если обозначить
Kр = К/α, (16.5)
то
C*т ≈ KpC*ж. (16.6)
Иначе говоря, линейное распределение между равновесными концентрациями вещества в твердой и жидкой фазах (т. е. связь, определяемая как коэффициент распределения) имеет место при относительно малых концентрациях вещества в твердой фазе, далеких от насыщения. Такая ситуация представлена на рис. 16.2 пунктирной линией.
Основной характеристикой обменной способности ионита является полная обменная емкость (ПОЕ). Она определяется как число обменных групп в мг-эквивалентах, приходящееся на 1 г ионита.
Практически это и есть К, выраженное в мг-эквивалентах растворенного вещества:
К = С*т mах, 16·7)
Не надо забывать, что связь, определяемая изотермой Ленгмюра, характеризует условия равновесия. В реальном же процессе, пока идет насыщение ионообменной смолы ионами растворенного вещества, текущая концентрация Cт в сорбенте отличается от равновесной.
Движущей силой процесса массопередачи как раз и является разность между равновесной концентрацией C*т (определяемой по изотерме Ленгмюра или по коэффициенту распределения, если концентрация находится в зоне малых значений) и текущей концентрацией Ст: (16.8)
где Kv – объемный коэффициент массоотдачи между жидкостью и ионитом, учитывающий, в частности, и концентрацию гранул ионита в системе, и поверхность массообмена в каждой грануле, и истинный коэффициент массоотдачи растворенного вещества; C*т – концентрация, равновесная с той, которая есть в жидкости, Сж.
В зависимости от знака выражения в скобках (C*т- Cт) будет происходить либо процесс сорбции (концентрация Cт во времени будет возрастать), либо процесс десорбции (концентрация Cт падает).
Рассмотрим пример. Концентрация антибиотика в жидкости Сж = 1 мг/мл. Концентрация того же антибиотика в ионите Cт = 10 мг/л. Коэффициент распределения Kp = 20. Что происходит: сорбция или десорбция?
Определим величину C*т, равновесную с концентрацией растворенного вещества в жидкости Сж:
C*т = KpСж = 20 мг/л.
Отсюда видно, что разность (C*т – Cт) = 20 – 10 = 10 мг/л, т. е. имеет положительное значение. Следовательно, идет сорбция антибиотика из жидкости, хотя физически его концентрация (1 мг/л) в жидкости меньше, чем в ионите. Если бы концентрация в жидкости была Сж = 0,5 мг/л, то имело бы место равновесие, и лишь при Сж < 0,5 мг/л происходила бы десорбция антибиотика из ионита в раствор.
На практике при десорбции несколько изменяется рабочая жидкость, для нее может быть своя изотерма Ленгмюра и свой коэффициент распределения.
Сорбция же обычно осуществляется до тех пор, пока вся обменная емкость ионита не будет заполнена (т. е. пока концентрация C*т не достигнет величины К).
Кстати, в процессах ионообмена процесс десорбции имеет специфическое название элюция, а десорбирующая жидкость называется элюентом.
Как на практике осуществляется процесс ионного обмена?
Наиболее прост статический способ. В аппарат с мешалкой загружают ионит и обрабатываемый раствор. Затем при перемешивании ионит суспендируется и дается время, достаточное для установления равновесия. Далее раствор сливают или фильтруют (если гранулы ионита слишком мелкие). Раствор обычно направляют в канализацию (так как он обеднен по целевому продукту) или повторно используют на стадии ферментации. Ионит же возвращают в аппарат, заливают элюентом, т. е. водным раствором, часто с измененным значением рН или с добавлением противоиона (иона хлора). Происходит обратный процесс (десорбция, элюция) – противоион сорбируется в ионите, а сорбированное ранее вещество переходит в элюент. При этом продукт освобождается от примесей, которые не сорбируются и уходят с исходным раствором.
Однократная сорбция–десорбция имеет недостаток: при этом сорбент не полностью поглощает растворенное вещество и не полностью переходит в элюент. Поэтому процесс иногда повторяют.
Чаще же в промышленности используют динамический способ. В этом способе ионит загружается в аппарат и обрабатываемый раствор непрерывно протекает через слой ионита. Назвать этот процесс полностью непрерывным нельзя, так как ионит загружается и выгружается периодически, поэтому процесс нестационарный.
Аппарат с загруженным ионитом называется ионитовым фильтром, или ионообменной колонной. Возможны два варианта таких «фильтров»: закрытый (напорный) и открытый (безнапорный).
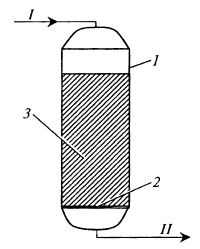
Закрытый фильтр (рис. 16.3) представляет собой колонну, заполненную гранулами ионита. Жидкость подается под напором сверху. У днища внутри аппарата устанавливается колпачковый фильтр с прорезями 0,2–0,3 мм, через которые проходит жидкость, но задерживаются гранулы ионита.
Рис. 16.3. Схема «закрытого фильтра»:
1 – корпус; 2 — колпачковый фильтр;
3 — слой ионита; I — исходный раствор;
II — отработанный раствор
Недостатком такой простой конструкции является неподвижность слоя ионитов, который сжат давлением нагнетаемой жидкости. Происходит слипание частиц ионита, образование каналов и застойных зон. В результате довольно большая часть ионита не участвует в процессе ионообмена, возможно также инфицирование застойных участков посторонней микрофлорой.
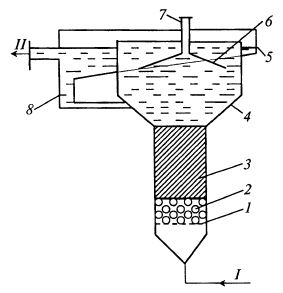
Открытый фильтр (рис. 16.4) – раствор подается в него снизу через специальный слой зернистого материала. Скорость потока в аппарате выбирается таким образом, чтобы слой ионита находился во взвешенном состоянии. Чтобы при этом не происходило выноса гранул ионита, верхняя часть колонны выполнена расширенной. В этой части колонны скорость потока снижается, что способствует оседанию гранул. Вывод отработанного раствора из колонны снабжен системой улавливания гранул ионита (за счет изменения направления потока).
Рис. 16.4. Схема «открытого фильтра»:
1 – колпачковый фильтр; 2 – слой зернистого материала;
3 – слой ионита; 4 – корпус; 5 – кольцевой карман;
6 – экран для задержания гранул ионита;
7 – патрубок сообщения с атмосферой;
8 – переливной патрубок;
I – исходный раствор; II – отработанный раствор
В обоих случаях после насыщения слоя ионита (определяемого по повышению концентрации растворенного вещества в отработанном растворе) раствор переключается на другую колонну, затем на третью, четвертую и т. д.
Обычно существует батарея ионообменных колонн, работающих в различных режимах. На отключенной колонне сначала проводят вытеснение рабочего раствора обессоленной водой, затем промывают ионит раствором антисептика.
Далее осуществляется процесс извлечения полезного вещества из сорбента – элюция. Элюат (чистый раствор, содержащий десор- бированное вещество) поступает на дальнейшие стадии концентрирования. Элюция прекращается после снижения концентрации в выходном потоке до предельного уровня.
После элюции проводится процесс регенерации ионита. Для этого через слой ионита пропускают раствор противоиона, который сорбируется на ионите, занимая там свое «законное место».
Поскольку в рассмотренной схеме слой ионита остается неподвижным, приходится иметь батареи аппаратов, постепенно переключая их на тот или иной режим работы.
Обычно количество элюата меньше, чем количество исходного раствора, что позволяет наряду с очисткой вещества от примесей проводить частичное концентрирование раствора.
Главное же в этом методе – это отделение продукта от примесей, «грязи». Способность ионообменных смол сорбировать именно целевой продукт называется селективностью.
При помощи ионитов с очень высокой селективностью делались попытки выделения растворенного компонента (например, антибиотиков) прямо из культуральной жидкости, содержащей биомассу микроорганизмов. Хотя при этом исключается стадия фильтрации, это не всегда хорошо – остатки сред и микроорганизмы забивают поры ионита, способствуют обрастанию его гранул.
Ионообменным способом выделяют многие антибиотики, аминокислоты, ферменты.
Несколько слов о самих ионообменных смолах. Есть много типов ионитов, имеющих размеры гранул от 300 мкм до 2 мм и более. При этом очень важен их равномерный дисперсный состав (чтобы не было уноса). Иногда делают смолы с непористым внутренним ядром, внешний слой смолы занимает лишь 30–50 мкм, что способствует более быстрой сорбции – десорбции.
В качестве матриц в смолах используют:
- полистирол (поливинилбензол);
- полиакрилат, полиметакрилат;
- полиамин;
- целлюлозу, декстран и др.
В качестве функциональных групп применяются:
- карбоксильные;
- сульфоновые;
- первичные – четвертичные аминогруппы.
Преимущества метода:
- простота аппаратурного оформления;
- многократное использование ионообменных смол;
- возможность полной механизации и автоматизации процесса;
- протекание процесса в водных растворах, без использования вредных органических растворителей.
Недостатки метода:
- нельзя использовать для извлечения неполярных веществ;
- селективность метода не всегда достаточна для разделения смеси веществ;
- наличие твердой фазы затрудняет возможность использования противотока для создания равномерной движущей силы процесса;
- довольно велико гидравлическое сопротивление колонн при малых размерах гранул ионита.
Жидкие ионообменники. Использование твердофазных ионитов связано с одним противоречием. С одной стороны, для быстрой сорбции следует снижать размер гранул. С другой стороны, это технологически неудобно: создается большое гидравлическое сопротивление, увеличивается возможность уноса ионитов, затрудняется отделение гранул от раствора.
Часть этих недостатков исключается при использовании жидких ионообменников, представляющих собой амины или органические кислоты или алкилфосфаты с молекулярной массой 250–500.
В этих случаях ионный обмен протекает быстро, а для его аппаратурного оформления используются аппараты для экстракции жидкость–жидкость. Собственно говоря, и сам процесс очень напоминает экстракцию, хотя в обмене участвуют ионы, а не молекулы.