ТЕХНОЛОГИЯ РЕКОМБИНАНТНЫХ ДНК
15 октября 1980 г. на Нью-Йоркской фондовой бирже произошло знаменательное событие: уже через 20 минут после начала торгов стоимость одной акции биотехнологической компании Genentech поднялась с 35 до 89 долларов. Это был рекордный для того времени скачок цен на акции коммерческого предприятия. К моменту закрытия торгов в тот день цена одной акции Genentech составляла 71,25 доллара, а стоимость всех 528 тысяч акций была столь баснословно высока, что мелкие инвесторы, собиравшиеся приобрести небольшой пакет акций, не имели никаких шансов.
По-видимому, это был первый случай в истории, когда о начале великой технологической революции возвестил биржевой колокол. В 1980 г., когда фирма Genentech впервые предложила обществу свои акции, это была небольшая компания в Калифорнии, в течение четырех лет успешно работавшая над проблемой получения рекомбинантных ДНК. За два года до этого ученым компании удалось выделить фрагменты гена (последовательности ДНК), кодирующие человеческий инсулин, и перенести их в генетические элементы (клонирующие векторы), способные реплицироваться в клетках обычной кишечной палочки (Escherichia colt). Эти бактериальные клетки работали как биологические фабрики по производству человеческого инсулина, который после соответствующей очистки мог использоваться как лекарственный препарат для больных диабетом, дающих аллергическую реакцию на свиной инсулин. Еще десять лет назад такое развитие событий представлялось нереальным, но сегодня все это стало вполне привычным.
Головокружительный взлет стоимости акций компании Genentech предопределялся как реальной оценкой потенциала технологии рекомбинантных ДНК, так и мечтами о будущих возможностях. Многие думали, что новая технология станет тем рогом изобилия XX века, который напоит и накормит всех желающих. Эти мечты подпитывались энтузиазмом газетных и журнальных публикаций и телевизионных репортажей, подогревались активностью биржевых брокеров и научно-фантастическими сюжетами. Воображение будоражили полчища удивительных микробов, растения и животные, созданные человеком. Энтузиасты предрекали, что генноинженерные микробы вытеснят химические удобрения, будут уничтожать разливы нефти; появятся растения с передающимися по наследству устойчивостью к вредителям и исключительно высокой питательной ценностью; будут созданы сельскохозяйственные животные, более эффективно усваивающие пищу, быстро прибавляющие в весе и дающие нежирное мясо. Казалось, что коль скоро конкретные биологические свойства обусловливаются одним или несколькими генами (единицами наследственности), создание организмов с новым генетическим устройством не составит труда. И в самом деле, хотя шумиха, поднятая вокруг новой технологии, была не совсем адекватной, увлечение этой идеей имело основания. Прошло немногим более пятнадцати лет, и многие наиболее разумные проекты стали реальностью. В своей книге мы расскажем о том, как это произошло и каковы перспективы применения технологии рекомбинантных ДНК.Стратегия переноса функциональной единицы наследственности (гена) из одного организма в другой была разработана американскими учеными Стэнли Коэном и Гербертом Бойером в 1973 г. И Коэну, и Бойеру, и многим другим было ясно, что технология рекомбинантных ДНК предоставляет огромные возможности. Как в то время отмечал Коэн, «...есть надежда, что удастся ввести в [бактериальную клетку] Е. coli гены, ассоциированные с метаболическими или синтетическими функциями, присущими другим биологическим видам, например гены фотосинтеза или продукции антибиотиков».
Однако одним из первых откликов научного мира на создание новой технологии был мораторий на некоторые биотехнологические эксперименты, считавшиеся потенциально опасными Запрет на собственные исследования был провозглашен группой молекулярных биологов, включая Коэна и Бойера. Они считали, что объединение генов, происходящих из двух разных организмов, может случайно привести к созданию нового организма с нежелательными и опасными свойствами. Прошло несколько лет, у ученых накопился опыт работы с новой технологией, были согласованы инструкции по обеспечению безопасности этих работ, и страсти постепенно улеглись. Временное прекращение реализации некоторых научных проектов, связанных с рекомбинантными ДНК, не уменьшило энтузиазма генных инженеров. Новая технология продолжает привлекать беспрецедентное внимание как со стороны общественности, так и со стороны ученых.
Весть о клонировании генов, осуществленном Коэном и Бойером, облетела весь мир. Многие исследователи немедленно оценили все преимущества этой стратегии и создали огромное количество методик, следуя которым, можно было с высокой эффективностью и относительно просто идентифицировать, выделять, охарактеризовывать и использовать гены. Эти технологические разработки внесли значительный вклад в развитие практически всех биологических дисциплин, включая науку о поведении животных, биологию развития, молекулярную эволюцию, клеточную биологию и генетику человека, однако наиболее глубокие изменения произошли в области биотехнологии.
ВОЗНИКНОВЕНИЕ МОЛЕКУЛЯРНОЙ БИОТЕХНОЛОГИИ
В начале 70-х годов традиционная биотехнология как научная дисциплина была не слишком известна; исследования в этой области в основном проводились в отделах инженерной химии и иногда в рамках социальных микробиологических программ. В широком смысле биотехнология занимается производством коммерческих продуктов, образуемых микроорганизмами в результате их жизнедеятельности. Более формально биотехнологию можно определить как «применение научных и инженерных принципов к переработке материалов живыми организмами с целью создания товаров и услуг». В историческом смысле биотехнология возникла тогда, когда дрожжи были впервые использованы при производстве пива, а бактерии – для получения йогурта.
Термин «биотехнология» был придуман в 1917 г. венгерским инженером Карлом Эреки для описания процесса крупномасштабного выращивания свиней с использованием в качестве корма сахарной свеклы. По определению Эреки, биотехнология – это «все виды работ, при которых из сырьевых материалов с помошью живых организмов производятся те или иные продукты». Однако это совершенно точное определение не получило широкого распространения Долгое время термин «биотехнология» относился к двум очень разным дисциплинам. С одной стороны, его употребляли, говоря о промышленной ферментации, с другой – применительно к той области, которая сейчас называется эргономикой. Такой двойственности пришел конец в 1961 г., когда шведский микробиолог Карл Гёрен Хеден порекомендовал изменить название научного журнала "Journal of Microbiological and Biochemical Engineering and Technology" («Журнал микробиологической и химической инженерии и технологии»), специализирующегося на публикации работ по прикладной микробиологии и промышленной ферментации, на "Biotechnology and Bioengineering" («Биотехнология и биоинженерия»). С этого момента биотехнология оказалась четко и необратимо связана с исследованиями в области «промышленного производства товаров и услуг при участии живых организмов, биологических систем и процессов» и встала на прочный фундамент микробиологии, биохимии и химической инженерии.
Промышленный биотехнологический процесс, в котором для производства коммерческих продуктов используются микроорганизмы, обычно состоит из трех ключевых этапов (рис. 1.1.).
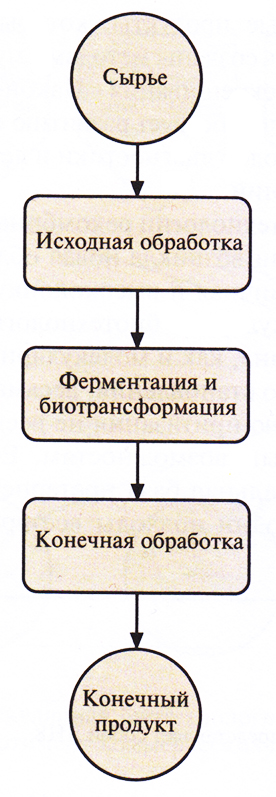
Рис. 1.1. Основные этапы биотехнологического процесса. Термин был введен Карлом Эреки и относился к крупномасштабному получению свинины (конечный продукт) с использованием дешевой сахарной свеклы (сырье) в качестве корма для свиней (биотрансформация).
1. Исходная обработка: обработка сырья таким образом, чтобы его можно было использовать как источник питательных веществ для микроорганизма-мишени.
2. Ферменгация и биотрансформация: рост микроорганизма-мишени в большом (обычно более 100 л) биореакторе (ферментация) с последующим образованием нужного метаболита, например антибиотика, аминокислоты или белка (биотрансформация).
3. Конечная обработка: очистка нужного вещества от компонентов культуральной среды или от клеточной массы.
Целью биотехнологических исследований является максимальное повышение эффективности каждого из этих этапов и поиск микроорганизмов, с помощью которых можно получить нужные вещества (пищевые добавки, антибиотики и т. д.). В 60–70-е годы все эти исследования касались только исходной обработки, устройства биореакторов и получения конечного продукта. Благодаря этому был усовершенствован инструментальный контроль процесса ферментации и значительно расширены возможности крупномасштабного культивирования, что позволило повысить эффективность производства некоторых продуктов.
Наиболее трудным для оптимизации был этап биотрансформации. Когда использовались природные микробные штаммы, выход конечного продукта часто оказывался намного ниже оптимального. Поэтому предпринимались попытки изменить генетическую конституцию существующих штаммов-продуцентов с помощью химического мутагенеза или ультрафиолетового облучения. При таком подходе уровень повышения продукции обычно лимитировался чисто биологическими факторами. Например, если мутантный штамм синтезировал слишком много того или иного вещества, часто это отрицательно влияло на прочие метаболические процессы и приводило к угнетению роста культуры при крупномасштабном культивировании. Несмотря на это традиционные стратегии «индуцированного мутагенеза и селекции», направленные на усовершенствование штамма-продуцента, были исключительно плодотворны для многих процессов, например для производства антибиотиков.
Традиционные схемы генетического усовершенствования бактерий включают скрининг, отбор и тестирование огромного количества колоний, поэтому такие схемы высокозатратны и занижают много времени. Более того, при этом можно рассчитывать только на усовершенствование уже существующих, передаваемых по наследству свойств штамма, а не на расширение его генетических возможностей. И все же к концу 70-х годов таким образом были усовершенствованы производственные процессы получения целого ряда продуктов.
С развитием технологии рекомбинантных ДНК природа биотехнологии изменилась окончательно и бесповоротно. Появилась возможность оптимизировать этап биотрансформации более прямым путем, создавать, а не просто отбирать высокопродуктивные штаммы, использовать микроорганизмы и эукариотические клетки как «биологические фабрики» для производства инсулина, интерферона, гормона роста, вирусных антигенов и множества других белков. Технология рекомбинантных ДНК позволяет получать в больших количествах ценные низкомолекулярные вещества и макромолекулы, которые в естественных условиях синтезируются в минимальных количествах. Растения и животные стали естественными биореакторами, продуцирующими новые или измененные генные продукты, которые никогда не могли бы быть созданы методами мутагенеза и селекции или скрещивания. Наконец, эта новая технология способствует развитию принципиально новых методов диагностики и лечения различных заболеваний.
_________________________________________________________________________
Таблица 1.1. История развития молекулярной биотехнологии
Дата Событие
1917 Карл Эреки ввел термин «биотехнология»
1943 Произведен пенициллин в промышленном масштабе
1944 Эвери. МакЛеод и МакКарти показали, что генетический материал представляет собой ДНК
1953 Уотсон и Крик определили структуру молекулы ДНК
1961 Учрежден журнал " Biotechnology and Bioengineering"
1961– Расшифрован генетический код
1966
1970 Выделена первая рестрицирующая эндонуклеаза
1972 Корана и др. синтезировали полноразмерный ген тРНК
1973 Бойер и Коэн положили начало технологии рекомбинантных ДНК
1975 Колер и Мильштейн описали получение моноклональных антител
1976 Изданы первые руководства, регламентирующие работы с рекомбинантными ДНК
1976 Разработаны методы определения нуклеотидной последовательности ДНК
1978 Фирма Genentech выпустила человеческий инсулин, полученный с помощью Е. coli
1980 Верховный суд США, слушая дело Даймонд против Чакрабарти, вынес вердикт,
что микроорганизмы, полученные генноинженерными методами, могут быть запатентованы
1981 Поступили в продажу первые автоматические синтезаторы ДНК
1981 Разрешен к применению в США первый диагностический набор моноклональных антител
1982 Разрешена к применению в Европе первая вакцина для животных, полученная
по технологии рекомбинантных ДНК
1983 Для трансформации растений применены гибридные Ti-плазмиды
1988 Выдан патент США на линию мышей с повышенной частотой возникновения опухолей,
полученную генноинженерными методами
1988 Создан метод полимеразной цепной реакции (ПЦР)
1990 В США утвержден план испытаний генной терапии с использованием соматических клеток человека
1990 Официально начаты работы над проектом «Геном человека»
1994– Опубликованы подробные генетические и физические карты хромосом человека
1995
1996 Ежегодный объем продаж первого рекомбинантного белка (эритропоэтина) превысил 1 млрд. долларов
1996 Определена нуклеотидная последовательность всех хромосом эукариотического микроорганизма
(Saccharomyces cerevisiae)
1997 Клонировано млекопитающее из дифференцированной соматической клетки.
_______________________________________________________________________________________________________
На стыке технологии рекомбинантных ДНК и биотехнологии возникла новая область исследований, динамичная и высококонкурентоспособная, — молекулярная биотехнология. Эта молодая дисциплина, как и молекулярная биология в период своего становления, весьма амбициозна, заявляемые ею притязания не всегда соответствуют реальным возможностям. Ее стратегия и экспериментальная база претерпевают быстрое изменение, одни подходы все время вытесняются другими. Но несомненно одно: в будущем молекулярная биотехнология станет рутинным методом создания живых систем, обладающих новыми функциями и возможностями.
Очень редко новые научные дисциплины возникают «на пустом месте»; как правило, их фундаментом служат различные области науки. Что касается молекулярной биотехнологии, то ее биотехнологическая составляющая относится к сфере промышленной микробиологии и химической инженерии, а молекулярная – к областям молекулярной биологии, молекулярной генетики бактерий и энзимологии нуклеиновых кислот (табл. 1.1). В широком смысле молекулярная биотехнология пользуется достижениями самых разных областей науки и применяет их для создания самых разных коммерческих продуктов (рис. 1.2).
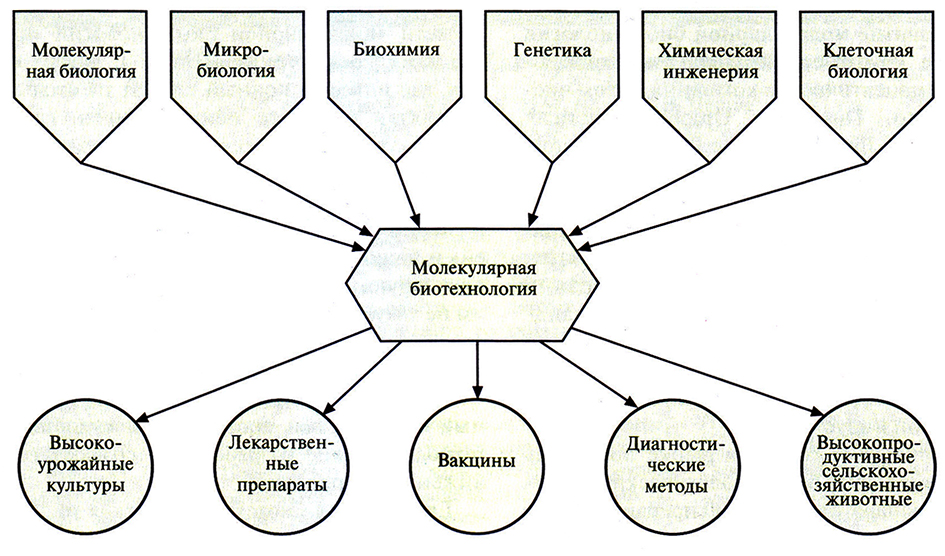
Рис. 1.2. Молекулярная биотехнология использует достижения многих областей науки и позволяет создавать широкий ассортимент коммерческих продуктов и методов.
КОММЕРЦИАЛИЗАЦИЯ МОЛЕКУЛЯРНОЙ БИОТЕХНОЛОГИИ
Конечной целью всех биотехнологических исследований является создание коммерческого продукта. Следовательно, молекулярная биотехнология тесно связана с экономикой. Конечно, сейчас ее развитие обусловливается не только экономическими факторами, однако на первых порах ажиотаж вокруг этой молодой науки был связан с возможностью получения прибыли. К вечеру 15 октября 1980 г. основные держатели акций фирмы Genentech стали обладателями миллионных состояний, и это побудило очень многих людей к энергичным действиям. В период 1980–1983 гг. в Соединенных Штатах было создано около 200 мелких биотехнологических компаний; этому способствовали введение налоговых льгот, высокие прибыли от операций с ценными бумагами и заинтересованность частных вкладчиков. Вслед за Гербертом Бойером, который вначале был научным сотрудником Калифорнийского университета в Сан-Франциско, а затем стал вице-президентом фирмы Genentech, многие университетские профессора открыли собственные компании.
К 1985 г. в Соединенных Штатах было уже более 400 биотехнологических фирм; многие из них включили в свое название слово «ген», чтобы заявить о принадлежности к генноинженерному «цеху»: Biogen, Amgen, Calgene, Engenics, Genex, Cangene. На сегодняшний день в США свыше 1500 биотехнологических компаний, а во всем мире их более 3000. Кроме того, большой вклад в развитие молекулярной биотехнологии внесли все крупные международные химические и фармацевтические компании, в том числе Monsanto, Du Pont, Upjohn, American Cyanamid, Eli Lilly, SmithKline Beecham, Merck, Novartis, Hoffman LaRoche. В период бурного развития биотехнологического бизнеса в 80-е годы мелкие компании поглощались крупными, образовывались совместные предприятия. Например, в 1991 г. 60% акций компании Genentech было продано фирме Hoffmann-LaRoche за 2,1 млрд. долларов. В то же время многие компании обанкротились. Такая мобильность – характерная особенность биотехнологической индустрии.
К середине 90-х годов на рынке появилось более десятка новых биотехнологических лекарственных препаратов, более 100 препаратов сейчас проходят клинические испытания, еще свыше 500 находятся на стадии разработки. Создано и выпущено на рынок множество новых молекулярно-биотехнологических продуктов, повышающих урожайность сельскохозяйственных культур и продуктивность сельскохозяйственных животных. Ежегодный доход молекулярно-биотехнологической индустрии увеличился с 6 млн. долларов в 1986 г. до примерно 30 млрд. в 1996 г. По оценкам, к 2000 г. объем продаж продуктов, изготовленных с применением молекулярной биотехнологии, превысит 60 млрд. долларов в год. И хотя в целом доходность биотехнологического бизнеса оказалась не такой высокой, как ожидалось, энтузиазм инвесторов не ослабевает и свидетельствует о том, что молекулярная биотехнология – по крайней мере по их представлениям – имеет блестящие перспективы.
Все новые независимые молекулярно-биотехнологические компании узкоспециализированы, что часто находит отражение в их названии. Например, вслед за компаниями, занимающимися клонированием генов, в США появились компании, выпускающие полученные генноинженерными методами антитела, которые предназначены для лечения инфекционных заболеваний, рака и других болезней человека: Immunex, ImmuLogic, ImmunoGen, Immunomedics, Medlmmune, Immune Response.
Большая часть коммерческих разработок в области молекулярной биотехнологии приходится на Соединенные Штаты. В других странах, где инвестиционный климат не столь благоприятен и бизнес менее активен, главную роль в создании молекулярно-биотехнологических предприятий играют крупные корпорации и государство. Так, правительство Японии объявило биотехнологию «стратегической индустрией» и национальным приоритетом. За дело взялись крупные японские корпорации. Вначале им не хватало собственных кадров, и первые исследования проводились в сотрудничестве с американскими университетами и компаниями. Сейчас эти корпорации приобрели необходимый опыт и сами проводят молекулярно-биотехнологические разработки и создают генно-инженерные продукты.
Европейская биотехнологическая индустрия тоже неуклонно развивается: к 1995 г. в странах Европы было создано более 600 биотехнологических компаний. В экономически менее развитых странах роль «локомотива» в развитии национальной молекулярно-биотехнологической индустрии взяло на себя государство. Стимулом здесь служила уверенность в том, что молекулярная биотехнология – «самая революционная из всех технологий XX века». Ни одна страна не хотела оказаться лишенной всех тех благ, которые сулило ее развитие.
Сейчас, в конце второго десятилетия своего развития, молекулярная биотехнология фактически стала одной из отраслей промышленности, хотя вначале некоторые ученые считали ее чисто эзотерическим направлением. Без сомнения, в ближайшие десять лет коммерческую молекулярную биотехнологию ожидает бурный рост, но именно поэтому давать какие-то конкретные прогнозы здесь весьма рискованно.
ВАЖНАЯ ВЕХА
Создание функциональных бактериальных плазмид in vitro
S.N. Cohen, A.C.Y. Chang, H.W. Boyer, R.B. Helling
Proc. Natl. Acad. Sci. USA 70: 3240-3244, 1973
Отсчет истории технологии рекомбинантных ДНК ведется с работы Коэна и др., которые показали, как, объединив генетические элементы из разных источников, можно создать новую реплицирующуюся генетическую структуру. Эту структуру Коэн и др. получили из автономно существующих в бактериальной клетке внехромосомных генетических элементов, называемых плазмидами. В своей предыдущей работе (Cohen, Chang. Proc. Natl. Acad. Sci. USA 70: 1293-1297, 1973; авторы получили маленькую плазмиду из более крупной природной, отррзая от последней случайные фрагменты и вводя их смесь в клетки Е. coli. Один из таких фрагментов размером около 1/10 размера исходной плазмиды «прижился» в бактериальной клетке как функционирующая плазмида. Чтобы исключить фактор случайности, присущий подобному подходу, и сделать процесс манипулирования генетическим материалом более управляемым, Коэн и др. решили использовать фермент (рестрицирующую эндонуклеазу), который расщепляет молекулу ДНК в строго определенном месте с образованием фрагментов с выступающими концами (липкими концами). Фрагменты разных молекул ДНК, обработанных одним и тем же ферментом, имели одинаковые липкие концы и при отжиге соединялись. Таким образом, если расщепить ДНК из разных источников одной и той же рестрицирующей эндонуклеазой, а затем смешать фрагменты, то образуются новые комбинированные молекулы ДНК, не существовавшие прежде. Коэн и др. не только смогли перенести ген из одной плазмиды в другую, но и показали, что этот ген остается биологически активным. К их чести, они в полной мере осознали, что данная стратегия «позволяет внедрять специфические нуклеотидные последовательности из прокариотической или эукариотической хромосомы или внехромосомной ДНК в независимо реплицирующуюся бактериальную плазмиду». Другими словами, любой ген, взятый из любого организма, теоретически можно встроить в плазмиду, которая будет размножаться в клетке-хозяине, и при этом, возможно, будет синтезироваться белок, кодируемый клонированным геном. Проиллюстрировав возможность клонирования генов, Коэн и др. создали экспериментальную базу для технологии рекомбинантных ДНК, показали, что плазмиды могут служить носителями и векторами клонированных генов. Последующие работы очень скоро привели к созданию более сложных векторов и стратегий клонирования. Все это вызвало серьезную озабоченность относительно безопасности и этичности подобных экспериментов, и чтобы снять обеспокоенность общественности, были разработаны официальные инструкции и созданы правительственные органы, регламентирующие работы с рекомбинантными ДНК. Завершая перечень тех последствий, к которым привела публикация работы Коэна и др., отметим, что она самым непосредственным образом повлияла на становление молекулярно-биотехнологической индустрии.
НАДЕЖДЫ И ОПАСЕНИЯ
С молекулярной биотехнологией человечество связывают самые большие надежды:
- возможность точной диагностики, профилактики и лечения множества инфекционных и генетических заболеваний
- значительное повышение урожайности сельскохозяйственных культур путем создания
- растений, устойчивых к вредителям, грибковым и вирусным инфекциям и вредным воздействиям окружающей среды
- создание микроорганизмов, продуцирующих различные химические соединения, антибиотики, полимеры, аминокислоты, ферменты
- создание пород сельскохозяйственных и других животных с улучшенными наследуемыми признаками
- переработка отходов, загрязняющих окружающую среду.
Обсуждать все блага, которые нас ожидают, легко и приятно, но одновременно нельзя забывал о последствиях, к которым может привести столь бурное развитие молекулярной биотехнологии. Эта новая отрасль раскинула свои сети так широко, что общество вправе получить ответы на свои вопросы:
- не будут ли организмы, полученные методами генной инженерии, оказывать вредное воздействие на другие живые организмы или на окружающую среду?
- не приведет ли создание и распространение генетически модифицированных организмов к уменьшению природного генетического разнообразия?
- правомочно ли, используя генноинженерные методы, изменять генетическую природу человека?
- не нарушит ли применение новых диагностических методов прав человека на неприкосновенность частной жизни?
- следует ли патентовать животных, полученных генноинженерными методами?
- не будет ли активное финансирование молекулярной биотехнологии сдерживать развитие других важных технологий?
- не приведет ли стремление к получению максимальной прибыли к тому, что преимуществами молекулярной биотехнологии смогут воспользоваться только состоятельные люди?
- не нанесет ли молекулярная биотехнология ущерб традиционному сельскому хозяйству?
- не вытеснят ли подходы к лечению, основанные на достижениях молекулярной биотехнологии, традиционные, столь же эффективные методы лечения?
- не помешает ли борьба за приоритеты свободному обмену идеями между учеными?
Эти и многие другие вопросы рассматривают правительственные комиссии, активно обсуждают на конференциях и в научных публикациях ученые, о них глубокомысленно рассуждают авторы популярных изданий. На этой широчайшей основе были сформулированы соответствующие правила и инструкции, написаны руководства и выработаны политические решения. В этом принимали участие и ученые, и общественность, но некоторые противоречия все же остались.
За рекордно короткое время молекулярная биотехнология превратилась в многопрофильное научное предприятие, в равной степени коммерческое и академическое. Ей посвящено огромное количество научных и деловых публикаций, в университетах всего мира студентам и аспирантам читают учебные курсы по молекулярной биотехнологии. Об энтузиазме, с которым написан отчет Отдела по оценкам новых технологий США за 1987 г., свидетельствует следующее заявление: «Молекулярная биотехнология знаменовала собой еще одну революцию в науке, которая могла бы изменить жизнь и будущее... людей так же радикально, как это сделала Промышленная революция два века назад и компьютерная революция в наши дни. Возможность целенаправленного манипулирования генетическим материалом... обещает великие перемены в нашей жизни».
ЗАКЛЮЧЕНИЕ
В 1973 г. Стэнли Коэн и Герберт Бойер с сотрудниками разработали способ переноса генетической информации из одного организма в другой. Этот метод, получивший название технологии рекомбинантных ДНК, позволил ученым выделять конкретные гены и вводить их в организм нового хозяина. Технология рекомбинантных ДНК стимулировала развитие различных областей науки, но прежде всего она создала необходимые предпосылки для появления биотехнологии.
Биотехнология в значительной мере нацелена на получение с помощью микроорганизмов продуктов, имеющих коммерческую ценность. До эпохи рекомбинантных ДНК самым эффективным методом повышения продуктивности организмов был мутагенез с последующей селекцией оптимального штамма-продуцента. Это длительный, трудоемкий, высокозатратный и небезошибочный процесс, позволяющий улучшить лишь немногие из присущих природному организму свойств. В то же время технология рекомбинантных ДНК – это быстродействующий, эффективный, мощный инструмент, обеспечивающий создание микроорганизмов с заранее заданными генетическими характеристиками. Более того, этот инструмент может работать не только с микроорганизмами, но также с растениями и животными. Союз технологии рекомбинантных ДНК и биотехнологии породил очень динамичную, исключительно интересную дисциплину – молекулярную биотехнологию.
Молекулярная биотехнология сразу захватила воображение общества. При участии частного капитала было создано много мелких компаний, занимающихся генным клонированием (технологией рекомбинантных ДНК). Правда, на то, чтобы предложить свою продукцию рынку, этим компаниям потребовалось времени несколько больше, чем ожидалось, но уже сейчас множество биотехнологических продуктов имеется в продаже и еще больше появится в ближайшем будущем.
Молекулярная биотехнология скрупулезно изучалась на предмет возможных негативных последствий ее распространения для человечества, поскольку спектр ее воздействия неограниченно широк. Рассматривались такие волнующие общественность вопросы, как безопасность экспериментов, негативное влияние на окружающую среду, патентование организмов, полученных генноинженерными методами.

