Для получения гетерологичных рекомбинантных белкод с клонированной эукариотической комплементарной ДНК (кДНК) обычно используются прокариотические системы экспрессии. Однако в некоторых случаях эукариотические белки, синтезированные в бактериях, оказываются нестабильными или биологически неактивными. Кроме того, как бы тщательно ни проводилась очистка, конечный продукт может быть загрязнен токсичными веществами или веществами, вызывающими повышение температуры у человека и животных (пирэгенами). Чтобы решить эти проблемы, для получения рекомбинантных белков, предназначенных для использования в медицине, были разработаны эукариотические системы экспрессии. Такие белки должны быть идентичны природным по своим биохимическим, физическим и функциональным свойствам. Неспособность прокариот синтезировать аутентичные варианты белков обусловлена в основном отсутствием у них адекватных механизмов внесения специфических посттрансляционных модификаций.
Белки в клетках эукариот претерпевают следующие посттрансляционные изменения.
- Обра ювание дисульфидных связей. Эту реакцию катализирует фермент дисульфидизомераза. Неправильно уложенный белок оказывается нестабильным и неактивным.
- Протеолитическое расщепление предшественника, удаление определенного участка полипептидной цепи с образованием функционально активного белка.
- Гликозилирование: основная модификация, благодаря которой белки приобретают стабильность, а в некоторых случаях – особые свойства. Наиболее распространенная реакция гликолизирования – это присоединение специфического сахарного остатка либо к серину или треонину (О-гликозилирование), либо к аспарагину (N-гликолизирование).
- Модификации аминокислот в составе белка: фосфорилирование, ацетилирование, ацилирование, гамма-карбоксилирование, сульфатирование, миристилирование и пальмитоилирование.
Из всех этих модификаций прокариотические хозяйские клетки наименее всего способны осуществлять правильное гликозилирование и модификацию специфических аминокислот в гетерологичном белке. Однако ни одна эукариотическая система не может осуществить одновременно все посттрансляционные изменения в каждом потенциальном гетерологичном белке. Таким образом, для получения белка с полным набором специфических модификаций необходимо провести тестирование различных эукариотических систем экспрессии и найти такую, которая воспроизводила бы биологически аутентичный продукт.
Эукариотические экспрессирующие векторы имеют такую же структуру, что и их прокариотические аналоги (рис. 7.1), и должны содержать:
- эукариотический селективный маркер
- эукариотический промотор
- соответствующие эукариотические сайты терминации транскрипции и трансляции
- сигнал гюлиаденилирования мРНК.
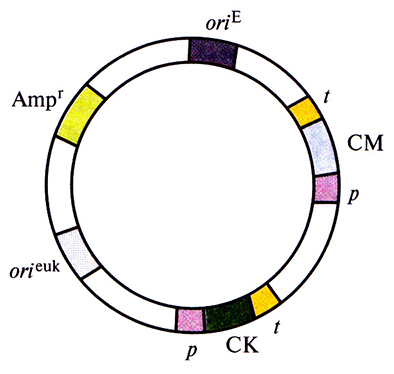
Рис. 7.1. Обобщенная структура эукариотического экспрессирующего вектора. Его основные элементы: эукариотический транскриптон с промотором (p), сайтом клонирования (СК) и сигналами терминации и полиаденилирования (t); эукариотический селективный маркер (СМ); сайт инициации репликации, функционирующий в клетках эукариот (ortcuk)-, сайт инициации репликации, функционирующий в Е. coli (ortЕ); селективный маркер Е. coli (Ampr).
Если вектор представляет собой плазмиду, реплицирующуюся независимо от хромосомы, то он должен содержать сайт инициации репликации, функционирующий в хозяйской клетке. Если же вектор предназначен для встраивания в хозяйскую хромосомную ДНК, то для обеспечения рекомбинации он должен нести последовательность, комплементарную определенному участку хромосомной ДНК хозяина (хромосомный сайт интеграции). Поскольку технически многие операции с рекомбинантными ДНК сложнее проводить в клетках эукариот, чем прокариот, большинство эукариотических векторов сконструированы как челночные. Другими словами, эти векторы несут два типа сайтов инициации трансляции и два типа селективных маркерных генов, одни из которых функционируют в Escherichia coli, а другие – в эукариотических хозяйских клетках. Такие векторные системы экспрессии разработаны для дрожжей, насекомых и клеток млекопитающих.
Введение ДНК в бактериальные и дрожжевые клетки называется трансформацией. В микробиологии этот термин используется для описания наследственных изменений в результате внедрения (приобретения) экзогенной (чужеродной) ДНК. А применительно к животным клеткам трансформация обозначает изменение характера их роста в культуре, обусловленное превращением нормальных клеток в раковые. Чтобы избежать путаницы в терминологии, для обозначения наследственных изменений в животных клетках после введения в них экзогенной ДНК был выбран термин трансфекция.
Для трансформации дрожжей обычно используют три способа. В первом случае экзогенную ДНК добавляют к клеткам дрожжей, клеточные стенки которых удалены химически или энзиматически (протопласты) (1). В других случаях клетки перед добавлением чужеродной ДНК обрабатывают ацетатом лития (2) или подвергают электропорации (3). Трансфекцию культур животных клеток осуществляют инкубацией клеток с ДНК, осажденной фосфатом кальция или ДЕАЕ-декстраном (1), либо электропорацисй в присутствии очищенной трансфицирующей ДНК (2). Как уже упоминалось в гл. 4, электропорация заключается в воздействии на клетки коротких мощных импульсов электрического тока, вследствие чего в наружной мембране или клеточной стенке образуются временные поры, через которые в клетку может проникнуть ДНК. В некоторых эукариотических системах для доставки ДНК в репипиентные клетки используют вирусы.
СИСТЕМЫ ЭКСПРЕССИИ SACCHAROMYCES CEREVISIAE
Для экспрессии клонированных эукариотических генов интенсивно используют обычные дрожжи Saccharomyces cerevisiae. Тому есть несколько причин. Во-первых, это одноклеточный организм, генетика и физиология которого детально изучены и который можно выращивать как в небольших лабораторных колбах, так и в промышленных биореакторах. Во-вторых, выделены и охарактеризованы несколько сильных промоторов этих дрожжей, а для систем эндогенных дрожжевых экспрессирующих векторов могут использоваться природные, так называемые 2 мкм-плазмиды. В-третьих, в клетках S. cerevisiae осуществляется большое число посттрансляционных модификаций. В-четвертых, лишь очень немногие из собственных дрожжевых белков секретируются в среду; таким образом, если гетерологичный белок секретируетсяклеткой, то его очистка не составит большого труда. В-пятых, поскольку дрожжи уже многие годы используют в хлебопечении и пивоварении, Департамент по контролю за качеством пищевых продуктов, медикаментов и косметических средств (США) включил S. cerevisiae в список «организмов, признаных безопасными» (GRAS, generally recognized as safe). Таким образом, использование этих организмов для получения белков, применяемых в медицине, не требует дополнительных экспериментов, необходимых при работе с неразрешенными к применению микроорганизмами. Некоторые белки, синтезированные в S. cerevisiae, уже применяются в качестве вакцин и фармацевтических препаратов, а также для диагностики (рис. 7.2).

Рис. 7.2. Рекомбинантные белки, синтезируемые в системах экспрессии S. cerevisiae. HIV-1 – вирус иммунодефицита человека I типа.
Векторы для S. cerevisiae
Существует три типа экспрессирующих векторов для S. cerevisiae. 1) эписомные, или плазмидные векторы; 2) интегрирующие векторы, 3) искусственные дрожжевые хромосомы (YAC). Плазмидные векторы уже широко использовались для получения как секретируемых, так и несекретируемых гетерологичных белков. Однако системы экспрессии, основанные на использовании плазмид, зачастую оказываются нестабильными при выращивании клеток в больших объемах (≥10 л). Стратегия с использованием векторов второго типа пока не получила широкого распространения, несмотря на то что в результате интеграции экспрессирующего вектора или транскриптона в хромосомную ДНК получается стабильный рекомбинантный организм. Причиной этого служит то, что число копий клонированного гена ограничивается одной на хромосому, иными словами, конечный выход белка невысок. Можно было бы использовать тандемные последовательности генов, но они часто оказываются нестабильными. Поэтому исследователи остановились на плазмидных векторах с одним клонированным геном, но попытались изменить условия роста, с тем чтобы повысить стабильность плазмид.
Искусственные дрожжевые хромосомы (YAC) предназначены для клонирования больших фрагментов ДНК (100 т. п. н.), которые затем поддерживаются в дрожжевой клетке как отдельные хромосомы. YAC-система чрезвычайно стабильна. С ее помощью проводили физическое картирование геномной ДНК человека и анализ больших транскриптонов, создавали геномные библиотеки, содержащие ДНК индивидуальных хромосом человека. YAC-вектор напоминает хромосому, поскольку он содержит последовательность, функционирующую как сайт инициации репликации ДНК (автономно реплицирующуюся последовательность), сегмент центромерной области дрожжевой хромосомы и последовательности, образующиеся на обоих концах при линеаризации ДНК и действующие как теломеры, обеспечивающие стабильность хромосомы (рис. 7.3). При встраивании чужеродной ДНК в YAC может происходить нарушение рамки считывания маркерного дрожжевого гена. В результате продукт этого гена не образуется, и при выращивании клеток на специальной среде можно наблюдать цветную реакцию. Кроме того, некоторые YAC-векторы несут селективный маркер, независимый от сайта клонирования. Несмотря на все преимущества, YAC пока не использовались для промышленного синтеза гетерологичных белков.
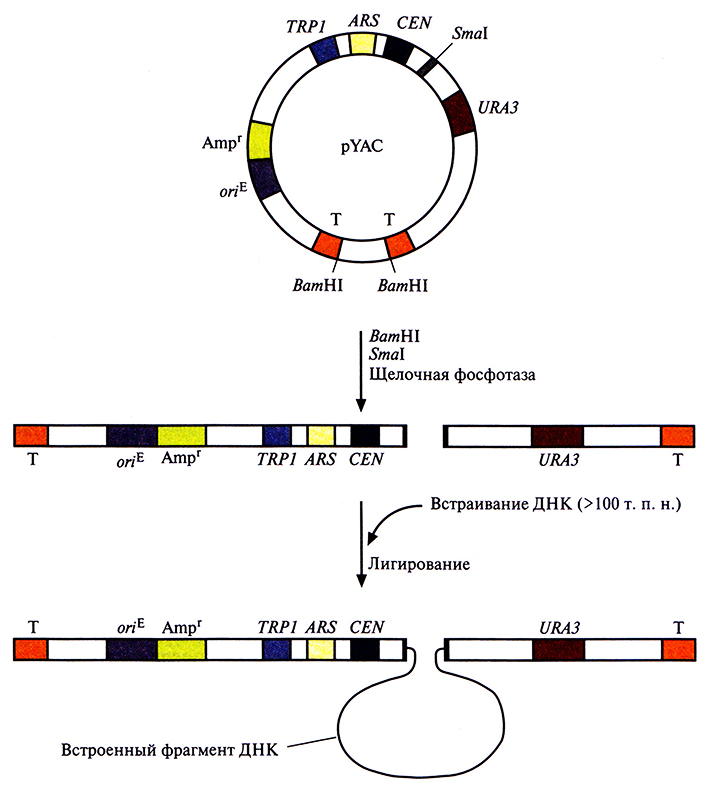
Рис. 7.3. YAC-система клонирования. YAC-плазмида (pYAC) содержит селективный маркерный ген Е. coli (Аmрr); сайт инициации репликации, функционирующий в Е. coii (oriE); сегмент дрожжевой ДНК, включающий участки URA3, CEN, TRP1 и ARS (CEN – последовательность, выполняющая центромерную функцию, ARS – дрожжевая автономно реплицирующаяся последовательность, эквивалентная дрожжевому сайту инициации репликации, URA3 – один из генов биосинтеза урацила, TRPl – один из генов биосинтеза триптофана). Т – это теломерные области дрожжевой хромосомы, Smal – сайт, по которому осуществляется клонирование. pYAC сначала обрабатывают Smal, BamHl и щелочной фосфатазой, а затем сшивают с фрагментом ДНК длиной 100 т. п. н. Конечная генетическая конструкция содержит клонированную ДНК и может стабильно поддерживаться в дрожжевых клетках Ura– Trр–
Прямая экспрессия в S. cerevisiae
Термин «прямая экспрессия» применяется для описания векторных систем, при использовании которых синтезированные белки аккумулируются в цитоплазме хозяйской клетки. Несколькими группами исследователей были разработаны различные экспрессирующие дрожжевые векторы, но все они имеют сходные основные черты. Мы рассмотрим процесс экспрессии чужеродного гена в S. cerevisiae на примере синтеза фермента супероксид-дисмутазы человека.
Супероксиданион – это побочный продукт утилизации кислорода аэробными организмами. У человека он участвует в стимуляции иммунного ответа фагоцитов и направлении лейкоцитов к месту инфекции. Однако избыток данного соединения и его производных может вызывать повреждение клеток. В минимизации потенциального цитотоксического воздействия таких веществ и принимает участие цитоплазматический фермент Cu/Zn-супероксид-дисмутаза (Cu/Zn-SOD); он катализирует связывание супероксид-аниона и иона водорода с образованием пероксида водорода, который в свою очередь служит субстратом для каталазы или пероксидазы. Супероксид-анион образуется также при повторной перфузии органа, кровоснабжение которого было прекращено перед хирургическим вмешательством. Чтобы избежать повреждения клеток супероксид-анионом, исследователи предложили перед повторной перфузией вводить в орган Cu/Zn-SOD. Cu/Zn-SOD может использоваться также для лечения таких воспалительных заболеваний, как остеоартрит, ревматоидный артрит, склеродермия и болезнь Бехтерева. При этом в обоих случаях лучше использовать белок, аутентичный Cu/Zn-SOD человека, для того чтобы избежать любых нежелательных иммунных реакций, которые могут возникнуть при введении фермента от других видов.
Первоначально кДНК Cu/Zn-SOD человека была клонирована в системе экспрессии Е. coli. Но в этом случае от молекулы Cu/Zn-SOD только отщеплялся инициаторный N-концевой метионин – так, как это происходит со всеми белками, синтезируемыми в Е. coli, а следующая аминокислота (аланин) не ацетилировалась, как в клетках человека. Поэтому для получения аутентичного фермента кДНК Cu/Zn-SOD человека была встроена в дрожжевой эписомный вектор. Дрожжевые клетки не способны эффективно вырезать интроны, поэтому для кодирования специфичных генных продуктов необходимо использовать соответствующие кДНК или химически синтезированные последовательности. Дрожжевой вектор с кДНК Cu/Zn-SOD человека (рис. 7.4) содержал: 1) дрожжевой ген биосинтеза лейцина (LEU2); 2) сегмент 2мкм-плазмиды с сигналом инициации репликации ДНК дрожжей, что обеспечивало репликацию плазмиды в дрожжевых клетках; 3) селективный маркер – Е. coli-ген устойчивости к ампициллину (Аmрr) и сайт инициации репликации, активный в Е. coli, что позволяет осуществлять стандартные генноинженерные манипуляции, необходимые для создания плазмиды, в клетках Е. coli', 4) кДНК Cu/Zn-SOD человека, встроенную между промотором дрожжевого гена глицеральдегидфосфатдегидрогеназы (GAPDp) и последовательностью, содержащей сигналы терминации транскрипции и полиаденилирования мРНК того же гена (GAPDt).
Этим вектором трансформировали штамм дрожжей, не способный к синтезу лейцина (LEU2-), и высевали их на среду без лейцина. В этих условиях могут расти только клетки с функционирующим LEU2-геном, находящимся в векторе. GAPD-промотор не регулируется, транскрипция с него происходит непрерывно. Поэтому кДНК Cu/Zn-SOD человека транскрибируется в течение всего периода роста (конститутивно). В этом эксперименте в дрожжевых клетках накапливались большие количества Cu/Zn SOD, в котором, подобно нативному белку из клеток человека, аминогруппа N-концевого остатка аланина была ацетилирована.
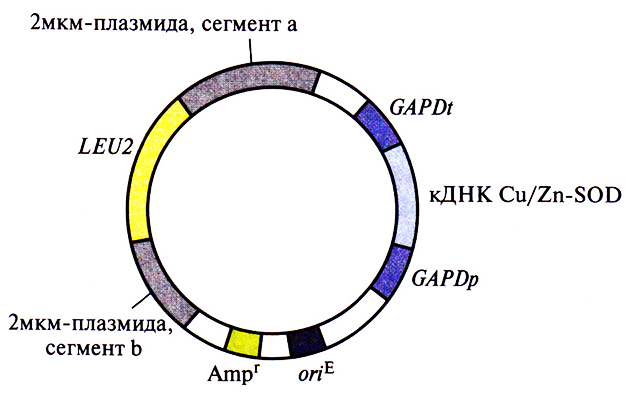
Рис. 7.4. Экспрессирующий вектор S. cerevisiae. Между промотором (GAPDp) и сигналом терминации-полиаденилирования (GAPDt) гена глицеральдегидфосфатдегидрогеназы S. cerevisiae встроена кДНК Cu/Zn-SOD человека. Ген LEU2, встроенный в середину дрожжевой 2мкм-плазмиды, кодирует один из ферментов биосинтеза лейцина. Ген устойчивости к ампициллину (Ampr) и сайт инициации репликации Е. coli (oriE) переклонированы из плазмиды pBR322.
Секреция гетерологичных белков, синтезируемых S. cerevisiae
В дрожжевых клетках гликозилируются только секретируемые белки, поэтому для получения рекомбинантных белков, которые для перехода в активную форму должны подвергнуться N- или О-гликозилированию, необходимо использовать системы секреции. Для этого перед кДНК, которая кодирует интересующий исследователя белок, нужно поместить так называемый пре-про-α-фактор – лидерную (сигнальную) последовательность гена α1 фактора спаривания дрожжей. Синтезируемый рекомбинантный белок сможет в этом случае эффективно секретироваться дрожжами.
Во время транспорта белка в нем образуются дисульфидные связи, происходят протеолитическое расщепление и другие посттрансляционные модификации, так что в некоторых случаях в среду попадает уже активный белок. Лидерный пептид обеспечивает проникновение белка через цитоплазматическую мембрану и секрецию, при этом сам он отщепляется дрожжевой эндопротеиназой, узнающей дипептид Lys-Arg. Поэтому кодоны Lys и Arg должны располагаться непосредственно перед кДНК, так чтобы после отщепления сигнального пептида синтезированный белок содержал на N-конце нужный аминокислотный остаток.
Используя эписомный экспрессирующий вектор с сигнальной последовательностью α-фактора, удалось получить правильным образом модифицированный, биологически активный белок гирудин: он синтезировался и секретировался штаммом S. cerevisiae. Ген гирудина был выделен из клеток беспозвоночного – пиявки Hirudo medicinalis. Этот белок является мощным антикоагулянтом и не вызывает нежелательных иммунологических реакций у человека. Его можно получать в активной форме в больших количествах, что упростило исследование его способности разрушать сгустки венозной крови и устранять другие проявления тромбоза. К сожалению, клинические исследования 12 142 больных, у 4131 из которых имелись сердечнососудистые заболевания, выявили лишь незначительные преимущества рекомбинантного гирудина перед гепарином. Эти преимущества не могут компенсировать высокую стоимость рекомбинантного гирудина, так что его широкое использование в клинике представляется маловероятным.
Чтобы повысить эффективность секреции рекомбинантных белков штаммами S. cerevisiae, были предприняты дальнейшие исследования. Так, попытались выяснить, способствует ли повышению выхода рекомбинантного белка суперэкспрессия такого природного фермента системы секреции, как дисульфидизомераза, которая обеспечивает правильную укладку белковой молекулы в процессе секреции. Для этого в хромосому S. cerevisiae встроили ген дрожжевой дисульфидизомеразы, находящийся под контролем конститутивного промотора глицеральдегидфосфатдегидрогеназы и сигнала терминации транскрипции. Уровень синтеза дисульфидизомеразы модифицированным штаммом был в 16 раз выше по сравнению со штаммом дикого типа. Далее в штамм – суперпродуцент дисульфидизомеразы ввели внехромосомный экспрессирующий вектор, несущий ген фактора роста тромбоцитов В человека. Количество секретируемого этим штаммом тромбоцитарного фактора роста в человека превысило в 10 раз количество фактора, секретируемого штаммом с нормальным уровнем синтеза дисульфидизомеразы. Суперпродукция дисульфидизомеразы повышает секрецию белков только с дисульфидными связями. Изменение других белков дрожжевой системы секреции может повысить количество секретируемых рекомбинантных белков с другими требованиями к укладке белковой молекулы.
ДРУГИЕ ДРОЖЖЕВЫЕ СИСТЕМЫ ЭКСПРЕССИИ
С помощью систем экспрессии S. cerevisiae удалось получить много разных рекомбинантных белков. К сожалению, в большинстве случаев уровень их экспрессии был довольно низким. Кроме того, обнаружились и другие проблемы.
- При увеличении масштабов системы часто происходит потеря плазмид, даже если используются индуцируемые промоторы.
- Гетерологичный белок зачастую оказывается гипергликозилированным и содержит более 100 остатков маннозы в каждой боковой олигосахаридной цепи, в то время как в нативных белках их содержится только от 8 до 13 на цепь. Наличие лишних маннозных остатков может изменять биологическую активность продукта или его иммуногенность.
- Во многих экспериментах белки, которые должны были секретироваться, на самом деле концентрировались в периплазматическом пространстве, что еще более осложняло их очистку.
Все это заставило ученых исследовать возможность получения гетерологичных белков с помощью других видов дрожжей и с использованием эукариотических систем. В частности, изучались соответствующие векторы – системы экспрессии, содержащие видоспецифичные регуляторные последовательности транскрипции и трансляции, возможность трансформации этих видов и получения высокого выхода белков и возможность крупномасштабного культивирования организма-хозяина. В качестве альтернативы S. cerevisiae можно использовать Kluyveromyces lactis, дрожжи, которые применяют для промышленного производства лактозы β-галактозидазы); Schizosaccharomyces pombe, дрожжи, размножающиеся делением, а не почкованием; Yarrowia lipolytica, которые используют алканы в качестве субстрата; Pichia pastoris и Hansenula polymorpha, которые могут использовать метанол как единственный источник углерода и энергии.
Синтез поверхностного антигена вируса гепатита В
Метилотрофные дрожжи P. pastoris можно без труда и больших затрат выращивать в промышленных биореакторах. Их использование в качестве организма-хозяина позволило бы увеличить выход активных продуктов – гетерологичных белков. Такой вывод можно сделать, рассмотрев в качестве примера получение поверхностного антигена вируса гепатита В (HBsAg) с помощью специально разработанной системы с использованием интегрирующего вектора. Сначала ген HBsAg встроили между промотором гена алкогольоксидазы 1 (AOXlp) и сигналом терминацииполиаденилирования (AOXlt) того же гена (рис. 7.5). Регуляция активности гена АОХl Р. pastoris осуществляется с помощью метанола. В его присутствии на долю алкогольоксидазы может приходиться до 30% всех белков клетки, а в отсутствие метанола алкогольоксидаза не синтезируется вообще.
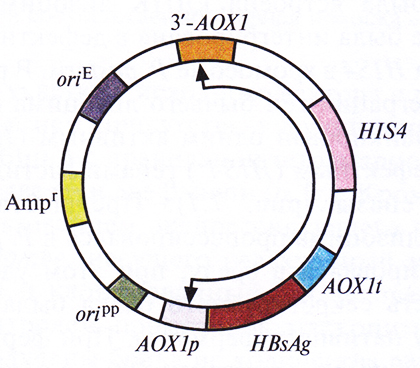
Рис. 7.5. Интегрирующий экспрессирующий вектор для P. pastoris. Между промотором (AOX1p) и сигналом терминации-полиаденилирования (AOX1t) гена алкогольоксидазы 1 P. pastoris встроен ген HBsAg. HIS4– ген, кодирующий один из ферментов биосинтеза гистидина, гистидинолдегидрогеназу. Кроме того, вектор содержит сайт инициации репликации Р. pastoris (оripp), ген устойчивости к ампициллину (Ampr) и сайт инициации репликации, активный в Е. coli (оriE). 3'-АОХ1 – это фрагмент З'-концевой последовательности гена алкогольоксидазы 1 P. pastoris. Стрелками указан сегмент, который интегрируется в геном P. pastoris.
Вектор (рис. 7.5), специально сконструированный для этих исследований, содержал следующие элементы: 1) блок AOX1p-HBsAg-AOX1t; 2) сайт инициации репликации, функционирующий в P. Pastoris;, 3) фрагмент ДНК, содержащий сайт инициации репликации плазмиды pBR322 и селективный маркер Е. coli; 4) фрагмент 3'-АОХ1, способствующий интеграции клонированной ДНК в определенный сайт хромосомы; 5) активный ген гистидинолдегидрогеназы (HIS4), кодируюший фермент, который участвует в синтезе аминокислоты гистидина. Наличие в этой конструкции последовательностей pBR322 позволяет использовать для работы с ней Е. coli, что облегчает клонирование и при необходимости позволяет получать большие количества векторной ДНК.
Чтобы предотвратить утрату плазмиды, была предусмотрена интеграция участка AOX1p-HBsAg-AOX1t в геном P. pastoris. Для этого штамм P. pastoris HIS4- с дефектным геном гистидинолдегидрогеназы трансформировали фрагментом вектора, содержащим элементы AOX1p-HBsAg-AOX1t, HIS4 и 3'-АОХ1 (рис. 7.5). В результате двойного кроссинговера между AOX1p и 3'-AOX1 введенной ДНК, с одной стороны, и комплементарными последовательностями хромосомной ДНК, с другой, произошла интеграция последовательностей AOX1p-HBsAg-AOX1t и HIS4 в геном, сопровождающаяся утратой хромосомного гена АОХ1 (рис. 7.6). Клетки, в геном которых включился ген HIS4, растут на среде без гистидина; этот признак может использоваться для их отбора. Вторым критерием отбора служит замедление роста клеток в присутствии метанола, поскольку после потери гена АОХl после двойного кроссинговера активным остается только один, менее эффективный ген АОХ2.
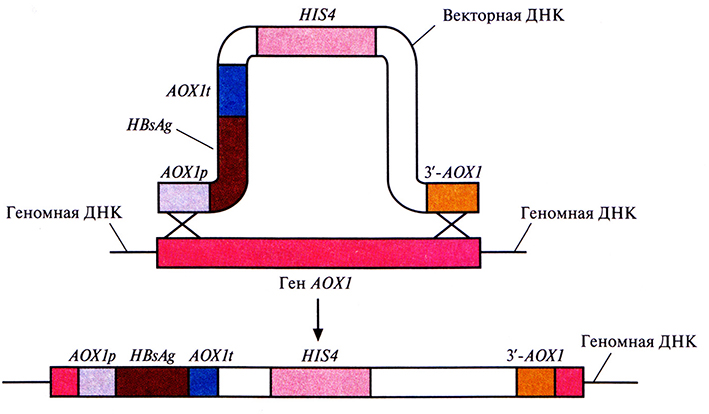
Рис. 7.6. Интеграция части экспрессируюгцего вектора в ген алкогольоксидазы 1 P. pastoris. В результате двойного кроссинговера между геном АОХ1 и участками AOX1p и 3'-АОХ1 (верхняя часть рисунка) происходит интеграция вектора в геномную ДНК и утрата большей части гена алкогольоксидазы 1 (АОХ1) хозяйской хромосомой (нижняя часть рисунка). Продукт гена HIS4 дает возможность клеткам расти на среде без гистидина. В присутствии метанола AOX1p активирует транскрипцию гена HBsAg, a AOX1t обеспечивает терминацию транскрипции и полиаденилирование.
Клон с интегрировавшим фрагментом AOX1p-HBsAg-AOX1t при росте в присутствии метанола, который активирует АOX1-промотор, синтезировал в больших количествах аутентичный белок HBsAg, накапливающийся в цитоплазме. Белковый продукт образовывал такой же мультисубъединичный комплекс, как и соответствующий белок в клетках человека, инфицированных вирусом гепатита В, и связывался с антителами к этому вирусу. При выращивании данного клона в 240-литровом ферментере периодического действия количества синтезируемого белка хватило бы примерно на 107 вакцинаций. При этом генетическая конструкция оставалась неизменной в течение 200 часов культивирования в присутствии метанола.
Синтез бычьего лизоцима С2
Способность P. pastoris секретировать гетерологичный белок исследовали в системе с использованием кДНК бычьего лизоцима С2, кодирующей полноразмерный белок и его собственный лидерный пептид. Бычий лизоцим – это желудочный фермент, разрушающий клеточные стенки бактерий; он устойчив к протеазам и сохраняет активность в узком диапазоне рН, что позволяет использовать его в качестве добавки к кормам жвачных животных для улучшения пищеварения.
Вектор, созданный для этого исследования, был идентичен вектору AOX1p-HBsAg-AOX1t, описанному выше, за исключением того, что вместо кодирующей последовательности HBsAg в него была встроена кДНК лизоцима. Вся плазмида была интегрирована в дефектную копию гена HIS4 в хромосоме P. pastoris. В результате интеграции ген бычьего лизоцима оказывался фланкирован одним активным (HIS4) и одним дефектным (IIIS4) генами гистидинолдегидрогеназы (рис. 7.7). Предшественник бычьего лизоцима процессировался в P. pastoris и секретировался в среду, при этом удельная активность секретируемого белка была такой же, как у нативного фермента. При ферментации 10 л культуры в течение 200 ч в непрерывном режиме при высокой плотности клеток синтезировалось примерно 20 г лизоцима.
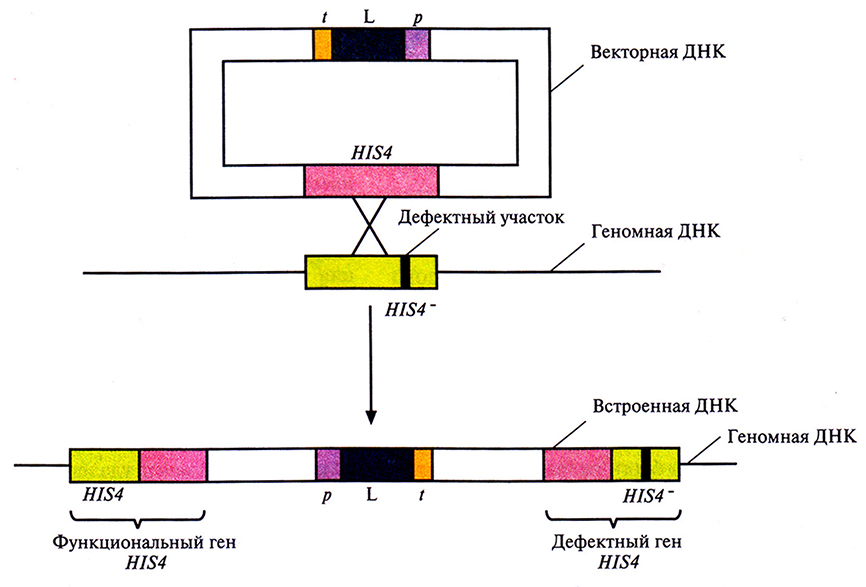
Рис. 7.7. Интеграция экспрессирующего плазмидного вектора в дефектный хромосомный ген HIS4– P. pastoris. В результате кроссннговера между плазмидным геном HIS4 и геном HIS4– клетки-хозяина происходит интеграция в геном всей плазмиды, которая оказывается фланкированной функциональным и дефектным генами HIS4. р, L и t – промотор АОХl, кДНК бычьего лизоцима С2 и сигнал терминации транскрипции-полиаденилирования соответственно. Черная полоска – дефектный участок в HIS4–-гене.
Аутентичные гетерологичные белки были получены и с помощью других дрожжевых систем. Например, кДНК α- и β-цепей гемоглобина А человека были встроены между промотором (MOXp) и сигналом терминации транскрипции (MOXt) гена метанолоксидазы Hansenula polymorpha и помещены друг за другом в экспрессирующий вектор. Через 40 генераций был взят изолят со случайно интегрировавшим участком исходного вектора и показано, что в нем присутствует функциональный гемоглобин А с правильной тетрамерной структурой: две α- и две β-цепи (α2β2). Кроме того, с использованием экспрессирующего вектора для S. pombe, несущего селективный маркерный ген и клонированный ген человека, оба под контролем промоторов млекопитающих, были получены большие количества рекомбинантных белков, кодируемых разными генами человека.
Дрожжевые системы экспрессии стали играть важную роль в получении гетерологичных белков для научных, промышленных и медицинских целей. Однако, как показали исследования, ни одна из них не может гарантировать получение аутентичного белка любого гена. По этой и ряду других причин были разработаны системы экспрессии генов с использованием клеток насекомых и млекопитающих.
СИСТЕМЫ ЭКСПРЕССИИ С ИСПОЛЬЗОВАНИЕМ КУЛЬТУР КЛЕТОК НАСЕКОМЫХ
Бакуловирусы инфицируют только беспозвоночных, в том числе многих насекомых. В ходе инфекционного процесса образуются две их формы. Одна представлена отдельными вирионами, которые высвобождаются из инфицированной клетки хозяина, как правило клетки средней кишки, и способны инфицировать другие клетки этого органа. Вторая состоит из множества вирионов, заключенных в белковый матрикс. Белок этого матрикса называется полиэдрином, а сама структура – полиэдроном. Синтез полиэдрина начинается через 36–48 ч после инфекции и продолжается 4–5 сут, пока зараженные клетки не лизируют и хозяйский организм не погибнет. После этого множество таких частиц высвобождается и попадает в среду, где от инактивации их защищает белковыйматрикс. Если восприимчивый хозяйский организм проглатывает такую частицу, то полиэдрин солюбилизируется и высвобождаются вирионы, способные инициировать новый инфекционный цикл.
Промотор гена полиэдрина чрезвычайно сильный, а цикл развития вируса не зависит от наличия самого гена. Следовательно, замена последнего геном чужеродного белка с последующей инокуляцией полученным рекомбинантным бакуловирусом культуры клеток насекомого может привести к синтезу большого количества гетерологичного белка, который благодаря сходству систем внесения посттрансляционных модификаций у насекомых и млекопитающих будет близок (а возможно, и идентичен) к нативной форме того белка, который интересует исследователя. Исходя из этого на основе бакуловирусов были разработаны векторы для экспрессии генов, кодирующих белки млекопитающих и вирусов животных.
Наиболее широко используется вирус множественного ядерного полиэдроза Autographa californica (AcMNPV). Этот бакуловирус инфицирует более 30 других видов насекомых, а также хорошо растет в культуре многих клеточных линий. Линии клеток, обычно использующиеся для работы с рекомбинантным AcMNPV, получают из гусениц Spodoptera frugiperda. Промотор полиэдрина в этих клетках чрезвычайно активен, и при их заражении бакуловирусом дикого типа синтезируются большие количества белка.
Система экспрессирующих векторов на основе бакуловирусов
Первый шаг в конструировании рекомбинантного бакуловируса AcMNPV состоит в создании транспортного вектора. Транспортный вектор – это производная плазмиды Е. coli, содержащая фрагмент ДНК AcMNPV (рис. 7.8), который включает:
1) промоторную область и расположенную перед ней последовательность ДНК AcMNPV, необходимую для гомологичной рекомбинации с AcMNPV; 2) сайт для клонирования; 3) сайт терминации-полиаденилирования гена полиэдрина и прилегающую к нему последовательность ДНК AcMNPV – вторую область, обеспечивающую гомологичную рекомбинацию с AcMNPV (рис. 7.8). Кодирующая последовательность гена полиэдрина из этого фрагмента удалена. Интересующий исследователя ген встраивают между промотором и сигналом терминации гена полиэдрина и вводят конструкцию в Е. coli.
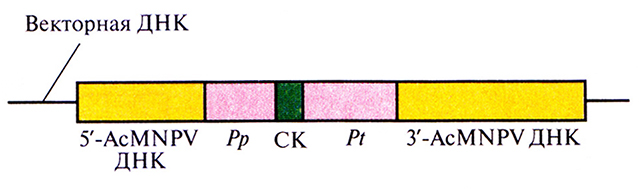
Рис. 7.8. Схематическое представление единицы экспрессии транспортного вектора на основе бакуловирусов (AcMNPV). Ген белка-мишени встраивают в сайт клонирования (СК) между промотором гена по лиэдрина (Рр) и сайтом терминации его транскрипции (Pt). Перед промотором и после сайта терминации транскрипции встраивают фрагменты ДНК AcMNPV (5'-AcMNPV ДНК и З'-AcMNPV ДНК соответственно), обеспечивающие интеграцию единицы экспрессии в ДНК AcMNPV за счет гомологичной рекомбинации в клетках насекомого.
Культуру клеток насекомого, трансфицирсванную ДНК AcMNPV, трансфицируют затем транспортным вектором, несущим клонированный ген. В некоторых дважды трансфицированных клетках происходит двойной кроссинговер, в результате которого клонированный ген вместе с промотором и сигналом терминации транскрипции гена полиэдрина встраивается в ДНК AcMNPV (рис. 7.9), замещая ген полиэдрина. Вирионы, не содержащие этого гена, образуют зоны клеточного лизиса, из которых можно выделить рекомбинантный бакуловирус.
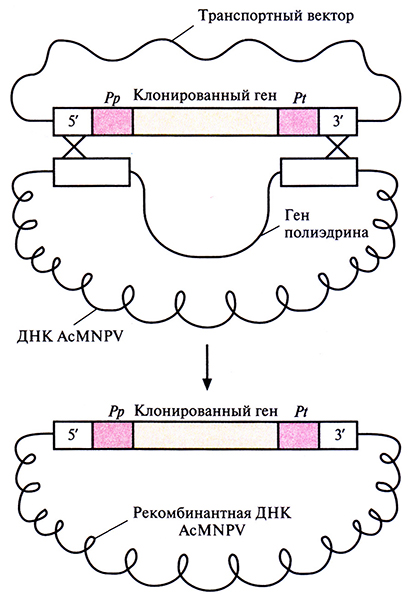
Рис. 7.9. Замещение гена полиэдрина AcMNPV единицей экспрессии транспортного вектора в результате двойного кроссинговера в 5'- и 3'-фрагментах.
Визуальная идентификация зон лизиса – утомительная и субъективная процедура. Вместо нее для обнаружения рекомбинантных бакуловирусов можно использовать ДНК-гибридизацию или полимеразную цепную реакцию (ПЦР). Кроме того, если под контроль промотора бакуловируса, активного с ранних и до поздних стадий литического цикла, поместить ген lacZ Е. coli, кодирующий β-галактозидазу, и такую конструкцию включить во фрагмент ДНК, встраивающийся в геном AcMNPV, то в присутствии хромогенного субстрата β-галактозидазы зоны с рекомбинантными вирусами окрасятся в синий цвет.
Гетерологичный белок, синтезируемый куль турой клеток насекомого-хозяина, зараженной рекомбинантным бакуловирусом, можно выделять через 4–5 сут. С помощью системы экспрессирующих векторов на основе бакуловирусов уже получено более 500 различных гетерологичных белков, при этом более 95% из них имели правильные посттрансляционные модификации (рис. 7.10).

Рис. 7.10. Некоторые рекомбинантные белки, синтезированные в системе экспрессирующих векторов на основе бакуловирусов. HIV-l – вирус иммунодефицита человека l типа; HSV – вирус простого герпеса.
Получение рекомбинантных бакуловирусов
Исходная методика получения рекомбинантных бакуловирусов в дальнейшем была изменена по ряду причин. Во-первых, применение промотора гена полиэдрина имеет ограничения: белки, синтезирующиеся на поздней стадии литического цикла, часто оказываются модифицированными не до конца. Для решения этой проблемы промотор гена полиэдрина заменили одним из сильных промоторов AcMNPV, активно функционирующих с самого начала и до конца литического цикла. Во-вторых, линеаризация генома AcMNPV перед трансфекцией клеток насекомого увеличивает долю зон лизиса с рекомбинантными вирусами. Расщепление генома AcMNPV в одном сайте уменьшает число зон с нерекомбинантными вирусами, потому что линеаризованные геномы бакуловирусов обладают ограниченной инфицирующей способностью. В результате двойного кроссинговера между линеаризованной ДНК AcMNPV и кольцевым транспортным вектором образуется замкнутая кольцевая молекула, которая обладает инфицирующей способностью. Чтобы обеспечить стабильную линеаризацию в каждом эксперименте, в геном AcMNPV дикого типа в ген полиэдрина встроили уникальный сайт для рестриктазы Bsu361. В результате доля зон лизиса с рекомбинантными бакуловирусами увеличилась с <1% (когда использовались нерасщепленные кольцевые молекулы AcMNPV) до примерно 30%.
ВАЖНАЯ ВЕХА
Синтез Р-глобина кролика в культуре почечных клеток обезьяны, инфицированных рекомбинантным SV40
R. С. Mulligan. В. Н. Howard, P. Berg Nature 111-. 108-114, 1979
На первый взгляд разработка любой эукариотической системы экспрессии представляется относительно простой процедурой, состоящей в подборе соответствующих регуляторных последовательностей, встраивании их в вектор в определенном порядке и клонировании гена-мишени таким образом, чтобы обеспечивалась его эффективная экспрессия. На практике же создание первого поколения эукариотических экспрессирующих векторов оказалось весьма кропотливым делом, основанным на методе проб и ошибок. До появления работы Муллигана, Хоуарда и Берга в векторы млекопитающих на основе SV40 было встроено множество разных генов, однако после введения их в хозяйские клетки зрелые функциональные мРНК не обнаруживались. Муллиган и др. встроили кДНК β-глобина кролика в один из генов SV40, из которого была удалена почти вся кодирующая область, но который содержал «все участки, отвечающие за инициацию и терминацию транскрипции, сплайсинг и полиаденилирование...» В клетках, трансфицированных этой генетической конструкцией, синтезировались и мРНК р– β-глобина кролика, и белок. По мнению авторов статьи, «основное новшество состояло в решении оставить неизмененной область вектора, участвующую в ...процессинге мРНК...» Это исследование показало, что эффективную эукариотическую систему экспрессии можно создать, поместив ген-мишень под контроль транскрипционных и трансляционных регуляторных последовательностей. В ходе дальнейших экспериментов были установлены все структурные особенности, которые должны быть присущи эукариотическим экспрессирующим векторам.
BsuЗ61-систему линеаризации далее модифицировали так, чтобы полнить сверхвысокую частоту рекомбинантных бакуловирусов. Для этого в геном AcMNPV внесли два BsuЗ61-сайта, по одному с каждой стороны гена полиэдрина (рис. 7.11). Один сайт находился в гене 603 (открытая рамка считывания 603 [ORF603]), а второй – в одном из генов (ORF1629), необходимых для репликации вирусной ДНК. При трансфекции клеток насекомого с помощью ДНК модифицированного бакуловируса, инкубированного с BsuЗ61, репликация вируса не происходила, поскольку отсутствовал фрагмент необходимого для этого гена (ORF1629). Далее был создан транспортный вектор, содержащий ген-мишень и, если это нужно, селективный маркерный ген между интактной копией гена 603 и необходимым для репликации геном. Таким вектором трансфицировали клетки насекомого, которые были предварительно трансфицированы линеаризованной ДНК AcMNPV с делецией участка между BsuЗб1-сайтами В результате двойного кроссинговера восстанавливалась функциональная форма ORF1629 и происходило включение клонированного гена в геном AcMNPV (рис. 7.11). С помощью этой системы доля зон лизиса, содержащих рекомбинантные бакуловирусы, была увеличена до 99%.

Рис. 7.11. Получение рекомбинантных бакуловирусов. В геном AcMNPV, а именно в ген 603 и ген ORF1629, необходимый для репликации бакуловируса в клетках насекомых, встраивают по одному BsuЗ61-сайту. Эти гены фланкируют ген полиэдрина AcMNPV. Инкубируют рекомбинантный бакуловирус с BsuЗ61, в результате чего выщепляется фрагмент, находящийся между Bsu361-сайтами. Трансфицируют клетки насекомого, несущие бакуловирус, который был обработан Bsu361, транспортным вектором с клонированным геном, фланкированным промотором (р) и сайтом терминации транскрипции (t) гена полиэдрина, а также с полноразмерным геном 603 и геном, необходимым для репликации. В результате двойного кроссинговера (пунктирные линии) образуется рекомбинантный бакуловирус с функционирующим геном, необходимым для репликации. Выход рекомбинантных бакуловирусов в такой системе составляет 99%.
Создание челночного вектора
на основе бакуловирусов для Е. coli и клеток насекомых
Разработана система, позволяющая осуществлять все генноинженерные манипуляции по созданию экспрессирующего вектора на основе бакуловируса в Е. coli. При этом трансфекция клеток насекомого нужна только для синтеза рекомбинантного белка. В системе используется фрагмент небольшой плазмиды Е. coli, фланкированный участками ДНК, расположенными с 5'- и 3'-концов гена полиэдрина. Он содержит ген устойчивости к канамицину, нуклеотидную последовательность, играющую роль сайта интеграции и встроенную в ген lacZ' без нарушения его функции, и сайт инициации репликации, активный в Е. coli. Интеграция плазмиды в геном AcMNPV происходит в результате двойного кроссинговера и сопровождается элиминацией гена полиэдрина (рис. 7.12, А). При этом образуется кольцевая ДНК, способная существовать в Е. coli как плазмида и ответственная за образование в трансфицированных клетках насекомого бакуловирусов. Челночные векторы на основе бакуловирусов для Е. coli и клеток насекомых называют бакмидами.
Система на основе бакмид позволяет создать еще одну плазмиду Е. coli, в которой между промотором и сайтом терминации гена полиэдрина встроен ген-мишень (плазмида-донор). В донорной плазмиде ген устойчивости к гентамицину и единица экспрессии гена-мишени фланкированы нуклеотидными последовательностями, которые связываются с сайтом интеграции в бакмиде, а ген устойчивости к ампициллину находится вне двух сайтов встраивания (рис. 7.12, Б). Рекомбинация между соответствующими сайтами в донорной плазмиде и бакмиде может происходить только в присутсивии специфичных белков (белков транспозиции), которые в этой системе кодируются третьей плазмидой Е. coli (плазмидой-помощницей), несущей еще и ген устойчивости к тетрациклину (рис. 7.12, Б).
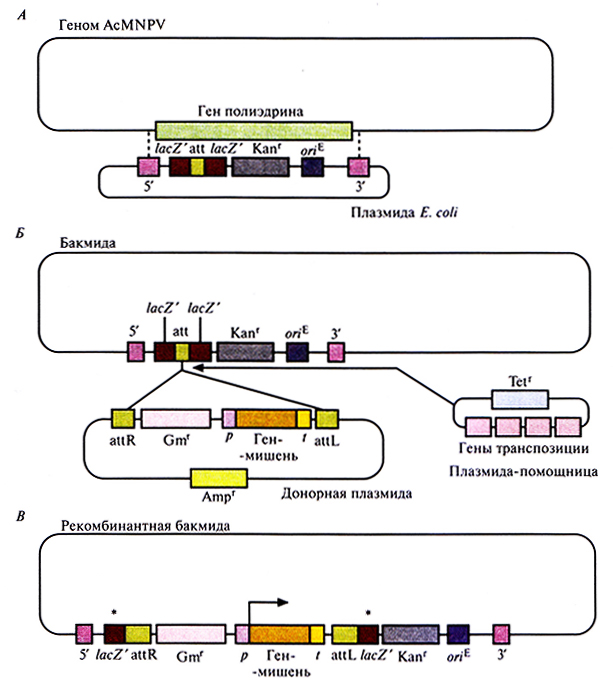
Рис. 7.12. Получение рекомбинантной бакмиды. А. Плазмиду Е. coli встраивают в-геном AcMNPV с помощью двойного кроссинговера (пунктирные линии) между сегментами ДНК (5' и 3'), фланкирующими ген полиэдрина, с образованием челночного вектора, способного к репликации как в Е. coli, так и в клетках насекомых. Встраиваемая плазмидная ДНК содержит ген устойчивости к канамицину (Каnг), сайт интеграции (att), клонированный без нарушения рамки считывания в последовательности lacZ', и сайт инициации репликации Е. coli (oriE). Б. Фрагмент донорной плазмиды, ограниченный двумя сайтами интеграции (attR и attL) и несущий ген устойчивости к гентамицину (Gmr) и ген-мишень под контролем промотора (р) и сайта терминации транскрипции (!) гена полиэдрина, встраивают в сайт интеграции (att) бакмиды с помощью белков транспозиции, кодируемых плазмидой-помощницей. Плазмида-помощница и донорная плазмида несут гены устойчивости к тетрациклину (Tetr) и ампициллину (Ampr) соответственно. В. Рекомбинантная бакмида содержит дефектный ген lacZ'(*). Угловой стрелкой обозначен сайт инициации транскрипции клонированного гена после трансфекции клеток насекомого рекомбинантной бакмидой.
Бактериальные клетки, несущие бакмиду, трансформируют одновременно плазмидой-пoмощницей и донорной плазмидой. В некоторых двойных трансформантах фрагмент ДНК, ограниченный двумя сайтами интеграции, встраивается в сайт интеграции бакмиды (рис. 7.12, Б и В). Встраивание фрагмента донорной плазмиды с единицей экспрессии и геном устойчивости к гентамицину в сайт интеграции бакмиды нарушает рамку считывания гена lacZ'. В результате бактерии, несущие рекомбинантные (со встройкой) бакмиды, образуют белые колонии в присутствии изопропил-β-D-тиогалактопиранозид а (ИПТГ) и 5-бром-4-хлор-3-индолил-β-D-галактопиранозида (X-Gal). Те из них, которые устойчивы к канамицину и чувствительны к ампициллину и тетрациклину, несут только рекомбинантную бакмиду, но не донорную плазмиду и плазмиду-помощницу. В наличии вставки клонированного гена после всех этих манипуляций можно убедиться при помощи ПЦР. Далее рекомбинантной бакмидой можно трансфицировать клетки насекомого, в которых произойдет транскрипция клонированного гена и синтез рекомбинантного белка.
Для создания экспрессирующих векторов на основе бакуловирусов использовались и другие подходы. Один из них предполагал проведение всех генноинженерных манипуляций с геномом AcMNPV в дрожжевых клетках с использованием челночного вектора для дрожжей и клеток насекомых с последующим введением рекомбинантного бакуловируса в клетки насекомого. В другом для создания конструкции «клонированный ген–геном AcMNPV» использовали систему рекомбинации in vitro, основанную на вырезании–встраивании ДНК бактериофага Рl, после чего такой конструкцией напрямую трансфицировали клетки насекомого.
Выделение рекомбинантного белка
из клеток насекомых с помощью аффинного связывания
Для выделения специфических гетерологичных белков из клеточных экстрактов и из смесей секретируемых белков можно использовать разные подходы. Один из них основывается на присоединении к клонированному гену – без нарушения рамки считывания – сегмента ДНК, кодирующего короткую аминокислотную последовательность, которая специфически связывается с каким-либо химическим элементом, соединением или макромолекулой. Такую конструкцию встраивают в экспрессирующий вектор между промотором и сайтом терминапии транскрипции. Короткая аминокислотная последовательность в составе рекомбинантного белка, синтезируемого в хозяйской клетке, играет роль аффинной метки. В одном случае перед клонированным геном был встроен – без нарушения рамки считывания – сегмент ДНК, кодирующий шесть остатков гистидина (His6), спейсерный участок, кодирующий семь аминокислот, и сайт расщепления протеиназы из шести аминокислот; получившийся рекомбинантный белок выделяли хроматографией на колонке с никельгарозой. Последовательность из шести остатков гистидина (гексагистидин) связывалась с ионами никеля, и рекомбинантный белок задерживался в колонке. Его элюировали добавлением конкурирующего соединения (например, имидазола), который вытеснял гексагистидин рекомбинантного белка из комплекса с ионами никеля, или понижением рН буфера для элюпии. Аффинную метку отщепляли с помощью протеолитического фермента (протеиназы) и очищали рекомбинантный белок от нее и от протеиназы хроматографическими методами. Если рекомбинантный белок не предполагается использовать в медицинских целях, можно и не отщеплять гексагистидиновую последовательность, поскольку обычно она не влияет на структуру и функцию белка.
Было разработано несколько аффинных меток. Среди них – глутатионтрансфераза, белок, связывающий мальтозу, и короткие аминокислотные последовательности – антигенные детерминанты, которые связываются соответственно с глутатионом, мальтозой и специфическими антителами. Использовали и разные сайты расщепления, специфичные для тромбина, энтерокиназы и других протеиназ. Аффинная метка и сайт расщепления могут находиться как на N-, так и на С-конце рекомбинантного белка и использоваться в прокариотических системах экспрессии, а также в системах экспрессии на основе клеток насекомых, млекопитающих или грибов.
ЭКСПРЕССИРУЮЩИЕ ВЕКТОРЫ
ДЛЯ РАБОТЫ С КЛЕТКАМИ МЛЕКОПИТАЮЩИХ
Внехромосомные экспрессирующие векторы млекопитающих используются для изучения функций и регуляции генов млекопитающих. Кроме того, с их помощью могут быть получены аутентичные рекомбинантные белки, которые потенциально могут использоваться в медицинских целях для лечения некоторых заболеваний человека. Уже сконструированные экспрессирующие векторы млекопитающих весьма многочисленны, но все они обладают сходными свойствами и похожи на другие эукариотические экспрессирующие векторы.
Вектор, представленный на рис. 7.13, содержит эукариотический сайт инициации репликации вируса животных (например, обезьяньего вируса 40 [SV40]). Промсторы клонированного и селективного маркерного генов, а также их сигналы терминации транскрипции (сигналы полиаденилирования) должны происходить из клеток эукариот; обычно используют регуляторные последовательности ДНК вирусов животных (например, цитомеголовируса человека, SV40 или HSV) или генов млекопитающих (например, гена β-актина, металлотионеина, тимидинкиназы или бычьего гормона роста). При этом более предпочтительны сильные промоторы и эффективные сигналы полиаденилирования. Последовательности, необходимые для отбора и амплификации экспрессирующего вектора млекопитающих в Е. coli, происходят из стандартного клонирующего вектора Е. coli (например, плазмиды pBR322).
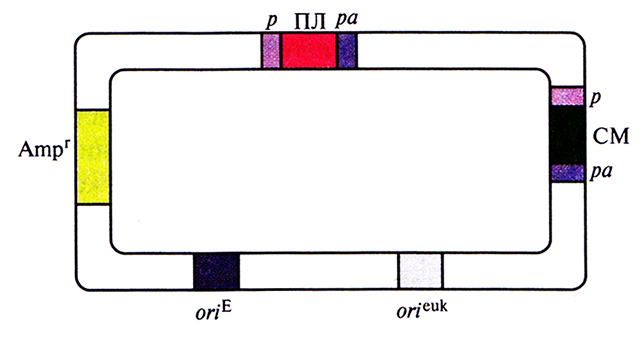
Рис. 7.13. Обобщенная схема экспрессирующего вектора млекопитающих. Полилинкер (ПЛ) и селективный маркер (СМ) находятся под контролем эукариотического промотора (р) и сигнала полиаденилирования (ра). Репликация вектора в Е. coli и в клетках млекопитающих обеспечивается сайтами инициации репликации oriE и oricuk соответственно Для отбора трансформированных клеток Е. coli используется ген устойчивости к ампициллину (Ampr)
Селективные маркерные гены
Для отбора трапсфицированных клеток млекопитающих часто используют бактериальный ген Neor, кодирующий неомицинфосфотрансферазу. В этой системе применяется токсичное соединение генетицин (G-418), блокирующее трансляцию в нетрансфицированных клетках млекопитающих. При этом в трансфицированных клетках G-418 фосфорилируется неомицинфосфотрансферазой и инактивируется. Следовательно, выживают и пролиферируюг только клетки, синтезирующие продукт гена Neor.
Другая система отбора трансфицированных клеток млекопитающих основана на использовании гена, кодирующего фермент дигидрофолатредуктазу (DHFR). В этой системе используют клетки с дефектным геном DHFR, т. е. клетки, в которых функциональная DHFR несинтезирулся. После трансфекции DHFR–-клеток экспрессирующим вектором млекопитающих с функционирующим DHFR-геном в среду добавляют метотрексат. Не трансфицированные клетки не растут в его присутствии, а клетки, синтезирующие дигидрофолатредуктазу, выживают. После предварительного отбора клеток с DHFR-геном концентрацию метотрексата в среде увеличивают и отбирают клетки с большим числом копий вектора, синтезирующие в большом количестве рекомбинантный белок.
Разработаны и другие схемы отбора с доминантным маркером, например с использованием фермента глутаминсинтетазы (GS), обеспечивающей устойчивость к цитотоксическому действию метионинсульфоксимина. В этой системе применяется вектор, несущий GS-ген. Его вводят в культуру клеток млекопитающих и для отбора клеток, несущих большое количество копий вектора, повышают концентрацию метионинсульфоксимина в среде. При этом в хозяйских клетках тоже должна присутствовать GS, поскольку только множественные копии GS-reнa могут обеспечивать устойчивость к метионинсульфоксимину. Такая схема обладает определенными преимуществами перед описанной выше.
В экспрессирующие векторы млекопитающих уже встроены гены самых разных белков и осуществлена их экспрессия в хозяйских клетках. Иногда выход продукта увеличивался, если между промотором и клонированным геном встраивали интрон. Механизм этого феномена неизвестен. Возможно, первичный транскрипт клонированного гена содержит скрытые сайты сплайсинга, по которым вырезается часть кодирующей области клонированного гена, а при наличии дополнительного интрона сплайсинг по ним происходит с меньшей вероятностью.
Высокий уровень экспрессии клонированного гена достигался при ее координации с экспрессией селективного маркерного гена. Для этого, например, ген DHFR встраивали поблизости от клонированного гена, так чтобы оба гена находились под контролем одного промотора и имели общий сигнал полиаденилирования, а ген DHFR был фланкирован сайтами сплайсинга интрона. DHFR и рекомбинантный белок транслировались с первичного транскрипта и сплайсированной мРНК соответственно (рис. 7.14).
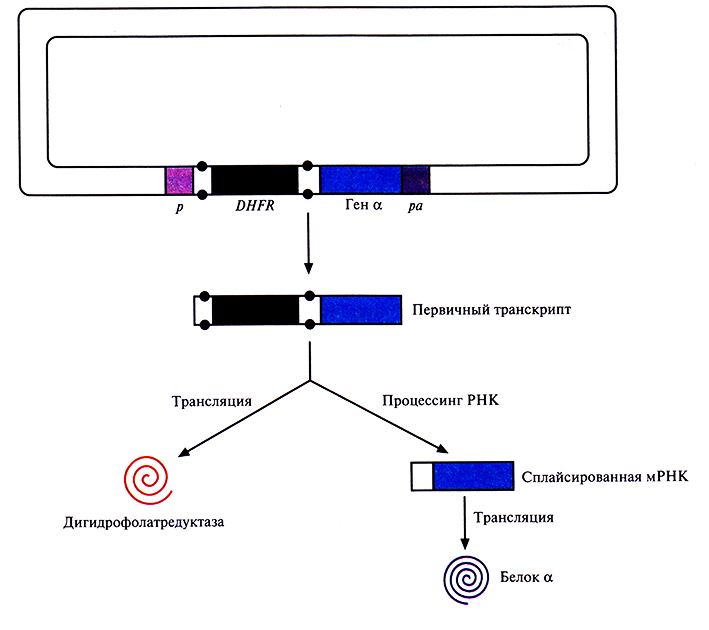
Рис. 7.14. Координированная экспрессия генов дигидрофолатредуктазы (DHFR) и рекомбинантного белка. Ген DHFR встроен между донорным и акцепторным сайтами сплайсинга интрона (точки), перед геном-мишенью (ген α) И ген DHFR, и клонированный ген находятся под контролем одного эукариотического промотора (р) и имеют общий сигнал полиаденилирования (pa). DHFR транслируется с несплайсированного (первичного) транскрипта, а гетерологичный белок (белок α) – с транскрипта, подвергшегося процессингу (сплайсингу).
Экспрессия двух клонированных генов
в одной клетке млекопитающих
Некоторые ценные в коммерческом отношении белки в активной форме состоят из разных полипептидных цепей. Например, тиреотропный гормон человека – это гетеродимер, а гемоглобин – тетрамер, состоящий из двух субъединиц, по две копии каждая (α2β2). Чтобы получить активный мультимерный белок, можно попытаться клонировать ген или кДНК каждой из субъединиц, синтезировать и очистить субъединицы, а затем смешать их в пробирке. Однако таким образом удается получить лишь немногие мультимерные белки, поскольку in vitro правильная укладка полипептидных цепей осуществляется редко. Сборка же димерных и тетрамерных белков in vivo протекает весьма эффективно. Поэтому были разработаны стратегии синтеза двух разных рекомбинантных белков в одной клетке.
Для этого хозяйские клетки одновременно трансфицировали двумя экспрессирующими векторами млекопитающих, каждый из которых нес ген или кДНК одной из субъединиц и разные гены селективных маркеров (рис. 7.15). Трансфицированные клетки подвергали двойному отбору, соответственно и выжившие клетки несли оба вектора. Системы с двумя векторами успешно использовались для синтеза аутентичных димерных и тетрамерных рекомбинантных белков. К сожалению, дважды трансфицированные клетки часто утрачивают один из двух векторов. Кроме того, число копий каждого из векторов не всегда одинаково, так что одна субъединица может синтезироваться в большем количестве, чем другая, и выход конечного продукта может снижаться. Чтобы решить эти проблемы, были сконструированы векторы, содержащие оба клонированных гена. В некоторых случаях они были помещены под контроль независимых промоторов и сигналов полиаденилирования (рис. 7.16). А для того, чтобы гарантировать синтез рекомбинантных белков в одинаковом количестве, были созданы так называемые двухцистронные векторы, в которых клонированные гены разделялись сегментом ДНК, содержащим внутренний сайт связывания рибосом. Такие сайты были обнаружены в геномах вирусов млекопитающих; они обеспечивают одновременную трансляцию различных белков с полицистронной мРНК. Транскрипция конструкции «ген-внутренний сайт связывания рибосом–ген» регулируется одним промотором и одним сигналом полиаденилирования. Синтезируется один транскрипт с двумя генами, трансляция начинается с 5'-конца мРНК и с внутреннего сайта, в результате синтезируются субъединицы димерного белка а и р (рис. 7.17).
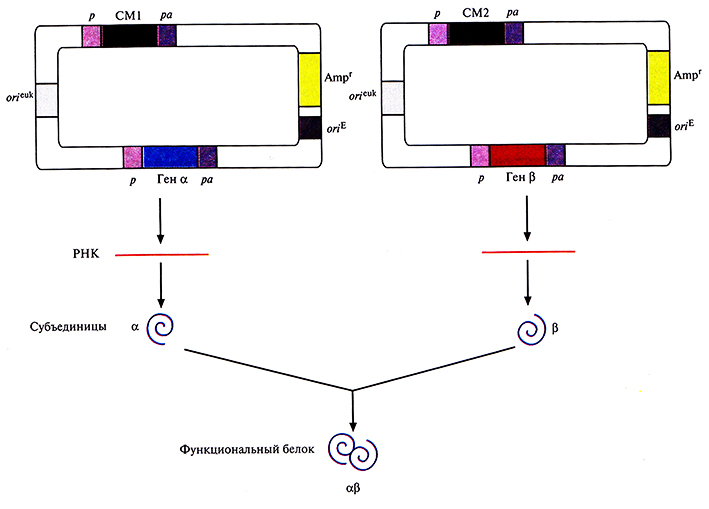
Рис. 7.15. Двухвекторная система экспрессии. Клонированные гены (α и β) кодируют субъединицы димерного белка (αβ). После одновременной трансфекции клетки двумя плазмидами в ней синтезируются обе субъединицы и собирается функциональный димерный белок. Оба вектора несут сайты инициации репликации, функционирующие в Е. coli (oriE) и в клетках млекопитающих (orfuk); маркерный ген (Ampr) для отбора трансформированных клеток Е. colil; эукариотический промотор (р) и сигнал полиаденилирования (ра), которые регулируют экспрессию селективного маркерного гена (СМ) и каждого из клонированных генов.
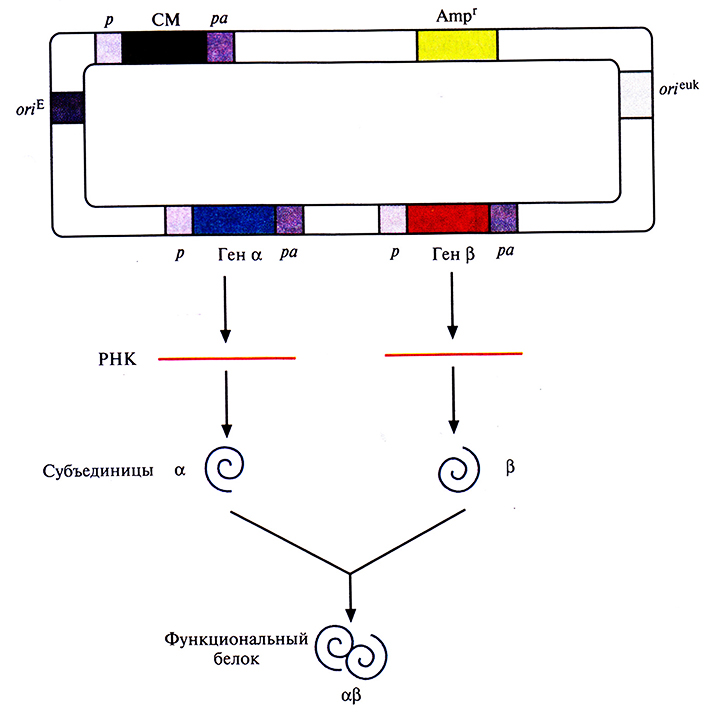
Рис. 7.16. Экспрессирующий вектор с двумя независимо транскрибируемыми генами. Клонированные гены (α и β) кодируют субъединицы димерного белка (αβ). Каждый ген встроен в вектор как часть отдельной единицы транскрипции и находится под контролем эукариотического промотора (р) и сигнала полиаденилирования (ра). Каждая субъединица транслируется со своей мРНК; объединяясь, субъединицы образуют функциональный димерный белок (αβ). Векторы содержат сайты инициации репликации, функционирующие в Е. coli (oriE) и в клетках млекопитающих (oriсuk); маркерный ген (Аmрr) для отбора трансформированных клеток Е. coli; селективный маркерный ген (СМ), находящийся под контролем эукариотических промотора (р) и сигнала полиаденилирования (ра).
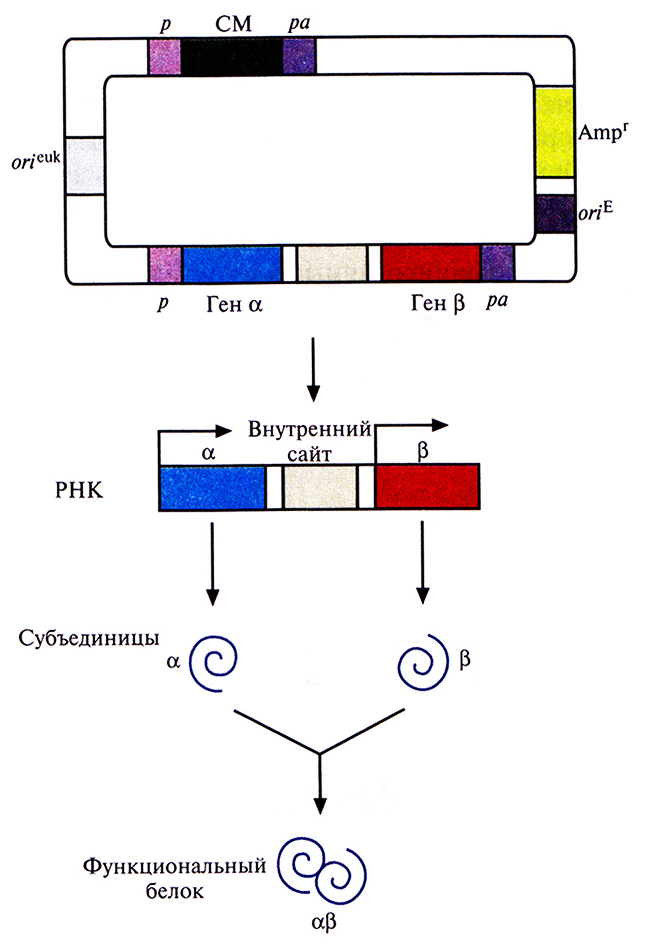
Рис. 7.17. Двухцистронный экспрессирующий вектор. Клонированные гены (α и β) кодируют субъединицы димерного белка (αβ). Они разделены сегментом ДНК, который после транскрипции, на уровне мРНК, играет роль внутреннего сайта связывания рибосом. Каждый ген находится под контролем эукариотических промотора (р) и сигнала полиаденилирования (ра). Трансляция мРНК начинается с 5'-конца и с внутреннего сайта (угловые стрелки). Синтезированные субъединицы объединяются с образованием функционального димерного белка. Вектор содержит сайты инициации репликации, функционирующие в Е. coli (oriE) и в клетках млекопитающих (oricuk); селективный маркерный ген (Ampr) для отбора трансформированных клеток Е. coir, селективный маркерный ген (СМ), находящийся под контролем эукариотических промотора (р) и сигнала полиаденилирования (ра).
Суммируя, можно сказать, что экспрессирующие векторы млекопитающих столь же универсальны и эффективны, как и векторы для других эукариотических систем экспрессии, если речь вдет о получении аутентичных рекомбинантных белков для исследовательских и медицинских целей. Однако промышленный синтез рекомбинантных белков с использованием модифицированных клеток млекопитающих обходится слишком дорого. В этом случае предпочтительны менее дорогие системы экспрессии, за исключением тех ситуаций, когда аутентичности рекомбинантного белка удается достичь только с помощью культуры клеток млекопитающих.
ЗАКЛЮЧЕНИЕ
Прокариотические системы экспрессии успешно используются для синтеза многих белков. Однако некоторые белки для превращения в активною форму должны претерпеть специфические пост трансляционные модификации – гликозилирование, фосфорилирование или ацетилирование, а бактерии к этому не способны. Поэтому было решено попытаться экспрессировать клонированные гены в эукариотических клетках с помощью специально созданных эукариотических экспрессирующих векторов.
Для синтеза разнообразных белков, кодируемых клонированными генами, использовались дрожжи S. cerevisiae. Их генетика хорошо изучена, а кроме того, их можно выращивать в больших ферментерах. Чтобы упростить очистку белков, были сконструированы векторы, обеспечивающие их секрецию. С помощью S. cerevisiae было получено множество самых разных аутентичных белков. Однако многие рекомбинантные белки в этой системе не подвергались посттрансляционной модификации, к тому же их выход зачастую был недостаточно высок. Поэтому были предприняты попытки разработать другие дрожжевые системы синтеза рекомбинантных белков.
В поисках других эукариотических систем экспрессии, с помощью которых можно было бы получать биологически активные белки, исследователи сосредоточили усилия на создании экспрессирующих векторов на основе бакуловирусов, в частности бакуловируса AcMNPV, инфицирующего клетки многих насекомых. Исходная стратегия предполагала трансфекцию клеток насекомого, зараженных AcMNPV, транспортным вектором, который содержал клонированный ген, фланкированный AcMNPV-специфичными последовательностями. В результате двойного кроссинговера между вектором и геном AcMNPV клонированный ген встраивался в последний и попадал под контроль сильного промотора, функционирующего на последних стадиях литического цикла. Клетки насекомого, инфицированные рекомбинантным бакуловирусом, синтезировали гетерологичный белок.
Частоту появления рекомбинантных бакуловирусов удалось повысить с менее чем 1% до 99%. Для этого ДНК AcMNPV обрабатывали эндонуклеазой рестрикции, которая расщепляла ДНК в двух специфичных сайтах с высвобождением фрагмента, несущего часть гена, необходимого для осуществления литического цикла. Клетки насекомого трансфицировали этим фрагментом, а затем – транспортным вектором. В результате двойного кроссинговера в некоторых клетках восстанавливался кольцевой геном AcMNPV, который содержал клонированный ген и функциональный ген, необходимый для осуществления литического цикла. В результате почти все вирулентные бакуловирусы оказывались рекомбинантными.
Следующий шаг в усовершенствовании системы экспрессии на основе бакуловирусов состоял в создании бакмиды, челночного вектора Е. colli клетки насекомого, позволяющего проводить все генноинженерные манипуляции в Е. coli. Клетки насекомого трансфицировали рекомбинантной бакмидой только с целью получения гетерологичного белка. Примерно 95% гетерологичных белков, синтезированных в системах экспрессии на основе бакуловирусов, имели соответствующие посттрансляционные модификации.
Внехромосомные экспрессирующие векторы млекопитающих обычно применяют для синтеза гетерологичных белков, использующихся в научных или медицинских целях. Они представляют собой челночные векторы с сайтами инициации репликации вируса животных и Е. coli-плазмиды. Регуляторные элементы транскрипции обычно происходят из генома вируса животных или из геномов млекопитающих. Для отбора трансфицированных клеток используют доминантные селективные маркерные гены. Некоторые системы отбора основаны на введении в среду возрастающего количества цитотоксичного соединения и позволяют получать клетки, содержащие большое число копий вектора, что увеличивает выход чужеродного белка.
Разработаны системы экспрессии млекопитающих, позволяющие получать белки, состоящие из двух разных субъединиц. Для этого хозяйские клетки трансфицировали сразу двумя векторами, каждый из которых нес ген одной из субъединиц. Альтернативный подход состоял в использовании одного вектора, который нес эти два гена в виде отдельных единиц транскрипции или в виде одного транскриптона, содержащего оба этих гена.

